Method Article
症候性子宮筋腫の治療における子宮動脈塞栓術のルブリンプロトコル
* これらの著者は同等に貢献しました
要約
ここでは、症候性子宮筋腫の治療のための子宮動脈塞栓術について、資格、準備、パフォーマンス、術後ケア、フォローアップの5つのセクションに分けて紹介します。このプロトコルは、婦人科医とインターベンショナルラジオロジストの間の緊密な協力が必要であり、上記の手順を適切に実行することができます。
要約
子宮筋腫は、平滑筋組織に由来する良性腫瘍で、子宮筋間質を構成します。子宮筋腫は、女性に見られる最も一般的な良性腫瘍です。女性の20%〜50%では、子宮筋腫は無症候性であり、治療は必要ありません。子宮筋腫の主な症状は、大量の月経出血、異常な子宮出血、および圧力症状です。圧迫症状は、骨盤痛症候群、排尿障害、便秘を引き起こす可能性があります。
現在使用されている治療法には、外科的治療、薬物療法、および低侵襲手術が含まれます。最も一般的に適用される低侵襲法は、子宮動脈の塞栓術です。この手順は現在、症候性子宮筋腫の治療方法として広く受け入れられており、国立衛生臨床研究所によって、重い月経出血のガイドラインでそのように認識されています。
これは複雑な手順であり、婦人科医とインターベンショナルラジオロジストの間の緊密な協力が必要です。症候性子宮筋腫の治療における子宮動脈塞栓術に適用可能なプロトコルを提示します。プロトコルは5つのセクションに分かれています。最初の2つのセクションは、婦人科医とインターベンショナルラジオロジストを対象としており、塞栓術の患者を段階的に認定し、準備する方法を説明しています。インターベンショナルラジオロジストを対象としたセクション3では、塞栓術をどのように行うべきかを説明します。セクション4は、塞栓術後の患者の世話をする婦人科医または病棟の医師を対象としています。プロトコルのこのセクションでは、患者制御鎮痛 (PCA) ポンプを使用して塞栓術後の痛みを治療する方法を提供します。セクション 5 では、子宮動脈塞栓術の影響と晩期合併症の評価で手順を完了します。
5つのセクションすべてが、この分野に不慣れな臨床医、専門家、研究者を対象とした統一されたプロトコルを作成します。
概要
子宮筋腫は、平滑筋組織に由来する良性腫瘍で、子宮筋間質を構成します。これらはモノクローナル腫瘍であり、コラーゲン、フィブロネクチン、プロテオグリカンを含む細胞外物質が大量に存在しています。子宮筋腫は、圧縮された筋線維、コラーゲン線維、神経線維、および血管1,2で作られた薄い偽カプセルに囲まれています。筋腫の病態生理学は完全には理解されていませんが、主に選択的および組織特異的なエピジェネティックな変化によって引き起こされるモノクローナル増殖に依存しているようです3。子宮筋腫を引き起こす単一の遺伝子は見つかりませんでした。しかし、多発性皮膚および子宮平滑筋腫症などのまれな子宮筋腫症候群の存在は、クレブスサイクル4に関与するミトコンドリア酵素であるフマル酸ヒドラターゼをコードする遺伝子に起因しています。7番染色体、12番染色体、14番染色体における7番染色体の欠失と転座の存在は、子宮筋腫の50%にみられるが、これは原発性の5、6、7ではなく二次性のようである。
子宮筋腫の成長の調節因子は、卵巣(エストロゲンとプロゲステロン)、成長因子、血管新生、およびアポトーシスによって産生されるステロイドホルモンです。子宮筋腫の発症の危険因子も特定されており、これには、年齢、初潮、アフリカ系アメリカ人の人種、遺伝、未経産、肥満、多嚢胞性卵巣症候群、糖尿病、高血圧、ビタミンD欠乏症、豆乳の使用、アルコール、カフェインの摂取が含まれます8。
子宮筋腫は、女性の生殖器官の最も一般的な良性腫瘍です。これらの腫瘍は、1793年にロンドンのセントジョージ病院のマシューベイリーによって最初に報告されました。入手可能な疫学データでは、子宮筋腫の発生率を正確に特定していません。なぜなら、その大きな割合は診断されていないためです。子宮筋腫は、全患者の5.4%から77%に発生すると推定されています。彼らの有病率はヨーロッパよりも米国で高く、おそらく原因は人種の違いです8。
出産可能年齢の女性では、筋腫の約30%が異常な子宮出血という形で臨床症状を呈し、その結果、患者様の血液供給が不十分になることがあります9。ほとんどの場合、患者は子宮内に位置する球状病変である複数の筋腫を持っています。それらの寸法と位置は異なる場合があります。症例の90%で、それらは子宮の体内に位置しています。それらの直径は数ミリメートルから20 cm10までであり得る。
FIGO(Fédération Internationale de Gynécologie et d'Obstétrique)分類では、子宮内膜の近さに応じて0〜8のグループに分類されます(数値が小さいほど、子宮内膜が近くなります)(図1)11。症例の約50%〜75%で、子宮筋腫は無症候性です。子宮筋腫の最も一般的な症状は、大量の月経出血、異常な子宮出血、および圧迫症状です。筋腫は不妊症の症例の約10%に関連しており、1%〜3%で筋腫が唯一の原因です12。無症候性子宮筋腫は通常、定期的な医学的管理のみを受けますが、症候性子宮筋腫は治療の適応です13。
現在使用されている子宮筋腫の治療法には、外科的治療、薬物療法、および低侵襲手術が含まれます13,14,15,16,17,18。外科的治療には、子宮摘出術(腹部および子宮鏡検査)と子宮摘出術が含まれます。筋腫核出術と子宮摘出術はどちらも生活の質にプラスの影響を与えます19。子宮摘出術は、生殖能力の不可逆的な喪失と関連しています。したがって、多くの女性は他の治療オプションを求めています20。
腹部筋腫核出術は、生殖能力の維持を可能にします。子宮筋腫のサイズと数、および外科医の経験に応じて、この手順は開腹術または腹腔鏡検査を介して行うことができます。出血は子宮摘出術ほど一般的ではありませんが、全体的な罹患率は似ています。子宮鏡下筋腫核出術は、腹部筋腫核出術よりも安全で侵襲性の低い方法であり、粘膜下筋腫(FIGO0)の治療を可能にします。その後の子宮鏡検査は、より大きな2型筋腫21を完全に除去するために必要になる場合があります。
レボノルゲストレル放出子宮内避妊器具は、重い月経出血の効果的な治療法ですが、子宮筋腫のサイズを縮小することはありません。それらの使用は、変形した子宮腔を有する患者に限定される。GnRH類似体は、主に子宮筋腫のサイズと周術期の失血を減らすための術前薬剤として使用されます。また、子宮摘出術および子宮摘出術中の垂直切開の割合を減らし、膣手術の可能性を高めます20。
短期的には、選択的プロゲステロン受容体モジュレーターは筋腫の体積を減少させ、無月経を誘発します。しかし、長期的な有効性と安全性にはさらなる研究が必要です。アロマターゼ阻害剤に加えて、貧血の術前治療や筋腫の体積の減少のための他の選択肢があるかもしれません22。いくつかの研究は、ビタミンDが子宮筋腫の成長と症状の発症を遅らせるか、または予防する可能性があることを示唆しています23。
2-メトキシエストラジオールとナノ粒子を組み合わせた新しい方法も開発中である24。子宮筋腫の治療に使用される低侵襲法には、子宮動脈塞栓術(UAE)、磁気共鳴ガイド下焦点式超音波手術(MRgFUS)、腹腔鏡下子宮動脈閉塞術(LUAO)、および高周波性筋融解症が含まれます14,25。超音波ガイド下高密度焦点式超音波(US-HIFU)は、新しい、まだ実験的な、低侵襲法です26,27。
血管閉塞の治療方法と子宮への血液供給の遮断方法は、120年以上前に言及されました。1894年、ケリーは、腫瘍学的子宮摘出術中に内腸骨動脈の結紮術を行い、当時は外科的処置後の一般的な合併症であった難治性の骨盤出血を制御しました28。その後、Sack(1973)は、鉗子分娩後の大量の分娩後出血の治療における同じ技術の効果的な使用について説明しました。いずれの場合も、止血は子宮摘出術なしで達成されました29。1979年、HeastonらとBrownらは、分娩後出血を制御するために吸収性ゼラチンスポンジを使用した骨盤動脈の塞栓術を独立して報告した30,31。
UAEは、1991年にフランスで症候性子宮筋腫の治療方法として最初に使用されました32。当初は、子宮摘出術後の失血を減らすために使用されていました。1995年、Ravinaらは、症候性子宮筋腫33の主要な治療法としてこの手順を提案しました。米国では、子宮動脈塞栓術は1997年に成功裏に行われました34。
症候性子宮筋腫の女性における子宮温存への関心の高まりにより、UAEは低侵襲性子宮筋腫治療の最前線に立っています14,18,35,36,37。2000年、UAEに関するガイドラインを発行するために、Royal College of Obstetricians and GynecologistsとThe Royal College of Radiologistsの合同作業部会が設立されました。当時、UAEは実験的な方法と見なされていました(世界中で行われた手順が7,000未満)。ガイドラインが発表されて以来、世界中で100,000件以上のUAEの手続きが行われています。また、UAEを他の外科的処置と比較した5つのランダム化比較試験が実施されています。研究結果によると、UAEは短中期的(最大数年)で非常に効果的であり、中等度(子宮感染症など)および重篤な(生命を脅かす)合併症のリスクが低いことが示されています38,39。無作為化研究では、入院期間の短縮、回復の迅速化、日常生活への復帰がUAEに有利に働きます。外科的処置は、統計的有意性を維持しながら、より安価で必要な再介入の頻度が少ないことが証明された32。この手順は現在、症候性子宮筋腫の治療方法として広く受け入れられており、国立衛生臨床評価機構(NICE)の大量月経出血のガイドラインでそのように認識されています40。
現在、症候性子宮筋腫の治療におけるUAEの使用に関する11の推奨事項があり、ヨーロッパ、北米、オーストラリアの科学団体によって作成されています。ほとんどの場合、推奨事項は一貫していますが、相違は2つの不一致に関係しています。1つ目は、有茎性粘膜下筋腫(FIGO 0)および漿膜下筋腫(FIGO 7)がUAEの禁忌であるかどうかです。2つ目は、将来の妊娠を宣言する女性がこの手順の資格を持つべきかどうかです41。米国産科婦人科学会(ACOG)(2008)は、子宮筋腫の治療に関する興味深いガイドラインを発表しました。一貫した科学的証拠(レベルA)に基づいて、ACOGは、子宮筋腫の治療のための典型的な適応症で子宮を温存したい適切な資格を持つ女性にとって、UAEを効果的で安全な方法として定義しました。同時に、ACOGの推奨事項は、婦人科医とインターベンショナルラジオロジストの間の緊密な協力の必要性を強調しました。公表されたガイドラインでは、ACOGは、生殖能力を維持したいという願望を唯一の禁忌(相対的)として認識しました42。
最新の勧告の一つは、2013年に王立産科婦人科学会(RCOG)によって、2015年にカナダ産科婦人科学会(SOGC)によって出された41。この記事の残りの部分では、著者は上記の推奨事項を使用します。RCOGおよびSOGCのガイドラインによると、症候性筋腫の患者は誰でも塞栓術の候補になることができますが、禁忌がなく、手順の利点(症状の解決)が合併症のリスクを上回っています。低侵襲手術としての子宮筋腫の塞栓術は、重篤な合併症の数をごくわずかしか伴わないことに注意すべきです。したがって、ほとんどの場合、利点は合併症のリスクを上回ります14,32,43。
適切な患者の資格は、高い臨床効果とUAE後の合併症の予防にとって非常に重要です。アラブ首長国連邦の主な適応症は症候性子宮筋腫であり、大量の月経出血、月経困難症、痛み、性交疼痛症、および尿路または胃腸管へのその他の悪影響をもたらします。子宮筋腫を腺筋症または腺筋症と共存する子宮筋腫と区別する必要があります。なぜなら、このような状況では、UAEは効果が低く、手順技術14,32,43,44,45,46,47の変更が必要になるためです。症候性子宮筋腫の女性にUAEの手術を行うための具体的な適応症には、手術の拒否、輸血への同意なし、および以前に失敗した子宮筋腫手術が含まれます。
上記の適応症では、UAEは外科的治療の代替として扱われるべきです。しかし、少数のケースでは、処置後の合併症が外科的介入14,32,43の必要性をもたらす可能性があることを患者に助言すべきである。RCOGガイドラインによると、筋腫が不妊症の推定原因である状況でUAEを使用するには、不妊症と生殖補助医療の治療を専門とする婦人科医の特別なケアと適切な評価が必要です。子宮筋腫の存在による不妊症は絶対的なものではなく、多くの女性が介入なしに妊娠します。したがって、男性パートナーの評価を含む、不妊の他の可能な原因を除外することは合理的です14,32,43。
したがって、RCOGおよびSOGCの推奨によれば、候補者は、子宮筋腫様の臨床症状を伴う骨盤内の病状が除外されている症候性子宮筋腫の女性であるべきです41,43。
この手順に対する絶対禁忌には、現在または最近の性器感染症、臨床的要因または不適切な画像診断による診断の疑い、無症候性子宮筋腫、生存可能な妊娠、および放射線造影剤の使用に対する禁忌が含まれます。
相対的禁忌には、有茎粘膜下 (FIGO 0) および漿膜下 (FIGO 7) 筋腫が含まれ、理論的には茎壊死により子宮内膜から剥離し、まれに敗血症を引き起こす可能性があります。これらの場合、UAEは、手順が計画される前に有茎性筋腫の子宮鏡下または腹腔鏡下除去の場合にのみ考慮する必要があります。
現在の文献が筋腫の大きさはそれ自体が禁忌ではないことを示唆しているという事実にもかかわらず、経験上、UAEの大きな筋腫(特に圧迫症状に関連する)の患者を適格とする際には、体積の減少が症状を緩和し、患者の期待を満たすには不十分である可能性があるため、細心の注意が必要であることが示されています14,32。43,48.
UAE後の妊娠が成功したという多くの報告がありますが、既存の証拠は、若い女性における薬理学的または外科的治療(子宮摘出術)の代替としての使用を完全に支持していません49。したがって、この手順は、妊娠の願望を宣言する女性には細心の注意を払って使用する必要があります(妊娠率が低く、流産率が高く、子宮破裂、癒着胎盤、および子宮摘出術後よりもUAE後の妊娠転帰が悪くなるため)32,50,51,52,53,54,55.婦人科医として、私たちは妊娠を希望する女性にUAEをお勧めしません。私たちにとっては、手術や輸血の拒否など、治療の欠如が生命を脅かす可能性があるUAEに追加の適応がある場合、それは相対的な禁忌です。
RCOGのガイドラインによると、症候性子宮筋腫の若い女性の生殖能力を維持または改善したいという願望は、UAE32に対する相対的な禁忌です。対照的に、SOGCガイドラインは、同様のケースでは、そのような女性の安全性と有効性が確立されていないため、UAEを子宮筋腫の治療選択肢として提案すべきではないと推奨しています14,43。同様の見解は、米国生殖医学会(ASRM)、米国産科婦人科学会(ACOG)、米国放射線学会(ACR)、王立オーストラリア・ニュージーランド産科婦人科学会(RANZCOG)など、他の科学団体によっても代表されており、筋腫核出術後の出生率の改善を挙げています41,43,56.UAEは、特に筋腫核出術に好ましくない特徴を持つ妊孕性の維持または改善を求める女性、特に筋腫摘出術(多発性子宮筋腫)に対してのみNICEによって推奨されてきた57。
一般的に、UAEの手続きは月経周期のどの段階でも行うことができる32。しかし、受精や着床の段階で妊娠を除外する理想的な方法がないと仮定して、当センターでは早期妊娠を除外するために、10サイクル日目まで実施しています。ほとんどの場合、患者は手術の日に婦人科病棟に入院します。血管外科病棟への患者の入院は、適切な検査と婦人科の診察が提供されていれば許可されます。婦人科医とインターベンショナルラジオロジストは、子宮筋腫の塞栓術の資格を取得します。婦人科資格には、病歴、検査、生殖器官の超音波評価、および筋腫型が含まれます。さらに、子宮内の悪性腫瘍を排除するには、子宮頸部(PAP)塗抹標本と子宮内膜生検が必要です。卵巣の超音波スキャンが疑わしい場合は、ROMAテスト(Risk of Ovarian Malignancy Algorithm)が必要です。
議論が必要な別の問題は、子宮肉腫、特に平滑筋肉腫(LMS)であり、これはこれらの子宮腫瘍の70%を占めています。筋腫の手術を受けた患者におけるLMSの有病率は低く、0.13%〜0.29%58,59と推定されています。LMSの発生率の増加は、40歳以上の女性で観察されます。LMSは良性筋腫に似ている可能性があるため、治療前に診断するのが困難です60。ほとんどのLMSは既存の子宮筋腫とは無関係であり、LMSと子宮筋腫との関連を示す証拠はない61。子宮筋腫とLMSはどちらも急速に成長する傾向があります。したがって、サイズまたは成長率は悪性子宮腫瘍の危険因子ではありません60。
現在、平滑筋肉腫を明確に特定し、それを平滑筋腫 60,62 と区別できる信頼できる臨床検査や画像検査はありません。平滑筋肉腫の診断における子宮内膜生検の感度は86%である。したがって、生検結果が陰性であっても、悪性子宮腫瘍の存在を排除するものではありません。造影MRIは、現在、子宮腫瘍の最適な診断方法です。LMSの診断におけるこのテストの感度は94%60です。
すでに述べたように、上記の検査は悪性子宮腫瘍の100%を除外するものではありません。したがって、治療後にLMSの診断を延長するわずかなリスクがあり、子宮腫瘍の組織病理学的検証の可能性はありません。UAEの資格取得時に、患者にこのことを通知する必要があります。
全血球計算 (CBC) および凝固検査 (INR、APTT)、腎パネル (クレアチニン、尿素)、甲状腺刺激ホルモン (TSH)、抗ミュラー管ホルモン (AMH) の濃度 (推奨) または卵胞期の卵胞刺激ホルモン (FSH)、C反応性タンパク質 (CRP)、一般的な尿検査、および膣塗抹標本 (好気性膣培養) を実施することで、塞栓術後の潜在的な合併症 (感染症、 医原性卵巣の損傷、ガドリニウムベースの造影剤後の以前の腎障害の激化、ヨウ素ベースの造影剤後の甲状腺機能亢進症の場合の甲状腺中毒症)63,64。FSHは若い女性50,65の卵巣予備能の変化の敏感な指標ではないため、FSH検査は40歳未満の場合は推奨されないことに注意してください。
インターベンショナルラジオロジストは、病歴と磁気共鳴画像法(MRI)に基づいて患者を手術の資格を与えます。病歴を収集する際には、利点と起こりうる合併症、および手順自体について患者と話し合う必要があります。UAEに対する患者の期待についても話し合う必要があります。MRIは、生殖器官および隣接する構造の他の病状を除外するだけでなく、子宮筋腫および解剖学的構造の形態と位置を評価し、手順の技術的実現可能性を評価することを目的としています35,36,37,57。
UAEは、子宮、卵巣、および骨盤内の周辺組織への血液供給を維持しながら、すべての筋腫の血管系を完全にブロックすることを目指しています。UAEの技術的な側面は、まだある程度進化しています。
子宮動脈の塞栓術は、血管内塞栓術の分野で適切な能力を持つインターベンショナルラジオロジストによって行われます。この手順は、透視検査のガイダンスの下で行われます。これには、鼠径部の穿刺から大腿動脈、大動脈、内腸骨動脈、子宮動脈までの血管カテーテルの経皮的挿入が含まれます。カテーテルを子宮動脈の奥深くに留置し、安定した位置に到達した後、造影剤を混合した塞栓剤を透視制御下で注入し、逆流や「非標的」塞栓術を回避します。筋腫の血管床は、塞栓材料の種類に応じて500〜900μmの粒子を使用して閉じられます(通常のサイズは700μmです)。塞栓術は、うっ血流が達成されるまで継続されます。処置の最後に、カテーテルを抜去し、血管アクセス部位を手動圧力とドレッシング、または機械的なクローザーで固定します。この手順は約0.5〜1.0時間続きます。UAEで卵巣に吸収される平均電離放射線量は0.04〜0.22(Gy:灰色)で、平均推定実効線量は22〜34(mSv:ミリシーベルト)の範囲です。平均透視時間は約22分66,67です。
ほとんどの子宮筋腫の血管系は子宮動脈から来ています。子宮筋腫の約5%〜10%だけが卵巣動脈によって追加で供給されます。動脈性子宮吻合は症例の約10%で発生し、子宮卵巣は10%〜30%で発生します。塞栓組織への血液供給が遮断されると、虚血性壊死を引き起こし、続いて硝子変性または凝固性壊死を引き起こします。このプロセスには数ヶ月かかります68,69。
UAEの有効性は、症状の解決またはその軽減の程度によって異なります。過度の月経出血、骨盤痛、圧迫症状の治療について、UAEの臨床効果指数はそれぞれ81%〜96%、70%〜100%、46%〜100%です。処置後3〜6か月以内に、子宮筋腫の体積の観察された減少は25%〜60%でした33,70,71,72。筋腫の平均直径縮小は2.2cm57でした。
子宮筋腫の体積の減少は、必ずしも臨床症状の解消または軽減と相関するわけではありません。UAE後の長期追跡調査では、患者の70%以上が処置後5年以内に臨床症状の解消または大幅な軽減を報告し、そのうちの16%〜23%が再介入を必要とした73,74。
初期のUAE効果を評価する際に、この出版物の著者は、Virtual Organ Computer-aided AnaLysis(VOCAL)を使用して、血管指数の測定を行う3次元(3D)超音波の使用を提案しています:血管新生指数(VI)、フロー指数(FI)、および血管新生フロー指数(VFI)75。
塞栓術後の痛みは、UAEの成功(合併症と混同しないでください)の予想される後遺症(約24時間持続)であり、積極的に治療する必要があります。この臨床症状は、虚血性筋腫の組織分解産物の放出によって引き起こされます。治療には、適切な疼痛管理、水分補給、および可能な抗生物質療法が含まれます32,43。処置後24時間維持される硬膜外麻酔(EA)は、痛みを完全に許容できるレベルまで大幅に軽減するが、患者管理鎮痛(PCA)と比較してコストが高く、合併症のリスクも増加する76。
他のアプローチは、塞栓術後の疼痛管理レビューでも利用できます。アラブ首長国連邦での鎮痛剤とポリビニルアルコール分子の混合物の使用と電気鍼治療麻酔の使用について言及する価値があります。どちらの方法も、病院で行われるUAEの処置の数を制限することを目的としていた77,78。これらの方法は、当社および協力センターでは使用しておりません。
UAEの初期の合併症は通常、血管造影手順に関連する局所合併症です。このグループの有害事象はまれであり(症例の1%未満で発生します)、主に鼠径部血腫、動脈血栓症、動脈解離および偽動脈瘤、造影剤に対するアレルギー反応、処置中の血管内のカテーテルの操作によって引き起こされる子宮動脈のけいれんに関連しています(数分が経過した後、一時的なイベントとして扱われ、手順を続行できます。 けいれんが続く場合は、ベラパミル(2.5〜5 mg)または硝酸塩(100〜150 μg)を動脈内に投与することができます)および「非標的」塞栓術32,37,38。
他の骨盤臓器の「非標的」塞栓術とその後の虚血についてもいくつかの報告があります。この合併症は、手順の実行が不十分な結果、ならびに骨盤血管系の吻合および解剖学的変異体の存在が原因で発生する可能性があります。非標的塞栓術の特別なケースは、一部の患者79,80の子宮血管と卵巣との間の吻合に起因する卵巣損傷である。
筋腫壊死の結果は、患者の約10%〜15%で処置後30日以内に発生する塞栓術後症候群です。この症候群の症状は、吐き気、嘔吐、倦怠感、微熱、下腹部痛、白血球レベルの上昇など、一緒にまたは個別に発生する可能性があります。これは通常、自己限定的な症候群であり、通常は10〜14日以内に消えます。この合併症の治療には、鎮痛薬と抗炎症薬が使用されます32。塞栓術後症候群の症状と敗血症などのより深刻な合併症を区別することが重要です。これは、言及された症状が2週間以上続く場合に特に当てはまります32,37,38。
感染症はUAEに次いで最も深刻な合併症である可能性があり、症例の約0.5%で発生します32,38。24〜48時間持続する高熱(38.5°C以上)と腹部の硬くて痛みを伴う場合は、敗血症が疑われるべきです。.この場合、治療には抗生物質療法の使用だけでなく、子宮を摘出する必要も必要になる場合があります。後者の場合、症例の1%未満で、患者の生命に脅威を与える可能性があります。敗血症は、UAEが大きな子宮(20cmを超える場合、または単一の筋腫の直径が9cmより大きい場合、および大きな粘膜下筋腫が共存する場合)でより一般的です37,38。
UAE後(処置後30日以上)の遅発性合併症は、粘膜下筋腫の塞栓術後に発生し、子宮頸管を通る子宮筋腫の顕著な壊死性断片の排泄である。これは、ケースの約10%で発生します32,81,82。アラブ首長国連邦(UAE)後の女性の約16%は、子宮からの壊死性子宮筋腫の排泄の結果として、数週間から数ヶ月にわたって大量の膣分泌物を有する可能性がある83。アラブ首長国連邦の処置の後、月経の有意な短縮およびその豊富さの減少が観察され、これはこの手順の有益な効果と考えられている。しかし、完全な無月経は、塞栓術後の卵巣不全50,84の影響として扱われます。
アラブ首長国連邦後の無月経は通常一過性であり、数サイクルに限定されます。永久性無月経は、40歳以上の女性の約15%、この年齢未満の女性の約1%に発生し、早期閉経の症状を引き起こします。私たち自身の研究では、卵巣予備能の減少の結果として、若い女性(33〜40歳)の出生率の低下が見つかりました65。アラブ首長国連邦の後に無月経を報告する女性の約85%は45歳以上であると推定されています85歳。高齢女性における無月経の発生率の増加の理由は、「非標的」塞栓術86によって引き起こされる卵巣予備能の減少と卵巣組織の虚血に対する感受性の増加によるものであると主張されてきた。
UAEの手術は、手術を受ける女性の性機能にも影響を与えます。UAE後の性機能の改善は女性の26%で報告され、女性の10%で悪化が見られ、残りの64%の女性で変化が見られませんでした。性機能障害の考えられる原因は、UAEの処置の結果としてのクリトリス、子宮頸部、および子宮体の異常な血管系である74。
プロトコル
著者らは、このプロトコルがルブリン医科大学の地元の倫理委員会のガイドラインに従っていることを宣言します。
1. UAE手続きの資格
注:これは婦人科医とインターベンショナルラジオロジストを対象としています。
- UAEの手続きの詳細について患者に知らせます。
- UAEの手続きの適応症と禁忌について話し合います。
- 子宮筋腫の治療におけるUAEの仮定と代替方法(はじめにに記載)について患者と話し合います。
- 警告!UAEは根本的な手順ではないことを患者に伝えます(筋腫は切除されません)。
- 警告!UAE後に子宮筋腫の組織病理学報告を受け取らないことを患者に伝えます。
- 警告!子宮腫瘍1,000例のうち1〜3例が悪性腫瘍(LMS)である可能性があることを患者に伝えます。UAEの資格取得中に実施される子宮内膜生検とMRIは、平滑筋肉腫の診断に非常に敏感ですが、100%ではないことを患者と話し合ってください。平滑筋肉腫に対してUAEを実施すると、診断と適切な治療が遅れる可能性があることを患者に伝えます。その事実を医療記録に記してください。
- 患者が故意に UAE の実施を希望する場合は、この プロトコルを続行します。
- 資格認定は2段階で行われることを患者に伝えます。婦人科医による資格認定には適応症と禁忌の分析が含まれ、インターベンショナルラジオロジストはUAEの技術的能力を評価します。
- 婦人科相談を計画または実施し、UAEの前にインターベンショナルラジオロジストとの相談を計画します。
- 可能であれば、外来診療所でできるだけ多くの資格認定手続きを行います。
- 患者がUAEの適応症を持っていることを確認してください:症候性子宮筋腫(月経困難症、出血、月経困難症、性交疼痛症、慢性骨盤痛);手術治療の拒否;輸血の同意はありません。以前に失敗した子宮筋腫の手術。病歴にそれらを記録してください。
- 子宮筋腫の症状について患者に尋ねます。
- UAEの有効性と患者の期待について話し合います( 代表的な結果)。
- 患者が以前に子宮筋腫の治療を受けたかどうかを尋ねます。どの方法が使用されたかを確認します。
- 患者が外科的治療または輸血を拒否した場合は、書面による声明を取ります。
- アラブ首長国連邦の手順の資格を得た患者が絶対的な禁忌を持っていないことを確認してください:無症候性子宮筋腫;生存可能な妊娠;現在または最近の性器感染症;臨床的要因または不適切な画像診断による診断の疑い;放射線造影剤の使用に対する禁忌;MRIでの平滑筋肉腫の特徴;子宮または卵巣の悪性腫瘍で、緩和のためまたは手術の補助として行われる場合を除きます87。病歴にそれらを記録してください。
- 患者が無症候性の子宮筋腫にもかかわらずUAEを要求した場合は、そのようなケースは処置の対象とならないことを説明してください。無症候性子宮筋腫は定期的な婦人科モニタリングのみが必要であることを患者に説明します。
- アラブ首長国連邦(UAE)に相対的な禁忌(大きな子宮筋腫と生殖計画)がある場合は、患者と話し合い、その事実を医療記録に書き留めてください。
- 序論で説明されている相対的禁忌に関連する可能性のある合併症に焦点を当て、患者が手順を理解し、同意していることを確認します。
- 子宮動脈塞栓術の後遺症と合併症について患者と話し合い(紹介を参照)、その事実を医療記録に記録します。
- 患者と話すときは、塞栓術後の痛みに特に注意を払ってください。
- 塞栓術後の痛みの治療について話し合います。
- 婦人科の資格を取得します。
- 病歴を収集し、婦人科検査を行います。
- 生殖器官の超音波評価を実施して、子宮筋腫のサイズと種類を評価する(FIGO分類)88。
- 膣プローブを使用して、筋腫のサイズと位置を推定します(図2)。アラブ首長国連邦で治療された子宮筋腫は、FIGO分類に従って2〜5(理想的には3〜4)であるべきであり、直径は10cmを超えてはなりません。
- 骨盤超音波スキャンのプロトコルを医療記録に含めます。
- 超音波スキャンの結果がUAEの手続きの資格を示すものであることを確認してください。
- 骨盤内の悪性プロセスを除外します。
- 患者が子宮頸部(PAP)塗抹標本および子宮内膜生検の現在の(できれば6か月以内に実施された)結果を持っていることを確認します。
- 骨盤内超音波検査中に、膣プローブを使用して卵巣を評価し、その構造が正しいことを確認します。疑わしい場合は、以前の超音波スキャンを確認するか、ROMAテストを実行してください。
- 子宮腫瘍のLMSの特徴とUAEの技術力を評価するためにMRIを注文してください。
- 子宮頸部(PAP)塗抹標本、子宮内膜生検、超音波スキャン(おそらくROMAテスト)、およびMRIの結果に注意してください。
- 結果が正しくない場合は、患者を手術から失格にします。
- 婦人科資格の結果を患者に知らせます。
- その事実を医療記録に記してください。患者を病院に紹介します。
- アラブ首長国連邦の手続きの予約をし、患者はサイクルの10日目より前にいなければならないことを忘れないでください。
- 患者が手術を拒否するかどうかを尋ねてください。拒否された場合は、患者のインフォームドコンセントまたは医療記録にその事実に注意してください。
- 手術を拒否する症候性子宮筋腫の患者は、UAEの資格があります。
- 潜在的な合併症を評価して回避するために、UAEの少なくとも7日前に次のテストを実行します:膣塗抹標本の微生物学的テスト(好気性膣培養);検尿;選択された血液検査:CBC、凝固検査(INR、APPT)、腎パネル(クレアチン、尿素)、TSH、CRP。
- 結果を医療記録に記載してください。
- 誤った結果が彼女を手術に失格とすることを患者に伝えます。
- 卵胞期のAMH(推奨)またはFSH(40歳未満では推奨されません)の血清レベルを検査することにより、患者の卵巣予備能を確認します。上記の検査が非標的塞栓術の結果としての卵巣損傷を評価するのに役立つことを患者と話し合ってください。その事実を医療記録に記してください。
- アラブ首長国連邦の資格を持つ患者は、妊娠合併症14,32,38,50,51,52,89,90,91のリスクが高いため、妊娠する意志を宣言すべきではありません。
- アラブ首長国連邦(UAE)後の妊娠合併症のリスク増加について患者に伝えます。
- 患者が患者のインフォームドコンセントまたは医療記録で妊娠する意志を宣言していないという事実に注意してください。
- 患者が将来妊娠を除外しないが、UAEが必要な場合は、UAE後に妊娠合併症の可能性について知らされたことを書面で宣言してください。
- 放射線適格性評価を実施します。
- 骨盤MRIが実施されていることを確認してください。MRI検査では、生殖器官および隣接する構造の他の病状を除外することができます(UAEの資格のステップ1.6.3.3.手順)、子宮筋腫の形態と位置、および塞栓術の技術的実現可能性のための解剖学を評価します(図3、 図4)。そうでない場合は、MRI検査を手配し、インターベンショナルラジオロジストに相談してください。
- 画像検査を分析し、子宮筋腫の種類とサイズを評価します。
- 粘膜下組織(FIGO0–1)の筋腫が見つかった場合は、子宮腔に落ちるリスクについて患者に知らせてください。完全排泄は敗血症を引き起こす可能性があるが、断片的な排泄は通常無症候性である50。
- 漿膜下狭茎性有茎性(FIGO7)子宮筋腫が見つかった場合は、塞栓術後に子宮筋腫が腹腔内剥離するリスクについて患者に知らせてください。.それは急性炎症を引き起こす可能性があり、腹腔鏡下再手術が必要になるかもしれません92。
- 大きな子宮筋腫が見つかった場合は、合併症のリスクは変わらないが、処置の結果は小さな子宮筋腫93の方が優れていることを患者に伝えます。
- 患者または医療記録のインフォームドコンセントでその事実に注意してください。
2. UAE手続きの準備
注:これは、婦人科医または血管外科医およびインターベンショナルラジオロジストを対象としています。
- 患者を病院(婦人科または血管外科)に入院させます。
- 彼女が入院時にサイクルの10日目より前であることを確認してください。
- 婦人科検査と骨盤の超音波スキャンを実施または注文します。
- UAEの手続きの診断と資格が正しいことを確認してください。
- UAEの資格取得以降、新たな禁忌が現れていないことを確認してください。その場合は、他の治療オプションを提案し、手順の日付を変更します。
- 3D経膣超音波スキャン(TVUS)を実行し、VOCALソフトウェア試験(UAE手順72,75の有効性を評価するために使用されます)(はじめに説明)(図5および図6)を使用して、子宮筋腫(VI、FI、およびVFI)の体積と血管新生指数を計算します。
- その事実を医療記録に記してください。
- アラブ首長国連邦の資格を持つ患者が、アラブ首長国連邦の資格認定中に検査を実施していることを確認します(アラブ首長国連邦の資格のステップ1.6.2、1.6.3、1.6.5、1.6.6で説明されています)。
- 患者が婦人科医による事前認定を受けており、血液検査、尿検査、MRIを受けていない場合は、検査を注文し、インターベンショナルラジオロジストとの相談を手配してください(UAEの資格のステップ1.7)。
- 「非標的」塞栓術の結果としての卵巣損傷の評価を可能にするために、UAEの前にAMH(推奨)またはFSH(40歳未満は推奨されません)血清レベルを評価または注文します。
- 検査結果は約1日で利用可能になり、UAEの手続きはこれらの結果を受け取った後にのみ可能になることを患者に伝えてください。
- 誤った結果が彼女を手術に失格とすることを患者に伝えます。
- 警告!PAP塗抹標本、子宮内膜生検の結果が欠落または不正確な場合。膣塗抹標本の微生物学的検査は、患者をUAEから失格にします(これらの結果を得るには時間がかかりすぎます)。正しい結果を得た後、再予選を行います。
- その事実を医療記録に記してください。
- UAEを実行するためのインフォームドコンセントを取得します。
- UAEに関するすべての情報を患者に提供します。
- UAEで起こりうる合併症について話し合います(冒頭で説明されています)。
- 患者が考え、質問する時間を残してください。患者が UAE の手順を実行するためのインフォームド コンセントを与えることができます。
- UAEが始まるまで、患者には彼女の決定を変更する権利があることを患者に伝えてください。
- 患者がUAEに関する決定を変更した場合は、子宮筋腫の他の治療オプションを提案します(はじめに説明)。
- 患者または医療記録のインフォームドコンセントでその事実に注意してください。
- UAEの手続きの直前に、UAEの資格のセクション1.6.2、1.6.3、1.6.5、1.6.6に記載されているテスト、および3D TVUS、MRI、およびインターベンショナルラジオロジストとの相談が実施され、結果が正しいことを確認します。
- 検査が欠落しているか、結果が正しくない場合、UAEからの患者を失格にします。
- その事実を医療記録に記してください。
- 朝から施術まで食べ物や液体の摂取禁止を患者に伝え、世話をしてください。例外は、朝の薬を服用するために必要な少量の液体です。
- 午前中(UAE開催前)に、患者が絶食していることを確認してください。
- 患者が自分の慢性疾患の薬を服用していることを確認してください。
- その事実を医療記録に記してください。
- 患者に次の薬を注文します:経口で1錠の抗不安薬(例えば、エスタゾラム)、1回の静脈内抗生物質、膣内メトロニダゾールの1小球、ジクロフェナク100mg直腸坐剤。.
- UAEに約30〜40分前に上記の薬を投与してください。
- その事実を医療記録に記してください。
- 左の脇の下と右の鼠径部が剃られていることを確認して、手術野を準備します。
- 上記の皮膚の部分が剃られていない場合は、やさしく剃ってください。
- その事実を医療記録に記してください。
- 患者が子宮内避妊器具(IUD)を持っていないことを確認してください。
- 患者が子宮内にIUDを持っている場合は、子宮腔内の感染リスクが高いことを彼女に伝え、UAEの前にそれを取り除くことを提案してください。
- 患者がIUDの取り外しに同意しない場合は、患者のインフォームドコンセントまたは医療記録にその事実を記入してください。
- 患者が薬、造影剤、消毒剤に対するアレルギー反応を報告することを確認し、その事実と結果を医療記録に記録します。
3. UAEの手続きの実施
注:これはインターベンショナルラジオロジストと麻酔科医を対象としています。
- 滅菌状態で手順を実行します。
- 患者を手術台に乗せ、病院の消毒剤を使用して右鼠径部を広く消毒します(適切な承認を得てください)。
- 手術部位(右鼠径部)の周りに手術用ドレープを接着します。
- 麻酔の種類を局所麻酔または硬膜外麻酔(EA)から選択し、医療記録に患者の選択を記入します。
- 局所麻酔下のUAE。
- 手術部位に麻酔(皮下投与)2%リグノカイン溶液を投与します。
- 必要に応じて5 mgのモルヒネを静脈内投与します。.
- アラブ首長国連邦の手順を開始する前に、局所麻酔が機能していることを確認してください。
- EA の下の UAE
- EAのために患者を適切に準備します。
- 外科用ドレープを接着する前にEAを実行してください。
- EA手順の資格のある患者が次の禁忌EAを持っていないことを確認してください:手順の拒否、凝固障害、血小板減少症、溶血性疾患、抗凝固薬の服用、ショック、硬膜外注射部位での感染、菌血症、局所麻酔薬アレルギー、脊椎の解剖学的変形、頭蓋内圧の上昇、神経疾患、重度の大動脈弁または僧帽弁狭窄症94。その事実を医療記録に記してください。
- 麻酔科医に電話してEAを依頼してください。
- 腰部の硬膜外腔に細いカテーテルを留置し、麻酔薬を投与します(麻酔科医向けの手順)。
- UAEの手続きを開始する前に、EAが動作していることを確認してください。
- UAEの手続き
- Angio SuitでUAEの手順を透視検査のガイダンスの下で実行します。
- セルディンガー法95,96を使用して血管系にアクセスします(図7、図8、および図9)。
- 腎動脈のすぐ下の腹部大動脈にピグテールカテーテルを挿入します。
- 血管造影を行い、血管を可視化します。
- 大動脈腎造影を実施して、子宮筋腫を供給する血管の解剖学的構造を評価し、手順を計画します(図10)。
- 前後および斜めの突起で内腸骨動脈の血管造影を行い、子宮動脈口を明らかにします。
- 左側から始めて、次に右側から始めて、穿刺部位とカテーテルの特定の形状のために。血管の口径に応じて、メインカテーテルまたはマイクロカテーテルが選択的に子宮動脈に導入されます(図11)。
- カテーテルを子宮動脈の奥深くに配置します。ヒドロゲル粒子で血管を塞栓します。子宮卵巣吻合の存在により、そのサイズは約500μmと推定されるため、塞栓術のための粒子の推奨サイズは、「非標的塞栓術」のリスクを減らすために700μmです。
- 血管内の血流が完全に遮断されるまで塞栓術を続けます。治療のエンドポイントは血管内の造影剤のうっ血であり、これはその効果的な閉鎖を証明しています。
- 同じアクセスで反対側の子宮動脈の塞栓術を行います。治療は約0.5〜1.0時間66,67続きます(図12)。
- コントロール血管造影中に内腸骨動脈に留置されたカテーテルからの塞栓術の有効性を評価します。陰影血液の(子宮動脈への)活発な流入がないことは、この手順が技術的に正しいと考えられていることを示しています(図13)。
- カテーテルを慎重に取り外します。
- 穿刺部位を圧迫ドレッシングによる手動圧縮で閉じます。これは、次の6時間または閉鎖装置(図14)の間維持する必要があります。
- 医療記録にUAEの経過を説明してください。
4. UAEでの施術後の患者ケア
注:これは、婦人科医または血管外科医および麻酔科医を対象としています。
- 鎮痛治療の開始:患者管理鎮痛(PCA)ポンプまたはEA。
- 鎮痛治療の選択肢について患者に知らせ、話し合います。
- EAはPCAポンプ76と比較して、より優れた疼痛管理と迅速なリハビリテーションを提供することを患者に伝えます。
- その事実と医療記録の患者の選択に注意してください。
- PCAポンプを使用した塞栓術後の痛みの鎮痛治療。
- PCAポンプ用のシリンジをモルヒネ溶液で準備します。
- PCAポンプ用の50 mLシリンジに50 mgのモルヒネと0.9%NaCl(濃度1 mg / mL)の溶液を入れます。.
- 静脈内使用のためにPCAポンプを準備します。
- ドレンをシリンジに結合します。
- カニューレを使用して静脈穿刺を挿入します。
- シリンジをPCAポンプに挿入します。
- ドレンを満たし、PCAポンプを起動します。
- STARTボタンをオンにします。
- PCAポンプをロックします。
- PCAポンプパラメータ(以下に記載)を設定します(図15)。
警告!モルヒネの高用量は呼吸抑制を引き起こす可能性があります。.- モルヒネ濃度は1 mg / mLを使用してください。.オンデマンドのモルヒネ注入(静脈内ボーラス)(Bolus p.)を0.5 mgの用量で使用し、その後、次のオンデマンド注入を提供できる時間間隔(ロックアウト間隔/ [Karencja])を5分(呼吸抑制を避けるため)。.10秒のオンデマンド注入中にモルヒネの静脈内注射の時間を使用してください。.
- 上記の手順がすべて完了したことを確認します。
- PCAポンプでモルヒネを最大24時間注文します。
- 数値評価尺度(NRS)に従って痛みを監視します。医療記録の NRS 値をメモします。
- 疼痛評価カード(PAC)を使用します。
- 痛みの症状が出たときは、自分で「ジョイスティック」を押すように患者に伝え、それによって必要に応じて薬を入手してください。
- 患者が指示を理解していることを確認してください。
- オンデマンドの「静脈内ボーラス」から「エンプティボーラス」の量を観察します(ロックアウト間隔中に開始-UAEプロトコル後の患者ケアのセクション4.2.3)(図16)。
- 「空のボーラス」とオンデマンドの「静脈内ボーラス」の比率が2/1(67%/ 33%)を超える値に達した場合は、以下の手順を使用します(図17、 図18)。
- PCAポンプを使用した鎮痛療法の有効性を向上させ、モルヒネの副作用のリスクを減らすために、パラセタモールまたは非ステロイド性抗炎症薬を静脈内注射および標準用量で使用することを検討してください。.
- 患者がベッドを離れる必要がある状況に注意してください。
- ポンプを切らないでください。
- ドレンを外し、ストッパーで固定します。
- 患者が戻ったら、ドレーンを再接続します。
- PCAポンプ用のシリンジをモルヒネ溶液で準備します。
- EAを用いた塞栓術後の痛みに対する鎮痛治療。
- UAEの手続きに使用された場合は、EAを続行します。
- アラブ首長国連邦の処置に局所麻酔が使用され、患者が EA を注文した場合は、硬膜外カテーテル留置の前に、CBC および凝固検査が正しいことを確認してください。
- EA 手順の対象となる患者が、UAE 手順の実行のセクション 3.4.3 で説明されている矛盾がないことを確認します。その事実を医療記録に記してください。
- 麻酔科医に電話してEAを依頼してください。
- EA が動作していることを確認します。
- 麻酔科医とEAの作業モード(ボーラスまたは連続)を決定します。その事実を医療記録に記してください。
- 連続モード(CEA)では、麻酔科医に相談し、輸液ポンプの設定を確認してください。
- ボーラスモード(BEA)では、局所麻酔薬を投与する時間間隔について麻酔科医と話し合います。
- 必要に応じて、カテーテルを24〜48時間維持します。
- NRSスケールで痛みを監視します。医療記録の NRS 値をメモします。
- PAC を使用します。
- 必要になるまで、48時間以内でCEA / BEAを続けます。
- 必要に応じて、PCAまたはEAの後に鎮痛治療を継続します。.
- パラセタモール3 x 1.0 gを静脈内投与します。.
- ジクロフェナク2 x 50 mg直腸坐剤を注文します。.
- 上記の鎮痛薬治療が十分でない場合は、支持的鎮痛薬を含めてください。
- ケトプロフェン2 x 100 mgを静脈内投与するように注文します。.
- 尿路症状を治療するには、フラジジン3 x 100 mgを経口で注文します。.
5. UAE手続き後のコントロール訪問
注:これは婦人科医に宛てられています。
- UAEの翌日に最初の対照検査を実施します。
- 患者の全身状態を評価します。
- 患者の体温を測定します。
- NRSスケールに従ってUAE後の痛みを評価します。PAC を使用します。
- 血管カテーテルが挿入された傷を評価します。
- CBCおよび凝固テストを実行します。
- UAE後の骨盤内臓器の状態を評価するためにTVUSを実行します。
- ボリュームプローブを使用して3D TVUSを実行し、子宮筋腫(VI、FI、およびVFI)のボリュームと血管新生指数を評価します。
- 合併症がなく、塞栓後の痛みが経口鎮痛薬によって制御されている場合は、患者を自宅に退院させます。
- 入院後に発熱、腹痛、化膿性 ?? 疹性 ?? 疹が発生した場合、患者はすぐに医師の診察を受ける必要があることを患者に伝えてください。.
- UAEの3か月後に次のコントロール訪問を行います。
- 婦人科検査、CBC検査、およびAMHまたはFSH血清レベルを実施します。
- MRIまたはTVUSを実施して、UAE後の骨盤内臓器の状態を評価します(図19)。
- ボリュームプローブを使用して3D TVUSを実行し、子宮筋腫(VI、FI、およびVFI)のボリュームと血管新生指数を評価します。
- UAEの6か月後に最後のコントロール訪問を実行します。
- 婦人科検査、CBC検査、およびAMHまたはFSH血清レベルを実施します。
- UAE後の骨盤内臓器の状態を評価するためにTVUSを実行します。
- ボリュームプローブを使用して3D TVUSを実行し、子宮筋腫(VI、FI、およびVFI)のボリュームと血管新生指数を評価します。
- UAEの有効性を評価します。
- UAEの前後のCBCテストの結果を比較します。
- アラブ首長国連邦の前後の子宮筋腫(VI、FI、およびVFI)の体積と血管新生指数を比較します。
- UAEの前後の血清AMHまたはFSHレベルを比較して、「非標的」塞栓術の結果としてUAE中の卵巣に医原性損傷の可能性を評価します。
- 子宮動脈塞栓術後、定期的な婦人科検診を受けるべきであることを患者に伝えます。
- 選択された症例(子宮筋腫の症状の軽減なし、組織の境界の疑い、または他の追加検査での疑い)は、UAEの1年後にMRIを実施します(図20)。
結果
2009年から2019年までの期間に557件のUAEの手続きが実施されました。患者の平均年齢は38歳(31〜53歳)でした。547例(98.2%)の患者様で技術的な成功を達成しました。
2009年から2013年までの期間にUAE手術を行った3か月後の子宮筋腫体積の平均減少(MRI体積評価)は、32歳から52歳までの206人の患者グループで62%でした。最小の減少は9%(ヒアリン化子宮筋腫の患者)であった。分離した粘膜下筋腫(FIGO0)の患者では、完全な減少(100%)が達成されました。患者の90%がUAEの手術後に満足度を報告した64。
29〜52歳(平均年齢:43.1歳)の65人の患者グループにおけるUAEの3か月後の子宮筋腫体積の平均減少(超音波VOCAL体積評価)は50.1%(2.7%〜93.5%)でした。アラブ首長国連邦の手術前は、子宮筋腫の体積の中央値は101 cm3 (23.6〜610.0 cm3の範囲)でしたが、3か月後、子宮筋腫の体積の中央値が50.4 cm3 (6.9〜193.9 cm3の範囲)に減少することが観察されました。スピアマン相関検定では、初期の優勢な子宮筋腫の体積と体積減少率との間に、統計的に有意ではあるが比較的弱い正の相関(R = 0.33;p = 0.006)が示された。興味深いことに、小さい子宮筋腫はUAEの3か月後に子宮筋腫の体積減少の大きな変動を示しましたが、大きな子宮筋腫はUAE72に対して安定した予測可能な反応を示しました。
UAEの3か月後に17人の患者のグループにおけるドップラー血管指数(VI、FI、およびVFI)の減少が観察されました。VIとVFIの減少率は95.4%でしたが、FIでは58.3%の減少でした75。
卵巣予備能の評価は、UAEの3か月後に33〜40歳(平均年齢:35歳)の30人の患者で行われました。平均優勢な子宮筋腫の体積は107.75 cm3 (87.4〜131.1 cm3の範囲)でした。卵巣予備能の次のマーカーが調査されました:胞状卵胞数(AFC)、AMH、インヒビンB(INHB)、FSH、およびエストラジオール(E2)。AFC(56.7%)、AHM(36.7%、p<<0.001)、INHB(46.7%、p<0.001)、E2(43.3%、p<0.001)で有意な減少が観察された。同時に、FSH血清レベルの有意な増加(43.4%;p < 0.001)が観察された65。
UAEの手術から3か月後、粘膜下筋腫(FIGO 0)(直径6cmおよび8cm)の2人の患者で、子宮頸管を介した子宮筋腫の顕著な壊死性断片の排泄中に子宮逆転が観察され、緊急子宮摘出術が実施されました。
PCA(UAEプロトコル後の患者ケアの手順4.2)を使用した塞栓術後の痛みの軽減(PACによる)は、UAE手順の翌日にNRSスケールで60人の患者で評価されました。UAE直後のNRSの中央値は10(範囲5〜10)でしたが、治療後のNRSの中央値は4(範囲1〜5)と評価されました。子宮筋腫の初期容積(中央値194.5 cm3、範囲79-411 cm3)とUAE直後のNRSとの間のスピアマンの相関検定は、統計的に有意で強い正の相関(R = 0.6;p < 0.001)を示したが、治療後の子宮筋腫の初期容積とNRSとの間の相関は、統計的に有意な弱い正の相関を示した(R = 0.34;p < 0.001)。上記の関係を分析すると、UAE後の主要な子宮筋腫は、UAE後の塞栓術後の痛みを強く引き起こすと結論付けることができます。ただし、PCAを使用してUAE後の小さな子宮筋腫の塞栓後の痛みを治療すると、より良い結果が得られます。
代表結果の概要データを 表1に示します。

図1:FIGO子宮筋腫の分類。この図の拡大版を表示するには、ここをクリックしてください。

図2:経膣超音波スキャンを使用した骨盤検査。
73 x 50 x 55 mmの寸法の子宮筋腫(FIGO 5)が見えて、 この図の拡大版を表示するには、ここをクリックしてください。

図3:UAEの事前資格取得のための骨盤MRI検査。
矢状部分には、腫瘤効果のある大きな子宮筋腫(FIGO 2–5)が見えます。 この図の拡大版を表示するには、ここをクリックしてください。
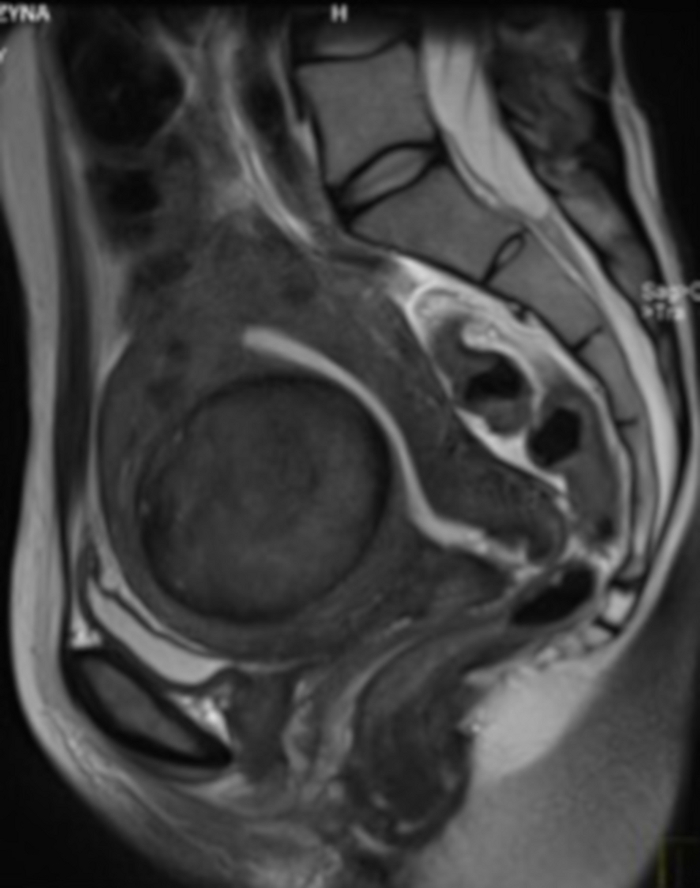
図4:UAEの事前資格取得のための骨盤MRI検査。
矢状切片に子宮筋腫(FIGO 2–5)が見えます。 この図の拡大版を表示するには、ここをクリックしてください。
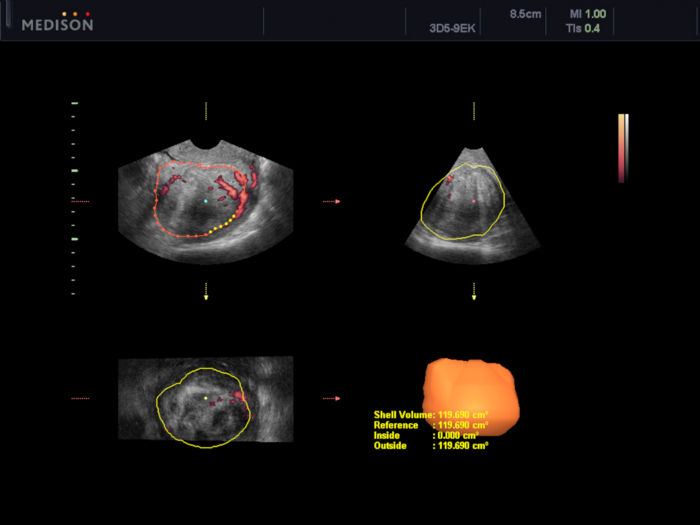
図5:VOCALソフトウェアを使用した子宮筋腫の体積の評価。
この場合、体積は119.7 cm3と推定されます。 この図の拡大版を表示するには、ここをクリックしてください。

図6:VOCALソフトウェアを使用した子宮筋腫の血管新生の評価。
この場合、血管新生指数が計算されました (VI 4.85、FI 25.38、および VFI 1.23)。 この図の拡大版を表示するには、ここをクリックしてください。

図7:写真は血管造影検査室の断片を示しています。
左下隅には、鼠径部が露出した患者がおり、そこからさらに多くのツールが導入されています。左上隅には、血管造影のCアームが見えます。右上隅にはモニターが表示され、オペレーターは入力ツールを追跡します。 この図の拡大版を表示するには、ここをクリックしてください。

図8:動脈穿刺のセット。
下から:針、イントロデューサー付き血管ロック、ガイド。 この図の拡大版を表示するには、ここをクリックしてください。
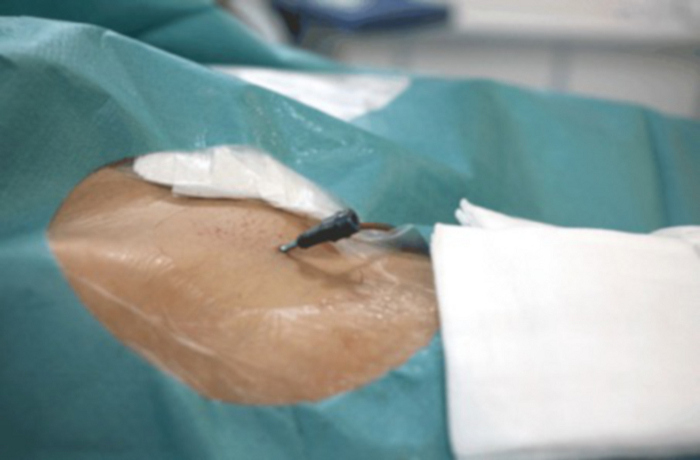
図9:大腿動脈に挿入された血管ロックが見える鼠径部のクローズアップ。この図の拡大版を表示するには、ここをクリックしてください。

図10:左側は、腹部大動脈に留置されたカテーテルからの血管造影。
子宮筋腫の目に見える血管のベアリング。比較のために(右)、UAEの後に実施されたコントロールテスト。 この図の拡大版を表示するには、ここをクリックしてください。

図11:子宮動脈の近位部分に留置されたRUCカテーテルを使用した選択的血管造影。
子宮筋腫の目に見える血管床。 この図の拡大版を表示するには、ここをクリックしてください。
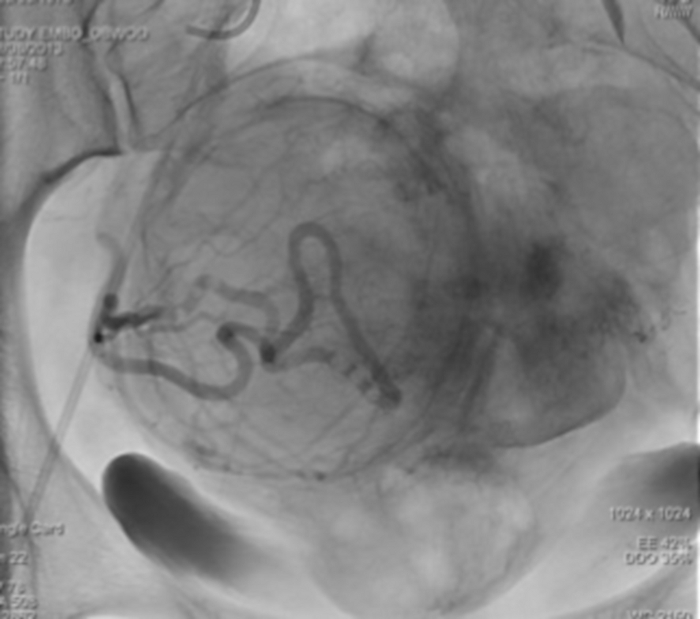
図12:右子宮動脈の造影剤のうっ血を示す単一のX線画像。この図の拡大版を表示するには、ここをクリックしてください。
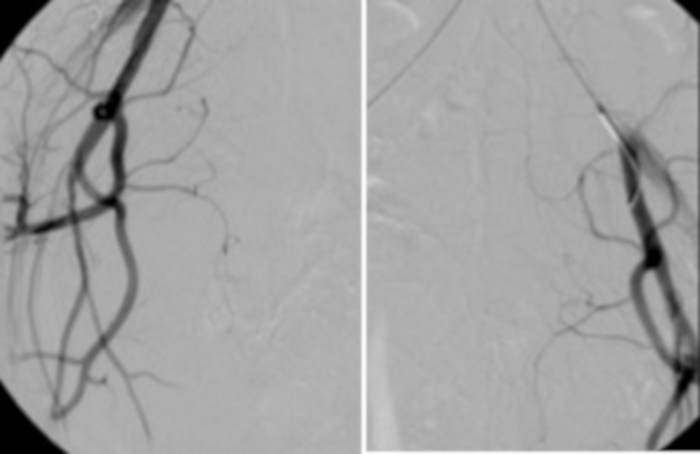
図13:左右の腸骨動脈にそれぞれ配置されたメインカテーテルから行われるコントロール血管造影は、子宮動脈への新鮮な血液の流入の欠如を確認します(シェーディング)。この図の拡大版を表示するには、ここをクリックしてください。
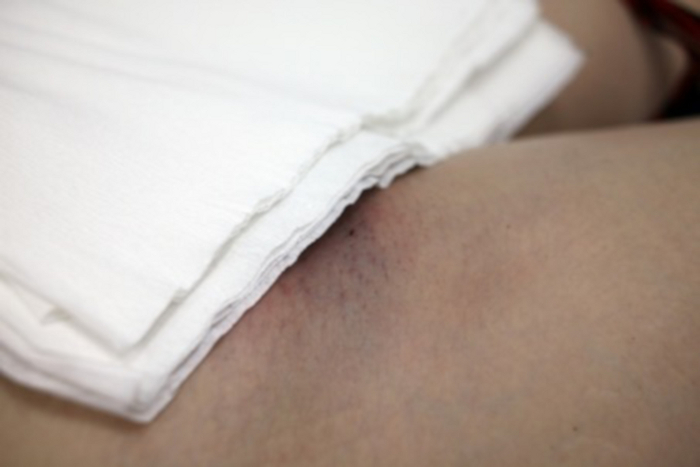
図14:UAE完成後の血管アクセス部位。
右鼠径部付近に2mmの切開部が見えます。 この図の拡大版を表示するには、ここをクリックしてください。

図15:UAE治療後の塞栓術後の痛みに対するPCAポンプパラメータ設定(UAEプロトコル後の患者ケアのセクション4.2.3)。この図の拡大版を表示するには、ここをクリックしてください。

図16:動作中のPCAポンプ。
オンデマンドの静脈内ボーラスと「空のボーラス」の比率 (UAE プロトコル後の患者ケアのセクション 4.2.6.2) 1:1 (50%:50%)。 この図の拡大版を表示するには、ここをクリックしてください。

図17:稼働中のPCAポンプ。
オンデマンド静脈内ボーラスと「空のボーラス」の比率 (UAE プロトコル後の患者ケアのセクション 4.2.6.3) 1:2 (33%:67%)。これには、追加の鎮痛治療が必要です(UAEプロトコル後の患者ケアの手順4.2.6.4.)。 この図の拡大版を表示するには、ここをクリックしてください。

図18:動作中のPCAポンプ。
オンデマンド静脈内ボーラスと「空のボーラス」の比率 (UAE プロトコル後の患者ケアのセクション 4.2.6.3) 1:3 (25%:75%)。これには、継続的な追加の鎮痛治療が必要です(UAEプロトコル後の患者ケアの手順4.2.6.4.)。. この図の拡大版を表示するには、ここをクリックしてください。

図19:UAEの手術から3か月後の骨盤MRI検査(図3と同じケース)。
矢状部分に見えるのは子宮筋腫(FIGO5)で、処置前よりも大幅に小さく、子宮筋腫組織の密度が異なります。 この図の拡大版を表示するには、ここをクリックしてください。
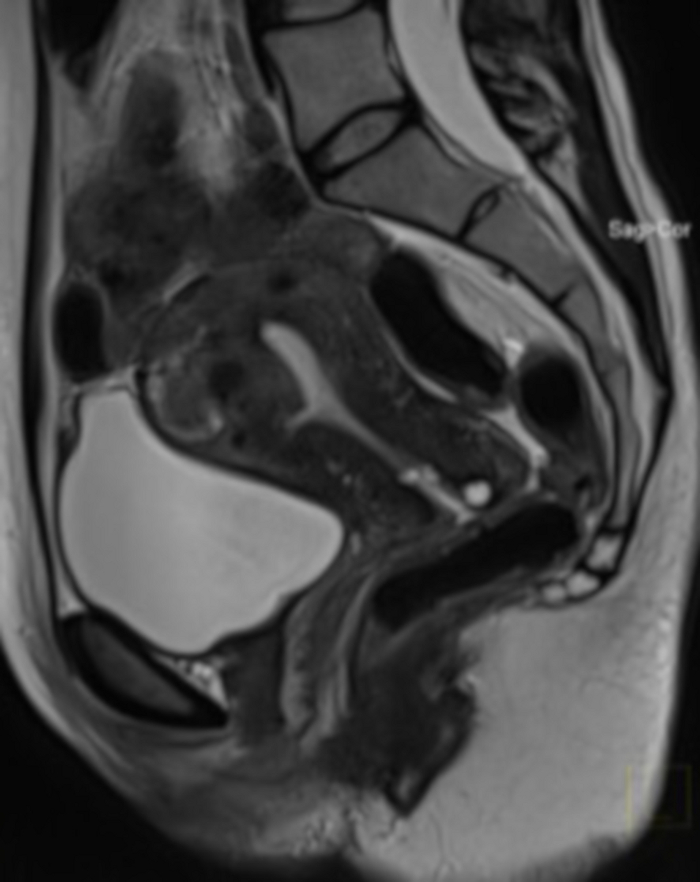
図20:UAEの手術から1年後の骨盤MRI検査(図4と同じケース)。
矢状切片に見えるのは子宮筋腫(FIGO2-5)で、UAE後には非常に大きな体積減少が見られます。MRIは、処置後に組織の境界が疑われたため実施されました(両手検査で子宮筋腫の構造を評価する可能性はありません)。 この図の拡大版を表示するには、ここをクリックしてください。
| 代表的結果/ルブリンプロトコル64,65,72 | ||
| 2009年から2019年までの期間に実施されたUAEの手続きの数 | 557 | |
| 技術的な成功 | 547人の患者様(98.2%)で達成 | |
| 32 歳から 52 歳 (平均年齢 - 39 歳) の 206 人の患者のグループにおける UAE の 3 か月後の子宮筋腫体積の平均減少 (MRI 体積評価) | 62.0% (9.0-100.0%) | |
| 29〜52歳(平均年齢– 43.1歳)の65人の患者のグループにおけるUAEの3か月後の子宮筋腫体積の平均減少(超音波VOCAL体積評価) | 50.1% (2.7-93.5%) | |
| 卵巣予備能の評価 | AFCの減少 | 56.7% (p<0.001) |
| AMHの減少 | 36.7%(p<0.001) | |
| INHBの減少 | 46.7% (p<0.001) | |
| E2の減少 | 43.3% (p<0.001) | |
| FSHの増加 | 43.4% (p<0.001) | |
| 60人の患者のグループで評価されたPCA(「UAE後の患者ケア」プロトコルの手順2)を使用した塞栓後の痛みの軽減(PACによる) | UAE直後のNRSの中央値 | 10(範囲5〜10) |
| UAEの翌日の NRSの中央値 | 4 (範囲 1 〜 5) | |
表1:ルブリンプロトコルに従って実施された症候性子宮筋腫の治療におけるUAE技術の代表的な結果。
ディスカッション
子宮筋腫の構造、サイズ、局在、症状が異なるため、統一されたUAEプロトコルの作成は簡単な作業ではありませんでした。この治療法の仮定と患者の期待に関しては、資格の段階と治療の効果の両方において、多くの不一致がありました。UAEに紹介された患者は、子宮筋腫の臨床徴候を報告しておらず、これらの子宮腫瘍が根本的に切除されないことに気づいていなかったことが何度もありました。唯一の明確な期待は、手術なしで子宮筋腫を取り除くことでした。
したがって、患者がこの方法の仮定を理解し、それを受け入れ、子宮筋腫治療の代替方法に関する違いを知ることが重要です。彼女の意識的な選択(UAE議定書の資格のセクション1.1)は重要なポイントであり、その適切な実施により、議定書の継続が可能になります。
プロトコルの実装中に、いくつかの手順が繰り返されます。これは、このジャーナルが採用した公式、つまり個々のコマンドが命令モードで記述され、一人の人に向けられるという公式から意図されたものであり、その結果です。ただし、資格、準備、およびその他のUAEの段階には、複数の医師が関与することがよくあります。これらは、プロトコルの重要なポイントでもあります。それらの省略は、最適でない条件下で、または禁忌の存在下でUAEをもたらす可能性があります。したがって、プロトコルは5つの章に分割されています。これにより、さまざまな専門家がそれを継続することができ、繰り返されるプロトコルポイントが独立してチェックされます。
子宮筋腫の治療における子宮動脈塞栓術の統一されたプロトコルを作成することにおけるさらなる困難は、同じ手順41に関連する現在の多数の推奨事項(11ものもの)です。彼らの仮定は似ていますが、いつものように、「悪魔は細部に宿る」ため、その詳細には統一が必要でした。アラブ首長国連邦(UAE)を受けている患者の子宮筋腫の位置や生殖計画に関する相対的な禁忌は、資格取得時に最も物議を醸すものです。SOGCによって提案されたより厳格な基準を適用すると、患者はこの手順から除外されるべきですが、より自由なRCOGの推奨事項はUAE14,32,43の資格を許可しています。問題は何をすべきかです。プロトコールの作成時には、(広範な文献は別として)症例の分析と得られた経験に基づいて決定を下しましたが、これには各患者に対する個別のアプローチが必要です。したがって、プロトコルは、相対的禁忌の患者におけるUAEのパフォーマンスを除外するものではありません(UAEプロトコルの資格のセクション1.4)。UAEの適切な資格と準備が、治療の成功の鍵であるように思われます。この技術自体も非常に重要であり、UAEのケアと同様に、治療の成功や患者の満足度だけでなく、上記の合併症の欠如も保証します。
子宮筋腫の数に関係なく、すべての病変は1回の処置で塞栓されます。通常、子宮筋腫が多ければ多いほど、注入される塞栓術材料が多くなります。これにより、塞栓術の期間が延長されますが、手順は変わりません。UAEは、卵巣動脈との明らかな関連が見られる場合、非標的塞栓術のリスクが増加する可能性があります。次に、そのような接続を閉じることができます(たとえば、コイルを使用して)、卵巣と子宮の供給を分離し、700μmの粒子を使用して塞栓術を続行します。コイルを埋め込むことができない場合は、粒子径を900μmに増やします。
子宮筋腫を卵巣動脈の側から供給できる場合もあります。その後、子宮動脈は低形成になります。これらの場合、塞栓術を成功させるためには、マイクロカテーテルを卵巣動脈に挿入し、卵巣を過ぎて塞栓術材料を子宮血管床に沈着させながら、適切な卵巣供給を維持する必要があります。
塞栓術の疑いのない利点は、技術的に難しい手順ではなく、高度な機器を必要としないという事実です。
このプロトコルの強みは、少なくとも半数の患者がUAEの資格を得たときに聞いたことがなかった塞栓術後の痛みの治療に関するポイントです。私たちが提案する標準的な手順は、PCAポンプの使用です(UAEプロトコル後の患者ケアのセクション4.2)、得られた結果は、そのような治療の高い有効性を確認します。
UAE議定書の将来の修正については、炎症や敗血症のリスクがあるため、手順の前に子宮からIUDを取り外す必要があるUAE議定書の準備のセクション10を変更することが可能だと思われます。大規模な追跡研究では、骨盤内の感染リスクとIUDの存在を組み合わせると、1300人に1人未満である49。
UAEは、この手順が短期的および長期的にもたらす可能性のある合併症の有効性を評価し、調査する必要があったため、最初の使用以来、実験的な方法として扱われてきました。この間、適応症と禁忌は、新しい検査結果と臨床観察に基づいて修正されました。いくつかのランダム化比較試験を含む現在のデータでは、UAEは症候性子宮筋腫の貴重な治療法として認識されており、その有効性と安全性は十分に確立されています。
上記のプロトコルの作成は、10年間の婦人科医と外科放射線科医の緊密な協力の結果として得られた現在の文献、関連する推奨事項、および経験の徹底的な分析によるものです。
開示事項
著者は何も開示していません。
陳述:
FIGO子宮筋腫の分類を示す 図1の著者であるPiotr Szkodziakは、変更を加えずに科学的および教育的アプリケーションに図を自由に使用できます。図を修正する意図は、著者(piotr.szkodziak@gmail.com)によって受け入れられるべきです。
謝辞
著者は、ルブリン医科大学の第3代議長および婦人科およびインターベンショナルラジオロジーおよび神経放射線科のチーム全体に感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
参考文献
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved