Method Article
פרוטוקול לובלין של תסחיף עורקי הרחם בטיפול בשרירנים סימפטומטיים ברחם
* These authors contributed equally
In This Article
Summary
כאן, אנו מציגים שיטת אמבוליזציה של עורק הרחם לטיפול בשרירנים רחמיים סימפטומטיים המחולקת לחמישה חלקים: הסמכה, הכנה, ביצוע, טיפול לאחר ההליך וביקורי מעקב. פרוטוקול זה דורש שיתוף פעולה הדוק בין גינקולוגים לרדיולוגים התערבותיים, המאפשר ביצוע נכון של ההליך הנ"ל.
Abstract
שרירנים ברחם הם גידולים שפירים שמקורם ברקמת שריר חלקה, המהווים סטרומה של שרירי הרחם. שרירנים ברחם הם הגידולים השפירים הנפוצים ביותר המצויים אצל נשים. אצל 20%-50% מהנשים, שרירנים הם אסימפטומטיים ואינם דורשים טיפול כלשהו. התסמינים העיקריים של שרירנים ברחם הם דימום וסתי רב, דימום רחמי חריג ותסמיני לחץ. תסמיני לחץ עלולים לגרום לתסמונת כאבי אגן, הפרעות במתן שתן ועצירות.
שיטות הטיפול המשמשות כיום כוללות טיפול כירורגי, טיפול תרופתי ופרוצדורות זעיר פולשניות. השיטה הזעיר פולשנית הנפוצה ביותר היא אמבוליזציה של עורקי הרחם. הליך זה הוא כיום שיטת טיפול מקובלת בשרירנים סימפטומטיים ברחם והוכר ככזה על ידי המכון הלאומי לבריאות ומצוינות קלינית בהנחיות לדימום וסתי כבד.
זהו הליך מסובך ודורש שיתוף פעולה הדוק בין גינקולוגים לרדיולוגים התערבותיים. אנו מציגים פרוטוקול החל על תסחיף עורק הרחם בטיפול בשרירנים רחמיים סימפטומטיים. הפרוטוקול מחולק לחמישה חלקים. שני הסעיפים הראשונים מיועדים לגניקולוגים ולרדיולוגים התערבותיים, ומסבירים כיצד להכשיר ולהכין מטופלת לאמבוליזציה באופן צעד אחר צעד. החלק השלישי, המיועד לרדיולוגים התערבותיים, מסביר כיצד יש לבצע אמבוליזציה. החלק הרביעי מכוון לגניקולוגים או לרופאי מחלקות בבית חולים המטפלים במטופלות לאחר אמבוליזציה. חלק זה של הפרוטוקול מציע שיטה לטיפול בכאב לאחר אמבוליזציה באמצעות משאבת שיכוך כאבים מבוקרת על ידי המטופל (PCA). החלק החמישי משלים את ההליך עם הערכה של ההשפעות והסיבוכים המאוחרים של אמבוליזציה של עורק הרחם.
כל חמשת הסעיפים יוצרים פרוטוקול אחיד המכוון לקלינאים, מומחים וחוקרים חדשים בתחום.
Introduction
שרירנים ברחם הם גידולים שפירים שמקורם ברקמת שריר חלקה, המהווים סטרומה של שרירי הרחם. הם גידולים חד שבטיים, המורכבים מכמות גדולה של חומר חוץ-תאי המכיל קולגן, פיברונקטין ופרוטאוגליקנים. השרירנים מוקפים בפסאודו-קפסולה דקה העשויה מסיבי שריר דחוסים, סיבי קולגן, נוירו-סיבים וכלי דם 1,2. הפתופיזיולוגיה של מיומות אינה מובנת לחלוטין אך נראה שהיא מסתמכת בעיקר על התפשטות חד שבטית הנגרמת על ידי שינויים אפיגנטיים סלקטיביים וספציפיים לרקמה3. לא נמצא גן אחד הגורם לשרירנים ברחם. עם זאת, נוכחותן של תסמונות שרירנים נדירות ברחם, כגון ליומיומטוזיס עורי ורחמי מרובים, יוחסה לגן המקודד לפומראט הידרטאז, אנזים מיטוכונדריאלי המעורב במחזורקרבס 4. הנוכחות של מחיקות וטרנסלוקציות של כרומוזום 7 בכרומוזומים 7, 12 ו-14, המתרחשות ב-50% מהשרירנים, נראית משנית ולא ראשונית 5,6,7.
המווסתים את צמיחת השרירנים ברחם הם הורמונים סטרואידים המיוצרים על ידי שחלות (אסטרוגנים ופרוגסטרון), גורמי גדילה, אנגיוגנזה ואפופטוזיס. זוהו גם גורמי סיכון להתפתחות שרירנים ברחם, כולל גיל, וסת מוקדמת, גזע אפרו-אמריקאי, תורשה, אפסיות, השמנת יתר, תסמונת השחלות הפוליציסטיות, סוכרת, יתר לחץ דם, מחסור בוויטמין D, שימוש בחלב סויה, אלכוהול וצריכת קפאין8.
שרירנים ברחם הם הגידולים השפירים הנפוצים ביותר של איברי הרבייה אצל נשים. גידולים אלה תוארו לראשונה בשנת 1793 על ידי מתיו ביילי בבית החולים סנט ג'ורג' בלונדון. נתונים אפידמיולוגיים זמינים אינם מציינים במדויק את שכיחות השרירנים ברחם, מכיוון שחלקם הגדול נותר לא מאובחן. ההערכה היא כי שרירנים ברחם מופיעים אצל 5.4% עד 77% מכלל החולים. שכיחותם גבוהה יותר בארצות הברית מאשר באירופה, הסיבה הסבירה היא הבדלים גזעיים8.
בקרב נשים בגיל הפוריות, כ-30% מהמיומות עלולות לגרום לתסמינים קליניים בצורה של דימום רחמי לא תקין, וכתוצאה מכך אספקת דם לא מספקת במטופלות9. ברוב המקרים, לחולים יש יותר ממיומה אחת, שהם נגעים כדוריים הממוקמים ברחם. מידותיהם ומיקומם עשויים להשתנות. ב-90% מהמקרים הם ממוקמים בגוף הרחם. הקוטר שלהם יכול להיות בין כמה מילימטרים ל -20 ס"מ10.
סיווג FIGO (Fédération Internationale de Gynécologie et d'Obstétrique) מחלק אותם לקבוצות מ-0-8 בהתאם לסמיכות רירית הרחם (נמוך יותר המספר, קרוב יותר יהיה רירית הרחם) (איור 1)11. בכ-50%-75% מהמקרים, שרירנים הם אסימפטומטיים. התסמינים השכיחים ביותר של שרירנים ברחם הם דימום וסתי רב, דימום רחמי חריג ותסמיני לחץ. מיומות קשורות לכ-10% ממקרי הפוריות, וב-1%-3% הן הגורם היחידל-12. שרירנים ברחם אסימפטומטיים עוברים בדרך כלל רק בקרה רפואית רגילה, בעוד ששרירנים סימפטומטיים הם אינדיקציה לטיפול13.
שיטות הטיפול בשרירנים ברחם המשמשות כיום כוללות טיפול כירורגי, טיפול תרופתי ופרוצדורות זעיר פולשניות 13,14,15,16,17,18. הטיפול הכירורגי כולל כריתת שריר (בטן והיסטרוסקופיה) וכריתת רחם. גם לכריתת שריר וגם לכריתת רחם יש השפעה חיובית על איכות החיים19. כריתת רחם קשורה לאובדן פוריות בלתי הפיך; לפיכך, נשים רבות מחפשות אפשרויות טיפול אחרות20.
כריתת שריר הבטן מאפשרת שמירה על הפוריות. בהתאם לגודל ומספר השרירנים, כמו גם לניסיון המנתח, ניתן לבצע הליך זה באמצעות לפרוטומיה או לפרוסקופיה. למרות ששטפי דם נפוצים פחות מאשר בכריתת רחם, התחלואה הכללית דומה. כריתת שרירנים היסטרוסקופית היא שיטה בטוחה יותר, פחות פולשנית מכריתת שרירנים בבטן ומאפשרת טיפול בשרירנים תת-ריריים (FIGO 0). ייתכן שיהיה צורך בהליכים היסטרוסקופיים הבאים כדי להסיר לחלוטין שרירנים גדולים יותר מסוג 221.
לבונורגסטרל המשחרר התקנים תוך רחמיים הם טיפול יעיל לדימום וסתי כבד, אך הם אינם מקטינים את גודל השרירנים. השימוש בהם מוגבל בחולים עם חלל הרחם המעוות. אנלוגים של GnRH משמשים בעיקר כחומר טרום ניתוחי להפחתת גודל השרירנים ואיבוד הדם סביב הניתוח. הם גם מפחיתים את אחוז החתכים האנכיים במהלך כריתת רחם וכריתת שריר תוך הגדלת האפשרות להליך נרתיקי20.
בטווח הקצר, מודולטורים סלקטיביים של קולטני פרוגסטרון מפחיתים את נפח המיומה וגורמים לאמנוריאה. עם זאת, היעילות והבטיחות לטווח הארוך דורשות מחקר נוסף. יחד עם מעכבי ארומטאז, עשויות להיות אפשרויות אחרות לטיפול טרום ניתוחי באנמיה ולהפחתת נפח המיומה22. מחקרים מסוימים מצביעים על כך שוויטמין D עשוי להאט או למנוע את צמיחת השרירנים ואת הופעת התסמינים23.
שיטות חדשות המשתמשות ב-2-מתוקסיאסטרדיול בשילוב עם ננו-חלקיקים נמצאות גם הן בפיתוח24. שיטות זעיר פולשניות המשמשות לטיפול בשרירנים כוללות אמבוליזציה של עורק הרחם (UAE), ניתוח אולטרסאונד ממוקד מונחה תהודה מגנטית (MRgFUS), חסימת עורק רחם לפרוסקופית (LUAO) ומיוליזה בתדר רדיו14,25. אולטרסאונד ממוקד בעוצמה גבוהה מונחה אולטרסאונד (US-HIFU) היא שיטה חדשה, עדיין ניסיונית, זעיר פולשנית26,27.
שיטות לחסימת כלי דם טיפולית וחסימת אספקת הדם לרחם הוזכרו לפני למעלה מ-120 שנה. בשנת 1894, קלי הציג את קשירת עורקי הכסל הפנימיים במהלך כריתת רחם אונקולוגית כדי לשלוט בדימום אגן בלתי פתיר, שהיה באותה תקופה סיבוך שכיח לאחרההליך הכירורגי. לאחר מכן, סאק (1973) תיאר את השימוש היעיל באותה טכניקה בטיפול בדימום מסיבי לאחר לידה לאחר לידת מלקחיים. בשני המקרים, המוסטזיס הושג ללא כריתת רחם29. בשנת 1979, Heaston et al. ו-Brown et al., תיארו באופן עצמאי אמבוליזציה של עורקי האגן באמצעות ספוגי ג'לטין נספגים כדי לשלוט בדימום לאחר לידה30,31.
איחוד האמירויות הערביות שימש לראשונה כשיטת טיפול בשרירנים סימפטומטיים ברחם בשנת 1991 בצרפת32. הוא שימש בתחילה להפחתת אובדן דם לאחר כריתת שריר. בשנת 1995, Ravina et al. הציעו הליך זה כשיטת הטיפול העיקרית בשרירנים רחמיים סימפטומטיים33. בארצות הברית, אמבוליזציה של עורק הרחם בוצעה בהצלחה בשנת 199734.
העניין הגובר בשימור הרחם אצל נשים עם שרירנים סימפטומטיים מציב את איחוד האמירויות בחזית הטיפול בשרירנים זעיר פולשניים 14,18,35,36,37. בשנת 2000 הוקמה קבוצת העבודה המשותפת של הקולג' המלכותי למיילדות וגינקולוגים והקולג' המלכותי לרדיולוגים כדי להוציא הנחיות בנושא איחוד האמירויות הערביות. באותה תקופה, איחוד האמירויות הערביות נחשבה לשיטה ניסיונית (פחות מ-7,000 פרוצדורות שבוצעו ברחבי העולם). מאז פרסום ההנחיות, בוצעו יותר מ-100,000 הליכים באיחוד האמירויות ברחבי העולם. כמו כן, בוצעו חמישה ניסויים אקראיים ומבוקרים, המשווים את איחוד האמירויות להליכים כירורגיים אחרים. תוצאות המחקר מצביעות על כך שאיחוד האמירויות יעיל מאוד בטווח הקצר עד הבינוני (עד מספר שנים) עם סיכון נמוך לסיבוכים בינוניים (למשל, זיהום ברחם) וחמורים (מסכני חיים)38,39. במחקרים אקראיים, זמני אשפוז קצרים יותר, התאוששות מהירה יותר וחזרה לפעילות יומיומית מדברים לטובת איחוד האמירויות. פרוצדורות כירורגיות הוכחו כזולות יותר ודרשו התערבות חוזרת בתדירות נמוכה יותר תוך שמירה על מובהקות סטטיסטית32. הליך זה הוא כיום שיטת טיפול מקובלת בשרירנים ברחם סימפטומטיים והוכר ככזה על ידי המכון הלאומי לבריאות ומצוינות קלינית (NICE) בהנחיות לדימום וסתי כבד40.
נכון לעכשיו, ישנן 11 המלצות לגבי השימוש ב-UAE לטיפול בשרירנים רחמיים סימפטומטיים, שנוצרו על ידי אגודות מדעיות מאירופה, צפון אמריקה ואוסטרליה. ברוב המקרים, ההמלצות עקביות בעוד שהסטייה נוגעת לשני אי-התאמות. הראשונה היא האם מיומה תת-רירית (FIGO 0) ותת-סרוזלית (FIGO 7) הן התוויות נגד לאיחוד האמירויות הערביות. השנייה היא האם נשים המצהירות על הריון עתידי צריכות להיות מוסמכות להליך זה41. הקולג' האמריקאי למיילדות וגינקולוגים (ACOG) (2008) הציג הנחיה מעניינת לטיפול בשרירנים ברחם. בהתבסס על ראיות מדעיות עקביות (רמה A), ה-ACOG הגדיר את איחוד האמירויות הערביות כשיטה יעילה ובטוחה לנשים מוסמכות כראוי המעוניינות לשמר את הרחם עם אינדיקציות אופייניות לטיפול בשרירנים. יחד עם זאת, המלצות ה-ACOG הדגישו את הצורך בשיתוף פעולה הדוק בין גינקולוגים לרדיולוגים התערבותיים. בהנחיות שפורסמו, ה-ACOG הכיר ברצון לשמר את הפוריות כהתווית נגד (יחסית)42.
אחת ההמלצות האחרונות פורסמה בשנת 2013 על ידי הקולג' המלכותי למיילדות וגינקולוגים (RCOG) ובשנת 2015 על ידי אגודת המיילדות והגינקולוגים של קנדה (SOGC)41. בחלק הנותר של מאמר זה, המחברים ישתמשו בהמלצות לעיל. על פי ההנחיות של RCOG ו-SOGC, כל חולה עם מיומות סימפטומטיות יכול להיות מועמד לאמבוליזציה, בתנאי שאין התוויות נגד והיתרונות של ההליך (פתרון הסימפטומים) עולים על הסיכון לסיבוכים. יש לציין כי אמבוליזציה של שרירנים ברחם כהליך זעיר פולשני טומנת בחובה מספר זניח של סיבוכים חמורים. לפיכך, היתרונות ברוב המקרים עולים על הסיכון לסיבוכים 14,32,43.
להסמכה מתאימה של המטופל יש חשיבות מכרעת ליעילות קלינית גבוהה ולמניעת סיבוכים לאחר איחוד האמירויות הערביות. האינדיקציה העיקרית ל-UAE היא שרירנים ברחם סימפטומטיים, וכתוצאה מכך דימום וסתי כבד, דיסמנוריאה, כאבים, דיספרוניה ותופעות לוואי אחרות על דרכי השתן או מערכת העיכול. יש צורך להבדיל בין שרירנים לבין אדנומיוזיס או שרירנים המתקיימים במקביל לאדנומיוזיס מכיוון שבמצב כזה, איחוד האמירויות פחות יעיל ודורש שינוי של טכניקת ההליך 14,32,43,44,45,46,47. אינדיקציות ספציפיות לביצוע הליך איחוד האמירויות בנשים עם שרירנים ברחם סימפטומטיים כוללות סירוב לניתוח, היעדר הסכמה לעירוי דם וניתוח שרירנים ברחם שנכשל בעבר.
באינדיקציות לעיל, יש להתייחס לאיחוד האמירויות כחלופה לטיפול כירורגי. עם זאת, יש ליידע את המטופלים כי במספר קטן של מקרים, סיבוכים לאחר ההליך עלולים לגרום לצורך בהתערבות כירורגית 14,32,43. על פי הנחיות RCOG, השימוש באיחוד האמירויות במצב בו מיומה היא גורם סביר לאי פוריות דורש טיפול מיוחד והערכה נכונה של רופא נשים המתמחה בטיפול באי פוריות ורבייה בסיוע. אי פוריות עקב נוכחות שרירנים אינה מוחלטת, ונשים רבות ייכנסו להריון ללא כל התערבות. לכן, סביר לשלול סיבות אפשריות אחרות לאי פוריות, כולל הערכת בן הזוג הגבר 14,32,43.
לפיכך, על פי המלצות RCOG ו-SOGC, המועמדות צריכות להיות נשים עם שרירנים ברחם סימפטומטיים שבהן לא נכללו פתולוגיות באגן עם תסמינים קליניים דמויי שרירנים41,43.
התוויות נגד מוחלטות להליך זה כוללות זיהום באברי המין הנוכחי או האחרון, ספקות אבחנתיים עקב גורמים קליניים או הדמיה לא מספקת, שרירנים אסימפטומטיים, הריון בר קיימא והתוויות נגד לשימוש בחומרי ניגוד רדיולוגיים.
התוויות נגד יחסיות כוללות שרירנים תת-ריריים (FIGO 0) ותת-סרוזליים (FIGO 7), אשר תיאורטית עלולים להתנתק מרירית הרחם עקב נמק פדונקל, במקרים נדירים ולגרום לאלח דם. במקרים אלה, יש לשקול את UAE רק אם הסרה היסטרוסקופית או לפרוסקופית של מיומה פדונקולטית לפני תכנון ההליך.
למרות העובדה שהספרות הנוכחית מצביעה על כך שגודל המיומה אינו מהווה התווית נגד בפני עצמו, הניסיון מראה כי נדרשת זהירות רבה בעת הכשרת חולים עם מיומות גדולות (במיוחד הקשורות לתסמיני דחיסה) לאיחוד האמירויות, שכן הפחתת הנפח עשויה להיות לא מספיקה כדי להקל על הסימפטומים ולעמוד בציפיות המטופלים14,32, 43,48.
ישנם דיווחים רבים על הריון מוצלח לאחר איחוד האמירויות, אך הראיות הקיימות אינן תומכות באופן מלא בשימוש בו כחלופה לטיפול תרופתי או כירורגי (כריתת שריר) בנשים צעירות49. לכן, יש להשתמש בהליך זה בזהירות רבה בנשים המצהירות על רצון להיכנס להריון (מכיוון שיש שיעור הריון נמוך יותר, שיעור הפלות גבוה יותר, קרע ברחם, שליה אקרטית ותוצאות הריון שליליות לאחר איחוד האמירויות מאשר לאחר כריתת שריר)32,50,51,52,53,54,55. כגינקולוגים, אנו לא ממליצים על איחוד האמירויות לנשים המעוניינות בהריון. עבורנו, זוהי התווית נגד יחסית, בתנאי שישנן אינדיקציות נוספות לאיחוד האמירויות, כגון סירוב לניתוח או עירויי דם, שבהם היעדר טיפול עלול להיות מסכן חיים.
על פי הנחיות RCOG, הרצון לשמר או לשפר את הפוריות אצל נשים צעירות עם שרירנים ברחם סימפטומטיים הוא התווית נגד יחסית ל-UAE32. לעומת זאת, הנחיות SOGC ממליצות כי במקרים דומים אין להציע את UAE כאופציה טיפולית לשרירנים, מכיוון שבטיחות ויעילות בנשים כאלה לא נקבעו14,43. נקודת מבט דומה מיוצגת על ידי אגודות מדעיות אחרות, כולל האגודה האמריקאית לרפואת רבייה (ASRM), הקולג' האמריקאי למיילדות וגינקולוגים (ACOG), הקולג' האמריקאי לרדיולוגיה (ACR), הקולג' המלכותי של אוסטרליה וניו זילנד למיילדות וגינקולוגים (RANZCOG) ואחרים, המצטטים תוצאות פוריות משופרות לאחר כריתת שריר 41,43,56. איחוד האמירויות הערביות הומלץ רק על ידי NICE לנשים המבקשות לשמור על פוריות או לשפר אותה, במיוחד עם מאפיינים שליליים לכריתת שרירנים (שרירנים מרובים)57.
באופן כללי, ניתן לבצע את ההליכים של איחוד האמירויות בכל שלב של המחזור החודשי32. עם זאת, בהנחה שאין שיטה אידיאלית לשלול הריון בשלב ההפריה או ההשתלה, על מנת לשלול הריון מוקדם, במרכזנו הוא מבוצע עד יום המחזור העשירי. ברוב המקרים, המטופלות מתקבלות למחלקת נשים ביום ההליך. אשפוז מטופל במחלקה לכירורגיית כלי דם מותר אם ניתנות בדיקות מתאימות וייעוץ גינקולוגי. גינקולוג ורדיולוג התערבותי מבצעים הסמכה לאמבוליזציה של שרירנים. הסמכה גינקולוגית כוללת היסטוריה רפואית, בדיקה, הערכת אולטרסאונד של איבר הרבייה וסוג המיומה. בנוסף, כדי לשלול כל ממאירות בתוך הרחם, יש צורך במריחת צוואר הרחם (PAP) וביופסיה של רירית הרחם. במקרים בהם סריקת האולטרסאונד של השחלות מוטלת בספק, יש צורך בבדיקת ROMA (אלגוריתם סיכון לממאירות בשחלות).
נושא נפרד הדורש דיון הוא סרקומה ברחם, בפרט ליומיוסרקומה (LMS), המהווה 70% מגידולי הרחם הללו. השכיחות של LMS בחולים שנותחו למיומה נמוכה ומוערכת ב-0.13%-0.29%58,59. העלייה בשכיחות LMS נצפתה אצל נשים מעל גיל 40. קשה לאבחן LMS לפני הטיפול מכיוון שהוא עשוי להידמות לשרירנים שפירים60. רוב ה-LMS אינם קשורים לשרירנים קיימים, ואין עדות לקשר של LMS עם שרירנים ברחם61. גם שרירנים ברחם וגם LMS נוטים לגדול במהירות. לפיכך, הגודל או קצב הגדילה אינם מהווים גורם סיכון לגידול רחם ממאיר60.
נכון לעכשיו, אין בדיקות מעבדה או הדמיה אמינות שיאפשרו לנו לזהות בבירור ליומיוסרקומה ולהבדיל בינה לבין ליומיומה60,62. הרגישות של ביופסיית רירית הרחם באבחון ליומיוסרקומה היא 86%. לפיכך, תוצאת ביופסיה שלילית אינה שוללת את קיומו של גידול רחם ממאיר. MRI משופר ניגודיות הוא כיום שיטת האבחון האופטימלית לגידולי רחם. הרגישות של מבחן זה באבחון LMS היא 94%60.
כאמור, הבדיקות לעיל אינן שוללות 100% מגידולי הרחם הממאירים. לכן, קיים סיכון קל להארכת האבחנה של LMS לאחר הטיפול, ללא אפשרות לאימות היסטופתולוגי של הגידול ברחם. יש ליידע את המטופל על כך במהלך ההסמכה לאיחוד האמירויות הערביות.
ביצוע ספירת דם מלאה (CBC) ובדיקות קרישה (INR, APTT), פאנל כליות (קריאטינין, אוריאה), הורמון מגרה בלוטת התריס (TSH), ריכוז ההורמון האנטי-מולרי (AMH) (מומלץ) או ההורמון מגרה הזקיק (FSH) בשלב הזקיקי, חלבון מגיב C (CRP), בדיקת שתן כללית ומריחת נרתיק (תרבית נרתיק אירובית) מאפשרים להעריך ולהימנע מסיבוכים פוטנציאליים לאחר אמבוליזציה (זיהומים, נזק שחלתי יאטרוגני, העצמה של פגיעה כלייתית קודמת לאחר חומרי ניגוד מבוססי גדוליניום, תירוטוקסיקוזיס במקרים של יתר פעילות בלוטת התריס לאחר חומר ניגוד על בסיס יוד)63,64. שימו לב שבדיקת FSH אינה מומלצת מתחת לגיל 40, מכיוון ש-FSH אינו אינדיקטור רגיש לשינויים ברזרבה השחלתית אצל נשים צעירותבגיל 50,65.
רדיולוג התערבותי מכשיר את המטופלים להליך על סמך היסטוריה רפואית והדמיית תהודה מגנטית (MRI). בעת איסוף ההיסטוריה הרפואית, יש לדון עם המטופל ביתרונות ובסיבוכים האפשריים, כמו גם בהליך עצמו. יש לדון גם בציפיות המטופלים לגבי איחוד האמירויות. MRI נועד לשלול פתולוגיות אחרות של איבר הרבייה והמבנים הסמוכים, כמו גם להעריך את המורפולוגיה והמיקום של שרירנים ואנטומיה לצורך ההיתכנות הטכנית של ההליך 35,36,37,57.
איחוד האמירויות שואפת לחסום לחלוטין את כלי הדם של כל המיומות תוך שמירה על אספקת הדם לרחם, לשחלות ולרקמות הסובבות בתוך האגן. ההיבטים הטכניים של איחוד האמירויות עדיין מתפתחים במידה מסוימת.
אמבוליזציה של עורקי הרחם מבוצעת על ידי רדיולוגים התערבותיים בעלי יכולת מתאימה בתחום התסחיף התוך-וסקולרי. ההליך מתבצע בהנחיית פלואורוסקופיה. זה כרוך בהחדרה מלעורית של קטטר כלי דם מהנקב באזור המפשעתי לעורק הירך, אבי העורקים, עורק הכסל הפנימי, עד לעורק הרחם. לאחר הנחת הצנתר עמוק בעורק הרחם והשגת מיקום יציב, חומר התסחיף המעורבב בניגודיות מוזרק תחת בקרה פלואורוסקופית באופן שימנע ריפלוקס ותסחיף "לא מטרה". מצע כלי הדם של מיומות נסגר באמצעות חלקיקים של 500-900 מיקרומטר בהתאם לסוג חומר התסחיף - הגדלים הרגילים הם 700 מיקרומטר. התסחיף נמשך עד להשגת קיפאון זרימת הדם. בתום ההליך מסירים את הקטטר, ואתר הגישה לכלי הדם מאובטח בלחץ ידני וחבישה או סגירה מכנית. ההליך נמשך כ- 0.5-1.0 שעות. מנת הקרינה המייננת הממוצעת הנספגת בשחלה במהלך UAE נעה בין 0.04-0.22 (Gy: אפור) והמינון האפקטיבי הממוצע המשוער נע בין 22-34 (mSv: millisievert). הזמן הפלואורוסקופי הממוצע הוא כ-22 דקות66,67.
כלי הדם של רוב השרירנים מגיעים מעורקי הרחם. רק כ-5%-10% מהשרירנים מסופקים בנוסף על ידי עורקי השחלות. אנסטומוזה של רחם עורקי מתרחשת בכ-10% מהמקרים, בעוד שרחם-שחלה ב-10%-30%. ניתוק אספקת הדם לרקמות המובלעות גורם לנמק איסכמי, ואחריו ניוון היאלין או נמק קרישה. תהליך זה אורך מספר חודשים 68,69.
היעילות של UAE תלויה בפתרון התסמינים או במידת הפחתתם. לטיפול בדימום וסתי מוגזם, כאבי אגן ותסמיני לחץ, מדד היעילות הקלינית לאיחוד האמירויות הוא 81%-96%, 70%-100% ו-46%-100%, בהתאמה. תוך 3-6 חודשים לאחר ההליך, הירידה שנצפתה בנפח השרירנים הייתה 25%-60%33,70,71,72. הפחתת הקוטר הממוצעת של המיומה הייתה 2.2 ס"מ57.
הירידה בנפח השרירנים לא תמיד קשורה לפתרון או להפחתה של תסמינים קליניים. במעקב ארוך טווח לאחר UAE, יותר מ-70% מהמטופלים דיווחו על פתרון או הפחתה משמעותית של התסמינים הקליניים תוך 5 שנים לאחר ההליך, בעוד ש-16%-23% מהם נזקקו להתערבות חוזרת73,74.
בהערכת ההשפעה המוקדמת של איחוד האמירויות, מחברי פרסום זה מציעים שימוש באולטרסאונד תלת מימדי (תלת מימד), תוך שימוש באנליזה בעזרת מחשב של איברים וירטואליים (VOCAL), תוך ביצוע מדידות של מדדי כלי דם: אינדקס כלי דם (VI), אינדקס זרימה (FI) ומדד זרימת כלי דם (VFI)75.
כאב לאחר אמבוליזציה הוא תופעת לוואי מוקדמת (הנמשכת כ-24 שעות) צפויה של UAE מוצלח (לא להתבלבל עם סיבוך) ויש לטפל בו באופן פעיל. סימפטום קליני זה נגרם על ידי שחרור תוצרי פירוק רקמות של מיומה איסכמית. הטיפול כולל שליטה נאותה בכאב, הידרציה וטיפול אנטיביוטי אפשרי32,43. הרדמה אפידורלית (EA) שנשמרת במשך 24 שעות לאחר ההליך מפחיתה משמעותית את הכאב לרמה מקובלת לחלוטין, אך בעלות גבוהה יותר ובסיכון מוגבר לסיבוכים בהשוואה לשיכוך כאבים בשליטת המטופל (PCA)76.
גישות אחרות זמינות גם בסקירות ניהול כאב לאחר אמבוליזציה. ראוי להזכיר את השימוש בתערובות של תרופות נגד כאבים עם מולקולות אלכוהול פוליוויניל והרדמה אלקטרו-אקופונקטורה במהלך איחוד האמירויות הערביות. שתי השיטות נועדו להגביל את מספר ההליכים המבוצעים באיחוד האמירויות בבית חולים77,78. איננו משתמשים בשיטות אלה במרכזים שלנו ובמרכזים המשתפים פעולה.
הסיבוכים המוקדמים של איחוד האמירויות הם בדרך כלל סיבוכים מקומיים הקשורים להליך האנגיוגרפיה. קבוצה זו של תופעות לוואי נדירה (הן מתרחשות בפחות מ-1% מהמקרים) ומתייחסת בעיקר להמטומה במפשעה, פקקת עורקים, דיסקציה עורקית ופסאודו-מפרצת, תגובות אלרגיות לחומרי ניגוד, עווית בעורק הרחם הנגרמת כתוצאה ממניפולציה של הקטטר בכלי במהלך ההליך (מטופל כאירוע זמני לאחר שחולפות מספר דקות וניתן להמשיך את ההליך). אם העווית נמשכת, ניתן לתת וראפמיל (2.5-5 מ"ג) או ניטראט (100-150 מיקרוגרם) תוך עורקי) ותסחיף "לא מטרה" 32,37,38.
היו גם מספר דיווחים על אמבוליזציה "לא ממוקדת" של איברי אגן אחרים והאיסכמיה שלהם לאחר מכן. סיבוך זה יכול להתרחש כתוצאה מביצוע לקוי של ההליך, כמו גם עקב נוכחותם של אנסטומוזות וגרסאות אנטומיות של כלי הדם באגן. מקרה מיוחד של אמבוליזציה שאינה מטרה הוא נזק לשחלתי הנובע מאנסטומוזות בין כלי הרחם והשחלות בחלק מהמטופלות 79,80.
התוצאה של נמק מיומה היא תסמונת פוסט-אמבוליזציה המתרחשת תוך 30 יום מההליך בכ-10%-15% מהחולים. התסמינים של תסמונת זו, שעלולים להופיע ביחד או בנפרד, כוללים בחילות, הקאות, חולשה, חום נמוך, כאבי בטן תחתונה ורמות לויקוציטים גבוהות. בדרך כלל מדובר בתסמונת מגבילה את עצמה שבדרך כלל נעלמת תוך 10-14 יום. משככי כאבים ותרופות אנטי דלקתיות משמשים לטיפול בסיבוך זה32. חשוב להבדיל בין הסימפטומים של תסמונת פוסט-אמבוליזציה לבין סיבוכים חמורים יותר כמו אלח דם. זה נכון במיוחד במקרים שבהם התסמינים שהוזכרו נמשכים יותר משבועיים 32,37,38.
זיהום הוא הסיבוך החמור ביותר אחרי איחוד האמירויות, והוא מתרחש בכ-0.5% מהמקרים32,38. במקרה של חום גבוה מתמשך (38.5 מעלות צלזיוס ומעלה) במשך 24-48 שעות ובטן קשה וכואבת, יש לחשוד באלח דם. במקרה זה, הטיפול עשוי לדרוש לא רק שימוש בטיפול אנטיביוטי, אלא גם צורך בהסרת הרחם. במקרה האחרון, בפחות מ-1% מהמקרים, הוא עלול להוות איום על חיי המטופל. אלח דם שכיח יותר כאשר UAE מבוצע על רחם גדול (מעל 20 ס"מ או כאשר קוטר מיומה בודדת גדול מ-9 ס"מ, וגם במקרה של קיום משותף של שרירנים תת-ריריים גדולים)37,38.
סיבוך מאוחר לאחר UAE (יותר מ-30 יום לאחר ההליך), המתרחש לאחר אמבוליזציה של שרירנים תת-ריריים, הוא הפרשה של שברים נמקיים מסומנים של שרירנים דרך תעלת צוואר הרחם. זה קורה בכ-10% מהמקרים 32,81,82. כ-16% מהנשים, לאחר איחוד האמירויות הערביות, עשויות לסבול מהפרשות נרתיקיות בשפע במשך מספר שבועות עד חודשים רבים כתוצאה מהפרשת שרירנים נמקיים מהרחם83. לאחר ההליך באיחוד האמירויות נצפה קיצור משמעותי של הווסת וירידה בשכיחותה, מה שנחשב להשפעה מיטיבה של הליך זה. עם זאת, אמנוריאה מלאה מטופלת כהשפעה של אי ספיקת שחלות לאחר אמבוליזציה 50,84.
אמנוריאה לאחר איחוד האמירויות הערביות היא בדרך כלל חולפת ומוגבלת למספר מחזורים. אמנוריאה קבועה מופיעה בכ-15% מהנשים מעל גיל 40 ובכ-1% מהנשים מתחת לגיל זה, וגורמת לתסמינים של גיל המעבר בטרם עת. במחקר שלנו נמצאה ירידה בפוריות אצל נשים צעירות (33-40 שנים) כתוצאה מהקטנת הרזרבה השחלתית65. ההערכה היא שכ-85% מהנשים המדווחות על אמנוריאה לאחר איחוד האמירויות הן מעל גיל45 85. נטען כי הסיבה לעלייה בשכיחות אמנוריאה אצל נשים מבוגרות נובעת מהרזרבה השחלתית המופחתת והרגישות הגדולה יותר של רקמת השחלה לאיסכמיה הנגרמת על ידי אמבוליזציה "לא מטרה"86.
ההליך באיחוד האמירויות משפיע גם על התפקוד המיני של נשים שעוברות את ההליך. שיפור בתפקוד המיני לאחר איחוד האמירויות דווח על ידי 26% מהנשים, הידרדרות נמצאה ב-10%, וללא שינוי ב-64% הנותרים של הנשים. סיבה אפשרית להפרעות בתפקוד המיני היא כלי דם לא תקינים של הדגדגן, צוואר הרחם וקורפוס הרחם כתוצאה מהליך איחוד האמירויות74.
Protocol
המחברים מצהירים כי הפרוטוקול עוקב אחר הנחיות הוועדה האתית המקומית של האוניברסיטה הרפואית של לובלין.
1. זכאות להליך איחוד האמירויות
הערה: זה מופנה לגניקולוגים ולרדיולוגים התערבותיים.
- יידע את המטופל על פרטי ההליך באיחוד האמירויות הערביות.
- דונו באינדיקציות והתוויות נגד לנוהל איחוד האמירויות.
- שוחח עם המטופלת על הנחות היסוד של UAE ושיטות אלטרנטיביות (המתוארות במבוא) בטיפול בשרירנים ברחם.
- אזהרה! הודע למטופל כי איחוד האמירויות אינו הליך רדיקלי (המיומה לא תוסר).
- אזהרה! הודע למטופלת שהיא לא תקבל דוח היסטופתולוגיה של שרירנים ברחם לאחר איחוד האמירויות.
- אזהרה! ליידע את המטופלת כי 1-3 מקרים מתוך 1,000 גידולי רחם יכולים להיות ממאירים (LMS). שוחח עם המטופלת על כך שביופסיית רירית הרחם וה-MRI שבוצעו במהלך ההסמכה של איחוד האמירויות רגישות מאוד באבחנה של ליומיוסרקומה, אך לא ב-100%. ליידע את המטופל כי ביצוע UAE לליומיוסרקומה עלול לעכב את האבחון והטיפול הנכון. רשום עובדה זו ברשומה הרפואית.
- אם המטופל רוצה ביודעין לבצע את איחוד האמירויות הערביות, המשך בפרוטוקול זה.
- הודע למטופל כי ההסמכה מתבצעת בשני שלבים. הסמכה על ידי רופא נשים כוללת ניתוח של אינדיקציות והתוויות נגד, בעוד רדיולוג התערבותי מעריך את היכולות הטכניות של איחוד האמירויות הערביות.
- תכננו או בצעו ייעוץ גינקולוגי ותכננו התייעצות עם הרדיולוג ההתערבותי לפני איחוד האמירויות.
- במידת האפשר, בצע כמה שיותר מהליכי ההסמכה במרפאת החוץ.
- ודא שלמטופל יש אינדיקציות לאיחוד האמירויות הערביות: שרירנים ברחם סימפטומטיים (מנומטרורגיה, מטרורגיה, דיסמנוריאה, דיספרוניה, כאבי אגן כרוניים); סירוב לטיפול כירורגי; אין הסכמה לעירוי דם; ניתוח שרירנים ברחם שנכשל בעבר. ציין אותם בהיסטוריה הרפואית.
- שאל את המטופל על התסמינים של שרירן/ים.
- דונו ביעילות של איחוד האמירויות הערביות ובציפיות המטופל ( בתוצאות המייצגות).
- שאל אם המטופלת טופלה בעבר בשרירנים ברחם. ודא באיזו שיטה השתמשת.
- אם המטופל מסרב לטיפול כירורגי או עירוי דם, גבה הצהרה בכתב.
- לוודא שלמטופל המתאים להליך באיחוד האמירויות אין התוויות נגד מוחלטות: שרירנים אסימפטומטיים; הריון בר-קיימא; זיהום באברי המין הנוכחי או האחרון; ספקות אבחנתיים עקב גורמים קליניים או הדמיה לא מספקת; התוויות נגד לשימוש בחומרי ניגוד רדיולוגיים; תכונות של ליומיוסרקומה ב- MRI; גידול ממאיר ברחם או בשחלות אלא אם כן הוא מבוצע לצורך שיכוך או כתוספת לניתוח87. ציין אותם בהיסטוריה הרפואית.
- אם המטופל דורש איחוד האמירויות למרות שרירנים אסימפטומטיים, הסבירו שמקרים כאלה אינם מתאימים להליך. הסבירו למטופלת ששרירנים אסימפטומטיים דורשים רק ניטור גינקולוגי קבוע.
- אם יש התוויות נגד יחסית ל-UAE (שרירנים גדולים ותוכניות רבייה), שוחחו עליהן עם המטופל ורשמו עובדה זו ברשומה הרפואית.
- התמקדו בסיבוכים האפשריים הקשורים להתווית נגד יחסית, המתוארים בהקדמה, וודאו שהמטופל מבין ומסכים להליך.
- שוחח עם המטופלת על תופעת הלוואי והסיבוכים של תסחיף עורק הרחם (ראה מבוא) ורשום עובדה זו ברשומה הרפואית.
- כאשר מדברים עם המטופל, שימו לב במיוחד לכאב שלאחר התסחיף.
- שוחחו על טיפולי כאב לאחר אמבוליזציה.
- לבצע הסמכה גינקולוגית.
- לאסוף היסטוריה רפואית ולבצע בדיקה גינקולוגית.
- בצע הערכת אולטרסאונד של איברי הרבייה כדי להעריך את גודל וסוג השרירנים (סיווג FIGO)88.
- השתמש בבדיקה נרתיקית כדי להעריך את הגודל והמיקום של המיומה (איור 2). שרירני הרחם המטופלים באיחוד האמירויות צריכים להיות 2-5 (באופן אידיאלי, 3-4) על פי סיווג FIGO, והקוטר לא יעלה על 10 ס"מ.
- כלול את הפרוטוקול של סריקת אולטרסאונד האגן ברשומה הרפואית.
- ודא שתוצאת סריקת האולטרסאונד נותנת אינדיקציות להסמכה להליך איחוד האמירויות.
- לא לכלול תהליכים ממאירים בתוך האגן.
- ודא שלמטופלת יש תוצאות עדכניות (רצוי מבוצעות תוך 6 חודשים) של מריחת צוואר הרחם (PAP) וביופסיית רירית הרחם.
- במהלך אולטרסאונד אגן, השתמש בבדיקה הנרתיקית כדי להעריך את השחלות ולאשר שהמבנה שלהן נכון. אם יש ספק, בדוק את סריקת האולטרסאונד הקודמת או בצע את בדיקת ROMA.
- הזמינו MRI כדי להעריך את הגידול ברחם עבור תכונות LMS ויכולות טכניות של איחוד האמירויות.
- שימו לב לתוצאות בדיקת צוואר הרחם (PAP), ביופסיית רירית הרחם, סריקת האולטרסאונד (אולי בדיקת ROMA) וה-MRI ברשומה הרפואית.
- אם התוצאות אינן נכונות, פסלו את המטופל מההליך.
- ליידע את המטופלים על תוצאות ההסמכה הגינקולוגית.
- רשום עובדה זו ברשומה הרפואית. הפנה את המטופל לבית החולים.
- קבעו תור להליך באיחוד האמירויות הערביות וזכרו שהמטופל צריך להיות לפני היום העשירי של המחזור.
- שאל את המטופלת אם היא מסרבת לניתוח. במקרה של סירוב יש לציין עובדה זו בהסכמה מדעת של המטופל או ברשומה הרפואית.
- חולים עם שרירנים סימפטומטיים המסרבים לניתוח זכאים לאיחוד האמירויות הערביות.
- בצע את הבדיקות הבאות לפחות 7 ימים לפני איחוד האמירויות הערביות כדי להעריך ולהימנע מסיבוכים פוטנציאליים: בדיקה מיקרוביולוגית של מריחת הנרתיק (תרבית נרתיקית אירובית); בדיקת שתן; בדיקות דם נבחרות: CBC, בדיקות קרישה (INR, APPT), פאנל כליות (קריאטין, אוריאה), TSH, CRP.
- תאר את התוצאות ברשומה הרפואית.
- הודע למטופלת שתוצאות שגויות פוסלות אותה להליך.
- בדוק את הרזרבה השחלתית של המטופלת על ידי בדיקת רמות AMH (מומלץ) או FSH (לא מומלץ מתחת לגיל 40) בשלב הזקיקים. שוחח עם המטופלת שהבדיקה לעיל תעזור להעריך נזק לשחלות כתוצאה מתסחיף שאינו מטרה. רשום עובדה זו ברשומה הרפואית.
- מטופלות הזכאיות לאיחוד האמירויות הערביות לא צריכות להצהיר על רצונם להיכנס להריון בשל הסיכון המוגבר לסיבוכי הריון 14,32,38,50,51,52,89,90,91.
- יידע את המטופל על הסיכון המוגבר לסיבוכי הריון לאחר איחוד האמירויות הערביות.
- יש לציין כי המטופלת אינה מצהירה על רצונה להיכנס להריון בהסכמה מדעת של המטופלת או ברשומה הרפואית.
- אם המטופלת עדיין לא שוללת הריון בעתיד, אך זקוקה לאיחוד האמירויות הערביות, קחו הצהרה בכתב שהיא קיבלה הודעה על סיבוכי הריון אפשריים לאחר איחוד האמירויות.
- בצע הסמכה רדיולוגית.
- ודא שבוצע MRI אגן. בדיקת MRI מאפשרת לשלול פתולוגיות אחרות של איבר הרבייה והמבנים הסמוכים לו (שלב 1.6.3.3. של הליך ההסמכה לאיחוד האמירויות), להעריך את המורפולוגיה והמיקום של שרירנים, ואנטומיה להיתכנות הטכנית של אמבוליזציה (איור 3, איור 4). אם לא, יש לתאם בדיקת MRI והתייעצות עם רדיולוג התערבותי.
- לנתח את בדיקות ההדמיה ולהעריך את סוג וגודל השרירנים.
- אם נמצאו שרירנים תת-ריריים (FIGO 0-1), יידע את המטופלת על הסיכון לגלישה לחלל הרחם. הפרשה מלאה עלולה לגרום לאלח דם, בעוד שהפרשה בשברים היא בדרך כלל א-סימפטומטית50.
- אם נמצאו שרירנים תת-סרוזליים צרים, פדונקולטים (FIGO 7), הודע למטופל על הסיכון לניתוק לאחר תסחיף של השרירן לחלל הבטן. זה יכול להוביל לדלקת חריפה, וייתכן שיהיה צורך בניתוח לפרוסקופיחוזר 92.
- אם נמצאו שרירנים גדולים, הודע למטופל כי הסיכון לסיבוכים נותר ללא שינוי, אך תוצאת ההליך טובה יותר עבור שרירנים קטנים93.
- ציין עובדה זו בהסכמה מדעת של המטופל או הרשומה הרפואית.
2. הכנה להליך באיחוד האמירויות
הערה: זה מופנה לגניקולוגים או מנתחי כלי דם ורדיולוגים התערבותיים.
- אשפוז המטופל בבית החולים (מחלקה גינקולוגית או כירורגיית כלי דם).
- ודא שהיא לפני היום העשירי של המחזור בעת הקבלה.
- לבצע או להזמין בדיקה גינקולוגית וסריקת אולטרסאונד של האגן.
- ודא שהאבחון וההסמכה להליך איחוד האמירויות נכונים.
- ודא שלא הופיעו התוויות נגד חדשות מאז ההעפלה לאיחוד האמירויות. אם כן, הצע אפשרויות טיפול אחרות ושנה את תאריך ההליך.
- בצע את סריקת האולטרסאונד הטרנס-ווגינלית התלת-ממדית (TVUS) וחשב את הנפח ומדדי כלי הדם של השרירן (VI, FI ו-VFI) באמצעות בדיקת תוכנת VOCAL (המשמשת להערכת היעילות של הליך איחוד האמירויות72,75) (המתואר בהקדמה) (איור 5 ואיור 6).
- רשום עובדה זו ברשומה הרפואית.
- ודא שהמטופל המתאים לאיחוד האמירויות עבר בדיקות שבוצעו במהלך ההסמכה לאיחוד האמירויות הערביות (המתוארות בשלבים 1.6.2, 1.6.3, 1.6.5 ו-1.6.6 של ההסמכה לאיחוד האמירויות הערביות).
- אם המטופלת הוסמכה מראש על ידי רופא נשים ואין לה בדיקות דם, בדיקת שתן ו-MRI, הזמינו את הבדיקות וקבעו פגישת ייעוץ עם רדיולוג התערבותי (שלב 1.7 של הסמכה לאיחוד האמירויות הערביות).
- דרג או הזמינו את רמת הסרום AMH (מומלץ) או FSH (לא מומלץ מתחת לגיל 40) לפני איחוד האמירויות כדי לאפשר הערכה של נזק לשחלות כתוצאה מאמבוליזציה "לא מטרה".
- הודע למטופל שתוצאות הבדיקה יהיו זמינות תוך כיממה וההליך באיחוד האמירויות יתאפשר רק לאחר קבלת תוצאות אלה.
- הודע למטופלת שתוצאות שגויות פוסלות אותה להליך.
- אזהרה! במקרה של תוצאות חסרות או שגויות של מריחת PAP, ביופסיה של רירית הרחם; הבדיקה המיקרוביולוגית של מריחת הנרתיק, פוסלת את המטופלת מאיחוד האמירויות (זמן רב מדי להשיג תוצאות אלה). העפיל מחדש לאחר השגת התוצאות הנכונות.
- רשום עובדה זו ברשומה הרפואית.
- לקבל הסכמה מדעת לביצוע איחוד האמירויות הערביות.
- ספק למטופל את כל המידע על איחוד האמירויות הערביות.
- דונו בסיבוכים האפשריים של איחוד האמירויות (המתוארים בהקדמה).
- השאירו למטופל זמן לחשוב ולשאול שאלות; לאפשר למטופל לתת הסכמה מדעת לביצוע ההליך באיחוד האמירויות.
- להודיע למטופלת שיש לה את הזכות לשנות את החלטתה עד לתחילת איחוד האמירויות.
- אם המטופלת משנה את החלטתה לגבי UAE, אז הצע אפשרויות טיפול אחרות לשרירנים ברחם (המתואר בהקדמה).
- ציין עובדה זו בהסכמה מדעת של המטופל או הרשומה הרפואית.
- מיד לפני ההליך באיחוד האמירויות, בדוק וודא שהבדיקות המתוארות בסעיפים 1.6.2, 1.6.3, 1.6.5 ו-1.6.6 של הסמכה לאיחוד האמירויות וכן תלת מימד TVUS, MRI והתייעצות עם רדיולוג התערבותי בוצעו, והתוצאות נכונות.
- פסילת מטופל מאיחוד האמירויות הערביות אם הבדיקות חסרות או שהתוצאות שגויות.
- רשום עובדה זו ברשומה הרפואית.
- ליידע את המטופל ולדאוג לאיסור נטילת מזון ונוזלים מהבוקר ועד ההליך. היוצא מן הכלל הוא כמות קטנה של נוזלים הדרושה כדי ליטול את מנת הבוקר של התרופות.
- ודא בבוקר (לפני איחוד האמירויות) שהמטופל צם.
- ודא שהמטופל נטל את התרופות למחלות כרוניות משלו.
- רשום עובדה זו ברשומה הרפואית.
- הזמינו למטופל את התרופות הבאות: טבליה אחת של נוגדי חרדה (למשל, אסטזולם) דרך הפה, מנה אחת של אנטיביוטיקה תוך ורידית, כדורית אחת של מטרונידזול תוך נרתיקי, נר פי הטבעת דיקלופנק 100 מ"ג.
- תן את התרופות הנ"ל כ-30-40 דקות לפני UAE.
- רשום עובדה זו ברשומה הרפואית.
- הכן את שדה הניתוח על ידי הקפדה על גילוח בית השחי השמאלי והמפשעה הימנית.
- אם אזורי העור הנ"ל אינם מגולחים, גלח אותם בעדינות.
- רשום עובדה זו ברשומה הרפואית.
- ודא שלמטופל אין התקן תוך רחמי (IUD).
- אם למטופלת יש התקן תוך רחמי ברחם, הודע לה על הסיכון המוגבר לזיהום בחלל הרחם והצע להסיר אותו לפני איחוד האמירויות.
- אם המטופלת אינה מסכימה להוציא את ההתקן התוך רחמי, יש לציין זאת בהסכמה מדעת של המטופלת או ברשומה הרפואית.
- ודא שהמטופל מדווח על כל תגובה אלרגית לתרופות, חומרי ניגוד וחומרי חיטוי ורשום עובדה ותוצאות אלה ברשומה הרפואית.
3. ביצוע ההליך באיחוד האמירויות
הערה: זה מופנה לרדיולוגים התערבותיים ומרדימים.
- בצע את ההליך בתנאים סטריליים.
- הניחו את המטופל על שולחן הניתוחים וחטאו את אזור המפשעה הנכון באופן נרחב באמצעות חומר חיטוי לבית חולים (באישור מתאים).
- הדביקו את וילון הניתוח סביב מקום הניתוח (מפשעה ימין).
- בחר את סוג ההרדמה: הרדמה מקומית או אפידורלית (EA) ורשום את בחירת המטופל ברשומה הרפואית.
- איחוד האמירויות בהרדמה מקומית.
- הרדמה (מתן תת עורי) תמיסת ליגנוקאין 2% במקום הניתוח.
- יש לתת 5 מ"ג מורפיום תוך ורידי לפי הצורך.
- לפני תחילת ההליך באיחוד האמירויות, ודא שההרדמה המקומית פועלת.
- איחוד האמירויות הערביות תחת EA
- הכן את המטופל כראוי ל-EA.
- בצע את ה-EA לפני הדבקת הווילון הכירורגי.
- ודא שלמטופל המוסמך להליך EA אין את התוויות נגד הבאות: סירוב להליך, קרישת דם, טרומבוציטופניה, מחלה המוליטית, נטילת נוגדי קרישה, הלם, זיהום באתר הזרקת אפידורל, בקטרמיה, אלרגיה להרדמה מקומית, עיוותים אנטומיים של עמוד השדרה, לחץ תוך גולגולתי מוגבר, מחלה נוירולוגית, היצרות אבי העורקים או המיטרליחמורה 94. רשום עובדה זו ברשומה הרפואית.
- התקשר לרופא מרדים ובקש EA.
- הניחו קטטר דק לחלל האפידורלי באזור המותני ותנו חומר הרדמה (הליך המיועד לרופאים מרדימים).
- לפני שתתחיל בהליך איחוד האמירויות, ודא שה-EA פועל.
- נוהל איחוד האמירויות
- בצע את הליך איחוד האמירויות בחליפת אנגיו בהנחיית פלואורוסקופיה.
- קבל גישה למערכת כלי הדם באמצעות טכניקת סלדינגר95,96 (איור 7, איור 8 ואיור 9).
- הכנס קטטר צמה לאבי העורקים הבטני ממש מתחת לעורקי הכליה.
- בצע אנגיוגרפיה כדי לדמיין את הכלים.
- בצע אורטונפרוגרפיה כדי להעריך את האנטומיה של כלי הדם המספקים את השרירנים ולתכנן את ההליך (איור 10).
- בצע אנגיוגרפיה של עורק הכסל הפנימי בהקרנה קדמית-אחורית ואלכסונית כדי לחשוף את אוסטיום עורק הרחם.
- התחל מהצד השמאלי, ואז הימני, בגלל אתר הפנצ'ר והצורה הספציפית של הצנתר. בהתאם לקליבר של כלי הדם, הצנתר הראשי או המיקרו-קטטר מוכנס באופן סלקטיבי לעורק הרחם (איור 11).
- הנח את הקטטר עמוק בעורק הרחם. תסחיף את הכלי בחלקיקי הידרוג'ל. בשל נוכחותה של אנסטומוזיס רחם-שחלה, שגודלה מוערך בכ-500 מיקרומטר, הגודל המוצע של החלקיקים לאמבוליזציה הוא 700 מיקרומטר כדי להפחית את הסיכון ל"אמבוליזציה שאינה מטרה".
- המשך באמבוליזציה עד שזרימת הדם בכלי נחסמת לחלוטין. נקודת הסיום של הטיפול היא קיפאון ניגודיות בכלי הדם, מה שמוכיח את סגירתו היעילה.
- בצע את האמבוליזציה של עורק הרחם בצד הנגדי באותה גישה. הטיפול נמשך כ-0.5 עד 1.0 שעות66.67 (איור 12).
- להעריך את יעילות התסחיף מצנתר המונח בעורק הכסל הפנימי במהלך אנגיוגרפיית בקרה. היעדר זרימה פעילה של דם מוצל (לעורקי הרחם) מעיד על כך שההליך נחשב לנכון מבחינה טכנית (איור 13).
- הסר בזהירות את הקטטר.
- סגור את אתר הניקוב באמצעות דחיסה ידנית עם חבישת לחץ, אותה יש לשמור במשך 6 השעות הבאות או מכשיר הסגירה (איור 14).
- תאר את מהלך איחוד האמירויות ברשומה הרפואית.
4. טיפול בחולים לאחר ההליך באיחוד האמירויות הערביות
הערה: זה מופנה לגניקולוגים או מנתחי כלי דם ומרדימים.
- התחל טיפול במשככי כאבים: משאבת שיכוך כאבים מבוקרת (PCA) או EA.
- ליידע ולדון עם המטופל באפשרויות הטיפול במשכך כאבים.
- יידע את המטופל כי EA מספק שליטה טובה יותר בכאב ושיקום מהיר יותר, בהשוואה למשאבת PCA76.
- ציין עובדה זו ובחירת המטופל ברשומה הרפואית.
- טיפול משכך כאבים בכאבים לאחר תסחיף באמצעות משאבת PCA.
- הכן את המזרק למשאבת ה- PCA עם תמיסת המורפיום.
- מלאו את מזרק ה-50 מ"ל למשאבת ה-PCA ב-50 מ"ג מורפיום ותמיסה של 0.9% NaCl (ריכוז 1 מ"ג/מ"ל).
- הכן את משאבת ה-PCA לשימוש תוך ורידי.
- חבר את הניקוז למזרק.
- הכנס את ניקור הוורידים באמצעות צינורית.
- הכנס את המזרק למשאבת ה-PCA.
- מלא את הניקוז, הפעל את משאבת ה-PCA.
- הפעל את כפתור START.
- נעל את משאבת ה-PCA.
- הגדר את פרמטרי משאבת ה-PCA (המפורטים להלן) (איור 15).
אזהרה! מינונים גבוהים יותר של מורפיום עלולים לגרום לדיכוי נשימתי.- יש להשתמש בריכוז מורפיום של 1 מ"ג/מ"ל. השתמש במינון של עירוי מורפיום לפי דרישה (בולוס תוך ורידי) (בולוס p.) של 0.5 מ"ג עם מרווח זמן שלאחריו ניתן לספק את העירוי הבא לפי דרישה (מרווח נעילה/[Karencja]) של 5 דקות (כדי למנוע דיכוי נשימתי). השתמש בזמן של הזרקת מורפיום תוך ורידית במהלך עירוי לפי דרישה של 10 שניות.
- ודא שכל השלבים לעיל בוצעו.
- הזמינו מורפיום במשאבת PCA עד 24 שעות.
- עקוב אחר כאב לפי סולם הדירוג המספרי (NRS). שים לב לערך NRS ברשומה הרפואית.
- השתמש בכרטיס הערכת הכאב (PAC).
- הודע למטופלת שכאשר מופיעים תסמיני הכאב, עליה ללחוץ בעצמה על "מקל הג'וי" ובכך להשיג את התרופה לפי דרישה.
- ודא שהמטופל מבין את ההוראות.
- שימו לב לכמות "הבולוס התוך-ורידי" לפי דרישה ל"בולוס ריק" (המופעל במהלך מרווח נעילה - סעיף 4.2.3 לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות) (איור 16).
- אם היחס בין "בולוס ריק" ל"בולוס תוך ורידי" לפי דרישה מגיע לערך גבוה מ-2/1 (67% / 33%), השתמש בהליך שלהלן (איור 17, איור 18).
- כדי לשפר את יעילות הטיפול בשיכוך כאבים באמצעות משאבת PCA, ולהפחית את הסיכון לתופעות לוואי של מורפיום, שקול להשתמש באקמול או בתרופות נוגדות דלקת לא סטרואידיות בזריקות תוך ורידיות ובמינונים סטנדרטיים.
- לטפל במצבים בהם המטופל צריך לעזוב את המיטה.
- אל תכבה את המשאבה.
- נתק את הניקוז ואבטח אותו בעזרת פקק.
- כאשר המטופל חוזר, חבר מחדש את הניקוז.
- הכן את המזרק למשאבת ה- PCA עם תמיסת המורפיום.
- טיפול משכך כאבים בכאבים לאחר אמבוליזציה באמצעות EA.
- המשך EA אם הוא שימש להליך איחוד האמירויות הערביות.
- אם נעשה שימוש בהרדמה מקומית להליך באיחוד האמירויות והמטופל מזמין EA, לפני הכנסת קטטר אפידורלי, ודא שבדיקות CBC וקרישה נכונות.
- ודא שלמטופל המוסמך להליך EA אין את הסתירות המתוארות בסעיף 3.4.3 של ביצוע הליך איחוד האמירויות הערביות. רשום עובדה זו ברשומה הרפואית.
- התקשר לרופא מרדים ובקש EA.
- ודא שה- EA פועל.
- קבע את מצב העבודה של EA (בולוס או רציף) עם הרופא המרדים. רשום עובדה זו ברשומה הרפואית.
- במצב רציף (CEA), התייעץ עם רופא מרדים ובדוק את הגדרות משאבת העירוי.
- במצב בולוס (BEA), שוחח עם הרופא המרדים על מרווחי הזמן בין מתן חומר ההרדמה המקומי.
- שמור על הצנתר למשך 24-48 שעות, בהתאם לצרכים.
- עקוב אחר הכאב באמצעות סולם NRS. שים לב לערך NRS ברשומה הרפואית.
- השתמש ב-PAC.
- יש להמשיך ב-CEA/BEA עד לצורך, לא יותר מ-48 שעות.
- יש להמשיך בטיפול במשככי כאבים לאחר PCA או EA במידת הצורך.
- הזמינו אקמול 3 x 1.0 גרם תוך ורידי.
- הזמינו דיקלופנק 2 x 50 מ"ג נר פי הטבעת.
- אם הטיפול במשכך כאבים הנ"ל אינו מספיק, כלול משככי כאבים תומכים.
- הזמינו קטופרופן 2 x 100 מ"ג דרך הווריד.
- טפל בתסמינים בדרכי השתן על ידי הזמנת Furazidin 3 x 100 מ"ג דרך הפה.
5. ביקור ביקורת לאחר הליך איחוד האמירויות
הערה: זה מופנה לגניקולוגים.
- בצע את בדיקת הבקרה הראשונה ביום הראשון לאחר איחוד האמירויות.
- העריכו את מצבו הכללי של המטופל.
- מדוד את טמפרטורת הגוף של המטופל.
- דרג את הכאב לאחר איחוד האמירויות הערביות לפי סולם NRS. השתמש ב-PAC.
- העריכו את הפצע שבו הוכנס קטטר כלי הדם.
- בצע בדיקות CBC וקרישה.
- בצע TVUS כדי להעריך את מצב איברי האגן לאחר איחוד האמירויות הערביות.
- בצע TVUS תלת מימדי באמצעות בדיקת נפח כדי להעריך את מדדי הנפח וכלי הדם של השרירן (VI, FI ו-VFI).
- אם אין סיבוכים, והכאב שלאחר התסחיף נשלט על ידי משככי כאבים דרך הפה, שחרר את המטופל הביתה.
- הודע למטופל שאם מתרחשים חום, כאבי בטן והפרשות מוגלתיות לאחר האשפוז, על המטופל לפנות מיד לטיפול רפואי.
- בצעו את ביקור הבקרה הבא 3 חודשים לאחר איחוד האמירויות הערביות.
- בצע בדיקה גינקולוגית, בדיקת CBC ורמת סרום AMH או FSH.
- בצע MRI או TVUS כדי להעריך את מצב איברי האגן לאחר UAE (איור 19).
- בצע TVUS תלת מימדי באמצעות בדיקת נפח כדי להעריך את מדדי הנפח וכלי הדם של השרירן (VI, FI ו-VFI).
- בצע את ביקור הבקרה האחרון 6 חודשים לאחר איחוד האמירויות.
- בצע בדיקה גינקולוגית, בדיקת CBC ורמת סרום AMH או FSH.
- בצע TVUS כדי להעריך את מצב איברי האגן לאחר איחוד האמירויות הערביות.
- בצע TVUS תלת מימדי באמצעות בדיקת נפח כדי להעריך את מדדי הנפח וכלי הדם של השרירן (VI, FI ו-VFI).
- העריכו את האפקטיביות של איחוד האמירויות הערביות.
- השווה את תוצאות בדיקת CBC לפני ואחרי איחוד האמירויות הערביות.
- השווה את הנפחים ומדדי כלי הדם של השרירנים (VI, FI ו-VFI) לפני ואחרי איחוד האמירויות הערביות.
- השוו את רמות ה-AMH או ה-FSH בסרום לפני ואחרי איחוד האמירויות הערביות כדי להעריך את האפשרות של נזק יאטרוגני לשחלות במהלך איחוד האמירויות כתוצאה מתסחיף "לא מטרה".
- הודע למטופלת כי לאחר אמבוליזציה של עורק הרחם, עליה לעבור בדיקות גינקולוגיות קבועות.
- במקרים נבחרים (ללא הפחתה בתסמיני השרירנים, חשד לתיחום רקמות, או ספק בבדיקות נוספות אחרות), בצע MRI שנה לאחר איחוד האמירויות (איור 20).
תוצאות
557 הליכים באיחוד האמירויות בוצעו בתקופה שבין 2009 ל-2019. ממוצע גיל החולים היה 38 שנים (גיל 31-53 שנים). הצלחה טכנית הושגה ב-547 חולים (98.2%).
ההפחתה הממוצעת של נפח השרירנים (הערכת נפח MRI) 3 חודשים לאחר הליך איחוד האמירויות שבוצע בתקופה שבין 2009 ל-2013 בקבוצה של 206 חולים בגילאי 32 עד 52 שנים (גיל ממוצע: 39 שנים) הייתה 62%. הירידה הקטנה ביותר הייתה 9% (מטופל עם שרירנים היאליניים). הפחתה מלאה (100%) הושגה בחולים עם שרירנים תת-ריריים מופרדים (FIGO 0). 90% מהמטופלים דיווחו על שביעות רצון לאחר ההליך באיחוד האמירויות64.
ההפחתה הממוצעת של נפח השרירנים 3 חודשים לאחר UAE (הערכת נפח אולטרסאונד VOCAL) בקבוצה של 65 חולים בגילאי 29-52 שנים (גיל ממוצע: 43.1 שנים) הייתה 50.1% (2.7%-93.5%). לפני ההליך באיחוד האמירויות, נפח השרירנים החציוני היה 101ס" מ 3 (טווח שבין 23.6 ל-610.0 ס"ממעוקב), בעוד שלאחר 3 חודשים, נצפתה ירידה בנפח השרירנים החציוני ל-50.4 ס"ממעוקב (טווח שבין 6.9 ל-193.9 ס"ממעוקב). מבחן המתאם של ספירמן הראה מתאם חיובי מובהק סטטיסטית, אך חלש יחסית (R = 0.33; p = 0.006) בין נפח השרירנים הדומיננטי הראשוני לבין אחוז הפחתת הנפח. מעניין ששרירנים קטנים יותר הראו שונות גדולה של הפחתת נפח השרירנים לאחר 3 חודשים לאחר UAE, בעוד ששרירנים גדולים יותר הראו תגובה יציבה וצפויה ל-UAE72.
נצפתה ירידה במדדי כלי דם דופלרים (VI, FI ו-VFI) בקבוצה של 17 חולים 3 חודשים לאחר איחוד האמירויות הערביות. אחוז הירידה ב-VI וב-VFI היה 95.4%, בעוד שב-FI הירידה הייתה 58.3%75.
הערכת הרזרבה השחלתית בוצעה ב-30 מטופלות בגילאי 33-40 שנים (גיל ממוצע: 35 שנים) 3 חודשים לאחר איחוד האמירויות הערביות. נפח השרירנים הדומיננטי הממוצע היה 107.75ס" מ 3 (נע בין 87.4 ל-131.1 ס"מ3). הסמנים הבאים של הרזרבה השחלתית נחקרו: ספירת זקיקים אנטרלית (AFC), AMH, אינהיבין B (INHB), FSH ואסטרדיול (E2). נצפתה ירידה משמעותית ב-AFC (56.7%; p < 0.001), AHM (36.7%; p < 0.001), INHB (46.7%; p < 0.001) ו-E2 (43.3%; p < 0.001). במקביל, נצפתה עלייה משמעותית ברמת ה-FSH בסרום (43.4%; p <-0.001)65.
שלושה חודשים לאחר ההליך באיחוד האמירויות הערביות, בשתי חולות עם שרירנים תת-ריריים (FIGO 0) (בקוטר של 6 ס"מ ו-8 ס"מ) נצפתה היפוך רחם במהלך הפרשה של שברים נמקיים מסומנים של שרירנים דרך תעלת צוואר הרחם, מה שהביא לכריתת רחם דחופה.
הפחתת כאב לאחר אמבוליזציה (על פי PAC) באמצעות PCA (הליך 4.2 של הטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות) הוערכה ב-60 מטופלים בסולם NRS ביום שלאחר ההליך באיחוד האמירויות. ה-NRS החציוני מיד לאחר איחוד האמירויות היה 10 (טווח 5-10), בעוד שלאחר הטיפול ה-NRS החציוני דורג 4 (טווח 1-5). מבחן המתאם של ספירמן בין הנפח ההתחלתי של השרירנים (חציון 194.5 ס"מ3, טווח 79-411 ס"מ3) לבין NRS מיד לאחר איחוד האמירויות הראה מתאם חיובי חזק ומובהק סטטיסטית (R = 0.6; p < 0.001), בעוד שהמתאם בין הנפח ההתחלתי של שרירנים ל-NRS לאחר הטיפול הראה מתאם חיובי חלש ומובהק סטטיסטית (R = 0.34; p < 0.001). מניתוח הקשרים לעיל, ניתן להסיק כי שרירנים גדולים לאחר איחוד האמירויות גורמים לכאבים חזקים יותר לאחר התסחיף לאחר איחוד האמירויות. עם זאת, הטיפול בכאבים לאחר תסחיף לאחר איחוד האמירויות של שרירנים קטנים יותר עם שימוש ב-PCA נותן תוצאות טובות יותר.
נתונים מסוכמים עבור תוצאות מייצגות מסופקים בטבלה 1.

איור 1: סיווג שרירנים ברחם FIGO. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: בדיקת אגן באמצעות סריקת אולטרסאונד טרנס-ווגינלית.
נראה שרירן רחמי (FIGO 5) במידות של 73 x 50 x 55 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: בדיקת MRI אגן בהסמכה מוקדמת לאיחוד האמירויות הערביות.
נראה בחלק הסגיטלי שרירן רחמי גדול (FIGO 2-5) עם אפקט מסה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
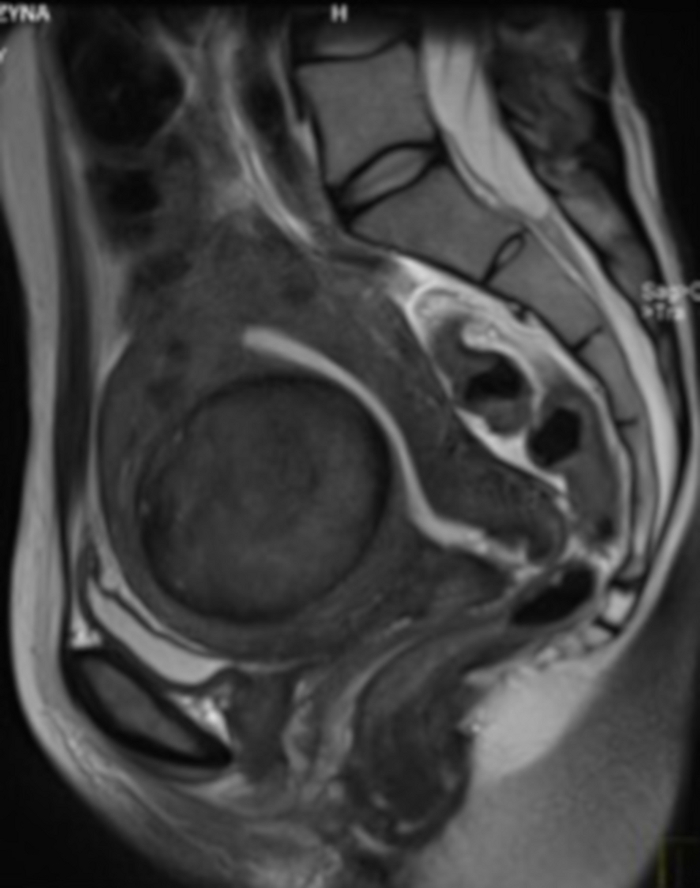
איור 4: בדיקת MRI אגן בהסמכה מוקדמת לאיחוד האמירויות הערביות.
נראה בחתך הסגיטלי שרירן רחמי (FIGO 2-5). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
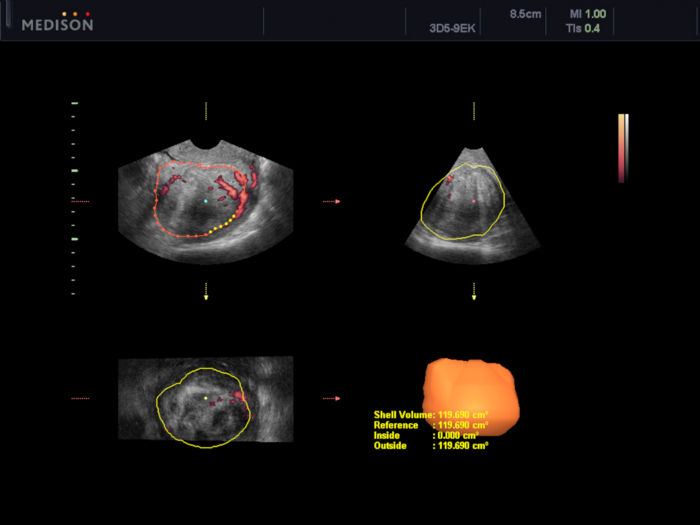
איור 5: הערכת נפח השרירנים ברחם באמצעות תוכנת VOCAL.
במקרה זה, הנפח מוערך ב-119.7 ס"מ3. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: הערכת כלי הדם של שרירנים ברחם באמצעות תוכנת VOCAL.
במקרה זה, מדדי כלי הדם חושבו (VI 4.85, FI 25.38 ו-VFI 1.23). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 7: התמונה מציגה שבר של המעבדה האנגיוגרפית.
בפינה השמאלית התחתונה, המטופל עם מפשעה חשופה שדרכה מוכנסים כלים נוספים. בפינה השמאלית העליונה ניתן לראות את זרוע ה-C של האנגיוגרף. בפינה השמאלית העליונה, הצגים גלויים, שם המפעיל עוקב אחר כלי הקלט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 8: סט לניקור עורקים.
מלמטה: מחט, מנעול כלי דם עם מבוא ומדריך. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
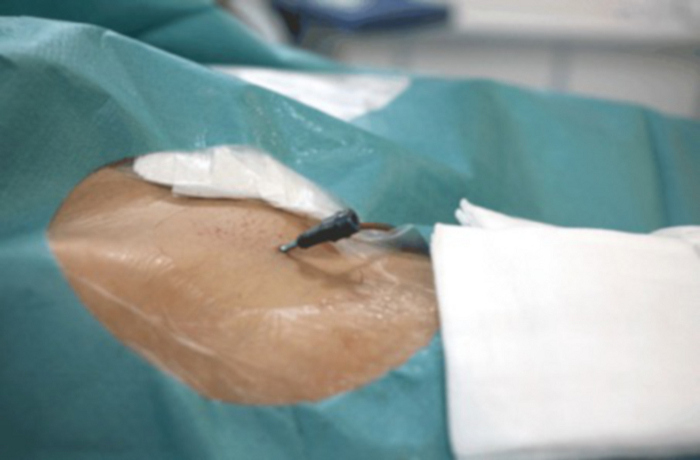
איור 9: תקריב של המפשעה עם נעילת כלי דם גלויה המוחדרת לעורק הירך. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 10: משמאל, אנגיוגרפיה מצנתר הממוקם באבי העורקים הבטני.
הנושא הגלוי של כלי הדם של מיומות ברחם. להשוואה (מימין), בדיקת בקרה שבוצעה לאחר איחוד האמירויות הערביות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 11: אנגיוגרפיה סלקטיבית באמצעות קטטר RUC הממוקם בחלקים הפרוקסימליים של עורקי הרחם.
מצע כלי דם גלוי של שרירנים ברחם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
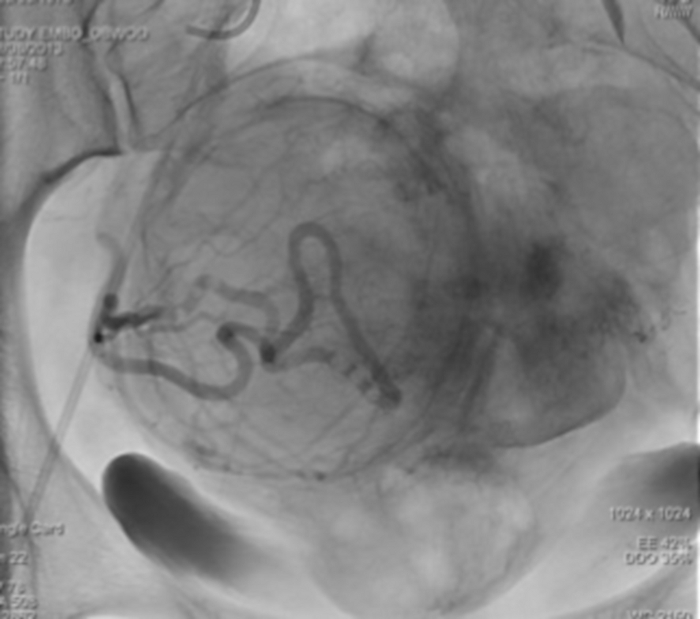
איור 12: הדמיית רנטגן בודדת המראה את הקיפאון של חומר הניגוד בעורק הרחם הימני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
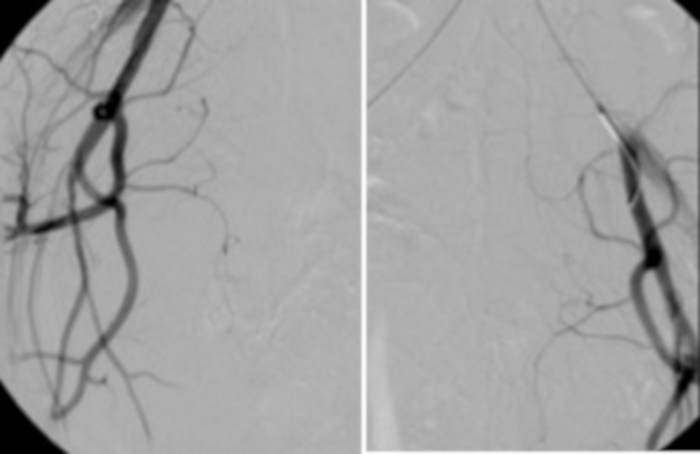
איור 13: אנגיוגרפיה מבוקרת המבוצעת מהצנתר הראשי הממוקם, בהתאמה, בעורק הכסל השמאלי והימני, מאשרת את היעדר זרימת דם טרי (הצללה) לעורקי הרחם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
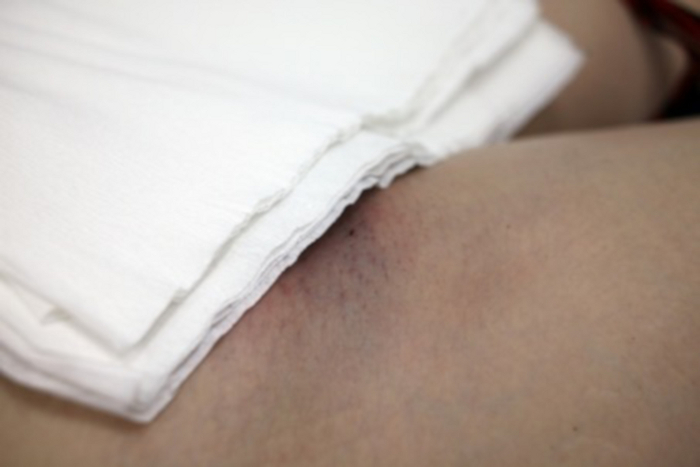
איור 14: אתר הגישה לכלי הדם לאחר השלמת איחוד האמירויות הערביות.
חתך גלוי של 2 מ"מ ליד המפשעה הימנית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 15: הגדרות פרמטר משאבת PCA לכאב לאחר אמבוליזציה לאחר טיפול באיחוד האמירויות הערביות (סעיף 4.2.3 לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 16: משאבת PCA בפעולה.
היחס בין בולוס תוך-ורידי לפי דרישה ל"בולוס ריק" (סעיף 4.2.6.2. לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות) 1:1 (50%:50%). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 17: משאבת PCA בפעולה.
היחס בין בולוס תוך-ורידי לפי דרישה ל"בולוס ריק" (סעיף 4.2.6.3. לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות) 1:2 (33%:67%). זה דורש טיפול משכך כאבים נוסף (נוהל 4.2.6.4. של הטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 18: משאבת PCA בפעולה.
היחס בין בולוס תוך ורידי לפי דרישה ל"בולוס ריק" (סעיף 4.2.6.3. לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות) 1:3 (25%:75%). זה דורש המשך טיפול משכך כאבים נוסף (נוהל 4.2.6.4. של הטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 19: בדיקת MRI אגן 3 חודשים לאחר ההליך באיחוד האמירויות (אותו מקרה כמו באיור 3).
בחלק הסגיטלי נראה שרירן רחמי (FIGO 5), קטן משמעותית מאשר לפני ההליך, צפיפות שונה של רקמת השרירן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
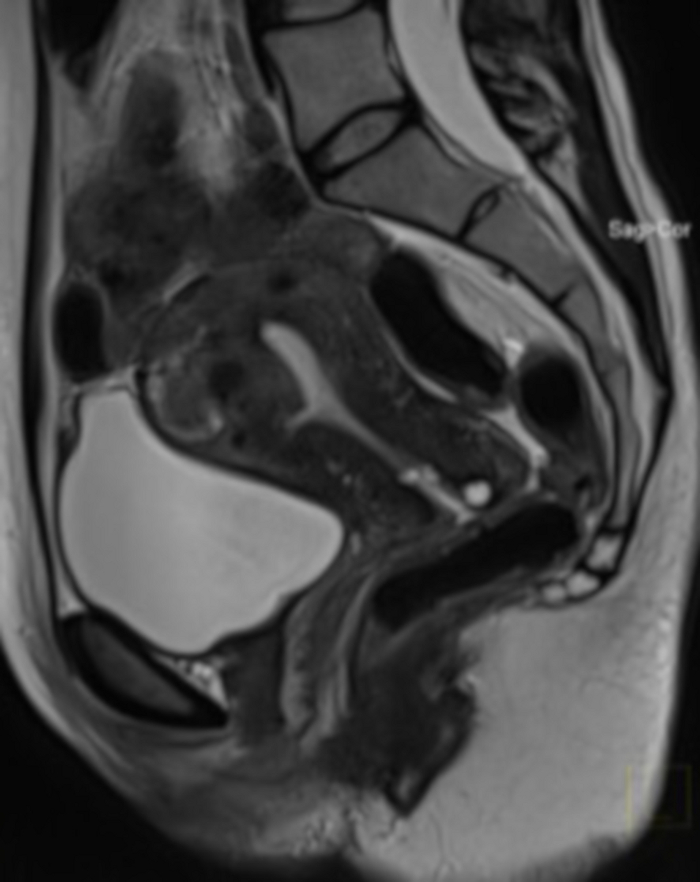
איור 20: בדיקת MRI אגן שנה לאחר ההליך באיחוד האמירויות (אותו מקרה כמו באיור 4).
בחתך הסגיטלי נראה שרירן רחמי (FIGO 2-5), עם הפחתת נפח גדולה מאוד לאחר UAE. MRI בוצע עקב חשד לתיחום רקמות לאחר ההליך (אין אפשרות להעריך את מבנה השרירנים בבדיקה דו-ידנית). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| תוצאות ייצוגיות / פרוטוקול לובלין 64,65,72 | ||
| מספר ההליכים באיחוד האמירויות שבוצעו בתקופה שבין 2009 ל-2019 | 557 | |
| הצלחה טכנית | הושג ב-547 מטופלים (98.2%) | |
| ההפחתה הממוצעת של נפח השרירנים (הערכת נפח MRI) 3 חודשים לאחר איחוד האמירויות בקבוצה של 206 חולים בגילאי 32 עד 52 שנים (גיל ממוצע - 39 שנים) | 62.0% (9.0-100.0%) | |
| ההפחתה הממוצעת של נפח השרירנים (הערכת נפח אולטרסאונד VOCAL) 3 חודשים לאחר UAE בקבוצה של 65 חולים בגילאי 29-52 שנים (גיל ממוצע - 43.1 שנים) | 50.1% (2.7-93.5%) | |
| הערכת רזרבה שחלתית | ירידה ב-AFC | 56.7% (עמ<0.001) |
| ירידה ב-AMH | 36.7% (עמ<0.001) | |
| ירידה ב-INHB | 46.7% (עמ<0.001) | |
| ירידה ב-E2 | 43.3% (עמ<0.001) | |
| עלייה ב-FSH | 43.4% (עמ<0.001) | |
| הפחתת כאב לאחר אמבוליזציה (על פי PAC) עם שימוש ב-PCA (הליך 2. של פרוטוקול "טיפול בחולה לאחר איחוד האמירויות") שהוערך בקבוצה של 60 מטופלים | ה-NRS החציוני מיד אחרי איחוד האמירויות | 10 (טווח 5-10) |
| ה-NRS החציוני ביום שאחרי איחוד האמירויות | 4 (טווח 1-5) | |
טבלה 1: תוצאות מייצגות של טכניקת איחוד האמירויות הערביות בטיפול בשרירנים סימפטומטיים ברחם שבוצעו בהתאם לפרוטוקול לובלין.
Discussion
בגלל ההבדלים במבנה, בגודל, בלוקליזציה ובתסמינים של שרירנים ברחם, יצירת פרוטוקול אחיד של איחוד האמירויות לא הייתה משימה קלה. היו פערים רבים בין ההנחות של שיטה טיפולית זו לבין ציפיות המטופלים, הן בשלב ההסמכה והן בהשפעות הטיפול. יותר מפעם אחת, מטופלות שהופנו לאיחוד האמירויות לא דיווחו על סימנים קליניים של שרירנים ולא היו מודעות לכך שגידולי הרחם הללו לא יוסרו באופן קיצוני. הציפייה המפורשת היחידה הייתה להיפטר משרירנים ללא ניתוח.
לכן, חשוב שהמטופלת תבין את הנחות היסוד של שיטה זו, תקבל אותה ותכיר את ההבדלים לגבי שיטות אלטרנטיביות לטיפול בשרירנים ברחם. בחירתה המודעת (סעיף 1.1. לפרוטוקול הכשירות לאיחוד האמירויות) היא נקודה קריטית, ויישומה הנכון יאפשר את המשך הפרוטוקול.
במהלך יישום הפרוטוקול, כמה נהלים חוזרים על עצמם. זה נועד ונובע מהנוסחה שאומצה על ידי כתב העת הזה, שבה פקודות בודדות נכתבות במצב ציווי ומופנות לאדם אחד. עם זאת, מספר רופאים מעורבים לעתים קרובות בהסמכה, בהכנה ובשלבים אחרים של איחוד האמירויות. אלה גם נקודות קריטיות של הפרוטוקול; השמטתם עלולה לגרום לאיחוד האמירויות בתנאים לא אופטימליים או בנוכחות התוויות נגד. מכאן חלוקת הפרוטוקול ל-5 פרקים. זה מאפשר להמשיך אותו על ידי מומחים שונים, ולאחר מכן נבדקות נקודות הפרוטוקול החוזרות ונבדקות באופן עצמאי.
קושי נוסף ביצירת פרוטוקול אחיד של אמבוליזציה של עורק הרחם בטיפול בשרירנים ברחם הוא המספר הגדול הנוכחי של המלצות (עד 11) המתייחסות לאותו הליך41. למרות שההנחות שלהם דומות, כמו תמיד, "השטן נמצא בפרטים", המפרט את האיחוד. התוויות נגד יחסיות לגבי מיקום השרירנים או תוכניות הרבייה של חולים העוברים איחוד האמירויות הן השנויות ביותר במחלוקת במהלך ההסמכה. על ידי יישום קריטריונים מחמירים יותר המוצעים על ידי SOGC, יש להוציא מטופלים מהליך זה, בעוד שהמלצות RCOG ליברליות יותר מאפשרות זכאותל-UAE 14,32,43. השאלה היא מה לעשות. במהלך יצירת הפרוטוקול, ביססנו את ההחלטה (מלבד ספרות נרחבת) על ניתוח המקרים והניסיון שצברנו, הדורש התייחסות פרטנית לכל מטופל. לכן, הפרוטוקול אינו שולל את ביצועי UAE בחולים עם התוויות נגד יחסית (סעיפים 1.4 להסמכה לפרוטוקול איחוד האמירויות הערביות). נראה כי ההסמכה וההכנה הנכונות לאיחוד האמירויות הן המפתח להצלחה טיפולית. גם הטכניקה עצמה חשובה מאוד, כמו גם טיפול באיחוד האמירויות, המבטיח לא רק הצלחה טיפולית או שביעות רצון המטופל אלא גם היעדר סיבוכים שתוארו לעיל.
ללא קשר למספר השרירנים, כל הנגעים מובלעים במהלך הליך אחד. בדרך כלל, יותר שרירנים, יותר יהיה חומר האמבוליזציה שיוזרק. פעולה זו מאריכה את משך האמבוליזציה אך אינה משנה את הנוהל. ניתן לשנות את איחוד האמירויות אם אנו רואים קשר ברור לעורק השחלה, מה שעלול לגרום לסיכון מוגבר לאמבוליזציה שאינה מטרה. לאחר מכן נוכל לסגור חיבור כזה (למשל, באמצעות סלילים), ובכך להפריד את אספקת השחלות והרחם, ואז להמשיך באמבוליזציה באמצעות חלקיקים של 700 מיקרומטר. אם לא ניתן להשתיל סלילים, אנו מגדילים את קוטר החלקיקים ל 900 מיקרומטר.
ישנם גם מקרים שבהם ניתן לספק את השרירנים מהצד של עורקי השחלה; לאחר מכן, עורקי הרחם הם היפופלסטיים. במקרים אלה, כדי לבצע בהצלחה אמבוליזציה, יש להחדיר מיקרוקטטר לעורק השחלה ומעבר לשחלה, תוך הפקדת חומר התסחיף למיטת כלי הדם של הרחם, תוך שמירה על אספקת שחלות תקינה.
היתרון הבלתי מעורער של אמבוליזציה הוא העובדה שלא מדובר בהליך קשה מבחינה טכנית ואינו דורש ציוד מתוחכם.
הנקודות החזקות של הפרוטוקול הן הנקודות הנוגעות לטיפול בכאב לאחר אמבוליזציה, שלפחות מחצית מהמטופלים לא שמעו עליו בעת הזכאות לאיחוד האמירויות. ההליך הסטנדרטי שאנו מציעים הוא שימוש במשאבת PCA (סעיף 4.2 לטיפול בחולה לאחר פרוטוקול איחוד האמירויות הערביות), והתוצאות המתקבלות מאשרות את היעילות הגבוהה של טיפול כזה.
לגבי שינויים עתידיים בפרוטוקול איחוד האמירויות, נראה כי ניתן לשנות את סעיף 10 בפרוטוקול ההכנה לפרוטוקול איחוד האמירויות, המחייב הוצאת ההתקן התוך רחמי מהרחם לפני ההליך בשל הסיכון לדלקת ואלח דם. במחקרי מעקב גדולים, הסיכון לזיהום באגן בשילוב עם נוכחות התקן תוך רחמי הוא פחות מ-1 ל-130049.
איחוד האמירויות הערביות נחשבת לשיטה ניסיונית מאז השימוש הראשון בה מכיוון שהיא דרשה הערכת יעילות ובחינת הסיבוכים שהליך זה עלול לגרום לתקופות קצרות וארוכות טווח. במהלך שנים אלה, אינדיקציות והתוויות נגד שונו על סמך תוצאות בדיקה חדשות ותצפית קלינית. נתונים עדכניים, כולל מספר מחקרים אקראיים מבוקרים, מכירים באיחוד האמירויות כשיטת טיפול רבת ערך לשרירנים ברחם סימפטומטיים, שיעילותם ובטיחותם הוכחו היטב.
יצירת הפרוטוקול הנ"ל נובעת מניתוח מעמיק של הספרות העדכנית, המלצות רלוונטיות וניסיון שנצבר כתוצאה משיתוף פעולה הדוק של גינקולוגים ורדיולוגים כירורגיים במהלך העשור.
Disclosures
למחברים אין מה לחשוף.
הצהרה:
פיוטר שקודז'יאק כמחבר איור 1, הממחיש את סיווג שרירני הרחם של FIGO, מאפשר שימוש חופשי באיור ליישומים מדעיים וחינוכיים ללא כל שינוי. הכוונה לשנות את הדמות צריכה להתקבל על ידי המחבר (piotr.szkodziak@gmail.com).
Acknowledgements
המחברים מבקשים להודות לכל הצוות של היו"ר השלישי והמחלקה לגינקולוגיה והמחלקה לרדיולוגיה התערבותית ונוירורדיולוגיה, האוניברסיטה הרפואית של לובלין על עזרתם ביישום פרוטוקול לובלין אמבוליזציה של עורקי הרחם.
Materials
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
References
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved