Method Article
子宫动脉栓塞治疗症状性子宫肌瘤的 Lublin 方案
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种治疗有症状子宫肌瘤的子宫动脉栓塞方法,分为五个部分:鉴定、准备、性能、术后护理和随访。该协议需要妇科医生和介入放射科医生之间的密切合作,以便能够正确执行上述程序。
摘要
子宫肌瘤是起源于平滑肌组织的良性肿瘤,构成子宫肌基质。子宫肌瘤是女性最常见的良性肿瘤。在 20%-50% 的女性中,肌瘤是无症状的,不需要任何治疗。子宫肌瘤的主要症状是月经大量出血、异常子宫出血和压迫症状。压力症状可导致盆腔疼痛综合征、排尿障碍和便秘。
目前使用的治疗方法包括手术治疗、药物治疗和微创手术。最常用的微创方法是子宫动脉栓塞术。该手术目前是治疗症状性子宫肌瘤的广泛接受的方法,并已被美国国家卫生与临床优化研究所 (National Institute for Health and Clinical Excellence) 在月经过多指南中得到认可。
这是一个复杂的过程,需要妇科医生和介入放射科医生之间的密切合作。我们提出了一种适用于子宫动脉栓塞治疗症状性子宫肌瘤的方案。该协议分为五个部分。前两部分面向妇科医生和介入放射科医生,逐步解释如何使患者进行栓塞鉴定和准备。第 3 部分针对介入放射科医生,解释了应如何进行栓塞。第四部分针对在栓塞后照顾患者的妇科医生或医院病房医生。该方案的这一部分提供了一种使用患者自控镇痛 (PCA) 泵治疗栓塞后疼痛的方法。第 5 部分通过评估子宫动脉栓塞的效果和晚期并发症来完成该程序。
所有五个部分都为临床医生、专家和该领域的新研究人员制定了统一的协议。
引言
子宫肌瘤是起源于平滑肌组织的良性肿瘤,构成子宫肌基质。它们是单克隆肿瘤,由大量含有胶原蛋白、纤连蛋白和蛋白聚糖的细胞外物质组成。肌瘤被一个薄的假包膜包围,该假包膜由压缩的肌肉纤维、胶原纤维、神经纤维和血管组成 1,2。肌瘤的病理生理学尚不完全清楚,但似乎主要依赖于由选择性和组织特异性表观遗传变化引起的单克隆增殖3。没有发现单个基因会导致子宫肌瘤。然而,罕见的子宫肌瘤综合征(例如多发性皮肤和子宫平滑肌瘤病)的存在归因于编码富马酸水合酶的基因,富马酸水合酶是一种参与 Krebs 周期4 的线粒体酶。7 号、 12 号和 14 号染色体中存在 50% 的肌瘤 7 号染色体缺失和易位,这似乎是继发性的,而不是原发性的 5,6,7。
子宫肌瘤生长的调节因子是由卵巢(雌激素和孕激素)、生长因子、血管生成和细胞凋亡产生的类固醇激素。子宫肌瘤发展的危险因素也已被确定,包括年龄、月经初潮早、非裔美国人种、遗传、未生育、肥胖、多囊卵巢综合征、糖尿病、高血压、维生素 D 缺乏症、使用豆浆、酒精和咖啡因消费8。
子宫肌瘤是女性生殖器官最常见的良性肿瘤。这些肿瘤于 1793 年由伦敦圣乔治医院的 Matthew Baillie 首次描述。现有的流行病学数据并不能准确说明子宫肌瘤的发病率,因为子宫肌瘤的大部分仍未得到诊断。据估计,子宫肌瘤发生在 5.4% 至 77% 的患者中。他们在美国的患病率高于欧洲,可能的原因是种族差异8。
在育龄妇女中,大约 30% 的肌瘤可能以异常子宫出血的形式出现临床症状,导致患者供血不足9。在大多数情况下,患者有不止一个肌瘤,肌瘤是位于子宫内的球形病变。它们的尺寸和位置可能会有所不同。在 90% 的情况下,它们位于子宫体内。它们的直径可以从几毫米到 20 厘米不等10.
FIGO (Fédération Internationale de Gynécologie et d'Obstétrique) 分类根据子宫内膜的接近程度将它们分为 0-8 组(数字越低,子宫内膜越近)(图 1)11。在大约 50%-75% 的病例中,肌瘤是无症状的。子宫肌瘤最常见的症状是月经大量出血、异常子宫出血和压力症状。肌瘤与大约 10% 的不孕症病例有关,在 1%-3% 的情况下,它们是唯一的原因12。无症状子宫肌瘤通常只接受常规的医疗控制,而有症状的子宫肌瘤是治疗的适应症13。
目前使用的子宫肌瘤治疗方法包括手术治疗、药物治疗和微创手术 13,14,15,16,17,18。手术治疗包括子宫肌瘤切除术(腹部和子宫镜下子宫)和子宫切除术。子宫肌瘤切除术和子宫切除术都对生活质量有积极影响19。子宫切除术与不可逆的生育能力丧失有关;因此,许多女性寻求其他治疗方案20。
腹部子宫肌瘤切除术可以保留生育能力。根据肌瘤的大小和数量,以及外科医生的经验,该手术可以通过剖腹手术或腹腔镜检查进行。虽然出血比子宫切除术少见,但总体发病率相似。宫腔镜子宫肌瘤切除术是一种比腹部子宫肌瘤切除术更安全、侵入性更小的方法,可以治疗粘膜下肌瘤 (FIGO 0)。可能需要随后的宫腔镜手术以完全切除较大的 2 型肌瘤21。
左炔诺孕酮宫内节育器释放是治疗月经量过多的有效方法,但它们不会减小肌瘤的大小。它们的使用仅限于子宫腔变形的患者。GnRH 类似物主要用作术前药物,以减小肌瘤的大小和围手术期失血。它们还减少了子宫切除术和子宫肌瘤切除术期间垂直切口的百分比,同时增加了阴道手术的可能性20。
在短期内,选择性孕激素受体调节剂会减少肌瘤体积并诱发闭经。然而,长期疗效和安全性需要进一步研究。除了芳香化酶抑制剂外,可能还有其他选择可用于贫血的术前治疗和减少肌瘤体积22。一些研究表明,维生素 D 可以减缓或阻止肌瘤的生长和症状的发作23。
使用 2-甲氧基雌二醇与纳米颗粒结合的新方法也正在开发中 24。用于治疗子宫肌瘤的微创方法包括子宫动脉栓塞术 (UAE)、磁共振引导聚焦超声手术 (MRgFUS)、腹腔镜子宫动脉闭塞术 (LUAO) 和射频肌溶解症14,25。超声引导高强度聚焦超声 (US-HIFU) 是一种新的、仍处于实验阶段的微创方法26,27。
治疗性血管阻塞和阻断子宫血液供应的方法在 120 多年前就被提及。1894 年,Kelly 提出了在肿瘤子宫切除术中结扎髂内动脉以控制顽固性盆腔出血,这在当时是外科手术后的常见并发症28。然后,Sack (1973) 描述了相同技术在产钳分娩后大量产后出血中的有效使用。在这两种情况下,无需子宫切除术即可实现止血29。1979 年,Heaston 等人和 Brown 等人独立描述了使用可吸收明胶海绵栓塞盆腔动脉以控制产后出血30,31。
UAE 于 1991 年在法国首次用作症状性子宫肌瘤的治疗方法32.它最初用于减少子宫肌瘤切除术后的失血。1995 年,Ravina 等人提出将该程序作为症状性子宫肌瘤的主要治疗方法33。在美国,子宫动脉栓塞术于 1997 年成功进行34。
对有症状肌瘤女性子宫保留的兴趣日益浓厚,使阿联酋处于微创肌瘤治疗的前沿 14,18,35,36,37。2000 年,皇家妇产科学院和皇家放射科医师学院联合工作组成立,旨在发布阿联酋指南。当时,UAE 被认为是一种实验方法(全球进行的手术不到 7,000 例)。自指南发布以来,全球已进行了超过 100,000 例阿联酋手术。此外,还进行了 5 项随机对照试验,将 UAE 与其他外科手术进行了比较。研究结果表明,UAE 在中短期(长达几年)内非常有效,中度(例如子宫感染)和严重(危及生命)并发症的风险较低38,39。在随机研究中,更短的住院时间、更快的恢复和恢复日常活动都有利于阿联酋。事实证明,外科手术更便宜,并且不需要再次干预,同时保持统计学意义32。该手术目前是治疗症状性子宫肌瘤的广泛接受的方法,并已被美国国家卫生与临床优化研究所 (NICE) 在月经过多指南40 中认可。
目前,来自欧洲、北美和澳大利亚的科学协会制定了 11 条关于使用 UAE 治疗症状性子宫肌瘤的建议。在大多数情况下,建议是一致的,而差异涉及两个差异。首先是带蒂粘膜下 (FIGO 0) 和浆膜下 (FIGO 7) 肌瘤是否是 UAE 的禁忌症。第二个问题是宣布未来怀孕的妇女是否应该有资格接受这种手术41.美国妇产科医师学会 (ACOG) (2008) 提出了一个有趣的子宫肌瘤治疗指南。基于一致的科学证据(A 级),ACOG 将阿联酋定义为一种有效且安全的方法,适用于希望保留具有治疗肌瘤典型适应症的子宫的具有适当资格的女性。同时,ACOG 建议强调了妇科医生和介入放射科医生之间密切合作的必要性。在已发布的指南中,ACOG 认识到保持生育能力的愿望是唯一的禁忌症(相对)42。
2013 年,皇家妇产科学院 (RCOG) 和 2015 年加拿大妇产科医师协会 (SOGC) 分别发布了最新建议之一41。在本文的其余部分,作者将使用上述建议。根据 RCOG 和 SOGC 的指南,任何有症状的肌瘤患者都可以成为栓塞术的候选人,前提是没有禁忌症并且手术的好处(症状消退)大于并发症的风险。应该注意的是,子宫肌瘤栓塞作为一种微创手术,严重并发症的数量可以忽略不计。因此,在大多数情况下,益处大于并发症的风险 14,32,43。
适当的患者资格对于高临床疗效和预防 UAE 后的并发症至关重要。UAE 的主要适应症是有症状的子宫肌瘤,导致月经量过多、痛经、疼痛、痛以及对泌尿或胃肠道的其他不利影响。有必要区分肌瘤与子宫腺肌病或肌瘤与子宫腺肌病共存,因为在这种情况下,UAE 效果较差,需要修改手术技术 14,32,43,44,45,46,47。对有症状的子宫肌瘤女性进行 UAE 手术的具体适应症包括拒绝手术、不同意输血以及既往子宫肌瘤手术失败。
在上述适应症中,应将 UAE 视为手术治疗的替代治疗。然而,应告知患者,在少数情况下,手术后的并发症可能导致需要手术干预 14,32,43。根据 RCOG 指南,在肌瘤是不孕症的可能原因的情况下使用 UAE 需要特别小心,并由专门治疗不孕症和辅助生殖的妇科医生进行适当评估。由于肌瘤的存在而导致的不孕并不是绝对的,许多女性会在没有任何干预的情况下怀孕。因此,排除其他可能的不孕症原因是合理的,包括对男性伴侣的评估 14,32,43。
因此,根据 RCOG 和 SOGC 的建议,候选人应该是患有症状性子宫肌瘤的女性,其中已排除具有肌瘤样临床症状的骨盆病变41,43。
该手术的绝对禁忌症包括当前或近期的生殖器感染、由于临床因素或影像学检查不足导致的诊断怀疑、无症状肌瘤、存活妊娠以及使用放射造影剂的禁忌症。
相对禁忌证包括带蒂粘膜下 (FIGO 0) 和浆膜下 (FIGO 7) 肌瘤,理论上由于花蒂坏死,它们可能会从子宫内膜脱离,在极少数情况下会导致脓毒症。在这些情况下,只有在计划手术前通过宫腔镜或腹腔镜切除带蒂肌瘤时,才应考虑 UAE。
尽管目前的文献表明肌瘤的大小本身并不是禁忌症,但经验表明,在将患有大肌瘤(尤其是与压迫症状相关)的患者确定为 UAE 时需要格外小心,因为体积的减少可能不足以缓解症状和满足患者的期望14,32,43,48.
有许多关于阿联酋成功怀孕的报道,但现有证据并不完全支持将其用作年轻女性药物或手术治疗(子宫肌瘤切除术)的替代疗法49。因此,对于宣布希望怀孕的女性,应非常谨慎地使用该程序(因为 UAE 后的妊娠率低于子宫肌瘤切除术后,子宫破裂、胎盘植入和不良妊娠结局)32,50,51,52,53,54,55.作为妇科医生,我们不建议寻求怀孕的女性使用阿联酋。对我们来说,这是一个相对禁忌症,前提是阿联酋有其他适应症,例如拒绝手术或输血,在这些情况下,缺乏治疗可能会危及生命。
根据 RCOG 指南,希望保持或提高患有症状子宫肌瘤的年轻女性的生育能力是 UAE32 的相对禁忌症。相比之下,SOGC 指南建议,在类似情况下,不应将 UAE 作为肌瘤的治疗选择,因为尚未确定此类女性的安全性和有效性14,43。其他科学协会也提出了类似的观点,包括美国生殖医学学会 (ASRM)、美国妇产科医师学会 (ACOG)、美国放射学会 (ACR)、澳大利亚和新西兰皇家妇产科医师学会 (RANZCOG) 等,引用子宫肌瘤切除术后生育结果改善 41,43,56.NICE 仅向寻求维持或提高生育能力的女性推荐阿联酋,尤其是具有不利于子宫肌瘤切除术的特征(多发性肌瘤)的女性57。
一般来说,UAE 的程序可以在月经周期的任何阶段进行32。但是,假设在受精或植入阶段没有理想的排除妊娠的方法,为了排除早孕,在我们中心,它进行到第 10 个周期日。在大多数情况下,患者在手术当天被送入妇科病房。如果提供适当的检查和妇科咨询,允许患者入住血管外科病房。妇科医生和介入放射科医生进行肌瘤栓塞的鉴定。妇科资格包括病史、检查、生殖器官和肌瘤类型的超声评估。此外,为了排除子宫内的任何恶性肿瘤,需要进行宫颈 (PAP) 涂片和子宫内膜活检。在卵巢超声扫描有问题的情况下,ROMA 测试(卵巢恶性肿瘤风险算法)是必要的。
另一个需要讨论的问题是子宫肉瘤,特别是平滑肌肉瘤 (LMS),占这些子宫肿瘤的 70%。肌瘤手术患者中 LMS 的患病率较低,估计为 0.13%–0.29%58,59。在 40 岁以上的女性中观察到 LMS 发病率的增加。LMS 在治疗前很难诊断,因为它可能类似于良性肌瘤60。大多数 LMS 与预先存在的肌瘤无关,没有证据表明 LMS 与子宫肌瘤有关61。子宫肌瘤和 LMS 都倾向于快速生长。因此,大小或生长速度不是恶性子宫肿瘤的危险因素60。
目前,没有可靠的实验室或影像学测试可以让我们清楚地识别平滑肌肉瘤并将其与平滑肌瘤区分开来 60,62。子宫内膜活检诊断平滑肌肉瘤的敏感性为 86%。因此,活检结果阴性并不能排除存在恶性子宫肿瘤。对比增强 MRI 是目前子宫肿瘤的最佳诊断方法。该测试诊断 LMS 的敏感性为 94%60。
如前所述,上述测试并不能排除 100% 的恶性子宫肿瘤。因此,治疗后存在延长 LMS 诊断的轻微风险,而没有对子宫肿瘤进行组织病理学验证的可能性。在获得阿联酋资格期间,应告知患者这一点。
进行全血细胞计数 (CBC) 和凝血试验(INR、APTT)、肾检查(肌酐、尿素)、促甲状腺激素 (TSH)、卵泡期抗苗勒管激素 (AMH)(推荐)或卵泡刺激素 (FSH) 浓度、C 反应蛋白 (CRP)、一般尿液检查和阴道涂片(需氧阴道培养)可以评估和避免潜在的栓塞后并发症(感染、 医源性卵巢损伤,含钆造影剂后既往肾功能损害加剧,含碘造影剂后甲状腺功能亢进症病例的甲状腺毒症)63,64。请注意,不建议在 40 岁以下进行 FSH 检测,因为 FSH 不是年轻女性卵巢储备变化的敏感指标50,65。
介入放射科医生根据病史和磁共振成像 (MRI) 确定患者是否有资格接受手术。在收集病史时,应与患者讨论益处和可能的并发症,以及手术本身。还应讨论患者对 UAE 的期望。MRI 旨在排除生殖器官和邻近结构的其他病理,以及评估肌瘤的形态和位置以及解剖结构,以确定手术的技术可行性 35,36,37,57。
UAE 的目标是完全阻断所有肌瘤的脉管系统,同时维持子宫、卵巢和骨盆内周围组织的血液供应。阿联酋的技术方面在一定程度上仍在发展。
子宫动脉栓塞由在血管内栓塞领域具有适当能力的介入放射科医生进行。该程序在透视引导下进行。它涉及将血管导管从腹股沟区域的穿刺经皮插入股动脉、主动脉、髂内动脉,直至子宫动脉。将导管深埋入子宫动脉并达到稳定位置后,在透视控制下注射混合造影剂的栓塞剂,以避免反流和“非目标”栓塞。肌瘤的血管床使用 500-900 μm 的颗粒闭合,具体取决于栓塞材料的类型——通常尺寸为 700 μm。栓塞治疗持续进行,直到达到淤滞血流。在手术结束时,移除导管,并用手动压力和敷料或机械闭合器固定血管通路部位。该过程持续约 0.5-1.0 小时。UAE 期间卵巢吸收的平均电离辐射剂量为 0.04-0.22(Gy:灰色),平均估计有效剂量为 22-34(mSv:毫西弗)。平均透视时间约为 22 分钟66,67。
大多数肌瘤的脉管系统来自子宫动脉。只有大约 5%-10% 的肌瘤由卵巢动脉额外供应。动脉子宫吻合发生在大约 10% 的病例中,而子宫-卵巢吻合发生在 10%-30% 的病例中。切断栓塞组织的血液供应会导致缺血性坏死,然后是透明变性或凝血性坏死。这个过程需要几个月的时间68,69.
阿联酋的有效性取决于症状的消退或减轻的程度。对于月经过多、盆腔疼痛和压力症状的治疗,阿联酋的临床有效性指数分别为 81%-96%、70%-100% 和 46%-100%。在手术后 3-6 个月内,观察到的肌瘤体积减少 25%-60%33,70,71,72。肌瘤的平均直径减小为 2.2 cm57。
肌瘤体积的减少并不总是与临床症状的消退或减轻相关。在 UAE 后的长期随访中,超过 70% 的患者报告在手术后 5 年内缓解或临床症状显着减轻,而其中 16%-23% 的患者需要再次干预73,74。
在评估早期 UAE 效应时,本出版物的作者建议使用三维 (3D) 超声,使用虚拟器官计算机辅助分析法 (VOCAL),测量血管指数:血管形成指数 (VI)、血流指数 (FI) 和血管化血流指数 (VFI)75。
栓塞后疼痛是 UAE 成功的早期(持续约 24 小时)预期后遗症(不要与并发症混淆),应积极治疗。这种临床症状是由缺血性肌瘤的组织分解产物的释放引起的。治疗包括充分的疼痛控制、补水和可能的抗生素治疗32,43。手术后维持 24 小时的硬膜外麻醉 (EA) 显着将疼痛减轻到完全可接受的水平,但与患者自控镇痛 (PCA) 相比,成本更高,并发症风险更高76。
栓塞后疼痛管理审查中也提供了其他方法。值得一提的是,在阿联酋期间使用止痛药与聚乙烯醇分子和电针麻醉的混合物。这两种方法都旨在限制在医院环境中进行的 UAE 手术数量77,78。我们不在 Our Cooperative Center 和 Cocooperative Center 中使用这些方法。
UAE 的早期并发症通常是与血管造影手术相关的局部并发症。这组不良事件很少见(发生在不到 1% 的病例中),主要与腹股沟血肿、动脉血栓形成、动脉夹层和假性动脉瘤、对造影剂的过敏反应、手术过程中纵血管导管引起的子宫动脉痉挛有关(几分钟后作为临时事件处理,手术可以继续, 如果痉挛持续存在,可以给予动脉内维拉帕米 (2.5-5 mg) 或硝酸盐 (100-150 μg)和“非靶向”栓塞 32,37,38。
也有几篇关于其他盆腔器官的“非靶向”栓塞及其随后的缺血的报道。这种并发症可能是由于手术执行不力以及盆腔脉管系统吻合口和解剖变异的存在而发生的。非靶向栓塞的一个特殊情况是一些患者子宫血管和卵巢之间的吻合引起的卵巢损伤79,80。
肌瘤坏死的后果是大约 10%-15% 的患者在手术后 30 天内发生栓塞后综合征。这种综合征的症状可能同时或单独发生,包括恶心、呕吐、不适、低烧、下腹痛和白细胞水平升高。这通常是一种自限性综合征,通常在 10-14 天内消失。镇痛药和抗炎药用于治疗这种并发症32。区分栓塞后综合征的症状与更严重的并发症(如脓毒症)很重要。在上述症状持续时间超过两周的情况下尤其如此 32,37,38.
感染可能是 UAE 之后最严重的并发症,约占 0.5% 的病例32,38。如果持续高烧(38.5 °C 及以上)持续 24-48 小时,腹部坚硬疼痛,应怀疑脓毒症。在这种情况下,治疗可能不仅需要使用抗生素治疗,还需要切除子宫。在后一种情况下,在不到 1% 的情况下,它可能对患者的生命构成威胁。当在大子宫上进行 UAE 手术时(超过 20 厘米或单个肌瘤的直径大于 9 厘米,以及在大粘膜下肌瘤共存的情况下)37,38,脓毒症更为常见。
UAE 后(手术后 30 天以上)发生在粘膜下肌瘤栓塞后,是肌瘤的明显坏死碎片通过宫颈管排泄。它发生在大约 10% 的情况下 32,81,82。大约 16% 的女性,在 UAE 之后,由于坏死肌瘤从子宫排泄,可能在数周至数月内出现大量阴道分泌物83。在阿联酋手术后,观察到月经显着缩短和月经丰度减少,这被认为是该程序的有益效果。然而,完全闭经被视为栓塞后卵巢衰竭的影响50,84。
阿联酋疫情后的闭经通常是短暂的,仅限于几个周期。永久性闭经发生在 15% 的 40 岁以上女性中,约 1% 的该年龄以下女性中发生,导致过早绝经的症状。在我们自己的研究中,发现由于卵巢储备减少,年轻女性(33-40 岁)的生育能力下降65。据估计,在阿联酋手术后报告闭经的女性中,约有 85% 的年龄在 45 岁以上,85 岁。有人认为,老年女性闭经发生率增加的原因是卵巢储备减少和卵巢组织对“非靶向”栓塞引起的缺血更敏感86。
阿联酋手术还会影响接受手术的女性的性功能。26% 的女性报告说 UAE 后性功能有所改善,10% 的女性发现性功能恶化,其余 64% 的女性没有变化。性功能障碍的一个可能原因是阿联酋手术导致、宫颈和子宫体的脉管系统异常74。
研究方案
作者声明该协议遵循当地卢布林医科大学伦理委员会的指导方针。
1. 阿联酋程序的资格
注意:这是针对妇科医生和介入放射科医生的。
- 告知患者 UAE 程序的详细信息。
- 讨论 UAE 手术的适应症和禁忌证。
- 与患者讨论 UAE 的假设和治疗子宫肌瘤的替代方法(在引言中描述)。
- 警告!告诉患者 UAE 不是一个根治性手术(不会去除肌瘤)。
- 警告!告知患者,她在 UAE 后不会收到子宫肌瘤的组织病理学报告。
- 警告!告诉患者,1 个子宫肿瘤中有 3-1,000 个病例可能是恶性的 (LMS)。与患者讨论,在 UAE 认证期间进行的子宫内膜活检和 MRI 对平滑肌肉瘤的诊断具有高度敏感性,但不是 100%。告知患者,对平滑肌肉瘤进行 UAE 可能会延迟诊断和适当治疗。在病历中记下这个事实。
- 如果患者故意希望执行 UAE,请继续此 协议。
- 告诉患者资格认证分两个阶段进行。妇科医生的资格认证包括适应症和禁忌症的分析,而介入放射科医生则评估阿联酋的技术能力。
- 计划或进行妇科会诊,并计划在 UAE 之前与介入放射科医生会诊。
- 如果可能,请在门诊执行尽可能多的资格认证程序。
- 确保患者有 UAE 的适应症:有症状的子宫肌瘤(子宫出血、子宫出血、痛经、痛、慢性盆腔痛);拒绝手术治疗;不同意输血;以前子宫肌瘤手术失败。在病史中记下它们。
- 向患者询问肌瘤的症状。
- 讨论 UAE 的有效性和患者的期望(在 代表性结果中)。
- 询问患者之前是否接受过子宫肌瘤治疗。确保使用了哪种方法。
- 如果患者拒绝手术治疗或输血,请提供书面声明。
- 确保符合阿联酋手术条件的患者没有绝对禁忌症:无症状肌瘤;可行的怀孕;当前或近期生殖器感染;由于临床因素或影像学检查不足而对诊断产生怀疑;使用放射造影剂的禁忌症;MRI 上平滑肌肉瘤的特征;子宫或卵巢恶性肿瘤,除非用于姑息治疗或作为手术的辅助手段87.在病史中记下它们。
- 如果患者尽管没有症状肌瘤但仍需要 UAE,请解释此类病例不符合手术条件。向患者解释无症状肌瘤只需要定期妇科监测。
- 如果存在 UAE 的相对禁忌症(大肌瘤和生育计划),请与患者讨论并在病历中记下这一事实。
- 重点关注引言中描述的与相对禁忌症相关的可能并发症,确保患者理解并同意该程序。
- 与患者讨论子宫动脉栓塞的后遗症和并发症(见引言),并在病历中记录这一事实。
- 与患者交谈时,请特别注意栓塞后的疼痛。
- 讨论栓塞后疼痛治疗。
- 进行妇科资格认证。
- 收集病史并进行妇科检查。
- 对生殖器官进行超声评估,以评估肌瘤的大小和类型(FIGO 分类)88。
- 使用阴道探针估计肌瘤的大小和位置(图2)。根据 FIGO 分类,用 UAE 治疗的子宫肌瘤应为 2-5(理想情况下为 3-4),直径不应超过 10 厘米。
- 在病历中包括盆腔超声扫描的方案。
- 确保超声扫描结果表明符合 UAE 程序的资格。
- 排除盆腔内的恶性病变。
- 确保患者目前有宫颈 (PAP) 涂片和子宫内膜活检的结果(最好在 6 个月内进行)。
- 在盆腔超声检查期间,使用阴道探针评估卵巢并确认其结构正确。如有疑问,请检查之前的超声扫描或进行 ROMA 测试。
- 订购 MRI 以评估子宫肿瘤的 LMS 特征和 UAE 技术能力。
- 注意病历中的宫颈 (PAP) 涂片、子宫内膜活检、超声扫描(可能是 ROMA 测试)和 MRI 的结果。
- 如果结果不正确,则取消患者参加手术的资格。
- 告知患者妇科资格的结果。
- 在病历中记下这个事实。将患者转诊至医院。
- 预约 UAE 手术,并记住患者应在周期的第 10 天之前到达。
- 询问患者是否拒绝手术。如果拒绝,请在患者的知情同意书或病历中注明该事实。
- 拒绝手术的有症状肌瘤患者有资格获得 UAE。
- 在 UAE 前至少 7 天进行以下测试,以评估和避免潜在的并发症:阴道涂片微生物学测试(需氧阴道培养);尿分析;选定的血液检查:CBC、凝血试验(INR、APPT)、肾脏检查(肌酸、尿素)、TSH、CRP。
- 在病历中描述结果。
- 告知患者不正确的结果将使她失去接受手术的资格。
- 通过在卵泡期检测 AMH(推荐)或 FSH(不建议 40 岁以下)血清水平来检查患者的卵巢储备。与患者讨论上述测试将有助于评估非目标栓塞引起的卵巢损伤。在病历中记下这个事实。
- 符合阿联酋资格的患者不应声明怀孕意愿,因为妊娠并发症的风险增加14、32、38、50、51、52、89、90、91。
- 告知患者 UAE 后妊娠并发症的风险增加。
- 请注意,患者没有在患者的知情同意书或病历中声明怀孕的意愿。
- 如果患者仍然不排除将来怀孕,但需要 UAE,请提供书面声明,表明她已被告知 UAE 后可能出现的妊娠并发症。
- 进行放射学鉴定。
- 确保已进行盆腔 MRI。MRI 检查可以排除生殖器官和邻近结构的其他病变(阿联酋资格认证程序的步骤 1.6.3.3.),评估肌瘤的形态和位置,以及栓塞技术可行性的解剖结构(图 3、 图 4)。如果没有,请安排 MRI 检查并咨询介入放射科医生。
- 分析影像学检查并评估肌瘤的类型和大小。
- 如果发现粘膜下 (FIGO 0-1) 肌瘤,请告知患者脱落到子宫腔的风险。完全排泄可能导致脓毒症,而碎片排泄通常无症状50。
- 如果发现浆膜下窄柄、带蒂 (FIGO 7) 肌瘤,请告知患者栓塞后肌瘤脱离到腹腔的风险。它可导致急性炎症,可能需要腹腔镜再次手术92。
- 如果发现大肌瘤,请告知患者并发症的风险保持不变,但小肌瘤的手术结果更好93。
- 请注意患者知情同意书或病历中的事实。
2. 准备阿联酋程序
注意:这是针对妇科医生或血管外科医生和介入放射科医生的。
- 将患者送入医院(妇科或血管外科)。
- 确保她在入院周期的第 10 天之前。
- 进行或安排妇科检查和盆腔超声扫描。
- 确保 UAE 程序的诊断和资格正确。
- 确保自获得阿联酋资格后没有出现新的禁忌证。如果是这样,请建议其他治疗方案并更改手术日期。
- 使用 VOCAL 软件检查(用于评估 UAE 手术的有效性72,75)(在介绍中描述)进行 3D 经阴道超声扫描 (TVUS) 并计算肌瘤的体积和血管形成指数(VI、FI 和 VFI)(图 5 和图 6)。
- 在病历中记下这个事实。
- 确保符合阿联酋资格认证的患者在阿联酋资格认证期间进行了测试(如阿联酋资格认证的步骤 1.6.2、1.6.3、1.6.5 和 1.6.6 所述)。
- 如果患者已通过妇科医生的资格预审,但没有进行血液检查、尿液检查和 MRI,请订购测试并安排与介入放射科医生的会诊(阿联酋资格认证的步骤 1.7)。
- 在 UAE 之前评估或检测 AMH(推荐)或 FSH(40 岁以下不推荐)血清水平,以便能够评估“非目标”栓塞导致的卵巢损伤。
- 告知患者,检测结果将在大约一天内提供,只有在收到这些结果后才能进行 UAE 程序。
- 告知患者不正确的结果将使她失去接受手术的资格。
- 警告!如果 PAP 涂片结果缺失或不正确,则进行子宫内膜活检;阴道涂片的微生物测试,取消患者进入阿联酋的资格(获得这些结果的时间太长)。获得正确结果后重新获得资格。
- 在病历中记下这个事实。
- 获得知情同意以执行 UAE。
- 向患者提供有关 UAE 的所有信息。
- 讨论 UAE 可能出现的并发症(在引言中描述)。
- 让患者有时间思考和提问;允许患者给予执行 UAE 程序的知情同意。
- 告诉患者,她有权在阿联酋开始之前更改她的决定。
- 如果患者改变对 UAE 的决定,则建议子宫肌瘤的其他治疗方案(在引言中描述)。
- 请注意患者知情同意书或病历中的事实。
- 在 UAE 程序之前,检查并确保已执行 UAE 资格的第 1.6.2、1.6.3、1.6.5 和 1.6.6 节中描述的测试以及 3D TVUS、MRI 并咨询介入放射科医生,并且结果正确。
- 如果测试缺失或结果不正确,请取消 UAE 患者的资格。
- 在病历中记下这个事实。
- 告知患者并注意从早上到手术期间禁止进食和液体的规定。例外情况是早上服用药物需要少量液体。
- 确保患者在早上(阿联酋之前)禁食。
- 确保患者服用治疗自身慢性病的药物。
- 在病历中记下这个事实。
- 给患者安排以下药物:1 片口服抗焦虑药(例如,艾司唑仑),1 剂静脉注射抗生素,1 小球甲硝唑阴道内注射,双氯芬酸 100 mg 直肠栓剂。
- 在阿联酋前约 30-40 分钟服用上述药物。
- 在病历中记下这个事实。
- 通过确保剃除左腋窝和右腹股沟来准备手术区域。
- 如果上述皮肤区域没有剃光,请轻轻剃除。
- 在病历中记下这个事实。
- 确保患者没有宫内节育器 (IUD)。
- 如果患者的子宫内有宫内节育器,请告知她子宫腔感染的风险增加,并提出在 UAE 之前将其取出。
- 如果患者不同意取出宫内节育器,请在患者的知情同意书或病历中注明这一事实。
- 确保患者报告对药物、造影剂和消毒剂的任何过敏反应,并在病历中记录这一事实和结果。
3. 执行阿联酋程序
注意:这是针对介入放射科医生和麻醉师的。
- 在无菌条件下执行该程序。
- 将患者放在手术台上,并使用医院消毒剂(经适当批准)对右侧腹股沟区域进行广泛消毒。
- 将手术单粘在手术部位(右腹股沟)周围。
- 选择麻醉类型:局部麻醉或硬膜外麻醉 (EA),并在病历中记下患者的选择。
- UAE 接受局部麻醉。
- 在手术部位麻醉(皮下给药)2% 利多卡因溶液。
- 根据需要静脉注射 5 mg 吗啡。
- 在开始 UAE 程序之前,请确保局部麻醉处于可作状态。
- EA 下的阿联酋
- 让患者为 EA 做好适当的准备。
- 在粘合手术单之前执行 EA。
- 确保符合 EA 手术条件的患者没有以下禁忌症 EA:手术拒绝、凝血病、血小板减少症、溶血性疾病、服用抗凝剂、休克、硬膜外注射部位感染、菌血症、局部麻醉剂过敏、脊柱解剖畸形、颅内压升高、神经系统疾病、严重主动脉瓣或二尖瓣狭窄94。在病历中记下这个事实。
- 打电话给麻醉师并要求 EA。
- 将一根细导管放置到腰椎区域的硬膜外腔并给予麻醉剂(针对麻醉师的程序)。
- 在开始 UAE 程序之前,请确保 EA 正常运行。
- 阿联酋程序
- 在透视引导下穿着 Angio Suit 执行 UAE 程序。
- 使用 Seldinger 技术95,96 进入血管系统(图 7、图 8 和 图 9)。
- 将尾纤导管插入肾动脉正下方的腹主动脉中。
- 进行血管造影以观察血管。
- 进行主动脉腔造影以评估供应肌瘤的血管的解剖结构并计划手术(图10)。
- 对前后投影和斜投影的髂内动脉进行血管造影,以揭示子宫动脉口。
- 由于穿刺的部位和导管的特定形状,从左侧开始,然后是右侧。根据血管的口径,选择性地将主导管或微导管引入子宫动脉(图11)。
- 将导管深埋在子宫动脉中。用水凝胶颗粒栓塞血管。由于存在子宫-卵巢吻合口,其大小估计约为 500 μm,建议用于栓塞的颗粒尺寸为 700 μm,以降低“非靶向栓塞”的风险。
- 继续栓塞,直到血管中的血流完全阻塞。治疗的终点是血管中的造影剂停滞,这证明了其有效闭合。
- 在具有相同通路的对侧进行子宫动脉栓塞术。治疗持续约 0.5 至 1.0 小时66,67(图 12)。
- 评估在对照血管造影期间从放置在髂内动脉中的导管栓塞的有效性。没有主动流入阴影血液(流向子宫动脉)表明该程序在技术上被认为是正确的(图13)。
- 小心地取出导管。
- 通过用压力敷料手动压缩来关闭穿刺部位,应在接下来的 6 小时内保持或闭合装置(图 14)。
- 在病历中描述阿联酋的病程。
4. 阿联酋手术后的患者护理
注意:这是针对妇科医生或血管外科医生和麻醉师的。
- 开始镇痛治疗:患者自控镇痛 (PCA) 泵或 EA。
- 告知患者并与患者讨论镇痛治疗的选择。
- 告诉患者,与 PCA 泵76 相比,EA 提供更好的疼痛控制和更快的康复。
- 在病历中记下这一事实和患者的选择。
- 使用 PCA 泵镇痛治疗栓塞后疼痛。
- 用吗啡溶液为 PCA 泵准备注射器。
- 用 50 mg 吗啡和 0.9% NaCl(浓度 1 mg/mL)溶液填充 PCA 泵的 50 mL 注射器。
- 准备用于静脉使用的 PCA 泵。
- 将引流管连接到注射器。
- 使用套管插入静脉穿刺。
- 将注射器插入 PCA 泵。
- 注满排水管,启动 PCA 泵。
- 打开 START 按钮。
- 锁定 PCA 泵。
- 设置 PCA 泵参数(如下所列)(图 15)。
警告!较高剂量的吗啡可能会导致呼吸抑制。- 使用 1 mg/mL 的吗啡浓度。按需使用剂量为 0.5 mg 的吗啡输注(静脉推注)(推注 p.),时间间隔为 5 分钟(锁定间隔/[Karencja])(以避免呼吸抑制)。在按需输注 10 s 期间使用静脉注射吗啡的时间。
- 确保完成上述所有步骤。
- 在 PCA 泵中订购吗啡长达 24 小时。
- 根据数字评定量表 (NRS) 监测疼痛。记下病历中的 NRS 值。
- 使用疼痛评估卡 (PAC)。
- 告诉病人,当疼痛症状出现时,她应该自己按下“纵杆”,从而按需取药。
- 确保患者理解说明。
- 观察按需“静脉推注”到“空推注”的量(在锁定间隔期间启动 - 阿联酋方案后的患者护理第 4.2.3 节)(图 16)。
- 如果“空推注”与按需“静脉推注”的比率达到高于 2/1 (67% / 33%) 的值,请使用以下程序(图 17、 图 18)。
- 为了提高使用 PCA 泵的止痛疗法的有效性,并降低吗啡副作用的风险,请考虑在静脉注射和标准剂量中使用扑热息痛或非甾体抗炎药。
- 照顾患者需要离开床的情况。
- 不要关闭泵。
- 断开排水管并用塞子固定。
- 当患者返回时,重新连接引流管。
- 用吗啡溶液为 PCA 泵准备注射器。
- 使用 EA 镇痛治疗栓塞后疼痛。
- 如果 EA 用于 UAE 程序,请继续作。
- 如果 UAE 手术使用局部麻醉并且患者订购 EA,则在硬膜外导管放置之前,请确保 CBC 和凝血测试正确。
- 确保符合 EA 程序条件的患者不存在执行 UAE 程序的第 3.4.3 节中描述的矛盾。在病历中记下这个事实。
- 打电话给麻醉师并要求 EA。
- 确保 EA 正常运行。
- 与麻醉师一起确定 EA 工作模式(推注或连续)。在病历中记下这个事实。
- 在连续模式 (CEA) 下,请咨询麻醉师并检查输液泵设置。
- 在推注模式 (BEA) 中,与麻醉师讨论局部麻醉剂给药之间的时间间隔。
- 根据需要,将导管维持 24-48 小时。
- 使用 NRS 量表监测疼痛。记下病历中的 NRS 值。
- 使用 PAC。
- 继续 CEA/BEA 直到需要,不超过 48 小时。
- 如有必要,在 PCA 或 EA 后继续镇痛治疗。
- 订购扑热息痛 3 x 1.0 g,静脉注射。
- 订购双氯芬酸 2 x 50 mg 直肠栓剂。
- 如果上述镇痛治疗还不够,请包括支持性镇痛药。
- 静脉注射酮洛芬 2 x 100 毫克。
- 口服呋喃西丁 3 x 100 毫克来治疗尿路症状。
5. 阿联酋手术后的控制访问
注意:这是写给妇科医生的。
- 在 UAE 后的第一天进行第一次对照检查。
- 评估患者的一般状况。
- 测量患者的体温。
- 根据 NRS 量表对 UAE 后的疼痛进行评分。使用 PAC。
- 评估插入血管导管的伤口。
- 进行全血细胞计数 (FBC) 和凝血功能检查。
- 进行 TVUS 以评估 UAE 后盆腔器官的状况。
- 使用体积探针进行 3D TVUS,以评估肌瘤的体积和血管形成指数(VI、FI 和 VFI)。
- 如果没有并发症,并且口服镇痛药控制了栓塞后疼痛,则让患者出院回家。
- 告知患者,如果住院后出现发热、腹痛和脓性阴道分泌物,患者应立即就医。
- 在 UAE 后 3 个月进行下一次对照访问。
- 进行妇科检查、全血细胞计数 (FBC) 检测以及 AMH 或 FSH 血清水平。
- 进行 MRI 或 TVUS 以评估 UAE 后盆腔器官的状况(图19)。
- 使用体积探针进行 3D TVUS,以评估肌瘤的体积和血管形成指数(VI、FI 和 VFI)。
- 在 UAE 后 6 个月进行最后一次对照访问。
- 进行妇科检查、全血细胞计数 (FBC) 检测以及 AMH 或 FSH 血清水平。
- 进行 TVUS 以评估 UAE 后盆腔器官的状况。
- 使用体积探针进行 3D TVUS,以评估肌瘤的体积和血管形成指数(VI、FI 和 VFI)。
- 评估 UAE 的有效性。
- 比较 UAE 前后的 CBC 测试结果。
- 比较 UAE 前后肌瘤(VI、FI 和 VFI)的体积和血管形成指数。
- 比较 UAE 前后的血清 AMH 或 FSH 水平,以评估 UAE 期间“非靶向”栓塞导致卵巢医源性损伤的可能性。
- 告知患者子宫动脉栓塞后,应定期接受妇科检查。
- 在选定的病例中(肌瘤症状没有减轻、疑似组织分界或其他附加检查有疑问),在 UAE 后一年进行 MRI(图20)。
结果
557 年至 2009 年期间进行了 2019 例阿联酋手术。患者的平均年龄为 38 岁 (31-53 岁)。547 例患者 (98.2%) 取得了技术成功。
2009 年至 2013 年期间,206 名年龄为 32 至 52 岁 (平均年龄: 39 岁) 的患者在进行 UAE 手术后 3 个月肌瘤体积 (MRI 体积评估) 的平均减少为 62%。最小的减少为 9% (透明化肌瘤患者)。分离性粘膜下肌瘤患者 (FIGO 0) 达到完全复位 (100%)。90% 的患者在 UAE 手术后表示满意64。
一组 65 名年龄为 29-52 岁(平均年龄:43.1 岁)的患者在 UAE(超声 VOCAL 体积评估)后 3 个月肌瘤体积平均减少 50.1% (2.7%-93.5%)。在 UAE 手术之前,中位肌瘤体积为 101 cm3 (范围为 23.6 至 610.0 cm3),而 3 个月后,观察到中位肌瘤体积减少至 50.4cm3 (范围为 6.9 至 193.9 cm3)。Spearman 相关检验显示初始显性肌瘤体积和体积减少百分比之间存在统计学意义但相对较弱的正相关 (R = 0.33;p = 0.006)。有趣的是,较小的肌瘤在 UAE 后 3 个月表现出肌瘤体积减少的很大变异性,而较大的肌瘤对 UAE72 表现出稳定、可预测的反应。
观察到 UAE 后 3 个月 17 例患者多普勒血管指数 (VI 、 FI 和 VFI) 降低。VI 和 VFI 的百分比降低为 95.4%,而 FI 的降低百分比为 58.3%75。
对 30 名年龄在 33-40 岁 (平均年龄: 35) 之间的患者进行了卵巢储备评估 UAE 后 3 个月。平均显性肌瘤体积为 107.75 cm3 (范围为 87.4 至 131.1 cm3)。研究了卵巢储备的以下标志物: 窦卵泡计数 (AFC) 、 AMH 、抑制素 B (INHB) 、 FSH 和雌二醇 (E2)。观察到 AFC (56.7%;p < 0.001)、AHM (36.7%;p < 0.001)、INHB (46.7%;p < 0.001) 和 E2 (43.3%;p < 0.001) 显著降低。同时,观察到 FSH 血清水平显着升高 (43.4%;p < 0.001)65。
UAE 手术后 3 个月,在两名粘膜下肌瘤 (FIGO 0) (直径为 6 cm 和 8 cm) 患者中,观察到子宫内翻,肌瘤的明显坏死碎片通过宫颈管排泄,导致紧急子宫切除术。
在 UAE 手术后的第二天,在 NRS 量表上评估了 60 名患者使用 PCA(UAE 方案后患者护理的程序 4.2)栓塞后疼痛减轻(根据 PAC)。UAE 后 NRS 的中位数为 10(范围 5-10),而治疗后的中位 NRS 评分为 4(范围 1-5)。子宫肌瘤初始体积(中位数 194.5 cm3,范围 79-411 cm3)与 UAE 后立即进行的 NRS 之间的 Spearman 相关性测试显示具有统计学意义的强正相关 (R = 0.6;p < 0.001),而治疗后肌瘤初始体积与 NRS 之间的相关性显示具有统计学意义的弱正相关 (R = 0.34;p < 0.001)。分析上述关系,可以得出结论,UAE 后大肌瘤会导致 UAE 后栓塞后疼痛更强。然而,使用 PCA 治疗较小肌瘤 UAE 后栓塞后疼痛效果更好。
表 1 提供了代表性结果的汇总数据。

图 1:FIGO 子宫肌瘤分类。请单击此处查看此图的较大版本。

图 2:使用经阴道超声扫描进行盆腔检查。
可见尺寸为 73 x 50 x 55 毫米的子宫肌瘤 (FIGO 5)。 请 点击此处查看此图的较大版本。

图 3:阿联酋资格预审中的盆腔 MRI 检查。
在矢状面上可见一个大的子宫肌瘤 (FIGO 2-5),具有占位效应。 请单击此处查看此图的较大版本。
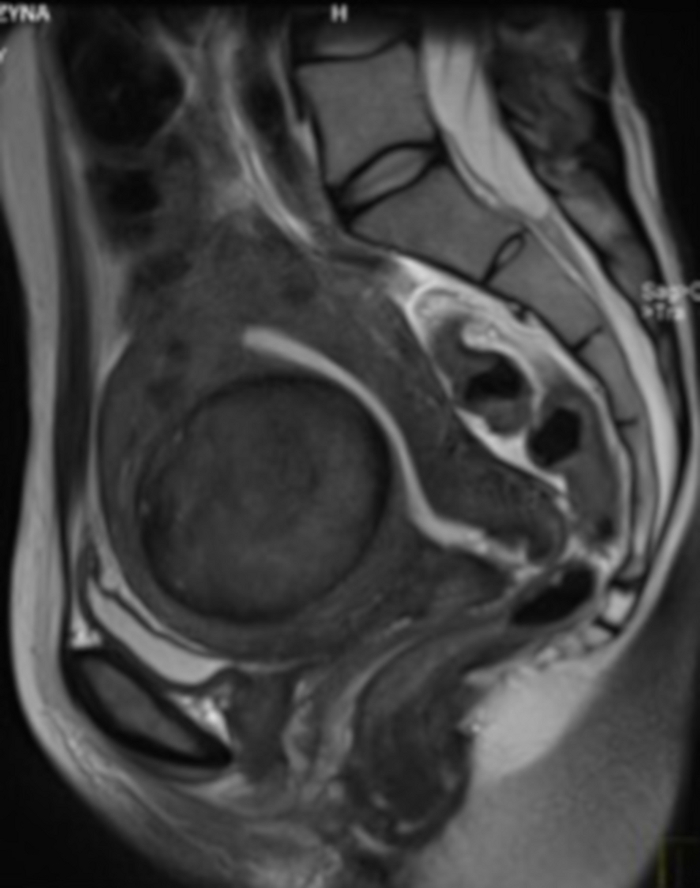
图 4:阿联酋资格预审中的盆腔 MRI 检查。
在矢状切片中可见子宫肌瘤 (FIGO 2-5)。 请单击此处查看此图的较大版本。
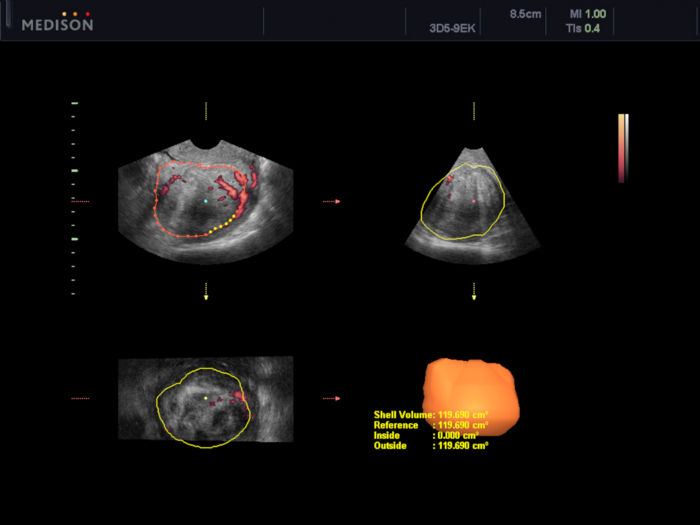
图 5:使用 VOCAL 软件评估子宫肌瘤的体积。
在这种情况下,体积估计为 119.7 cm3。 请单击此处查看此图的较大版本。

图 6:使用 VOCAL 软件评估子宫肌瘤的血管形成。
在这种情况下,计算了血管形成指数 (VI 4.85 、 FI 25.38 和 VFI 1.23 )。 请单击此处查看此图的较大版本。

图 7:图片显示了血管造影实验室的片段。
在左下角,腹股沟外露的患者,通过它引入了更多工具。在左上角,可以看到血管造影的 C 臂。在右上角,可以看到监视器,作员可以在其中跟踪输入工具。 请单击此处查看此图的较大版本。

图 8:一组动脉穿刺。
从底部开始:一根针、一个带有导引器的血管锁和一个导向器。 请单击此处查看此图的较大版本。
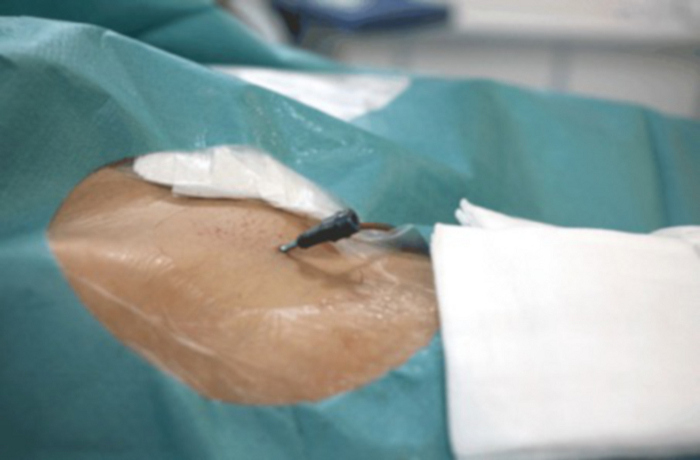
图 9:腹股沟特写,可见血管锁插入股动脉。请单击此处查看此图的较大版本。

图 10:左侧是放置在腹主动脉中的导管的血管造影。
子宫肌瘤的可见血管承载。为了进行比较(右侧),在 UAE 之后执行的控制测试。 请单击此处查看此图的较大版本。

图 11:使用放置在子宫动脉近端的 RUC 导管进行选择性血管造影。
子宫肌瘤的可见血管床。 请单击此处查看此图的较大版本。
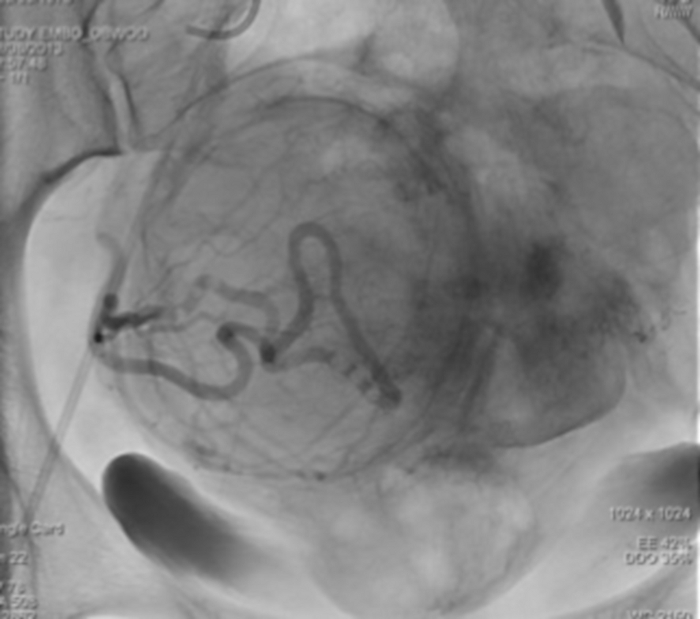
图 12:单张 X 射线成像显示造影剂在右侧子宫动脉中的停滞。请单击此处查看此图的较大版本。
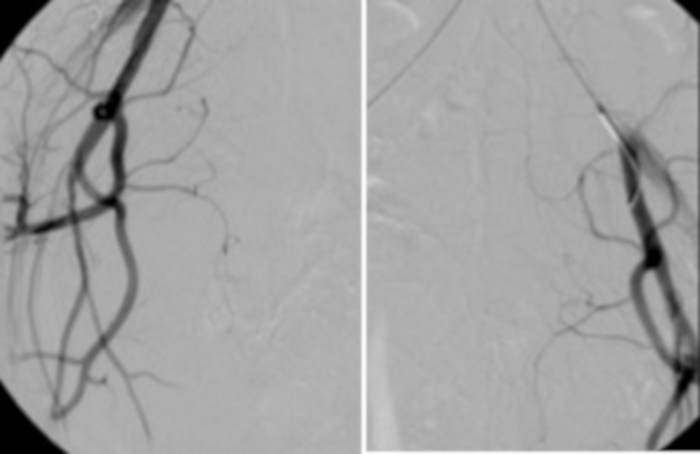
图13:从分别位于左髂动脉和右髂动脉的主导管进行的对照血管造影证实缺乏新鲜血液流入子宫动脉(阴影)。请单击此处查看此图的较大版本。
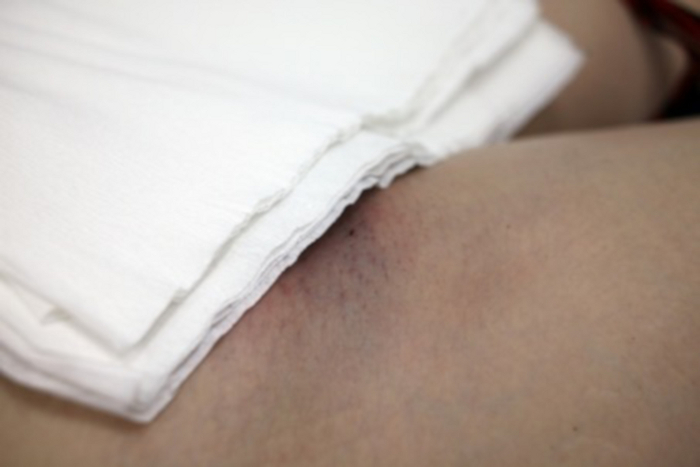
图 14:UAE 建成后的血管通路部位。
右腹股沟附近可见 2 毫米切口。 请单击此处查看此图的较大版本。

图 15:UAE 治疗后栓塞后疼痛的 PCA 泵参数设置(UAE 方案后的患者护理第 4.2.3 节)。请单击此处查看此图的较大版本。

图 16:运行中的 PCA 泵。
按需静脉推注与“空推注”(阿联酋方案后的患者护理第 4.2.6.2 节)的比例为 1:1 (50%:50%)。 请单击此处查看此图的较大版本。

图 17:运行中的 PCA 泵。
按需静脉推注与“空推注”(阿联酋方案后的患者护理第 4.2.6.3 节)的比例为 1:2 (33%:67%)。这需要额外的镇痛治疗(程序 4.2.6.4. UAE 协议后的患者护理)。 请单击此处查看此图的较大版本。

图 18:运行中的 PCA 泵。
按需静脉推注与“空推注”(阿联酋方案后的患者护理第 4.2.6.3 节)的比例为 1:3 (25%:75%)。这需要继续额外的镇痛治疗(程序 4.2.6.4. UAE 协议后的患者护理)。 请单击此处查看此图的较大版本。

图 19:UAE 手术后 3 个月的盆腔 MRI 检查(与图 3 中的情况相同)。
在矢状面上可见的是子宫肌瘤 (FIGO 5),明显小于手术前,肌瘤组织的密度不同。 请单击此处查看此图的较大版本。
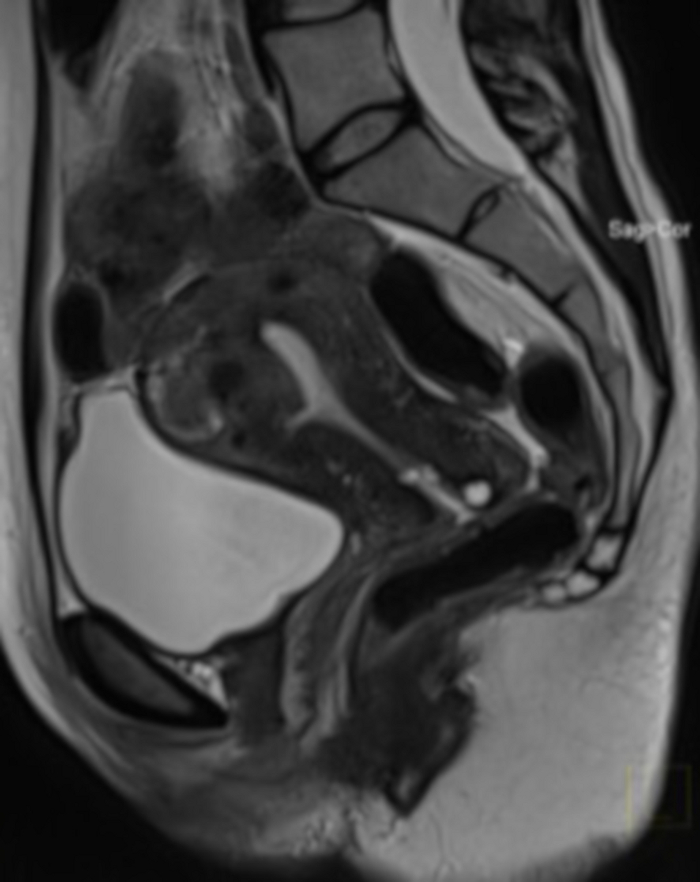
图 20:UAE 手术后 1 年的盆腔 MRI 检查(与 图 4 中的情况相同)。
在矢状面上可见子宫肌瘤 (FIGO 2-5),UAE 后体积减少非常大。由于手术后怀疑组织划定,因此进行了 MRI (在双合诊检查中无法评估肌瘤结构)。 请单击此处查看此图的较大版本。
| 代表性结果 / 《卢布林议定书》 64,65,72 | ||
| 2009 年至 2019 年期间执行的阿联酋手术数量 | 557 | |
| 技术成功 | 547 名患者 (98.2%) 实现 | |
| UAE 后 3 个月,206 名年龄为 32 至 52 岁 (平均年龄 - 39 岁) 的患者子宫肌瘤体积的平均减少(MRI 体积评估) | 62.0% (9.0-100.0%) | |
| UAE 后 3 个月,65 名年龄为 29-52 岁的患者(平均年龄 - 43.1 岁)肌瘤体积的平均减少(超声 VOCAL 体积评估) | 50.1% (2.7-93.5%) | |
| 卵巢储备评估 | AFC 降低 | 56.7% (p<0.001) |
| AMH 降低 | 36.7% (p<0.001) | |
| INHB 降低 | 46.7% (p<0.001) | |
| E2 减少 | 43.3% (p<0.001) | |
| FSH 增加 | 43.4% (p<0.001) | |
| 在 60 名患者中评估使用 PCA(“阿联酋后的患者护理”方案的程序 2.)栓塞后疼痛减轻(根据 PAC) | 阿联酋之后的 NRS 中位数 | 10(范围 5-10) |
| 阿联酋次日的 NRS 中位数 | 4(范围 1-5) | |
表 1:根据 Lublin 方案进行的 UAE 技术治疗症状性子宫肌瘤的代表性结果。
讨论
由于子宫肌瘤的结构、大小、定位和症状的差异,创建统一的阿联酋方案并非易事。这种治疗方法的假设与患者的期望存在许多差异,无论是在合格阶段还是在治疗效果方面。不止一次,转诊到 UAE 的患者没有报告任何肌瘤的临床症状,并且不知道这些子宫肿瘤不会被彻底切除。唯一明确的期望是无需手术即可摆脱肌瘤。
因此,重要的是患者理解这种方法的假设,接受它,并了解子宫肌瘤治疗替代方法的差异。她的有意识选择(阿联酋资格认证协议第 1.1 节)是一个关键点,其正确实施将使协议得以继续。
在协议实施过程中,会重复一些过程。这是本期刊采用的公式的预期和结果,其中各个命令以命令式模式编写并指向一个人。但是,几名医生经常参与资格认证、准备和其他阿联酋阶段。这些也是协议的关键点;它们的遗漏可能会导致 UAE 处于非最佳条件或存在禁忌症。因此,该协议分为 5 章。这允许它由不同的专家继续进行,然后独立检查重复的协议点。
在子宫肌瘤治疗中制定子宫动脉栓塞术统一方案的另一个困难是目前与同一手术相关的大量建议(多达 11 条)41。尽管他们的假设相似,但一如既往,“魔鬼在细节中”,哪些细节需要统一。在资格认证期间,关于肌瘤位置的相对禁忌症或接受 UAE 的患者的生殖计划是最具争议的。应用 SOGC 提出的更严格的标准,患者应被排除在该程序之外,而更宽松的 RCOG 建议允许符合阿联酋 14,32,43 的资格。问题是该怎么办。在方案创建过程中,我们根据对我们的病例和获得的经验的分析做出决定(除了广泛的文献),这需要对每位患者采取单独的方法。因此,该方案并不排除 UAE 在有相对禁忌症的患者中的表现(UAE 方案资格的第 1.4 节)。阿联酋的正确资格和准备似乎是治疗成功的关键。该技术本身也非常重要,阿联酋护理也非常重要,它不仅可以确保治疗成功或患者满意度,还可以确保没有上述并发症。
无论肌瘤的数量如何,所有病变都在一次手术中栓塞。通常,肌瘤越多,注射的栓塞材料就越多。这会延长栓塞的持续时间,但不会改变手术过程。如果我们看到与卵巢动脉有明显的连接,则可以修改 UAE,这可能会导致非目标栓塞的风险增加。然后,我们可以关闭这样的连接(例如,使用线圈),从而分离卵巢和子宫的供应,然后使用 700 μm 颗粒继续栓塞。如果无法植入线圈,那么我们将颗粒直径增加到 900 μm。
在某些情况下,肌瘤可以从卵巢动脉一侧供血;然后,子宫动脉发育不全。在这些情况下,为了成功进行栓塞,应将微导管插入卵巢动脉并穿过卵巢,将栓塞材料沉积到子宫血管床中,同时保持适当的卵巢供应。
栓塞术无疑的优势在于它不是一个技术难度大的手术,也不需要复杂的设备。
该方案的强项是关于栓塞后疼痛治疗的要点,至少有一半的患者在获得 UAE 资格时没有听说过。我们建议的标准程序是使用 PCA 泵(阿联酋协议后的患者护理第 4.2 节),获得的结果证实了这种治疗的高效性。
关于对阿联酋协议的未来修改,似乎可以更改准备阿联酋协议的第 10 节,由于存在炎症和败血症的风险,该节要求在手术前从子宫中取出宫内节育器。在大型随访研究中,骨盆感染和宫内节育器存在的风险低于 1/130049。
自首次使用以来,UAE 一直被视为一种实验方法,因为它需要评估有效性并检查该程序在短期和长期内可能产生的并发症。在这些年里,根据新的测试结果和临床观察,对适应症和禁忌症进行了修改。目前的数据,包括几项随机对照研究,认为 UAE 是治疗症状性子宫肌瘤的有价值的方法,其有效性和安全性已得到充分证实。
上述协议的创建是由于对当前文献、相关建议和十年来妇科医生和外科放射科医生密切合作而获得的经验的全面分析。
披露声明
作者没有什么可披露的。
陈述:
Piotr Szkodziak 作为 图 1 的作者,说明了 FIGO 子宫肌瘤分类,允许将该图免费用于科学和教育应用,无需任何修改。作者应接受修改图的意图 (piotr.szkodziak@gmail.com)。
致谢
作者要感谢卢布林医科大学妇科和介入放射学和神经放射学系第 3 任主席和介入放射学和神经放射学系的整个团队,感谢他们在实施子宫动脉栓塞卢布林方案方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 2% lignocaine in an ampoule | Intended for interventional radiologist (section 3) | ||
| Access to Angio Suite for Minimally Invasive Vascular Surgery | Intended for interventional radiologist (section 3) | ||
| Angiogarfic set | Balton | INT5F | (5 Fr sheath, needle, guidewire) Intended for interventional radiologist (section 3) |
| Angiografic kit | Panep | 44000291 | (Sterile Disposable Angiography DRAPE) Intended for interventional radiologist (section 3) |
| Cervical (PAP) smear kit | Intended only for the gynecologist (section 1) | ||
| Diagnostic lab (possibility to use) | Necessary to perform laboratory tests (section 1, 2 and 5) | ||
| Disinfectant | Intended for interventional radiologist (section 3) | ||
| Dressings | Intended for interventional radiologist (section 3) | ||
| Embozene 700 μm | Varian Medical | 17020-SI | (Particles) Intended for interventional radiologist (section 3) |
| Epidural anesthesia kit | Intended only for the anesthesiologist (section 3 and 4) | ||
| Equipment for gynecological examination | Intended only for the gynecologist (section 1 and 2) | ||
| Intravaginal antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous antibiotic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Intravenous nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Morphine in ampoules | Intended for interventional radiologist and gynecologist or vascular surgeons (section 3, 4) | ||
| MRI lab (possibility to use) | Intended for interventional radiologist (section 1 and 2) | ||
| Oral anxiolytic | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Oral Furazidin | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Oral Paracetamol or nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Pain Assessment Card | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Patient Controlled Analgesia Pump | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Progreate Microcathete PROGREA 2.7 Fr x 130 cm STR w/Marker + GW 100 mm x 2.7 Fr | Terumo | MC-PE27131 | (Microcatheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS GUIDE WIRE M Standard Angled 0.032”/0.81 mm 180 cm 30 mm flex | Terumo | RF-GA32183M | (Guidewire) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm Cobra 2 Middle SH0 | Terumo | RH-AB55108M | (Catheter) Intended for interventional radiologist (section 3) |
| RADIFOCUS OPTITORQUE 5 Fr x 80 cm UFE Type 1 19 SH0 | Terumo | RH-AUB5108M | (Catheter) Intended for interventional radiologist (section 3) |
| Rectal nonsteroidal anti-inflammatory drug | Intended for the gynecologist or vascular surgeons (section 2, 4) | ||
| Shaving kit | Intended for the gynecologist or vascular surgeons (section 2) | ||
| Single-use Endometrial Biopsy Kit | Intended only for the gynecologist (section 1) | ||
| Solution of 0,9% NaCl | Intended for the gynecologist or vascular surgeons (section 4) | ||
| Ultrasound machine with 3D-transvaginal probe | Intended only for the gynecologist (section 2 and 5) | ||
| Ultrasound machine with transvaginal probe | Intended only for the gynecologist (section 1 and 2) |
参考文献
- Tinelli, A., et al. Myoma pseudocapsule: A distinct endocrino-anatomical entity in gynecological surgery. Gynecological Endocrinology. 25 (10), 661-667 (2009).
- Tinelli, A., et al. Myomas: anatomy and related issues. Minerva Ginecologica. 68 (3), 261-273 (2016).
- Laganà, A. S., et al. Epigenetic and genetic landscape of uterine leiomyomas: a current view over a common gynecological disease. Archives of Gynecology and Obstetrics. 296 (5), 855-867 (2017).
- Vanharanta, S., et al. Distinct expression profile in fumarate-hydratase-deficient uterine fibroids. Human Molecular Genetics. 15 (1), 97-103 (2006).
- Hug, K., et al. Physical mapping of the uterine leiomyoma t(12;14)(q13-15;q24.1) breakpoint on chromosome 14 between SPTB and D14S77. Genes, Chromosomes & Cancer. 11 (4), 263-266 (1994).
- Ozisik, Y. Y., et al. Cytogenetic findings in a symplastic leiomyoma. Cancer Genetics and Cytogenetics. 67 (1), 79-80 (1993).
- Ozisik, Y. Y., Meloni, A. M., Surti, U., Sandberg, A. A. Deletion 7q22 in uterine leiomyoma. A cytogenetic review. Cancer Genetics and Cytogenetics. 71 (1), 1-6 (1993).
- Sparic, R., Mirkovic, L., Malvasi, A., Tinelli, A. Epidemiology of uterine myomas: A review. International Journal of Fertility and Sterility. 9 (4), 424-435 (2016).
- Stewart, E. A. Uterine fibroids. Lancet. 357 (9252), 293-298 (2001).
- Williams, A. R. W. Uterine fibroids - what's new. F1000Research. 6, 2109 (2017).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Al-Hendy, A., Myers, E. R., Stewart, E. Uterine fibroids: burden and unmet medical need. Seminars in Reproductive Medicine. 35 (6), 473-480 (2017).
- de la Cruz, M. S. D., Buchanan, E. M. Uterine fibroids: Diagnosis and treatment. American Family Physician. 95 (2), 100-107 (2017).
- Vilos, G. A., et al. The management of uterine leiomyomas. Journal of Obstetrics and Gynaecology Canada. 37 (2), 157-178 (2015).
- Stewart, E. A. Uterine fibroids. The New England Journal of Medicine. 372 (17), 1646-1655 (2015).
- Sabry, M., Al-Hendy, A. Medical treatment of uterine leiomyoma. Reproductive sciences (Thousand Oaks, Calif.). 19 (4), 339-353 (2012).
- Istre, O. Management of symptomatic fibroids: conservative surgical treatment modalities other than abdominal or laparoscopic myomectomy. Best Practice & Research. Clinical Obstetrics & Gynaecology. 22 (4), 735-747 (2008).
- Donnez, J., Dolmans, M. M. Uterine fibroid management: from the present to the future. Human Reproduction Update. 22 (6), 665-686 (2016).
- Rogers, T. S., Bieck, A. M. Management of Uterine Fibroids. American Family Physician. 99 (5), (2019).
- Chwalisz, K., Taylor, H. Current and Emerging Medical Treatments for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 510-522 (2017).
- Saridogan, E. Surgical treatment of fibroids in heavy menstrual bleeding. Women's Health. 12 (1), 53-62 (2016).
- Fritton, K., Borahay, M. A. New and Emerging Therapies for Uterine Fibroids. Seminars in Reproductive Medicine. 35 (6), 549-559 (2017).
- Ciavattini, A., et al. Hypovitaminosis D and "small burden" uterine fibroids: Opportunity for a Vitamin D supplementation. Medicine (Baltimore). 95 (52), (2016).
- Friend, D. R. Drug delivery for the treatment of endometriosis and uterine fibroids. Drug Delivery and Translational Research. 7 (6), 829-839 (2017).
- Donnez, J., Courtoy, G. E., Dolmans, M. M. Fibroid management in premenopausal women. Climacteric: The Journal of the International Menopause Society. 22 (1), 27-33 (2019).
- Maksym, R. B., Wierzba, W., Baranowski, W. E. P23.06: The feasibility of uterine fibroid treatment with advanced ultrasound-guided HIFU system: preliminary report. Ultrasound in Obstetrics & Gynecology. 48, 242 (2016).
- Lee, J. S., Hong, G. Y., Lee, K. H., Song, J. H., Kim, T. E. Safety and efficacy of ultrasound-guided high-intensity focused ultrasound treatment for uterine fibroids and adenomyosis. Ultrasound in Medicine and Biology. 45 (12), 3214-3221 (2019).
- Burbank, F. History of uterine artery occlusion and subsequent pregnancy. American Journal of Roentgenology. 192 (6), 1593-1600 (2009).
- Sack, R. A. Bilateral internal iliac (hypogastric) artery ligation to control obstetric and gynecologic hemorrhage. A ten-year review at the community hospital level. American Journal of Obstetrics and Gynecology. 116 (4), 493-497 (1973).
- Brown, B. J., Heaston, D. K., Poulson, A. M., Gabert, H. A., Mineau, D. E., Miller, F. J. Uncontrollable postpartum bleeding: A new approach to hemostasis through angiographic arterial embolization. Obstetrics and Gynecology. 54 (3), 361-365 (1979).
- Heaston, D. K., Mineau, D. E., Brown, B. J., Miller, F. J. Transcatheter arterial embolization for control of persistent massive puerperal hemorrhage after bilateral surgical hypogastric artery ligation. American Journal of Roentgenology. 133 (1), 152-154 (1979).
- Royal College of Obstetricians and Gynaecologists Clinical recommendations on the use of uterine artery embolization (UAE) in the management of fibroids. Royal College of Radiologists Available from: https://www.rcog.org.uk/globalassets/documents/guidelines/23-12-2013_rcog_rcr_uae.pdf (2013)
- Ravina, J. H., et al. Arterial embolization to treat uterine myomata. The Lancet. 346 (8976), 671-672 (1995).
- Goodwin, S. C., Vedantham, S., McLucas, B., Forno, A. E., Perrella, R. Preliminary experience with uterine artery embolization for uterine fibroids. Journal of Vascular and Interventional Radiology. 8 (4), 517-526 (1997).
- Kohi, M. P., Spies, J. B. Updates on uterine artery embolization. Seminars in Interventional Radiology. 35 (1), 48-55 (2018).
- Gupta, J. K., et al. Cochrane Database of Systematic Reviews Uterine artery embolization for symptomatic uterine fibroids (Review). Cochrane Database of Systematic Reviews. (12), (2014).
- Naredi, N., Bhattacharyya, T. K. Uterine Artery Embolization: A Nonsurgical Cure for Fibroids. South Asian Federation of Obstetrics and Gynecology. 1 (3), (2009).
- Memtsa, M., Homer, H. Complications associated with uterine artery embolization for fibroids. Obstetrics and Gynecology International. 2012 (290542), 1-5 (2012).
- Dutton, S., Hirst, A., McPherson, K., Nicholson, T., Maresh, M. A UK multicentre retrospective cohort study comparing hysterectomy and uterine artery embolization for the treatment of symptomatic uterine fibroids (HOPEFUL study): Main results on medium-term safety and efficacy. BJOG: An International Journal of Obstetrics and Gynaecology. 114 (11), 1340-1351 (2007).
- Heavy menstrual bleeding: assessment and management (CG44). Nice guidelines. National Collaborating Centre for Women's and Children's Health (UK) Available from: https://www.nice.org.uk/guidance/cg44 (2007)
- Chen, H. T., Athreya, S. Systematic review of uterine artery embolization practice guidelines: are all the guidelines on the same page. Clinical Radiology. 73 (5), 507 (2018).
- American College of Obstetricians and Gynecologists. American College of Obstetricians and Gynecologists ACOG practice bulletin. Alternatives to hysterectomy in the management of leiomyomas. Obstetrics and Gynecology. 112 (2), 387-400 (2008).
- Carranza-Mamane, B., et al. The Management of Uterine Fibroids in Women With Otherwise Unexplained Infertility. Journal of Obstetrics and Gynaecology Canada. 37 (3), 277-285 (2015).
- Wozniak, S., Czuczwar, P., Szkodziak, P. R., Pyra, K., Paszkowski, T. EP26.01: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of adenomyosis: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 381 (2017).
- Szkodziak, P. R., Wozniak, S., Czuczwar, P., Wrona, W., Trzeciak, K., Paszkowski, T. OP24.04: Value of "elasto strain ratio" ultrasound elastography in the diagnosis of intramural uterine fibroids: preliminary study. Ultrasound in Obstetrics & Gynecology. 50, 126 (2017).
- Popovic, M., Puchner, S., Berzaczy, D., Lammer, J., Bucek, R. A. Uterine artery embolization for the treatment of adenomyosis: A review. Journal of Vascular and Interventional Radiology. 22 (7), 901-909 (2011).
- de Bruijn, A. M., et al. Uterine Artery Embolization for the Treatment of Adenomyosis: A Systematic Review and Meta-Analysis. Journal of Vascular and Interventional Radiology. 28 (12), (2017).
- Bérczi, V., et al. Safety and Effectiveness of UFE in Fibroids Larger than 10 cm. CardioVascular and Interventional Radiology. 38 (5), 1152-1156 (2015).
- Stępniak, A. Uterine artery embolization in the treatment of symptomatic fibroids - State of the art 2018. Przeglad Menopauzalny. 17 (4), 141-143 (2018).
- Czuczwar, P., et al. The influence of uterine artery embolization on ovarian reserve, fertility, and pregnancy outcomes - A review of literature. Przeglad Menopauzalny. 15 (4), 205-209 (2016).
- Firouznia, K., Ghanaati, H., Sanaati, M., Jalali, A. H., Shakiba, M. Pregnancy after uterine artery embolization for symptomatic fibroids: A series of 15 pregnancies. American Journal of Roentgenology. 192 (6), 1588-1592 (2009).
- Bonduki, C. E., et al. Pregnancy after uterine arterial embolization. Clinics. 66 (5), 807-810 (2011).
- Yeaton-Massey, A., Loring, M., Chetty, S., Druzin, M. Uterine rupture after uterine artery embolization for symptomatic leiomyomas. Obstetrics and Gynecology. 123 (2), 418-420 (2014).
- Takahashi, H., Hayashi, S., Matsuoka, K., Kitagawa, M. Placenta accreta following uterine artery embolization. Taiwanese Journal of Obstetrics and Gynecology. 49 (2), 197-198 (2010).
- Takeda, J., et al. Spontaneous uterine rupture at 32 weeks of gestation after previous uterine artery embolization. Journal of Obstetrics and Gynaecology Research. 40 (1), 243-246 (2014).
- Practice Committee of American Society for Reproductive Medicine in collaboration with Society of Reproductive Surgeons. Myomas and reproductive function. Fertility and Sterility. 90 (5), 125-130 (2008).
- Leibsohn, S., d'Ablaing, G., Mishell, D. R., Schlaerth, J. B. Leiomyosarcoma in a series of hysterectomies performed for presumed uterine leiomyomas. American Journal of Obstetrics and Gynecology. 162 (4), 968-976 (1990).
- Parker, W. H., Fu, Y. S., Berek, J. S. Uterine sarcoma in patients operated on for presumed leiomyoma and rapidly growing leiomyoma. Obstetrics and Gynecology. 83 (3), 414-418 (1994).
- Ricci, S., Stone, R. L., Fader, A. N. Uterine leiomyosarcoma: Epidemiology, contemporary treatment strategies and the impact of uterine morcellation. Gynecologic Oncology. 145 (1), 208-216 (2017).
- Felix, A. S., et al. The etiology of uterine sarcomas: A pooled analysis of the epidemiology of endometrial cancer consortium. British Journal of Cancer. 108 (3), 727-734 (2013).
- Roberts, M. E., Aynardi, J. T., Chu, C. S. Uterine leiomyosarcoma: A review of the literature and update on management options. Gynecologic Oncology. 151 (3), 562-572 (2018).
- Schieda, N., et al. Gadolinium-Based Contrast Agents in Kidney Disease: A Comprehensive Review and Clinical Practice Guideline Issued by the Canadian Association of Radiologists. Canadian Journal of Kidney Health and Disease. 5, 1-17 (2018).
- Pyra, K., et al. Uterine artery embolization for the treatment of symptomatic uterine fibroids. (Embolizacja tętnic macicznych w leczeniu objawowych mięśniaków macicy). Postępy Nauk Medycznych. 28 (2), 88-94 (2015).
- Czuczwar, P., Stepniak, A., Milart, P., Paszkowski, T., Wozniak, S. Comparison of the influence of three fibroid treatment options: Supracervical hysterectomy, ulipristal acetate and uterine artery embolization on ovarian reserve - An observational study. Journal of Ovarian Research. 11 (1), (2018).
- Nocum, D. J., Robinson, J., Liang, E., Thompson, N., Reed, W. The factors contributing to the total radiation exposure of patients during uterine artery embolization. Journal of Medical Radiation Sciences. 66 (3), 200-211 (2019).
- Nikolic, B., Spies, J. B., Lundsten, M. J., Abbara, S. Patient radiation dose associated with uterine artery embolization. Radiology. 214 (1), 121-125 (2000).
- Colgan, T. J., et al. Pathologic features of uteri and leiomyomas following uterine artery embolization for leiomyomas. The American Journal of Surgical Pathology. 27 (2), 167-177 (2003).
- Weichert, W., et al. Uterine arterial embolization with tris-acryl gelatin microspheres: a histopathologic evaluation. The American Journal of Surgical Pathology. 29 (7), 955-961 (2005).
- Walker, W. J., Pelage, J. P. Uterine artery embolization for symptomatic fibroids: clinical results in 400 women with imaging follow up. BJOG An International Journal of Obstetrics and Gynaecology. 109 (11), 1262-1272 (2002).
- Ravina, J. H., Aymard, A., Ciraru-Vigneron, N., Clerissi, J., Merland, J. J. Uterine fibroids embolization: results about 454 cases. Gynécologie, Obstétrique & Fertilité. 31 (7-8), 597-605 (2003).
- Czuczwar, P., et al. Predicting the results of uterine artery embolization: Correlation between initial intramural fibroid volume and percentage volume decrease. Przeglad Menopauzalny. 13 (4), 247-252 (2014).
- Lohle, P. N. M., et al. Long-term Outcome of Uterine Artery Embolization for Symptomatic Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (3), 319-326 (2008).
- Walker, W. J., Barton-Smith, P. Long-term follow up of uterine artery embolization - An effective alternative in the treatment of fibroids. BJOG: An International Journal of Obstetrics and Gynaecology. 113 (4), 464-468 (2006).
- Czuczwar, P., et al. Influence of ulipristal acetate therapy compared with uterine artery embolization on fibroid volume and vascularity indices assessed by three-dimensional ultrasound: Prospective observational study. Ultrasound in Obstetrics and Gynecology. 45 (6), 744-750 (2015).
- Van Der Kooij, S. M., et al. Epidural analgesia versus patient-controlled analgesia for pain relief in uterine artery embolization for uterine fibroids: A decision analysis. CardioVascular and Interventional Radiology. 36 (6), 1514-1520 (2013).
- Pisco, J. M., et al. Pelvic Pain after Uterine Artery Embolization: A Prospective Randomized Study of Polyvinyl Alcohol Particles Mixed with Ketoprofen versus Bland Polyvinyl Alcohol Particles. Journal of Vascular and Interventional Radiology. 19 (11), 1537-1542 (2008).
- Pisco, J. M., et al. Uterine Artery Embolization under Electroacupuncture for Uterine Leiomyomas. Journal of Vascular and Interventional Radiology. 20 (7), 863-870 (2009).
- Pelage, J. P., et al. Uterine embolization. Journal de Radiologie. 81 (12), 1873-1874 (2000).
- Pelage, J. P., et al. Uterine Fibroid Vascularization and Clinical Relevance to Uterine Fibroid Embolization. RadioGraphics. 25, 99-117 (2005).
- Siskin, G. P., et al. Outpatient uterine artery embolization for symptomatic uterine fibroids: Experience in 49 patients. Journal of Vascular and Interventional Radiology. 11 (3), 305-311 (2000).
- Salehi, M., Jalilian, N., Salehi, A., Ayazi, M. Clinical Efficacy and Complications of Uterine Artery Embolization in Symptomatic Uterine Fibroids. Global Journal of Health Science. 8 (7), (2015).
- Worthington-Kirsch, R., et al. The Fibroid Registry for outcomes data (FIBROID) for uterine embolization: Short-term outcomes. Obstetrics and Gynecology. 106 (1), 52-59 (2005).
- Paszkowski, T., et al. Uterine artery embolization - clinical problems. Polish Gynaecology. 84 (12), (2013).
- Spies, J. B., et al. Fibroid Registry Investigators. The FIBROID Registry: symptom and quality-of-life status 1 year after therapy. Obstetrics & Gynecology. 106 (6), 1309-1318 (2005).
- Chrisman, H. B., et al. The impact of uterine fibroid embolization on resumption of menses and ovarian function. Journal of Vascular and Interventional Radiology. 11 (6), 699-703 (2000).
- Maciel, C., Tang, Y. Z., Sahdev, A., Madureira, A. M., Vilares-Morgado, P. Preprocedural MRI and MRA in planning fibroid embolization. Diagnostic and Interventional Radiology. 23 (2), 163-171 (2017).
- Laughlin-Tommaso, S. K., et al. Clinical limitations of the International Federation of Gynecology and Obstetrics (FIGO) classification of uterine fibroids. International Journal of Gynecology and Obstetrics. 139 (2), 143-148 (2017).
- Vilos, G. A. Uterine fibroids: relationships to reproduction. Minerva Ginecologica. 55 (5), 417-423 (2003).
- McLucas, B. Pregnancy following uterine artery embolization: An update. Minimally Invasive Therapy and Allied Technologies. 22 (1), 39-44 (2013).
- Karlsen, K., Hrobjartsson, A., Korsholm, M., Mogensen, O., Humaidan, P., Ravn, P. Fertility after uterine artery embolization of fibroids: a systematic review. Archives of Gynecology and Obstetrics. 297 (1), 13-25 (2018).
- Margau, R., et al. Outcomes after Uterine Artery Embolization for Pedunculated Subserosal Leiomyomas. Journal of Vascular and Interventional Radiology. 19 (5), 657-661 (2008).
- Spies, J. B., et al. The FIBROID registry: Symptom and quality-of-life status 1 year after therapy. Obstetrics and Gynecology. 106 (6), 1309-1318 (2005).
- Avilla-Hernandez, A., Singh, P. Epidural Anesthesia - StatPearls - NCBI Bookshelf. Statpearls. , 1 (2019).
- Higgs, Z. C. J., Macafee, D. A. L., Braithwaite, B. D., Maxwell-Armstrong, C. A. The Seldinger technique: 50 Years on. Lancet. 366 (9494), 1407-1409 (2005).
- Seldinger, S. I. Catheter replacement of the needle in percutaneous arteriography: A new technique. Acta Radiologica. 39 (5), 368-376 (1953).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。