Method Article
Modelo pré-clínico de exposição pré-natal ao delta-9-tetrahidrocanabinol para avaliar seu impacto nos resultados do neurodesenvolvimento
Neste Artigo
Resumo
À medida que as restrições legislativas mudam, resultando em maior acessibilidade aos produtos canabinóides, é extremamente importante desenvolver modelos para estudar o impacto dessas exposições, principalmente durante a gravidez. Um modelo pré-clínico de exposição pré-natal moderada a canabinóides por meio de ingestão voluntária foi desenvolvido, permitindo investigações mais aprofundadas.
Resumo
A exposição pré-natal a canabinóides (PCE) está se tornando cada vez mais frequente à medida que mais estados nos Estados Unidos legalizam a maconha recreativa (canabinóides). O consumo de produtos canabinóides durante a gravidez tem sido associado a vários resultados anormais, embora estudos históricos tenham sido realizados durante uma época em que a potência desses produtos era aproximadamente 300% menor do que a dos produtos atuais. Dado o uso crescente de canabinóides, é essencial entender os impactos potenciais que o PCE pode ter no neurodesenvolvimento fetal e no subsequente desenvolvimento infantil e infantil. Estudos anteriores demonstraram que o PCE afeta negativamente o aprendizado e a memória, as habilidades comportamentais, o sono e a atenção na prole. O objetivo deste estudo é recapitular o PCE por meio da ingestão voluntária de delta-9-tetrahidrocanabinol (THC), o componente psicoativo dos produtos canabinóides, durante a gravidez em um modelo pré-clínico. Este artigo descreve o procedimento para alcançar PCE moderado durante a gestação. Neste modelo, o grupo de controle consome biscoitos simples de mini-chocolate / manteiga de amendoim, enquanto o grupo PCE consome THC misturado à manteiga de amendoim emparelhado com mini-biscoitos de chocolate. Essa abordagem permite uma investigação mais aprofundada sobre o impacto do PCE nos resultados do desenvolvimento.
Introdução
À medida que as taxas de uso pré-natal de produtos canabinóides aumentam1, provavelmente influenciadas pela crescente legalização de produtos canabinóides nos Estados Unidos, são necessários estudos para entender melhor seu impacto no desenvolvimento fetal. O delta-9-tetrahidrocanabinol (THC), o componente psicoativo dos produtos canabinóides, atravessa prontamente a placenta e interage com o sistema endocanabinóide endógeno 2,3. O sistema endocanabinoide endógeno desempenha um papel crítico no desenvolvimento neural e pode ser um caminho através do qual ocorrem alterações no desenvolvimento. O uso de canabinóides durante a gravidez tem sido associado à redução do peso ao nascer4 e ao aumento do risco de parto prematuro 5,6. Anormalidades adicionais no desenvolvimento, como déficits no comportamento social e nas funções executivas ao longo da vida, também foram relatadas 7,8,9.
Com o tempo, as mudanças na potência dos canabinóides e nos padrões de uso na população em geral destacaram a necessidade de estudos detalhados sobre os efeitos potenciais da exposição pré-natal no desenvolvimento fetal. O uso de produtos canabinóides durante a gravidez está aumentando, pois esses produtos são frequentemente percebidos como aliviadores de sintomas como depressão, estresse, dor, distúrbios do sono e náuseas10,11. Dickson et al.12 conduziram um estudo investigando recomendações de 400 dispensários de cannabis sobre o uso no primeiro trimestre no Colorado e descobriram que aproximadamente metade dos dispensários (50,5%) recomendava comestíveis para grávidas. Muitas vezes, percebe-se que os comestíveis evitam danos e riscos à saúde associados ao tabagismo13,14, o que resulta em muitas gestantes consumindo comestíveis.
Os comestíveis fornecem canabinóides através do sistema gastrointestinal, onde o THC é absorvido pela corrente sanguínea e transportado através da veia porta para o fígado para o metabolismo de primeira passagem. No fígado, as enzimas hidroxilam o THC para produzir 11-hidroxitetrahidrocanabinol (11-OH-THC), um metabólito psicoativo altamente potente que atravessa facilmente a barreira hematoencefálica15. Embora demore mais para o efeito psicoativo inicial dos comestíveis (30-90 min), o 'barato' resultante dura mais tempo, com um pico em 2-4 h após a ingestão16,17. A meia-vida farmacocinética do THC é de 1,3-7,3 h em ratos18,19.
Dada a crescente utilização durante a gravidez e a escassez de dados sobre seu impacto no neurodesenvolvimento fetal, foi desenvolvido um modelo pré-clínico de ingestão voluntária de THC durante a gravidez, alinhando-se mais de perto com o uso humano típico relatado (consumo oral para aliviar náuseas) para descrever melhor o impacto nos resultados do neurodesenvolvimento.
Protocolo
Todos os procedimentos descritos aqui foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Centro de Ciências da Saúde da Universidade do Novo México (UNM HSC). Todos os experimentos foram conduzidos de acordo com as diretrizes ARRIVE. Ratos Long-Evans (Blue Spruce, HsdBlu: LE) foram obtidos de uma fonte comercial. Os machos utilizados foram ratos reprodutores adultos comprovados, com 12 semanas de idade na chegada e 15-16 semanas de idade no início do protocolo de reprodução. As fêmeas pesavam 125-150 g e tinham aproximadamente 6-7 semanas de idade na chegada. No momento da reprodução, as fêmeas tinham aproximadamente 9 a 10 semanas de idade. É fundamental garantir que todas as mães em potencial não tenham histórico anterior de gravidez. Reserve pelo menos uma semana para aclimatação às instalações e ao novo ambiente de habitação. A primeira parte deste protocolo aborda o consumo de canabinóides pré-gravidez, enquanto a segunda parte se concentra na exposição a canabinóides na gravidez. Detalhes dos animais, reagentes e equipamentos usados são fornecidos na Tabela de Materiais. O desenho experimental é fornecido na Figura 1.
1. Exposição a canabinóides pré-gravidez
- Alojamento e manutenção
- Animais domésticos individualmente em gaiolas micro-isoladoras estáticas padrão para ratos com cama a 22 °C em um horário reverso de 12 horas de luz/escuridão (luzes acesas das 21:00 às 09:00 diariamente).
- Forneça acesso a alimentos irradiados (ver Tabela de Materiais) e água da torneira ad libitum durante todo o estudo.
- Preparação de materiais e produtos químicos
- Obtenha todos os materiais e produtos químicos necessários (conforme fornecido na Tabela de Materiais).
- Mantenha o THC de grau de pesquisa em frascos contendo 10 mg / mL ou 20 mg / mL de THC dissolvido em etanol.
NOTA: Use equipamento de proteção individual (EPI) adequado, pois o THC é irritante para a pele e um risco de aspiração. Fixe o THC em um gabinete de aço, pois é classificado como uma substância controlada da Tabela I pelo Departamento de Saúde e Serviços Humanos dos EUA e pela Food and Drug Administration dos EUA.
- Medições de linha de base
- Obtenha os pesos corporais basais para cada rato.
- Pause o experimento aqui por 1-2 semanas, se necessário.
- Preparação de biscoitos com infusão de THC
- Prepare os biscoitos 30 minutos antes da administração às 14:00 diariamente para manter horários de alimentação consistentes.
- Separe os mini biscoitos de chocolate e adicione aproximadamente meia colher de chá de manteiga de amendoim ao creme.
- Misture a dose necessária de THC (1,5 mg/kg nos primeiros 2 dias, seguida de 3 mg/kg por 7 dias) com a manteiga de amendoim antes de montar o biscoito.
- Avaliação de consumo
- Forneça uma manteiga de amendoim simples / mini biscoito de chocolate por 2-4 dias até que o consumo consistente seja alcançado. Remova a água da gaiola e administre a guloseima a cada rato usando uma pinça às 14:00 diariamente.
- Observe até que a guloseima seja completamente consumida. Remova os restos, se necessário.
NOTA: Administre THC na dose de 1,5 mg/kg por 2 dias, seguido de 3 mg/kg por 7 dias. Deixe as guloseimas na gaiola por até 2 h para ratos que não consomem imediatamente. - Continue apenas com ratos que apresentem consumo consistente de guloseimas. Remova aqueles com ingestão inconsistente do experimento.
- Avalie o consumo pré-gravidez por 2 semanas.
- Atribuição de grupo pós-PCE
- Atribua ratos com ingestão consistente aleatoriamente ao grupo de biscoitos simples (controle) ou com infusão de THC (PCE).
- Permita um mínimo de 4 dias sem cookies antes da reprodução para garantir a eliminação do THC de seus sistemas.
2. Exposição a canabinóides na gravidez (pré-natal)
- Confirmação de reprodução e gravidez
- Pese as fêmeas para obter um peso inicial antes de colocá-las em uma gaiola com um criador macho comprovado (o macho é ingênuo de THC).
- Certifique-se de que as ratas não consumam um biscoito durante esse período.
- Confirme a gravidez pela presença de um tampão vaginal, que normalmente ocorre 24 horas após o acasalamento.
- Pese a ratazana e devolva-a à gaiola de casa. Isso é definido como Dia Gestacional (GD) 1.
- Infusão de THC durante a gravidez
- Forneça um biscoito simples ou com infusão de THC (3 mg/kg) às 14:00 diariamente, começando no GD 1 durante a gravidez.
- Continue este regime até que a mãe esteja nidificando para o parto, momento em que a exposição ao THC é interrompida.
- Monitoramento do ganho de peso materno
- Pese as mães de ratos duas vezes por semana para avaliar o ganho de peso materno.
NOTA: Os novos pesos também são usados para calcular a quantidade de THC a ser incluída no biscoito, ajustando a dose conforme necessário com base no peso da mãe.
- Pese as mães de ratos duas vezes por semana para avaliar o ganho de peso materno.
- Cessação da exposição ao THC e documentação de nascimento
- Pare os procedimentos de exposição ao THC quando a barragem estiver nidificando no horário previsto de entrega.
- Assim que os filhotes nascerem, registre o número de filhotes vivos.
- Designe o dia do nascimento como dia pós-natal (P) 0.
- Desmame e alojamento da prole
- Desmame a prole no dia pós-natal (P) 23.
- Abriga em grupo a prole desmamada com irmãos de ninhada com base no sexo.
- Eutanásia de barragens
- Uma vez que a cama é desmamada, eutanasiar as mães seguindo protocolos aprovados institucionalmente.
3. Etapas pós-procedimento
- Alojamento e monitoramento da prole
- Certifique-se de que todos os filhotes sejam mantidos em condições de alojamento adequadas, garantindo temperatura, luz e ventilação adequadas.
- Monitore os filhotes regularmente em busca de problemas de saúde ou desenvolvimento, como peso corporal anormal ou atrasos no desenvolvimento.
- Avaliação inicial
- Se necessário, avalie as medidas basais, como peso corporal, reflexos ou outros parâmetros de desenvolvimento relevantes antes de iniciar experimentos com a prole.
- Trabalho experimental em grupo
- Atribua filhotes a grupos experimentais aleatoriamente para minimizar quaisquer vieses nos testes.
- Limite o número de filhotes usados por experimento a 1-2 filhotes de cada ninhada para reduzir os possíveis efeitos da ninhada.
Resultados
Para estabelecer o consumo voluntário de THC, várias guloseimas foram testadas para determinar quais eram palatáveis para os ratos e seriam consumidas de forma rápida e consistente.
Inicialmente, foram testados cubos de gelatina com sabor de morango sem açúcar (tamanho de 1 mL cúbico), com e sem THC. A quantidade de aromatizante de xarope de morango foi aumentada e o THC foi testado em três concentrações diferentes (2 mg / kg / dose, 3 mg / kg / dose e 5 mg / kg / dose). Os ratos não consumiram consistentemente os cubos e interromperam rapidamente o consumo nas concentrações mais altas de THC. Sabe-se que os ratos podem recusar alimentos com sabor amargo ou ácido, o que levantou preocupações de que esse modelo possa não ser viável para consumo voluntário.
Após consulta com o veterinário institucional, várias outras guloseimas foram testadas, incluindo biscoitos com manteiga de amendoim ou queijo, mini biscoitos de chocolate com manteiga de amendoim, biscoitos de queijo com manteiga de amendoim e biscoitos em forma de peixe com queijo, todos obtidos da Amazon. As ratas consumiram consistentemente os mini biscoitos de chocolate com manteiga de amendoim, muitas vezes dentro de 10 a 30 minutos após receberem a guloseima. O THC foi então adicionado aos mini biscoitos de chocolate com manteiga de amendoim, e a porcentagem de mães que consumiram a guloseima diária foi semelhante entre os grupos controle e expostos ao THC (67% vs. 62%, respectivamente; p = 0,14).
As mães foram então expostas ao THC conforme descrito no protocolo, com exposição pré-gravidez e pré-natal a canabinóides. As mães foram randomizadas para o grupo controle ou grupo PCE (exposição ao THC a 3 mg / kg / dose) antes da reprodução. O tamanho da ninhada e o ganho de peso materno foram semelhantes entre os grupos. A taxa de mortalidade (porcentagem de óbito desde o nascimento até P2) e o peso ao nascer aproximaram-se da significância entre os controles e o PCE (0% vs. 0,04%, p = 0,06 e 6,25 g vs. 5,96 g, p = 0,07, respectivamente). A taxa de mortalidade apresentou tendência maior no grupo PCE, e o peso da prole ao nascer apresentou menor no grupo PCE (Tabela 1 e Figura 2), o que é consistente com a literatura humana20.

Figura 1: Desenho experimental. As mães ingeriram voluntariamente biscoitos com infusão de THC diariamente antes da reprodução para garantir uma ingestão consistente. As barragens que não consumiram os biscoitos foram excluídas do experimento. As mães restantes foram randomizadas para consumir um biscoito simples ou com infusão de THC (3 mg / kg) durante a gravidez. O nascimento ocorreu normalmente, e os filhotes foram desmamados no dia pós-natal (P) 23. Clique aqui para ver uma versão maior desta figura.
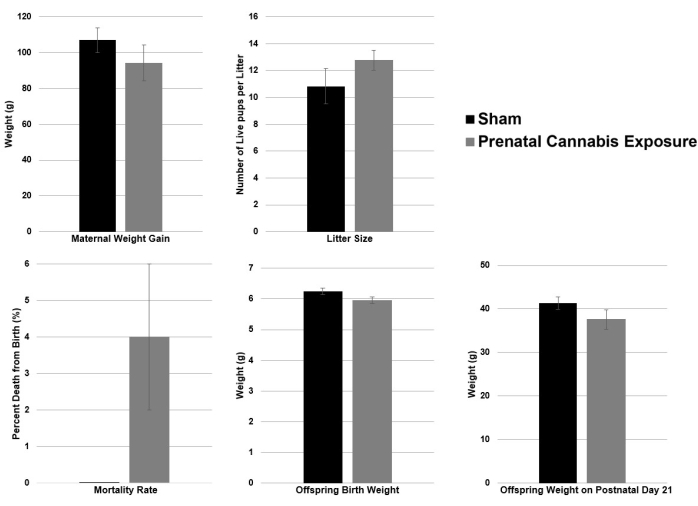
Figura 2: Representação gráfica das características da mãe e da prole para o modelo PCE. Esta figura fornece uma representação gráfica das características da mãe e da prole no modelo PCE. Clique aqui para ver uma versão maior desta figura.
| Simulado (n = 6 barragens) | PCE (n = 4 barragens) | p Valor* | |
| Ganho de peso materno (g) | 107.00 ± 6.83 | 94.25 ± 10.03 | 0.48 |
| Tamanho da ninhada (número de filhotes vivos/ninhada) | 10,83 ± 1,31 | 12,75 ± 0,74 | 0.22 |
| Taxa de mortalidade (% de óbitos desde o nascimento até P2) | 0,00 ± 0,00 | 0,04 ± 0,02 | 0.06 |
| Peso da prole ao nascer (g) | 6,25 ± 0,11 | 5,96 ± 0,10 | 0.07 |
| Peso da prole no dia pós-natal 21 (g) | 41,31 ± 1,40 | 37,61 ± 2,22 | 0.17 |
| *O valor de p foi calculado usando o teste t de Student | |||
Tabela 1: Características da mãe e da prole para o modelo PCE. O ganho de peso materno ao longo do dia gestacional (DG) 22 foi medido como o aumento do peso corporal em gramas e não foi significativamente diferente entre os grupos (p = 0,48). A tabela também inclui o tamanho médio da ninhada, a taxa de mortalidade (porcentagem de mortes desde o nascimento até P2), o peso ao nascer da prole por ninhada e o peso em P21. Todos os dados são apresentados como o valor médio ± erro padrão da média (EPM); *Os valores de p foram calculados usando um teste t de Student.
Discussão
O paradigma PCE descrito aqui envolve o consumo voluntário de THC por mães de ratos grávidas. Este é o primeiro estudo a explorar a administração de THC a mães de ratos prenhes por meio de ingestão voluntária em um modelo pré-clínico. Ambos os grupos de mães de ratos consumiram a mesma dieta de ração para ratos, minimizando a variabilidade potencial na nutrição e ingestão calórica entre os grupos. Os modelos animais oferecem a vantagem de controlar o tempo e a dosagem de PCE para fins de estudo.
O consumo pré-gestacional é avaliado para identificar ratos que consomem THC nos níveis desejados para as fases subsequentes do protocolo de consumo. Essa abordagem garante que todas as ratas tenham experiência anterior com a ingestão de THC antes da gravidez, refletindo com mais precisão o comportamento humano5, onde os indivíduos costumam usar THC antes da gravidez. Nesse modelo, o PCE ocorre durante todo o desenvolvimento gestacional, correspondendo aproximadamente aos dois primeiros trimestres da gestação humana. As evidências sugerem que o uso de canabinóides é mais comum durante o primeiro trimestre, diminui no segundo e diminui ainda mais no terceiro1.
Os receptores endocanabinóides não são expressos no feto até 5-6 semanas de gestação21. A exposição antes desse período pode não influenciar diretamente o desenvolvimento do cérebro fetal, embora efeitos indiretos por meio da expressão do receptor endocanabinoide na placenta ainda sejam possíveis22. Consequentemente, os pesquisadores focados nos resultados do neurodesenvolvimento precisarão levar em conta o momento da exposição em relação aos resultados específicos de interesse.
Uma etapa crítica no protocolo é a capacidade de medir os níveis de THC com frequência para garantir que o consumo atinja os níveis séricos desejados. Experimentos em andamento estão medindo os níveis séricos durante a gravidez para garantir que um nível estável possa ser mantido, apesar das alterações metabólicas que ocorrem durante a gravidez.
Foram consideradas outras técnicas de administração oral, como a gavagem oral. No entanto, o objetivo deste modelo é permanecer o mais clinicamente relevante possível. A administração de gavagem pode induzir estresse significativo em ratos, resultando em aumento da pressão arterial, níveis plasmáticos elevados de corticosterona e outros efeitos adversos23,24. Assim, optamos pela ingestão voluntária para minimizar quaisquer efeitos colaterais não intencionais.
As limitações deste estudo incluem garantir um consumo consistente e a necessidade de cautela ao preparar as guloseimas, pois imprecisões na dosagem de THC durante a preparação podem afetar os resultados. Embora os ratos individuais possam diferir no metabolismo, isso também é um ponto forte, dado o desejo de correlação clínica.
No geral, um modelo pré-clínico de ingestão voluntária para produzir exposição moderada ao THC é viável. O desenvolvimento deste modelo permitirá investigações mais aprofundadas sobre os resultados do neurodesenvolvimento, bem como outras áreas de interesse. Estudos futuros contribuirão para a crescente literatura sobre o impacto do PCE no desenvolvimento fetal.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Obrigado ao Programa de Fornecimento de Drogas do Instituto Nacional de Abuso de Drogas (NIDA) pelo generoso fornecimento de THC. Apoiado pela concessão do Comitê de Alocação de Pesquisa do Departamento de Pediatria da Universidade do Novo México e pela Divisão de Neonatologia.
Materiais
| Name | Company | Catalog Number | Comments |
| 5L0D PicoLab Laboratory Rodent Diet, irradiated | Purina LabDiet | 5L0D | |
| Cellulose/paper bedding BioFresh Comfort Bedding | BioFresh Vet | NA | https://biofreshvet.com/products/ |
| Digital Kitchen Scale | Etekcity | EK4150 | |
| Female rats, 125-150 g | Inotiv | 14005F | |
| Long-Evans rats (Blue Spruce, HsdBlu: LE) | Inotiv | 14016M | |
| N10 Rodent Plastic Cage Bottoms | Ancare | N10PLF | |
| N10 Rodent Wire Lids | Ancare | N10SS | |
| Narrow Pattern Forceps | Fine Science tools (FST) | 11002-14 | |
| OREO mini chocolate Sandwich cookies, Go Paks, 12-3.5 oz cups | Amazon | B0198TUO7W | |
| proven adult breeder males | Inotiv | 14016M | |
| Rat static polysulfone microisolator cages (R20): | |||
| Research Grade THC (only available with a DEA license, Schedule I drug) | NIDA | NA | https://nida.nih.gov/research/research-data-measures-resources/nida-drug-supply-program |
| SKIPPY Creamy Peanut Butter spread | Amazon | B0C75KZ28C | |
| THC Consumption Supplies: |
Referências
- Volkow, N. D., Han, B., Compton, W. M., McCance-Katz, E. F. Self-reported medical and nonmedical cannabis use among pregnant women in the United States. JAMA. 322 (2), 167-169 (2019).
- de Salas-Quiroga, A., et al. Prenatal exposure to cannabinoids evokes long-lasting functional alterations by targeting CB1 receptors on developing cortical neurons. Proc Natl Acad Sci USA. 112 (44), 13693-13698 (2015).
- Baglot, S. L., et al. Maternal-fetal transmission of delta-9-tetrahydrocannabinol (THC) and its metabolites following inhalation and injection exposure during pregnancy in rats. J Neurosci Res. 100 (3), 713-730 (2022).
- Ryan, S. A., Ammerman, S. D., O'Connor, M. E. Committee on Substance Use and Prevention; Section on Breastfeeding. Marijuana use during pregnancy and breastfeeding: implications for neonatal and childhood outcomes. Pediatrics. 142 (3), e20181889(2018).
- Corsi, D. J., et al. Association between self-reported prenatal cannabis use and maternal, perinatal, and neonatal outcomes. JAMA. 322 (2), 145-152 (2019).
- Duko, B., Dachew, B. A., Pereira, G., Alati, R. The effect of prenatal cannabis exposure on offspring preterm birth: a cumulative meta-analysis. Addiction. 118 (4), 607-619 (2023).
- Scheyer, A. F., Melis, M., Trezza, V., Manzoni, O. J. J. Trends in Neurosciences. Trends Neurosci. 42 (12), 871-884 (2019).
- Nashed, M. G., Hardy, D. B., Laviolette, S. R. Prenatal Cannabinoid Exposure: Emerging Evidence of Physiological and Neuropsychiatric Abnormalities. Front Psychiatry. 11, 624275(2021).
- Lin, A., et al. Prenatal cannabinoid exposure: why expecting individuals should take a pregnancy pause from using cannabinoid products. Front Pediatr. 11, 1278227(2023).
- Chang, J. C., et al. Beliefs and attitudes regarding prenatal marijuana use: perspectives of pregnant women who report use. Drug Alcohol Depend. 196, 14-20 (2019).
- Young-Wolff, K. C., et al. Trends in cannabis polysubstance use during early pregnancy among patients in a large health care system in Northern California. JAMA Netw Open. 5 (6), e2215418(2022).
- Dickson, B., et al. Recommendations from cannabis dispensaries about first-trimester cannabis use. Obstet Gynecol. 131 (6), 1031-1038 (2018).
- Murphy, F., et al. Baby boomers and cannabis delivery systems. J Drug Issues. 45 (3), 293-313 (2015).
- Barrus, D. G., et al. Tasty THC: Promises and challenges of cannabis edibles. Methods Rep, RTI Press. , 1-22 (2016).
- Mura, P., Kintz, P., Dumestre, V., Raul, S., Hauet, T. THC can be detected in brain while absent in blood. J Anal Toxicol. 29 (8), 842-843 (2005).
- Grotenhermen, F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacol Ther. 42 (4), 327-360 (2003).
- Thompson, R., DeJong, K., Lo, J. Marijuana Use in Pregnancy: A Review. Obstet Gynecol Surv. 74 (7), 415-428 (2019).
- Ravula, A., et al. Pharmacokinetic and pharmacodynamic characterization of tetrahydrocannabinol-induced cannabinoid dependence after chronic passive cannabis smoke exposure in rats. Cannabis Cannabinoid Res. 4 (4), 240-254 (2019).
- Zgair, A., et al. Dietary fats and pharmaceutical lipid excipients increase systemic exposure to orally administered cannabis and cannabis-based medicines. Am J Transl Res. 8 (8), 3448-3459 (2016).
- Mulligan, M. K., Hamre, K. M. Influence of prenatal cannabinoid exposure on early development and beyond. Adv Drug Alcohol Res. 3, 10981(2023).
- Paul, S. E., et al. Associations between prenatal cannabis exposure and childhood outcomes: Results from the ABCD study. JAMA Psychiatry. 78 (1), 64-76 (2021).
- Fügedi, G., et al. Increased placental expression of cannabinoid receptor 1 in preeclampsia: An observational study. BMC Pregnancy Childbirth. 14, 395(2014).
- Walker, M. K., et al. A less stressful alternative to oral gavage for pharmacological and toxicological studies in mice. Toxicol Appl Pharmacol. 260 (1), 65-69 (2012).
- Brown, A. P., Dinger, N., Levine, B. S. Stress produced by gavage administration in the rat. Contemp Top Lab Anim Sci. 39 (1), 17-21 (2000).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados