Method Article
Implante de dispositivo de telemetria sem fio em um modelo ovino de Fontan para monitorização hemodinâmica contínua e de longo prazo
Neste Artigo
Resumo
Este protocolo descreve a metodologia cirúrgica para implantar um dispositivo de telemetria sem fio para animais de grande porte para permitir a coleta contínua e de longo prazo de dados hemodinâmicos, incluindo frequência cardíaca, pressão arterial, pressões de veia cava inferior e superior e ritmo cardíaco.
Resumo
Embora o procedimento de Fontan melhore drasticamente a expectativa de vida de pacientes com ventrículo único, é bem reconhecido que a circulação resultante causa uma carga significativa de doença a longo prazo como consequência de pressões venosas centrais cronicamente elevadas e diminuição do débito cardíaco. Os modelos animais crônicos de Fontan são um recurso valioso para estudar os resultados fisiológicos tardios associados a esta operação e uma ferramenta necessária na avaliação de futuros dispositivos projetados para aliviar a falha de Fontan. No entanto, tentativas anteriores de criação de modelos crônicos de Fontan foram prejudicadas por baixas taxas de sobrevivência. Além disso, a coleta eficaz de dados hemodinâmicos representa um desafio significativo em animais em movimento livre. Para esse fim, o uso de sistemas de telemetria implantáveis sem fio fornece uma nova solução para monitoramento em tempo real e de longo prazo de dados cardiovasculares. Este protocolo descreve a metodologia para implantação cirúrgica de um dispositivo de telemetria sem fio em um modelo ovino de sobrevivência de Fontan, facilitando o registro contínuo e contínuo de vários parâmetros hemodinâmicos, incluindo frequência cardíaca, pressão arterial e pressões localizadas na veia cava inferior (VCI) e superior (VCS). Foram implantados dispositivos de telemetria com canulação da artéria carótida e veia jugular interna ou artéria e veia femoral, para colocação de cateteres pressóricos na aorta ascendente e VCS ou aorta abdominal e VCI, respectivamente. O uso dos sistemas de telemetria sem fio permitiu um monitoramento pós-operatório rigoroso após uma operação de Fontan em estágio único, o que contribuiu para melhorar o bem-estar e a sobrevivência dos animais.
Introdução
O desenvolvimento da operação de Fontan em 1971 levou a melhorias significativas nos resultados para pacientes com ventrículo único1. O objetivo desta operação é separar o retorno venoso sistêmico e pulmonar ao coração, aumentando assim a oxigenação sistêmica e aliviando a carga volêmica no ventrículo sistêmico. Desde a sua introdução, inúmeras modificações foram feitas na abordagem cirúrgica. Atualmente, a circulação extracorpórea total do coração direito é mais frequentemente alcançada por meio da reconstrução em estágios 2,3. Normalmente, o primeiro estágio é realizado durante a primeira semana de vida4. Os pacientes são submetidos a um segundo estágio, que consiste no procedimento de Glenn ou hemi-Fontan, para redirecionar o fluxo sanguíneo da veia cava superior (VCS) para a artéria pulmonar (AP)5. Segue-se o procedimento de Fontan, que envolve a criação de um conduto extracardíaco ou túnel lateral entre a veia cava inferior (VCI) e a AP6. Avanços cirúrgicos como os realizados ao longo da história do procedimento de Fontan não poderiam ter sido alcançados sem o uso de modelos animais7.
Embora o procedimento de Fontan melhore drasticamente a expectativa de vida de pacientes com ventrículo único, é bem reconhecido que a circulação resultante, que opera sem uma bomba subpulmonar, causa carga significativa de doença em longo prazo como consequência de pressões venosas centrais (PVC) cronicamente elevadas e diminuição do débito cardíaco 8,9,10,11,12 . Modelos animais crônicos de Fontan são um recurso valioso para estudar os resultados fisiológicos tardios associados a esta operação13. A coleta ativa de dados de parâmetros cardiovasculares, como PVC, frequência cardíaca e outros sinais vitais, para capturar as alterações hemodinâmicas pós-operatórias é essencial para uma avaliação abrangente do desenvolvimento da fisiopatologia. Além disso, os modelos animais são uma ferramenta necessária para testar a capacidade de novos dispositivos de assistência ventricular projetados para aliviar as deficiências hemodinâmicas da circulação de Fontan in vivo 14,15,16,17,18,19.
No entanto, a coleta eficaz de dados representa um desafio significativo. As técnicas invasivas baseadas em cateter são limitadas por sua natureza transitória, riscos de procedimento associados e incapacidade de monitorar a condição do animal por longos períodos. Além disso, tentativas anteriores de criar um modelo de Fontan de animais de grande porte foram prejudicadas por baixas taxas de sobrevivência, presumivelmente devido à falha de corações normais em se adaptar ao estabelecimento agudo da circulação de Fontan 7,20. Para esse fim, o uso de sistemas de telemetria sem fio fornece uma nova solução para a coleta de dados cardiovasculares em tempo real e de longo prazo em animais em movimento livre21,22. Esses dispositivos também podem permitir um monitoramento pós-operatório rigoroso, o que pode levar a um melhor bem-estar e sobrevivência animal.
Aqui, descrevemos a metodologia para o sucesso da implantação e uso de um sistema de telemetria sem fio23 em um modelo ovino crônico de Fontan. Essa técnica forneceu um meio robusto e confiável de coleta contínua de dados hemodinâmicos, permitindo o estudo das pressões venosas e outros parâmetros fisiológicos importantes. A implementação dessa tecnologia em modelos pré-clínicos é fundamental para o avanço de nossa compreensão da fisiologia de Fontan e o desenvolvimento de novas estratégias terapêuticas destinadas a melhorar os resultados a longo prazo dos pacientes com Fontan.
Protocolo
Este protocolo experimental foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais do Nationwide Children's Hospital Abigail Wexner Research Institute (AR20-00121). Todos os procedimentos seguiram as diretrizes descritas no Guia do Instituto Nacional de Saúde para o Uso e Cuidados com Animais de Laboratório. Esta pesquisa seguiu as diretrizes da Animal Research: Reporting of In Vivo Experiments. Ovelhas Dorset com uma faixa de peso de 23-38 kg e uma faixa etária de 2-12 meses foram alojadas em um ambiente específico livre de patógenos com livre acesso a comida e água por pelo menos 1 semana antes da cirurgia. Os equipamentos e reagentes utilizados no estudo estão listados na Tabela de Materiais.
1. Preparação animal
- Faça com que as ovelhas sejam avaliadas pela equipe veterinária 1 semana antes da cirurgia para garantir que possam ser submetidas à anestesia com segurança. Ovinos saudáveis e privados de água por 12 h antes do procedimento cirúrgico.
- Sedar com uma combinação de cetamina (4 mg/kg) e diazepam (0,5 mg/kg) injetada através de uma veia jugular interna (IJ).
- Raspe as ovelhas de acordo com o procedimento planejado (detalhado abaixo) e sobre a coxa para a colocação da almofada de aterramento do eletrocautério. Limpe os locais cirúrgicos com álcool.
- Insira um tubo endotraqueal de lúmen único de 8-9 mm na traqueia.
- Insira uma sonda orogástrica para descompressão do estômago e do rúmen.
- Insira um cateter venoso de lúmen único (16-18 G) na veia jugular direita ou em uma veia safena lateral para administração contínua de fluidos, infusão contínua (IRC) de propofol e injeção de medicamentos, conforme necessário.
- Coloque uma linha arterial (22-24 G) em uma artéria auricular para monitoramento contínuo da pressão arterial.
- Coloque um manguito de pressão arterial no membro frontal direito para medição não invasiva da pressão arterial, um clipe na orelha ou língua para monitorar a saturação de oxigênio e eletrocardiograma (ECG) nos quatro membros.
- Durante o procedimento, manter a anestesia com isoflurano inalatório 1%-3% com 100% deO2 e/ou propofol IRC (20-45 mg/kg/h).
- Limpe assepticamente os locais cirúrgicos usando uma preparação à base de clorexidina e cortina da maneira estéril padrão.
- Administre cefazolina (25 mg / kg) para profilaxia antibiótica antes da incisão e retome a cada 4 h durante a operação, conforme necessário.
- Administre uma injeção subcutânea de anestésico local, como bupivacaína 0,25%, em todos os locais de incisão planejados antes da incisão.
2. Preparação do dispositivo de telemetria
- Abra o programa de software de telemetria e ligue o dispositivo de telemetria usando o interruptor magnético enquanto ele ainda está selado em sua embalagem original.
- No programa de software, clique em Hardware localizado na barra superior e selecione Editar configuração do PhysioTel Digital (CLC) para atribuir a unidade de telemetria a um controlador de link de comunicação (CLC).
- Depois que um CLC for selecionado, sua página Detalhes do CLC será aberta. Nesta página, clique em Pesquisar implantes, que iniciará uma pesquisa por dispositivos de implante que estão ativados nas proximidades.
- Clique em Adicionar para adicionar a unidade de telemetria à lista Implantes selecionados . O dispositivo agora aparecerá na lista Implantes configurados na página Detalhes do CLC . Clique em Salvar e sair.
- Inicie a aquisição de dados pressionando o botão Reproduzir ao lado do nome da unidade de telemetria na guia Controle de Amostragem . O gráfico exibindo a aquisição de dados ao vivo será aberto automaticamente.
- Remova o dispositivo de sua embalagem externa e transfira-o para sua embalagem interna estéril para a mesa de operação.
- Zere o dispositivo enquanto ele permanece em sua embalagem interna. Aguarde até que as medições do dispositivo estejam estáveis por 30 s e use os valores de pressão média não pulsátil estabilizada (NPMN) como compensação.
- Em Configuração do assunto, selecione o ícone de configurações ao lado do parâmetro que está sendo zerado e abra a guia Deslocamentos . Insira o valor de deslocamento obtido das medições NPMN na caixa de texto.
- Depois de inserir o deslocamento, verifique se as leituras do NPMN são 0 ± 0.1 mmHg. Caso contrário, repita a etapa 2.7 até que os valores estejam dentro do intervalo desejado.
- Execute as etapas 2.7-2.9 para ambos os canais de pressão.
- Antes de inserir os cateteres com sensor de pressão em um vaso sanguíneo, bata na ponta para identificar seu canal correspondente. Os toques se tornarão aparentes na saída da forma de onda.
- Use o cateter correspondente ao canal da pressão ventricular esquerda (LVP) para medição da pressão arterial e o canal da pressão arterial (PA) para medição da pressão venosa.
- Na guia Atributos padrão da caixa de diálogo Atributos de análise de pressão arterial , defina a altura mínima do pulso como 1 mmHg para o canal de PA.
3. Método 1: Canulação da artéria e veia femoral
- Raspe as ovelhas em um perímetro largo ao redor da virilha direita e sobre o abdômen e o peito.
- Posicione as ovelhas em decúbito dorsal na mesa cirúrgica com os membros anteriores presos em flexão usando um cinto de tecido flexível e os membros posteriores presos em extensão usando um laço de nó corrediço para permitir o acesso à virilha (Figura 1A).
- Faça uma incisão transversal de 5 cm na região inguinal direita centrada sobre a artéria femoral palpável, aproximadamente 1 cm abaixo da prega inguinal.
- Usando uma combinação de eletrocautério e dissecção romba, disseque através do tecido subcutâneo até o triângulo femoral. Localize os vasos femorais palpando o pulso arterial.
- Divida entre o sartório e o músculo adutor longo ao longo da direção das fibras musculares para expor os vasos femorais (Figura 1B).
- Usando uma combinação de dissecção contundente e aguda, limpe o tecido conjuntivo dos vasos femorais circunferencialmente.
- Passe um laço de seda 2-0 duplo ao redor de ambos os vasos proximal e distal ao local da canulação para ligadura temporária do vaso.
- Faça uma incisão transversal de 6 cm através da pele na parte inferior direita do abdômen, aproximadamente 3 cm acima da prega inguinal.
- Usando uma combinação de eletrocautério e dissecção romba, disseque através da gordura subcutânea e do tecido conjuntivo para criar uma bolsa de 6 cm x 4 cm superficial ao oblíquo externo.
- Insira o dispositivo de telemetria na bolsa subcutânea e prenda-o no lugar usando uma sutura de seda 2-0 (Figura 1C).
- Encapsule a antena do dispositivo de telemetria sob o tecido subcutâneo e prenda-a no lugar usando uma sutura de seda 2-0.
- Para a colocação das derivações de biopotencial (ECG), faça contra-incisões de 1 cm na pele sobre o abdômen médio e inferior, bem como na parte inferior e superior do tórax. Faça um túnel subcutâneo para conectar essas incisões ao bolso do corpo do dispositivo e guie os eletrodos do ECG até o local desejado.
- Coloque o eletrodo positivo no tecido subcutâneo à esquerda do esterno inferior. Certifique-se de que o tubo de silicone seja removido para revelar a ponta do fio de aço por baixo.
- Coloque o eletrodo negativo no tecido subcutâneo à direita do esterno superior.
- O excesso de fiação para ambos os eletrodos pode ser enrolado e preso no local subcutâneo usando uma sutura de seda 2-0.
- Crie um túnel subcutâneo da bolsa do dispositivo abdominal inferior até a incisão inguinal e passe os dois cateteres de pressão.
- Coloque um ponto em bolsa usando uma sutura de polipropileno 6-0 ao redor do local da canulação da artéria e da veia femoral, que pode ser fixada com um torniquete de plástico.
- Encha as pontas do gel do cateter com gel não compressível e de alta viscosidade para evitar a coagulação dentro das pontas do cateter, garantindo que não haja bolhas de ar.
- Administre uma dose de heparina intravenosa (100 unidades/kg) 3 min antes da canulação.
- Aperte os torniquetes de seda 2-0 proximal e distal ao redor da artéria femoral. Incise cuidadosamente no vaso no centro do ponto da bolsa usando um bisturi de lâmina # 11 e dilate levemente com a ponta de um hemostático curvo.
- Insira o cateter de pressão correspondente ao canal LVP e avance-o para a aorta abdominal, afrouxando o torniquete de seda proximal para permitir a passagem do cateter. Aperte a sutura do cordão da bolsa e amarre-a ao redor do cateter.
- Repita os passos 3.20 e 3.21 para canulação da veia femoral usando o cateter de pressão correspondente ao canal de BP e avance-o para a VCI abdominal (Figura 1D).
- Confirme se as pontas do cateter estão localizadas adequadamente na VCI e na aorta usando fluoroscopia.
- Reaproxime o músculo sartório usando uma sutura absorvível 2-0.
- Feche a pele com suturas dérmicas profundas e subcuticulares usando suturas absorvíveis 3-0 e 4-0, respectivamente.
4. Método 2: Canulação da artéria carótida e veia jugular interna
- Raspe as ovelhas em um perímetro largo ao redor do pescoço esquerdo e para baixo sobre o peito.
- Posicione as ovelhas em decúbito lateral direito na mesa cirúrgica com o membro anterior esquerdo preso em flexão usando uma amarração de nó corrediço para expor o tórax (Figura 2A).
- Faça uma incisão longitudinal na pele de 5 cm acima da artéria carótida esquerda e da veia IJ, aproximadamente 7 cm cranial à entrada torácica.
- Usando eletrocautério, dissecar através da gordura subcutânea, tecido conjuntivo e platisma para expor os vasos do pescoço (Figura 2B).
- Usando uma combinação de dissecção contundente e aguda, limpe o tecido conjuntivo da artéria carótida esquerda e da veia IJ circunferencialmente.
- Passe um laço de seda 2-0 duplo ao redor de ambos os vasos proximal e distal ao local da canulação para ligadura temporária do vaso.
- Faça uma incisão longitudinal de 6 cm na base do pescoço esquerdo entre a escápula e a coluna cervical.
- Usando uma combinação de eletrocautério e dissecção romba, disseque através da gordura subcutânea e do tecido conjuntivo para criar uma bolsa de 6 cm x 4 cm que se estende em direção à coluna.
- Insira o dispositivo de telemetria na bolsa subcutânea e prenda-o no lugar usando uma sutura de seda 2-0.
- Encapsule a antena do dispositivo de telemetria sob o tecido subcutâneo e prenda-a no lugar usando uma sutura de seda 2-0.
- Faça incisões contracutâneas de 1 cm na base do pescoço, bem como na parte inferior esquerda e superior direita do tórax, para colocação das derivações do ECG. Faça um túnel subcutâneo para conectar essas incisões à bolsa do corpo do dispositivo e guie as derivações do ECG até o local desejado (Figura 2C).
- Coloque as derivações do ECG de forma semelhante às etapas descritas acima para o procedimento de implante femoral (seção 3).
- Crie um túnel subcutâneo do bolso lateral do dispositivo até a incisão medial do pescoço e passe os dois cateteres de pressão. Prepare esses cateteres de pressão usando gel antes da canulação, conforme detalhado no procedimento de implante femoral.
- Usando uma sutura de polipropileno 6-0, coloque um ponto de bolsa ao redor do local da canulação em ambos os vasos e prenda com um torniquete de plástico.
- Administre uma dose de heparina intravenosa (100 unidades/kg) 3 min antes da canulação.
- Aperte os torniquetes de seda 2-0 proximal e distal ao redor da artéria carótida. Incise cuidadosamente no vaso no centro do ponto da bolsa usando um bisturi de lâmina # 11 e dilate levemente com a ponta de um hemostático curvo.
- Insira o cateter de pressão correspondente ao canal LVP e avance-o para a aorta torácica ascendente, afrouxando o torniquete de seda proximal para permitir a passagem do cateter. Aperte a sutura do cordão da bolsa e amarre-a ao redor do cateter.
- Repita as etapas 4.16 e 4.17 para canulação da veia IJ esquerda usando o cateter de pressão correspondente ao canal BP e avance-o para a VCS torácica.
- Confirme a localização apropriada das pontas do cateter na VCS torácica e na aorta ascendente usando fluoroscopia (Figura 2D).
- Reaproximar o músculo platisma usando uma sutura absorvível 2-0.
- Feche a pele com suturas dérmicas profundas e subcuticulares usando suturas absorvíveis 3-0 e 4-0, respectivamente.
5. Recuperação
- Interrompa os anestésicos. Remova a sonda orogástrica e extube quando a ovelha estiver respirando sem a ajuda do ventilador. Isso geralmente ocorre depois que a ovelha mostra sinais de excitação (movimento, piscar, resposta a estímulos dolorosos, tônus da mandíbula, mastigação).
- Remova a linha arterial.
NOTA: O monitoramento contínuo da pressão arterial pode ser fornecido pelo dispositivo de telemetria se um de seus cateteres de pressão tiver sido colocado na aorta. - Transfira as ovelhas para uma unidade de alojamento isolada para recuperação. Ajude as ovelhas a permanecerem em decúbito esternal e, eventualmente, em pé.
- Administre banamina intravenosa (2,2 mg / kg) e buprenorfina subcutânea SR (0,03 mg / kg) para dor pós-operatória.
Resultados
Resultados cirúrgicos
Um total de 13 ovinos foi submetido à cirurgia de Fontan em estágio único envolvendo conexão cavopulmonar total com descolamento da VCS e VCI do átrio direito, anastomose término-lateral direta da VCS à AP e colocação de um conduto extracardíaco entre a VCI e a AP. Os ovinos foram submetidos a esse procedimento com idade média de 13,3 ± 7,6 meses. Destes, 3 ovinos foram submetidos ao implante de dispositivo de telemetria sem fio com colocação de cateteres sensores de pressão na aorta abdominal e VCI; 2 ovinos foram submetidos ao implante de dispositivo de telemetria com colocação de cateteres sensores de pressão na aorta ascendente e VCS; e 8 ovinos não tiveram nenhum dispositivo de telemetria implantado. Nenhum animal apresentou complicações pós-operatórias importantes após o implante do dispositivo de telemetria. Sete dos 8 ovinos (87,5%) sem aparelho de telemetria expiraram em até 30 dias após a operação de Fontan, enquanto apenas 1 dos 5 (20,0%) ovinos com aparelho de telemetria faleceu nesse pós-operatório (Tabela 1).
Coleta de dados hemodinâmicos
A implantação de sistemas de telemetria sem fio facilitou a coleta contínua e de dados de longo prazo para vários parâmetros cardiovasculares, incluindo frequência cardíaca, pressão arterial e PVC. Isso permitiu um monitoramento hemodinâmico rigoroso de animais submetidos à cirurgia de Fontan em estágio único antes, durante e por vários dias após a operação (Figura 3). Variações nas pressões venosas foram observadas minuto a minuto, embora as tendências gerais parecessem mostrar um aumento agudo nas pressões da VCI abdominal (Figura 4A) e da VCS torácica (Figura 4B) após o estabelecimento da circulação de Fontan. Algumas flutuações minuto a minuto nas pressões venosas podem ser atribuídas ao nível de atividade e posicionamento das ovelhas. Por exemplo, observou-se que as pressões na VCI abdominal aumentavam consistentemente quando as ovelhas estavam descansando sobre o abdômen em decúbito (Figura 5). Em um ovino, um procedimento de cateterismo foi realizado no mesmo dia após o implante do dispositivo na região do pescoço com colocação do canal de pressão venosa na VCS. Isso foi feito para avaliar discrepâncias entre os valores relatados pelo dispositivo de telemetria e aqueles adquiridos pelo monitoramento invasivo da pressão, que foi visto como o padrão-ouro. As pressões médias não pulsáteis da VCS obtidas no procedimento de cateterismo oscilaram entre 2-4 mmHg, com oscilações atribuíveis a mudanças na pressão intratorácica ao longo do ciclo respiratório (Figura 6). Durante todo o procedimento, o dispositivo de telemetria emitiu, em média, 43 leituras de pressão média não pulsátil da VCS por minuto, com uma pressão média geral da VCS de 1,1 ± 3,1 mmHg, indicando deslocamento mínimo entre as medições do dispositivo e os valores reais.

Figura 1: Implante de dispositivo com canulação da artéria e veia femoral. Para o implante do dispositivo com canulação da artéria e veia femoral, a ovelha é posicionada em decúbito dorsal com as patas traseiras em extensão. (A) As marcações pré-operatórias indicam o posicionamento das incisões planejadas, a bolsa do corpo do dispositivo e o curso subcutâneo das derivações do ECG e dos cateteres com sensor de pressão até sua localização final. (B) Uma bolsa subcutânea medindo aproximadamente 6 cm x 4 cm é criada entre o tecido subcutâneo e acima do músculo oblíquo externo para colocação do corpo do dispositivo de telemetria. (C) Os vasos femorais são expostos após a divisão do músculo sartório. A artéria femoral palpável (setas brancas) está localizada medial à veia femoral (setas azuis). (D) Os cateteres com sensor de pressão são inseridos na artéria femoral (seta branca) e na veia (seta azul) e, em seguida, fixados no lugar com um ponto de bolsa. Clique aqui para ver uma versão maior desta figura.

Figura 2: Implante do dispositivo com canulação da artéria carótida esquerda e veia jugular interna (IJ). Para o implante do dispositivo com a canulação da artéria carótida esquerda e da veia jugular interna (IJ), a ovelha é posicionada em decúbito lateral direito com a perna dianteira esquerda estendida posteriormente. (A) As marcações pré-operatórias indicam o posicionamento das incisões planejadas. (B) A artéria carótida esquerda (setas brancas) e a veia IJ (setas azuis) são expostas após a divisão do platisma. A artéria carótida está localizada profunda e lateralmente à veia IJ. (C) O excesso de fiação dos eletrodos do ECG é enrolado e depois preso no espaço subcutâneo. A derivação positiva é colocada à esquerda da face inferior do esterno (setas pretas), enquanto a derivação negativa é colocada à direita da face superior do esterno (setas vermelhas). (D) A colocação das pontas do cateter com sensor de pressão na veia cava superior (seta azul) e na aorta ascendente (seta branca) foi confirmada por fluoroscopia. O posicionamento das derivações positiva (seta preta) e negativa (seta vermelha) do ECG também pode ser visto na imagem de raios-X. Clique aqui para ver uma versão maior desta figura.

Figura 3: Implantação de dispositivo de telemetria sem fio para monitoramento contínuo. O implante de dispositivo de telemetria sem fio permitiu o monitoramento contínuo de vários parâmetros cardiovasculares, incluindo frequência cardíaca, pressão arterial e pressão venosa, em modelos ovinos de sobrevivência de Fontan durante todo o período perioperatório. As tendências hemodinâmicas representadas neste gráfico são representativas dos dados coletados de cateteres com sensor de pressão colocados na aorta abdominal e na veia cava inferior (VCI). Clique aqui para ver uma versão maior desta figura.

Figura 4: Posicionamento dos cateteres com sensor de pressão. Cateteres com sensor de pressão foram posicionados na (A) veia cava inferior abdominal (VCI) ou (B) veia cava superior torácica (VCS) para registro contínuo das pressões venosas centrais. As medidas das pressões venosas foram obtidas no pré-operatório, intraoperatório durante o procedimento de Fontan e no pós-operatório para avaliar as tendências após o estabelecimento da circulação de Fontan. Variações minuto a minuto nas medições de pressão ocorreram com mudanças no posicionamento e nível de atividade do animal. Clique aqui para ver uma versão maior desta figura.
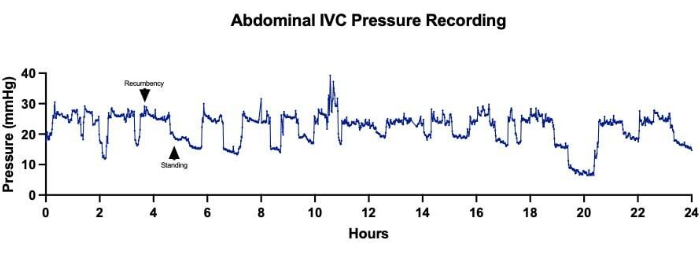
Figura 5: Pressões da veia cava inferior abdominal (VCI). A aquisição contínua de pressões abdominais de VCI durante um período de 24 horas mostrou flutuações nas medidas de pressão correlacionadas a mudanças no posicionamento das ovelhas. Pressões médias de VCI mais altas corresponderam aos momentos em que a ovelha estava em decúbito, enquanto pressões médias de VCI mais baixas foram registradas quando a ovelha estava em pé. Clique aqui para ver uma versão maior desta figura.

Figura 6: Medição da pressão invasiva da VCS. Um procedimento de cateterismo foi realizado no mesmo dia após o implante do dispositivo em uma ovelha para verificar as leituras de pressão da veia cava superior (VCS) do sistema de telemetria. Os valores adquiridos por esse método de monitorização invasiva da pressão foram vistos como o padrão-ouro. As pressões médias não pulsáteis da VCS obtidas no procedimento de cateterismo oscilaram entre 2-4 mmHg em sincronia com o ciclo respiratório. Enquanto isso, a média de todas as pressões médias não pulsáteis da VCS coletadas pelo dispositivo de telemetria durante o procedimento foi de 1,1 ± 3,1 mmHg, indicando deslocamento mínimo entre as leituras de telemetria e os valores reais. Clique aqui para ver uma versão maior desta figura.
| Ovelha | Sexo | Colocação de cateter de dispositivo de telemetria | Peso no momento da operação de Fontan (kg) | Idade no momento da operação de Fontan (meses) | Morte perioperatória |
| 1 | M | Nenhum | 45 | 13 | Sim |
| 2 | F | Nenhum | 43 | 13 | Não |
| 3 | M | Nenhum | 46.5 | 25 | Sim |
| 4 | F | Nenhum | 46.5 | 19 | Sim |
| 5 | M | Nenhum | 50 | 20 | Sim |
| 6 | F | Nenhum | 53 | 28 | Sim |
| 7 | M | Nenhum | 40.5 | 8 | Sim |
| 8 | M | Nenhum | 42 | 10 | Sim |
| 9 | F | Aorta abdominal e VCI | 33.5 | 3 | Não |
| 10 | M | Aorta abdominal e VCI | 24 | 7 | Sim |
| 11 | M | Aorta abdominal e VCI | 29 | 8 | Não |
| 12 | M | Aorta ascendente e VCS | 37.5 | 13 | Não |
| 13 | M | Aorta ascendente e VCS | 39.5 | 6 | Não |
Tabela 1: Resultados cirúrgicos. Treze ovinos foram submetidos à cirurgia de Fontan em estágio único, 5 dos quais haviam sido submetidos ao implante de dispositivo de telemetria sem fio 1 mês antes. Após a operação de Fontan, 7 dos 8 ovinos (87,5%) sem dispositivo de telemetria expiraram em 30 dias, em comparação com 1 dos 5 (20,0%) ovinos com dispositivo de telemetria.
Discussão
Desenvolvemos dois métodos cirúrgicos para a implantação de um dispositivo de telemetria sem fio em um modelo ovino. O dispositivo foi implantado com sucesso em 5 ovelhas para obter monitoramento e registro contínuos e de longo prazo de vários parâmetros cardiovasculares, incluindo frequência cardíaca, pressão arterial e pressões venosas localizadas da VCI abdominal e da VCS torácica. Todas as ovelhas sobreviveram à cirurgia para implantação do dispositivo sem grandes complicações e foram submetidas a uma operação de Fontan em estágio único um mês depois.
Em 2019, Van Puyvelde et al. relataram a criação do primeiro modelo de sobrevivência ovina de Fontan para estudar o processo crônico de falha de Fontan13. No entanto, dois terços dos animais não sobreviveram além da vigésima semana de pós-operatório. Notavelmente, é extremamente difícil estabelecer uma circulação aguda de Fontan em animais com corações normais, presumivelmente porque eles são menos adaptados do que os corações univentriculares a esse estado fisiológico específico. A utilidade da implantação do dispositivo de telemetria é, consequentemente, dupla. Primeiro, a capacidade de monitorar de perto os sinais vitais durante o período pós-operatório pode permitir o rápido reconhecimento e resposta aos sinais de descompensação cardiovascular, bem como facilitar o início de terapias direcionadas a metas. Em nossa experiência, o implante de dispositivos de telemetria sem fio em uma coorte de ovelhas submetidas à operação de Fontan de estágio único contribuiu para sua melhor sobrevida. Em segundo lugar, a capacidade de adquirir dados em tempo real a longo prazo nos permitirá identificar tendências hemodinâmicas em desenvolvimento associadas à falha de Fontan.
Embora tenhamos nos concentrado na criação de um modelo animal de grande porte crônico de Fontan, os benefícios dos sistemas de telemetria sem fio também podem ser aplicados a outros empreendimentos, como o teste e o desenvolvimento de novos dispositivos de assistência cavopulmonar (CPAD) destinados a fornecer suporte circulatório mecânico em casos de falha de Fontan. Vários grupos publicaram estudos em animais de grande porte examinando a viabilidade e a capacidade funcional de CPADs aplicados à circulação de Fontan 16,17,18,19. No entanto, a maioria desses experimentos foi conduzida em modelos agudos de Fontan com avaliação de curto prazo do desempenho hemodinâmico usando métodos de coleta de dados que não são viáveis fora da sala de cirurgia. Em 2019, Cysyk et al. descreveram o implante bem-sucedido de um CPAD em um modelo de sobrevivência ovina de Fontan14,15. Em seu estudo, linhas de monitoramento de pressão cheias de líquido foram colocadas na SVC, IVC, PA e átrio esquerdo e trazidas através da parede torácica posterior para obter medições contínuas de pressão durante o período de estudo de 30 dias. Embora esse método tenha sido amplamente suficiente para os propósitos de seu estudo, eles observaram problemas com a migração do cateter. Para coleta de dados de longo prazo superior a 30 dias, o uso de um sistema de telemetria sem fio pode ser mais preferível.
Nenhuma das ovelhas submetidas ao implante do dispositivo de telemetria apresentou complicações importantes como resultado do procedimento. No entanto, descobriu-se que um eletrodo de ECG havia corroído a pele de uma ovelha no local da incisão cicatrizada várias semanas após a cirurgia. Acredita-se que isso esteja relacionado a uma lesão por pressão, pois as ovelhas normalmente repousam em decúbito esternal com o peso corporal colocado no esterno anterior sobre os locais onde as derivações do ECG foram localizadas por via subcutânea. Portanto, para evitar a erosão do eletrodo do ECG, os eletrodos do ECG foram posicionados lateralmente, em vez de diretamente sobre o esterno em futuras ovelhas submetidas ao implante do dispositivo, e nenhuma outra ovelha experimentou esse problema desde então.
Várias etapas são necessárias para garantir que as leituras de pressão sejam tão precisas. Primeiro, o dispositivo de telemetria deve ser zerado à pressão atmosférica em uma superfície plana com as pontas do cateter niveladas com o corpo do dispositivo enquanto estiver dentro de sua embalagem original. Antes de inserir os cateteres com sensor de pressão em um vaso sanguíneo, é necessário encher as pontas do cateter com gel não compressível e de alta viscosidade, tomando cuidado para garantir que não haja bolhas de ar dentro do gel transparente. Por fim, é importante observar o posicionamento do corpo do dispositivo em relação à ponta do cateter, pois diferenças de altura podem distorcer as medidas de pressão. Optou-se por colocar o corpo do dispositivo sobre o abdome inferior ou na base do pescoço posterior à escápula, de modo que ficasse aproximadamente no mesmo nível da ponta do cateter dentro da VCI abdominal ou da VCS torácica, respectivamente, quando a ovelha estivesse em pé.
É importante observar que também posicionamos o corpo do dispositivo de telemetria em um local a pelo menos 15 cm de distância da região de interesse, incluindo o coração, grandes vasos e fígado, para minimizar a quantidade de artefato que ele pode produzir em futuras imagens de ressonância magnética. Por fim, cateteres com sensor de pressão foram inseridos na artéria carótida esquerda e na veia IJ para que fosse possível realizar futuros procedimentos de cateterismo através da veia IJ direita.
Várias limitações permanecem neste momento com o uso dos sistemas de telemetria sem fio, conforme descrito. É importante notar que o implante do dispositivo tem uma vida útil da bateria de 84 dias. Uma vez implantada, a bateria do dispositivo não pode ser recarregada ou substituída. No entanto, os dispositivos podem ser desligados e ligados novamente durante os períodos de tempo em que a coleta de dados é desejada para prolongar seu uso. Além disso, observou-se que as medições da pressão venosa variam dependendo do posicionamento do animal, e não está claro se isso se deveu a mudanças reais na pressão intravenosa ou mudanças no posicionamento do corpo do dispositivo em relação às pontas do cateter. Além disso, enquanto os corpos dos dispositivos de telemetria foram posicionados aproximadamente no mesmo nível das pontas dos cateteres na VCI ou VCS quando os animais estavam em pé, as diferenças de altura permaneceram devido a limitações anatômicas. Para o implante cervical, o corpo do dispositivo repousava mais alto que a ponta do cateter na VCS e, para o implante na virilha, o corpo do dispositivo ficava mais baixo que a ponta do cateter na VCI. No entanto, o exame das tendências gerais nos valores de pressão ainda pode fornecer informações cruciais sobre quaisquer alterações hemodinâmicas que possam surgir. Uma análise mais aprofundada dos dados de longo prazo coletados por esses sistemas de telemetria será necessária para obter uma compreensão mais completa da fisiologia crônica de Fontan e dos mecanismos de falha de Fontan. Procedimentos adicionais de cateterismo realizados no pós-operatório também serão necessários para verificar a precisão da saída de telemetria e identificar possíveis desvios do sensor ao longo do tempo. Finalmente, o deslocamento das pontas dos cateteres do dispositivo como resultado do crescimento somático é uma preocupação potencial, especialmente quando as unidades de telemetria são implantadas em animais mais jovens. A localização das pontas do cateter radiopaco pode ser verificada e confirmada durante os procedimentos de cateterismo pós-operatório.
Os sistemas de telemetria sem fio permitem a coleta de dados hemodinâmicos contínuos em tempo real a partir de modelos animais de grande porte em movimento livre. O implante cirúrgico desses dispositivos com a colocação de cateteres com sensor de pressão na VCI e na VCS, bem como na aorta abdominal e ascendente, é seguro e viável.
Divulgações
Este projeto foi financiado pela Additional Ventures Cures Collaborative, Palo Alto, Califórnia.
Agradecimentos
Agradecemos a equipe veterinária dedicada do Animal Research Core. Também desejamos expressar nossa gratidão a Mary Walker, DVM, MS, por sua experiência inestimável e cuidado vigilante durante todo o estudo.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
Referências
- Fontan, F. Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L. Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), 387-394; discussion 394-385 (1996).
- Iskander, C. et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244 (2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. Statpearls, Treasure Island, FL (2024).
- Daley, M. D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit? J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z. et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601 (2024).
- Al Balushi, A. Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J. et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260 (2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F. et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J. et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J. et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P. et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240--1249 (2021).
- D'udekem, Y. et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594 (2024).
- Granegger, M. et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X. et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J. et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M. et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H. et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. At <https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l > (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados