Method Article
継続的および長期の血行動態モニタリングのためのフォンタンヒツジモデルへのワイヤレステレメトリデバイス埋め込み
要約
このプロトコルは、心拍数、動脈血圧、下大静脈圧と上大静脈圧、心拍リズムなどの血行動態データの継続的かつ長期的な収集を可能にするために、大型動物の無線テレメトリデバイスを埋め込むための外科的方法論を説明しています。
要約
フォンタン法は、単心室患者の平均余命を劇的に改善しますが、結果として生じる循環が慢性的な中心静脈圧の上昇と心拍出量の減少の結果として、長期的に重大な疾患負担を引き起こすことはよく認識されています。慢性フォンタン動物モデルは、この手術に関連する後期の生理学的転帰を研究するための貴重な資産であり、フォンタンの失敗を軽減するために設計された将来のデバイスの評価に必要なツールです。しかし、慢性フォンタンモデルの作成に向けたこれまでの試みは、生存率の低さによって妨げられてきた。さらに、効果的な血行動態データ収集は、自由に動く動物にとって大きな課題となります。この目的のために、ワイヤレス埋め込み型テレメトリシステムの使用は、心血管データのリアルタイムおよび長期モニタリングのための新しいソリューションを提供します。このプロトコルは、フォンタン生存ヒツジモデルにワイヤレステレメトリデバイスを外科的に移植するための方法論を説明し、心拍数、動脈血圧、および下大静脈(IVC)および上大静脈(SVC)の局所圧力を含むいくつかの血行動態パラメータの連続的かつ継続的な記録を容易にします。テレメトリー デバイスには、頸動脈と内頸静脈、または大腿動脈と静脈のいずれかのカニューレ挿入が埋め込まれ、圧力感知カテーテルがそれぞれ上行大動脈と SVC または腹部大動脈と IVC に留置されました。無線テレメトリーシステムの使用により、1段階のフォンタン手術後の術後綿密なモニタリングが可能になり、動物福祉と生存率の向上に貢献しました。
概要
1971年のフォンタン法の開発により、単心室1の患者の転帰が大幅に改善されました。この手術の目的は、全身性静脈と肺静脈の心臓への戻りを分離し、それによって全身性酸素化を増加させ、全身性心室への体積負荷を軽減することです。導入以来、外科的アプローチには多くの変更が加えられてきました。現在、右心臓の完全なバイパスは、ほとんどの場合、段階的な再建によって達成されます2,3。通常、最初の段階は生後1週間に行われます4。その後、患者は、上大静脈 (SVC) から肺動脈 (PA) 5 に血流をリダイレクトするために、Glenn 手順または hemi-Fontan のいずれかで構成される第 2 段階を受けます。これに続いて、下大静脈 (IVC) と PA6 との間に心臓外導管または側方トンネルを作成するフォンタン手順が続きます。フォンタン手術の歴史を通じてなされたような外科的進歩は、動物モデル7の使用なしには達成できなかったであろう。
フォンタン法は単心室患者の平均余命を劇的に改善しますが、肺下ポンプなしで機能する結果として生じる循環は、慢性的な中心静脈圧(CVP)の上昇と心拍出量の減少の結果として、長期的に大きな疾患負担を引き起こすことがよく認識されています8,9,10,11,12 .慢性フォンタン動物モデルは、この手術に関連する後期の生理学的結果を研究するための貴重な資産です13。CVP、心拍数、その他のバイタルサインなどの心血管パラメータの積極的なデータ収集は、術後の血行動態の変化を捉えるために不可欠です 病態生理学の包括的な評価。さらに、動物モデルは、フォンタン循環の血行動態の欠点を緩和するように設計された新しい心室補助装置の能力をテストするために必要なツールです in vivo14,15,16,17,18,19。
しかし、効果的なデータ収集には大きな課題があります。侵襲的なカテーテルベースの技術は、その一時的な性質、関連する処置上のリスク、および長期間にわたって動物の状態を監視できないことによって制限されます。さらに、大型動物のフォンタンモデルを作成する以前の試みは、おそらく正常な心臓がフォンタン循環の急激な確立に適応できなかったため、生存率の低下によって妨げられてきました7,20。この目的のために、無線テレメトリーシステムの使用は、自由に動く動物21,22の心血管データのリアルタイムかつ長期的な収集のための新しい解決策を提供する。また、これらの機器は、術後の詳細なモニタリングを可能にし、動物福祉と生存率の向上につながる可能性があります。
ここでは、慢性フォンタンヒツジモデルにおける無線テレメトリーシステム23 の移植と使用を成功させるための方法論を説明する。この手法は、継続的な血行動態データ収集の堅牢で信頼性の高い手段を提供し、静脈圧やその他の主要な生理学的パラメータの研究を可能にしました。この技術を前臨床モデルに実装することは、フォンタンの生理学の理解を深め、フォンタンの患者の長期的な転帰を改善することを目的とした新しい治療戦略を開発するために重要です。
プロトコル
この実験プロトコルは、全国小児病院アビゲイル・ウェクスナー研究所(AR20-00121)の施設動物管理および使用委員会によって承認されました。すべての手順は、国立衛生研究所の実験動物の使用とケアに関するガイドに概説されているガイドラインに準拠しています。この研究は、Animal Research: Reporting of In Vivo Experimentsガイドラインに従ったものです。体重範囲が23〜38 kg、年齢が2〜12か月のドーセット羊は、手術前の少なくとも1週間、食物と水に無料でアクセスできる特定の病原体のない環境で飼育されました。この試験で使用された機器と試薬は、 材料表に記載されています。
1.動物の調理
- 羊が安全に麻酔を受けることができるように、手術の1週間前に獣医チームによる評価を受けさせます。健康な羊を速くし、外科的処置の12時間前に水分を奪います。
- ケタミン(4 mg / kg)とジアゼパム(0.5 mg / kg)の組み合わせを内頸静脈(IJ)から注射して鎮静します。.
- 計画された手順(以下に詳述)に従って羊を剃り、電気焼灼接地パッドの配置のために大腿部を剃ります。手術部位をアルコールで洗浄します。
- 8〜9mmのシングルルーメン気管内チューブを気管に挿入します。
- 胃とルーメンの減圧のために口腔胃管を挿入します。
- 右頸静脈または外側伏在静脈にシングルルーメン静脈カテーテル(16-18G)を挿入し、持続輸液、プロポフォールの持続速度注入(CRI)、必要に応じて薬物注射を行います。
- 動脈線(22-24 G)を耳介動脈に留置して、継続的な血圧モニタリングを行います。
- 非侵襲的な血圧測定のために右前肢に血圧カフを装着し、酸素飽和度を監視するために耳または舌にクリップを装着し、四肢すべてに心電図(ECG)リードを装着します。
- 処置中は、吸入イソフルラン1%〜3%と100%O2 および/またはプロポフォールCRI(20〜45 mg / kg / h)を使用して麻酔を維持します。.
- クロルヘキシジンベースのプレップを使用して手術部位を無菌的に洗浄し、標準的な滅菌方法でドレープします。
- 切開前に抗生物質予防のためにセファゾリン(25 mg / kg)を投与し、必要に応じて手術中に4時間ごとに再投与します。.
- 切開前に、計画されたすべての切開部位で、ブピバカイン 0.25% などの局所麻酔薬の皮下注射を投与します。
2. テレメトリー デバイスの準備
- テレメトリソフトウェアプログラムを開き、元のパッケージに密封されたままの状態で、マグネットスイッチを使用してテレメトリデバイスの電源を入れます。
- ソフトウェアプログラム内で、トップバーにある [ハードウェア ]をクリックし、[ PhysioTel Digital(CLC)設定の編集 ]を選択して、テレメトリユニットを通信リンクコントローラー(CLC)に割り当てます。
- CLCを選択すると、その CLC詳細 ページが開きます。このページ内で 「インプラントを検索」をクリックすると、近くで電源が入っているインプラントデバイスの検索が開始されます。
- [追加]をクリックして、テレメトリユニットを[選択したインプラント]リストに追加します。デバイスは、CLCの詳細ページの設定されたインプラントリストの下に表示されます。[Save and Exit] をクリックします。
- データ取得を開始するには、Sampling Controlタブでテレメトリユニットの名前の横にあるPlayボタンを押します。ライブデータ取得を表示するグラフが自動的に開きます。
- デバイスを外部パッケージから取り出し、滅菌済み内部パッケージに移して手術台に移します。
- デバイスが内部パッケージに残っている間、デバイスをゼロにします。デバイスからの測定値が 30 秒間安定するまで待ち、安定化された非脈動性平均 (NPMN) 圧力値をオフセットとして使用します。
- [Subject Setup] で、ゼロにするパラメータの横にある設定アイコンを選択し、[Offsets] タブを開きます。NPMN測定値から取得したオフセット値をテキストボックスに入力します。
- オフセット入力後、NPMNの読み取り値が0±0.1mmHgになっているか確認してください。そうでない場合は、値が目的の範囲内に収まるまで手順2.7を繰り返します。
- 両方の圧力チャネルに対して手順2.7〜2.9を実行します。
- 圧力感知カテーテルを血管に挿入する前に、先端をタップして対応するチャネルを特定します。タップは波形出力で明らかになります。
- 動脈圧測定には左心室圧(LVP)チャネル、静脈圧測定には血圧(BP)チャネルに対応するカテーテルを使用します。
- 「血圧分析属性」ダイアログ・ボックスの「標準属性」タブで、BPチャネルの最小パルス高さを1 mmHgに設定します。
3.方法1:大腿動脈と静脈カニューレ挿入
- 羊を右鼠径部の周りと腹部と胸部の広い範囲で剃ります。
- 羊を仰臥位にして手術台に置き、前肢を柔軟な布ベルトを使用して屈曲で固定し、後肢をスリップノットタイを使用して伸展して固定して鼠径部にアクセスできるようにします(図1A)。
- 触知可能な大腿動脈の中央、鼠径部のしわの約 1 cm 下にある右鼠径部に 5 cm の横切開を行います。
- 電気焼灼と鈍的解剖の組み合わせを使用して、皮下組織から大腿骨三角形まで解剖します。動脈脈拍を触診して大腿骨血管を特定します。
- 筋線維の方向に沿ってザルトリウス筋と長内転筋を分割して、大腿骨血管を露出させます(図1B)。
- 鈍的解剖と鋭い解剖の組み合わせを使用して、大腿骨血管から結合組織を円周方向に取り除きます。
- 一時的な血管結紮のために、カニューレ挿入部位の近位と遠位の両方の血管の周りにダブルループの2-0シルクタイを通します。
- 鼠径部のしわの約3cm上、右下腹部の皮膚を横切開します。
- 電気焼灼と鈍的解剖を組み合わせて、皮下脂肪と結合組織を解剖し、外腹斜筋の表面に 6 cm x 4 cm のポケットを作成します。
- テレメトリーデバイスを皮下ポケットに挿入し、2-0シルク縫合糸を使用して所定の位置に固定します(図1C)。
- テレメトリーデバイスのアンテナを皮下組織の下にトンネルで固定し、2-0シルク縫合糸を使用して所定の位置に固定します。
- 生体電位(ECG)リード線の配置には、中腹部と下腹部、および胸の下部と上部の皮膚に1cmのカウンター切開を行います。皮下トンネルを通し、これらの切開部をデバイスのボディポケットに接続し、ECGリードを目的の場所に導きます。
- 正極を胸骨下部の左側にある皮下組織に配置します。シリコンチューブを取り外して、下の鋼線の先端が見えるようにします。
- 負極を上部胸骨の右側の皮下組織に配置します。
- 両方のリード線の余分な配線は、2-0シルク縫合糸を使用してコイル状に巻き付けて皮下位置に固定することができます。
- 下腹部のデバイスポケットから鼠径切開部まで皮下トンネルを作成し、2 本の圧力カテーテルを通します。
- 大腿動脈と静脈の両方のカニューレ挿入部位の周りに6-0ポリプロピレン縫合糸を使用して巾着ステッチを配置します。これはプラスチック製の止血帯を使用して固定できます。
- カテーテルゲルの先端に非圧縮性の高粘度ゲルを充填して、カテーテルの先端内での凝固を防ぎ、気泡が発生しないようにします。
- カニューレ挿入の3分前に静脈内ヘパリン(100ユニット/ kg)を投与します。.
- 大腿動脈の周りの近位および遠位の2-0シルク止血帯を引き締めます。#11ブレードメスを使用して、巾着ステッチの中央にある血管に慎重に切込み、湾曲した止血剤の先端でわずかに拡張します。
- LVPチャネルに対応する圧力カテーテルを挿入し、腹部大動脈に進め、近位のシルク止血帯を緩めてカテーテルの通過を可能にします。巾着縫合糸を締め、カテーテルの周りに結びます。
- 手順3.20と3.21を繰り返して、BPチャネルに対応する圧力カテーテルを使用して大腿静脈カニューレ挿入を行い、腹部IVCに進めます(図1D)。
- 透視法を使用して、カテーテルの先端がIVCと大動脈に適切に配置されていることを確認します。
- 2-0吸収性縫合糸を使用してザルトリウス筋を再近似します。
- 深部真皮縫合糸と皮下縫合糸で、それぞれ3-0吸収性縫合糸と4-0吸収性縫合糸を使用して皮膚を閉じます。
4.方法2:頸動脈と内頸静脈カニューレ挿入
- 羊を左首の周りと胸の上の広い範囲で剃ります。
- 羊を手術台の右側褥瘡に置き、左前肢をスリップノットタイを使用して屈曲で固定し、胸を露出させます(図2A)。
- 左頸動脈とIJ静脈、胸部入口までの頭蓋骨約7cmの上に5cmの縦方向の皮膚切開を行います。
- 電気焼灼を使用して、皮下脂肪、結合組織、および板腫を解剖し、頸部血管を露出させます(図2B)。
- 鈍的解剖と鋭い解剖の組み合わせを使用して、左頸動脈とIJ静脈から結合組織を円周方向にきれいにします。
- 一時的な血管結紮のために、カニューレ挿入部位の近位と遠位の両方の血管の周りにダブルループの2-0シルクタイを通します。
- 肩甲骨と頸椎の間の左首の付け根に6cmの縦切開を行います。
- 電気焼灼と鈍的解剖を組み合わせて、皮下脂肪と結合組織を解剖し、脊椎に向かって伸びる6cm×4cmのポケットを作ります。
- テレメトリーデバイスを皮下ポケットに挿入し、2-0シルク縫合糸を使用して所定の位置に固定します。
- テレメトリーデバイスのアンテナを皮下組織の下にトンネルで固定し、2-0シルク縫合糸を使用して所定の位置に固定します。
- 心電図リードを配置するために、首の付け根と左下と右上の胸に1cmのカウンタースキン切開を行います。皮下トンネルを通して、これらの切開部をデバイスのボディポケットに接続し、ECGリードを目的の場所に導きます(図2C)。
- ECGリード線は、上記の大腿骨インプラント手順(セクション3)の手順と同様に配置します。
- 外側のデバイスポケットから内側の頸部切開部まで皮下トンネルを作成し、2本の圧力カテーテルを通します。大腿骨インプラントの手順で詳しく説明されているように、カニューレ挿入前にゲルを使用してこれらの圧力カテーテルを準備します。
- 6-0ポリプロピレン縫合糸を使用して、両方の血管のカニューレ挿入部位の周りに財布紐ステッチを配置し、プラスチック製の止血帯で固定します。
- カニューレ挿入の3分前に静脈内ヘパリン(100ユニット/ kg)を投与します。.
- 頸動脈の周りの近位および遠位の2-0シルク止血帯を締めます。#11ブレードメスを使用して、巾着ステッチの中央にある血管に慎重に切込み、湾曲した止血剤の先端でわずかに拡張します。
- LVPチャネルに対応する圧力カテーテルを挿入し、胸部上行大動脈に進め、近位のシルク止血帯を緩めてカテーテルの通過を可能にします。巾着縫合糸を締め、カテーテルの周りに結びます。
- 手順4.16と4.17を繰り返して、BPチャネルに対応する圧力カテーテルを使用して左IJ静脈のカニューレ挿入を行い、胸部SVCに進めます。
- 透視法を使用して、胸部SVCおよび上行大動脈のカテーテル先端の適切な位置を確認します(図2D)。
- 2-0吸収性縫合糸を使用して板腫筋を再近似します。
- 深部真皮縫合糸と皮下縫合糸で、それぞれ3-0吸収性縫合糸と4-0吸収性縫合糸を使用して皮膚を閉じます。
5. リカバリー
- 麻酔薬を中止します。.口腔胃管を取り外し、羊が人工呼吸器の補助なしで呼吸しているときに抜管します。これは通常、羊が覚醒の兆候(動き、まばたき、痛みを伴う刺激への反応、顎のトーン、咀嚼)を示した後に発生します。
- 幹線を取り外します。
注:テレメトリーデバイスの圧力カテーテルの1つが大動脈に配置されている場合、継続的な血圧モニタリングを提供できます。 - 羊を隔離されたハウジングユニットに移して回復させます。羊が胸骨の横臥位にとどまり、最終的には立っているのを助けます。
- 術後の痛みに対して、バナミン(2.2 mg / kg)とブプレノルフィンSR(0.03 mg / kg)を静脈内投与します。.
結果
手術結果
合計 13 頭のヒツジが、右心房からの SVC と IVC の両方の剥離を伴う全大肺接続、SVC から PA への直接端間吻合、および IVC と PA の間の心臓外導管の配置を含む単段階のフォンタン手術を受けました。羊は平均年齢13.3ヶ月±7.6ヶ月でこの手順を受けました。これらのうち、3頭のヒツジは、腹部大動脈とIVCに圧力感知カテーテルを配置するワイヤレステレメトリーデバイスの埋め込みを受けました。2頭のヒツジは、上行大動脈とSVCに圧力感知カテーテルを配置してテレメトリーデバイスの埋め込みを受けました。また、8頭のヒツジにはテレメトリーデバイスが埋め込まれていませんでした。テレメトリーデバイスの移植後に術後の主要な合併症を経験した動物はいませんでした。テレメトリーデバイスを持たない8頭のヒツジのうち7頭(87.5%)は、フォンタン手術後30日以内に死亡しましたが、テレメトリーデバイスを使用した5頭のうち1頭(20.0%)だけがこの術後の期間中に死亡しました(表1)。
血行動態データ収集
ワイヤレステレメトリーシステムの移植により、心拍数、動脈血圧、CVPなど、いくつかの心血管パラメータの継続的および長期的なデータ収集が容易になりました。これにより、手術前、手術中、手術後数日間、フォンタンの単期手術を受ける動物の血行動態を綿密にモニタリングすることができました(図3)。静脈圧の変動は分刻みで観察されましたが、全体的な傾向は、フォンタン循環の確立後、腹部IVC(図4A)と胸部SVC(図4B)の両方の圧力が急激に増加しているように見えました。静脈圧の分刻みの変動は、羊の活動レベルと位置に起因する可能性があります。例えば、ヒツジが横臥状態で腹部に休んでいるとき、腹部のIVCの圧力は一貫して増加することが観察されました(図5)。1頭のヒツジでは、頸部にデバイスを埋め込んだ同じ日にカテーテル法を行い、SVCに静脈圧チャネルを配置しました。これは、テレメトリーデバイスによって報告された値と、ゴールドスタンダードと見なされていた侵襲的圧力モニタリングから取得した値との間の不一致を評価するために行われました。カテーテル法から得られた非拍動性の平均SVC圧は2〜4mmHgの間で変動し、振動は呼吸周期に沿った胸腔内圧の変化に起因するものでした(図6)。手順全体を通じて、テレメトリデバイスは、1分あたり平均43回の非拍動平均SVC圧力の読み取り値を出力し、全体の平均SVC圧力は1.1±3.1mmHgであり、デバイスの測定値と実際の値との間のオフセットが最小であることを示しています。

図1:大腿動脈と静脈カニューレ挿入によるデバイス埋め込み。 大腿動脈と静脈カニューレ挿入によるデバイス移植の場合、羊は仰臥位で配置され、後ろ足が伸展します。(A) 術前のマーキングは、計画された切開部の位置、デバイスのボディポケット、およびECGリードと圧力感知カテーテルの皮下経過を最終位置まで示しています。(B)テレメトリーデバイス本体を配置するために、皮下組織と外斜筋の上との間に約6cm×4cmの皮下ポケットを作成します。(C)大腿骨血管は、ザルトリウス筋の分裂に続いて露出します。触知可能な大腿動脈 (白い矢印) は、大腿静脈 (青い矢印) の内側に位置しています。(D)大腿動脈(白矢印)と静脈(青矢印)に感圧カテーテルを挿入し、巾着縫いで固定します。 この図の拡大版を表示するには、ここをクリックしてください。

図2:左頸動脈と内頸静脈(IJ)カニューレ挿入によるデバイス埋め込み。 左頸動脈と内頸静脈 (IJ) カニューレ挿入によるデバイス移植の場合、羊は左前脚を後方に伸ばした状態で右外側褥瘡に配置されます。(A) 術前のマーキングは、計画された切開の位置を示しています。(B)左頸動脈(白矢印)とIJ静脈(青矢印)は、板腫の分裂後に露出しています。頸動脈は、IJ静脈の深く外側に位置しています。(C)ECGリードの余分な配線をコイル状に巻いて皮下空間に固定します。正のリード線は胸骨の下面の左側に配置され(黒の矢印)、負のリード線は胸骨の上面の右側に配置されます(赤い矢印)。(D)上大静脈(青矢印)と上行大動脈(白矢印)における圧力感知カテーテル先端の配置を透視法で確認した。ECGのポジティブリード線(黒矢印)とネガティブリード線(赤矢印)の位置は、X線画像でも確認できます。 この図の拡大版を表示するには、ここをクリックしてください。

図3:継続的な監視のためのワイヤレステレメトリデバイスの埋め込み。 ワイヤレステレメトリーデバイスの埋め込みにより、周術期を通じてフォンタン生存ヒツジモデルで、心拍数、動脈圧、静脈圧などのいくつかの心血管パラメータを継続的に監視することができました。このグラフに示されている血行動態の傾向は、腹部大動脈および下大静脈(IVC)内に留置された圧力感知カテーテルから収集されたデータを表しています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:圧力感知カテーテルの位置決め。 圧力感知カテーテルは、中心静脈圧を連続的に記録するために、(A)腹部下大静脈(IVC)または(B)胸部上大静脈(SVC)のいずれかに配置されました。静脈圧の測定は、術前、術中、フォンタン手術中、および術後に取得され、フォンタン循環の確立後の傾向を評価しました。圧力測定値の分刻みの変動は、動物の位置と活動レベルの変化に伴って発生しました。 この図の拡大版を表示するには、ここをクリックしてください。
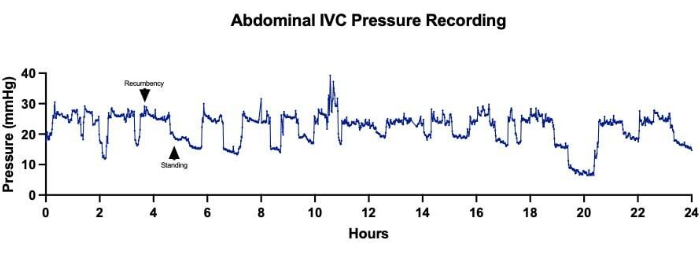
図5:腹部下大静脈(IVC)圧。 24時間にわたって腹部IVC圧を連続的に取得すると、ヒツジの体位の変化と相関する圧力測定値の変動が示されました。平均IVC圧が高いほど、羊が横臥位で休んでいる時間に対応し、羊が立っているときの平均IVC圧が低いことが記録されました。 この図の拡大版を表示するには、ここをクリックしてください。

図6:SVCの侵襲的圧力測定。 テレメトリーシステムからの優れた大静脈(SVC)圧力測定値を確認するために、1頭のヒツジにデバイスを埋め込んだ翌日にカテーテル法を実施しました。この侵襲的圧力モニタリングの方法によって取得された値は、ゴールドスタンダードと見なされていました。カテーテル法から得られる非拍動性の平均 SVC 圧力は、呼吸周期と同期して 2 〜 4 mmHg の間で変動しました。一方、手順中にテレメトリーデバイスによって収集されたすべての非拍動性平均SVC圧力の平均は1.1 ± 3.1 mmHgであり、テレメトリーの読み取り値と実際の値との間のオフセットが最小であることを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
| 羊 | 性 | テレメトリーデバイスカテーテルの配置 | フォンタン操業時の重量(kg) | フォンタン手術時の年齢(月) | 周術期の死 |
| 1 | M | 何一つ | 45 | 13 | はい |
| 2 | F | 何一つ | 43 | 13 | いいえ |
| 3 | M | 何一つ | 46.5 | 25 | はい |
| 4 | F | 何一つ | 46.5 | 19 | はい |
| 5 | M | 何一つ | 50 | 20 | はい |
| 6 | F | 何一つ | 53 | 28 | はい |
| 7 | M | 何一つ | 40.5 | 8 | はい |
| 8 | M | 何一つ | 42 | 10 | はい |
| 9 | F | 腹部大動脈とIVC | 33.5 | 3 | いいえ |
| 10 | M | 腹部大動脈とIVC | 24 | 7 | はい |
| 11 | M | 腹部大動脈とIVC | 29 | 8 | いいえ |
| 12 | M | 上行大動脈とSVC | 37.5 | 13 | いいえ |
| 13 | M | 上行大動脈とSVC | 39.5 | 6 | いいえ |
表1:手術結果。 13頭の羊が1段階のフォンタン手術を受け、そのうち5頭は1か月前に無線テレメトリーデバイスの埋め込みを受けていました。フォンタン手術後、テレメトリーデバイスを持たない8頭の羊のうち7頭(87.5%)が30日以内に死亡したのに対し、テレメトリーデバイスを搭載した羊は5頭中1頭(20.0%)が死亡しました。
ディスカッション
私たちは、無線テレメトリーデバイスをヒツジモデルに埋め込むための2つの外科的方法を開発しました。このデバイスは5頭のヒツジに移植され、心拍数、動脈血圧、腹部IVCおよび胸部SVCからの局所静脈圧など、いくつかの心血管パラメータの継続的かつ長期的なモニタリングと記録を達成しました。すべての羊は、大きな合併症なしにデバイス埋め込み手術を生き延び、1か月後に1段階のフォンタン手術を受けました。
2019年、Van Puyveldeらは、フォンタン不全の慢性過程を研究するための最初のフォンタンヒツジ生存モデルの作成を報告しました13。しかし、動物の3分の2は、最終的に術後20週目を超えて生存しませんでした。特に、正常な心臓を持つ動物では、急性フォンタン循環を確立することは非常に困難です。これは、おそらく、彼らがこの特定の生理学的状態に対して単心室の心臓よりも適応していないためです。したがって、テレメトリーデバイスの埋め込みの有用性は2つあります。第一に、術後の期間にバイタルを綿密に監視する能力は、心血管代償不全の兆候を迅速に認識し、反応することを可能にするだけでなく、目標指向型治療の開始を促進する可能性があります。私たちの経験では、1段階のフォンタン手術を受けている羊のコホートに無線テレメトリデバイスを埋め込むことは、彼らの生存率の向上に貢献しました。第二に、長期的にリアルタイムのデータを取得する能力により、フォンタンの失敗に関連する血行動態の進行傾向を特定することができます。
私たちは慢性的なフォンタン大動物モデルの作成に焦点を当ててきましたが、ワイヤレステレメトリシステムの利点は、フォンタンの故障の場合に機械的な循環支援を提供することを目的とした新しいカボ肺補助装置(CPAD)の試験や開発など、他の取り組みにも適用できます。いくつかのグループは、フォンタン循環16,17,18,19に適用されるCPADの実現可能性と機能的能力を調べる大規模な動物実験を発表しています。ただし、これらの実験の大部分は、手術室の外で実行できないデータ収集方法を使用して血行動態のパフォーマンスを短期的に評価する急性フォンタンモデルで実施されました。2019年、Cysykらは、フォンタンヒツジの生存モデル14,15にCPADの移植が成功したことを発表しました。彼らの研究では、液体で満たされた圧力監視ラインがSVC、IVC、PA、および左心房に配置され、胸部後壁から引き出されて、30日間の研究期間にわたって継続的な圧力測定が行われました。この方法は彼らの研究の目的には概ね十分でしたが、彼らはカテーテルの移動に問題があることに気づきました。30日を超える長期データ収集の場合、ワイヤレステレメトリシステムの使用がより好ましいことが証明される可能性があります。
テレメトリーデバイスの埋め込みを受けた羊は、この手順の結果として大きな合併症を経験しませんでした。しかし、手術の数週間後に治癒した切開部位で、1頭の羊の皮膚から心電図リードが侵食されていることが判明しました。これは、羊は通常、心電図リードが皮下に配置されていた部位の胸骨前部に体重がかかった状態で胸骨に横たわって休むため、褥瘡に関連していると感じられました。したがって、ECGリードの侵食を避けるために、ECGリードは、デバイス埋め込みを受ける将来の羊の胸骨の真上ではなく横方向に配置され、それ以来、他の羊はこの問題を経験していません。
圧力測定値が正確であることを保証するには、複数の手順が必要です。まず、テレメトリーデバイスは、カテーテルの先端がデバイス本体と同じ高さになるように、元のパッケージ内にある間、平らな面で大気圧にゼロにする必要があります。圧力感知カテーテルを血管に挿入する前に、透明なゲル内に気泡が入らないように注意しながら、カテーテルの先端に非圧縮性の高粘度ゲルを充填する必要があります。最後に、高さの違いが圧力測定値を歪める可能性があるため、カテーテルの先端に対するデバイス本体の位置に注意することが重要です。デバイス本体を下腹部の上または肩甲骨の後方の首の付け根に配置して、羊が直立したときに腹部IVCまたは胸部SVC内のカテーテル先端とそれぞれほぼ同じ高さになるようにすることを選択しました。
注目すべきは、テレメトリーデバイスの本体を、心臓、大血管、肝臓などの関心領域から少なくとも15cm離れた場所に配置して、将来の磁気共鳴画像法で生成される可能性のあるアーティファクトの量を最小限に抑えたことです。最後に、圧力感知カテーテルを左頸動脈とIJ静脈に挿入して、将来の右IJ静脈を介したカテーテル挿入手順を実行できるようにしました。
現時点では、説明したようにワイヤレステレメトリシステムの使用にはいくつかの制限があります。注目すべきは、デバイスインプラントのバッテリー寿命が84日であることです。一度埋め込まれたデバイスのバッテリーは、再充電や交換ができません。ただし、デバイスの使用を延長するためにデータ収集が必要な期間中は、デバイスの電源をオフにしたり、再度オンにしたりする場合があります。さらに、静脈圧の測定値は動物の位置によって異なることが観察されており、これが静脈内圧の真の変化によるものなのか、カテーテルの先端に対するデバイス本体の位置の変化によるものなのかは不明です。さらに、テレメトリーデバイスの本体は、動物が直立しているときにIVCまたはSVCのカテーテル先端とほぼ同じ高さに配置されていましたが、解剖学的制限のために高さの違いが残っていました。頸部インプラントはSVCのカテーテル先端よりもデバイス本体が、鼠径部インプラントはIVCのカテーテル先端よりもデバイス本体が下方に位置していました。それにもかかわらず、圧力値の全体的な傾向を調べることは、発生する可能性のある血行動態の変化について重要な洞察を提供する可能性があります。これらのテレメトリーシステムによって収集された長期データのさらなる分析は、慢性的なフォンタン生理学とフォンタン不全のメカニズムをより完全に理解するために必要になります。術後に行われる追加のカテーテル法手順も必要になります テレメトリー出力の精度を確認し、時間の経過とともに発生する可能性のあるセンサードリフトを特定するために。最後に、体細胞の成長の結果としてのデバイスカテーテルチップの変位は、特にテレメトリーユニットが若い動物に埋め込まれている場合、潜在的な懸念事項です。放射線不透過性カテーテルチップの位置は、術後のカテーテル処置中に確認および確認することができます。
ワイヤレステレメトリーシステムにより、自由に動く大型動物モデルから連続的な血行動態データをリアルタイムで長期間収集することができます。IVCとSVC、腹部大動脈と上行大動脈に圧力感知カテーテルを配置して、これらのデバイスを外科的に埋め込むことは、安全で実現可能です。
開示事項
このプロジェクトは、カリフォルニア州パロアルトのAdditional Ventures Cures Collaborativeから資金提供を受けました。
謝辞
動物研究コアの献身的な獣医師スタッフに感謝しています。また、Mary Walker (DVM, MS) の貴重な専門知識と研究全体にわたる細心の注意を払っていただいたことにも感謝の意を表したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
参考文献
- Fontan, F. Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L. Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), 387-394; discussion 394-385 (1996).
- Iskander, C. et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244 (2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. Statpearls, Treasure Island, FL (2024).
- Daley, M. D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit? J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z. et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601 (2024).
- Al Balushi, A. Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J. et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260 (2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F. et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J. et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J. et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P. et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240--1249 (2021).
- D'udekem, Y. et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594 (2024).
- Granegger, M. et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X. et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J. et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M. et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H. et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. At <https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l > (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved