Method Article
Implantation eines drahtlosen Telemetriegeräts in ein Fontan-Schafmodell zur kontinuierlichen und langfristigen hämodynamischen Überwachung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die chirurgische Methodik für die Implantation eines drahtlosen Telemetriegeräts für Großtiere, um eine kontinuierliche und langfristige Erfassung hämodynamischer Daten zu ermöglichen, einschließlich Herzfrequenz, arterieller Blutdruck, unterer und oberer Hohlvenendruck und Herzrhythmus.
Zusammenfassung
Während das Fontan-Verfahren die Lebenserwartung von Patienten mit einem Ventrikel drastisch verbessert, ist allgemein anerkannt, dass die daraus resultierende Durchblutung als Folge eines chronisch erhöhten zentralvenösen Drucks und eines verminderten Herzzeitvolumens langfristig zu einer erheblichen Krankheitslast führt. Chronische Fontan-Tiermodelle sind eine wertvolle Bereicherung für die Untersuchung der späten physiologischen Ergebnisse dieser Operation und ein notwendiges Werkzeug bei der Bewertung zukünftiger Geräte zur Linderung des Fontan-Versagens. Frühere Versuche, chronische Fontan-Modelle zu erstellen, wurden jedoch durch schlechte Überlebensraten behindert. Darüber hinaus stellt eine effektive hämodynamische Datenerfassung bei frei beweglichen Tieren eine große Herausforderung dar. Zu diesem Zweck bietet der Einsatz von drahtlosen implantierbaren Telemetriesystemen eine neuartige Lösung für die Echtzeit- und Langzeitüberwachung von Herz-Kreislauf-Daten. Dieses Protokoll beschreibt die Methodik für die chirurgische Implantation eines drahtlosen Telemetriegeräts in einem Fontan-Überlebensschafmodell, das die kontinuierliche und kontinuierliche Aufzeichnung verschiedener hämodynamischer Parameter ermöglicht, einschließlich Herzfrequenz, arterieller Blutdruck und lokalisierter Drücke in der unteren (IVC) und oberen Hohlvene (SVC). Telemetriegeräte wurden mit einer Kanülierung entweder der Halsschlagader und der Vena jugularis interna oder der Arteria femoralis und der Vene femoralis implantiert, um druckempfindliche Katheter in der Aorta ascending und SVC bzw. in der abdominalen Aorta bzw. IVC zu platzieren. Der Einsatz der drahtlosen Telemetriesysteme ermöglichte eine engmaschige postoperative Überwachung nach einer einstufigen Fontan-Operation, was zu einem verbesserten Wohlergehen und Überleben der Tiere beitrug.
Einleitung
Die Entwicklung des Fontan-Verfahrens im Jahr 1971 führte zu einer signifikanten Verbesserung der Ergebnisse bei Patienten mit einem Ventrikel1. Der Zweck dieser Operation besteht darin, den systemischen und pulmonalvenösen Rückfluss zum Herzen zu trennen, wodurch die systemische Sauerstoffversorgung erhöht und die Volumenbelastung des systemischen Ventrikels verringert wird. Seit seiner Einführung wurden zahlreiche Modifikationen am chirurgischen Ansatz vorgenommen. Gegenwärtig wird der totale Bypass des rechten Herzens am häufigsten durch eine stufenweise Rekonstruktion erreicht 2,3. In der Regel wird die erste Phase in der ersten Lebenswoche durchgeführt4. Die Patienten durchlaufen dann eine zweite Phase, die entweder aus dem Glenn-Verfahren oder der Hemi-Fontan-Behandlung besteht, um den Blutfluss von der oberen Hohlvene (SVC) zur Lungenarterie (PA) umzuleiten5. Daran schließt sich das Fontan-Verfahren an, bei dem ein extrakardialer Kanal oder lateraler Tunnel zwischen der Vena cava inferior (IVC) und PA6 angelegt wird. Chirurgische Fortschritte, wie sie in der Geschichte des Fontan-Verfahrens erzielt wurden, hätten ohne die Verwendung von Tiermodellen nicht erreicht werdenkönnen 7.
Während das Fontan-Verfahren die Lebenserwartung von Patienten mit einem Ventrikel drastisch verbessert, ist allgemein anerkannt, dass der resultierende Kreislauf, der ohne subpulmonale Pumpe auskommt, langfristig eine erhebliche Krankheitslast als Folge eines chronisch erhöhten zentralvenösen Drucks (ZVP) und eines verminderten Herzzeitvolumens verursacht 8,9,10,11,12 . Chronische Fontan-Tiermodelle sind eine wertvolle Bereicherung für die Untersuchung der späten physiologischen Ergebnisse im Zusammenhang mit dieser Operation13. Die aktive Datenerfassung von kardiovaskulären Parametern wie ZVP, Herzfrequenz und anderen Vitalparametern zur Erfassung der postoperativen hämodynamischen Veränderungen ist für eine umfassende Bewertung der sich entwickelnden Pathophysiologie unerlässlich. Darüber hinaus sind Tiermodelle ein notwendiges Werkzeug, um die Leistungsfähigkeit neuartiger ventrikulärer Unterstützungssysteme zu testen, die entwickelt wurden, um die hämodynamischen Mängel der Fontan-Zirkulation in vivozu lindern 14,15,16,17,18,19.
Eine effektive Datenerfassung stellt jedoch eine große Herausforderung dar. Invasive katheterbasierte Techniken sind durch ihre vorübergehende Natur, die damit verbundenen Verfahrensrisiken und die Unfähigkeit, den Zustand des Tieres über längere Zeiträume zu überwachen, begrenzt. Darüber hinaus wurden frühere Versuche, ein Fontan-Modell für Großtiere zu erstellen, durch schlechte Überlebensraten behindert, vermutlich aufgrund des Versagens normaler Herzen, sich an die akute Etablierung des Fontan-Kreislaufs anzupassen 7,20. Zu diesem Zweck bietet der Einsatz von drahtlosen Telemetriesystemen eine neuartige Lösung für die langfristige Echtzeiterfassung von kardiovaskulären Daten bei frei beweglichen Tieren21,22. Diese Geräte können auch eine engmaschige postoperative Überwachung ermöglichen, was zu einem verbesserten Tierschutz und Überleben führen könnte.
Hier beschreiben wir die Methodik für die erfolgreiche Implantation und Anwendung eines drahtlosen Telemetriesystems23 in einem chronischen Fontan-Schafmodell. Diese Technik bot ein robustes und zuverlässiges Mittel zur kontinuierlichen hämodynamischen Datenerfassung, das die Untersuchung des venösen Drucks und anderer wichtiger physiologischer Parameter ermöglichte. Die Implementierung dieser Technologie in präklinischen Modellen ist entscheidend für unser besseres Verständnis der Fontan-Physiologie und die Entwicklung neuer therapeutischer Strategien, die darauf abzielen, die langfristigen Ergebnisse von Fontan-Patienten zu verbessern.
Protokoll
Dieses Versuchsprotokoll wurde vom Institutional Animal Care and Use Committee des Nationwide Children's Hospital Abigail Wexner Research Institute (AR20-00121) genehmigt. Alle Verfahren entsprachen den Richtlinien des National Institute of Health's Guide for the Use and Care of Laboratory Animals. Diese Forschung folgte den Richtlinien für Tierversuche: Berichterstattung über In-vivo-Experimente . Dorset-Schafe mit einem Gewicht von 23-38 kg und einer Altersspanne von 2-12 Monaten wurden vor der Operation mindestens 1 Woche lang in einer spezifisch pathogenfreien Umgebung mit freiem Zugang zu Futter und Wasser untergebracht. Die in der Studie verwendeten Geräte und Reagenzien sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Tiere
- Lassen Sie das Schaf 1 Woche vor der Operation vom Tierarztteam untersuchen, um sicherzustellen, dass es sicher anästhesiert werden kann. Schnelle gesunde Schafe und 12 Stunden vor dem chirurgischen Eingriff ohne Wasser.
- Beruhigung mit einer Kombination aus Ketamin (4 mg/kg) und Diazepam (0,5 mg/kg), die durch eine Vena jugularis interna (IJ) injiziert wird.
- Rasieren Sie das Schaf gemäß dem geplanten Verfahren (siehe unten) und über dem Oberschenkel für die Platzierung des Elektrokauter-Erdungskissens. Reinigen Sie die Operationsstellen mit Alkohol.
- Führen Sie einen 8-9 mm einlumigen Endotrachealtubus in die Luftröhre ein.
- Legen Sie eine Magensonde zur Dekompression von Magen und Pansen ein.
- Führen Sie einen einlumigen Venenkatheter (16-18 G) in die rechte Jugularvene oder eine Vena saphena lateralis ein, um eine kontinuierliche Flüssigkeitsverabreichung, eine kontinuierliche Infusion (CRI) von Propofol und eine Medikamenteninjektion nach Bedarf durchzuführen.
- Legen Sie einen arteriellen Zugang (22-24 G) in eine Ohrarterie zur kontinuierlichen Blutdrucküberwachung.
- Platzieren Sie eine Blutdruckmanschette an der rechten vorderen Extremität für die nicht-invasive Blutdruckmessung, einen Clip am Ohr oder an der Zunge zur Überwachung der Sauerstoffsättigung und Elektrokardiogramm (EKG) an allen vier Gliedmaßen.
- Während des Eingriffs ist die Anästhesie mit inhalativem Isofluran 1%-3% mit 100% O2 und/oder Propofol CRI (20-45 mg/kg/h) aufrecht zu erhalten.
- Reinigen Sie die Operationsstellen aseptisch mit einem Präparat auf Chlorhexidin-Basis und bedecken Sie sie auf die übliche sterile Weise.
- Verabreichen Sie Cefazolin (25 mg/kg) zur Antibiotikaprophylaxe vor der Inzision und dosieren Sie während der Operation alle 4 Stunden nach Bedarf.
- Verabreichen Sie vor der Inzision eine subkutane Injektion eines Lokalanästhetikums wie Bupivacain 0,25% an allen geplanten Inzisionsstellen.
2. Vorbereitung des Telemetriegeräts
- Öffnen Sie das Telemetrie-Softwareprogramm, und schalten Sie das Telemetriegerät mit dem Magnetschalter ein, während es noch in der Originalverpackung versiegelt ist.
- Klicken Sie im Softwareprogramm in der oberen Leiste auf Hardware und wählen Sie Edit PhysioTel Digital (CLC) Configuration , um die Telemetrieeinheit einem Communication Link Controller (CLC) zuzuweisen.
- Sobald ein CLC ausgewählt ist, wird die Seite mit den CLC-Details geöffnet. Klicken Sie auf dieser Seite auf Nach Implantaten suchen, um eine Suche nach Implantaten zu starten, die in der Nähe eingeschaltet sind.
- Klicken Sie auf Hinzufügen , um die Telemetrieeinheit zur Liste Ausgewählte Implantate hinzuzufügen. Das Gerät wird nun in der Liste "Konfigurierte Implantate" auf der Seite "CLC-Details " angezeigt. Klicken Sie auf Speichern und beenden.
- Starten Sie die Datenerfassung, indem Sie auf der Registerkarte Samplingsteuerung auf die Schaltfläche Wiedergabe neben dem Namen der Telemetrieeinheit klicken. Das Diagramm, das die Live-Datenerfassung anzeigt, wird automatisch geöffnet.
- Nehmen Sie das Gerät aus der Außenverpackung und bringen Sie es in die sterile Innenverpackung auf den Operationstisch.
- Stellen Sie das Gerät auf Null, während es in der Innenverpackung verbleibt. Warten Sie, bis die Messungen des Geräts 30 s lang stabil waren, und verwenden Sie die stabilisierten NPMN-Druckwerte (Non-Pulsatile Mean) als Offset.
- Wählen Sie in der Subject-Einrichtung das Einstellungssymbol neben dem Parameter aus, der auf Null gesetzt wird, und öffnen Sie die Registerkarte Offsets . Geben Sie den aus den NPMN-Messungen erhaltenen Versatzwert in das Textfeld ein.
- Überprüfen Sie nach Eingabe des Offsets, ob die NPMN-Messwerte 0 ± 0,1 mmHg betragen. Wenn nicht, wiederholen Sie Schritt 2.7, bis die Werte im gewünschten Bereich liegen.
- Führen Sie die Schritte 2.7-2.9 für beide Druckkanäle durch.
- Bevor Sie die Druckmesskatheter in ein Blutgefäß einführen, klopfen Sie auf die Spitze, um den entsprechenden Kanal zu identifizieren. Taps werden in der Wellenformausgabe sichtbar.
- Verwenden Sie den Katheter für den linksventrikulären Druckkanal (LVP) für die arterielle Druckmessung und den Blutdruckkanal (BP) für die venöse Druckmessung.
- Legen Sie auf der Registerkarte Standardattribute des Dialogfelds Attribute für die Blutdruckanalyse die minimale Pulshöhe für den Blutdruckkanal auf 1 mmHg fest.
3. Methode 1: Kanülierung der Oberschenkelarterie und der Venen
- Rasieren Sie das Schaf in einem breiten Umfang um die rechte Leiste und über Bauch und Brust.
- Positionieren Sie das Schaf in Rückenlage auf dem Operationstisch, wobei die vorderen Gliedmaßen mit einem flexiblen Stoffgurt in Beugung gesichert sind und die Hintergliedmaßen mit einem Schlupfknoten in Verlängerung gesichert sind, um den Zugang zur Leiste zu ermöglichen (Abbildung 1A).
- Machen Sie einen 5 cm langen Querschnitt in der rechten Leistenregion, zentriert über der tastbaren Oberschenkelarterie, etwa 1 cm unterhalb der Leistenfalte.
- Mit einer Kombination aus Elektrokauter und stumpfer Dissektion wird durch das Unterhautgewebe bis zum Femurdreieck präpariert. Lokalisieren Sie die Femurgefäße, indem Sie auf den arteriellen Puls tasten.
- Teilen Sie zwischen dem Musculus sartorius und dem Musculus adductor longus entlang der Richtung der Muskelfasern, um die Femurgefäße freizulegen (Abbildung 1B).
- Mit einer Kombination aus stumpfer und scharfer Dissektion wird das Bindegewebe umlaufend von den Oberschenkelgefäßen befreit.
- Führen Sie eine doppelt geschlungene 2-0-Seidenbinde um beide Gefäße proximal und distal zur Kanülenstelle für eine temporäre Gefäßligatierung.
- Machen Sie einen 6 cm langen Querschnitt durch die Haut im rechten Unterbauch, etwa 3 cm über der Leistenfalte.
- Mit einer Kombination aus Elektrokauter und stumpfer Dissektion wird das Unterhautfett und das Bindegewebe durchtrennt, um eine 6 cm x 4 cm große Tasche zu schaffen, die oberflächlich zum äußeren Bauchmuskel reicht.
- Führen Sie das Telemetriegerät in die Unterhauttasche ein und befestigen Sie es mit einer 2-0-Seidennaht (Abbildung 1C).
- Tunneln Sie die Antenne des Telemetriegeräts unter das Unterhautgewebe und befestigen Sie sie mit einer 2-0-Seidennaht.
- Für die Platzierung der Biopotential-Ableitungen (EKG) werden 1 cm lange Gegenschnitte in der Haut über dem Mittel- und Unterbauch sowie der unteren und oberen Brust vorgenommen. Tunneln Sie subkutan, um diese Schnitte mit der Körpertasche des Geräts zu verbinden und die EKG-Ableitungen an die gewünschte Stelle zu führen.
- Platzieren Sie die positive Elektrode im Unterhautgewebe links vom unteren Brustbein. Stellen Sie sicher, dass der Silikonschlauch entfernt wird, um die Spitze des Stahldrahts darunter freizulegen.
- Platzieren Sie die negative Elektrode im Unterhautgewebe rechts vom oberen Brustbein.
- Überschüssige Drähte für beide Elektroden können aufgewickelt und an der subkutanen Stelle mit einer 2-0-Seidennaht gesichert werden.
- Legen Sie einen subkutanen Tunnel von der unteren Bauchtasche bis zum Leistenschnitt an und fädeln Sie die beiden Druckkatheter durch.
- Legen Sie einen Taschenstich mit einer 6-0-Polypropylen-Naht um die Kanülenstelle sowohl der Oberschenkelarterie als auch der Vene, die mit einem Kunststoff-Tourniquet gesichert werden kann.
- Füllen Sie die Kathetergelspitzen mit nicht komprimierbarem, hochviskosem Gel, um eine Koagulation in den Katheterspitzen zu verhindern und sicherzustellen, dass keine Luftblasen entstehen.
- Verabreichen Sie 3 Minuten vor der Kanülierung eine Dosis intravenöses Heparin (100 Einheiten/kg).
- Ziehen Sie die proximalen und distalen 2-0 Seidentourniquets um die Oberschenkelarterie fest. Mit einem Skalpell #11 vorsichtig in das Gefäß in der Mitte des Handbeutel-Fadenstichs einschneiden und mit der Spitze eines gebogenen Blutkörpers leicht erweitern.
- Führen Sie den Druckkatheter ein, der dem LVP-Kanal entspricht, und schieben Sie ihn in die Bauchaorta vor, wobei Sie das proximale Seidentourniquet lösen, um die Passage des Katheters zu ermöglichen. Ziehen Sie die Naht an der Handtasche fest und binden Sie sie um den Katheter.
- Wiederholen Sie die Schritte 3.20 und 3.21 für die Kanülierung der Oberschenkelvene mit dem Druckkatheter, der dem Blutdruckkanal entspricht, und schieben Sie ihn in die abdominale IVC vor (Abbildung 1D).
- Vergewissern Sie sich, dass sich die Katheterspitzen in der IVC und der Aorta mit Hilfe der Fluoroskopie befinden.
- Nähern Sie sich dem Sartorius-Muskel mit einer resorbierbaren Naht 2-0 an.
- Verschließen Sie die Haut mit tiefen dermalen und subkutikulären Nähten mit resorbierbaren Nähten 3-0 bzw. 4-0.
4. Methode 2: Kanülierung der Halsschlagader und der Vena jugularis interna
- Rasieren Sie das Schaf in einem weiten Umfang um den linken Hals und über die Brust hinunter.
- Positionieren Sie das Schaf im rechten lateralen Dekubitus auf dem Operationstisch, wobei das linke vordere Glied mit einem Slipknotbinder in Beugung gesichert ist, um die Brust freizulegen (Abbildung 2A).
- Machen Sie einen 5 cm langen Längsschnitt über der linken Halsschlagader und der Vene IJ, etwa 7 cm kranial zum thorakalen Einlass.
- Präparieren Sie mit Elektrokauter das Unterhautfett, das Bindegewebe und das Platysma, um die Halsgefäße freizulegen (Abbildung 2B).
- Mit einer Kombination aus stumpfer und scharfer Dissektion wird das Bindegewebe von der linken Halsschlagader und der Vena IJ umlaufend entfernt.
- Führen Sie eine doppelt geschlungene 2-0-Seidenbinde um beide Gefäße proximal und distal zur Kanülenstelle für eine temporäre Gefäßligatierung.
- Machen Sie einen 6 cm langen Längsschnitt an der Basis des linken Halses zwischen dem Schulterblatt und der Halswirbelsäule.
- Mit einer Kombination aus Elektrokauter und stumpfer Dissektion das Unterhautfett und das Bindegewebe durchtrennen, um eine 6 cm x 4 cm große Tasche zu schaffen, die sich in Richtung Wirbelsäule erstreckt.
- Führen Sie das Telemetriegerät in die Unterhauttasche ein und befestigen Sie es mit einer 2-0-Seidennaht.
- Tunneln Sie die Antenne des Telemetriegeräts unter das Unterhautgewebe und befestigen Sie sie mit einer 2-0-Seidennaht.
- Nehmen Sie 1 cm lange Gegenhautschnitte an der Basis des Halses sowie an der unteren linken und oberen rechten Brust vor, um die EKG-Ableitungen zu platzieren. Tunneln Sie subkutan, um diese Schnitte mit der Körpertasche des Geräts zu verbinden und die EKG-Ableitungen an die gewünschte Stelle zu führen (Abbildung 2C).
- Platzieren Sie die EKG-Ableitungen ähnlich wie die oben beschriebenen Schritte für das Verfahren der Femurimplantate (Abschnitt 3).
- Legen Sie einen subkutanen Tunnel von der lateralen Gerätetasche bis zum medialen Halsschnitt an und fädeln Sie die beiden Druckkatheter durch. Bereiten Sie diese Druckkatheter vor der Kanülierung mit Gel vor, wie im Femurimplantatverfahren beschrieben.
- Legen Sie mit einer 6-0-Polypropylen-Naht einen Handtaschenstich um die Kanülenstelle an beiden Gefäßen und befestigen Sie ihn mit einem Kunststoff-Tourniquet.
- Verabreichen Sie 3 Minuten vor der Kanülierung eine Dosis intravenöses Heparin (100 Einheiten/kg).
- Ziehen Sie die proximalen und distalen 2-0-Seidentourniquets um die Halsschlagader fest. Mit einem Skalpell #11 vorsichtig in das Gefäß in der Mitte des Handbeutel-Fadenstichs einschneiden und mit der Spitze eines gebogenen Blutkörpers leicht erweitern.
- Führen Sie den Druckkatheter ein, der dem LVP-Kanal entspricht, und schieben Sie ihn in die thorakale aufsteigende Aorta vor, wobei Sie das proximale Seidentourniquet lockern, um den Katheter passieren zu lassen. Ziehen Sie die Naht an der Handtasche fest und binden Sie sie um den Katheter.
- Wiederholen Sie die Schritte 4.16 und 4.17 für die Kanülierung der linken Vene IJ mit dem Druckkatheter, der dem Blutdruckkanal entspricht, und schieben Sie ihn in das thorakale SVC vor.
- Bestätigen Sie die geeignete Position der Katheterspitzen in der thorakalen SVC und der aufsteigenden Aorta mittels Fluoroskopie (Abbildung 2D).
- Nähern Sie sich dem Platysma-Muskel mit einem resorbierbaren 2-0-Naht an.
- Verschließen Sie die Haut mit tiefen dermalen und subkutikulären Nähten mit resorbierbaren Nähten 3-0 bzw. 4-0.
5. Wiederherstellung
- Brechen Sie die Anästhetika ab. Entfernen Sie die Magensonde und extubieren Sie, wenn das Schaf ohne Hilfe des Beatmungsgeräts atmet. Dies tritt typischerweise auf, nachdem das Schaf Anzeichen von Erregung zeigt (Bewegung, Blinzeln, Reaktion auf schmerzhafte Reize, Kiefertonus, Kauen).
- Entfernen Sie den arteriellen Zugang.
HINWEIS: Das Telemetriegerät kann eine kontinuierliche Blutdrucküberwachung durchführen, wenn einer seiner Druckkatheter in die Aorta eingeführt wurde. - Bringen Sie die Schafe zur Genesung in eine isolierte Haltungseinheit. Helfen Sie dem Schaf, in sternaler Liege zu bleiben und schließlich zu stehen.
- Intravenös Banamin (2,2 mg/kg) und subkutanes Buprenorphin SR (0,03 mg/kg) gegen postoperative Schmerzen verabreichen.
Ergebnisse
Chirurgische Ergebnisse
Insgesamt 13 Schafe wurden einer einstufigen Fontan-Operation unterzogen, die eine vollständige kavopulmonale Verbindung mit Ablösung sowohl des SVC als auch des IVC aus dem rechten Vorhof, einer direkten End-to-Side-Anastomose des SVC zum PA und der Platzierung eines extrakardialen Conduits zwischen IVC und PA umfasste. Schafe wurden diesem Verfahren im Durchschnittsalter von 13,3 ± 7,6 Monaten unterzogen. Von diesen wurden 3 Schafe einer drahtlosen Telemetrie-Geräteimplantation unterzogen, bei der Druckmesskatheter in die Bauchaorta und die IVC eingeführt wurden. 2 Schafe erhielten eine Implantation eines Telemetriegeräts mit Platzierung von Druckkathetern in der aufsteigenden Aorta und SVC; und bei 8 Schafen war kein Telemetriegerät implantiert. Bei keinem der Tiere traten nach der Implantation eines Telemetriegeräts größere postoperative Komplikationen auf. Sieben von 8 Schafen (87,5 %) ohne Telemetriegerät starben innerhalb von 30 Tagen nach der Fontan-Operation, während nur 1 von 5 (20,0 %) Schafen mit einem Telemetriegerät in dieser postoperativen Phase verstarb (Tabelle 1).
Hämodynamische Datenerfassung
Die Implantation von drahtlosen Telemetriesystemen ermöglichte die kontinuierliche und langfristige Datenerfassung für verschiedene kardiovaskuläre Parameter, einschließlich Herzfrequenz, arterieller Blutdruck und ZVP. Dies ermöglichte eine engmaschige hämodynamische Überwachung von Tieren, die sich vor, während und über mehrere Tage nach der Operation einer einstufigen Fontan-Operation unterzogen hatten (Abbildung 3). Schwankungen des venösen Drucks wurden von Minute zu Minute beobachtet, obwohl die Gesamttrends einen akuten Anstieg sowohl des abdominalen IVC- (Abbildung 4A) als auch des thorakalen SVC-Drucks (Abbildung 4B) nach der Etablierung des Fontan-Kreislaufs zu zeigen schienen. Einige minütliche Schwankungen des Venendrucks könnten auf das Aktivitätsniveau und die Positionierung des Schafs zurückgeführt werden. Zum Beispiel wurde beobachtet, dass der Druck in der abdominalen IVC stetig anstieg, wenn die Schafe im Liegen auf dem Bauch ruhten (Abbildung 5). Bei einem Schaf wurde am selben Tag nach der Implantation des Geräts im Halsbereich mit Platzierung des venösen Druckkanals im SVC ein Katheterisierungsverfahren durchgeführt. Dies geschah, um Diskrepanzen zwischen den vom Telemetriegerät gemeldeten Werten und den Werten der invasiven Drucküberwachung zu ermitteln, die als Goldstandard angesehen wurde. Der nicht-pulsierende mittlere SVC-Druck, der durch das Katheterisierungsverfahren erhalten wurde, schwankte zwischen 2 und 4 mmHg, wobei die Oszillationen auf Änderungen des intrathorakalen Drucks entlang des Atemzyklus zurückzuführen waren (Abbildung 6). Während des gesamten Verfahrens gab das Telemetriegerät durchschnittlich 43 Messwerte des nicht-pulsierenden mittleren SVC-Drucks pro Minute aus, mit einem mittleren SVC-Gesamtdruck von 1,1 ± 3,1 mmHg, was auf einen minimalen Versatz zwischen den Gerätemessungen und den tatsächlichen Werten hinweist.

Abbildung 1: Implantation des Geräts mit Venenarterie und Venenkanüle. Für die Implantation mit Oberschenkelarterie und Venenkanüle wird das Schaf in Rückenlage mit gestreckten Hinterbeinen positioniert. (A) Präoperative Markierungen zeigen die Positionierung der geplanten Schnitte, die Körpertasche des Geräts und den subkutanen Verlauf der EKG-Ableitungen und Druckmesskatheter bis zu ihrer endgültigen Position an. (B) Zwischen dem Unterhautgewebe und oberhalb des äußeren schrägen Muskels wird eine subkutane Tasche mit den Maßen etwa 6 cm x 4 cm zur Platzierung des Körpers des Telemetriegeräts erstellt. (C) Die Femurgefäße werden nach der Teilung des Musculus sartorius freigelegt. Die tastbare Oberschenkelarterie (weiße Pfeile) befindet sich medial der Oberschenkelvene (blaue Pfeile). (D) Druckmesskatheter werden in die Oberschenkelarterie (weißer Pfeil) und die Vene (blauer Pfeil) eingeführt und dann mit einem Naht an Ort und Stelle fixiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Implantation des Geräts mit der linken Halsschlagader und Kanülierung der Vena jugularis interna (IJ). Für die Implantation mit der linken Halsschlagader und der Kanüle der Vena jugularis interna (IJ) wird das Schaf mit dem linken Vorderbein nach hinten gestreckt im rechten lateralen Dekubitus positioniert. (A) Präoperative Markierungen zeigen die Positionierung der geplanten Schnitte an. (B) Die linke Halsschlagader (weiße Pfeile) und die Vena IJ (blaue Pfeile) sind nach der Teilung des Platysma freigelegt. Die Halsschlagader befindet sich tief und lateral der Vena IJ. (C) Die überschüssige Verkabelung der EKG-Ableitungen wird aufgewickelt und dann im subkutanen Raum gesichert. Die positive Elektrode befindet sich links von der unteren Seite des Brustbeins (schwarze Pfeile), während die negative Elektrode rechts von der oberen Seite des Brustbeins (rote Pfeile) platziert ist. (D) Die Platzierung der druckmessenden Katheterspitzen in der oberen Hohlvene (blauer Pfeil) und der aufsteigenden Aorta (weißer Pfeil) wurde mittels Fluoroskopie bestätigt. Die Positionierung der positiven (schwarzer Pfeil) und negativen (roter Pfeil) EKG-Ableitungen ist auch auf der Röntgenbildgebung zu sehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Implantation eines drahtlosen Telemetriegeräts für eine kontinuierliche Überwachung. Die Implantation eines drahtlosen Telemetriegeräts ermöglichte die kontinuierliche Überwachung verschiedener kardiovaskulärer Parameter, einschließlich Herzfrequenz, arterieller Druck und venöser Druck, in Fontan-Überlebensschafmodellen während der gesamten perioperativen Phase. Die in dieser Grafik dargestellten hämodynamischen Trends sind repräsentativ für die Daten, die von druckmessenden Kathetern gesammelt wurden, die in der Bauchaorta und der Vena cava inferior (IVC) platziert wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Positionierung von druckmessenden Kathetern. Druckmesskatheter wurden entweder in der (A) abdominalen unteren Hohlvene (IVC) oder (B) in der thorakalen oberen Hohlvene (SVC) positioniert, um den zentralen venösen Druck kontinuierlich aufzuzeichnen. Messungen des venösen Drucks wurden präoperativ, intraoperativ während des Fontan-Eingriffs und postoperativ durchgeführt, um Trends nach der Etablierung des Fontan-Kreislaufs zu bewerten. Von Minute zu Minute schwankten die Druckmessungen mit Veränderungen in der Positionierung und dem Aktivitätsniveau des Tieres. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
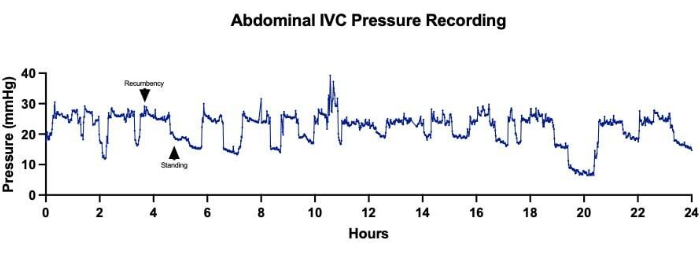
Abbildung 5: Druck der unteren Hohlvene (IVC) des Abdomens. Die kontinuierliche Erfassung des abdominalen IVC-Drucks über einen Zeitraum von 24 Stunden zeigte Schwankungen in den Druckmessungen, die mit Veränderungen in der Positionierung der Schafe korrelierten. Höhere durchschnittliche IVC-Drücke entsprachen den Zeiten, in denen das Schaf im Liegen ruhte, während niedrigere durchschnittliche IVC-Drücke aufgezeichnet wurden, wenn das Schaf stand. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Invasive Druckmessung des SVC. Am selben Tag nach der Implantation des Geräts bei einem Schaf wurde ein Katheterisierungsverfahren durchgeführt, um die Druckwerte der oberen Hohlvene (SVC) aus dem Telemetriesystem zu überprüfen. Die mit dieser Methode der invasiven Drucküberwachung gewonnenen Werte galten als Goldstandard. Der nicht-pulsierende mittlere SVC-Druck, der durch das Katheterverfahren erhalten wurde, schwankte synchron mit dem Atemzyklus zwischen 2 und 4 mmHg. In der Zwischenzeit betrug der Durchschnitt aller nicht-pulsierenden mittleren SVC-Drücke, die während des Verfahrens vom Telemetriegerät erfasst wurden, 1,1 ± 3,1 mmHg, was auf einen minimalen Versatz zwischen den Telemetriemesswerten und den tatsächlichen Werten hinweist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Schaf | Sex | Platzierung des Katheters eines Telemetriegeräts | Gewicht zum Zeitpunkt der Fontan-Operation (kg) | Alter zum Zeitpunkt der Fontan-Operation (Monate) | Perioperativer Tod |
| 1 | M | Nichts | 45 | 13 | Ja |
| 2 | F | Nichts | 43 | 13 | Nein |
| 3 | M | Nichts | 46.5 | 25 | Ja |
| 4 | F | Nichts | 46.5 | 19 | Ja |
| 5 | M | Nichts | 50 | 20 | Ja |
| 6 | F | Nichts | 53 | 28 | Ja |
| 7 | M | Nichts | 40.5 | 8 | Ja |
| 8 | M | Nichts | 42 | 10 | Ja |
| 9 | F | Abdominale Aorta und IVC | 33.5 | 3 | Nein |
| 10 | M | Abdominale Aorta und IVC | 24 | 7 | Ja |
| 11 | M | Abdominale Aorta und IVC | 29 | 8 | Nein |
| 12 | M | Aufsteigende Aorta und SVC | 37.5 | 13 | Nein |
| 13 | M | Aufsteigende Aorta und SVC | 39.5 | 6 | Nein |
Tabelle 1: Chirurgische Ergebnisse. Dreizehn Schafe wurden einer einstufigen Fontan-Operation unterzogen, von denen 5 1 Monat zuvor eine Implantation eines drahtlosen Telemetriegeräts erhalten hatten. Nach der Fontan-Operation starben 7 von 8 Schafen (87,5 %) ohne Telemetriegerät innerhalb von 30 Tagen, verglichen mit 1 von 5 Schafen (20,0 %) mit einem Telemetriegerät.
Diskussion
Wir haben zwei chirurgische Methoden für die Implantation eines drahtlosen Telemetriegeräts in ein Schafmodell entwickelt. Das Gerät wurde erfolgreich bei 5 Schafen implantiert, um eine kontinuierliche, langfristige Überwachung und Aufzeichnung verschiedener kardiovaskulärer Parameter zu erreichen, einschließlich Herzfrequenz, arterieller Blutdruck und lokalisierter venöser Drücke von der abdominalen IVC und der thorakalen SVC. Alle Schafe überstanden die Operation zur Implantation ohne größere Komplikationen und wurden einen Monat später einer einstufigen Fontan-Operation unterzogen.
Im Jahr 2019 berichteten Van Puyvelde et al. über die Erstellung des ersten Überlebensmodells für Fontan-Schafe, um den chronischen Prozess des Fontan-Versagens zu untersuchen13. Zwei Drittel der Tiere überlebten jedoch letztlich nicht über die zwanzigste postoperative Woche hinaus. Insbesondere ist es äußerst schwierig, einen akuten Fontan-Kreislauf bei Tieren mit normalem Herzen zu etablieren, vermutlich weil sie weniger als univentrikuläre Herzen an diesen spezifischen physiologischen Zustand angepasst sind. Der Nutzen der Implantation von Telemetriegeräten ist daher zweifach. Erstens kann die Fähigkeit, die Vitalwerte während der postoperativen Phase genau zu überwachen, das schnelle Erkennen und Reagieren auf Anzeichen einer kardiovaskulären Dekompensation ermöglichen sowie die Einleitung zielgerichteter Therapien erleichtern. Unserer Erfahrung nach trug die Implantation von drahtlosen Telemetriegeräten in einer Kohorte von Schafen, die sich der einstufigen Fontan-Operation unterzogen, zu deren verbessertem Überleben bei. Zweitens wird uns die Fähigkeit, langfristig Echtzeitdaten zu erfassen, ermöglichen, sich entwickelnde hämodynamische Trends zu identifizieren, die mit dem Versagen von Fontan verbunden sind.
Während wir uns auf die Schaffung eines chronischen Fontan-Großtiermodells konzentriert haben, können die Vorteile von drahtlosen Telemetriesystemen auch auf andere Unternehmungen angewendet werden, wie z. B. die Erprobung und Entwicklung neuartiger kavopulmonaler Unterstützungsgeräte (CPAD), die darauf abzielen, bei Fontan-Versagen eine mechanische Kreislaufunterstützung zu bieten. Mehrere Gruppen haben große Tierversuche veröffentlicht, in denen die Machbarkeit und Funktionsfähigkeit von CPADs untersucht wurde, die auf die Fontan-Zirkulation angewendet werden 16,17,18,19. Die Mehrzahl dieser Experimente wurde jedoch in akuten Fontan-Modellen mit kurzfristiger Bewertung der hämodynamischen Leistungsfähigkeit unter Verwendung von Datenerhebungsmethoden durchgeführt, die außerhalb des Operationssaals nicht praktikabel sind. Im Jahr 2019 beschrieben Cysyk et al. die erfolgreiche Implantation eines CPAD in ein Überlebensmodell von Fontan-Schafen14,15. In ihrer Studie wurden flüssigkeitsgefüllte Drucküberwachungsleitungen im SVC, IVC, PA und linken Vorhof platziert und durch die hintere Brustwand herausgeführt, um über den 30-tägigen Studienzeitraum kontinuierliche Druckmessungen zu erhalten. Obwohl diese Methode für die Zwecke ihrer Studie weitgehend ausreichend war, stellten sie Probleme mit der Kathetermigration fest. Bei einer langfristigen Datenerfassung von mehr als 30 Tagen kann sich die Verwendung eines drahtlosen Telemetriesystems als vorzuziehen erweisen.
Keines der Schafe, die sich einer Implantation eines Telemetriegeräts unterzogen, hatte größere Komplikationen als Folge des Eingriffs. Es wurde jedoch festgestellt, dass eine EKG-Ableitung einige Wochen nach der Operation durch die Haut eines Schafes an der verheilten Inzisionsstelle erodiert war. Es wurde angenommen, dass dies mit einer Druckverletzung zusammenhängt, da Schafe typischerweise in sternaler Liege ruhen und ihr Körpergewicht auf dem vorderen Brustbein über den Stellen verlagert wird, an denen die EKG-Ableitungen subkutan lokalisiert wurden. Um eine EKG-Elektrodenerosion zu vermeiden, wurden EKG-Ableitungen bei zukünftigen Schafen, die sich einer Geräteimplantation unterzogen, seitlich statt direkt über dem Brustbein positioniert, und bei keinem anderen Schaf trat dieses Problem seitdem auf.
Es sind mehrere Schritte erforderlich, um sicherzustellen, dass die Druckmesswerte genauso genau sind. Zuerst muss das Telemetriegerät auf einer ebenen Fläche auf Atmosphärendruck auf Null gestellt werden, wobei die Katheterspitzen auf Höhe des Gerätekörpers sind, während es sich in der Originalverpackung befindet. Vor dem Einführen der Druckkatheter in ein Blutgefäß ist es notwendig, die Katheterspitzen mit nicht komprimierbarem, hochviskosem Gel zu füllen, wobei darauf zu achten ist, dass sich keine Luftblasen im klaren Gel befinden. Abschließend ist es wichtig, die Positionierung des Gerätekörpers in Bezug auf die Katheterspitze zu beachten, da Höhenunterschiede die Druckmessungen verzerren können. Wir entschieden uns, den Gerätekörper über dem Unterbauch oder an der Basis des Halses hinter dem Schulterblatt zu platzieren, so dass er sich ungefähr auf der gleichen Höhe wie die Katheterspitze innerhalb der abdominalen IVC bzw. thorakalen SVC befindet, wenn das Schaf aufrecht steht.
Bemerkenswert ist, dass wir das Gehäuse des Telemetriegeräts an einer Stelle positioniert haben, die mindestens 15 cm von der interessierenden Region entfernt ist, einschließlich des Herzens, der großen Gefäße und der Leber, um die Menge an Artefakten zu minimieren, die bei zukünftigen Magnetresonanztomographien auftreten könnten. Zuletzt wurden Druckmesskatheter in die linke Halsschlagader und die Vena IJ eingeführt, um zukünftige Katheterisierungsverfahren durch die rechte Vena IJ durchführen zu können.
Zu diesem Zeitpunkt bestehen mehrere Einschränkungen bei der Verwendung der beschriebenen drahtlosen Telemetriesysteme. Zu beachten ist, dass das Geräteimplantat eine Batterielebensdauer von 84 Tagen hat. Nach der Implantation kann der Akku des Geräts nicht mehr aufgeladen oder ausgetauscht werden. Die Geräte können jedoch in Zeiträumen aus- und wieder eingeschaltet werden, in denen eine Datenerfassung gewünscht ist, um ihre Nutzung zu verlängern. Darüber hinaus wurde beobachtet, dass die venösen Druckmessungen je nach Positionierung des Tieres variierten, und es ist unklar, ob dies auf echte Änderungen des intravenösen Drucks oder auf Änderungen in der Positionierung des Gerätekörpers relativ zu den Katheterspitzen zurückzuführen war. Darüber hinaus waren die Körper der Telemetriegeräte zwar so positioniert, dass sie sich bei aufrechter Lage der Tiere in etwa auf der gleichen Höhe wie ihre Katheterspitzen in der IVC oder SVC befanden, die Größenunterschiede jedoch aufgrund anatomischer Einschränkungen bestehen. Bei dem Halsimplantat lag der Gerätekörper höher als die Katheterspitze in der SVC und bei der Leistenimplantate lag der Gerätekörper tiefer als die Katheterspitze in der IVC. Nichtsdestotrotz kann die Untersuchung der allgemeinen Trends der Druckwerte immer noch entscheidende Erkenntnisse über eventuell auftretende hämodynamische Veränderungen liefern. Eine weitere Analyse der von diesen Telemetriesystemen gesammelten Langzeitdaten wird notwendig sein, um ein umfassenderes Verständnis der chronischen Fontan-Physiologie und der Mechanismen des Fontan-Versagens zu erlangen. Zusätzliche Katheterisierungsverfahren, die postoperativ durchgeführt werden, sind ebenfalls erforderlich, um die Genauigkeit der Telemetrieausgabe zu überprüfen und eine mögliche Sensordrift im Laufe der Zeit zu identifizieren. Schließlich ist die Verschiebung von Gerätekatheterspitzen infolge des somatischen Wachstums ein potenzielles Problem, insbesondere wenn Telemetriegeräte bei jüngeren Tieren implantiert werden. Die Lage der röntgendichten Katheterspitzen kann im Rahmen der postoperativen Katheteruntersuchung bestimmt und bestätigt werden.
Drahtlose Telemetriesysteme ermöglichen die langfristige Erfassung kontinuierlicher hämodynamischer Daten in Echtzeit von frei beweglichen Großtiermodellen. Die chirurgische Implantation dieser Geräte mit der Platzierung von druckempfindlichen Kathetern in der IVC und SVC sowie in der abdominalen und aufsteigenden Aorta ist sicher und durchführbar.
Offenlegungen
Dieses Projekt wurde von der Additional Ventures Cures Collaborative, Palo Alto, Kalifornien, finanziert.
Danksagungen
Wir schätzen die engagierten tierärztlichen Mitarbeiter am Animal Research Core. Wir möchten auch Mary Walker, DVM, MS, unseren Dank für ihre unschätzbare Expertise und ihre wachsame Betreuung während der gesamten Studie aussprechen.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
Referenzen
- Fontan, F. Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L. Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), 387-394; discussion 394-385 (1996).
- Iskander, C. et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244 (2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. Statpearls, Treasure Island, FL (2024).
- Daley, M. D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit? J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z. et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601 (2024).
- Al Balushi, A. Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J. et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260 (2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F. et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J. et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J. et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P. et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240--1249 (2021).
- D'udekem, Y. et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594 (2024).
- Granegger, M. et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X. et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J. et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M. et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H. et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. At <https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l > (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten