Method Article
在 Fontan 绵羊模型中植入无线遥测设备,用于连续和长期血流动力学监测
摘要
该协议描述了植入大型动物无线遥测设备的手术方法,以实现连续和长期收集血液动力学数据,包括心率、动脉血压、下腔静脉压和上腔静脉压以及心律。
摘要
虽然 Fontan 手术大大提高了单心室患者的预期寿命,但众所周知,由于长期升高的中心静脉压和心输出量减少,由此产生的循环会长期造成重大的疾病负担。慢性 Fontan 动物模型是研究与该手术相关的晚期生理结果的宝贵资产,也是评估旨在减轻 Fontan 失败的未来设备的必要工具。然而,以前创建慢性 Fontan 模型的尝试因存活率低而受到阻碍。此外,有效的血液动力学数据收集对自由移动的动物构成了重大挑战。为此,无线植入式遥测系统的使用为心血管数据的实时和长期监测提供了一种新颖的解决方案。该协议描述了在 Fontan 绵羊存活模型中手术植入无线遥测设备的方法,有助于连续和持续记录多个血流动力学参数,包括心率、动脉血压以及下腔静脉 (IVC) 和上腔静脉 (SVC) 的局部压力。遥测装置植入颈动脉和颈内静脉或股动脉和静脉的插管,分别在升主动脉和 SVC 或腹主动脉和 IVC 中放置压力感应导管。无线遥测系统的使用使单阶段 Fontan 手术后的术后密切监测成为可能,这有助于改善动物福利和存活率。
引言
1971 年 Fontan 手术的开发导致单心室1 患者的预后得到显著改善。该手术的目的是分离体循环和肺静脉回流至心脏,从而增加体循环氧合并减轻体循环心室的容量负荷。自推出以来,对手术方法进行了许多修改。目前,右心的完全搭桥手术通常是通过分期重建来实现的 2,3。通常,第一阶段在出生后的第一周进行4。然后,患者接受第二阶段,包括 Glenn 手术或 hemi-Fontan,将血流从上腔静脉 (SVC) 重定向到肺动脉 (PA)5。接下来是 Fontan 手术,该手术涉及在下腔静脉 (IVC) 和 PA6 之间建立心外导管或侧向隧道。如果不使用动物模型,就不可能实现诸如 Fontan 手术历史上所取得的外科进步7。
虽然 Fontan 手术大大提高了单心室患者的预期寿命,但众所周知,由于长期升高的中心静脉压 (CVP) 和心输出量减少,在没有肺下泵的情况下运行的循环从长远来看会导致重大的疾病负担 8,9,10,11,12 .慢性 Fontan 动物模型是研究与该手术相关的晚期生理结果的宝贵资产13。主动收集心血管参数(如 CVP、心率和其他生命体征)以捕捉术后血流动力学变化对于全面评估发展中的病理生理学至关重要。此外,动物模型是测试新型心室辅助装置能力的必要工具,旨在减轻体内 Fontan 循环的血流动力学缺陷 14、15、16、17、18、19。
然而,有效的数据收集带来了重大挑战。基于侵入性导管的技术受到其瞬态性、相关手术风险以及无法长时间监测动物状况的限制。此外,之前创建大型动物 Fontan 模型的尝试因存活率低而受到阻碍,这可能是由于正常心脏无法适应 Fontan 环流的急性建立 7,20。为此,无线遥测系统的使用为实时、长期收集自由移动的动物的心血管数据提供了一种新颖的解决方案21,22。这些设备还可以实现密切的术后监测,从而改善动物福利和存活率。
在这里,我们描述了在慢性 Fontan 绵羊模型中成功植入和使用无线遥测系统23 的方法。该技术提供了一种稳健可靠的连续血流动力学数据收集方法,使静脉压和其他关键生理参数的研究成为可能。在临床前模型中实施这项技术对于促进我们对 Fontan 生理学的理解和开发旨在改善 Fontan 患者长期预后的新治疗策略至关重要。
研究方案
该实验方案得到了全国儿童医院 Abigail Wexner 研究所 (AR20-00121) 机构动物护理和使用委员会的批准。所有程序均符合美国国立卫生研究院 (National Institute of Health) 的《实验动物使用和护理指南》中概述的指南。这项研究遵循动物研究: 体内 实验报告指南。体重范围为 23-38 公斤,年龄范围为 2-12 个月的多塞特羊被饲养在特定的无病原体环境中,手术前至少 1 周可以自由获得食物和水。研究中使用的设备和试剂列在 材料表中。
1. 动物准备
- 让绵羊在手术前 1 周接受兽医团队的评估,以确保它们可以安全地接受麻醉。在手术前 12 小时禁食健康的绵羊并剥夺水分。
- 通过颈内静脉 (IJ) 注射氯胺酮 (4 mg/kg) 和地西泮 (0.5 mg/kg) 的组合进行镇静。
- 根据计划的程序(详见下文)剃羊毛,并在大腿上剃毛,以便放置电烙接地垫。用酒精清洁手术部位。
- 将 8-9 毫米单腔气管插管插入气管。
- 插入口胃管以减压胃和瘤胃。
- 将单腔静脉导管 (16-18 G) 插入右颈静脉或大隐外侧静脉,进行连续液体给药、异丙酚的连续速率输注 (CRI) 和根据需要注射药物。
- 在耳动脉中放置一条动脉管 (22-24 G) 以进行连续血压监测。
- 在右前肢放置一个血压袖带用于无创血压测量,在耳朵或舌头上放置一个夹子以监测氧饱和度,并在所有四个肢体上放置心电图 (ECG) 导联。
- 在手术过程中,使用吸入 1%-3% 异氟醚和 100% O2 和/或异丙酚 CRI (20-45 mg/kg/h) 维持麻醉。
- 使用基于洗必泰的制备剂无菌清洁手术部位,并以标准无菌方式悬垂。
- 切开前给予头孢唑啉 (25 mg/kg) 用于抗生素预防,并在手术期间根据需要每 4 小时重新给药一次。
- 在切口前,在所有计划的切口部位皮下注射局部麻醉剂,例如 0.25% 的布比卡因。
2. 遥测设备准备
- 打开遥测软件程序,并在遥测设备仍密封在原包装中时使用磁力开关打开遥测设备。
- 在软件程序中,单击位于顶部栏的 硬件 ,然后选择 编辑 PhysioTel 数字 (CLC) 配置 ,将遥测单元分配给通信链路控制器 (CLC)。
- 选择 CLC 后,将打开其 CLC 详细信息 页面。在此页面中,单击 “搜索植入物”,这将开始搜索附近打开的植入物设备。
- 单击 Add 将遥测单元添加到 Implants Selected 列表中。该设备现在将显示在 CLC 详细信息页面上的 Configured Implants 列表下。单击 Save and Exit。
- 按 Sampling Control 选项卡中遥测单元名称旁边的 Play 按钮开始数据采集。显示实时数据采集的图表将自动打开。
- 从外包装中取出设备,并将其转移到无菌内包装上,放到手术台上。
- 当设备保留在内部包装中时,将设备归零。等到设备的测量值稳定 30 秒,并使用稳定的非脉动平均值 (NPMN) 压力值作为偏移量。
- 在 Subject Setup 中,选择要清零的参数旁边的设置图标,然后打开 Offsets 选项卡。在文本框中输入从 NPMN 测量中获得的偏移值。
- 输入偏移量后,检查 NPMN 读数是否为 0 ± 0.1 mmHg。如果没有,请重复步骤 2.7,直到值在所需范围内。
- 对两个压力通道执行步骤 2.7-2.9。
- 在将压力感应导管插入血管之前,轻敲尖端以确定其相应的通道。抽头将在波形输出中变得明显。
- 使用与左心室压 (LVP) 通道相对应的导管进行动脉压测量,使用血压 (BP) 通道进行静脉压测量。
- 在“血压分析属性”对话框的“标准属性”选项卡中,将血压通道的最小脉冲高度设置为 1 mmHg。
3. 方法 1:股动脉和静脉插管
- 在右腹股沟周围以及腹部和胸部的宽阔范围内给绵羊剃毛。
- 将绵羊仰卧在手术台上,使用柔性布带将其前肢弯曲固定,并使用活结带将后肢伸展固定,以便进入腹股沟(图 1A)。
- 在以可触及股动脉为中心的右侧腹股沟区域做一个 5 cm 的横向切口,位于腹股沟折痕下方约 1 cm 处。
- 使用电烙术和钝性解剖的组合,通过皮下组织解剖到股骨三角。通过触诊动脉搏动来定位股血管。
- 沿肌纤维的方向在缝匠肌和内收长肌之间分开,以暴露股血管(图 1B)。
- 使用钝性解剖和锐器解剖的组合,从股血管圆周清除结缔组织。
- 将双环 2-0 丝带绕在插管部位近端和远端的两条血管上,以进行临时血管结扎。
- 在右下腹部的皮肤上做一个 6 厘米的横向切口,在腹股沟折痕上方约 3 厘米处。
- 使用电烙术和钝性解剖的组合,解剖皮下脂肪和结缔组织,在外斜肌浅表创建一个 6 cm x 4 cm 的口袋。
- 将遥测装置插入皮下袋并使用 2-0 丝缝线将其固定到位(图 1C)。
- 将遥测设备天线钻入皮下组织,并使用 2-0 丝缝合线将其固定到位。
- 为了放置生物电势 (ECG) 导联,在中下腹部以及上下胸部的皮肤上做 1 厘米的反向切口。皮下隧道将这些切口连接到设备本体口袋,并将 ECG 导联引导至所需位置。
- 将正电极放在胸骨下左侧的皮下组织中。确保移除硅胶管,露出下面的钢丝尖端。
- 将负极放在胸骨上部右侧的皮下组织中。
- 两根导线的多余布线可以使用 2-0 丝缝合线盘绕并固定在皮下位置。
- 从下腹部装置袋到腹股沟切口创建一条皮下隧道,并将两根压力导管穿过。
- 使用 6-0 聚丙烯缝合线在股动脉和静脉的插管部位周围放置钱包缝合线,可以使用塑料止血带固定。
- 用不可压缩的高粘度凝胶填充导管凝胶尖端,以防止导管尖端内凝结,确保没有气泡。
- 插管前 3 分钟静脉注射肝素 (100 单位/kg)。
- 收紧股动脉周围的近端和远端 2-0 丝绸止血带。使用 #11 刀片手术刀小心地切开钱包针脚中心的容器,并用弯曲的止血钳尖端略微扩张。
- 插入与 LVP 通道对应的压力导管并将其推进到腹主动脉中,松开近端丝绸止血带以允许导管通过。收紧荷包缝合线并将其系在导管上。
- 使用对应于 BP 通道的压力导管对股静脉插管重复步骤 3.20 和 3.21,并将其推进到腹部下腔(图 1D)。
- 使用透视确认导管尖端在 IVC 和主动脉中的位置正确。
- 使用 2-0 可吸收缝合线重新接近缝匠肌。
- 分别使用 3-0 和 4-0 可吸收缝线用深层真皮和皮下缝合线闭合皮肤。
4. 方法 2:颈动脉和颈内静脉插管
- 将绵羊的左脖子周围和胸部剃得宽阔。
- 将绵羊放在手术台上的右侧卧位,使用活结带将左前肢屈曲固定,以露出胸部(图 2A)。
- 在左颈动脉和 IJ 静脉上方做一个 5 cm 的纵向皮肤切口,距胸廓入口约 7 cm 的颅骨。
- 使用电烙术,通过皮下脂肪、结缔组织和颈阔肌解剖,露出颈部血管(图 2B)。
- 使用钝头和锐器解剖的组合,从左颈动脉和 IJ 静脉圆周清除结缔组织。
- 将双环 2-0 丝带绕在插管部位近端和远端的两条血管上,以进行临时血管结扎。
- 在肩胛骨和颈椎之间的左颈部底部做一个 6 厘米的纵向切口。
- 使用电烙术和钝性解剖的组合,解剖皮下脂肪和结缔组织,创建一个 6 厘米 x 4 厘米的口袋,向脊柱延伸。
- 将遥测设备插入皮下口袋并使用 2-0 丝缝合线将其固定到位。
- 将遥测设备天线钻入皮下组织,并使用 2-0 丝缝合线将其固定到位。
- 在颈部底部以及左下胸部和右上胸部做 1 厘米的计数器皮肤切口,以放置心电图导联。皮下隧道将这些切口连接到设备本体口袋,并将 ECG 导联引导至所需位置(图 2C)。
- 按照上述股骨植入手术步骤(第 3 节)放置 ECG 导联。
- 从外侧装置袋到内侧颈部切口创建一个皮下隧道,并将两个压力导管穿过。在插管前使用凝胶准备这些压力导管,如股骨植入手术中所述。
- 使用 6-0 聚丙烯缝合线,在两个血管的插管部位周围放置一个钱包针,并用塑料止血带固定。
- 插管前 3 分钟静脉注射肝素 (100 单位/kg)。
- 收紧颈动脉周围的近端和远端 2-0 丝绸止血带。使用 #11 刀片手术刀小心地切开钱包针脚中心的容器,并用弯曲的止血钳尖端略微扩张。
- 插入与 LVP 通道对应的压力导管并将其推进到胸升主动脉中,松开近端丝止血带以允许导管通过。收紧荷包缝合线并将其系在导管上。
- 重复步骤 4.16 和 4.17,使用对应于 BP 通道的压力导管对左侧 IJ 静脉进行插管,并将其推进到胸部 SVC 中。
- 使用透视确认导管尖端在胸 SVC 和升主动脉中的适当位置(图 2D)。
- 使用 2-0 可吸收缝合线重新接近颈阔肌。
- 分别使用 3-0 和 4-0 可吸收缝线用深层真皮和皮下缝合线闭合皮肤。
5. 恢复
- 停止麻醉剂。当绵羊在没有呼吸机帮助的情况下呼吸时,拔除口胃管并拔管。这通常发生在绵羊表现出唤醒迹象(运动、眨眼、对疼痛刺激的反应、下巴张力、咀嚼)之后。
- 去除动脉导管。
注意: 如果遥测设备的一根压力导管已放入主动脉,则遥测设备可以提供持续的血压监测。 - 将绵羊转移到隔离的饲养单元进行恢复。帮助绵羊保持胸骨卧位,然后最终站立。
- 静脉注射香蕉胺 (2.2 mg/kg) 和皮下注射丁丙诺啡 SR (0.03 mg/kg) 治疗术后疼痛。
结果
手术结局
共有 13 只绵羊接受了单期 Fontan 手术,涉及完全腔静脉肺连接,SVC 和 IVC 从右心房脱离,SVC 与 PA 直接端对侧吻合,并在 IVC 和 PA 之间放置心外导管。绵羊在平均 13.3 ± 7.6 个月时接受了这种手术。其中,3 只羊接受了无线遥测设备植入,将压力感应导管置入腹主动脉和 IVC;2 只绵羊接受了遥测装置植入,在升主动脉和 SVC 中放置了压力传感导管;8 只绵羊没有植入遥测设备。植入遥测设备后,没有动物出现任何重大的术后并发症。没有遥测设备的 8 只绵羊中有 7 只 (87.5%) 在 Fontan 手术后 30 天内死亡,而 5 只拥有遥测设备的绵羊中只有 1 只 (20.0%) 在术后期间死亡(表 1)。
血流动力学数据收集
无线遥测系统的植入促进了对多个心血管参数(包括心率、动脉血压和 CVP)的连续和长期数据收集。这使得能够在手术前、手术中和手术后数天内对接受单阶段 Fontan 手术的动物进行密切血流动力学监测(图 3)。每分钟都观察到静脉压的变化,尽管总体趋势似乎显示,在 Fontan 循环建立后,腹部 IVC(图 4A)和胸部 SVC(图 4B)压力急剧增加。静脉压的一些每分钟波动可能归因于绵羊的活动水平和位置。例如,当绵羊躺在腹部休息时,观察到腹部 IVC 中的压力持续增加(图 5)。在一只绵羊中,在颈部区域植入装置并放置静脉压力通道的同一天进行导管插入术。这样做是为了评估遥测设备报告的值与从被视为黄金标准的侵入性压力监测中获得的值之间的差异。导管插入术获得的非搏动平均 SVC 压力在 2-4 mmHg 之间波动,振荡归因于沿呼吸周期的胸内压变化(图6)。在整个过程中,遥测设备平均每分钟输出 43 个非脉动平均 SVC 压力读数,总体平均 SVC 压力为 1.1 ± 3.1 mmHg,表明设备测量值与实际值之间的偏移最小。

图 1:股动脉和静脉插管的装置植入。 对于股动脉和静脉插管的装置植入,绵羊仰卧位,后腿伸展。(A) 术前标记指示计划切口的位置、设备本袋以及 ECG 导联和压力感应导管到其最终位置的皮下路线。(B) 在皮下组织和外斜肌上方创建一个约 6 厘米 x 4 厘米的皮下袋,用于放置遥测设备主体。(C) 缝匠肌分裂后股血管暴露出来。可触及的股动脉(白色箭头)位于股静脉内侧(蓝色箭头)。(D) 将压力感应导管插入股动脉(白色箭头)和静脉(蓝色箭头),然后用荷包线固定到位。 请单击此处查看此图的较大版本。

图 2:左颈动脉和颈内静脉 (IJ) 插管的装置植入。 对于左颈动脉和颈内静脉 (IJ) 静脉插管的装置植入,绵羊位于右侧卧位,左前腿向后伸展。(A) 术前标记指示计划切口的位置。(B) 颈阔肌分裂后,左颈动脉(白色箭头)和 IJ 静脉(蓝色箭头)暴露出来。颈动脉位于 IJ 静脉的深处和外侧。(C) 心电图导联的多余布线盘绕,然后固定在皮下空间。正极导联位于胸骨下侧的左侧(黑色箭头),而负极导联位于胸骨上侧的右侧(红色箭头)。(D) 使用透视确认压力感应导管尖端放置在上腔静脉(蓝色箭头)和升主动脉(白色箭头)中。在 X 射线成像上也可以看到 ECG 阳性(黑色箭头)和阴性(红色箭头)导联的位置。 请单击此处查看此图的较大版本。

图 3:用于持续监测的无线遥测设备植入。 无线遥测设备植入允许在整个围手术期连续监测 Fontan 存活绵羊模型中的多个心血管参数,包括心率、动脉压和静脉压。该图中描述的血流动力学趋势代表了从放置在腹主动脉和下腔静脉 (IVC) 内的压力感应导管收集的数据。 请单击此处查看此图的较大版本。

图 4:压力感应导管的定位。 压力感应导管位于 (A) 腹部下腔静脉 (IVC) 或 (B) 胸部上腔静脉 (SVC) 中,用于连续记录中心静脉压。术前、术中 Fontan 手术期间和术后获得静脉压测量值,以评估 Fontan 循环建立后的趋势。压力测量值的每分钟变化都发生在动物的位置和活动水平的变化。 请单击此处查看此图的较大版本。
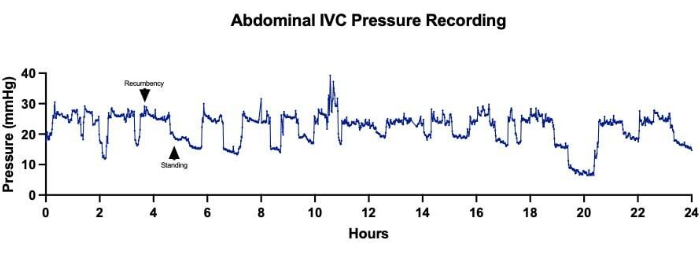
图 5:腹部下腔静脉 (IVC) 压力。 在 24 小时内连续采集腹部 IVC 压力显示,压力测量值与绵羊体位的变化相关。较高的平均 IVC 压力对应于绵羊躺卧休息的时间,而当绵羊站立时记录的平均 IVC 压力较低。 请单击此处查看此图的较大版本。

图 6:SVC 的侵入性压力测量。 在一只绵羊植入装置后的同一天进行导管插入术,以验证遥测系统的上腔静脉 (SVC) 压力读数。通过这种侵入性压力监测方法获得的值被视为黄金标准。从导管插入术中获得的非搏动平均 SVC 压力在 2-4 mmHg 之间波动,与呼吸周期同步。同时,遥测设备在手术过程中收集的所有非脉动平均 SVC 压力的平均值为 1.1 ± 3.1 mmHg,表明遥测读数与实际值之间的偏移最小。 请单击此处查看此图的较大版本。
| 羊 | 性 | 遥测设备导管放置 | Fontan作时的重量 (kg) | Fontan 手术时的年龄(月) | 围手术期死亡 |
| 1 | M | 没有 | 45 | 13 | 是的 |
| 2 | F | 没有 | 43 | 13 | 不 |
| 3 | M | 没有 | 46.5 | 25 | 是的 |
| 4 | F | 没有 | 46.5 | 19 | 是的 |
| 5 | M | 没有 | 50 | 20 | 是的 |
| 6 | F | 没有 | 53 | 28 | 是的 |
| 7 | M | 没有 | 40.5 | 8 | 是的 |
| 8 | M | 没有 | 42 | 10 | 是的 |
| 9 | F | 腹主动脉和 IVC | 33.5 | 3 | 不 |
| 10 | M | 腹主动脉和 IVC | 24 | 7 | 是的 |
| 11 | M | 腹主动脉和 IVC | 29 | 8 | 不 |
| 12 | M | 升主动脉和 SVC | 37.5 | 13 | 不 |
| 13 | M | 升主动脉和 SVC | 39.5 | 6 | 不 |
表 1:手术结果。 13 只羊接受了单期 Fontan 手术,其中 5 只在 1 个月前接受了无线遥测设备植入。在 Fontan 手术后,没有遥测设备的 8 只绵羊中有 7 只 (87.5%) 在 30 天内死亡,而 5 只拥有遥测设备的绵羊中有 1 只 (20.0%)在内死亡。
讨论
我们开发了两种手术方法,用于将无线遥测设备植入绵羊模型中。该装置成功植入 5 只绵羊体内,实现对多个心血管参数的连续、长期监测和记录,包括心率、动脉血压以及腹部 IVC 和胸部 SVC 的局部静脉压。所有绵羊都在装置植入手术中幸存下来,没有出现任何重大并发症,并在一个月后继续接受单期 Fontan 手术。
2019 年,Van Puyvelde 等人报道了第一个 Fontan 绵羊生存模型的创建,以研究 Fontan 失败的慢性过程13。然而,三分之二的动物最终未能存活超过术后第 20 周。值得注意的是,在心脏正常的动物中建立急性 Fontan 循环极为困难,这可能是因为它们比单心室心脏更不适应这种特定的生理状态。因此,遥测设备植入的效用是双重的。首先,在术后期间密切监测生命体征的能力可能允许快速识别和应对心血管失代偿的迹象,并促进目标导向治疗的开始。根据我们的经验,在接受单阶段 Fontan 手术的一组绵羊中植入无线遥测设备有助于提高它们的存活率。其次,长期获取实时数据的能力将使我们能够识别与 Fontan 失败相关的发展中的血流动力学趋势。
虽然我们专注于创建慢性 Fontan 大型动物模型,但无线遥测系统的好处也可以应用于其他工作,例如测试和开发新型腔静脉肺辅助装置 (CPAD),旨在为 Fontan 失败病例提供机械循环支持。几个小组发表了大型动物研究,研究了应用于 Fontan 环流的 CPAD 的可行性和功能能力 16,17,18,19。然而,这些实验中的大多数是在急性 Fontan 模型中进行的,使用在手术室外不可行的数据收集方法对血流动力学性能进行短期评估。2019 年,Cysyk 等人描述了在 Fontan 绵羊存活模型中成功植入 CPAD的情况 14,15。在他们的研究中,将充满液体的压力监测管放置在 SVC、IVC、PA 和左心房,并通过后胸壁引出,以获得 30 天研究期间的连续压力测量。虽然这种方法在很大程度上足以满足他们的研究目的,但他们确实注意到了导管迁移的问题。对于超过 30 天的长期数据收集,使用无线遥测系统可能更可取。
接受遥测设备植入的绵羊均未因手术而出现任何重大并发症。然而,在手术后几周内,在愈合的切口部位发现一根 ECG 导联通过一只绵羊的皮肤被侵蚀。这被认为与压力性损伤有关,因为绵羊通常靠胸骨卧着休息,体重放在胸骨前部,而不是皮下心电图导联所在的部位。因此,为避免心电图导联腐蚀,心电图导联被放置在未来接受装置植入的绵羊的胸骨外侧,而不是直接上方,此后没有其他绵羊经历过这个问题。
需要多个步骤才能确保压力读数同样准确。首先,遥测设备必须在平坦的表面上将大气压归零,当导管尖端与设备主体齐平时,将其置于原始包装内。在将压力传感导管插入血管之前,有必要用不可压缩的高粘度凝胶填充导管尖端,注意确保透明凝胶内没有气泡。最后,重要的是要注意设备主体相对于导管尖端的位置,因为高度差异可能会使压力测量值出现偏差。我们选择将装置主体放置在下腹部或肩胛骨后方的颈部底部,以便当绵羊直立时,它分别与腹部 IVC 或胸腔 SVC 内的导管尖端处于大致相同的水平。
值得注意的是,我们还将遥测设备主体放置在距离感兴趣区域至少 15 厘米的位置,包括心脏、大血管和肝脏,以尽量减少它可能在未来磁共振成像中产生的伪影数量。最后,将压力感应导管插入左颈动脉和 IJ 静脉,以便可以通过右侧 IJ 静脉进行未来的导管插入手术。
如前所述,目前使用无线遥测系统仍然存在一些限制。值得注意的是,该设备植入物的电池寿命为 84 天。一旦植入,设备电池就无法充电或更换。但是,在需要收集数据以延长其使用时间的时间段内,这些设备可能会关闭并重新打开。此外,观察到静脉压测量值根据动物的位置而变化,目前尚不清楚这是由于静脉内压的真实变化还是设备主体相对于导管尖端的位置变化。此外,当动物直立时,遥测设备主体的位置与它们在 IVC 或 SVC 中的导管尖端大致相同,但由于解剖学限制,高度差异仍然存在。对于颈部植入物,装置主体位于 SVC 中的导管尖端高于导管尖端,对于腹股沟植入物,装置主体位于 IVC 中的导管尖端下方。尽管如此,检查压力值的总体趋势仍可能为可能出现的任何血流动力学变化提供重要的见解。为了更全面地了解慢性 Fontan 生理学和 Fontan 失败的机制,有必要进一步分析这些遥测系统收集的长期数据。还需要在术后进行额外的导管插入手术,以验证遥测输出的准确性并确定可能随时间推移的传感器漂移。最后,由于体细胞生长而导致的设备导管尖端移位是一个潜在的问题,尤其是当遥测装置植入年轻动物时。在术后导管插入术过程中,可以确定和确认不透射线导管尖端的位置。
无线遥测系统允许从自由移动的大型动物模型中实时实时收集连续的血流动力学数据。通过在 IVC 和 SVC 以及腹主动脉和升主动脉中放置压力感应导管来手术植入这些装置是安全可行的。
披露声明
该项目由加利福尼亚州帕洛阿尔托的 Additional Ventures Cures Collaborative 资助。
致谢
我们感谢 Animal Research Core 敬业的兽医工作人员。我们还要感谢 Mary Walker,DVM,MS,感谢她在整个研究过程中的宝贵专业知识和警惕的照顾。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
参考文献
- Fontan, F. Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L. Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), 387-394; discussion 394-385 (1996).
- Iskander, C. et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244 (2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. Statpearls, Treasure Island, FL (2024).
- Daley, M. D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit? J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z. et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601 (2024).
- Al Balushi, A. Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J. et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260 (2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F. et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J. et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J. et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P. et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240--1249 (2021).
- D'udekem, Y. et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594 (2024).
- Granegger, M. et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X. et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J. et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M. et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H. et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. At <https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l > (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。