Method Article
Implantation d’un dispositif de télémétrie sans fil dans un modèle de Fontan Ovine pour une surveillance hémodynamique continue et à long terme
Dans cet article
Résumé
Ce protocole décrit la méthodologie chirurgicale d’implantation d’un dispositif de télémétrie sans fil pour animaux de grande taille afin de permettre une collecte continue et à long terme de données hémodynamiques, y compris la fréquence cardiaque, la pression artérielle, les pressions inférieures et supérieures de la veine cave et le rythme cardiaque.
Résumé
Bien que la procédure de Fontan améliore considérablement l’espérance de vie des patients atteints d’un ventricule unique, il est bien reconnu que la circulation qui en résulte entraîne un fardeau important de la maladie à long terme en raison d’une pression veineuse centrale chroniquement élevée et d’une diminution du débit cardiaque. Les modèles animaux chroniques de Fontan sont un atout précieux pour étudier les résultats physiologiques tardifs associés à cette opération et un outil nécessaire dans l’évaluation des futurs dispositifs conçus pour atténuer l’échec de Fontan. Cependant, les tentatives précédentes de création de modèles de Fontan chroniques ont été entravées par de faibles taux de survie. De plus, la collecte efficace de données hémodynamiques pose un défi important aux animaux en mouvement libre. À cette fin, l’utilisation de systèmes de télémétrie implantables sans fil offre une solution novatrice pour le suivi en temps réel et à long terme des données cardiovasculaires. Ce protocole décrit la méthodologie d’implantation chirurgicale d’un dispositif de télémétrie sans fil dans un modèle ovin de survie de Fontan, facilitant l’enregistrement continu et continu de plusieurs paramètres hémodynamiques, notamment la fréquence cardiaque, la pression artérielle et les pressions localisées dans la veine cave inférieure (VCI) et la veine cave supérieure (SVC). Des dispositifs de télémétrie ont été implantés avec canulation de l’artère carotide et de la veine jugulaire interne ou de l’artère et de la veine fémorales, pour la mise en place de cathéters sensibles à la pression dans l’aorte ascendante et la CVV ou l’aorte abdominale et la VCI, respectivement. L’utilisation des systèmes de télémétrie sans fil a permis une surveillance postopératoire étroite après une opération Fontan en une seule étape, ce qui a contribué à améliorer le bien-être et la survie des animaux.
Introduction
La mise au point de la procédure de Fontan en 1971 a permis d’améliorer considérablement les résultats pour les patients atteints d’un seul ventricule1. Le but de cette opération est de séparer le retour veineux systémique et pulmonaire vers le cœur, augmentant ainsi l’oxygénation systémique et soulageant la charge volumique sur le ventricule systémique. Depuis son introduction, de nombreuses modifications ont été apportées à l’approche chirurgicale. Actuellement, le pontage total du cœur droit est le plus souvent réalisé par reconstruction par étapes 2,3. En règle générale, la première étape est réalisée au cours de la première semaine de vie4. Les patients subissent ensuite une deuxième étape, qui consiste soit en la procédure Glenn, soit en l’hémi-fontan, pour rediriger le flux sanguin de la veine cave supérieure (SVC) vers l’artère pulmonaire (PA)5. S’ensuit la procédure de Fontan, qui consiste à créer un conduit extracardiaque ou un tunnel latéral entre la veine cave inférieure (VCI) et l’AP6. Des progrès chirurgicaux tels que ceux réalisés tout au long de l’histoire de la procédure de Fontan n’auraient pas pu être réalisés sans l’utilisation de modèles animaux7.
Bien que la procédure de Fontan améliore considérablement l’espérance de vie des patients atteints d’un ventricule unique, il est bien reconnu que la circulation qui en résulte, qui fonctionne sans pompe sous-pulmonaire, entraîne une charge de morbidité importante à long terme en raison d’une pression veineuse centrale (CVP) chroniquement élevée et d’une diminution du débit cardiaque 8,9,10,11,12 . Les modèles animaux de Fontan chronique sont un atout précieux pour étudier les résultats physiologiques tardifs associés à cette opération13. La collecte active de données sur les paramètres cardiovasculaires, tels que la PVC, la fréquence cardiaque et d’autres signes vitaux, afin de saisir les changements hémodynamiques postopératoires est essentielle pour une évaluation complète de la physiopathologie en développement. De plus, les modèles animaux sont un outil nécessaire pour tester la capacité de nouveaux dispositifs d’assistance ventriculaire conçus pour atténuer les défauts hémodynamiques de la circulation de Fontan in vivo 14,15,16,17,18,19.
Cependant, la collecte efficace des données pose un défi de taille. Les techniques invasives basées sur des cathéters sont limitées par leur nature transitoire, les risques procéduraux associés et l’incapacité de surveiller l’état de l’animal sur de longues périodes. De plus, les tentatives précédentes de création d’un modèle de Fontan chez les grands animaux ont été entravées par de faibles taux de survie, probablement en raison de l’incapacité des cœurs normaux à s’adapter à l’établissement aigu de la circulation de Fontan 7,20. À cette fin, l’utilisation de systèmes de télémétrie sans fil offre une solution novatrice pour la collecte en temps réel et à long terme de données cardiovasculaires chez les animaux en mouvement libre21,22. Ces dispositifs peuvent également permettre une surveillance postopératoire étroite, ce qui pourrait améliorer le bien-être et la survie des animaux.
Nous décrivons ici la méthodologie pour l’implantation et l’utilisation réussies d’un système de télémétrie sans fil23 dans un modèle ovin de Fontan chronique. Cette technique a fourni un moyen robuste et fiable de collecte continue de données hémodynamiques, permettant l’étude des pressions veineuses et d’autres paramètres physiologiques clés. La mise en œuvre de cette technologie dans des modèles précliniques est essentielle pour faire progresser notre compréhension de la physiologie de Fontan et le développement de nouvelles stratégies thérapeutiques visant à améliorer les résultats à long terme des patients atteints de Fontan.
Protocole
Ce protocole expérimental a été approuvé par le Comité institutionnel de soin et d’utilisation des animaux de l’Institut de recherche Abigail Wexner de l’Hôpital national pour enfants (AR20-00121). Toutes les procédures ont respecté les directives décrites dans le Guide d’utilisation et de soins des animaux de laboratoire de l’Institut national de la santé. Cette recherche a suivi les lignes directrices de la recherche animale : rapport des expériences in vivo . Des moutons Dorset d’un poids de 23 à 38 kg et d’un âge de 2 à 12 mois ont été logés dans un environnement spécifique exempt d’agents pathogènes avec un accès libre à la nourriture et à l’eau pendant au moins 1 semaine avant l’opération. L’équipement et les réactifs utilisés dans l’étude sont énumérés dans la table des matériaux.
1. Préparation des animaux
- Faites évaluer les moutons par l’équipe vétérinaire 1 semaine avant l’intervention chirurgicale pour s’assurer qu’ils peuvent subir une anesthésie en toute sécurité. Jeûnez les moutons en bonne santé et privez-les d’eau pendant 12 heures avant l’intervention chirurgicale.
- Sédatif avec une combinaison de kétamine (4 mg/kg) et de diazépam (0,5 mg/kg) injectée par une veine jugulaire interne (IJ).
- Rasez les moutons selon la procédure prévue (détaillée ci-dessous) et sur la cuisse pour la mise à disposition du tampon de mise à la terre par électrocautérisation. Nettoyez les sites chirurgicaux avec de l’alcool.
- Insérez une sonde endotrachéale à lumière unique de 8 à 9 mm dans la trachée.
- Insérez une sonde orogastrique pour la décompression de l’estomac et du rumen.
- Insérez un cathéter veineux à lumière unique (16-18 G) dans la veine jugulaire droite ou une veine saphène latérale pour l’administration continue de liquides, la perfusion à débit continu (IRC) de propofol et l’injection de médicament au besoin.
- Placez un cathéter artériel (22-24 G) dans une artère auriculaire pour une surveillance continue de la pression artérielle.
- Placez un brassard de tensiomètre sur le membre avant droit pour une mesure non invasive de la pression artérielle, un clip sur l’oreille ou la langue pour surveiller la saturation en oxygène et des sondes d’électrocardiogramme (ECG) sur les quatre membres.
- Pendant l’intervention, maintenez l’anesthésie à l’aide d’isoflurane inhalé à 1 % à 3 % avec 100 % d’O2 et/ou d’IRC au propofol (20 à 45 mg/kg/h).
- Nettoyez aseptiquement les sites chirurgicaux à l’aide d’une préparation à base de chlorhexidine et drapez de manière stérile standard.
- Administrer la céfazoline (25 mg/kg) pour l’antibioprophylaxie avant l’incision et redoser toutes les 4 heures pendant l’opération au besoin.
- Administrer une injection sous-cutanée d’un anesthésique local, tel que la bupivacaïne 0,25 %, à tous les sites d’incision prévus avant l’incision.
2. Préparation de l’appareil de télémétrie
- Ouvrez le logiciel de télémétrie et allumez-le à l’aide de l’interrupteur magnétique pendant qu’il est encore scellé dans son emballage d’origine.
- Dans le logiciel, cliquez sur Matériel situé dans la barre supérieure et sélectionnez Modifier la configuration PhysioTel Digital (CLC) pour attribuer l’unité de télémétrie à un contrôleur de liaison de communication (CLC).
- Une fois qu’un CLC est sélectionné, sa page Détails du CLC s’ouvre. Sur cette page, cliquez sur Rechercher des implants, ce qui lancera une recherche de dispositifs d’implants activés à proximité.
- Cliquez sur Ajouter pour ajouter l’unité de télémétrie à la liste Implants sélectionnés . Le dispositif apparaîtra désormais dans la liste des implants configurés sur la page Détails du CLC . Cliquez sur Enregistrer et quitter.
- Démarrez l’acquisition des données en appuyant sur le bouton Lecture à côté du nom de l’unité de télémétrie dans l’onglet Contrôle d’échantillonnage . Le graphique affichant l’acquisition de données en direct s’ouvrira automatiquement.
- Retirez le dispositif de son emballage extérieur et transférez-le dans son emballage intérieur stérile sur la table d’opération.
- Mettez l’appareil à zéro pendant qu’il reste dans son emballage intérieur. Attendez que les mesures de l’appareil soient stables pendant 30 s et utilisez les valeurs de pression moyenne non pulsatile stabilisée (NPMN) comme décalage.
- Dans Configuration du sujet, sélectionnez l’icône des paramètres en regard du paramètre qui est mis à zéro et ouvrez l’onglet Décalages . Entrez la valeur de décalage obtenue à partir des mesures NPMN dans la zone de texte.
- Après avoir saisi le décalage, vérifiez si les lectures NPMN sont de 0 ± 0,1 mmHg. Si ce n’est pas le cas, répétez l’étape 2.7 jusqu’à ce que les valeurs se situent dans la plage souhaitée.
- Effectuez les étapes 2.7-2.9 pour les deux canaux de pression.
- Avant d’insérer les cathéters de détection de pression dans un vaisseau sanguin, tapotez l’embout pour identifier le canal correspondant. Les tapotements deviendront apparents dans la sortie de la forme d’onde.
- Utilisez le cathéter correspondant au canal de pression ventriculaire gauche (LVP) pour la mesure de la pression artérielle et au canal de pression artérielle (BP) pour la mesure de la pression veineuse.
- Dans l’onglet Attributs standard de la boîte de dialogue Attributs d’analyse de la pression artérielle , définissez la hauteur minimale du pouls sur 1 mmHg pour le canal BP.
3. Méthode 1 : Canulation de l’artère fémorale et de la veine
- Rasez le mouton dans un large périmètre autour de l’aine droite et sur l’abdomen et la poitrine.
- Placez les moutons en décubitus dorsal sur la table d’opération, les membres antérieurs en flexion à l’aide d’une ceinture en tissu souple et les membres postérieurs en extension à l’aide d’un nœud coulant pour permettre l’accès à l’aine (figure 1A).
- Faites une incision transversale de 5 cm dans la région inguinale droite, centrée sur l’artère fémorale palpable, à environ 1 cm sous le pli inguinal.
- À l’aide d’une combinaison d’électrocautérisation et de dissection contondante, disséquez à travers le tissu sous-cutané jusqu’au triangle fémoral. Localisez les vaisseaux fémoraux en palpant le pouls artériel.
- Divisez le muscle sartorius et le muscle long adducteur le long dans la direction des fibres musculaires pour exposer les vaisseaux fémoraux (Figure 1B).
- À l’aide d’une combinaison de dissection émoussée et nette, dégagez le tissu conjonctif des vaisseaux fémoraux sur la circonférence de la région.
- Passez une attache en soie 2-0 à double boucle autour des deux vaisseaux proximaux et distaux du site de canulation pour une ligature temporaire des vaisseaux.
- Faites une incision transversale de 6 cm à travers la peau du bas-ventre droit, à environ 3 cm au-dessus du pli inguinal.
- À l’aide d’une combinaison d’électrocautérisation et de dissection contondante, disséquez à travers la graisse sous-cutanée et le tissu conjonctif pour créer une poche de 6 cm x 4 cm superficielle à l’oblique externe.
- Insérez l’appareil de télémétrie dans la poche sous-cutanée et fixez-le en place à l’aide d’une suture en soie 2-0 (Figure 1C).
- Tunnelisez l’antenne du dispositif de télémétrie sous le tissu sous-cutané et fixez-la en place à l’aide d’une suture en soie 2-0.
- Pour la mise en place des sondes de biopotentiel (ECG), faites des contre-incisions de 1 cm dans la peau sur le milieu et le bas de l’abdomen, ainsi que sur le bas et le haut du thorax. Creusez un tunnel sous-cutané pour connecter ces incisions à la poche du corps de l’appareil et guider les fils ECG vers l’emplacement souhaité.
- Placez l’électrode positive dans le tissu sous-cutané à gauche de la partie inférieure du sternum. Assurez-vous que le tube en silicone est retiré pour révéler la pointe du fil d’acier en dessous.
- Placez l’électrode négative dans le tissu sous-cutané à droite de la partie supérieure du sternum.
- L’excès de câblage pour les deux sondes peut être enroulé et fixé à l’emplacement sous-cutané à l’aide d’une suture en soie 2-0.
- Créez un tunnel sous-cutané entre la poche inférieure de l’appareil abdominal et l’incision inguinale et enfilez les deux cathéters de pression.
- Placez un point de fil de bourse à l’aide d’une suture en polypropylène 6-0 autour du site de canulation de l’artère et de la veine fémorales, qui peuvent être fixées à l’aide d’un garrot en plastique.
- Remplissez les embouts en gel du cathéter avec du gel non compressible à haute viscosité pour éviter la coagulation à l’intérieur des embouts du cathéter, en veillant à ce qu’il n’y ait pas de bulles d’air.
- Administrer une dose d’héparine intraveineuse (100 unités/kg) 3 min avant la canulation.
- Serrez les garrots de soie proximaux et distaux 2-0 autour de l’artère fémorale. Incisez soigneusement dans le récipient au centre du point de fil de bourse à l’aide d’un scalpel à lame #11 et dilatez légèrement avec la pointe d’un hémostat incurvé.
- Insérez le cathéter de pression correspondant au canal LVP et avancez-le dans l’aorte abdominale, en desserrant le garrot de soie proximal pour permettre le passage du cathéter. Serrez le cordon de suture et attachez-le autour du cathéter.
- Répéter les étapes 3.20 et 3.21 pour la canulation de la veine fémorale à l’aide du cathéter de pression correspondant au canal BP et l’introduire dans la VCI abdominale (Figure 1D).
- Confirmez que les extrémités du cathéter sont correctement situées dans la VCI et l’aorte à l’aide de la fluoroscopie.
- Rapprochez le muscle sartorius à l’aide d’une suture résorbable 2-0.
- Fermez la peau avec des sutures dermiques profondes et sous-cuticulaires à l’aide de sutures résorbables 3-0 et 4-0, respectivement.
4. Méthode 2 : Canulation de l’artère carotide et de la veine jugulaire interne
- Rasez les moutons dans un large périmètre autour du cou gauche et vers le bas sur la poitrine.
- Placez le mouton en décubitus latéral droit sur la table d’opération avec le membre avant gauche fixé en flexion à l’aide d’un nœud coulant pour exposer la poitrine (Figure 2A).
- Faites une incision cutanée longitudinale de 5 cm au-dessus de l’artère carotide gauche et de la veine IJ, à environ 7 cm du crâne jusqu’à l’entrée thoracique.
- À l’aide de l’électrocautérisation, disséquez la graisse sous-cutanée, le tissu conjonctif et le platysma pour exposer les vaisseaux du cou (Figure 2B).
- À l’aide d’une combinaison de dissection émoussée et nette, dégagez le tissu conjonctif de l’artère carotide gauche et de la veine IJ de la circonférence.
- Passez une attache en soie 2-0 à double boucle autour des deux vaisseaux proximaux et distaux du site de canulation pour une ligature temporaire des vaisseaux.
- Faites une incision longitudinale de 6 cm à la base du cou gauche, entre l’omoplate et la colonne cervicale.
- À l’aide d’une combinaison d’électrocautérisation et de dissection contondante, disséquez la graisse sous-cutanée et le tissu conjonctif pour créer une poche de 6 cm x 4 cm s’étendant vers la colonne vertébrale.
- Insérez l’appareil de télémétrie dans la poche sous-cutanée et fixez-le en place à l’aide d’une suture en soie 2-0.
- Tunnelisez l’antenne du dispositif de télémétrie sous le tissu sous-cutané et fixez-la en place à l’aide d’une suture en soie 2-0.
- Faites des incisions cutanées de 1 cm à la base du cou, ainsi qu’en bas du dos gauche et en haut du thorax droit, pour le placement des dérivations ECG. Creusez un tunnel sous-cutané pour relier ces incisions à la poche du corps de l’appareil et guider les fils de l’ECG vers l’emplacement souhaité (Figure 2C).
- Placez les dérivations ECG de la même manière que les étapes décrites ci-dessus pour la procédure d’implant fémoral (section 3).
- Créez un tunnel sous-cutané entre la poche latérale du dispositif et l’incision médiale du cou et enfilez les deux cathéters de pression. Préparez ces cathéters de pression à l’aide de gel avant la canulation, comme détaillé dans la procédure d’implant fémoral.
- À l’aide d’une suture en polypropylène 6-0, placez un cordon de persuasion autour du site de canulation sur les deux vaisseaux et fixez-le avec un garrot en plastique.
- Administrer une dose d’héparine intraveineuse (100 unités/kg) 3 min avant la canulation.
- Serrez les garrots proximaux et distaux en soie 2-0 autour de l’artère carotide. Incisez soigneusement dans le récipient au centre du point de fil de bourse à l’aide d’un scalpel à lame #11 et dilatez légèrement avec la pointe d’un hémostat incurvé.
- Insérez le cathéter de pression correspondant au canal LVP et avancez-le dans l’aorte thoracique ascendante, en desserrant le garrot de soie proximal pour permettre le passage du cathéter. Serrez le cordon de suture et attachez-le autour du cathéter.
- Répétez les étapes 4.16 et 4.17 pour la canulation de la veine IJ gauche à l’aide du cathéter de pression correspondant au canal BP et faites-le avancer dans le SVC thoracique.
- Confirmer l’emplacement approprié des extrémités du cathéter dans le SVC thoracique et l’aorte ascendante à l’aide de la fluoroscopie (figure 2D).
- Rapprochez le muscle platysma à l’aide d’une suture résorbable 2-0.
- Fermez la peau avec des sutures dermiques profondes et sous-cuticulaires à l’aide de sutures résorbables 3-0 et 4-0, respectivement.
5. Récupération
- Arrêtez les anesthésiques. Retirez la sonde orogastrique et extuber lorsque le mouton respire sans l’aide du ventilateur. Cela se produit généralement après que le mouton montre des signes d’excitation (mouvement, clignement des yeux, réponse à des stimuli douloureux, tonus de la mâchoire, mastication).
- Retirez la ligne artérielle.
REMARQUE : Une surveillance continue de la pression artérielle peut être fournie par l’appareil de télémétrie si l’un de ses cathéters de pression a été placé dans l’aorte. - Transférez les moutons dans une unité d’hébergement isolée pour qu’ils se rétablissent. Aidez le mouton à rester en position couchée sternale, puis éventuellement à se tenir debout.
- Administrer par voie intraveineuse de la banamine (2,2 mg/kg) et de la buprénorphine SR sous-cutanée (0,03 mg/kg) pour la douleur postopératoire.
Résultats
Résultats chirurgicaux
Au total, 13 moutons ont subi une chirurgie de Fontan en une seule étape comprenant une connexion cavopulmonaire totale avec détachement de la CVS et de la CVI de l’oreillette droite, une anastomose directe de bout en côté de la CVS à l’AP et la mise en place d’un conduit extracardiaque entre la CVI et l’AP. Les moutons ont subi cette procédure à l’âge moyen de 13,3 ± 7,6 mois. Parmi ceux-ci, 3 moutons ont subi l’implantation d’un dispositif de télémétrie sans fil avec placement de cathéters de détection de pression dans l’aorte abdominale et la VCI ; 2 moutons ont subi l’implantation d’un dispositif de télémétrie avec mise en place de cathéters de détection de pression dans l’aorte ascendante et la CVS ; et 8 moutons n’avaient pas de dispositif de télémétrie implanté. Aucun animal n’a présenté de complications postopératoires majeures après l’implantation d’un dispositif de télémétrie. Sept ovins sur 8 (87,5 %) sans appareil de télémesure sont décédés dans les 30 jours suivant l’opération de Fontan, tandis que seulement 1 mouton sur 5 (20,0 %) avec un appareil de télémesure est décédé pendant cette période postopératoire (tableau 1).
Collecte de données hémodynamiques
L’implantation de systèmes de télémétrie sans fil a facilité la collecte continue et à long terme de données pour plusieurs paramètres cardiovasculaires, notamment la fréquence cardiaque, la pression artérielle et la PVC. Cela a permis un suivi hémodynamique étroit des animaux subissant une chirurgie de Fontan en une seule étape avant, pendant et pendant de nombreux jours après leur opération (Figure 3). Des variations de la pression veineuse ont été observées d’une minute à l’autre, bien que les tendances globales semblaient montrer une augmentation aiguë des pressions de la VCV abdominale (figure 4A) et de la CVV thoracique (figure 4B) après l’établissement de la circulation de Fontan. Certaines fluctuations d’une minute à l’autre de la pression veineuse pourraient être attribuées au niveau d’activité et au positionnement des moutons. Par exemple, on a observé que les pressions dans la VCI abdominale augmentaient constamment lorsque les moutons se reposaient sur leur abdomen en position couchée (Figure 5). Chez un mouton, une procédure de cathétérisme a été effectuée le même jour après l’implantation du dispositif dans la région du cou avec la mise en place du canal de pression veineuse dans le SVC. Cela a été fait pour évaluer les écarts entre les valeurs rapportées par l’appareil de télémétrie et celles acquises par la surveillance invasive de la pression, qui était considérée comme l’étalon-or. Les pressions SVC moyennes non pulsatiles obtenues lors de la procédure de cathétérisme ont fluctué entre 2 et 4 mmHg, avec des oscillations attribuables à des changements de pression intrathoracique tout au long du cycle respiratoire (Figure 6). Tout au long de la procédure, l’appareil de télémesure a produit en moyenne 43 lectures de la pression SVC moyenne non pulsatile par minute, avec une pression SVC moyenne globale de 1,1 ± 3,1 mmHg, indiquant un décalage minimal entre les mesures de l’appareil et les valeurs réelles.

Figure 1 : Implantation d’un dispositif avec canulation de l’artère fémorale et de la veine. Pour l’implantation du dispositif avec canulation de l’artère fémorale et veineuse, le mouton est positionné en décubitus dorsal avec les pattes arrière en extension. (A) Les marquages préopératoires indiquent le positionnement des incisions prévues, de la poche corporelle du dispositif et le trajet sous-cutané des dérivations ECG et des cathéters de détection de pression jusqu’à leur emplacement final. (B) Une poche sous-cutanée d’environ 6 cm x 4 cm est créée entre le tissu sous-cutané et au-dessus du muscle oblique externe pour la mise en place du corps du dispositif de télémétrie. (C) Les vaisseaux fémoraux sont exposés suite à la division du muscle sartorius. L’artère fémorale palpable (flèches blanches) est située médialement à la veine fémorale (flèches bleues). (D) Des cathéters sensibles à la pression sont insérés dans l’artère fémorale (flèche blanche) et la veine (flèche bleue), puis fixés en place avec un point de persnère. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Implantation du dispositif avec l’artère carotide gauche et la canulation de la veine jugulaire interne (IJ). Pour l’implantation du dispositif avec l’artère carotide gauche et la canulation de la veine jugulaire interne (IJ), le mouton est positionné dans un décubitus latéral droit avec sa patte antérieure gauche étendue vers l’arrière. (A) Les marques préopératoires indiquent le positionnement des incisions prévues. (B) L’artère carotide gauche (flèches blanches) et la veine IJ (flèches bleues) sont exposées suite à la division du platysma. L’artère carotide est située profondément et latéralement à la veine IJ. (C) L’excès de câblage des sondes ECG est enroulé puis fixé dans l’espace sous-cutané. La mine positive est placée à gauche de la face inférieure du sternum (flèches noires), tandis que la mine négative est placée à droite de la face supérieure du sternum (flèches rouges). (D) La position des extrémités du cathéter sensible à la pression dans la veine cave supérieure (flèche bleue) et l’aorte ascendante (flèche blanche) a été confirmée par fluoroscopie. Le positionnement des dérivations ECG positive (flèche noire) et négative (flèche rouge) peut également être observé sur l’imagerie par rayons X. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Implantation d’un dispositif de télémétrie sans fil pour une surveillance continue. L’implantation d’un dispositif de télémétrie sans fil a permis de surveiller en continu plusieurs paramètres cardiovasculaires, notamment la fréquence cardiaque, la pression artérielle et la pression veineuse, dans des modèles ovins de survie de Fontan tout au long de la période périopératoire. Les tendances hémodynamiques illustrées dans ce graphique sont représentatives des données recueillies à partir de cathéters de détection de pression placés dans l’aorte abdominale et la veine cave inférieure (VCI). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Positionnement des cathéters de détection de pression. Des cathéters sensibles à la pression ont été positionnés dans la veine cave inférieure abdominale (A) ou la veine cave supérieure thoracique (B) pour l’enregistrement continu des pressions veineuses centrales. Les pressions veineuses ont été mesurées en préopératoire, en peropératoire pendant l’intervention de Fontan et en postopératoire afin d’évaluer les tendances suivant l’établissement de la circulation de Fontan. Des variations d’une minute à l’autre dans les mesures de pression se produisaient avec des changements dans le positionnement et le niveau d’activité de l’animal. Veuillez cliquer ici pour voir une version agrandie de cette figure.
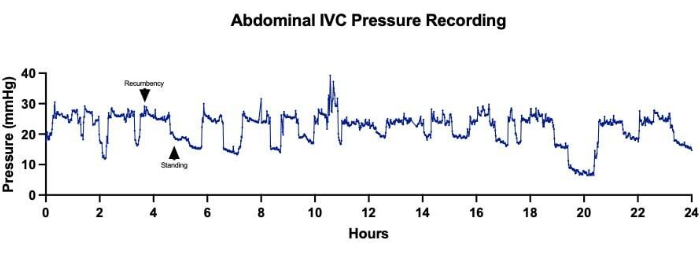
Figure 5 : Pressions de la veine cave inférieure abdominale (VCI). L’acquisition continue des pressions IVC abdominales sur une période de 24 heures a montré des fluctuations dans les mesures de pression corrélées aux changements dans le positionnement des moutons. Des pressions IVC moyennes plus élevées correspondaient aux moments où les moutons se reposaient en position couchée, tandis que des pressions IVC moyennes plus faibles étaient enregistrées lorsque les moutons étaient debout. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Mesure invasive de la pression du SVC. Une procédure de cathétérisme a été effectuée le même jour après l’implantation du dispositif chez un mouton pour vérifier les lectures de pression de la veine cave supérieure (SVC) du système de télémétrie. Les valeurs obtenues par cette méthode de surveillance invasive de la pression ont été considérées comme l’étalon-or. Les pressions SVC moyennes non pulsatiles obtenues lors de la procédure de cathétérisme ont fluctué entre 2 et 4 mmHg en synchronisation avec le cycle respiratoire. Pendant ce temps, la moyenne de toutes les pressions SVC moyennes non pulsatiles recueillies par le dispositif de télémétrie pendant la procédure était de 1,1 ± 3,1 mmHg, indiquant un décalage minimal entre les lectures de télémétrie et les valeurs réelles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Mouton | Sexe | Placement du cathéter du dispositif de télémétrie | Poids au moment de l’opération Fontan (kg) | Âge au moment de l’opération de Fontan (mois) | Décès périopératoire |
| 1 | M | Aucun | 45 | 13 | Oui |
| 2 | F | Aucun | 43 | 13 | Non |
| 3 | M | Aucun | 46.5 | 25 | Oui |
| 4 | F | Aucun | 46.5 | 19 | Oui |
| 5 | M | Aucun | 50 | 20 | Oui |
| 6 | F | Aucun | 53 | 28 | Oui |
| 7 | M | Aucun | 40.5 | 8 | Oui |
| 8 | M | Aucun | 42 | 10 | Oui |
| 9 | F | Aorte abdominale et VCI | 33.5 | 3 | Non |
| 10 | M | Aorte abdominale et VCI | 24 | 7 | Oui |
| 11 | M | Aorte abdominale et VCI | 29 | 8 | Non |
| 12 | M | Aorte ascendante et CVS | 37.5 | 13 | Non |
| 13 | M | Aorte ascendante et CVS | 39.5 | 6 | Non |
Tableau 1 : Résultats chirurgicaux. Treize moutons ont subi une intervention chirurgicale de Fontan en une seule étape, dont 5 avaient subi l’implantation d’un dispositif de télémétrie sans fil 1 mois auparavant. À la suite de l’opération de Fontan, 7 moutons sur 8 (87,5 %) sans appareil de télémesure sont morts dans les 30 jours, contre 1 mouton sur 5 (20,0 %) avec un appareil de télémesure.
Discussion
Nous avons développé deux méthodes chirurgicales pour l’implantation d’un dispositif de télémétrie sans fil dans un modèle ovin. Le dispositif a été implanté avec succès chez 5 moutons pour réaliser une surveillance et un enregistrement continus et à long terme de plusieurs paramètres cardiovasculaires, notamment la fréquence cardiaque, la pression artérielle et les pressions veineuses localisées de la VCI abdominale et du SVC thoracique. Tous les moutons ont survécu à l’opération d’implantation du dispositif sans aucune complication majeure et ont subi une opération de Fontan en une seule étape un mois plus tard.
En 2019, Van Puyvelde et al. ont rapporté la création du premier modèle de survie ovine de Fontan pour étudier le processus chronique de défaillance de Fontan13. Cependant, les deux tiers des animaux n’ont finalement pas survécu au-delà de la vingtième semaine postopératoire. Notamment, il est extrêmement difficile d’établir une circulation aiguë de Fontan chez les animaux à cœur normal, probablement parce qu’ils sont moins adaptés que les cœurs univentriculaires à cet état physiologique spécifique. L’utilité de l’implantation d’un dispositif de télémétrie est donc double. Premièrement, la capacité de surveiller de près les signes vitaux pendant la période postopératoire peut permettre de reconnaître et de répondre rapidement aux signes de décompensation cardiovasculaire, ainsi que de faciliter l’initiation de traitements orientés vers un objectif. D’après notre expérience, l’implantation de dispositifs de télémétrie sans fil dans une cohorte de moutons subissant l’opération Fontan en une seule étape a contribué à améliorer leur survie. Deuxièmement, la capacité d’acquérir des données en temps réel à long terme nous permettra d’identifier les tendances hémodynamiques émergentes associées à la défaillance de Fontan.
Bien que nous nous soyons concentrés sur la création d’un modèle de grand animal de Fontan chronique, les avantages des systèmes de télémétrie sans fil peuvent également être appliqués à d’autres entreprises, telles que la mise à l’essai et le développement de nouveaux dispositifs d’assistance cavopulmonaire (CPAD) visant à fournir une assistance circulatoire mécanique en cas de défaillance de Fontan. Plusieurs groupes ont publié de grandes études animales examinant la faisabilité et la capacité fonctionnelle des CPAD appliquées à la circulation de Fontan 16,17,18,19. Cependant, la majorité de ces expériences ont été menées dans des modèles de Fontan aigus avec évaluation à court terme des performances hémodynamiques à l’aide de méthodes de collecte de données qui ne sont pas viables en dehors de la salle d’opération. En 2019, Cysyk et al. ont décrit l’implantation réussie d’un CPAD dans un modèle de survie ovine de Fontan14,15. Dans leur étude, des lignes de surveillance de la pression remplies de liquide ont été placées dans le SVC, l’IVC, le PA et l’oreillette gauche et amenées à travers la paroi thoracique postérieure pour obtenir des mesures de pression continues pendant la période d’étude de 30 jours. Bien que cette méthode ait été largement suffisante pour les besoins de leur étude, ils ont noté des problèmes de migration du cathéter. Pour une collecte de données à long terme supérieure à 30 jours, l’utilisation d’un système de télémétrie sans fil peut s’avérer plus préférable.
Aucun des moutons ayant subi l’implantation d’un dispositif de télémétrie n’a connu de complications majeures à la suite de la procédure. Cependant, il a été constaté qu’une sonde ECG s’était érodée à travers la peau d’un mouton au site d’incision cicatrisé plusieurs semaines après l’opération. Cela a été ressenti comme étant lié à une escarre, car les moutons se reposent généralement en décubitus sternal, le poids de leur corps étant placé sur le sternum antérieur au-dessus des sites où les sondes ECG avaient été localisées sous-cutanéement. Par conséquent, pour éviter l’érosion de la sonde ECG, les sondes ECG ont été positionnées latéralement, plutôt que directement au-dessus, du sternum chez les futurs moutons subissant l’implantation d’un dispositif, et aucun autre mouton n’a depuis rencontré ce problème.
Plusieurs étapes sont nécessaires pour s’assurer que les lectures de pression sont aussi précises que possible. Tout d’abord, le dispositif de télémétrie doit être mis à zéro à la pression atmosphérique sur une surface plane, les extrémités du cathéter étant au niveau du corps du dispositif lorsqu’il est à l’intérieur de son emballage d’origine. Avant d’insérer les cathéters à détection de pression dans un vaisseau sanguin, il est nécessaire de remplir les extrémités du cathéter avec un gel non compressible à haute viscosité, en prenant soin de s’assurer qu’il n’y a pas de bulles d’air dans le gel transparent. Enfin, il est important de noter le positionnement du corps du dispositif par rapport à l’extrémité du cathéter, car les différences de hauteur peuvent fausser les mesures de pression. Nous avons choisi de placer le corps de l’appareil sur le bas-ventre ou à la base du cou en arrière de l’omoplate afin qu’il soit à peu près au même niveau que l’extrémité du cathéter dans la VCI abdominale ou la SVC thoracique, respectivement, lorsque le mouton était debout.
Il convient de noter que nous avons également positionné le corps du dispositif de télémétrie à un endroit à au moins 15 cm de la région d’intérêt, y compris le cœur, les gros vaisseaux et le foie, afin de minimiser la quantité d’artefacts qu’il pourrait produire lors de futures images par résonance magnétique. Enfin, des cathéters sensibles à la pression ont été insérés dans l’artère carotide gauche et la veine IJ afin qu’il soit possible d’effectuer de futures procédures de cathétérisme à travers la veine IJ droite.
À l’heure actuelle, l’utilisation des systèmes de télémesure sans fil décrits ci-dessus présente plusieurs limites. Il convient de noter que l’implant du dispositif a une durée de vie de la batterie de 84 jours. Une fois implantée, la batterie de l’appareil ne peut pas être rechargée ou remplacée. Cependant, les appareils peuvent être éteints et rallumés pendant les périodes de temps où la collecte de données est souhaitée pour prolonger leur utilisation. De plus, on a observé que les mesures de la pression veineuse variaient en fonction de la position de l’animal, et il n’est pas clair si cela était dû à de véritables changements de pression intraveineuse ou à des changements dans le positionnement du corps du dispositif par rapport aux extrémités du cathéter. De plus, alors que les corps des appareils de télémétrie étaient positionnés à peu près au même niveau que les extrémités de leur cathéter dans la VCI ou la CVV lorsque les animaux étaient debout, les différences de hauteur demeuraient en raison des limitations anatomiques. Pour l’implant cervical, le corps du dispositif reposait plus haut que l’extrémité du cathéter dans le SVC, et pour l’implant de l’aine, le corps du dispositif reposait plus bas que l’extrémité du cathéter dans le VCI. Néanmoins, l’examen des tendances globales des valeurs de pression peut encore fournir des informations cruciales sur les changements hémodynamiques qui peuvent survenir. Une analyse plus poussée des données à long terme recueillies par ces systèmes de télémétrie sera nécessaire pour parvenir à une compréhension plus complète de la physiologie chronique de Fontan et des mécanismes de défaillance de Fontan. Des procédures de cathétérisme supplémentaires effectuées en postopératoire seront également nécessaires pour vérifier la précision de la sortie de télémétrie et identifier une éventuelle dérive du capteur au fil du temps. Enfin, le déplacement des extrémités des cathéters du dispositif à la suite de la croissance somatique est une préoccupation potentielle, en particulier lorsque des unités de télémétrie sont implantées chez des animaux plus jeunes. L’emplacement des pointes du cathéter radio-opaque peut être déterminé et confirmé lors des procédures de cathétérisme postopératoires.
Les systèmes de télémétrie sans fil permettent la collecte à long terme de données hémodynamiques continues en temps réel à partir de grands modèles d’animaux se déplaçant librement. L’implantation chirurgicale de ces dispositifs avec la mise en place de cathéters sensibles à la pression dans la VCI et la CVV, ainsi que dans l’aorte abdominale et ascendante, est sûre et réalisable.
Déclarations de divulgation
Ce projet a été financé par Additional Ventures Cures Collaborative, à Palo Alto, en Californie.
Remerciements
Nous apprécions le personnel vétérinaire dévoué du Centre de recherche animale. Nous tenons également à exprimer notre gratitude à Mary Walker, D.M.M., M.Sc., pour son expertise inestimable et ses soins vigilants tout au long de l’étude.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride solution | Baxter Healthcare Corporation | Pharmacy | Intraoperative fluid resuscitation and wound rinse |
| 16 G intravenous catheter | BD | 382259 | For fluid and drug administration |
| 22 G intravascular catheter | BD | 381423 | For arterial blood pressure monitoring |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated clotting time |
| Backhaus towel clamp | Medline | MDS1411111 | To affix sterile drape |
| Banamine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 50 mg/mL, dose 2.2 mg/kg |
| Blood pressure cuff | Royal Philips | 9.89803E+11 | Non-invasive blood pressure monitoring |
| Bupivacaine hydrochloride | Hospira Pharmaceuticals | Pharmacy | Local anesthetic: concentration 2.5 mg/mL, dose 2.5 mg/kg |
| Buprenorphine | Hospira Pharmaceuticals | Pharmacy | Postoperative pain control: concentration 0.3 mg/mL, dose 0.03 mg/kg |
| Castroviejo needle holder | Medline | MDS0750386 | Needle holder when suturing blood vessels |
| Cautery cleaner pad | Cardinal Health | 300-2SS | To clean cautery pencil tip |
| Cautery pencil | Medline | ESRK3002L | For dissection using electrocautery |
| Cefazolin | Hospira Pharmaceuticals | Pharmacy | Antibiotic prophylaxis |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray for intubation |
| Chloraprep | BD | 930825 | Topical antiseptic |
| Debakey atraumatic forceps | Medline | MDS1130630F | For tissue handling |
| Diazepam | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 5 mg/mL, dose 0.5 mg/kg |
| ECG leads | 3M | 2570 | ECG monitoring |
| Endotracheal tube, size 8-9 | Covidien | 86452, 86114, or 86454 | To secure airway |
| Hartmann hemostatic forceps | Medline | MDS1221109 | To clamp blood vessels and hold small sutures |
| Heparin | Hospira Pharmaceuticals | Pharmacy | Anticoagulant: 1,000 USP units/mL |
| Pressure transducer kit | Edwards Lifesciences | VSYPX12N | For arterial blood pressure monitoring |
| Pulse oximeter lingual clip | Nellcor | PO736 | For pulse oximetry |
| Isoflurane | Baxter Healthcare Corporation | Pharmacy | Anesthetic: dose 1-3% |
| Kantrowitz forcep (right angle) | Medline | MDS1243528 | For blunt dissection around blood vessels |
| Ketamine | Hospira Pharmaceuticals | Pharmacy | Sedative: concentration 100 mg/mL, dose 4 mg/kg |
| Laparotomy drape | Medline | DYNJP3008 | Sterile drape |
| Lubricating jelly | Medline | MDS0322273Z | Endotracheal tube lubricant |
| Mayo Hegar needle holder | Medline | MDS2418420F | Needle holder when suturing soft tissue |
| Mayo scissors | Medline | MDS0816121 | To cut suture |
| Metzenbaum curved scissors | Medline | MDS3223226 | For sharp dissection |
| Needles and syringes | Cardinal Health | 309604 | For intravenous and subcutaneous drug administration |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| Perma-Hand silk suture | Ethicon | C016D | For blood vessel ligation and attachment of the telemetry device subcutaneously |
| PhysioTel Digital wireless telemetry device | Data Sciences International | L21 model | Wireless telemetry device implant |
| Pierce microforceps | Medline | MDG384908 | Small needle handling |
| Plastic tourniquet and suture snare | Medtronic | 79013 | To facilitate hemostasis during vessel cannulation |
| Pressure bag | Carefusion | 64-10029 | For arterial blood pressure monitoring |
| Prolene 6-0 suture | Ethicon | 8307H | Purse string stitch for vessel cannulation |
| Propofol | Fresenius Kabi | Pharmacy | Anesthetic: concentration 10 mg/mL, dose 20-45 mg/kg/h |
| Scalpel #10 blade | Medline | MDS15310 | For skin incisions |
| Scalpel #11 blade | Medline | CISION11CS | For incision into blood vessels |
| Schnidt tonsil forceps | Medline | MDS5018719 | For blunt dissection through subcutaneous tissue |
| SoftCarry stretcher | Four Flags Over Aspen | SSTR-4 | For animal transportation |
| Sterile disposable OR towel | Medline | MDT2168201 | Sterile drape |
| Sterile bowl | LSL Industries | 5232 | To hold saline solution |
| Sterile cotton X-ray detectable gauze sponge | Medline | NON21430LF | Fluid absorption |
| Orogastric tube | Jorgensen Lab, Inc. | J0348R | For stomach and rumen decompression |
| T-port | Medline | DYNDTN0001 | Intravenous catheter tubing connector |
| Urine drainage bag | Covidien | 3512 | Connects to orogastric tube to collect gastric fluids |
| Veterinary trocar with stylet | Braintree Scientific, Inc. | TRO-STY 7B-12 | To guide telemetry wires through subcutaneous tissue |
| Vicryl 2-0 suture | Ethicon | VCPB269H | Closure of subcutaneous soft tissue |
| Vicryl 3-0 suture | Ethicon | VCPB416H | Closure of deep dermal layer |
| Vicryl 4-0 suture | Ethicon | J494H | Closer of subcuticular layer |
| Warming blanket | Jorgensen Lab, Inc. | J1034B | To maintain animal's body temperature |
| Weitlander retractor | Teleflex Medical | 165358 | For wound retraction |
| Yankauer bulb tip suction | Medline | DYND50138 | Sterile waste management |
Références
- Fontan, F. Baudet, E. Surgical repair of tricuspid atresia. Thorax. 26 (3), 240-248 (1971).
- Attanavanich, S., Limsuwan, A., Vanichkul, S., Lertsithichai, P., Ngodngamthaweesuk, M. Single-stage versus two-stage modified fontan procedure. Asian Cardiovasc Thorac Ann. 15 (4), 327-331 (2007).
- Bove, E. L. Lloyd, T. R. Staged reconstruction for hypoplastic left heart syndrome. Contemporary results. Ann Surg. 224 (3), 387-394; discussion 394-385 (1996).
- Iskander, C. et al. Comparison of morbidity and mortality outcomes between hybrid palliation and norwood palliation procedures for hypoplastic left heart syndrome: Meta-analysis and systematic review. J Clin Med. 13 (14), 4244 (2024).
- Salik, I., Mehta, B., Ambati, S. Bidirectional Glenn Procedure or Hemi-Fontan. Statpearls, Treasure Island, FL (2024).
- Daley, M. D'udekem, Y. The optimal Fontan operation: Lateral tunnel or extracardiac conduit? J Thorac Cardiovasc Surg. 162 (6), 1825-1834 (2021).
- Jalal, Z. et al. Role and applications of experimental animal models of Fontan circulation. J Clin Med. 13 (9), 2601 (2024).
- Al Balushi, A. Mackie, A. S. Protein-losing enteropathy following Fontan palliation. Can J Cardiol. 35 (12), 1857-1860 (2019).
- Emamaullee, J. et al. Fontan-associated liver disease: Screening, management, and transplant considerations. Circulation. 142 (6), 591-604 (2020).
- Mazza, G. A., Gribaudo, E., Agnoletti, G. The pathophysiology and complications of Fontan circulation. Acta Biomed. 92 (5), e2021260 (2021).
- Schwartz, I., Mccracken, C. E., Petit, C. J., Sachdeva, R. Late outcomes after the Fontan procedure in patients with single ventricle: A meta-analysis. Heart. 104 (18), 1508-1514 (2018).
- Zafar, F. et al. Long-term kidney function after the Fontan operation: Jacc review topic of the week. J Am Coll Cardiol. 76 (3), 334-341 (2020).
- Van Puyvelde, J. et al. Creation of the Fontan circulation in sheep: A survival model. Interact Cardiovasc Thorac Surg. 29 (1), 15-21 (2019).
- Cysyk, J. et al. Chronic in vivo test of a right heart replacement blood pump for failed Fontan circulation. ASAIO J. 65 (6), 593-600 (2019).
- Cysyk, J. P. et al. Miniaturized Fontan circulation assist device: Chronic in vivo evaluation. ASAIO J. 67 (11), 1240--1249 (2021).
- D'udekem, Y. et al. Validating the concept of mechanical circulatory support with a rotary blood pump in the inferior vena cava in an ovine Fontan model. Bioengineering (Basel). 11 (6), 594 (2024).
- Granegger, M. et al. Feasibility of an animal model for cavopulmonary support with a double-outflow pump. ASAIO J. 69 (7), 673-680 (2023).
- Wei, X. et al. Mechanical circulatory support of a univentricular Fontan circulation with a continuous axial-flow pump in a piglet model. ASAIO J. 61 (2), 196-201 (2015).
- Zhu, J. et al. Cavopulmonary support with a microaxial pump for the failing Fontan physiology. ASAIO J. 61 (1), 49-54 (2015).
- Kelly, J. M. et al. Investigation of a chronic single-stage sheep Fontan model. JTCVS Open. 21, 268-278 (2024).
- Anderson, N. H. et al. Telemetry for cardiovascular monitoring in a pharmacological study: New approaches to data analysis. Hypertension. 33 (1 Pt 2), 248-255 (1999).
- Kearney, K., Appleby, C., Kieper, J., Atterson, P. Comparative analysis of data sciences international PhysioTel™ D70 and PhysioTel™ digital telemetry platforms. J Pharmacol Toxicol Methods. 81, 364-365 (2016).
- Physiotel digital l series. At <https://www.datasci.com/products/implantable-telemetry/large-animal/physiotel-digital-l > (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon