Method Article
Ultrassom focalizado guiado por ressonância magnética em tempo real para metástases ósseas dolorosas
Neste Artigo
Resumo
A ressonância magnética pode oferecer monitoramento em tempo real da posição e temperatura do ultrassom focalizado na ablação térmica para metástases ósseas dolorosas, independentemente do tipo de câncer ou tratamentos locais anteriores. Nosso método inovador de garantia de qualidade pode facilitar a aplicação desse tratamento eficaz e seguro.
Resumo
Os ossos são um dos locais mais comuns de metástase do câncer, que geralmente causa dor e prejudica a qualidade de vida. A radioterapia combinada com opioides é o tratamento padrão para metástases ósseas dolorosas. Este tratamento alcança um controle eficaz da dor em 60-74% dos pacientes, mas opções limitadas de tratamento com benefícios limitados estão disponíveis para metástases ósseas dolorosas recorrentes ou residuais após a radioterapia. Mais de 40% dos pacientes ainda sentem dor óssea moderada a intensa após a reirradiação. O ultrassom focalizado guiado por ressonância magnética (MRgFUS) combina ultrassom focalizado de alta intensidade, que alcança a ablação térmica de metástases ósseas e subsequente redução da dor, com termometria de ressonância magnética (RM) em tempo real para monitorar a temperatura das imagens anatômicas de RM, com precisão de 1 °C, resolução espacial de 1 mm e resolução temporal em 3 s. Além de ser cada vez mais utilizado clinicamente para o controle da dor óssea metastática, o uso do MRgFUS para outras doenças também tem sido testado. No entanto, o uso do software de RM como termômetro é a única técnica disponível para verificar a precisão do software e garantir o fornecimento de energia. Aqui, descrevemos um método eficiente de garantia de qualidade que desenvolvemos para detecção térmica e fornecimento de energia antes de cada tratamento com MRgFUS e também propomos um fluxo de trabalho modificado para agilizar o curso do tratamento, bem como para reduzir a dor dos pacientes durante o procedimento.
Introdução
Os ossos são um dos locais mais comuns de metástase do câncer, que geralmente causa dor e prejudica a qualidade de vida. A radioterapia (RT) combinada com opioides é o tratamento padrão para metástases ósseas dolorosas. Este tratamento alcança um controle eficaz da dor em 60-74% dos pacientes1. No entanto, opções limitadas de tratamento estão disponíveis para dor óssea metastática recorrente ou residual após RT. Reirradiação, intervenção cirúrgica, crioablação percutânea ou ablação por radiofrequência e doses aumentadas de opioides e analgésicos sistêmicos são opções com indicações limitadas e geralmente com efeitos colaterais. Além disso, esses tratamentos secundários produziram resultados insatisfatórios: mais de 40% dos pacientes continuam a sentir dor óssea moderada a intensa após a reirradiação2.
Os sistemas de ultrassom focalizado de alta intensidade integram ultrassons de vários ângulos em um ponto, transferindo energia acústica a temperaturas ablativas de mais de 65 °C3. Essa técnica não invasiva tem sido utilizada para ablação térmica em vários locais e para vários tipos de lesões 4,5. Geralmente, os sistemas de ultrassom focalizado geram energia acústica nas frequências de 200 kHz-4 MHz 6,7, produzindo uma intensidade no ponto focal da ordem de 100-10.000 W/cm2. Nesses níveis de energia, os feixes de ultrassom focalizados desencadeiam um aumento na temperatura da célula sobre o volume de tecido tratado. O aumento da temperatura varia de acordo com o coeficiente de absorção tecidual, previsto pela análise de Arrhenius ou pela relação dose térmica do isoefeito de Sapareto-Dewey. Para obter um melhor controle e um aumento de temperatura mais rápido, volumes focais de 0,2 a 5 mm3 são sugeridos para cada sonicação. Portanto, a ablação de áreas maiores requer ladrilhos de múltiplas sonicações para cobrir um grande volume e criar danos térmicos homogêneos. Além de causar danos como resultado de efeitos térmicos, o ultrassom focalizado também cria microbolhas devido a fatores físicos, como difusão retificada na área tratada. Quando o tamanho das microbolhas atinge um ponto de corte, elas eventualmente implodem, causando ondas de microchoque e afetando os tecidos circundantes. Esse efeito não térmico paralelo também contribui para a lesão tecidual e necrose tumoral.
Ao contrário de outras técnicas de orientação por imagem, como imagens de ultrassom, a ressonância magnética (RM) fornece uma imagem tridimensional da anatomia com imagens de resolução clara de tecidos moles e monitoramento quantitativo da temperatura. O software de mapeamento da termometria quantitativa de RM pode calcular a mudança térmica em graus Celsius e, em seguida, sobrepor as respectivas localizações às imagens anatômicas de RM8. Ao detectar a mudança de frequência de ressonância de prótons no hidrogênio da água, que corresponde a aproximadamente 0,01 ppm por grau Celsius, a sequência de RM sensível à temperatura pode controlar a deposição de energia, com uma precisão de 1 °C para medição de mudanças térmicas, uma resolução espacial de 1 mm e uma resolução temporal dentro de 3 s 9,10. Com esse software estendido, o dispositivo de RM pode fornecer imagens de diagnóstico e também detectar alterações térmicas em segundos, mapeando-as nas imagens anatômicas durante todo o curso de tratamento. Apesar do desenvolvimento de uma técnica tão inovadora, poucos artigos descrevem a segurança qualitativa durante cada curso de tratamento. Aqui pretendemos compartilhar nosso protocolo e experiências com o MRgFUS.
Protocolo
A aprovação do Conselho de Revisão Institucional Conjunta da Universidade Médica de Taipei foi obtida para este estudo.
NOTA: O mesmo protocolo, validado em Kao et al.11, foi utilizado para tratar 138 casos entre 2015 e 2019. Os critérios de inclusão para a inclusão no tratamento foram: 1) a presença de uma metástase óssea dolorosa solitária distinguível; 2) não administração de terapia local prévia à lesão óssea alvo; e 3) a capacidade de acessar a lesão óssea alvo com MRgFUS (Tabela de Materiais). Pacientes com fraturas patológicas iminentes foram excluídos. Materiais e dispositivos detalhados estão listados na Tabela de Materiais.
1. Consulta de pré-tratamento e simulação de tomografia computadorizada para local de tratamento
- Avaliação dos pacientes com indicação de MRgFUS
- Avalie a adequação do paciente para MRgFUS no tratamento da dor óssea metastática. Explique o procedimento e as informações relacionadas ao paciente e à família. Registre a medicação analgésica diária e o escore de dor antes e depois da medicação.
- Peça a um oncologista de radiação e radiologista para localizar a lesão e a anatomia próxima com base em tomografia computadorizada (TC) ou ressonância magnética (RM) pré-tratamento.
NOTA: A metástase espinhal é excluída devido a uma possível lesão na medula espinhal ou na cauda equina. As lesões no tronco devem ser tratadas dorsalmente e não ventralmente, a fim de evitar lesões nos principais vasos e órgãos.
- Confirme o local de tratamento por simulação de TC 1 dia antes do MRgFUS.
- Posicione o paciente em decúbito dorsal e com a cabeça no sofá e realize uma tomografia computadorizada helicoidal (120 kV, 400 mAs/corte) sobre a área de tratamento com uma espessura de corte de 3 mm. Ajuste e incline a posição do paciente, no centro do sofá, para localizar a lesão.
- Coloque um marcador de TC, fio condutor de 1 cm, na superfície da pele, verticalmente mais próximo da lesão, e realize uma tomografia computadorizada helicoidal (120 kV, 400 mAs/corte) novamente para confirmar a posição do paciente e a localização do marcador de TC. Marque a localização do marcador de TC com uma caneta marcadora e tire uma foto da posição do paciente.
NOTA: A confirmação precisa do local e da posição do tratamento antes do MRgFUS pode facilitar o processo de posicionamento durante o MRgFUS.
2. Preparação do paciente para MRgFUS no dia do tratamento
- Verifique a identidade do paciente de acordo com a identificação com foto. Verifique se o paciente removeu todos os objetos de metal e dispositivos magnéticos antes da varredura.
- Prescreva analgésicos locais e sistêmicos antes do tratamento.
- Às 1 h antes do horário de tratamento programado, aplique o creme de lidocaína na pele marcada, com raio de 10 cm. Retire o creme cuidadosamente 10 minutos antes do tratamento.
- Aos 30 minutos antes do tratamento, gotejar por via intravenosa 5 mg de dexametasona com 50 mL de solução salina normal por 10 min e 30 mg de cetorolaco com 50 mL de solução salina normal por 10 min. Defina a linha intravenosa periférica em qualquer mão, antebraço, perna ou pé no lado oposto à lesão.
- Verifique os sinais vitais do paciente (frequência cardíaca, pressão arterial, frequência respiratória e saturação sanguínea) 5 minutos antes de enviar o paciente para tratamento.
3. Garantia de qualidade diária (DQA) antes do MRgFUS
- Configuração de DQA
- Substitua a mesa de diagnóstico pela mesa MRgFUS por um transdutor de ultrassom focalizado e conecte a mesa ao sistema.
NOTA: A equipe deve remover todos os objetos de metal e dispositivos elétricos, incluindo anéis, relógios, canetas, telefones celulares ou cartões de identificação magnéticos, antes de entrar na sala de ressonância magnética. - Aplique gel de transmissão de ultrassom (~ 1 mm de espessura) e água desgaseificada no painel de superfície do transdutor de ultrassom focado.
NOTA: Tenha cuidado para não arranhar o painel de plástico durante este processo. - Cubra cuidadosamente o painel com uma cortina de plástico, evitando dobras da cortina sobre a área do painel. Adicione água desgaseificada a um nível tão alto quanto a bobina de RM no sofá.
NOTA: Tenha cuidado para não fazer bolhas de gás entre o painel, o gel de transmissão, a cortina e a água desgaseificada. - Lenta e cuidadosamente, coloque a almofada de gel no painel sem criar bolhas de gás durante o processo. Coloque o simulador DQA na almofada de gel sem criar bolhas de gás.
- Coloque a bobina de RM no sofá e conecte a bobina ao dispositivo de ressonância magnética. Pressione Landmark no painel de controle de ressonância magnética e alinhe o laser vermelho com a faixa preta na bobina. Em seguida, pressione Avançado para digitalizar no painel de controle de ressonância magnética.
- Substitua a mesa de diagnóstico pela mesa MRgFUS por um transdutor de ultrassom focalizado e conecte a mesa ao sistema.
- Pré-escaneamento DQA
- Clique em Ocioso no sistema de ressonância magnética para criar uma nova varredura de ressonância magnética. Digite DQA como nome do paciente e digite 50 kg para peso corporal. Escolha Supine e Feet First como parâmetros de digitalização.
- Escolha o protocolo de digitalização como ExAblate - Plan - Bone. Em seguida, clique em Salvar Série | Baixar | Digitalização. Verifique as imagens digitalizadas no monitor para verificar se há bolhas de gás.
NOTA: Se forem encontradas bolhas de gás, configure o DQA mais uma vez para removê-las.
- Procedimento DQA
- Clique em Tumores ósseos no sistema MRgFUS e clique em Calibrar para iniciar o DQA. Clique em RM Scan e confirme se o número do exame é o mesmo do sistema de ressonância magnética.
- Ajuste a posição do transdutor nas imagens axiais e sagitais para permitir que o campo de sonicação cubra o simulador. Clique em Carregar para carregar imagens de ressonância magnética. Em seguida, clique em Curvatura | Selecione Tudo para selecionar todas as imagens. Clique em Machado | Selecione Tudo novamente.
- Clique em Desenhar para definir a área de sonicação. Clique em Linha de pele para contornar a superfície entre o simulador e a almofada de gel. Clique em Copiar para copiar as linhas de pele para todas as fatias sagitais e axiais das imagens. Em seguida, ajuste e confirme se a linha da pele está correta em cada imagem.
- Clique em Área de tratamento para contornar a área de tratamento no simulador para três fatias contínuas. Clique em Protocolo para escolher Bone 15 e, em seguida, clique em Aplicar. Clique em Fiducial e escolha um ponto no fantasma como ponto de referência.
- Planejamento DQA
- Clique em Plano | Verifique para continuar. Clique em Adicionar sonicação para adicionar um ponto para sonicação dentro do fantasma. Confirme se o campo de sonicação está dentro do simulador em cada fatia sagital e axial.
- Defina os parâmetros de varredura: direção = Coronal e fatia numérica = 5 com saída de energia predefinida. Clique em Sonicação para iniciar.
- Calibração
- Após a sonicação, o monitoramento do sistema MRgFUS mostra as imagens de temperatura. Confirme o ponto de aquecimento e clique em Centro para marcar o ponto. Use o mouse para verificar o ponto de aquecimento e outros pontos diferentes para comparar a curva térmica para localizar artefatos ou sinais de fundo.
- O sistema mostra ajustes para a localização do transdutor em milímetros em 3 axiais. Clique em Aceitar e, em seguida, clique em Voltar para realizar a sonicação novamente com um aumento de 20% na energia. Confirme se o2º ajuste está dentro de 1 mm e clique em Rejeitar.
- Defina o parâmetro de varredura: direção = Axial e fatia numérica = 5 com saída de energia predefinida. Faça ajustes axiais conforme descrito nas etapas 3.5.1 e 3.5.2. Clique em Sair para sair do DQA e remover o fantasma.
4. Posicionamento do paciente e varredura da RM do pré-tratamento
- Posicionamento do paciente
- Posicione o paciente na mesa MRgFUS na mesma posição da simulação anterior na etapa 1.2. Alinhe a marca na pele com o centro da almofada de gel.
- Prenda o paciente ao sofá usando um cinto de segurança e ensine-o a usar o botão de emergência. Coloque o oxímetro de pulso de dedo em um dedo indicador.
- Coloque a bobina de RM no sofá e alinhe a bobina. Em seguida, pressione Avançado para digitalizar no painel de controle de ressonância magnética.
- Varredura de RM pré-tratamento
- Crie uma nova ressonância magnética e insira as informações do paciente. Escolha Supine e Feet First como os parâmetros de escaneamento e o protocolo de escaneamento como ExAblate - Plan - Bone.
- Adquira imagens T2 de três planos e clique em Exibir Edição para confirmar a área de digitalização. Clique em Salvar | Baixar | Pré-varredura automática. Confirme a área de digitalização após a pré-digitalização e clique em Digitalizar.
- Confirme a lesão e a posição do paciente.
- Reconfirme a lesão, o campo de varredura de RM e a posição do paciente.
NOTA: O campo de varredura de RM deve estar sobre a área de tratamento e cobrir o transdutor de ultrassom. - Examine quaisquer bolhas de gás entre a superfície da pele e a almofada de gel. Reposicione o paciente se houver bolhas de gás.
- Reconfirme a lesão, o campo de varredura de RM e a posição do paciente.
5. Contorno e planejamento do tratamento
- Importar imagens MR
- Clique em Tumores ósseos no sistema MRgFUS. Clique em Contorno | Ressonância magnética e confirme se o número do exame é o mesmo do sistema de ressonância magnética.
- Clique em Carregar para carregar as imagens de ressonância magnética coletadas na etapa 4.2. Clique em Curvatura | Selecione Tudo. Em seguida, clique em Machado | Selecione Tudo novamente.
- Contorno
- Clique em Desenhar para definir a área de sonicação. Clique em Linha de Pele para contornar a superfície da pele. Clique em Copiar para copiar as linhas de pele para todas as fatias sagitais e axiais das imagens. Ajuste e confirme se a linha da pele está correta em cada imagem.
NOTA: A linha da pele deve ser contornada em cada corte de imagem de RM com o transdutor de ultrassom. - Clique em Osso para contornar a superfície óssea. Clique em Bloquear para contornar órgãos vitais, como nervos, vasos ou intestinos, para evitar a sonicação por essas áreas. Clique em Fiducial e escolha um ponto próximo à lesão como ponto de referência.
- Clique em Desenhar para definir a área de sonicação. Clique em Linha de Pele para contornar a superfície da pele. Clique em Copiar para copiar as linhas de pele para todas as fatias sagitais e axiais das imagens. Ajuste e confirme se a linha da pele está correta em cada imagem.
- Planeamento
- Clique em Plano | Verifique para continuar depois que todo o contorno for concluído. Revise o planejamento do tratamento e ajuste a sonicação, se necessário.
NOTA: O caminho da sonicação deve ser do transdutor até a lesão através da superfície da pele.
- Clique em Plano | Verifique para continuar depois que todo o contorno for concluído. Revise o planejamento do tratamento e ajuste a sonicação, se necessário.
6. Verificação e tratamento
- Analgésicos e sedação
- Aos 10 minutos antes da verificação e tratamento, gotejar por via intravenosa 25 mg de meperidina e 7,5 mg de midazolam com 50 mL de solução salina normal por 10 min.
- Gotejar por via intravenosa 7,5 mg de morfina com 50 mL de solução salina normal por 10 min em um intervalo de 30 min se o paciente se queixar de dor durante o curso do tratamento.
NOTA: Um médico pode ajustar analgésicos e medicação sedativa de acordo com as condições clínicas. - Verifique periodicamente o pulso e o oxímetro entre a sonicação.
NOTA: Se o paciente estiver muito nervoso ou precisar de acompanhamento, uma enfermeira ou membro da equipe pode ficar dentro de casa durante a sonicação. A ressonância magnética e o ultrassom não causam radiação nem danos a outras pessoas próximas.
- Verificação
- Escolha uma sonicação com parâmetros predefinidos e clique em Sonicação para iniciar. Monitore o aumento de temperatura e a curva térmica do ponto de aquecimento, bem como o ponto de referência, para verificar se há artefatos ou sinais de fundo. Aumente a saída de energia e repita a sonicação no mesmo local.
- Repita a sonicação no mesmo local até que a temperatura seja superior a 65 °C para atingir a ablação térmica.
NOTA: Pessoas diferentes com massa corporal diferente, locais diferentes e tecidos diferentes teriam várias absorções de energia e mudanças térmicas. É necessário usar menos energia para verificação.
NOTA: Aquecer repetidamente o mesmo local ou uma área próxima em um curto espaço de tempo pode influenciar a termometria de RM. Portanto, permita que o sistema pause se os intervalos de sonicação estiverem muito próximos.
- Tratamento
- Clique em Sonicação para iniciar o tratamento com a saída de energia verificada descrita na etapa 6.2.
- Monitore o aumento da temperatura e a curva térmica do ponto de aquecimento e repita a sonicação com o aumento da produção de energia até que a temperatura seja superior a 65 °C. Complete toda a sonicação para a área de tratamento.
7. Avaliação pós-tratamento
- Varredura de RM pós-tratamento
- Realize a varredura pós-MRgFUS com todas as séries conforme as etapas 4.2 e 4.3.
- Injete meio de contraste intravenoso a uma taxa de 4−5 mL / s e realize uma ressonância magnética contrastada conforme a etapa 7.1.1.
NOTA: O volume de contraste é baseado no peso corporal (ou seja, 0,2 mL por 1 kg).
- Avalie o efeito do tratamento/térmico da ressonância magnética pós-tratamento. Repita a sonicação se a ablação térmica não tratar toda a lesão.
Resultados
Paciente do sexo masculino, 68 anos, foi diagnosticado com carcinoma hepatocelular (CHC) em outubro de 2012. Ele recebeu uma lobectomia esquerda em 18 de outubro de 2012, e a patologia relatou um CHC de 8,8 cm. Após a operação, ele sentiu dor e dor lombar, e uma ressonância magnética em 2 de novembro de 2012 revelou uma grande massa metastática envolvendo o sacro esquerdo, ílio e tecido mole glúteo. Devido à compressão tumoral e dor atingindo 6 pontos na escala visual analógica (EVA), ele recebeu RT com 45 Gy em 15 frações em novembro de 2012, e terapia sistêmica para CHC metastático também foi prescrita. Seis meses depois, o tumor metastático pélvico progrediu e a dor recidivou, chegando a 7 pontos na EVA. Um segundo RT com 25 Gy em 10 frações em junho de 2013 e um terceiro RT com 25 Gy em 10 frações em novembro de 2013 foram organizados para tratar o tumor em progresso. A dor diminuiu por mais 4 meses, mas depois voltou a aparecer, atingindo 7 pontos na EVA em maio de 2014.
Como a irradiação já havia sido administrada três vezes no mesmo local, o MRgFUS era a única opção de tratamento. Para uma enorme massa pélvica sobre o lado esquerdo da pelve, o tratamento em 27 de maio de 2014 usou nove sonicações de 2987,56 ± 1083,98 J, aquecendo o tumor até 61,78 ± 7,11 °C a cada sonicação de 20 s (Figura 1). Usando o CTCAE versão 4.0, foi observada uma queimadura cutânea de Grau 1 com sintomas mínimos, mas nenhuma intervenção foi necessária. O nível de dor do paciente caiu para 4 pontos na EVA, o que permitiu a redução das dosagens analgésicas por mais de 3 meses.
No entanto, devido à falha da medicação sistêmica, a massa residual progrediu novamente e causou dor moderada a intensa, atingindo intermitentemente 8 pontos na EVA 5 meses após seu primeiro tratamento com MRgFUS. Na ausência de alternativas, o segundo tratamento com MRgFUS (Figura 2) foi agendado em 11 de janeiro de 2015 para a mesma metástase óssea. O plano de tratamento utilizou 5 sonicações com 1638,60 ± 210,67 J, aquecendo o tumor a 64,40 ± 6,31 °C a cada sonicação de 20 s. Nenhum efeito adverso foi observado nesta ocasião. O nível de dor do paciente diminuiu para 4 pontos na EVA em 1 dia, e ele foi mantido continuamente em um nível de <4 pontos na EVA por mais de 3 meses. Ele faleceu 7 meses após o segundo MRgFUS.

Figura 1: Imagem de RM no1º tratamento. (A) A imagem superior esquerda mostra a saturação de gordura T2 antes do tratamento e a imagem superior direita (B) mostra T1 com contraste. A ponta da seta vermelha indica o tumor metastático sobre a articulação sacroilíaca esquerda. A imagem inferior (C) é a imagem de monitoramento durante o tratamento, com o lado esquerdo mostrando o ponto de sonicação atual e o lado direito mostrando a saída de energia e a temperatura do ponto de sonicação. Clique aqui para ver uma versão maior desta figura.
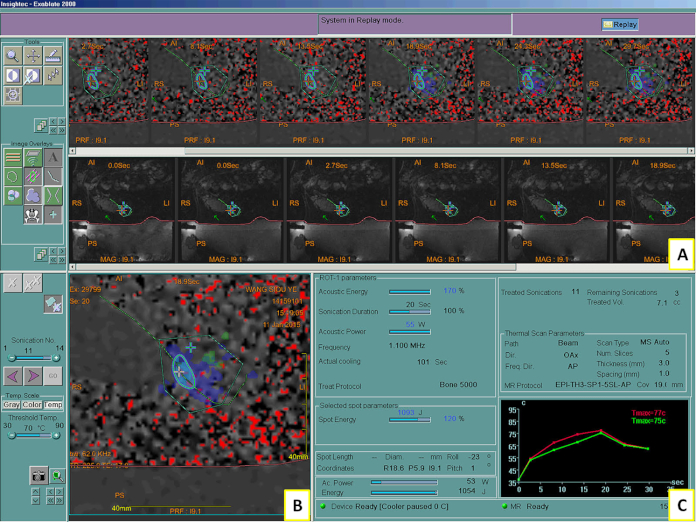
Figura 2: Sistema MRgFUS mostrando no2º tratamento. Tela do sistema mostrando as imagens e controles de RM intraprocedimento (A), o mapa térmico após a sonicação (B) e um gráfico da elevação de temperatura calculada durante a sonicação (C). Tmax = temperatura máxima. Clique aqui para ver uma versão maior desta figura.
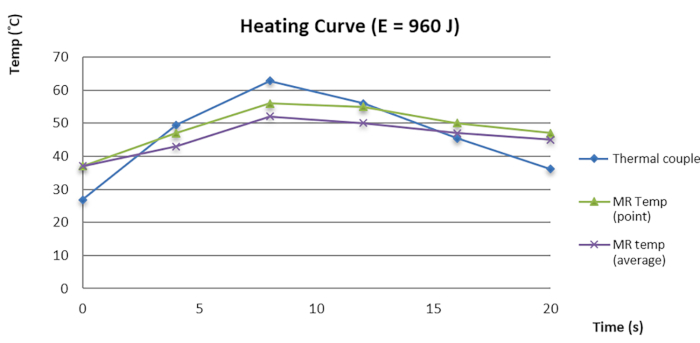
Figura 3: Curva temperatura-tempo da termometria de RM e do par termoelétrico. Clique aqui para ver uma versão maior desta figura.
Discussão
Vários estudos demonstraram que o MRgFUS é seguro e eficiente no controle da dor de metástases ósseas recorrentes ou residuais após TR12,13. Para 64,3-72,0% dos pacientes, a dor óssea metastática persiste após RT e opioides. Estudos também determinaram que o MRgFUS tem toxicidade limitada e um curso de tratamento tolerável.
O MRgFUS recebeu aprovação para uso em dor óssea metastática em 2011 pela Conformité Européenne e em 2012 pela Food and Drug Administration dos EUA. Além de ser cada vez mais utilizado clinicamente no controle da dor óssea metastática, o MRgFUS também tem sido investigado para uso em outras doenças, como câncer de próstata, câncer de mama e tremoressencial9. No entanto, o uso de software de RM como termômetro é a única técnica disponível para verificar a precisão do software e a segurança do dispositivo, que gera um ultrassom focalizado e fornece energia. Portanto, demonstramos um curso de tratamento usando MRgFUS para tratar metástases ósseas e também investigamos um método eficiente de fornecer garantia de qualidade para detecção térmica e fornecimento de energia antes de cada tratamento. Neste artigo, propomos modificações no fluxo de trabalho atualmente preconizado, que com o auxílio da simulação da tomografia computadorizada antes do tratamento, poderiam agilizar o curso do tratamento e também reduzir o sofrimento e a dor do paciente durante o procedimento.
Em nossa investigação interna, descobrimos que o erro de foco (FE) entre o foco de sonicação e o ponto com a temperatura mais alta no simulador foi de 1,73 ± 1,21 mm no axial direito-esquerdo (RL), 0,95 ± 0,82 mm no axial superior-inferior (SI) e 0,31 ± 0,63 nos eixos ântero-posterior (AP) antes da garantia de qualidade dos dados (DQA). Após a DQA, a FE foi significativamente reduzida para 0,43 ± 0,34 no RL axial e 0,11 ± 0,22 no SI axial, com p < 0,01 (teste t pareado). Nossa investigação sugeriu que o DQA melhora o EG em até 1 mm, com intervalo de confiança de 95%, resultando em um FE inferior a 0,5 mm nos eixos SI e AP. Além disso, também verificamos a termometria de RM do MRgFUS com um par termoelétrico compatível com RM (TEC) dentro de um simulador para detectar mudanças térmicas. O resultado sugeriu que a curva térmica e a detecção de temperatura seguiram a mesma tendência (Figura 3). A pequena diferença de temperatura entre a termometria de RM e o TEC contribuiu para a garantia de qualidade. Como o TEC é pequeno e o componente metálico interfere na resolução da imagem, foi difícil contornar a posição exata do TEC. A modificação adicional do TEC no simulador para melhorar o mapeamento e a detecção térmica requer uma investigação mais aprofundada.
Em conclusão, o MRgFUS parece ser um tratamento paliativo eficaz, instantâneo e seguro em pacientes com dor óssea metastática, especialmente para dor recorrente ou residual. A demanda e o uso do tratamento têm crescido rapidamente, mas a garantia de qualidade e as melhorias no fluxo de trabalho do tratamento raramente foram discutidas nos estudos. Aqui, descrevemos nosso procedimento e os resultados do estudo para DQA, indicando o valor do DQA antes de cada tratamento. O uso da simulação de TC antes do MRgFUS pode facilitar o fluxo de trabalho e reduzir o sofrimento e a dor dos pacientes durante o procedimento.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem a Renyi Wang, física médica, por sua ajuda na investigação do DQA.
Materiais
| Name | Company | Catalog Number | Comments |
| 1L degasseed water pouch | InSightec | ASM001480 | for good ultrasound beam transmission |
| CT scan | Philips | Brilliance Big Bore 16 Slice CT, 7387 | Acquire CT images for positioning |
| EXABLATE | InSightec | EXABLATE 2000 | System for non-invasive tumor ablation through Focal Ultrasound (FUS) treatment under Magnetic Resonance (MR) guidance |
| Gel Pad ASSY | InSightec | SET999014 | Transmission gel pad for single Body treatment. |
| MR scan | GE | HDxT | Acquire MR images for contouring and planning |
| MRI contrast | Guerbet | Dotarem | Enhance MR for acquiring images |
| Patient accessory kit | InSightec | SET000016 | clinical applications single use treatment kit |
| Patient plastic drape | InSightec | DTP000067 | Cover the panel of ultrasound transducer. Deposible, hygiene use |
| Pelvic RF coil | GE | ASM000956 | Enhance MR for acquiring images |
| phantom | ATS Labs ATS Labs Inc | Model TxS-100 | for calibration |
| ultrasound transmission gel | InSightec | SET000885 | gel for calibration prior MR-guided FUS treatment |
Referências
- Lutz, S., et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence-Based Guideline. Practical Radiation Oncology. 7 (1), 4-12 (2017).
- Selvaggi, G., Scagliotti, G. V. Management of bone metastases in cancer: a review. Critical Reviews in Oncology/Hematology. 56 (3), 365-378 (2005).
- Simon, C. J., Dupuy, D. E., Mayo-Smith, W. W. Microwave ablation: principles and applications. Radiographics. 25 (Suppl 1), S69-S83 (2005).
- Napoli, A., et al. MR imaging-guided focused ultrasound for treatment of bone metastasis. Radiographics. 33 (6), 1555-1568 (2013).
- Jolesz, F. A., Hynynen, K. Magnetic resonance image-guided focused ultrasound surgery. Cancer Journal. 8, S100-S112 (2002).
- Umemura, S., Kawabata, K., Hashiba, K. Enhancement of ultrasonic absorption by microbubbles for therapeutic application. , (2001).
- Tran, B. C., et al. Microbubble-enhanced cavitation for noninvasive ultrasound surgery. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 50 (10), 1296-1304 (2003).
- Rieke, V., Butts Pauly, K. MR thermometry. Journal of Magnetic Resonance Imaging. 27 (2), 376-390 (2008).
- Poorter, J. D., et al. Noninvasive MRI thermometry with the proton resonance frequency (PRF) method: in vivo results in human muscle. Magnetic Resonance in Medicine. 33 (1), 74-81 (1995).
- Gorny, K. R., et al. MR guided focused ultrasound: technical acceptance measures for a clinical system. Physics in Medicine & Biology. 51 (12), 3155 (2006).
- Kao, Y. T., et al. Position stability analysis of a clinical mri-guided focused ultrasound system: one-year experience. Therapeutic Radiology and Oncology (In Traditional Chinese). 23 (2), 107-114 (2016).
- Bazzocchi, A., et al. MRI-guided focused ultrasound surgery in musculoskeletal diseases: the hot topics. The British Journal of Radiology. 89 (1057), 20150358 (2016).
- Gennaro, N., et al. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiology. 48 (8), 1161-1169 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados