Method Article
Ultrasuoni focalizzati guidati da risonanza magnetica in tempo reale per metastasi ossee dolorose
In questo articolo
Riepilogo
La risonanza magnetica potrebbe offrire il monitoraggio in tempo reale della posizione e della temperatura degli ultrasuoni focalizzati nell'ablazione termica per metastasi ossee dolorose, indipendentemente dal tipo di cancro o da precedenti trattamenti locali. Il nostro metodo innovativo di garanzia della qualità potrebbe facilitare l'applicazione di questo trattamento efficace e sicuro.
Abstract
Le ossa sono uno dei siti più comuni di metastasi tumorali, che di solito causano dolore e compromettono la qualità della vita. La radioterapia combinata con oppioidi è il trattamento standard per le metastasi ossee dolorose. Questo trattamento consente di ottenere un efficace controllo del dolore nel 60-74% dei pazienti, ma sono disponibili scelte terapeutiche limitate con benefici limitati per metastasi ossee dolorose ricorrenti o residue dopo radioterapia. Più del 40% dei pazienti avverte ancora dolore osseo da moderato a grave dopo la reirradiazione. L'ecografia focalizzata guidata da risonanza magnetica (MRgFUS) combina l'ecografia focalizzata ad alta intensità, che consente di ottenere l'ablazione termica delle metastasi ossee e la conseguente riduzione del dolore, con la termometria a risonanza magnetica (RM) in tempo reale per monitorare la temperatura delle immagini RM anatomiche, con una precisione di 1 °C, una risoluzione spaziale di 1 mm e una risoluzione temporale entro 3 s. Oltre ad essere sempre più utilizzato clinicamente per il controllo del dolore osseo metastatico, è stato testato anche l'uso di MRgFUS per altre malattie. Tuttavia, l'uso del software RM come termometro è l'unica tecnica disponibile per verificare l'accuratezza del software e garantire l'erogazione di energia. In questo articolo, descriviamo un metodo efficiente di garanzia della qualità che abbiamo sviluppato per la rilevazione termica e l'erogazione di energia prima di ogni trattamento MRgFUS e proponiamo anche un flusso di lavoro modificato per accelerare il corso del trattamento e ridurre il dolore dei pazienti durante la procedura.
Introduzione
Le ossa sono uno dei siti più comuni di metastasi tumorali, che di solito causano dolore e compromettono la qualità della vita. La radioterapia (RT) combinata con oppioidi è il trattamento standard per le metastasi ossee dolorose. Questo trattamento consente di ottenere un efficace controllo del dolore nel 60-74% dei pazienti1. Tuttavia, sono disponibili scelte terapeutiche limitate per il dolore osseo metastatico ricorrente o residuo dopo RT. La reirradiazione, l'intervento chirurgico, la crioablazione percutanea o l'ablazione con radiofrequenza e l'aumento delle dosi di oppioidi sistemici e analgesici sono opzioni con indicazioni limitate e di solito con effetti collaterali. Inoltre, questi trattamenti secondari hanno dato risultati insoddisfacenti: oltre il 40% dei pazienti continua a manifestare dolore osseo da moderato a grave dopo la reirradiazione2.
I sistemi a ultrasuoni focalizzati ad alta intensità integrano gli ultrasuoni da più angolazioni in un unico punto, trasferendo energia acustica a temperature ablative superiori a 65 °C3. Questa tecnica non invasiva è stata utilizzata per la termoablazione in vari siti e per vari tipi di lesioni 4,5. Generalmente, i sistemi ad ultrasuoni focalizzati generano energia acustica a frequenze di 200 kHz-4 MHz 6,7, producendo un'intensità nel punto focale dell'ordine di 100-10.000 W/cm2. A questi livelli di energia, i fasci di ultrasuoni focalizzati innescano un aumento della temperatura cellulare rispetto al volume di tessuto trattato. L'aumento della temperatura varia in base al coefficiente di assorbimento tissutale, previsto utilizzando l'analisi di Arrhenius o la relazione di dose termica isoeffetto di Sapareto-Dewey. Per ottenere un migliore controllo e un aumento più rapido della temperatura, si consigliano volumi focali di 0,2-5 mm3 per ogni sonicazione. Pertanto, l'ablazione di aree più grandi richiede l'affiancamento di più sonicazioni per coprire un grande volume e creare un danno termico omogeneo. Oltre a causare danni a causa degli effetti termici, gli ultrasuoni focalizzati creano anche microbolle a causa di fattori fisici come la diffusione rettificata nell'area trattata. Quando la dimensione delle microbolle raggiunge un limite, alla fine implodono, causando onde microd'urto e colpendo i tessuti circostanti. Questo effetto parallelo non termico contribuisce anche al danno tissutale e alla necrosi tumorale.
A differenza di altre tecniche di guida delle immagini, come l'imaging a ultrasuoni, la risonanza magnetica (RM) fornisce un'immagine tridimensionale dell'anatomia con immagini a risoluzione chiara dei tessuti molli e monitoraggio quantitativo della temperatura. Il software di mappatura della termometria RM quantitativa è in grado di calcolare la variazione termica in gradi Celsius e quindi di sovrapporre le rispettive posizioni alle immagini RM anatomiche8. Rilevando lo spostamento della frequenza di risonanza protonica nell'idrogeno dell'acqua, che corrisponde a circa 0,01 ppm per grado Celsius, la sequenza RM sensibile alla temperatura può controllare la deposizione di energia, con una precisione di 1 °C per la misurazione delle variazioni termiche, una risoluzione spaziale di 1 mm e una risoluzione temporale entro 3 s 9,10. Con questo software esteso, il dispositivo RM è in grado di fornire immagini diagnostiche e di rilevare le variazioni termiche in pochi secondi, mappandole sulle immagini anatomiche durante l'intero ciclo di trattamento. Nonostante lo sviluppo di una tecnica così innovativa, pochi articoli descrivono la sicurezza qualitativa durante ogni ciclo di trattamento. Qui miriamo a condividere il nostro protocollo e le nostre esperienze con MRgFUS.
Protocollo
Per questo studio è stata ottenuta l'approvazione del Comitato di revisione istituzionale congiunta della Taipei Medical University.
NOTA: Lo stesso protocollo, convalidato in Kao et al.11, è stato utilizzato per trattare 138 casi tra il 2015 e il 2019. I criteri di inclusione per l'arruolamento nel trattamento erano 1) la presenza di metastasi ossee dolorose distinguibili solitarie; 2) mancata somministrazione di precedente terapia locale alla lesione ossea mirata; e 3) la capacità di accedere alla lesione ossea mirata con MRgFUS (Table of Materials). Sono stati esclusi i pazienti con fratture patologiche imminenti. I materiali e i dispositivi dettagliati sono elencati nella Tabella dei materiali.
1. Consultazione pretrattamento e simulazione TC per il punto di trattamento
- Valutazione dei pazienti indicati per MRgFUS
- Valutare l'idoneità del paziente per MRgFUS nel trattamento del dolore osseo metastatico. Spiegare la procedura e le relative informazioni al paziente e alla famiglia. Registra quotidianamente i farmaci analgesici e il punteggio del dolore prima e dopo il trattamento.
- Chiedi a un oncologo radioterapista e a un radiologo di localizzare la lesione e l'anatomia vicina in base alla tomografia computerizzata (TC) o alla risonanza magnetica (MRI) pretrattamento.
NOTA: Le metastasi spinali sono escluse a causa di possibili lesioni al midollo spinale o alla cauda equina. Le lesioni nel tronco devono essere trattate dorsalmente piuttosto che ventralmente al fine di prevenire lesioni ai vasi e agli organi principali.
- Confermare il punto di trattamento mediante simulazione TC 1 giorno prima della MRgFUS.
- Posizionare il paziente in posizione supina, con la testa in avanti, sul lettino ed eseguire una TAC elicoidale (120 kV, 400 mAs/fetta) sull'area da trattare con uno spessore della fetta di 3 mm. Regolare e inclinare la posizione del paziente, al centro del lettino, per localizzare la lesione.
- Posizionare un marcatore TC, filo conduttore di 1 cm, sulla superficie cutanea, verticalmente più vicino alla lesione, ed eseguire nuovamente una TAC elicoidale (120 kV, 400 mAs/fet) per confermare la posizione del paziente e la posizione del marcatore TC. Segna la posizione del marcatore CT con un pennarello e scatta una foto della posizione del paziente.
NOTA: La conferma precisa del punto di trattamento e della posizione prima della MRgFUS può facilitare il processo di posizionamento durante la MRgFUS.
2. Preparazione del paziente per MRgFUS il giorno del trattamento
- Verificare l'identità del paziente in base a un documento d'identità con foto. Verificare che il paziente abbia rimosso tutti gli oggetti metallici e i dispositivi magnetici prima della scansione.
- Prescrivere analgesici locali e sistemici prima del trattamento.
- A 1 ora prima dell'orario di trattamento programmato, applicare la crema alla lidocaina sulla pelle segnata, con un raggio di 10 cm. Rimuovere la crema con cura 10 minuti prima del trattamento.
- A 30 minuti prima del trattamento, gocciolare per via endovenosa 5 mg di desametasone con 50 ml di soluzione fisiologica normale per 10 minuti e 30 mg di ketorolac con 50 ml di soluzione fisiologica normale per 10 minuti. Posizionare la linea endovenosa periferica su una mano, un avambraccio, una gamba o un piede sul lato opposto alla lesione.
- Controllare i segni vitali del paziente (frequenza cardiaca, pressione sanguigna, frequenza respiratoria e saturazione del sangue) 5 minuti prima di inviare il paziente per il trattamento.
3. Garanzia di qualità giornaliera (DQA) prima di MRgFUS
- Configurazione DQA
- Sostituire il lettino diagnostico con il lettino MRgFUS con un trasduttore a ultrasuoni focalizzato e collegare il lettino al sistema.
NOTA: Il personale deve rimuovere tutti gli oggetti metallici e i dispositivi elettrici, inclusi anelli, orologi, penne, telefoni cellulari o tessere magnetiche, prima di entrare nella sala di risonanza magnetica. - Applicare il gel di trasmissione degli ultrasuoni (spessore ~1 mm) e l'acqua degassata sul pannello superficiale del trasduttore a ultrasuoni focalizzato.
NOTA: Fare attenzione a non graffiare il pannello di plastica durante questo processo. - Coprire accuratamente il pannello con un telo di plastica, evitando pieghe del telo sull'area del pannello. Aggiungere acqua degassata a un livello alto quanto la serpentina MR sul divano.
NOTA: Fare attenzione a non formare bolle di gas tra il pannello, il gel di trasmissione, il telo e l'acqua degassata. - Posizionare lentamente e con attenzione il cuscinetto in gel sul pannello senza creare bolle di gas durante il processo. Posizionare il phantom DQA sul cuscinetto in gel senza creare bolle di gas.
- Posizionare la bobina MR sul divano e collegare la bobina al dispositivo MRI. Premere Landmark sul pannello di controllo della risonanza magnetica e allineare il laser rosso alla striscia nera sulla bobina. Quindi, premere Avanzate per eseguire la scansione sul pannello di controllo della risonanza magnetica.
- Sostituire il lettino diagnostico con il lettino MRgFUS con un trasduttore a ultrasuoni focalizzato e collegare il lettino al sistema.
- Scansione preliminare DQA
- Fare clic su Inattivo nel sistema di risonanza magnetica per creare una nuova scansione RM. Inserire DQA come nome del paziente e inserire 50 kg per il peso corporeo. Selezionate Supine e Feet First come parametri di scansione.
- Scegli il protocollo di scansione come ExAblate - Plan - Bone. Quindi fare clic su Salva serie | Scarica | Scansione. Controllare le immagini di scansione sul monitor per verificare la presenza di eventuali bolle di gas.
NOTA: Se vengono rilevate bolle di gas, impostare nuovamente il DQA per rimuoverle.
- Procedura DQA
- Fare clic su Tumori ossei nel sistema MRgFUS e fare clic su Calibra per avviare il DQA. Fare clic su Scansione RM e verificare che il numero dell'esame sia lo stesso del sistema MRI.
- Regolare la posizione del trasduttore nelle immagini assiali e sagittali in modo che il campo sonico copra il fantoccio. Fare clic su Carica per caricare le immagini MRI. Quindi fare clic su Abbassa | Seleziona Tutto per selezionare tutte le immagini. Fare clic su Ascia | Selezionare di nuovo Tutto.
- Fare clic su Disegna per definire l'area di sonicazione. Fare clic su Linea pelle (Skin Line ) per contornare la superficie tra il phantom e il cuscinetto in gel. Fare clic su Copia per copiare le linee della pelle in tutte le sezioni sagittali e assiali delle immagini. Quindi regola e verifica che la linea della pelle sia corretta in ogni immagine.
- Fare clic su Area di trattamento per contornare l'area da trattare nel fantoccio per tre sezioni continue. Fare clic su Protocollo per scegliere Bone 15 , quindi fare clic su Applica. Fare clic su Fiducial e scegliere un punto nel fantasma come punto di riferimento.
- Pianificazione DQA
- Fai clic su Piano | Verifica per procedere. Fare clic su Aggiungi sonicazione per aggiungere un punto per la sonicazione all'interno del fantasma. Verificare che il campo di sonicazione si trovi all'interno del fantoccio in ogni fetta sagittale e assiale.
- Impostare i parametri di scansione: direzione = coronale e fetta numerica = 5 con uscita di energia preimpostata. Fare clic su Sonicazione per iniziare.
- Taratura
- Dopo la sonicazione, il monitoraggio del sistema MRgFUS mostra le immagini della temperatura. Conferma il punto di riscaldamento e fai clic su Centro per contrassegnare il punto. Usa il mouse per controllare il punto di riscaldamento e altri punti diversi per confrontare la curva termica e individuare artefatti o segnali di fondo.
- Il sistema mostra le regolazioni per la posizione del trasduttore in millimetri in 3 assiali. Fare clic su Accetta, quindi su Indietro per eseguire nuovamente la sonicazione con un aumento del 20% dell'energia. Verificare che la 2aregolazione sia entro 1 mm e fare clic su Rifiuta.
- Impostare il parametro di scansione: direzione = Assiale e numero fetta = 5 con uscita di energia preimpostata. Effettuare le regolazioni assiali come descritto nei passaggi 3.5.1 e 3.5.2. Fare clic su Esci per uscire da DQA e rimuovere l'immagine fantasma.
4. Posizionamento del paziente e scansione RM pretrattamento
- Posizionamento del paziente
- Posizionare il paziente sul lettino MRgFUS nella stessa posizione della simulazione precedente al punto 1.2. Allineare il segno sulla pelle con il centro del cuscinetto in gel.
- Fissare il paziente al lettino utilizzando una cintura di sicurezza e insegnare al paziente come utilizzare il pulsante di emergenza. Posizionare il pulsossimetro da dito su un dito indice.
- Posizionare la bobina MR sul divano e allineare la bobina. Quindi premere Avanzate per eseguire la scansione sul pannello di controllo della risonanza magnetica.
- Scansione RM pretrattamento
- Creare una nuova scansione RM e inserire le informazioni del paziente. Scegliere Supine e Feet First come parametri di scansione e il protocollo di scansione come ExAblate - Plan - Bone.
- Acquisire immagini T2 a tre piani, quindi fare clic su Visualizza modifica per confermare l'area di scansione. Fai clic su Salva | Scarica | Prescansione automatica. Confermare l'area di scansione dopo la prescansione, quindi fare clic su Scansione.
- Confermare la lesione e la posizione del paziente.
- Riconfermare la lesione, il campo di scansione RM e la posizione del paziente.
NOTA: Il campo di scansione RM deve essere sopra l'area da trattare e coprire il trasduttore a ultrasuoni. - Esaminare eventuali bolle di gas tra la superficie della pelle e il cuscinetto in gel. Riposizionare il paziente se sono presenti bolle di gas.
- Riconfermare la lesione, il campo di scansione RM e la posizione del paziente.
5. Contorno e pianificazione del trattamento
- Importa immagini MR
- Fare clic su Tumori ossei sul sistema MRgFUS. Fare clic su Contouring | Scansione RM e conferma che il numero dell'esame è lo stesso del sistema MRI.
- Fare clic su Carica per caricare le immagini MRI raccolte nel passaggio 4.2. Fare clic su Abbassamento | Seleziona Tutto. Quindi fare clic su Ascia | Selezionare di nuovo Tutto.
- Contornatura
- Fare clic su Disegna per definire l'area di sonicazione. Fare clic su Linea pelle (Skin Line ) per contornare la superficie della pelle. Fare clic su Copia per copiare le linee della pelle in tutte le sezioni sagittale e assiale delle immagini. Regola e verifica che la linea della pelle sia corretta in ogni immagine.
NOTA: La linea cutanea deve essere sagomata su ciascuna fetta di immagine RM con il trasduttore a ultrasuoni. - Fare clic su Osso per contornare la superficie dell'osso. Fare clic su Blocca per modellare gli organi vitali, come nervi, vasi o intestini, per prevenire la sonicazione attraverso queste aree. Fare clic su Fiducial e scegliere un punto vicino alla lesione come punto di riferimento.
- Fare clic su Disegna per definire l'area di sonicazione. Fare clic su Linea pelle (Skin Line ) per contornare la superficie della pelle. Fare clic su Copia per copiare le linee della pelle in tutte le sezioni sagittale e assiale delle immagini. Regola e verifica che la linea della pelle sia corretta in ogni immagine.
- Pianificazione
- Fai clic su Piano | Verificare di procedere dopo che tutto il contorno è stato completato. Rivedere la pianificazione del trattamento e, se necessario, regolare la sonicazione.
NOTA: La via di sonicazione deve essere dal trasduttore alla lesione attraverso la superficie della pelle.
- Fai clic su Piano | Verificare di procedere dopo che tutto il contorno è stato completato. Rivedere la pianificazione del trattamento e, se necessario, regolare la sonicazione.
6. Verifica e trattamento
- Analgesici e sedativi
- A 10 minuti prima della verifica e del trattamento, gocciolare per via endovenosa 25 mg di meperidina e 7,5 mg di midazolam con 50 ml di soluzione fisiologica normale per 10 minuti.
- Flebo per via endovenosa 7,5 mg di morfina con 50 ml di soluzione fisiologica normale per 10 minuti a un intervallo di 30 minuti se il paziente lamenta dolore durante il corso del trattamento.
NOTA: Un medico può regolare gli analgesici e i farmaci sedativi in base alle condizioni cliniche. - Controllare periodicamente il polso e l'ossimetro tra una sonicazione e l'altra.
NOTA: Se il paziente è molto nervoso o necessita di accompagnamento, un infermiere o un membro del personale può rimanere all'interno durante la sonicazione. La risonanza magnetica e gli ultrasuoni non causano radiazioni né danni ad altro personale nelle vicinanze.
- Verifica
- Scegli una sonicazione con parametri preimpostati e fai clic su Sonicazione per iniziare. Monitora l'aumento della temperatura e la curva termica del punto di riscaldamento, nonché del punto di riferimento per verificare la presenza di artefatti o segnali di fondo. Aumenta la produzione di energia e ripeti la sonicazione nello stesso punto.
- Ripetere la sonicazione nello stesso punto fino a quando la temperatura non supera i 65 °C per raggiungere l'ablazione termica.
NOTA: Persone diverse con massa corporea diversa, posizioni diverse e tessuti diversi avrebbero assorbimenti di energia e cambiamenti termici diversi. È necessario utilizzare meno energia per la verifica.
NOTA: Il riscaldamento ripetuto dello stesso punto o di un'area vicina in breve tempo può influenzare la termometria RM. Pertanto, lasciare che il sistema si fermi se gli intervalli di sonicazione sono troppo ravvicinati.
- Trattamento
- Fare clic su Sonicazione per iniziare il trattamento con l'energia verificata descritta al punto 6.2.
- Monitorare l'aumento della temperatura e la curva termica del punto di riscaldamento e ripetere la sonicazione con l'aumentare dell'energia fino a quando la temperatura non supera i 65 °C. Completa tutta la sonicazione per l'area da trattare.
7. Valutazione post-trattamento
- Scansione RM post-trattamento
- Eseguire la scansione post-MRgFUS con tutte le serie come nei passaggi 4.2 e 4.3.
- Iniettare il mezzo di contrasto per via endovenosa a una velocità di 4-5 mL/s ed eseguire una risonanza magnetica con contrasto come al passaggio 7.1.1.
NOTA: Il volume del contrasto si basa sul peso corporeo (ad esempio, 0,2 ml per 1 kg).
- Valutare il trattamento/l'effetto termico della risonanza magnetica post-trattamento. Ripetere la sonicazione se la termoablazione non tratta l'intera lesione.
Risultati
A un paziente di sesso maschile di 68 anni è stato diagnosticato un carcinoma epatocellulare (HCC) nell'ottobre 2012. Ha ricevuto una lobectomia sinistra il 18 ottobre 2012 e la patologia ha riportato un HCC di 8,8 cm. Dopo l'operazione, ha avvertito dolore lombare e indolenzimento e una risonanza magnetica il 2 novembre 2012 ha rivelato una grande massa metastatica che coinvolge l'osso sacro sinistro, l'ileo e i tessuti molli glutei. A causa della compressione del tumore e del dolore che raggiungeva i 6 punti sulla scala analogica visiva (VAS), ha ricevuto RT con 45 Gy in 15 frazioni nel novembre 2012 ed è stata prescritta anche una terapia sistemica per l'HCC metastatico. Sei mesi dopo, il tumore metastatico pelvico è progredito e il dolore si è ripresentato, raggiungendo i 7 punti sul VAS. Un secondo RT con 25 Gy in 10 frazioni nel giugno 2013 e un terzo RT con 25 Gy in 10 frazioni nel novembre 2013 sono stati organizzati per trattare il tumore in progressione. Il dolore si è attenuato per altri 4 mesi ma poi si è ripresentato, raggiungendo i 7 punti sulla VAS nel maggio 2014.
Poiché l'irradiazione era stata precedentemente somministrata tre volte nella stessa posizione, la MRgFUS era l'unica opzione di trattamento. Per un'enorme massa pelvica sul lato sinistro del bacino, il trattamento del 27 maggio 2014 ha utilizzato nove sonicazioni di 2987,56 ± 1083,98 J, riscaldando il tumore fino a 61,78 ± 7,11 °C in ogni sonicazione di 20 s (Figura 1). Utilizzando CTCAE versione 4.0, è stata notata un'ustione cutanea di grado 1 con sintomi minimi, ma non è stato richiesto alcun intervento. Il livello di dolore del paziente è sceso a 4 punti sul VAS, il che ha permesso di ridurre i dosaggi analgesici per oltre 3 mesi.
Tuttavia, a causa del fallimento della medicazione sistemica, la massa residua è progredita di nuovo e ha causato dolore da moderato a grave, raggiungendo in modo intermittente 8 punti sulla VAS 5 mesi dopo il suo primo trattamento MRgFUS. In assenza di alternative, l'11 gennaio 2015 è stato organizzato il secondo trattamento MRgFUS (Figura 2) per le stesse metastasi ossee. Il piano di trattamento ha utilizzato 5 sonicazioni con 1638,60 ± 210,67 J, riscaldando il tumore a 64,40 ± 6,31 °C in ogni sonicazione di 20 secondi. In questa occasione non sono stati osservati effetti avversi. Il livello di dolore del paziente è diminuito a 4 punti sulla VAS entro 1 giorno ed è stato mantenuto continuamente a un livello di <4 punti sulla VAS per oltre 3 mesi. È morto 7 mesi dopo il secondo MRgFUS.

Figura 1: Immagine RM nel 1° trattamento. (A) L'immagine in alto a sinistra mostra la saturazione di grasso T2 prima del trattamento e l'immagine in alto a destra (B) mostra T1 con contrasto. La punta della freccia rossa indica il tumore metastatico sopra l'articolazione sacroiliaca sinistra. L'immagine inferiore (C) è l'immagine di monitoraggio durante il trattamento, con il lato sinistro che mostra il punto di sonicazione corrente e il lato destro che mostra l'energia e la temperatura del punto di sonicazione. Clicca qui per visualizzare una versione più grande di questa figura.
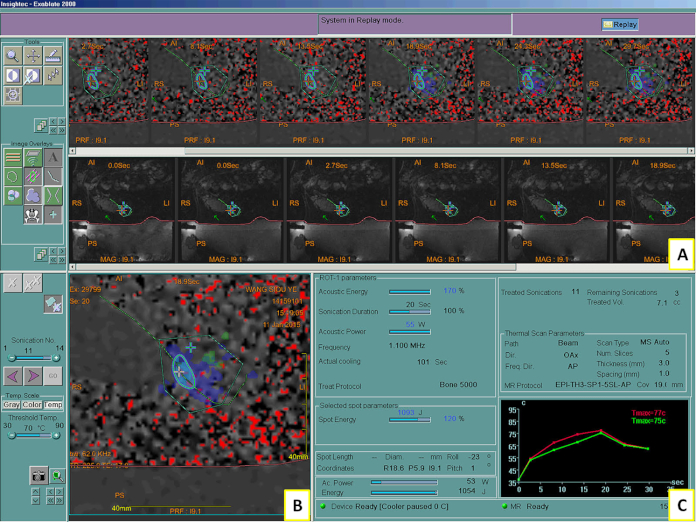
Figura 2: Sistema MRgFUS visibile nel 2° trattamento. Schermata del sistema che mostra le immagini e i controlli RM intraprocedurali (A), la mappa termica dopo la sonicazione (B) e un grafico dell'aumento della temperatura calcolato durante la sonicazione (C). Tmax = temperatura massima. Clicca qui per visualizzare una versione più grande di questa figura.
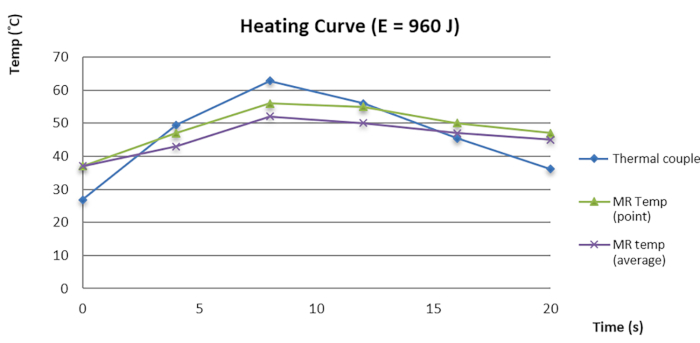
Figura 3: Curva temperatura-tempo della termometria RM e della coppia termoelettrica. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Diversi studi hanno dimostrato che la MRgFUS è sicura ed efficace per il controllo del dolore da metastasi ossee ricorrenti o residue dopo RT12,13. Per il 64,3-72,0% dei pazienti, il dolore osseo metastatico persiste dopo RT e oppioidi. Gli studi hanno anche determinato che la MRgFUS ha una tossicità limitata e un ciclo di trattamento tollerabile.
MRgFUS ha ricevuto l'approvazione per l'uso nel dolore osseo metastatico nel 2011 dalla Conformité Européenne e nel 2012 dalla Food and Drug Administration degli Stati Uniti. Oltre ad essere sempre più utilizzato clinicamente per il controllo del dolore osseo metastatico, la MRgFUS è stata studiata anche per l'uso in altre malattie, come il cancro alla prostata, il cancro al seno e il tremore essenziale9. Tuttavia, l'uso del software RM come termometro è l'unica tecnica disponibile per verificare l'accuratezza del software e la sicurezza del dispositivo, che genera un ecografo focalizzato ed eroga energia. Pertanto, abbiamo dimostrato un ciclo di trattamento che utilizza MRgFUS per trattare le metastasi ossee e abbiamo anche studiato un metodo efficiente per fornire garanzia di qualità per il rilevamento termico e l'erogazione di energia prima di ogni trattamento. In questo articolo, proponiamo modifiche al flusso di lavoro attualmente raccomandato, che con l'aiuto della simulazione della tomografia computerizzata prima del trattamento, potrebbero accelerare il corso del trattamento e anche ridurre la sofferenza e il dolore del paziente durante la procedura.
Nella nostra indagine interna, abbiamo riscontrato che l'errore di messa a fuoco (FE) tra il fuoco di sonicazione e il punto con la temperatura più alta nel fantoccio era di 1,73 ± 1,21 mm nell'assiale destra-sinistra (RL), di 0,95 ± 0,82 mm nell'assiale superiore-inferiore (SI) e di 0,31 ± 0,63 negli assi antero-posteriore (AP) prima della garanzia della qualità dei dati (DQA). Dopo DQA, FE è stato significativamente ridotto a 0,43 ± 0,34 nell'assiale RL e 0,11 ± 0,22 nell'assiale SI, con p < 0,01 (test della coppia t). La nostra indagine ha suggerito che la DQA migliora l'FE fino a 1 mm, con un intervallo di confidenza del 95%, risultando in un FE inferiore a 0,5 mm negli assi SI e AP. Inoltre, abbiamo anche verificato la termometria RM di MRgFUS con una coppia termoelettrica (TEC) compatibile con la risonanza magnetica all'interno di un fantoccio per rilevare le variazioni termiche. Il risultato ha suggerito che la curva termica e il rilevamento della temperatura hanno seguito la stessa tendenza (Figura 3). La piccola differenza di temperatura tra la termometria RM e la TEC ha contribuito alla garanzia della qualità. Poiché il TEC è piccolo e la componente metallica interferisce con la risoluzione dell'immagine, è stato difficile contornare la posizione esatta del TEC. Ulteriori modifiche del TEC nel fantoccio per migliorare la mappatura termica e il rilevamento richiedono ulteriori indagini.
In conclusione, la MRgFUS sembra essere un trattamento palliativo efficace, istantaneo e sicuro nei pazienti con dolore osseo metastatico, in particolare per il dolore ricorrente o residuo. La domanda e l'uso del trattamento sono cresciuti rapidamente, ma la garanzia della qualità e i miglioramenti del flusso di lavoro del trattamento sono stati raramente discussi negli studi. Qui, descriviamo la nostra procedura e i risultati dello studio per DQA, indicando il valore di DQA prima di ogni trattamento. L'utilizzo della simulazione TC prima della MRgFUS potrebbe facilitare il flusso di lavoro e ridurre la sofferenza e il dolore dei pazienti durante la procedura.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Renyi Wang, fisico medico, per il suo aiuto nello studio della DQA.
Materiali
| Name | Company | Catalog Number | Comments |
| 1L degasseed water pouch | InSightec | ASM001480 | for good ultrasound beam transmission |
| CT scan | Philips | Brilliance Big Bore 16 Slice CT, 7387 | Acquire CT images for positioning |
| EXABLATE | InSightec | EXABLATE 2000 | System for non-invasive tumor ablation through Focal Ultrasound (FUS) treatment under Magnetic Resonance (MR) guidance |
| Gel Pad ASSY | InSightec | SET999014 | Transmission gel pad for single Body treatment. |
| MR scan | GE | HDxT | Acquire MR images for contouring and planning |
| MRI contrast | Guerbet | Dotarem | Enhance MR for acquiring images |
| Patient accessory kit | InSightec | SET000016 | clinical applications single use treatment kit |
| Patient plastic drape | InSightec | DTP000067 | Cover the panel of ultrasound transducer. Deposible, hygiene use |
| Pelvic RF coil | GE | ASM000956 | Enhance MR for acquiring images |
| phantom | ATS Labs ATS Labs Inc | Model TxS-100 | for calibration |
| ultrasound transmission gel | InSightec | SET000885 | gel for calibration prior MR-guided FUS treatment |
Riferimenti
- Lutz, S., et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence-Based Guideline. Practical Radiation Oncology. 7 (1), 4-12 (2017).
- Selvaggi, G., Scagliotti, G. V. Management of bone metastases in cancer: a review. Critical Reviews in Oncology/Hematology. 56 (3), 365-378 (2005).
- Simon, C. J., Dupuy, D. E., Mayo-Smith, W. W. Microwave ablation: principles and applications. Radiographics. 25 (Suppl 1), S69-S83 (2005).
- Napoli, A., et al. MR imaging-guided focused ultrasound for treatment of bone metastasis. Radiographics. 33 (6), 1555-1568 (2013).
- Jolesz, F. A., Hynynen, K. Magnetic resonance image-guided focused ultrasound surgery. Cancer Journal. 8, S100-S112 (2002).
- Umemura, S., Kawabata, K., Hashiba, K. Enhancement of ultrasonic absorption by microbubbles for therapeutic application. IEEE Ultrasonics Symposium, , (2001).
- Tran, B. C., et al. Microbubble-enhanced cavitation for noninvasive ultrasound surgery. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 50 (10), 1296-1304 (2003).
- Rieke, V., Butts Pauly, K. MR thermometry. Journal of Magnetic Resonance Imaging. 27 (2), 376-390 (2008).
- Poorter, J. D., et al. Noninvasive MRI thermometry with the proton resonance frequency (PRF) method: in vivo results in human muscle. Magnetic Resonance in Medicine. 33 (1), 74-81 (1995).
- Gorny, K. R., et al. MR guided focused ultrasound: technical acceptance measures for a clinical system. Physics in Medicine & Biology. 51 (12), 3155(2006).
- Kao, Y. T., et al. Position stability analysis of a clinical mri-guided focused ultrasound system: one-year experience. Therapeutic Radiology and Oncology (In Traditional Chinese). 23 (2), 107-114 (2016).
- Bazzocchi, A., et al. MRI-guided focused ultrasound surgery in musculoskeletal diseases: the hot topics. The British Journal of Radiology. 89 (1057), 20150358(2016).
- Gennaro, N., et al. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiology. 48 (8), 1161-1169 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon