Method Article
الموجات فوق الصوتية المركزة الموجهة بالرنين المغناطيسي في الوقت الحقيقي لنقائل العظام المؤلمة
In This Article
Summary
يمكن أن يوفر الرنين المغناطيسي مراقبة في الوقت الفعلي لموضع ودرجة حرارة الموجات فوق الصوتية المركزة في الاستئصال الحراري لنقائل العظام المؤلمة ، بغض النظر عن نوع السرطان أو العلاجات المحلية السابقة. يمكن لطريقتنا المبتكرة لضمان الجودة أن تسهل تطبيق هذا العلاج الفعال والآمن.
Abstract
العظام هي واحدة من أكثر المواقع شيوعا للورم الخبيث السرطاني ، والتي عادة ما تسبب الألم وتضعف نوعية الحياة. العلاج الإشعاعي جنبا إلى جنب مع المواد الأفيونية هو العلاج القياسي لنقائل العظام المؤلمة. يحقق هذا العلاج تحكما فعالا في الألم في 60-74٪ من المرضى ، ولكن تتوفر خيارات علاجية محدودة ذات فوائد محدودة لنقائل العظام المؤلمة المتكررة أو المتبقية بعد العلاج الإشعاعي. لا يزال أكثر من 40٪ من المرضى يعانون من آلام متوسطة إلى شديدة في العظام بعد إعادة التشعيع. تجمع الموجات فوق الصوتية المركزة الموجهة بالرنين المغناطيسي (MRgFUS) بين الموجات فوق الصوتية المركزة عالية الكثافة ، والتي تحقق الاستئصال الحراري لنقائل العظام وتقليل الألم اللاحق ، مع قياس الحرارة بالرنين المغناطيسي في الوقت الفعلي (MR) لمراقبة درجة حرارة صور التصوير بالرنين المغناطيسي التشريحي ، بدقة 1 درجة مئوية ، والدقة المكانية 1 مم ، والدقة الزمنية في غضون 3 ثوان. بالإضافة إلى استخدامه بشكل متزايد سريريا للسيطرة على آلام العظام النقيلية ، تم أيضا اختبار استخدام MRgFUS لأمراض أخرى. ومع ذلك ، فإن استخدام برنامج MR كمقياس حرارة هو التقنية الوحيدة المتاحة للتحقق من دقة البرنامج وضمان توصيل الطاقة. هنا ، نصف طريقة فعالة لضمان الجودة طورناها للكشف الحراري وتوصيل الطاقة قبل كل علاج MRgFUS ونقترح أيضا سير عمل معدل لتسريع مسار العلاج وكذلك لتقليل آلام المرضى أثناء العملية.
Introduction
العظام هي واحدة من أكثر المواقع شيوعا للورم الخبيث السرطاني ، والتي عادة ما تسبب الألم وتضعف نوعية الحياة. العلاج الإشعاعي (RT) جنبا إلى جنب مع المواد الأفيونية هو العلاج القياسي لنقائل العظام المؤلمة. يحقق هذا العلاج السيطرة الفعالة على الألم في 60-74٪ من المرضى1. ومع ذلك ، تتوفر خيارات علاجية محدودة لألم العظام النقيلي المتكرر أو المتبقي بعد RT. إعادة التشعيع ، أو التدخل الجراحي ، أو الاستئصال بالتبريد عن طريق الجلد ، أو الاستئصال بالترددات الراديوية والجرعات المتزايدة من المواد الأفيونية الجهازية والمسكنات هي خيارات ذات مؤشرات محدودة وعادة ما تكون لها آثار جانبية. علاوة على ذلك ، أسفرت هذه العلاجات الثانوية عن نتائج غير مرضية: لا يزال أكثر من 40٪ من المرضى يعانون من آلام متوسطة إلى شديدة في العظام بعد إعادة التشعيع2.
تدمج أنظمة الموجات فوق الصوتية المركزة عالية الكثافة الموجات فوق الصوتية من زوايا متعددة في بقعة واحدة ، وتنقل الطاقة الصوتية عند درجات حرارة استئصالية تزيد عن 65 درجة مئوية3. تم استخدام هذه التقنية غير الغازية للاستئصال الحراري في مواقع مختلفة ولأنواع مختلفة من الآفات4،5. بشكل عام ، تولد أنظمة الموجات فوق الصوتية المركزة طاقة صوتية بترددات 200 كيلو هرتز -4 ميجاهرتز 6,7 ، مما ينتج عنه شدة في النقطة المحورية في حدود 100-10,000 واط / سم2. عند مستويات الطاقة هذه ، تؤدي أشعة الموجات فوق الصوتية المركزة إلى ارتفاع درجة حرارة الخلية على حجم الأنسجة المعالجة. يختلف ارتفاع درجة الحرارة وفقا لمعامل امتصاص الأنسجة ، المتوقع باستخدام تحليل Arrhenius أو علاقة الجرعة الحرارية ذات التأثير الإسوي Sapareto-Dewey. لتحقيق تحكم أفضل وزيادة أسرع في درجة الحرارة ، يقترح أحجام بؤرية من 0.2-5 مم3 لكل صوتنة. لذلك ، فإن استئصال المساحات الأكبر يتطلب تبليط صوتنة متعددة لتغطية حجم كبير وخلق ضرر حراري متجانس. بالإضافة إلى التسبب في ضرر نتيجة للتأثيرات الحرارية ، فإن الموجات فوق الصوتية المركزة تخلق أيضا فقاعات دقيقة بسبب عوامل فيزيائية مثل الانتشار المصحح في المنطقة المعالجة. عندما يصل حجم الفقاعات الدقيقة إلى نقطة انقطاع ، فإنها تنفجر في النهاية ، مما يتسبب في موجات الصدمات الدقيقة ويؤثر على الأنسجة المحيطة. يساهم هذا التأثير غير الحراري الموازي أيضا في إصابة الأنسجة ونخر الورم.
على عكس تقنيات توجيه الصور الأخرى ، مثل التصوير بالموجات فوق الصوتية ، يوفر التصوير بالرنين المغناطيسي (MR) صورة ثلاثية الأبعاد للتشريح مع صور واضحة الدقة للأنسجة الرخوة ومراقبة درجة الحرارة الكمية. يمكن لبرنامج رسم الخرائط لقياس الحرارة الكمي بالرنين المغناطيسي حساب التغير الحراري بالدرجات المئوية ثم تركيب المواقع المعنية على صور التصوير بالرنين المغناطيسي التشريحية8. من خلال الكشف عن تحول تردد رنين البروتون في هيدروجين الماء ، والذي يتوافق مع حوالي 0.01 جزء في المليون لكل درجة مئوية ، يمكن لتسلسل MR الحساس لدرجة الحرارة التحكم في ترسب الطاقة ، بدقة 1 درجة مئوية لقياس التغيرات الحرارية ، والدقة المكانية 1 مم ، والدقة الزمنية في حدود 3 ثانية 9,10. باستخدام هذا البرنامج الموسع ، يمكن لجهاز التصوير بالرنين المغناطيسي توفير صور تشخيصية وأيضا اكتشاف التغيرات الحرارية في غضون ثوان ، وتعيينها على الصور التشريحية خلال دورة العلاج بأكملها. على الرغم من تطوير مثل هذه التقنية المبتكرة ، إلا أن القليل من المقالات تصف الأمن النوعي خلال كل دورة علاجية. نهدف هنا إلى مشاركة بروتوكولنا وخبراتنا مع MRgFUS.
Protocol
تم الحصول على موافقة مجلس المراجعة المؤسسية المشترك لجامعة تايبيه الطبية لهذه الدراسة.
ملاحظة: تم استخدام نفس البروتوكول ، الذي تم التحقق من صحته في Kao et al.11 ، لعلاج 138 حالة بين عامي 2015 و 2019. كانت معايير الإدراج للتسجيل في العلاج هي 1) وجود ورم خبيث عظامي مؤلم منفرد يمكن تمييزه. 2) عدم إعطاء علاج موضعي سابق لآفة العظام المستهدفة ؛ و 3) القدرة على الوصول إلى آفة العظام المستهدفة باستخدام MRgFUS (جدول المواد). تم استبعاد المرضى الذين يعانون من كسور مرضية وشيكة. يتم سرد المواد والأجهزة التفصيلية في جدول المواد.
1. استشارة المعالجة المسبقة ومحاكاة التصوير المقطعي المحوسب لبقعة العلاج
- تقييم المرضى الذين تم تحديد إصابتهم ب MRgFUS
- تقييم مدى ملاءمة المريض ل MRgFUS في علاج آلام العظام النقيلية. اشرح الإجراء والمعلومات ذات الصلة للمريض وعائلته. سجل الأدوية المسكنة اليومية ودرجة الألم قبل الدواء وبعده.
- اطلب من أخصائي علاج الأورام بالإشعاع وأخصائي الأشعة تحديد موقع الآفة والتشريح القريب بناء على التصوير المقطعي المحوسب قبل المعالجة (CT) أو التصوير بالرنين المغناطيسي (MRI).
ملاحظة: يتم استبعاد ورم خبيث في العمود الفقري بسبب إصابة محتملة في الحبل الشوكي أو ذيل الفرس. يجب معالجة الآفات في الجذع ظهريا بدلا من البطني من أجل منع إصابة الأوعية والأعضاء الرئيسية.
- تأكد من بقعة العلاج عن طريق محاكاة التصوير المقطعي المحوسب قبل يوم واحد من MRgFUS.
- ضع المريض في وضع ضعيف ، رأسه أولا على الأريكة وقم بإجراء التصوير المقطعي المحوسب الحلزوني (120 كيلو فولت ، 400 مللي أمبير / شريحة) فوق منطقة العلاج بسمك شريحة 3 مم. اضبط وضع المريض وقم بإمالته ، في وسط الأريكة ، لتحديد موقع الآفة.
- ضع علامة التصوير المقطعي المحوسب، سلك الرصاص بطول 1 سم، على سطح الجلد، الأقرب عموديا إلى الآفة، وقم بإجراء فحص حلزوني بالأشعة المقطعية (120 كيلو فولت، 400 مللي أمبير/شريحة) مرة أخرى لتأكيد موضع المريض وموقع علامة التصوير المقطعي المحوسب. حدد موقع علامة التصوير المقطعي المحوسب بقلم تحديد والتقط صورة لوضع المريض.
ملاحظة: يمكن أن يؤدي التأكيد الدقيق لمكان العلاج والموضع قبل MRgFUS إلى تسهيل عملية تحديد المواقع أثناء MRgFUS.
2. تحضير المريض ل MRgFUS في يوم العلاج
- التحقق من هوية المريض وفقا لبطاقة الهوية التي تحمل صورة فوتوغية. التحقق من أن المريض أزال جميع الأجسام المعدنية والأجهزة المغناطيسية قبل الفحص.
- وصف المسكنات الموضعية والجهازية قبل العلاج.
- قبل ساعة واحدة من موعد العلاج المحدد ، ضع كريم الليدوكائين على الجلد المحدد ، بنصف قطر 10 سم. قم بإزالة الكريم بعناية قبل 10 دقائق من العلاج.
- قبل العلاج بمقدار 30 دقيقة ، قم بالتنقيط عن طريق الوريد 5 ملغ من ديكساميثازون مع 50 مل من المحلول الملحي العادي لمدة 10 دقائق و 30 مجم من الكيتورولاك مع 50 مل من المحلول الملحي العادي لمدة 10 دقائق. ضع الخط الوريدي المحيطي على أي من اليد أو الساعد أو الساق أو القدم على الجانب المقابل للآفة.
- فحص العلامات الحيوية للمريض (معدل ضربات القلب وضغط الدم ومعدل التنفس وتشبع الدم) قبل 5 دقائق من إرسال المريض للعلاج.
3. ضمان الجودة اليومية (DQA) قبل MRgFUS
- إعداد DQA
- استبدل الأريكة التشخيصية بأريكة MRgFUS بمحول طاقة مركز بالموجات فوق الصوتية وقم بتوصيل الأريكة بالنظام.
ملاحظة: يجب على الموظفين إزالة جميع الأجسام المعدنية والأجهزة الكهربائية ، بما في ذلك الخواتم أو الساعات أو الأقلام أو الهواتف المحمولة أو بطاقات الهوية الممغنطة ، قبل دخول غرفة التصوير بالرنين المغناطيسي. - ضع جل نقل الموجات فوق الصوتية (~ 1 مم) والماء منزوع الغازات على اللوحة السطحية لمحول الطاقة بالموجات فوق الصوتية المركزة.
ملاحظة: احرص على عدم خدش اللوحة البلاستيكية أثناء هذه العملية. - قم بتغطية اللوحة بعناية بستارة بلاستيكية ، وتجنب أي طيات للستارة فوق منطقة اللوحة. أضف الماء منزوع الغاز إلى مستوى مرتفع مثل ملف MR على الأريكة.
ملاحظة: احرص على عدم عمل أي فقاعات غاز بين اللوحة وهلام ناقل الحركة والستارة والمياه المنزوعة. - ضع وسادة الجل ببطء وحذر على اللوحة دون تكوين أي فقاعات غاز أثناء العملية. ضع فانتوم DQA على وسادة الجل دون تكوين أي فقاعات غاز.
- ضع ملف MR على الأريكة وقم بتوصيل الملف بجهاز التصوير بالرنين المغناطيسي. اضغط على لاندمارك على لوحة تحكم التصوير بالرنين المغناطيسي وقم بمحاذاة الليزر الأحمر مع الشريط الأسود الموجود على الملف. ثم اضغط على خيارات متقدمة للمسح الضوئي على لوحة تحكم التصوير بالرنين المغناطيسي.
- استبدل الأريكة التشخيصية بأريكة MRgFUS بمحول طاقة مركز بالموجات فوق الصوتية وقم بتوصيل الأريكة بالنظام.
- DQA prescan
- انقر فوق Idle على نظام التصوير بالرنين المغناطيسي لإنشاء فحص MRI جديد. أدخل DQA كاسم المريض وأدخل 50 كجم لوزن الجسم. اختر Supine and Feet First كمعلمات المسح.
- اختر بروتوكول المسح الضوئي ك ExAblate - Plan - Bone. ثم انقر على حفظ السلسلة | تحميل | مسح. تحقق من مسح الصور على الشاشة للتحقق من وجود أي فقاعات غاز.
ملاحظة: إذا تم العثور على أي فقاعات غاز ، فقم بإعداد DQA مرة أخرى لإزالتها.
- إجراء DQA
- انقر فوق أورام العظام على نظام MRgFUS وانقر فوق معايرة لبدء DQA. انقر فوق MR Scan وتأكد من أن رقم الاختبار هو نفسه الموجود في نظام التصوير بالرنين المغناطيسي.
- اضبط موضع محول الطاقة في الصور المحورية والسهمية للسماح لمجال الصوتنة بتغطية الشبح. انقر فوق تحميل لتحميل صور التصوير بالرنين المغناطيسي. ثم انقر فوق الترسام | حدد الكل لتحديد كل الصور. انقر فوق الفأس | حدد الكل مرة أخرى.
- انقر فوق رسم لتحديد منطقة الصوتنة. انقر فوق خط الجلد لتحديد السطح بين وسادة الشبح والجل. انقر فوق نسخ لنسخ خطوط الجلد إلى جميع الشرائح السهمية والمحورية للصور. ثم اضبط وتأكد من صحة خط الجلد في كل صورة.
- انقر فوق منطقة المعالجة لتحديد منطقة المعالجة في الشبح لثلاث شرائح متواصلة. انقر فوق بروتوكول لاختيار Bone 15 ثم انقر فوق Apply. انقر فوق Fiducial واختر بقعة في الشبح كنقطة مرجعية.
- تخطيط DQA
- انقر فوق خطة | تحقق للمتابعة. انقر فوق إضافة صوتنة لإضافة بقعة واحدة للصوتنة داخل الشبح. تأكد من أن مجال الصوتنة يقع داخل الشبح في كل شريحة سهمية ومحورية.
- اضبط معلمات المسح: الاتجاه = الشريعة الإكليلية والرقم = 5 مع خرج طاقة محدد مسبقا. انقر فوق Sonication للبدء.
- المعايره
- بعد الصوتنة ، تظهر مراقبة نظام MRgFUS صور درجة الحرارة. قم بتأكيد بقعة التسخين وانقر فوق المركز لتحديد البقعة. استخدم الماوس للتحقق من بقعة التسخين وغيرها من النقاط المختلفة لمقارنة المنحنى الحراري لتحديد موقع القطع الأثرية أو إشارات الخلفية.
- يعرض النظام تعديلات لموقع محول الطاقة بالمليمترات في 3 محاور. انقر فوق قبول ثم انقر فوق رجوع لإجراء صوتنة مرة أخرى مع زيادة الطاقة بنسبة 20٪. تأكد منأن الضبط الثاني في حدود 1 مم وانقر فوق رفض.
- تعيين معلمة المسح: الاتجاه = الشريحة المحورية والرقمية = 5 مع خرج طاقة محدد مسبقا. قم بإجراء تعديلات محورية كما هو موضح في الخطوتين 3.5.1 و 3.5.2. انقر فوق خروج لمغادرة DQA وإزالة الشبح.
4. وضع المريض والعلاج المسبق التصوير بالرنين المغناطيسي
- وضع المريض
- ضع المريض على أريكة MRgFUS في نفس وضع المحاكاة السابقة في الخطوة 1.2. قم بمحاذاة العلامة على الجلد مع مركز وسادة الجل.
- قم بتأمين المريض على الأريكة باستخدام حزام الأمان وعلم المريض كيفية استخدام زر الطوارئ. اضبط مقياس التأكسج النبضي بالإصبع على إصبع سبابة واحد.
- ضع ملف MR على الأريكة وقم بمحاذاة الملف. ثم اضغط على خيارات متقدمة للمسح الضوئي على لوحة تحكم التصوير بالرنين المغناطيسي.
- المسح بالرنين المغناطيسي للمعالجة المسبقة
- قم بإنشاء فحص التصوير بالرنين المغناطيسي الجديد وأدخل معلومات المريض. اختر الاستلقاء والقدمين أولا كمعلمات المسح وبروتوكول المسح مثل ExAblate - Plan - Bone.
- احصل على صور T2 ثلاثية المستويات، ثم انقر فوق عرض تحرير لتأكيد منطقة المسح. انقر فوق حفظ | تحميل | المسح المسبق التلقائي. قم بتأكيد منطقة المسح بعد المسح المسبق ثم انقر فوق مسح.
- تأكد من وضع الآفة والمريض.
- أعد تأكيد الآفة ومجال المسح بالرنين المغناطيسي ووضع المريض.
ملاحظة: يجب أن يكون مجال المسح بالرنين المغناطيسي فوق منطقة العلاج ويغطي محول الطاقة بالموجات فوق الصوتية. - افحص أي فقاعات غاز بين سطح الجلد ووسادة الجل. أعد وضع المريض في حالة وجود أي فقاعات غاز.
- أعد تأكيد الآفة ومجال المسح بالرنين المغناطيسي ووضع المريض.
5. تحديد العلاج والتخطيط
- استيراد صور التصوير بالرنين المغناطيسي
- انقر فوق أورام العظام في نظام MRgFUS. انقر على الكنتور | مسح التصوير بالرنين المغناطيسي والتأكد من أن رقم الفحص هو نفسه كما هو في نظام التصوير بالرنين المغناطيسي.
- انقر فوق تحميل لتحميل صور التصوير بالرنين المغناطيسي التي تم جمعها في الخطوة 4.2. انقر فوق الترهل | حدد الكل. ثم انقر فوق الفأس | حدد الكل مرة أخرى.
- الكنتوري
- انقر فوق رسم لتحديد منطقة الصوتنة. انقر فوق خط الجلد لتحديد سطح الجلد. انقر فوق نسخ لنسخ خطوط الجلد إلى جميع الشرائح السهمية والمحورية للصور. اضبط وتأكد من صحة خط الجلد في كل صورة.
ملاحظة: يجب تحديد خط الجلد على كل شريحة صورة بالرنين المغناطيسي باستخدام محول الطاقة بالموجات فوق الصوتية. - انقر فوق Bone لتحديد سطح العظام. انقر فوق كتلة لتحديد الأعضاء الحيوية ، مثل الأعصاب أو الأوعية الدموية أو الأمعاء ، لمنع صوتنة من خلال هذه المناطق. انقر فوق Fiducial واختر بقعة بالقرب من الآفة كنقطة مرجعية.
- انقر فوق رسم لتحديد منطقة الصوتنة. انقر فوق خط الجلد لتحديد سطح الجلد. انقر فوق نسخ لنسخ خطوط الجلد إلى جميع الشرائح السهمية والمحورية للصور. اضبط وتأكد من صحة خط الجلد في كل صورة.
- تخطيط
- انقر فوق خطة | تحقق من المتابعة بعد اكتمال جميع عمليات الكنتور. مراجعة تخطيط العلاج وضبط صوتنة إذا لزم الأمر.
ملاحظة: يجب أن يكون مسار الصوتنة من محول الطاقة إلى الآفة عبر سطح الجلد.
- انقر فوق خطة | تحقق من المتابعة بعد اكتمال جميع عمليات الكنتور. مراجعة تخطيط العلاج وضبط صوتنة إذا لزم الأمر.
6. التحقق والعلاج
- المسكنات والتخدير
- قبل 10 دقائق من التحقق والعلاج ، قم بالتنقيط عن طريق الوريد 25 مجم من الميبيريدين و 7.5 مجم من الميدازولام مع 50 مل من المحلول الملحي العادي لمدة 10 دقائق.
- قم بالتنقيط عن طريق الوريد 7.5 مجم من المورفين مع 50 مل من المحلول الملحي العادي لمدة 10 دقائق بفاصل 30 دقيقة إذا اشتكى المريض من الألم أثناء دورة العلاج.
ملاحظة: قد يقوم الطبيب بتعديل المسكنات وأدوية التخدير وفقا للظروف السريرية. - تحقق بشكل دوري من النبض ومقياس التأكسج بين الصوتنة.
ملاحظة: إذا كان المريض متوترا جدا أو يحتاج إلى مرافقة ، فقد تبقى ممرضة أو موظف في الداخل أثناء الصوتنة. لا يسبب التصوير بالرنين المغناطيسي والموجات فوق الصوتية الإشعاع أو الإضرار بالموظفين الآخرين القريبين.
- التحقق
- اختر صوتنة واحدة مع معلمات محددة مسبقا وانقر فوق Sonication للبدء. راقب ارتفاع درجة الحرارة والمنحنى الحراري لبقعة التسخين بالإضافة إلى البقعة المرجعية للتحقق من القطع الأثرية أو إشارات الخلفية. زيادة إنتاج الطاقة وتكرار صوتنة إلى نفس المكان.
- كرر صوتنة إلى نفس المكان حتى تصل درجة الحرارة إلى أكثر من 65 درجة مئوية للوصول إلى الاستئصال الحراري.
ملاحظة: الأشخاص المختلفون الذين لديهم كتلة جسم مختلفة ومواقع مختلفة وأنسجة مختلفة لديهم امتصاص مختلف للطاقة والتغيرات الحرارية. من الضروري استخدام طاقة أقل للتحقق.
ملاحظة: قد يؤثر التسخين المتكرر لنفس المكان أو منطقة قريبة في وقت قصير على قياس الحرارة بالرنين المغناطيسي. لذلك ، اسمح للنظام بالتوقف مؤقتا إذا كانت فترات الصوتنة قريبة جدا.
- العلاج
- انقر فوق Sonication لبدء العلاج بإخراج الطاقة الذي تم التحقق منه الموضح في الخطوة 6.2.
- راقب ارتفاع درجة الحرارة والمنحنى الحراري لبقعة التسخين وكرر الصوتنة مع زيادة إنتاج الطاقة حتى تزيد درجة الحرارة عن 65 درجة مئوية. أكمل جميع الصوتنة لمنطقة العلاج.
7. تقييم ما بعد العلاج
- مسح التصوير بالرنين المغناطيسي بعد العلاج
- إجراء مسح ضوئي بعد MRgFUS مع جميع السلاسل كما في الخطوتين 4.2 و 4.3.
- حقن وسط تباين وريدي بمعدل 4-5 مللي / ثانية وإجراء مسح بالرنين المغناطيسي المتباين كخطوة 7.1.1.
ملاحظة: يعتمد حجم التباين على وزن الجسم (أي 0.2 مل لكل 1 كجم).
- تقييم العلاج / التأثير الحراري من التصوير بالرنين المغناطيسي بعد العلاج. كرر الصوتنة إذا كان الاستئصال الحراري لا يعالج الآفة بأكملها.
النتائج
تم تشخيص مريض يبلغ من العمر 68 عاما بسرطان الخلايا الكبدية (HCC) في أكتوبر 2012. خضع لعملية استئصال الفص الأيسر في 18 أكتوبر 2012 ، وأبلغ علم الأمراض عن سرطان الكبد 8.8 سم. بعد العملية ، عانى من آلام ووجع في أسفل الظهر ، وكشف التصوير بالرنين المغناطيسي في 2 نوفمبر 2012 عن كتلة نقيلية كبيرة تشمل العجز الأيسر والحرقفة والأنسجة الرخوة الألوية. بسبب ضغط الورم والألم الذي وصل إلى 6 نقاط على المقياس التناظري البصري (VAS) ، تلقى RT مع 45 Gy في 15 جزءا في نوفمبر 2012 ، كما تم وصف العلاج الجهازي لسرطان الكبد النقيلي. بعد ستة أشهر ، تقدم الورم النقيلي في الحوض وتكرر الألم ، ليصل إلى 7 نقاط في VAS. تم ترتيب RT ثان مع 25 Gy في 10 كسور في يونيو 2013 و RT ثالث مع 25 Gy في 10 كسور في نوفمبر 2013 لعلاج الورم المتطور هدأ الألم لمدة 4 أشهر أخرى ولكنه تكرر بعد ذلك ، ليصل إلى 7 نقاط في VAS في مايو 2014.
نظرا لأن التشعيع قد تم إعطاؤه سابقا ثلاث مرات في نفس الموقع ، كان MRgFUS هو خيار العلاج الوحيد. بالنسبة لكتلة الحوض الضخمة على الجانب الأيسر من الحوض ، استخدم العلاج في 27 مايو 2014 تسعة صوتنة من 2987.56 ± 1083.98 جول ، مما أدى إلى تسخين الورم حتى 61.78 ± 7.11 درجة مئوية في كل صوتنة 20 ثانية (الشكل 1). باستخدام CTCAE الإصدار 4.0 ، لوحظ حروق جلدية من الدرجة 1 مع الحد الأدنى من الأعراض ، ولكن لم تكن هناك حاجة للتدخل. انخفض مستوى ألم المريض إلى 4 نقاط على VAS ، مما سمح بتقليل جرعات المسكنات لأكثر من 3 أشهر.
ومع ذلك ، بسبب فشل الدواء الجهازي ، تقدمت الكتلة المتبقية مرة أخرى وتسببت في ألم معتدل إلى شديد ، ووصلت بشكل متقطع إلى 8 نقاط على VAS بعد 5 أشهر من أول علاج له MRgFUS. في حالة عدم وجود بدائل ، تم ترتيب العلاج الثاني MRgFUS (الشكل 2) في 11 يناير 2015 لنفس ورم خبيث في العظام. استخدمت خطة العلاج 5 صوتنة مع 1638.60 ± 210.67 جول, تسخين الورم إلى 64.40 ± 6.31 درجة مئوية في كل 20 ثانية صوتنة. لم يلاحظ أي تأثير سلبي في هذه المناسبة. انخفض مستوى ألم المريض إلى 4 نقاط على VAS في غضون يوم واحد ، وتم الحفاظ عليه بشكل مستمر عند مستوى <4 نقاط على VAS لأكثر من 3 أشهر. توفي بعد 7 أشهر من MRgFUS الثاني.

الشكل 1: صورة التصوير بالرنين المغناطيسي في العلاج 1. (أ) تظهر الصورة العلوية اليسرى تشبع الدهون T2 قبل العلاج وتظهر الصورة العلوية اليمنى (B) T1 مع التباين. يشير رأس السهم الأحمر إلى الورم النقيلي فوق المفصل العجزي الحرقفي الأيسر. الصورة السفلية (C) هي صورة المراقبة أثناء العلاج ، حيث يظهر الجانب الأيسر بقعة الصوتنة الحالية والجانب الأيمن يظهر ناتج الطاقة ودرجة حرارة بقعة الصوتنة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
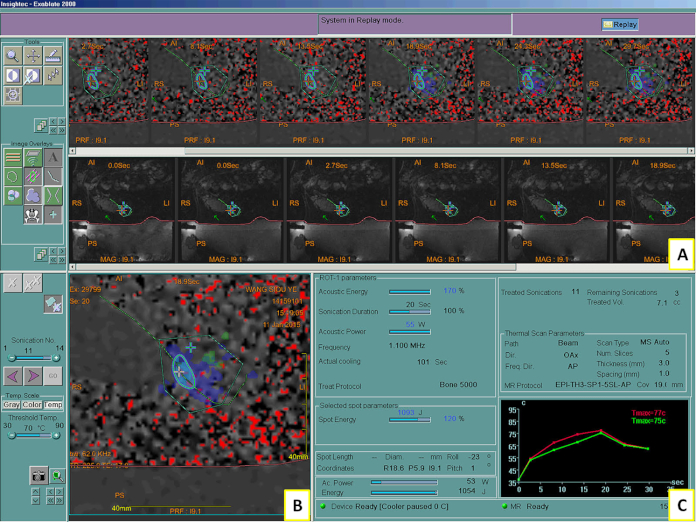
الشكل 2: يظهر نظام MRgFUS في العلاج الثاني. شاشة النظام توضح صور MR داخل الإجراءات وعناصر التحكم (A) ، والخريطة الحرارية بعد الصوتنة (B) ، ورسم بياني لارتفاع درجة الحرارة المحسوب أثناء الصوتنة (C). Tكحد أقصى = درجة الحرارة القصوى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
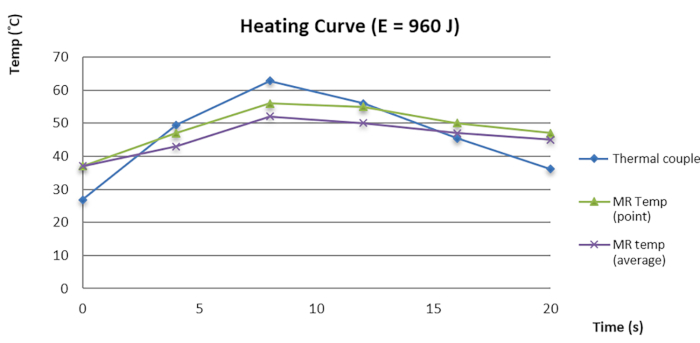
الشكل 3: منحنى درجة الحرارة والوقت لقياس الحرارة MR والزوجين الكهروحراريين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
أظهرت العديد من الدراسات أن MRgFUS آمن وفعال للسيطرة على الألم الناتج عن نقائل العظام المتكررة أو المتبقية بعد RT12،13. بالنسبة ل 64.3-72.0٪ من المرضى ، يستمر ألم العظام النقيلي بعد RT والمواد الأفيونية. حددت الدراسات أيضا أن MRgFUS له سمية محدودة ومسار علاج مقبول.
حصل MRgFUS على الموافقة على استخدامه في آلام العظام النقيلية في عام 2011 من قبل Conformité Européenne وفي عام 2012 من قبل إدارة الغذاء والدواء الأمريكية. بالإضافة إلى استخدامه بشكل متزايد سريريا للسيطرة على آلام العظام النقيلية ، فقد تم أيضا فحص MRgFUS لاستخدامه في أمراض أخرى ، مثل سرطان البروستاتا وسرطان الثدي والرعشة مجهولةالسبب 9. ومع ذلك ، فإن استخدام برنامج MR كمقياس حرارة هو التقنية الوحيدة المتاحة للتحقق من دقة البرنامج وسلامة الجهاز ، والذي يولد الموجات فوق الصوتية المركزة ويوفر الطاقة. لذلك ، أظهرنا دورة علاجية باستخدام MRgFUS لعلاج النقائل العظمية وبحثنا أيضا طريقة فعالة لتوفير ضمان الجودة للكشف الحراري وتوصيل الطاقة قبل كل علاج. في هذه المقالة ، نقترح تعديلات على سير العمل الموصى به حاليا ، والتي بمساعدة محاكاة التصوير المقطعي المحوسب قبل العلاج ، يمكن أن تسرع مسار العلاج وتقلل أيضا من معاناة المريض وألم أثناء العملية.
في تحقيقنا الداخلي ، وجدنا أن خطأ التركيز (FE) بين تركيز الصوتنة والبقعة ذات أعلى درجة حرارة في الشبح كانت 1.73 ± 1.21 ملم في المحور الأيمن والأيسر (RL) ، و 0.95 ± 0.82 ملم في المحور العلوي السفلي (SI) ، و 0.31 ± 0.63 في المحاور الأمامية الخلفية (AP) قبل ضمان جودة البيانات (DQA). بعد DQA ، تم تخفيض FE بشكل ملحوظ إلى 0.43 ± 0.34 في RL المحوري و 0.11 ± 0.22 في المحور SI ، مع p < 0.01 (اختبار الزوج t). اقترح تحقيقنا أن DQA يحسن FE بنسبة تصل إلى 1 مم ، مع فاصل ثقة 95٪ ، مما يؤدي إلى FE أقل من 0.5 مم في محوري SI و AP. علاوة على ذلك ، تحققنا أيضا من قياس الحرارة MR ل MRgFUS مع زوجين كهروحراريين متوافقين مع MR (TEC) داخل شبح للكشف عن التغيرات الحرارية. أشارت النتيجة إلى أن المنحنى الحراري واكتشاف درجة الحرارة يتبعان نفس الاتجاه (الشكل 3). ساهم الاختلاف الصغير في درجة الحرارة بين قياس الحرارة MR و TEC في ضمان الجودة. نظرا لأن TEC صغير والمكون المعدني يتداخل مع دقة الصورة ، كان تحديد الموضع الدقيق ل TEC أمرا صعبا. يتطلب التعديل الإضافي ل TEC في الشبح لتحسين رسم الخرائط الحرارية والكشف مزيدا من التحقيق.
في الختام ، يبدو أن MRgFUS علاج ملطف فعال وفوري وآمن في المرضى الذين يعانون من آلام العظام النقيلية ، خاصة للألم المتكرر أو المتبقي. يتزايد الطلب على العلاج واستخدامه بسرعة ، ولكن نادرا ما تمت مناقشة ضمان الجودة والتحسينات في سير عمل العلاج في الدراسات. هنا ، نصف إجراءاتنا ونتائج دراستنا ل DQA ، مع الإشارة إلى قيمة DQA قبل كل علاج. يمكن أن يؤدي استخدام محاكاة التصوير المقطعي المحوسب قبل MRgFUS إلى تسهيل سير العمل وتقليل معاناة المرضى وآلامهم أثناء العملية.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
يشكر المؤلفون ريني وانغ ، عالمة الفيزياء الطبية ، على مساعدتها في التحقيق في DQA.
Materials
| Name | Company | Catalog Number | Comments |
| 1L degasseed water pouch | InSightec | ASM001480 | for good ultrasound beam transmission |
| CT scan | Philips | Brilliance Big Bore 16 Slice CT, 7387 | Acquire CT images for positioning |
| EXABLATE | InSightec | EXABLATE 2000 | System for non-invasive tumor ablation through Focal Ultrasound (FUS) treatment under Magnetic Resonance (MR) guidance |
| Gel Pad ASSY | InSightec | SET999014 | Transmission gel pad for single Body treatment. |
| MR scan | GE | HDxT | Acquire MR images for contouring and planning |
| MRI contrast | Guerbet | Dotarem | Enhance MR for acquiring images |
| Patient accessory kit | InSightec | SET000016 | clinical applications single use treatment kit |
| Patient plastic drape | InSightec | DTP000067 | Cover the panel of ultrasound transducer. Deposible, hygiene use |
| Pelvic RF coil | GE | ASM000956 | Enhance MR for acquiring images |
| phantom | ATS Labs ATS Labs Inc | Model TxS-100 | for calibration |
| ultrasound transmission gel | InSightec | SET000885 | gel for calibration prior MR-guided FUS treatment |
References
- Lutz, S., et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence-Based Guideline. Practical Radiation Oncology. 7 (1), 4-12 (2017).
- Selvaggi, G., Scagliotti, G. V. Management of bone metastases in cancer: a review. Critical Reviews in Oncology/Hematology. 56 (3), 365-378 (2005).
- Simon, C. J., Dupuy, D. E., Mayo-Smith, W. W. Microwave ablation: principles and applications. Radiographics. 25 (Suppl 1), S69-S83 (2005).
- Napoli, A., et al. MR imaging-guided focused ultrasound for treatment of bone metastasis. Radiographics. 33 (6), 1555-1568 (2013).
- Jolesz, F. A., Hynynen, K. Magnetic resonance image-guided focused ultrasound surgery. Cancer Journal. 8, S100-S112 (2002).
- Umemura, S., Kawabata, K., Hashiba, K. Enhancement of ultrasonic absorption by microbubbles for therapeutic application. IEEE Ultrasonics Symposium, , (2001).
- Tran, B. C., et al. Microbubble-enhanced cavitation for noninvasive ultrasound surgery. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 50 (10), 1296-1304 (2003).
- Rieke, V., Butts Pauly, K. MR thermometry. Journal of Magnetic Resonance Imaging. 27 (2), 376-390 (2008).
- Poorter, J. D., et al. Noninvasive MRI thermometry with the proton resonance frequency (PRF) method: in vivo results in human muscle. Magnetic Resonance in Medicine. 33 (1), 74-81 (1995).
- Gorny, K. R., et al. MR guided focused ultrasound: technical acceptance measures for a clinical system. Physics in Medicine & Biology. 51 (12), 3155(2006).
- Kao, Y. T., et al. Position stability analysis of a clinical mri-guided focused ultrasound system: one-year experience. Therapeutic Radiology and Oncology (In Traditional Chinese). 23 (2), 107-114 (2016).
- Bazzocchi, A., et al. MRI-guided focused ultrasound surgery in musculoskeletal diseases: the hot topics. The British Journal of Radiology. 89 (1057), 20150358(2016).
- Gennaro, N., et al. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiology. 48 (8), 1161-1169 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved