Method Article
אולטרסאונד ממוקד מונחה תהודה מגנטית בזמן אמת לגרורות כואבות בעצמות
In This Article
Summary
תהודה מגנטית יכולה להציע ניטור בזמן אמת של המיקום והטמפרטורה של אולטרסאונד ממוקד באבלציה תרמית לגרורות כואבות בעצמות, ללא קשר לסוג הסרטן או לטיפולים מקומיים קודמים. השיטה החדשנית שלנו להבטחת איכות יכולה להקל על יישום טיפול יעיל ובטוח זה.
Abstract
עצמות הן אחד האתרים הנפוצים ביותר של גרורות סרטניות, הגורמות בדרך כלל לכאבים ופוגעות באיכות החיים. טיפול בקרינה בשילוב עם אופיואידים הוא הטיפול הסטנדרטי לגרורות כואבות בעצמות. טיפול זה משיג שליטה יעילה בכאב ב-60-74% מהחולים, אך אפשרויות טיפול מוגבלות עם יתרונות מוגבלים זמינות עבור גרורות כואבות חוזרות או שיוריות בעצמות לאחר הקרנות. יותר מ-40% מהחולים עדיין חווים כאבי עצמות בינוניים עד חמורים לאחר הקרנה חוזרת. אולטרסאונד ממוקד מונחה תהודה מגנטית (MRgFUS) משלב אולטרסאונד ממוקד בעוצמה גבוהה, המשיג אבלציה תרמית של גרורות בעצמות והפחתת כאב לאחר מכן, עם תרמומטריה של תהודה מגנטית בזמן אמת (MR) לניטור הטמפרטורה של תמונות MR אנטומיות, עם דיוק של 1 מעלות צלזיוס, רזולוציה מרחבית של 1 מ"מ ורזולוציה זמנית תוך 3 שניות. בנוסף לשימוש קליני הולך וגובר לשליטה בכאבי עצמות גרורתיים, נבדק גם השימוש ב-MRgFUS למחלות אחרות. עם זאת, השימוש בתוכנת MR כמדחום הוא הטכניקה היחידה הזמינה לאימות דיוק התוכנה ולהבטיח אספקת אנרגיה. כאן, אנו מתארים שיטה יעילה של אבטחת איכות שפיתחנו לזיהוי תרמי ואספקת אנרגיה לפני כל טיפול MRgFUS וגם מציעים זרימת עבודה שונה כדי לזרז את מהלך הטיפול כמו גם להפחית את כאבי המטופלים במהלך ההליך.
Introduction
עצמות הן אחד האתרים הנפוצים ביותר של גרורות סרטניות, הגורמות בדרך כלל לכאבים ופוגעות באיכות החיים. טיפול בקרינה (RT) בשילוב עם אופיואידים הוא הטיפול הסטנדרטי לגרורות כואבות בעצמות. טיפול זה משיג שליטה יעילה בכאב ב-60-74% מהמטופלים1. עם זאת, אפשרויות טיפול מוגבלות זמינות לכאבי עצמות גרורתיים חוזרים או שיוריים לאחר RT. הקרנה חוזרת, התערבות כירורגית, הקפאה מלעורית או אבלציה בגלי רדיו ומינונים מוגברים של אופיואידים מערכתיים ומשככי כאבים הם אפשרויות עם אינדיקציות מוגבלות ובדרך כלל עם תופעות לוואי. יתר על כן, טיפולים משניים אלה הניבו תוצאות לא משביעות רצון: יותר מ-40% מהחולים ממשיכים לחוות כאבי עצמות בינוניים עד חמורים לאחר הקרנה חוזרת2.
מערכות אולטרסאונד ממוקדות בעוצמה גבוהה משלבות אולטרסאונד מזוויות מרובות לנקודה אחת, ומעבירות אנרגיה אקוסטית בטמפרטורות אבלטיביות של יותר מ-65 מעלות צלזיוס3. טכניקה לא פולשנית זו שימשה לאבלציה תרמית באתרים שונים ולסוגים שונים של נגעים 4,5. בדרך כלל, מערכות אולטרסאונד ממוקדות מייצרות אנרגיה אקוסטית בתדרים של 200 קילו-הרץ-4 מגה-הרץ 6,7, ומייצרות עוצמה בנקודת המוקד בסדר גודל של 100-10,000 ואט/ס"מ2. ברמות אנרגיה אלה, קרני האולטרסאונד הממוקדות גורמות לעלייה בטמפרטורת התא על נפח הרקמה המטופלת. עליית הטמפרטורה משתנה בהתאם למקדם ספיגת הרקמות, הצפוי באמצעות ניתוח ארניוס או יחס המינון התרמי של איזואפקט ספרטו-דיואי. כדי להשיג שליטה טובה יותר ועליית טמפרטורה מהירה יותר, מוצעים נפחי מוקד של 0.2-5 מ"מ3 עבור כל סוניקציה. לכן, אבלציה של אזורים גדולים יותר דורשת ריצוף של סוניקציות מרובות כדי לכסות נפח גדול וליצור נזק תרמי הומוגני. בנוסף לגרימת נזק כתוצאה מהשפעות תרמיות, אולטרסאונד ממוקד יוצר גם מיקרו-בועות בגלל גורמים פיזיקליים כמו דיפוזיה מתוקנת באזור המטופל. כאשר גודל המיקרו-בועות מגיע לניתוק, הן בסופו של דבר מתפוצצות, גורמות לגלי מיקרו-הלם ומשפיעות על הרקמות הסובבות. השפעה לא תרמית מקבילה זו תורמת גם לפגיעה ברקמות ולנמק גידול.
בניגוד לטכניקות הנחיית תמונה אחרות, כגון הדמיית אולטרסאונד, הדמיית תהודה מגנטית (MR) מספקת תמונה תלת מימדית של אנטומיה עם תמונות ברזולוציה ברורה של רקמות רכות וניטור טמפרטורה כמותי. תוכנת המיפוי של תרמומטריית MR כמותית יכולה לחשב את השינוי התרמי במעלות צלזיוס ולאחר מכן להניח את המיקומים המתאימים על תמונות ה-MR האנטומיות8. על ידי זיהוי שינוי תדר התהודה של הפרוטונים במימן מים, המתאים לכ-0.01 ppm למעלה צלזיוס, רצף ה-MR הרגיש לטמפרטורה יכול לשלוט בשקיעת אנרגיה, עם דיוק של 1 מעלות צלזיוס למדידת שינויים תרמיים, רזולוציה מרחבית של 1 מ"מ ורזולוציה זמנית בתוך 3 שניות 9,10. עם תוכנה מורחבת זו, מכשיר ה-MR יכול לספק תמונות אבחון וגם לזהות שינויים תרמיים תוך שניות, ולמפות אותם על התמונות האנטומיות במהלך כל מהלך הטיפול. למרות הפיתוח של טכניקה חדשנית כזו, מעט מאמרים מתארים ביטחון איכותי במהלך כל קורס טיפול. כאן אנו שואפים לחלוק את הפרוטוקול והחוויות שלנו עם MRgFUS.
Protocol
הושג אישור מועצת הביקורת המוסדית המשותפת של האוניברסיטה הרפואית של טאיפיי למחקר זה.
הערה: אותו פרוטוקול, שתוקף ב-Kao et al.11, שימש לטיפול ב-138 מקרים בין 2015 ל-2019. קריטריוני ההכללה להרשמה לטיפול היו 1) נוכחות של גרורות כואבות בודדות בעצמות; 2) אין מתן טיפול מקומי קודם לנגע העצם הממוקד; ו-3) היכולת לגשת לנגע העצם הממוקד באמצעות MRgFUS (טבלת חומרים). חולים עם שברים פתולוגיים מתקרבים לא נכללו. חומרים והתקנים מפורטים מפורטים בטבלת החומרים.
1. ייעוץ טרום טיפול וסימולציה של CT לנקודת טיפול
- הערכת חולים המיועדים ל-MRgFUS
- להעריך את התאמת המטופל ל-MRgFUS בטיפול בכאבי עצמות גרורתיים. הסבירו את ההליך והמידע הקשור למטופל ולמשפחתו. רשום תרופות משככות כאבים יומיות וציון כאב לפני ואחרי התרופות.
- בקש מאונקולוג קרינה ורדיולוג לאתר את הנגע ואת האנטומיה הסמוכה על סמך סריקות טומוגרפיה ממוחשבת (CT) או הדמיית תהודה מגנטית (MRI) לפני הטיפול.
הערה: גרורות בעמוד השדרה אינן נכללות בגלל פגיעה אפשרית בחוט השדרה או בזנב הסוס. יש לטפל בנגעים בתא המטען בגב ולא בגחון על מנת למנוע פגיעה בכלי דם ואיברים עיקריים.
- אשר את נקודת הטיפול על ידי הדמיית CT יום אחד לפני MRgFUS.
- מקם את המטופל בשכיבה עם הראש על הספה ובצע סריקת CT סלילית (120 קילו וולט, 400 mA לפרוסה) על אזור הטיפול בעובי פרוסה של 3 מ"מ. כוונן והטה את מיקום המטופל, במרכז הספה, כדי לאתר את הנגע.
- הנח סמן CT, חוט עופרת 1 ס"מ, על פני העור, אנכית הקרובה ביותר לנגע, ובצע שוב סריקת CT סלילית (120 קילו וולט, 400 mA לפרוסה) כדי לאשר את מיקום המטופל ואת מיקום סמן ה-CT. סמן את מיקום סמן ה-CT בעט טוש וצלם את מיקום המטופל.
הערה: אישור מדויק של נקודת הטיפול והמיקום לפני MRgFUS יכול להקל על תהליך המיקום במהלך MRgFUS.
2. הכנת המטופל ל-MRgFUS ביום הטיפול
- אמת את זהות המטופל על פי זיהוי תמונה. ודא שהמטופל הסיר את כל חפצי המתכת והמכשירים המגנטיים לפני הסריקה.
- לרשום משככי כאבים מקומיים ומערכתיים לפני הטיפול.
- שעה לפני זמן הטיפול המתוכנן, יש למרוח קרם לידוקאין על העור המסומן, ברדיוס של 10 ס"מ. הסר את הקרם בזהירות 10 דקות לפני הטיפול.
- 30 דקות לפני הטיפול, יש לטפטף תוך ורידי 5 מ"ג דקסמתזון עם 50 מ"ל מי מלח רגילים למשך 10 דקות ו-30 מ"ג קטורולאק עם 50 מ"ל מי מלח רגילים למשך 10 דקות. הגדר את הקו התוך-ורידי ההיקפי על שתי הידיים, האמה, הרגל או כף הרגל בצד הנגדי לנגע.
- בדוק את הסימנים החיוניים של המטופל (דופק, לחץ דם, קצב נשימה וריווי דם) 5 דקות לפני שליחת המטופל לטיפול.
3. אבטחת איכות יומית (DQA) לפני MRgFUS
- הגדרת DQA
- החלף את ספת האבחון בספת MRgFUS במתמר אולטרסאונד ממוקד וחבר את הספה למערכת.
הערה: על הצוות להסיר את כל חפצי המתכת והמכשירים החשמליים, כולל טבעות, שעונים, עטים, טלפונים ניידים או תעודות זהות מגנטיות, לפני הכניסה לחדר ה-MRI. - מרחו ג'ל העברת אולטרסאונד (עובי ~1 מ"מ) ומים נטולי גז על לוח פני השטח של מתמר האולטרסאונד הממוקד.
הערה: היזהר לא לשרוט את לוח הפלסטיק במהלך תהליך זה. - מכסים בזהירות את הפאנל בווילון פלסטיק, והימנעו מקפלי הווילון מעל שטח הפאנל. הוסף מים נטולי גז לרמה גבוהה כמו סליל ה-MR על הספה.
הערה: היזהר לא ליצור בועות גז בין הפאנל, ג'ל ההילוכים, הווילון והמים המופרקים. - הנח לאט ובזהירות את כרית הג'ל על הפאנל מבלי ליצור בועות גז במהלך התהליך. הנח את פנטום ה-DQA על כרית הג'ל מבלי ליצור בועות גז.
- הנח את סליל ה-MRI על הספה וחבר את הסליל למכשיר ה-MRI. לחץ על ציון דרך בלוח הבקרה של ה-MRI ויישר את הלייזר האדום לפס השחור על הסליל. לאחר מכן, לחץ על מתקדם לסריקה בלוח הבקרה של ה-MRI.
- החלף את ספת האבחון בספת MRgFUS במתמר אולטרסאונד ממוקד וחבר את הספה למערכת.
- DQA prescan
- לחץ על לא פעיל במערכת ה-MRI כדי ליצור סריקת מציאות משולבת חדשה. הזן DQA כשם המטופל והזן 50 ק"ג למשקל גוף. בחר באפשרות Supine ו-Feet First כפרמטרי סריקה.
- בחר פרוטוקול סריקה כ-ExAblate - Plan - Bone. לאחר מכן לחץ על שמור סדרה | הורדה | סריקה. בדוק את תמונות הסריקה על הצג כדי לבדוק אם יש בועות גז.
הערה: אם נמצאו בועות גז, הגדר את ה-DQA פעם נוספת כדי להסיר אותן.
- נוהל DQA
- לחץ על גידולי עצם במערכת MRgFUS ולחץ על כיול כדי להפעיל את ה-DQA. לחץ על סריקת MRI ואשר שמספר הבדיקה זהה לזה שבמערכת ה-MRI.
- התאם את מיקום המתמר בתמונות הציריות והסגיטליות על מנת לאפשר לשדה הסוניקציה לכסות את הפנטום. לחץ על Load כדי לטעון תמונות MRI. לאחר מכן לחץ על Sag | בחר הכל כדי לבחור את כל התמונות. לחץ על גרזן | בחר שוב הכל .
- לחץ על צייר כדי להגדיר את אזור הסוניקציה. לחצו על 'קו עור ' כדי לעצב את פני השטח בין הפנטום לפד הג'ל. לחצו על 'העתק ' כדי להעתיק את קווי העור לכל הפרוסות הסגיטליות והציריות של התמונות. לאחר מכן התאם ואשר שקו העור נכון בכל תמונה.
- לחץ על אזור הטיפול כדי לעצב את אזור הטיפול בפנטום לשלוש פרוסות רצופות. לחץ על פרוטוקול כדי לבחור עצם 15 ולאחר מכן לחץ על החל. לחצו על Fiducial ובחרו נקודה בפנטום כנקודת התייחסות.
- תכנון DQA
- לחץ על תוכנית | ודא כדי להמשיך. לחץ על הוסף סוניקציה כדי להוסיף נקודה אחת לסוניקציה בתוך הפנטום. אשר ששדה הסוניקציה נמצא בתוך הפנטום בכל פרוסה סגיטלית וצירית.
- הגדר את פרמטרי הסריקה: כיוון = קורונל ופרוסת מספר = 5 עם תפוקת אנרגיה מוגדרת מראש. לחץ על סוניקציה כדי להתחיל.
- כיול
- לאחר סוניקציה, ניטור מערכת MRgFUS מציג את תמונות הטמפרטורה. אשר את נקודת החימום ולחץ על מרכז כדי לסמן את הנקודה. השתמש בעכבר כדי לבדוק את נקודת החימום ונקודות אחרות ושונות כדי להשוות את העקומה התרמית לאיתור חפצים או אותות רקע.
- המערכת מציגה התאמות למיקום המתמר במילימטרים ב-3 צירים. לחץ על קבל ולאחר מכן לחץ על הקודם כדי לבצע שוב את הסוניקציה עם עלייה של 20% באנרגיה. ודא שהכוונוןהשני נמצא בטווח של 1 מ"מ ולחץ על דחה.
- הגדר פרמטר סריקה: כיוון = פרוסת ציר ומספר = 5 עם תפוקת אנרגיה מוגדרת מראש. בצע התאמות ציריות כמתואר בשלבים 3.5.1 ו- 3.5.2. לחץ על יציאה כדי לצאת מ-DQA ולהסיר את הפאנטום.
4. מיקום המטופל וסריקת MR לפני הטיפול
- מיקום המטופל
- מקם את המטופל על ספת MRgFUS באותה תנוחה כמו הסימולציה הקודמת בשלב 1.2. יישר את הסימן על העור עם מרכז כרית הג'ל.
- אבטח את המטופל לספה באמצעות חגורת בטיחות ולמד את המטופל כיצד להשתמש בלחצן החירום. הגדר את אוקסימטר דופק האצבע על אצבע מורה אחת.
- הנח את סליל ה-MR על הספה ויישר את הסליל. לאחר מכן לחץ על מתקדם לסריקה בלוח הבקרה של ה-MRI.
- סריקת MR לפני הטיפול
- צור סריקת MR חדשה והזן את פרטי המטופל. בחר ב-Supine ו-Feet First כפרמטרי הסריקה ובפרוטוקול הסריקה כ-ExAblate - Plan - Bone.
- השג/י תמונות T2 בעלות שלושה מישורים ולאחר מכן לחץ/י על ״הצג עריכה ״ כדי לאשר את אזור הסריקה. לחץ על שמור | הורדה | סריקה מוקדמת אוטומטית. אשר את אזור הסריקה לאחר הסריקה המוקדמת ולאחר מכן לחץ על סריקה.
- אשר את הנגע ואת מיקום המטופל.
- אשר מחדש את הנגע, שדה סריקת MR ומיקום המטופל.
הערה: שדה סריקת ה-MR צריך להיות מעל אזור הטיפול ולכסות את מתמר האולטרסאונד. - יש לבחון את בועות הגז בין פני העור לרפידת הג'ל. מקם מחדש את המטופל אם קיימות בועות גז.
- אשר מחדש את הנגע, שדה סריקת MR ומיקום המטופל.
5. עיצוב ותכנון הטיפול
- ייבוא תמונות MR
- לחץ על גידולי עצם במערכת MRgFUS. לחץ על מתאר | סריקת MRI ואישור שמספר הבדיקה זהה לזה שבמערכת ה-MRI.
- לחץ על טען כדי לטעון תמונות MRI שנאספו בשלב 4.2. לחץ על Sag | בחר הכל. לאחר מכן לחץ על גרזן | בחר שוב הכל .
- קווי מתאר
- לחץ על צייר כדי להגדיר את אזור הסוניקציה. לחצו על 'קו עור ' כדי לעצב את פני העור. לחצו על 'העתק ' כדי להעתיק את קווי העור לכל הפרוסות הסגיטליות והציריות של התמונות. התאימו ואשרו שקו העור נכון בכל תמונה.
הערה: יש לעצב את קו העור על כל פרוסת תמונת MR עם מתמר האולטרסאונד. - לחץ על עצם כדי לעצב את פני העצם. נקישה בלוק כדי לעצב איברים חיוניים, כגון עצבים, כלי דם או מעיים, כדי למנוע סוניקציה דרך אזורים אלה. לחץ על Fiducial ובחר נקודה ליד הנגע כנקודת התייחסות.
- לחץ על צייר כדי להגדיר את אזור הסוניקציה. לחצו על 'קו עור ' כדי לעצב את פני העור. לחצו על 'העתק ' כדי להעתיק את קווי העור לכל הפרוסות הסגיטליות והציריות של התמונות. התאימו ואשרו שקו העור נכון בכל תמונה.
- תכנון
- לחץ על תוכנית | ודא להמשיך לאחר השלמת כל קווי המתאר. סקור את תכנון הטיפול והתאם את הסוניקציה במידת הצורך.
הערה: מסלול הסוניקציה צריך להיות מהמתמר לנגע דרך פני העור.
- לחץ על תוכנית | ודא להמשיך לאחר השלמת כל קווי המתאר. סקור את תכנון הטיפול והתאם את הסוניקציה במידת הצורך.
6. אימות וטיפול
- משככי כאבים וטשטוש
- 10 דקות לפני האימות והטיפול, יש לטפטף תוך ורידי 25 מ"ג מפרידין ו-7.5 מ"ג מידזולם עם 50 מ"ל מי מלח רגילים למשך 10 דקות.
- טפטוף תוך ורידי 7.5 מ"ג מורפיום עם 50 מ"ל מי מלח רגילים למשך 10 דקות במרווח של 30 דקות אם המטופל מתלונן על כאבים במהלך הטיפול.
הערה: רופא עשוי להתאים משככי כאבים ותרופות הרגעה בהתאם לתנאים הקליניים. - בדוק מעת לעת את הדופק והאוקסימטר בין סוניקציה.
הערה: אם המטופל עצבני מאוד או זקוק לליווי, אחות או איש צוות עשויים להישאר בפנים במהלך סוניקציה. MR ואולטרסאונד אינם גורמים לקרינה או נזק לאנשי צוות אחרים בקרבת מקום.
- אימות
- בחר סוניקציה אחת עם פרמטרים מוגדרים מראש ולחץ על סוניקציה כדי להתחיל. עקוב אחר עליית הטמפרטורה והעקומה התרמית של נקודת החימום כמו גם את נקודת הייחוס כדי לבדוק אם יש חפצים או אותות רקע. הגדל את תפוקת האנרגיה וחזור על הסוניקציה לאותה נקודה.
- חזור על הסוניקציה לאותה נקודה עד שהטמפרטורה היא מעל 65 מעלות צלזיוס כדי להגיע לאבלציה תרמית.
הערה: לאנשים שונים עם מסת גוף שונה, מיקומים שונים ורקמות שונות יהיו ספיגות אנרגיה שונות ושינויים תרמיים. יש צורך בשימוש באנרגיה נמוכה יותר לצורך אימות.
הערה: חימום חוזר ונשנה של אותה נקודה או אזור סמוך תוך זמן קצר עלול להשפיע על תרחום MR. לכן, אפשר למערכת להשהות אם מרווחי הסוניקציה קרובים מדי.
- טיפול
- לחץ על סוניקציה כדי להתחיל את הטיפול עם תפוקת האנרגיה המאומתת המתוארת בשלב 6.2.
- עקוב אחר עליית הטמפרטורה והעקומה התרמית של נקודת החימום וחזור על הסוניקציה עם הגדלת תפוקת האנרגיה עד שהטמפרטורה היא מעל 65 מעלות צלזיוס. השלם את כל הסוניקציה לאזור הטיפול.
7. הערכה לאחר הטיפול
- סריקת MR לאחר הטיפול
- בצע סריקה לאחר MRgFUS עם כל הסדרות כמו בשלבים 4.2 ו-4.3.
- הזרקת מדיום ניגוד תוך ורידי בקצב של 4-5 מ"ל לשנייה וביצוע סריקת MR מנוגד כשלב 7.1.1.
הערה: נפח הניגודיות מבוסס על משקל הגוף (כלומר, 0.2 מ"ל לכל 1 ק"ג).
- הערכת טיפול/השפעה תרמית מ-MRI לאחר הטיפול. חזור על הסוניקציה אם האבלציה התרמית אינה מטפלת בכל הנגע.
תוצאות
חולה גבר בן 68 אובחן עם קרצינומה של הכבד (HCC) באוקטובר 2012. הוא עבר כריתת אונה שמאלית ב-18 באוקטובר 2012, והפתולוגיה דיווחה על HCC של 8.8 ס"מ. לאחר הניתוח, הוא חווה כאבים בגב התחתון, ובדיקת MRI ב-2 בנובמבר 2012 גילתה גוש גרורתי גדול הכולל את עצם העצה השמאלית, איליום ורקמת העכוז הרכה. בגלל דחיסת הגידול והכאב שהגיע ל-6 נקודות בסולם האנלוגי החזותי (VAS), הוא קיבל RT עם 45 Gy ב-15 שברים בנובמבר 2012, ונרשם גם טיפול מערכתי ל-HCC גרורתי. שישה חודשים לאחר מכן, הגידול הגרורתי באגן התקדם והכאב חזר, והגיע ל-7 נקודות ב-VAS. RT שני עם 25 Gy ב-10 שברים ביוני 2013 ו-RT שלישי עם 25 Gy ב-10 שברים בנובמבר 2013 אורגנו לטיפול בגידול המתקדם. הכאב שכך למשך 4 חודשים נוספים אך לאחר מכן חזר והגיע ל-7 נקודות ב-VAS במאי 2014.
מכיוון שהקרנה ניתנה בעבר שלוש פעמים באותו מקום, MRgFUS הייתה אפשרות הטיפול היחידה. עבור מסת אגן ענקית מעל הצד השמאלי של האגן, הטיפול ב-27 במאי 2014 השתמש בתשע סוניקציות של 2987.56 ±-1083.98 J, וחימם את הגידול עד 61.78 ±-7.11 מעלות צלזיוס בכל סוניקציה של 20 שניות (איור 1). באמצעות CTCAE גרסה 4.0, נצפתה כוויית עור בדרגה 1 עם תסמינים מינימליים, אך לא נדרשה התערבות. רמת הכאב של המטופל ירדה ל-4 נקודות ב-VAS, מה שאיפשר להפחית את מינוני משככי הכאבים במשך למעלה מ-3 חודשים.
עם זאת, עקב כישלון התרופות המערכתיות, המסה השיורית התקדמה שוב וגרמה לכאבים בינוניים עד חמורים, והגיעה לסירוגין ל-8 נקודות ב-VAS 5 חודשים לאחר הטיפול הראשון שלו ב-MRgFUS. בהיעדר חלופות, הטיפול השני ב-MRgFUS (איור 2) נקבע ב-11 בינואר 2015 לאותה גרורות בעצמות. תוכנית הטיפול השתמשה ב-5 סוניקציות עם 1638.60 ±-210.67 J, וחיממה את הגידול ל-64.40 ±-6.31 מעלות צלזיוס בכל סוניקציה של 20 שניות. לא נרשמה תופעת לוואי באירוע זה. רמת הכאב של המטופל ירדה ל-4 נקודות ב-VAS תוך יום אחד, והוא נשמר ברציפות ברמה של <4 נקודות ב-VAS במשך למעלה מ-3 חודשים. הוא נפטר 7 חודשים לאחר ה-MRgFUS השני.

איור 1: תמונת MR בטיפולהראשון . (A) התמונה השמאלית העליונה מראה את רוויית השומן T2 לפני הטיפול, והתמונה הימנית העליונה (B) מציגה את T1 עם ניגודיות. ראש החץ האדום מציין את הגידול הגרורתי מעל מפרק העצה והכסל השמאלי. התמונה התחתונה (C) היא תמונת הניטור במהלך הטיפול, כאשר הצד השמאלי מציג את נקודת הסוניקציה הנוכחית והצד הימני מציג את תפוקת האנרגיה והטמפרטורה של נקודת הסוניקציה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
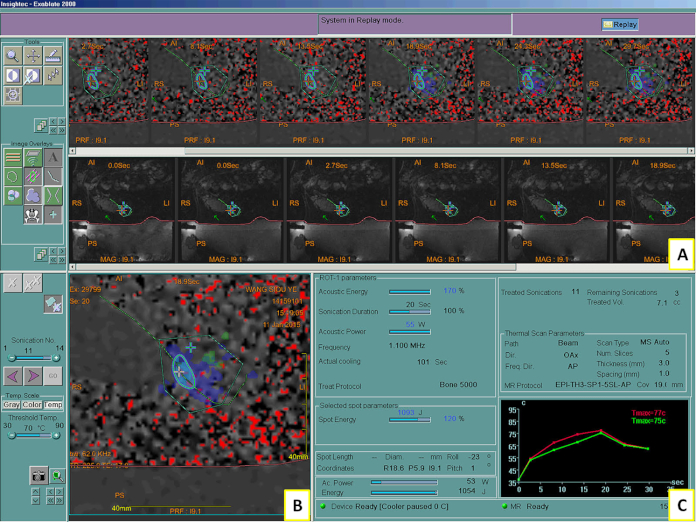
איור 2: מערכת MRgFUS המופיעה בטיפולהשני . מסך מערכת המציג את התמונות והבקרות התוך-פרוצדורליות של MR (A), המפה התרמית לאחר סוניקציה (B) וגרף של גובה הטמפרטורה המחושב במהלך הסוניקציה (C). Tמקסימום = טמפרטורה מקסימלית. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
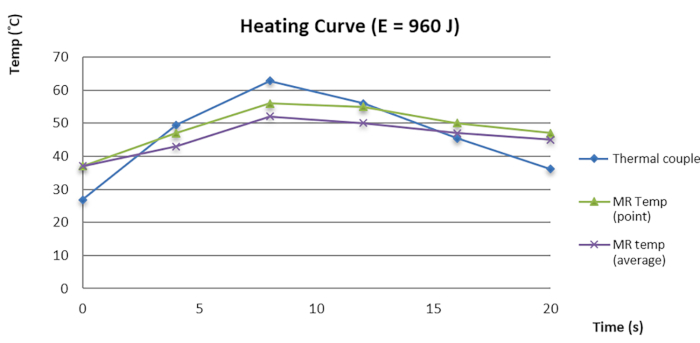
איור 3: עקומת זמן-טמפרטורה של תרמומטריית MR וצמד תרמו-אלקטרי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מספר מחקרים הוכיחו כי MRgFUS בטוח ויעיל לשליטה בכאב מגרורות עצם חוזרות או שיוריות לאחר RT12,13. עבור 64.3-72.0% מהחולים, כאבי עצמות גרורתיים נמשכים לאחר RT ואופיואידים. מחקרים גם קבעו של-MRgFUS יש רעילות מוגבלת ומהלך טיפול נסבל.
MRgFUS קיבל אישור לשימוש בכאבי עצמות גרורתיים בשנת 2011 על ידי Conformité Européenne ובשנת 2012 על ידי מנהל המזון והתרופות האמריקאי. בנוסף לשימוש קליני הולך וגובר לשליטה בכאבי עצמות גרורתיים, MRgFUS נחקר גם לשימוש במחלות אחרות, כגון סרטן הערמונית, סרטן השד ורעד בסיסי9. עם זאת, השימוש בתוכנת MR כמדחום הוא הטכניקה היחידה הזמינה לאימות דיוק התוכנה ובטיחות המכשיר, המייצר אולטרסאונד ממוקד ומספק אנרגיה. לכן, הדגמנו מהלך טיפול באמצעות MRgFUS לטיפול בגרורות בעצמות וגם חקרנו שיטה יעילה למתן אבטחת איכות לזיהוי תרמי ואספקת אנרגיה לפני כל טיפול. במאמר זה, אנו מציעים שינויים בזרימת העבודה המומלצת כיום, אשר בעזרת סימולציית טומוגרפיה ממוחשבת לפני הטיפול, יכולים לזרז את מהלך הטיפול וגם להפחית את הסבל והכאב של המטופל במהלך ההליך.
בחקירה הפנימית שלנו, מצאנו ששגיאת המיקוד (FE) בין מוקד הסוניקציה לנקודה עם הטמפרטורה הגבוהה ביותר בפנטום הייתה 1.73 ±-1.21 מ"מ בציר ימין-שמאל (RL), 0.95 ±-0.82 מ"מ בציר העליון-תחתון (SI) ו-0.31 ±-0.63 בציר הקדמי-אחורי (AP) לפני אבטחת איכות הנתונים (DQA). לאחר DQA, FE הופחת משמעותית ל-0.43 ±-0.34 בצירי RL ו-0.11 ±-0.22 בצירי SI, עם p <-0.01 (מבחן זוג t). המחקר שלנו הצביע על כך ש-DQA משפר את ה-FE בעד 1 מ"מ, עם רווח בר-סמך של 95%, וכתוצאה מכך FE של פחות מ-0.5 מ"מ בצירי SI ו-AP. יתר על כן, אימתנו גם את תרמומטריית ה-MR של MRgFUS עם זוג תרמו-אלקטרי תואם MR (TEC) בתוך פנטום כדי לזהות שינויים תרמיים. התוצאה הצביעה על כך שהעקומה התרמית וגילוי הטמפרטורה עקבו אחר אותה מגמה (איור 3). הפרש הטמפרטורות הקטן בין תרמומטריית MR ל-TEC תרם להבטחת האיכות. מכיוון שה-TEC קטן והרכיב המתכתי מפריע לרזולוציית התמונה, היה קשה לעצב את המיקום המדויק של ה-TEC. שינוי נוסף של ה-TEC בפנטום כדי לשפר את המיפוי והזיהוי התרמי דורש חקירה נוספת.
לסיכום, נראה כי MRgFUS הוא טיפול פליאטיבי יעיל, מיידי ובטוח בחולים עם כאבי עצמות גרורתיים, במיוחד לכאבים חוזרים או שיוריים. הביקוש והשימוש בטיפול גדלו במהירות, אך הבטחת איכות ושיפורים בזרימת העבודה של הטיפול נדונו רק לעתים רחוקות במחקרים. כאן, אנו מתארים את ההליך שלנו ואת תוצאות המחקר עבור DQA, ומציינים את הערך של DQA לפני כל טיפול. שימוש בהדמיית CT לפני MRgFUS יכול להקל על זרימת העבודה ולהפחית את הסבל והכאב של המטופלים במהלך ההליך.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מודים לרניי וואנג, פיזיקאית רפואית, על עזרתה בחקר DQA.
Materials
| Name | Company | Catalog Number | Comments |
| 1L degasseed water pouch | InSightec | ASM001480 | for good ultrasound beam transmission |
| CT scan | Philips | Brilliance Big Bore 16 Slice CT, 7387 | Acquire CT images for positioning |
| EXABLATE | InSightec | EXABLATE 2000 | System for non-invasive tumor ablation through Focal Ultrasound (FUS) treatment under Magnetic Resonance (MR) guidance |
| Gel Pad ASSY | InSightec | SET999014 | Transmission gel pad for single Body treatment. |
| MR scan | GE | HDxT | Acquire MR images for contouring and planning |
| MRI contrast | Guerbet | Dotarem | Enhance MR for acquiring images |
| Patient accessory kit | InSightec | SET000016 | clinical applications single use treatment kit |
| Patient plastic drape | InSightec | DTP000067 | Cover the panel of ultrasound transducer. Deposible, hygiene use |
| Pelvic RF coil | GE | ASM000956 | Enhance MR for acquiring images |
| phantom | ATS Labs ATS Labs Inc | Model TxS-100 | for calibration |
| ultrasound transmission gel | InSightec | SET000885 | gel for calibration prior MR-guided FUS treatment |
References
- Lutz, S., et al. Palliative radiation therapy for bone metastases: Update of an ASTRO Evidence-Based Guideline. Practical Radiation Oncology. 7 (1), 4-12 (2017).
- Selvaggi, G., Scagliotti, G. V. Management of bone metastases in cancer: a review. Critical Reviews in Oncology/Hematology. 56 (3), 365-378 (2005).
- Simon, C. J., Dupuy, D. E., Mayo-Smith, W. W. Microwave ablation: principles and applications. Radiographics. 25 (Suppl 1), S69-S83 (2005).
- Napoli, A., et al. MR imaging-guided focused ultrasound for treatment of bone metastasis. Radiographics. 33 (6), 1555-1568 (2013).
- Jolesz, F. A., Hynynen, K. Magnetic resonance image-guided focused ultrasound surgery. Cancer Journal. 8, S100-S112 (2002).
- Umemura, S., Kawabata, K., Hashiba, K. Enhancement of ultrasonic absorption by microbubbles for therapeutic application. IEEE Ultrasonics Symposium, , (2001).
- Tran, B. C., et al. Microbubble-enhanced cavitation for noninvasive ultrasound surgery. IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control. 50 (10), 1296-1304 (2003).
- Rieke, V., Butts Pauly, K. MR thermometry. Journal of Magnetic Resonance Imaging. 27 (2), 376-390 (2008).
- Poorter, J. D., et al. Noninvasive MRI thermometry with the proton resonance frequency (PRF) method: in vivo results in human muscle. Magnetic Resonance in Medicine. 33 (1), 74-81 (1995).
- Gorny, K. R., et al. MR guided focused ultrasound: technical acceptance measures for a clinical system. Physics in Medicine & Biology. 51 (12), 3155(2006).
- Kao, Y. T., et al. Position stability analysis of a clinical mri-guided focused ultrasound system: one-year experience. Therapeutic Radiology and Oncology (In Traditional Chinese). 23 (2), 107-114 (2016).
- Bazzocchi, A., et al. MRI-guided focused ultrasound surgery in musculoskeletal diseases: the hot topics. The British Journal of Radiology. 89 (1057), 20150358(2016).
- Gennaro, N., et al. Thermal ablation to relieve pain from metastatic bone disease: a systematic review. Skeletal Radiology. 48 (8), 1161-1169 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved