Method Article
행동 관찰을 위한 제브라피시 유충에 대한 휘발성 마취제 투여
요약
이 프로토콜은 행동 실험을 위해 유충 제브라피시에게 휘발성 마취제를 투여할 수 있는 기밀 환경을 조성하기 위한 접근 가능한 방법을 제공합니다.
초록
이 연구는 행동 실험 중에 유충 제브라피쉬에게 이소플루란 및 세보플루란과 같은 휘발성 마취제를 투여하는 독특한 방법을 설명합니다. 제브라피시는 척추동물 모델 유기체로서 복잡한 행동, 유전적 다루기, 투명한 배아, 빠른 발달 등 많은 이점을 제공하지만, 휘발성 마취제를 연구하는 데 사용되는 용도는 제한적입니다. 휘발성 마취제의 투여에는 일반적으로 접근할 수 없는 복잡하거나 번거로운 장치가 필요한 경우가 많아 수성 모델 유기체에서 휘발성 마취제에 대한 약리학적 연구에 장벽이 생깁니다. 이 방법은 접착 실리콘 시트를 사용하여 유리 96웰 플레이트에 기밀 밀봉을 생성하는 간단한 기술을 제공합니다. 검증은 자발적인 움직임에 대한 평가를 통해 수행되었으며, 90분 동안 밀폐된 우물과 열린 우물 간에 큰 차이가 없는 것으로 나타났습니다. 또한 마취제 농도는 HPLC로 측정한 바와 같이 시간이 지남에 따라 안정적으로 유지되었습니다. 대표적인 결과로는 세보플루란에 대한 유효농도 중앙값(EC50)의 실험적 측정이 있습니다. 이 연구는 휘발성 마취제를 사용하는 약리학적 실험에 대한 간단하고 접근 가능한 접근 방식을 제공하며, 이는 다른 휘발성 물질 및 실험 종점을 연구하는 데 쉽게 적용할 수 있습니다.
서문
비수생 동물 모델(벌레, 파리, 설치류, 토끼, 영장류 등)은 역사적으로 마취 약리학을 연구하는 데 가장 일반적으로 사용되는 모델이었습니다. 이러한 각 종에서 휘발성 마취제(가스 흡입을 통해 투여)는 정맥 마취제(정맥 주사 또는 복강 내 경로로 투여)보다 훨씬 덜 까다롭습니다1. 단순히 정맥 주사를 투여하는 기술적 어려움 외에도, 휘발성 약물을 사용하면 정맥 주사제보다 안정적인 마취 상태를 유지하는 것이 훨씬 쉽다2.
유충 수생 종에 대한 정맥 마취제의 투여는 주변 수성 매질 3,4로부터의 확산에 의해 달성될 수 있으며, 따라서 비수성 종에 대한 휘발성 마취제의 투여와 더 유사합니다. 수년 동안 올챙이(Xenopus laevis)는 인공 연못 물 5,6에 마취제의 간단한 목욕 첨가에 의해 달성된 약물 투여 및 정상 상태 약동학의 용이성으로 인해 마취제를 연구하기 위한 선택 모델이었습니다. 그러나, 이 모델에서는 휘발성 마취제에 대한 연구의 예가 상대적으로 적은데, 이는 종종 특수 목적에 맞게 제작되고 사용하는 것이 번거로울 수 있는 기밀 장치의 요구 사항 때문입니다 7,8.
최근 몇 년 동안 제브라피쉬는 잘 설명된 복잡한 거동 및 이러한 거동을 관찰할 수 있는 상용 장치의 가용성과 같은 다른 이점 외에도 약물 투여의 용이성으로 인해 정맥 마취제 연구에 선호되는 모델이 되었습니다9. 최근의 많은 연구에서는 제브라피시 유충의 행동을 정량화하기 위해 96웰 및 24웰 플레이트 형식을 사용하여 마취제를 포함한 신경 활성 화합물을 스크리닝하기 위해 상업적으로 이용 가능한 관찰 장치를 사용했습니다 4,10,11,12,13,14,15 . 유충 단계는 많은 행동 반응을 평가할 수 있는 능력, 작은 크기, 높은 처리량 호환성 및 잘 특성화된 신경 회로 9,16,17로 인해 약리학 연구에 특히 적합합니다. 그러나 제브라피시 모델의 마취제에 대한 이러한 연구에서 한 가지 중요한 한계는 휘발성 마취제 투여가 상대적으로 어렵다는 것입니다. 이러한 한계로 인해 휘발성제와 정맥주사제를 비교하는 사례가 거의 없었다 4,15,18. 단일 동물 모델에서 두 종류의 마취제를 쉽게 연구하고 비교할 수 있다는 것은 모든 등급에 걸쳐 마취 약리학 연구를 용이하게 하는 중요한 도구를 추가합니다.
전통적으로 수생 종의 정맥 마취제 연구에는 사용하기 어렵거나 실험 기간 동안 마취제 손실을 방지할 수 있을 만큼 충분히 가스가 밀폐되지 않을 수 있는 특수한 맞춤형 장비가 필요했습니다. 여기에 설명된 절차는 상업용 관찰 장치를 사용하여 유충 제브라피시 행동을 관찰하는 데 적합한 유리 챔버에서 기밀 밀봉을 생성하는 쉽게 접근할 수 있는 대체 수단을 제시합니다( 재료 표 참조).
프로토콜
모든 제브라피시 실험은 IACUC(Institutional Animal Care and Use Committee)에서 승인한 동물 사용 프로토콜에 따라 수행되었습니다. 성체 제브라피쉬는 University Laboratory Animal Resources(ULAR)의 감독하에 University of Pennsylvania의 수생 시설에서 유지되었습니다. 튀빙겐 롱핀 야생형 제브라피쉬는 모든 실험을 위해 사내에서 사육되었으며 수정 후 5일(dpf)에 도달할 때까지 13/11시간 명암 주기로 표준 축산 조건에서 유지되었습니다. 실험은 적절한 생물학적 다양성을 보장하기 위해 별개의 짝짓기 쌍에서 파생된 클러치와 함께 생물학적 복제품을 사용하여 수행되었습니다. 이 연구에 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 접착 실리콘 시트 제작
참고: 이 재료와 동등한 재료(실리콘 시트와 접착제)는 상업적으로 조달할 수 있지만 종종 비용이 더 많이 들고 가용성이 적습니다.
- 깨끗하고 평평한 표면에 0.5mm 실리콘 시트를 놓습니다.
- 시트에 주름이 있는지 검사하고 가능하면 피하십시오.
알림: 주름이 있는 실리콘 시트는 테이프에 적절하게 부착되지 않을 수 있으며 웰의 부적절한 밀봉 및/또는 제브라피쉬의 시각화가 좋지 않을 수 있습니다. - 70% 알코올로 시트를 청소하여 기름이나 부스러기를 제거하고 건조시킵니다.
- 페인트 브러시와 같은 어플리케이터를 사용하여 실리콘 시트에 접착 프라이머를 얇고 균일하게 코팅합니다. 과도한 적용을 방지하려면 접착제 프로모터가 빠르게 건조될 때(1-5초 안에 설정) 더 작은 섹션에서 작업하십시오.
알림: 이 접착 촉진 모터가 없으면 테이프가 실리콘 시트에 적절하게 부착되지 않습니다. - 접착 프로모터가 적용되면 양면 코팅 테이프를 종이 뒷면이 위를 향하도록 하여 실리콘 시트와 정렬합니다.
- 롤러를 사용하여 실리콘에 테이프를 점차적으로 적용하여 표면을 매끄럽게 하고 기포를 제거합니다(초기 적용 후 실리콘 면이 위로 향하게 작업하면 기포를 시각화하고 제거하는 데 도움이 됩니다).
- 접착 촉진제가 평평한 표면에서 24시간 동안 완전히 경화되도록 합니다.
- 접착 실리콘을 최소 10mm 너비(웰 직경 7.5mm와 각 면에 겹침)의 스트립으로 자릅니다.
참고: 웰 플레이트의 다른 모든 행을 사용할 때 스트립의 더 넓은 편차는 인접한 행의 웰에 부정적인 영향을 미치지 않으며, 이는 적용을 더 쉽게 만들 뿐만 아니라 웰의 전체 둘레를 밀봉하는 데 필요할 수 있습니다.- 스트립이 웰 플레이트의 한 줄 너비를 덮을 수 있을 만큼 충분히 긴지 확인하십시오.
알림: 24웰 또는 48웰 플레이트와 같이 96웰이 아닌 웰 플레이트를 사용하는 경우 플레이트의 특정 치수에 맞게 스트립 크기를 조정하거나 절단할 수 있으므로 플레이트 크기에 관계없이 적절한 적용 범위를 보장할 수 있습니다.
- 스트립이 웰 플레이트의 한 줄 너비를 덮을 수 있을 만큼 충분히 긴지 확인하십시오.
2. 용액 준비
참고: 휘발성 마취제의 모든 원액 및 분석 용액은 휘발성 화합물 농도의 손실을 피하기 위해 실험 직전에 만들어졌습니다.
- 각 용액(스톡 용액 또는 작업 용액)에 대해 HPLC 또는 섬광 바이알에 일정 량의 비휘발성 용매(E3 배아 물, DMSO 등)를 첨가하여 휘발성 마취제의 최종 희석액과 결합할 때 총 부피가 바이알을 충분히 채우고 최소한의 헤드 스페이스를 남깁니다( 그림 1A 참조).
- Hamilton 기밀 주사기로 휘발성 마취제를 추가하고 바이알을 빠르게 밀봉합니다.
참고: 격막 뚜껑이 있는 바이알의 원액은 기밀 주사기로 용액을 이동 시켜 추가 희석을 용이하게 하는 데 사용할 수 있습니다. - 그런 다음 필요에 따라 바이알(와류, 초음파 처리)을 혼합하고 제브라피시 플레이트를 준비하는 동안 임시로 보관합니다.
3. 행동 실험의 설정
참고: 프로토콜의 이 단계에서는 몇 가지 연습이 필요할 수 있습니다. 기술에 익숙해질 때까지 물고기나 귀중한 재료가 포함된 용액 없이 작업하는 것이 좋습니다.
- 애벌레 제브라피시 한 마리(5dpf)를 유리 96웰 플레이트의 다른 모든 줄로 옮깁니다.
참고: 다른 모든 행을 비워 두면 3.4단계에서 우물이 밀봉되므로 유출로 인한 인접 우물의 오염 가능성을 줄일 수 있습니다. - 각 웰에서 E3 용액을 조심스럽게 제거합니다. 이것은 한 번에 한 줄씩 또는 빠르게 작동할 수 있는 경우 전체 플레이트에서 수행할 수 있습니다.
참고: 유충이 용액에서 벗어나는 기간을 최소화하여 잠재적인 스트레스를 줄였습니다. 스트레스를 최소화하기 위해 약물 함유 용액을 첨가하기 전에 용액을 부분적으로만 제거하는 것을 포함하여 다양한 실험 요구에 따라 대체 절차를 사용할 수 있습니다. 프로토콜은 잠재적 스트레스를 보상하기 위해 동물에게 주어진 평형 시간, 용액 혼합 효율 및 작업 용액을 추가하기 전에 모든 E3를 제거하지 않은 경우 약물 함유 용액의 농도 정확도를 포함하여 실험의 요구에 맞게 조정되어야 합니다. - 다음으로, 전사 피펫을 사용하여 행의 각 웰을 실험 용액으로 채웁니다. 거품이 생기지 않도록 주의하세요. 각 웰을 과도하게 채웁니다(그림 1B).
- 1단계에서 만든 접착 실리콘 스트립을 사용하여 스트립을 빠르게 아래쪽으로 누릅니다(그림 1C). 이것은 거품 형성을 방지하고 물고기가 인접한 우물로 넘치는 것을 방지하는 데 도움이 됩니다.
- 접시 상단을 단단히 눌러 각 웰이 밀봉되었는지 확인합니다.
- 용액이 교환되고 웰 플레이트의 다른 모든 행에 대한 웰이 밀봉될 때까지 2-5단계를 반복합니다(그림 1D).
- 접시를 부드럽게 뒤집어 기포가 있는지 검사합니다.
참고: 기포가 있으면 제브라피시의 움직임을 시각화할 수 없습니다. - 플레이트를 행동 관찰 장치(실리콘 접착제 면이 아래를 향함)에 놓고 행동 실험을 수행합니다(자세한 내용은 결과 섹션 참조).
결과
기존의 노천-우물 관찰과 비교
접착 밀봉이 자발적인 움직임에 영향을 미치는지 여부를 평가하기 위해 개방형 우물과 밀봉된 우물의 대조군을 비교했습니다. 그림 2A에서 볼 수 있듯이, 이 기사에 설명된 실험에 사용된 표준 ~30분 동안 이러한 그룹 간에 통계적으로 유의미한 움직임 차이가 관찰되지 않았습니다. 다른 실험 패러다임은 더 긴 실험적 노출이 필요할 수 있음을 인식하고, 2시간 시간 과정을 수행하여 2시간 표시까지 움직임에 통계적 차이가 없음을 보여주었습니다( 그림 2B 참조). 실험 기간이 길수록 움직임의 차이가 더 커질 수 있습니다. 이전 연구에서는 저산소증이 수영 행동에 미치는 악영향을 정량화했으며,19 이는 궁극적으로 실험 결과의 무결성을 손상시켰다. 따라서, 저산소증 및/또는CO2 생성이 open-well control과 비교하여 SM에서 이러한 편차의 가장 가능성 있는 원인이라는 가설이 있습니다. 불행히도, 밀폐된 웰에서 휘발성 마취제의 손실을 방지하는 기밀 밀봉은 밀폐된 용액 안팎으로 다른 가스가 확산되는 것도 방지합니다. 물론 이것은 물고기가 각각 생산하고 소비하는 CO2 와 산소의 제한된 확산을 의미합니다. 이것은 이 방법으로 가능한 실험 길이와 관련하여 중요한 제한 사항입니다. 또한 시간이 지남에 따라 이전에 거품이 없었던 우물에 작은 거품이 형성되기 시작하는데, 이는 아마도 신진대사 때문일 것입니다. 그러나 테스트 중에 이러한 거품은 소프트웨어에 의한 제브라피시 추적을 방해하지 않았습니다. 최대 1.5시간(평형 시간 추가)의 실험은 이 야생형 제브라피쉬의 SM 추적에 큰 영향을 미치지 않는 것으로 보이지만, 더 많은 움직임을 보이거나 다른 증가된 신진대사 요구량을 보이는 물고기는 이 길이의 실험에 적합하지 않을 수 있습니다.
시간 경과에 따른 휘발성 마취제 농도
시간이 지남에 따라 휘발성 마취제의 일관된 농도를 보장하기 위해 제브라피시가 없는 웰을 사용하여 HPLC에 의해 결정된 마취 농도의 시간 경과를 측정했습니다. 동일한 용액을 각 웰에 첨가하고, 세보플루란 또는 이소플루란의 농도를 3시간 동안 15분마다 측정했습니다(동일한 웰에서 반복 측정과 반대로, 다른 웰에서 각 측정). 그림 3에서 볼 수 있듯이, 3시간에서 4%의 손실을 보인 이소플루란(25°C에서 238mmHg의 증기압)보다 증기압이 낮은 세보플루란(25°C에서 197mmHg의 증기압)을 사용하는 동안 시간 경과에 걸쳐 마취제가 거의 손실되지 않았습니다. 두 휘발성 마취제 모두 30분에서 60분 사이에 눈에 띄는 손실을 보이지 않았는데, 이는 많은 행동 실험에서 전형적이다.
유충 제브라피쉬에서 sevoflurane의 효능
이 기법은 제브라피시에서 휘발성 마취제의 효능을 측정하는 데 사용되었으며15 이전에 사용된 다른 방법보다 우수할 수 있습니다4. 자발적 운동(SM) 및 유도 운동(EM)의 측정에 의한 세보플루란의 평균 유효 농도(EC50)는 그림 4에 나와 있습니다. sealed-well 기법을 사용하여 SM의 경우 62μM(95% CI: 49-81), EM의 경우 126μM(95% CI: 81-193)의 EC50 값을 측정했습니다. SM 값은 이전에 보고된 76μM의 EC50 (95% CI: 50-114)과 유사합니다. 그러나 EM에 대해 이전에 보고된 240μM(95% CI: 169-328) 값은 여기에서 얻은 값의 거의 두 배입니다4. 이 방법론에 대한 유사한 HPLC 연구(밀폐 밀봉을 위한 진공 그리스 및 유리 커버슬립)를 수행하지 않고는 이러한 차이가 시간이 지남에 따른 휘발성 마취제 손실로 인한 것인지 확신할 수 없습니다. 그러나 특히 EM(음향 탭)에 대한 자극이 행동 관찰 시간이 끝날 때 기록된다는 점을 감안할 때 이는 합리적인 가설입니다. 유정을 밀봉하는 방법에 관계없이, 세보플루란 농도의 손실은 나중에 가장 큰 영향을 미칠 것입니다. 물론 이러한 차이는 제브라피쉬의 유전적 배경과 같은 다른 근본적인 요인에 기인할 수 있습니다.
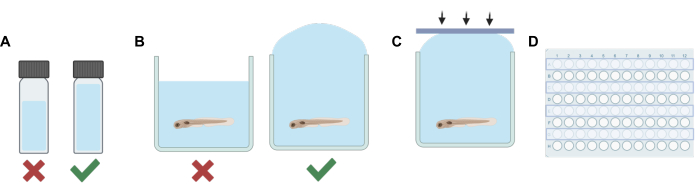
그림 1: 주요 절차 단계. (A) 휘발성 용액으로 작업할 때 각 바이알의 헤드 스페이스를 최소화하기 위해 희석 계획이 수행됩니다. (B) 우물의 과충전은 기포를 제거하기 위해 제브라피시가 포함된 용액에 실험 용액을 추가할 때 수행됩니다. (C) 실리콘 접착 스트립은 공기 갇힘을 방지하기 위해 플레이트의 한쪽에서 다른 쪽으로 도포됩니다. (D) 다른 모든 줄은 인접한 우물의 오염을 방지하기 위한 실험에 사용됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 밀폐된 우물과 열린 우물에서의 움직임 비교. (A) 동작 단위에서 15분 평형 후 0분에서 4분까지의 총 자발적 이동을 비교합니다. 열린 우물(254mm, 95% CI: 185-322)과 밀폐된 우물(257mm, 95% CI: 186-326)에서 수정 5일 후(dpf) 제브라피쉬의 이동은 유의한 차이를 보이지 않습니다(P = 0.374). (B) 제브라피시 행동 시스템에서 15분의 적응 기간을 거친 후, 매 30분마다 물고기(N ≥ 36)의 자발적인 움직임(총 이동 거리)이 관찰됩니다. 데이터는 0-h 시점에 대한 통계적 비교(ANOVA)와 함께 퍼센트 제어(열린 우물)로 표시됩니다. P-값 임계값 <0.05를 사용하면 빨간색으로 강조 표시된 2시간 표시(P = 0.0139)에서 개방형 우물과 밀폐된 우물 간의 이동에서 상당한 차이가 관찰됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 시간 경과에 따른 세보플루란의 회복. 실리콘 접착제로 밀봉된 유리 웰 플레이트의 세보플루란 및 이소플루란의 농도는 3시간 동안 고성능 액체 크로마토그래피(HPLC)에 의해 측정됩니다. 3회 반복의 평균으로 계산된 회수율이 그래프의 아래쪽 부분에 표시되어 있습니다. Isoflurane은 3 시간에서 최대 4 %의 농도 손실을 보이며, 이는 sevoflurane (25 ° C에서 197 mmHg)에 비해 더 높은 증기압 (25 ° C에서 238 mmHg)으로 인한 것으로 보입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
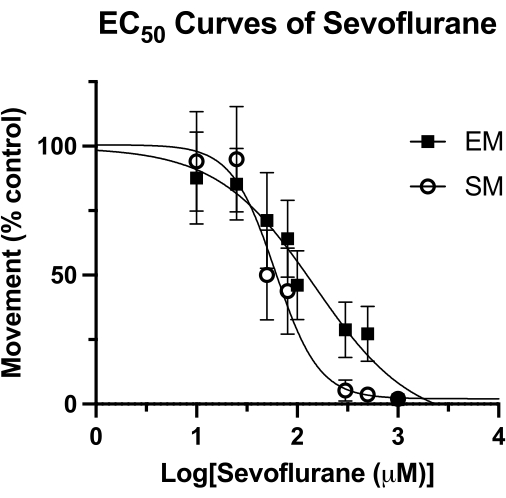
그림 4: Sevoflurane EC50 곡선. 밀폐된 웰의 sevoflurane EC50 곡선은 5dpf 제브라피시의 자발적인 움직임(4분 동안)과 유도된 움직임(음향 탭 후 1초 주기)을 기반으로 결정됩니다. 이동은 DMSO 전용 컨트롤로 조정됩니다. 최종 EC50 값은 자발적 운동(SM)의 경우 62μM(95% CI: 49-81), 유도 운동(EM)의 경우 126μM(95% CI: 81-193)로 계산됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 논문은 야생형 어류의 휘발성 마취 효능을 정량화하는 데 사용된 유충 제브라피쉬에 세보플루란과 같은 휘발성 마취제를 쉽게 투여하는 방법을 설명합니다. 이 기술은 개념적으로 간단하지만, 휘발성 물질의 손실을 최소화하기 위해 짧은 시간 내에 적절하게 밀봉되고 기포가 없는 웰 열을 보장하기 위해서는 연습이 필요할 수 있습니다. 이 방법은 휘발성 화합물을 위한 것이기 때문에 웰 플레이트에 실리콘 접착제를 신중하게 도포해야 할 뿐만 아니라 휘발성 화합물 농도의 정확도를 최적화하기 위해 실험 용액을 신중하게 준비해야 합니다.
공기가 갇히면 정확한 시각화 및 추적이 방해받을 수 있습니다. 밀봉을 연습하는 것 외에도 밀봉 전에 존재하는 기포가 밀봉 과정에서 제거될 가능성이 낮기 때문에 각 웰을 주의 깊게 채우고 검사하는 것이 중요합니다. 또한 우물을 과도하게 채우면 각 우물에 공기가 갇히는 것을 방지하는 데 도움이 됩니다. 그러나 너무 많이 채우면 물고기가 의도하지 않게 인접한 우물로 옮겨질 수 있습니다. 이 경우 과도하게 채우는 것을 줄이십시오. 과도한 과충전을 최소화하면 물고기가 의도하지 않게 인접한 우물로 이동하는 데 도움이 될 뿐만 아니라 많은 양의 과잉 용액이 있는 경우 밀봉에 사용되는 접착제의 효과를 향상시킬 수 있습니다. 접착제는 부분적으로 젖은 표면에 접착되는 능력 때문에 특별히 선택되었지만, 깨끗하고 건조한 플레이트부터 시작하면 다른 물질이 접착을 방해하지 않도록 하여 실험 설정의 전반적인 무결성을 향상시킬 수 있습니다. 접착제 도포 훨씬 전에 기포가 없음에도 불구하고 기포가 여전히 유지되는 경우, 과충진 최적화 및 실리콘 접착제 도포 기술은 너무 좁은 접착 스트립을 사용했기 때문일 수 있습니다. 충분히 넓지 않은 스트립은 밀봉되지 않거나 도포 과정 중 또는 후에 공기가 유입되는 것을 방지하기 위해 부적절하게 밀봉될 수 있습니다. 이 기술의 또 다른 잠재적인 오류는 접착 실리콘 스트립에 의해 생성되는 밀봉의 품질이며, 이는 실리콘의 주름, 접착제의 부적절한 밀봉(불충분한 접착 프라이머, 경화 시간 또는 실리콘 적용 전 표면 청소)으로 인해 발생할 수 있습니다. 접착제 자체가 충분히 단단한 밀봉을 제공하는 것처럼 보이지만 보호 지지대로서의 실리콘이 없으면 접착제만으로는 실험 기간 동안 순환하는 수조로부터 보호할 수 있는 적절한 내수성을 제공하지 못할 수 있습니다.
유리판은 많은 플라스틱(20)과 달리, 휘발성 마취제와 같은 소수성 물질과 호환되고, 표면이 평평하고(일반적인 플라스틱 웰 플레이트와 달리), 실리콘 스트립의 접착을 허용하고, 투명한 바닥을 갖기 때문에(테프론 및 일부 플라스틱 플레이트와 달리) 이 응용 분야에 매우 적합합니다. 석영 웰 플레이트는 고해상도 이미징이 필요한 실험에서 향상된 광학 선명도를 제공할 수 있습니다. 여기에 제시된 모든 예시 데이터는 96웰 유리판에서 얻은 것이며, 다른 유사한 플레이트는 더 큰 웰 형식으로 상업적으로 이용 가능하지만 저자는 이를 테스트하지 않았습니다. 더 큰 우물에 더 많은 용액이 있으면 산소의 가용성이 높아져 이 기술을 사용한 실험의 잠재적 기간이 늘어날 수 있고 더 오래된 제브라피시를 사용한 실험을 용이하게 할 수도 있지만 이러한 방식으로 실험을 수정하려면 추가 검증이 필요합니다. 이 기술의 다른 수정에는 다른 행동 패러다임(예: 빛과 같은 자극)21, 다양한 유전 모델, 다른 유형의 약리학적 연구(예: 약물 동시 투여) 및 아마도 이미징 연구를 위한 적응에 대한 이 기술의 적용이 포함됩니다.
이 방법은 행동 관찰을 위해 제브라피시에게 휘발성 화합물을 투여하는 간단하고 접근 가능한 방법을 제공합니다. 제브라피쉬는 마취제, 특히 정맥 주사(IV) 마취제(프로포폴, 에토미데이트, 케타민 등) 연구에서 점점 더 인기 있는 모델입니다. 이는 부분적으로는 약물 투여가 용이하기 때문이기도 하지만, 정상 투여를 위해 표적 제어 주입 모델이 필요한 비수생 동물 모델(벌레, 파리, 설치류, 인간 등)에 대한 IV 마취제 투여에 비해 약동학적 고려 사항이 적기 때문입니다2. 이것은 이 동물에게 휘발성 물질을 투여하는 것과 비슷하며, 이는 동물을 상자에 넣고 산소/공기와 혼합된 물질을 호흡하게 하는 것만큼 간단합니다. 수생 동물(제브라피시, 올챙이)에 휘발성 물질제를 투여하는 것은 밀폐된 수성 환경이 필요하기 때문에 더 복잡합니다. 이러한 차이는 특정 마취제에 대한 특정 동물 모델의 사용을 나누는 경향이 있지만, 여기에 제시된 방법을 사용하면 두 종류의 마취제를 동일한 동물 모델에 쉽게 전달할 수 있습니다. 서로 다른 투여 경로에도 불구하고 단일 모델에서 다양한 실험 패러다임을 쉽게 비교할 수 있습니다. 이것은 또한 생리학적 반응의 실시간 관찰을 용이하게 하는 제브라피쉬의 유전적 다루기, 빠른 발달 및 투명한 배아를 포함한 제브라피쉬의 다른 강점을 활용하는 방식으로 휘발성 마취제의 사용에 적용될 수 있습니다. 이소플루란(isoflurane) 및 세보플루란(sevoflurane)과 같은 휘발성 마취제가 제브라피쉬에 미치는 영향을 이해하면 제브라피쉬의 작용 기전과 부작용에 대한 이해를 높일 수 있습니다. 이 새로운 방법론은 제브라피시의 휘발성 마취제 연구를 위한 강력한 프레임워크를 제공합니다.
공개
저자는 공개할 충돌이 없습니다.
감사의 말
이 연구는 마취 교육 및 연구 재단(FAER)의 자금 지원을 받았습니다. 그림 1 은 BioRender.com 에서 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
참고문헌
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유