Method Article
Somministrazione di anestetici volatili a larve di pesce zebra per l'osservazione comportamentale
In questo articolo
Riepilogo
Questo protocollo presenta un metodo accessibile per creare un ambiente a tenuta di gas per somministrare anestetici volatili a larve di pesce zebra per esperimenti comportamentali.
Abstract
Questo studio descrive un metodo unico per la somministrazione di anestetici volatili, come isoflurano e sevoflurano, alle larve di pesce zebra durante gli esperimenti comportamentali. Mentre il pesce zebra offre numerosi vantaggi come organismo modello di vertebrato - tra cui comportamenti complessi, trattabilità genetica, embrioni trasparenti e sviluppo rapido - il loro uso nello studio degli anestetici volatili è stato limitato. La somministrazione di anestetici volatili richiede spesso apparati complessi o ingombranti che potrebbero non essere ampiamente accessibili, creando barriere allo studio farmacologico degli anestetici volatili in organismi modello acquosi. Questo metodo presenta una tecnica semplice che utilizza fogli di silicone adesivi per creare una tenuta stagna sui piatti di vetro a 96 pozzetti. La validazione è stata eseguita attraverso la valutazione del movimento spontaneo, che non ha mostrato differenze significative tra pozzetti sigillati e aperti per un periodo di 90 minuti. Inoltre, la concentrazione di anestetico è rimasta stabile nel tempo, come misurato mediante HPLC. I risultati rappresentativi includono la determinazione sperimentale dei valori di concentrazione efficace mediana (EC50) per il sevoflurano. Questo studio fornisce un approccio semplice e accessibile per esperimenti farmacologici che utilizzano anestetici volatili, che possono essere facilmente adattati per studiare altri agenti volatili e endpoint sperimentali.
Introduzione
I modelli animali non acquatici (vermi, mosche, roditori, conigli, primati, ecc.) sono stati storicamente i modelli più comunemente utilizzati per studiare la farmacologia anestetica. In ciascuna di queste specie, gli anestetici volatili (somministrati attraverso l'inalazione di gas) sono molto meno impegnativi rispetto alla somministrazione di anestetici per via endovenosa (somministrati per via endovenosa o intraperitoneale)1. Oltre alla sfida tecnica della semplice somministrazione dei farmaci per via endovenosa, raggiungere uno stato di anestesia costante è molto più facile con gli agenti volatili che con gli agenti per via endovenosa2.
La somministrazione di anestetici per via endovenosa a specie acquatiche larvali può essere ottenuta per diffusione dal mezzo acquoso circostante 3,4, ed è quindi più simile alla somministrazione di anestetici volatili per specie non acquose. Per molti anni, i girini (Xenopus laevis) sono stati il modello di scelta per lo studio degli anestetici grazie alla facilità di somministrazione dei farmaci e alla farmacocinetica allo stato stazionario ottenuta con la semplice aggiunta dell'anestetico all'acqua del laghetto artificiale 5,6. Tuttavia, ci sono relativamente pochi esempi di studio degli anestetici volatili in questo modello a causa della necessità di apparati a tenuta di gas che sono spesso costruiti appositamente e possono essere ingombranti da usare 7,8.
Negli ultimi anni, il pesce zebra è diventato un modello preferito per lo studio degli anestetici per via endovenosa a causa della stessa facilità di somministrazione del farmaco oltre ad altri vantaggi come i loro comportamenti complessi ben descritti e la disponibilità di unità commerciali per osservare questi comportamenti9. Molti studi recenti hanno impiegato tali unità di osservazione disponibili in commercio per lo screening di composti neuroattivi, compresi gli anestetici, utilizzando formati di piastre a 96 e 24 pozzetti per quantificare il comportamento delle larve di zebrafish 4,10,11,12,13,14,15 . Gli stadi larvali sono particolarmente adatti per gli studi farmacologici grazie alla loro capacità di valutare molte risposte comportamentali, alle loro piccole dimensioni, all'elevata compatibilità con il rendimento e ai circuiti neurali ben caratterizzati 9,16,17. Tuttavia, una limitazione significativa in questi studi sugli anestetici nel modello di zebrafish è la relativa difficoltà nella somministrazione di anestetici volatili. Questa limitazione ha portato a scarsi esempi di confronto tra agenti volatili ed endovenosi 4,15,18. Essere in grado di studiare e confrontare facilmente entrambe le classi di anestetici in un unico modello animale aggiunge uno strumento importante per facilitare lo studio della farmacologia anestetica in tutte le classi.
Tradizionalmente, lo studio degli anestetici per via endovenosa in una specie acquatica ha richiesto apparecchiature specializzate, spesso personalizzate, che possono essere difficili da usare o potrebbero non essere sufficientemente a tenuta di gas per prevenire la perdita dell'anestetico per la durata dell'esperimento. La procedura qui descritta presenta un mezzo alternativo facilmente accessibile per produrre una tenuta stagna in una camera di vetro adatta per l'osservazione del comportamento larvale del pesce zebra utilizzando un'unità di osservazione commerciale (vedi Tabella dei materiali).
Protocollo
Tutti gli esperimenti sul pesce zebra sono stati condotti in conformità con i protocolli di utilizzo degli animali approvati dall'Institutional Animal Care and Use Committee (IACUC). I pesci zebra adulti sono stati mantenuti presso la struttura acquatica dell'Università della Pennsylvania sotto la supervisione dell'University Laboratory Animal Resources (ULAR). I pesci zebra selvatici pinna lunga di Tubinga sono stati allevati internamente per tutti gli esperimenti e mantenuti in condizioni di allevamento standard con un ciclo luce/buio di 13/11 ore fino a raggiungere i 5 giorni dopo la fecondazione (dpf). Gli esperimenti sono stati condotti utilizzando repliche biologiche, con frizioni derivate da coppie di accoppiamento distinte per garantire un'adeguata diversità biologica. I dettagli dei reagenti e delle attrezzature utilizzate in questo studio sono elencati nella Tabella dei materiali.
1. Fabbricazione di fogli adesivi in silicone
NOTA: Gli equivalenti di questo materiale (foglio di silicone più adesivo) possono essere reperiti in commercio, ma spesso con costi maggiori e minore disponibilità.
- Stendere il foglio di silicone da 0,5 mm su una superficie piana e pulita.
- Ispeziona i fogli per eventuali pieghe ed evitale quando possibile.
NOTA: I fogli di silicone con pieghe potrebbero non aderire adeguatamente al nastro e potrebbero causare una sigillatura inadeguata dei pozzetti e/o una scarsa visualizzazione del pesce zebra. - Pulisci le lenzuola con alcool al 70% per rimuovere olio o detriti e lasciarle asciugare.
- Utilizzando un applicatore, come un pennello, applicare uno strato sottile e uniforme di primer adesivo sul foglio di silicone. Per evitare un'applicazione eccessiva, lavorare in sezioni più piccole poiché il promotore adesivo si asciuga rapidamente (si fissa in 1-5 s).
NOTA: Senza questo promotore di adesione, il nastro non aderirà adeguatamente al foglio di silicone. - Una volta applicato il promotore adesivo, allineare il nastro biadesivo con il foglio di silicone con il supporto di carta rivolto verso l'alto.
- Applicare gradualmente il nastro sul silicone utilizzando un rullo per levigare la superficie e rimuovere le bolle d'aria (dopo l'applicazione iniziale, lavorare con il silicone rivolto verso l'alto aiuterà a visualizzare e rimuovere le bolle d'aria).
- Lasciare indurire completamente il promotore adesivo per 24 ore su una superficie piana.
- Tagliare il silicone adesivo in strisce larghe almeno 10 mm (diametro del pozzetto 7,5 mm più sovrapposizione su ciascun lato).
NOTA: Quando si utilizza una fila ogni due file della piastra del pozzetto, una varianza più ampia delle strisce non avrà un impatto negativo sui pozzetti nelle file adiacenti, il che potrebbe non solo facilitare l'applicazione, ma anche essere necessario per ottenere una tenuta attorno all'intera circonferenza del pozzetto.- Assicurarsi che le strisce siano sufficientemente lunghe da coprire almeno la larghezza di una fila della piastra a pozzetti.
NOTA: Se si utilizza una piastra a pozzetti che non è a 96 pozzetti, come una piastra a 24 o 48 pozzetti, le dimensioni della striscia possono essere regolate o tagliate per adattarsi alle dimensioni specifiche della piastra, garantendo una copertura adeguata indipendentemente dalle dimensioni della piastra.
- Assicurarsi che le strisce siano sufficientemente lunghe da coprire almeno la larghezza di una fila della piastra a pozzetti.
2. Preparazione delle soluzioni
NOTA: Tutte le soluzioni madre e di dosaggio di anestetici volatili sono state preparate subito prima dell'esperimento per evitare la perdita di concentrazione di composti volatili.
- Per ogni soluzione (madre o soluzione di lavoro), aggiungere un volume di solvente non volatile (acqua embrionale E3, DMSO, ecc.) a una fiala HPLC o a scintillazione che, se combinata con la diluizione finale dell'anestetico volatile, il volume totale riempirà sufficientemente la fiala lasciando uno spazio di testa minimo (vedere Figura 1A).
- Aggiungere l'anestetico volatile con una siringa a tenuta di gas Hamilton e sigillare rapidamente la fiala.
NOTA: Le soluzioni madre in fiale con coperchi a setto possono essere utilizzate per facilitare ulteriori diluizioni tramite il trasferimento della soluzione con siringhe a tenuta di gas. - Quindi, mescolare le fiale (vortice, sonicazione) secondo necessità e conservarle temporaneamente durante la preparazione dei piatti di zebrafish.
3. Impostazione dell'esperimento comportamentale
NOTA: questo passaggio del protocollo potrebbe richiedere un po' di pratica. Si consiglia di lavorare senza pesce o soluzioni contenenti materiale prezioso fino a quando non si è abituati alla tecnica.
- Trasferire una larva di zebrafish (5 dpf) in ogni altra fila della piastra di vetro a 96 pozzetti.
NOTA: Lasciare vuote le due file consente di ridurre il potenziale di contaminazione dei pozzi adiacenti da spillover, poiché i pozzetti sono sigillati nella fase 3.4. - Rimuovere con cautela la soluzione E3 da ciascun pozzetto. Questo può essere fatto una fila alla volta o su tutta la piastra se è in grado di lavorare velocemente.
NOTA: La durata per la quale le larve sono rimaste fuori dalla soluzione è stata ridotta al minimo per ridurre il potenziale stress. Procedure alternative possono essere utilizzate in base alle diverse esigenze sperimentali, inclusa la rimozione solo parziale della soluzione prima dell'aggiunta della soluzione contenente il farmaco per ridurre al minimo lo stress. Il protocollo deve essere adattato per soddisfare le esigenze dell'esperimento, compreso il tempo di equilibrio dato agli animali per compensare qualsiasi potenziale stress, l'efficienza di miscelazione della soluzione e l'accuratezza delle concentrazioni di una soluzione contenente farmaco, se non tutto l'E3 viene rimosso prima dell'aggiunta della soluzione di lavoro. - Quindi, utilizzare una pipetta di trasferimento per riempire ogni pozzetto della fila con la soluzione sperimentale. Fare attenzione a non introdurre bolle. Riempire eccessivamente ogni pozzetto (Figura 1B).
- Utilizzando le strisce adesive in silicone realizzate al punto 1, premere rapidamente la striscia verso il basso (Figura 1C). Questo aiuta a prevenire la formazione di bolle e impedisce ai pesci di traboccare nei pozzi adiacenti.
- Premere con decisione sulla parte superiore della piastra per assicurarsi che ogni pozzetto sia sigillato.
- Ripetere i passaggi da 2 a 5 fino a quando la soluzione non viene sostituita e i pozzetti per ogni altra fila della piastra del pozzetto sono sigillati (Figura 1D).
- Capovolgere delicatamente la piastra e verificare la presenza di bolle d'aria.
NOTA: La presenza di bolle d'aria oscurerà la visualizzazione del movimento del pesce zebra. - Posizionare la piastra nell'unità di osservazione del comportamento (lato adesivo siliconico rivolto verso il basso) ed eseguire l'esperimento comportamentale (vedere la sezione Risultati per i dettagli).
Risultati
Confronto con l'osservazione tradizionale a pozzo aperto
Al fine di valutare se la sigillatura adesiva ha un effetto sul movimento spontaneo, è stato effettuato un confronto tra i controlli nei pozzetti aperti e quelli sigillati. Come si vede nella Figura 2A, non è stata osservata alcuna differenza statisticamente significativa nel movimento tra questi gruppi per la durata standard di ~30 minuti utilizzata negli esperimenti descritti in questo articolo. Riconoscendo che altri paradigmi sperimentali potrebbero richiedere un'esposizione sperimentale più lunga, è stato eseguito un corso temporale di 2 ore, che non ha rivelato alcuna differenza statistica nel movimento fino al segno delle 2 ore (vedi Figura 2B). Una maggiore durata sperimentale comporterebbe probabilmente un differenziale di movimento ancora maggiore. Studi precedenti hanno quantificato l'effetto avverso dell'ipossia sul comportamento di nuoto19, compromettendo in ultima analisi l'integrità dei risultati sperimentali. Pertanto, si ipotizza che l'ipossia e/o la produzione di CO2 siano le cause più probabili di questa deviazione nel SM rispetto ai controlli a pozzo aperto. Sfortunatamente, la guarnizione a tenuta di gas che impedisce la perdita di anestetico volatile dal pozzetto chiuso impedisce anche la diffusione di altri gas dentro o fuori dalla soluzione chiusa. Questo, ovviamente, significa una diffusione limitata di CO2 e ossigeno in quanto sono rispettivamente prodotti e consumati dai pesci. Questa è una limitazione importante rispetto alla durata dell'esperimento possibile con questo metodo. È anche importante notare che con il tempo, piccole bolle iniziano a formarsi in pozzetti precedentemente privi di bolle, presumibilmente a causa del metabolismo. Tuttavia, durante i test, queste bolle non hanno ostacolato il tracciamento del pesce zebra da parte del software. Gli esperimenti fino a 1,5 ore (più il tempo di equilibrio) sembrano non avere alcun effetto significativo sul tracciamento SM di questi pesci zebra wild-type, ma i pesci che mostrano più movimento o hanno altre maggiori richieste metaboliche potrebbero non essere adatti per esperimenti di questa lunghezza.
Concentrazione volatile di anestetico nel tempo
Per garantire una concentrazione costante di anestetico volatile nel tempo, sono stati utilizzati pozzetti senza zebrafish per misurare l'andamento temporale della concentrazione di anestetico determinato mediante HPLC. La stessa soluzione è stata aggiunta a ciascun pozzetto e la concentrazione di sevoflurano o isoflurano è stata misurata ogni 15 minuti per 3 ore (ogni misurazione da un pozzetto diverso, al contrario delle misurazioni ripetute dallo stesso pozzetto). Come si può vedere nella Figura 3, praticamente nessun anestetico è stato perso durante il corso del tempo con il sevoflurano (pressione di vapore di 197 mmHg a 25 °C), che ha una pressione di vapore inferiore rispetto all'isoflurano (pressione di vapore di 238 mmHg a 25 °C) che ha mostrato una perdita del 4% a 3 ore. Nessuno dei due anestetici volatili ha mostrato una perdita apprezzabile nell'intervallo da 30 a 60 minuti, che è tipico di molti esperimenti comportamentali.
Potenza del sevoflurano nelle larve di pesce zebra
Questa tecnica è stata utilizzata per misurare la potenza degli anestetici volatili nel pesce zebra15 e può essere superiore ad altre metodologie precedentemente utilizzate4. La concentrazione efficace mediana (EC50) per il sevoflurano mediante misure di movimento spontaneo (SM) e movimento suscitato (EM) è mostrata nella Figura 4. Con la tecnica a pozzetti sigillati, sono stati determinati valori di EC50 di 62 μM (IC 95%: 49-81) per SM e 126 μM (IC 95%: 81-193) per EM. Il valore SM è paragonabile all'EC50 precedentemente riportato di 76 μM (IC 95%: 50-114). Tuttavia, il valore precedentemente riportato di 240 μM (IC 95%: 169-328) per EM è quasi il doppio del valore ottenuto qui4. Senza eseguire uno studio HPLC simile di questa metodologia (grasso sottovuoto e vetrino coprioggetti per creare una tenuta ermetica), non si può dire con certezza se questa differenza sia dovuta a una perdita di anestetico volatile nel tempo. Si tratta comunque di un'ipotesi razionale, soprattutto se si considera che lo stimolo per EM (acustica) viene registrato al termine del tempo di osservazione comportamentale. Indipendentemente dal metodo di sigillatura del pozzo, qualsiasi perdita di concentrazione di sevoflurano avrebbe l'effetto maggiore nei punti temporali successivi. Naturalmente, queste differenze potrebbero essere dovute ad altri fattori sottostanti, come il background genetico del pesce zebra.
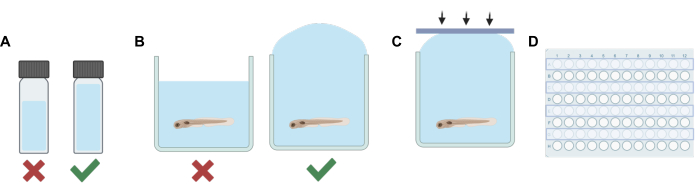
Figura 1: Passaggi procedurali chiave. (A) Quando si lavora con soluzioni volatili, la pianificazione della diluizione viene eseguita per ridurre al minimo lo spazio di testa in ciascuna fiala. (B) Il riempimento eccessivo dei pozzetti viene eseguito quando si aggiungono soluzioni sperimentali a quelli contenenti pesce zebra per eliminare le bolle d'aria. (C) Le strisce adesive in silicone vengono applicate da un lato all'altro della piastra per evitare l'intrappolamento dell'aria. (D) Ogni altra fila viene utilizzata per esperimenti volti a prevenire la contaminazione dei pozzi adiacenti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Confronto del movimento nei pozzetti sigillati rispetto a quelli aperti. (A) Viene confrontato il movimento spontaneo totale da 0 min a 4 min dopo un equilibrio di 15 minuti nell'unità comportamentale. Il movimento di 5 giorni dopo la fecondazione (dpf) in pozzetti aperti (254 mm, IC 95%: 185-322) e pozzetti sigillati (257 mm, IC 95%: 186-326) non mostra una differenza significativa (P = 0,374). (B) Dopo un periodo di acclimatazione di 15 minuti nel sistema comportamentale del pesce zebra, i pesci (N ≥ 36) vengono osservati per il movimento spontaneo (distanza totale percorsa) per un periodo di 4 minuti all'inizio di ogni mezz'ora. I dati sono mostrati come controllo percentuale (pozzi aperti), con confronti statistici (ANOVA) effettuati con il punto temporale 0-h. Utilizzando una soglia del valore P di <0,05, si osserva una differenza significativa nel movimento tra pozzetti aperti e sigillati al segno delle 2 ore (P = 0,0139), evidenziato in rosso. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Recupero del sevoflurano nel tempo. Le concentrazioni di sevoflurano e isoflurano nelle piastre a pozzetti di vetro sigillate con adesivo siliconico sono determinate mediante cromatografia liquida ad alta prestazione (HPLC) per un periodo di 3 ore. La percentuale di recupero, calcolata come media di tre repliche, è mostrata nella parte inferiore del grafico. L'isoflurano mostra una perdita di concentrazione fino al 4% a 3 ore, probabilmente a causa della sua maggiore pressione di vapore (238 mmHg a 25 °C) rispetto al sevoflurano (197 mmHg a 25 °C). Clicca qui per visualizzare una versione più grande di questa figura.
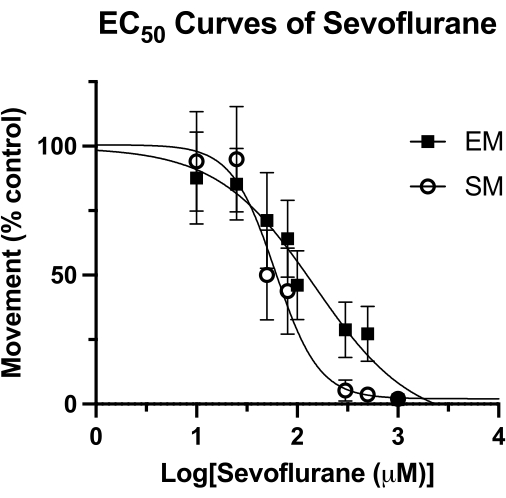
Figura 4: Curve del sevoflurano EC50 . Una curva EC50 del sevoflurano in pozzetti sigillati viene determinata in base al movimento spontaneo (per un periodo di 4 minuti) e al movimento suscitato (periodo di 1 secondo dopo un tocco acustico) di 5 dpf zebrafish. Il movimento viene ridimensionato in base ai soli controlli DMSO. Il valore finale di EC50 è calcolato come 62 μM (IC 95%: 49-81) per il movimento spontaneo (SM) e 126 μM (IC 95%: 81-193) per il movimento suscitato (EM). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo articolo descrive un metodo per somministrare prontamente anestetici volatili, come il sevoflurano, alle larve di pesce zebra, che è stato utilizzato per quantificare la potenza dell'anestetico volatile nei pesci selvatici. Sebbene questa tecnica sia concettualmente semplice, può essere necessaria la pratica per garantire una fila di pozzetti adeguatamente sigillata e priva di bolle in un breve lasso di tempo per ridurre al minimo la perdita di agenti volatili. Poiché questo metodo è destinato ai composti volatili, richiede non solo un'attenta applicazione dell'adesivo siliconico sulla piastra del pozzetto, ma anche un'attenta preparazione di soluzioni sperimentali per ottimizzare l'accuratezza delle concentrazioni di composti volatili.
L'intrappolamento dell'aria può inibire una visualizzazione e un tracciamento accurati. Oltre alla pratica di sigillatura, è fondamentale un accurato riempimento e ispezione di ogni pozzetto, poiché è improbabile che eventuali bolle presenti prima della sigillatura vengano rimosse durante il processo di sigillatura. Il riempimento eccessivo dei pozzi aiuta anche a prevenire l'intrappolamento dell'aria in ogni pozzo. Tuttavia, un riempimento eccessivo può portare al trasferimento involontario di pesci nei pozzi adiacenti. Se ciò accade, prova a riempire troppo di meno. Ridurre al minimo l'eccesso di riempimento non solo aiuterà il trasferimento involontario dei pesci nei pozzetti adiacenti, ma può migliorare l'efficacia dell'adesivo utilizzato per sigillare in presenza di grandi quantità di soluzione in eccesso. Sebbene l'adesivo sia stato scelto specificamente in parte per la sua capacità di aderire alle superfici bagnate, iniziare con una piastra pulita e asciutta garantisce che nessun'altra sostanza interferisca con l'adesione, migliorando così l'integrità complessiva della configurazione sperimentale. Se le bolle persistono nonostante la mancanza di bolle ben prima dell'applicazione dell'adesivo, l'ottimizzazione del riempimento eccessivo e la tecnica di applicazione dell'adesivo siliconico, ciò potrebbe essere dovuto all'uso di strisce adesive troppo strette. Le strisce non sufficientemente larghe potrebbero non sigillare o sigillare in modo inadeguato per evitare l'introduzione di aria durante o dopo il processo di applicazione. Un'altra potenziale introduzione di errore con questa tecnica è la qualità della tenuta prodotta dalle strisce di silicone adesive, che può essere causata da pieghe nel silicone, sigillatura inadeguata dell'adesivo (primer adesivo insufficiente, tempo di polimerizzazione o pulizia delle superfici prima dell'applicazione del silicone). Sebbene l'adesivo stesso sembri fornire una tenuta sufficientemente stretta, senza il silicone come supporto protettivo, l'adesivo da solo potrebbe non riuscire a fornire un'adeguata resistenza all'acqua per proteggere dal bagno d'acqua circolante per tutta la durata di un esperimento.
Le lastre di vetro sono adatte per questa applicazione poiché, a differenza di molte materie plastiche20, sono compatibili con sostanze idrofobiche come gli anestetici volatili, la loro superficie è piatta (a differenza delle tipiche piastre in plastica), consentendo l'adesione della striscia di silicone, e hanno fondi trasparenti (a differenza del teflon e di alcune lastre di plastica). Le piastre a pozzetti in quarzo possono fornire una maggiore chiarezza ottica per gli esperimenti in cui è giustificata l'imaging a risoluzione più elevata. Tutti i dati di esempio qui presentati sono stati ottenuti in lastre di vetro a 96 pozzetti e altre piastre simili sono disponibili in commercio in formati di pozzetti più grandi, ma questi non sono stati testati dagli autori. Più soluzioni in un pozzo più grande possono aumentare la durata potenziale di un esperimento con questa tecnica a causa della maggiore disponibilità di ossigeno e possono anche facilitare gli esperimenti con pesci zebra più anziani, ma la modifica di un esperimento in questo modo richiederebbe un'ulteriore convalida. Altre modifiche di questa tecnica includono l'applicazione di questa tecnica ad altri paradigmi comportamentali (ad esempio, stimoli come la luce)21, vari modelli genetici, altri tipi di studi farmacologici (ad esempio, la co-somministrazione di farmaci) e forse anche l'adattamento per studi di imaging.
Questo metodo fornisce un metodo semplice e accessibile per la somministrazione di composti volatili al pesce zebra ai fini dell'osservazione comportamentale. I pesci zebra sono un modello sempre più popolare per lo studio degli anestetici, in particolare degli anestetici per via endovenosa (IV) (propofol, etomidato, ketamina, ecc.). Ciò è in parte dovuto alla facilità di somministrazione del farmaco, ma ci sono anche considerazioni farmacocinetiche ridotte rispetto alla somministrazione di anestetici endovenosi a modelli animali non acquatici (vermi, mosche, roditori, esseri umani, ecc.) che richiedono modelli di infusione controllati da target per la somministrazione allo stato stazionario2. Questo è paragonabile alla somministrazione di agenti volatili in questi animali, che è semplice come mettere l'animale in una scatola e fargli respirare l'agente mescolato con ossigeno/aria. La somministrazione di agenti volatili agli animali acquatici (zebrafish, girini) è più complicata poiché richiede un ambiente acquoso sigillato. Questo differenziale tende a dividere l'uso di alcuni modelli animali per determinati anestetici, ma con il metodo qui presentato, entrambe le classi di anestetici possono essere facilmente somministrate allo stesso modello animale. Essere in grado di confrontare facilmente vari paradigmi sperimentali in un unico modello nonostante le diverse vie di somministrazione. Questo potrebbe anche essere adattato per l'uso di anestetici volatili in un modo che utilizzi gli altri punti di forza del pesce zebra, tra cui la loro trattabilità genetica, il rapido sviluppo e gli embrioni trasparenti, che facilitano l'osservazione in tempo reale delle risposte fisiologiche. Comprendere l'impatto degli anestetici volatili, come l'isoflurano e il sevoflurano, nel pesce zebra può migliorare la comprensione dei loro meccanismi d'azione e degli effetti collaterali. Questa nuova metodologia fornisce un solido quadro per lo studio degli anestetici volatili nel pesce zebra.
Divulgazioni
Gli autori non hanno conflitti da rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dalla Foundation for Anesthesia Education and Research (FAER). La Figura 1 viene creata in BioRender.com.
Materiali
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Riferimenti
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon