Method Article
Administración de anestésicos volátiles a larvas de pez cebra para observación del comportamiento
En este artículo
Resumen
Este protocolo presenta un método accesible para crear un entorno hermético al gas para administrar anestésicos volátiles a las larvas de pez cebra para experimentos de comportamiento.
Resumen
Este estudio describe un método único para administrar anestésicos volátiles, como el isoflurano y el sevoflurano, a larvas de pez cebra durante experimentos de comportamiento. Si bien el pez cebra ofrece numerosas ventajas como organismo modelo vertebrado, incluidos comportamientos complejos, trazabilidad genética, embriones transparentes y desarrollo rápido, su uso en el estudio de anestésicos volátiles ha sido limitado. La administración de anestésicos volátiles a menudo requiere aparatos complejos o engorrosos que pueden no ser ampliamente accesibles, lo que crea barreras para el estudio farmacológico de los anestésicos volátiles en organismos modelo acuosos. Este método presenta una técnica sencilla que utiliza láminas de silicona adhesivas para crear un sello hermético al gas en placas de vidrio de 96 pocillos. La validación se realizó a través de la evaluación del movimiento espontáneo, que no mostró diferencias significativas entre pozos sellados y abiertos durante un período de 90 minutos. Además, la concentración de anestésico se mantuvo estable a lo largo del tiempo, medida por HPLC. Los resultados representativos incluyen la determinación experimental de los valores medios de concentración efectiva (EC50) para el sevoflurano. Este estudio proporciona un enfoque simple y accesible para experimentos farmacológicos que utilizan anestésicos volátiles, que se puede adaptar fácilmente para estudiar otros agentes volátiles y criterios de valoración experimentales.
Introducción
Los modelos animales no acuáticos (gusanos, moscas, roedores, conejos, primates, etc.) han sido históricamente los modelos más utilizados para estudiar la farmacología anestésica. En cada una de estas especies, los anestésicos volátiles (administrados por inhalación de gas) son mucho menos desafiantes que la administración de anestésicos intravenosos (administrados por vía intravenosa o intraperitoneal)1. Además del desafío técnico de la simple administración de los medicamentos intravenosos, lograr un estado estable de anestesia es mucho más fácil con agentes volátiles que con agentes intravenosos2.
La administración de anestésicos intravenosos a las larvas de especies acuáticas puede lograrse por difusión desde el medio acuoso circundante 3,4 y, por lo tanto, es más similar a la administración de anestésicos volátiles para especies no acuosas. Durante muchos años, los renacuajos (Xenopus laevis) fueron el modelo de elección para el estudio de los anestésicos debido a la facilidad de administración del fármaco y a la farmacocinética en estado estacionario lograda mediante la simple adición del anestésico en un baño al agua de su estanque artificial 5,6. Sin embargo, existen relativamente pocos ejemplos del estudio de anestésicos volátiles en este modelo debido a la necesidad de aparatos herméticos al gas que a menudo están construidos específicamente y pueden ser engorrosos de usar 7,8.
En los últimos años, el pez cebra se ha convertido en un modelo preferido para el estudio de los anestésicos intravenosos debido a la misma facilidad de administración de fármacos, además de otras ventajas como sus comportamientos complejos bien descritos y la disponibilidad de unidades comerciales para observar estos comportamientos9. Muchos estudios recientes han empleado estas unidades de observación disponibles comercialmente para detectar compuestos neuroactivos, incluidos los anestésicos, utilizando formatos de placa de 96 y 24 pocillos para cuantificar el comportamiento de las larvas de pez cebra 4,10,11,12,13,14,15 . Los estadios larvarios son particularmente adecuados para estudios de farmacología debido a su capacidad para evaluar muchas respuestas conductuales, su pequeño tamaño, su alta compatibilidad de rendimiento y sus circuitos neuronales bien caracterizados 9,16,17. Sin embargo, una limitación significativa en estos estudios de anestésicos en el modelo de pez cebra es la relativa dificultad en la administración de anestésicos volátiles. Esta limitación ha llevado a escasos ejemplos de comparación entre agentes volátiles e intravenosos 4,15,18. La posibilidad de estudiar y comparar fácilmente ambas clases de anestésicos en un solo modelo animal añade una herramienta importante para facilitar el estudio de la farmacología anestésica en todas las clases.
Tradicionalmente, el estudio de los anestésicos intravenosos en una especie acuática ha requerido un equipo especializado, a menudo personalizado, que puede ser difícil de usar o puede no ser lo suficientemente hermético al gas para evitar la pérdida del anestésico durante la duración del experimento. El procedimiento descrito aquí presenta un medio alternativo fácilmente accesible para producir un sello hermético al gas en una cámara de vidrio que es adecuado para la observación del comportamiento de las larvas de pez cebra utilizando una unidad de observación comercial (ver Tabla de Materiales).
Protocolo
Todos los experimentos con pez cebra se llevaron a cabo de acuerdo con los protocolos de uso animal aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC). Los peces cebra adultos se mantuvieron en las instalaciones acuáticas de la Universidad de Pensilvania bajo la supervisión de los Recursos Animales de Laboratorio de la Universidad (ULAR). El pez cebra salvaje de aleta larga de Tübingen se crió internamente para todos los experimentos y se mantuvo en condiciones de cría estándar con un ciclo de luz/oscuridad de 13/11 h hasta que alcanzaron los 5 días posteriores a la fertilización (dpf). Los experimentos se llevaron a cabo utilizando réplicas biológicas, con nidadas derivadas de distintas parejas de apareamiento para garantizar una diversidad biológica adecuada. Los detalles de los reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Fabricación de láminas adhesivas de silicona
NOTA: Los equivalentes de este material (lámina de silicona más adhesivo) se pueden obtener comercialmente, pero a menudo a un costo mayor y menor disponibilidad.
- Extiende la lámina de silicona de 0,5 mm sobre una superficie limpia y plana.
- Inspeccione las sábanas en busca de arrugas y evítelas cuando sea posible.
NOTA: Es posible que las láminas de silicona con pliegues no se adhieran adecuadamente a la cinta y pueden resultar en un sellado inadecuado de los pocillos y / o una mala visualización del pez cebra. - Limpie las sábanas con alcohol al 70% para eliminar el aceite o los residuos y deje que se sequen.
- Con un aplicador, como un pincel, aplique una capa delgada y uniforme de imprimación adhesiva a la lámina de silicona. Para evitar la aplicación excesiva, trabaje en secciones más pequeñas, ya que el promotor adhesivo se seca rápidamente (se endurece en 1-5 segundos).
NOTA: Sin este promotor de adhesión, la cinta no se adherirá adecuadamente a la lámina de silicona. - Una vez que se aplica el promotor adhesivo, alinee la cinta de doble capa con la lámina de silicona con el respaldo del papel hacia arriba.
- Aplique gradualmente la cinta a la silicona con un rodillo para alisar la superficie y eliminar las burbujas de aire (después de la aplicación inicial, trabajar con el lado de la silicona hacia arriba ayudará a visualizar y eliminar las burbujas de aire).
- Deje que el promotor adhesivo se cure completamente durante 24 horas sobre una superficie plana.
- Corta la silicona adhesiva en tiras de al menos 10 mm de ancho (7,5 mm de diámetro de pocillo más solapamiento en cada lado).
NOTA: Cuando se usa cada dos filas de la placa de pocillos, una variación más amplia en las tiras no afectará negativamente a los pozos en las filas adyacentes, lo que no solo puede facilitar la aplicación, sino que también puede ser necesario para lograr un sellado alrededor de toda la circunferencia del pozo.- Asegúrese de que las tiras sean lo suficientemente largas como para cubrir al menos el ancho de una fila de la placa del pocillo.
NOTA: Si se utiliza una placa de pocillos que no es de 96 pocillos, como una placa de 24 o 48 pocillos, los tamaños de las tiras se pueden ajustar o cortar para que se ajusten a las dimensiones específicas de la placa, asegurando una cobertura adecuada independientemente del tamaño de la placa.
- Asegúrese de que las tiras sean lo suficientemente largas como para cubrir al menos el ancho de una fila de la placa del pocillo.
2. Preparación de soluciones
NOTA: Todas las soluciones de stock y ensayo de anestésicos volátiles se prepararon justo antes del experimento para evitar la pérdida de concentración de compuestos volátiles.
- Para cada solución (madre o solución de trabajo), agregue un volumen de solvente no volátil (agua de embrión E3, DMSO, etc.) a un vial de HPLC o centelleo que, cuando se combine con la dilución final de anestésico volátil, el volumen total llenará suficientemente el vial dejando un espacio de cabeza mínimo (ver Figura 1A).
- Agregue anestésico volátil con una jeringa hermética al gas Hamilton y selle rápidamente el vial.
NOTA: Las soluciones madre en viales con tapas de tabique se pueden utilizar para facilitar diluciones adicionales mediante la transferencia de la solución con jeringas herméticas al gas. - A continuación, mezcle los viales (vórtice, sonicación) según sea necesario y guárdelos temporalmente mientras prepara las placas de pez cebra.
3. Configuración del experimento conductual
NOTA: Este paso del protocolo puede requerir algo de práctica. Se recomienda trabajar sin peces ni soluciones que contengan materiales preciosos hasta que se sienta cómodo con la técnica.
- Transfiera una larva de pez cebra (5 dpf) a cada dos filas de la placa de vidrio de 96 pocillos.
NOTA: Dejar vacías todas las demás filas permite reducir el potencial de contaminación de los pozos adyacentes por derrame, ya que los pozos están sellados en el paso 3.4. - Retire con cuidado la solución E3 de cada pocillo. Esto se puede hacer una fila a la vez o en todo el plato si puede funcionar rápidamente.
NOTA: El tiempo durante el cual las larvas estuvieron fuera de la solución se minimizó para reducir el estrés potencial. Se pueden utilizar procedimientos alternativos basados en diferentes necesidades experimentales, incluida la eliminación parcial de la solución antes de la adición de la solución que contiene el fármaco para minimizar el estrés. El protocolo debe adaptarse a las necesidades del experimento, incluido el tiempo de equilibrio asignado a los animales para compensar cualquier estrés potencial, la eficiencia de la mezcla de la solución y la precisión de las concentraciones de una solución que contiene fármaco, si no se elimina todo el E3 antes de la adición de la solución de trabajo. - A continuación, utilice una pipeta de transferencia para llenar cada pocillo de la fila con la solución experimental. Tenga cuidado de no introducir burbujas. Sobrellene cada pozo (Figura 1B).
- Usando las tiras adhesivas de silicona hechas en el paso 1, presione la tira hacia abajo rápidamente (Figura 1C). Esto ayuda a prevenir la formación de burbujas y evita que los peces se desborden hacia los pozos adyacentes.
- Presione firmemente la parte superior de la placa para asegurarse de que cada pocillo esté sellado.
- Repita los pasos 2 a 5 hasta que se cambie la solución y se sellen los pocillos de cada dos filas de la placa de pocillos (Figura 1D).
- Dé la vuelta suavemente a la placa e inspeccione si hay burbujas de aire.
NOTA: La presencia de burbujas de aire oscurecerá la visualización del movimiento del pez cebra. - Coloque la placa en la unidad de observación del comportamiento (con el adhesivo de silicona hacia abajo) y realice el experimento de comportamiento (consulte la sección Resultados para obtener más detalles).
Resultados
Comparación con la observación tradicional de pozos abiertos
Con el fin de evaluar si el sellado adhesivo tiene algún efecto sobre el movimiento espontáneo, se realizó una comparación entre los controles en pozos abiertos versus sellados. Como se ve en la Figura 2A, no se observó una diferencia estadísticamente significativa en el movimiento entre estos grupos durante la duración estándar de ~ 30 minutos utilizada en los experimentos descritos en este artículo. Reconociendo que otros paradigmas experimentales podrían necesitar una exposición experimental más larga, se realizó un curso de tiempo de 2 horas, que no reveló diferencias estadísticas en el movimiento hasta la marca de 2 horas (ver Figura 2B). Una duración experimental más larga probablemente resultaría en un diferencial aún mayor en el movimiento. Estudios previos han cuantificado el efecto adverso de la hipoxia sobre el comportamiento de natación19, comprometiendo en última instancia la integridad de los resultados experimentales. Por lo tanto, se plantea la hipótesis de que la hipoxia y/o la producción de CO2 son las causas más probables de esta desviación en la MS en comparación con los controles de pozo abierto. Desafortunadamente, el sello hermético al gas que evita la pérdida de anestésico volátil del pozo cerrado también evita la difusión de otros gases dentro o fuera de la solución cerrada. Esto, por supuesto, significa una difusión restringida deCO2 y oxígeno, ya que son producidos y consumidos respectivamente por los peces. Esta es una limitación importante con respecto a la duración del experimento posible con este método. También es importante tener en cuenta que, con el tiempo, comienzan a formarse pequeñas burbujas en pozos previamente libres de burbujas, presumiblemente debido al metabolismo. Sin embargo, durante las pruebas, estas burbujas no obstaculizaron el seguimiento del pez cebra por parte del software. Los experimentos de hasta 1,5 h (más el tiempo de equilibrio) no parecen tener un efecto significativo en el seguimiento de SM de estos peces cebra de tipo salvaje, pero los peces que exhiben más movimiento o tienen otras demandas metabólicas aumentadas pueden no ser adecuados para experimentos de esta longitud.
Concentración de anestésicos volátiles a lo largo del tiempo
Para asegurar una concentración constante de anestésico volátil a lo largo del tiempo, se utilizaron pocillos sin pez cebra para medir un curso de tiempo de la concentración de anestésico determinado por HPLC. Se añadió la misma solución a cada pocillo y se midió la concentración de sevoflurano o isoflurano cada 15 min durante 3 h (cada medición desde un pocillo diferente, en lugar de repetir las mediciones desde el mismo pocillo). Como se puede observar en la Figura 3, prácticamente no se perdió anestésico durante todo el tiempo con el sevoflurano (presión de vapor de 197 mmHg a 25 °C), que tiene una presión de vapor menor que el isoflurano (presión de vapor de 238 mmHg a 25 °C) que mostró una pérdida del 4% a las 3 h. Ninguno de los anestésicos volátiles mostró una pérdida apreciable en el intervalo de 30 a 60 minutos, lo cual es típico de muchos experimentos conductuales.
Potencia del sevoflurano en larvas de pez cebra
Esta técnica ha sido utilizada para medir la potencia de los anestésicos volátiles en el pez cebra15, y puede ser superior a otras metodologías previamente utilizadas4. En la Figura 4 se muestra la mediana de la concentración efectiva (EC50) de sevoflurano mediante medidas de movimiento espontáneo (SM) y movimiento provocado (EM). Con la técnica de pocillo sellado se determinaron valores de EC50 de 62 μM (IC 95%: 49-81) para SM y 126 μM (IC 95%: 81-193) para EM. El valor de SM es comparable al EC50 reportado previamente de 76 μM (IC 95%: 50-114). Sin embargo, el valor previamente reportado de 240 μM (IC 95%: 169-328) para EM es casi el doble del valor obtenido aquí4. Sin realizar un estudio similar de HPLC de esta metodología (grasa al vacío y un cubreobjetos de vidrio para crear un sello hermético), no se puede decir con certeza si esta diferencia se debe a una pérdida de anestésico volátil con el tiempo. Sin embargo, es una hipótesis racional, sobre todo teniendo en cuenta que el estímulo para EM (golpeteo acústico) se registra al final del tiempo de observación conductual. Independientemente del método de sellado del pozo, cualquier pérdida de concentración de sevoflurano tendría el mayor efecto en puntos de tiempo posteriores. Por supuesto, estas diferencias podrían deberse a otros factores subyacentes, como los antecedentes genéticos del pez cebra.
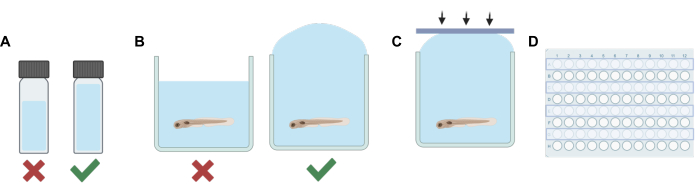
Figura 1: Pasos clave del procedimiento. (A) Cuando se trabaja con soluciones volátiles, la planificación de la dilución se realiza para minimizar el espacio libre en cada vial. (B) El sobrellenado de los pozos se realiza cuando se agregan soluciones experimentales a las que contienen pez cebra para eliminar las burbujas de aire. (C) Las tiras adhesivas de silicona se aplican de un lado a otro de la placa para evitar que el aire quede atrapado. (D) Cada dos hileras se utilizan para experimentos destinados a prevenir la contaminación de los pozos adyacentes. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Comparación del movimiento en pozos sellados versus pozos abiertos. (A) Se compara el movimiento espontáneo total de 0 min a 4 min siguiendo un equilibrio de 15 min en la unidad de comportamiento. El movimiento del pez cebra 5 días después de la fertilización (dpf) en pozos abiertos (254 mm, IC 95%: 185-322) y pozos sellados (257 mm, IC 95%: 186-326) no muestra una diferencia significativa (P = 0,374). (B) Después de un período de aclimatación de 15 minutos en el sistema de comportamiento del pez cebra, se observa el movimiento espontáneo de los peces (N ≥ 36) durante un período de 4 minutos al comienzo de cada media hora. Los datos se muestran como control porcentual (pozos abiertos), con comparaciones estadísticas (ANOVA) realizadas hasta el punto de tiempo 0-h. Utilizando un umbral de valor P de <0,05, se observa una diferencia significativa en el movimiento entre pozos abiertos y sellados en la marca de 2 h (P = 0,0139), resaltada en rojo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Recuperación del sevoflurano a lo largo del tiempo. Las concentraciones de sevoflurano e isoflurano en placas de pocillos de vidrio selladas con adhesivo de silicona se determinan mediante cromatografía líquida de alta resolución (HPLC) durante un período de 3 horas. El porcentaje de recuperación, calculado como el promedio de tres réplicas, se muestra en la parte inferior del gráfico. El isoflurano presenta una pérdida de concentración de hasta el 4% a las 3 h, probablemente debido a su mayor presión de vapor (238 mmHg a 25 °C) en comparación con el sevoflurano (197 mmHg a 25 °C). Haga clic aquí para ver una versión más grande de esta figura.
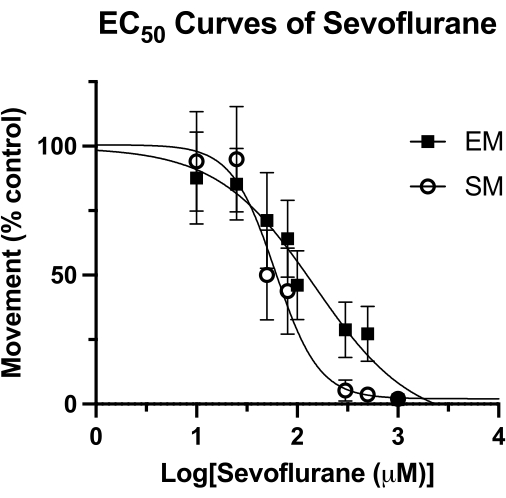
Figura 4: Curvas de Sevoflurano EC50 . Una curva EC50 de sevoflurano en pozos sellados se determina en función del movimiento espontáneo (durante un período de 4 minutos) y el movimiento provocado (1 segundo después de una toma acústica) de 5 dpf de pez cebra. El movimiento se escala a controles de solo DMSO. El valor final de EC50 se calcula como 62 μM (IC 95%: 49-81) para el movimiento espontáneo (SM) y 126 μM (IC 95%: 81-193) para el movimiento provocado (EM). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este artículo describe un método para administrar fácilmente anestésicos volátiles, como el sevoflurano, a larvas de pez cebra, que se utilizó para cuantificar la potencia de los anestésicos volátiles en peces de tipo salvaje. Aunque esta técnica es conceptualmente simple, puede llevar práctica garantizar una fila de pozos adecuadamente sellada y libre de burbujas en un corto período de tiempo para minimizar la pérdida de agentes volátiles. Debido a que este método está diseñado para compuestos volátiles, requiere no solo una aplicación cuidadosa del adhesivo de silicona a la placa del pocillo, sino también una preparación cuidadosa de soluciones experimentales para optimizar la precisión de las concentraciones de compuestos volátiles.
El atrapamiento de aire puede inhibir la visualización y el seguimiento precisos. Además de practicar el sellado, es fundamental un llenado e inspección cuidadosos de cada pozo, ya que es poco probable que las burbujas presentes antes del sellado se eliminen durante el proceso de sellado. El llenado excesivo de los pozos también ayuda a evitar el atrapamiento de aire en cada pozo. Sin embargo, un exceso de llenado excesivo puede provocar la transferencia involuntaria de peces a los pozos adyacentes. Si esto sucede, intente llenar menos en exceso. Minimizar el sobrellenado excesivo no solo ayudará a la transferencia involuntaria de peces a los pozos adyacentes, sino que también puede mejorar la eficacia del adhesivo utilizado para sellar en presencia de grandes cantidades de solución excesiva. Aunque el adhesivo se eligió específicamente en parte por su capacidad para adherirse a superficies húmedas, comenzar con una placa limpia y seca garantiza que ninguna otra sustancia interfiera con la adhesión, mejorando así la integridad general de la configuración experimental. Si las burbujas persisten a pesar de la falta de burbujas mucho antes de la aplicación del adhesivo, la optimización del sobrellenado y la técnica de aplicación del adhesivo de silicona, esto puede deberse al uso de tiras adhesivas que son demasiado estrechas. Es posible que las tiras que no son lo suficientemente anchas no sellen o se sellen inadecuadamente para evitar que se introduzca aire durante o después del proceso de aplicación. Otra posible introducción de errores con esta técnica es la calidad del sellado producido por las tiras adhesivas de silicona, que puede ser causada por pliegues en la silicona, sellado inadecuado del adhesivo (imprimación adhesiva insuficiente, tiempo de curado o limpieza de superficies antes de la aplicación de silicona). Aunque el adhesivo en sí parece proporcionar un sello suficientemente hermético, sin la silicona como respaldo protector, el adhesivo por sí solo puede no proporcionar una resistencia al agua adecuada para proteger contra el baño de agua circulante durante la duración de un experimento.
Las placas de vidrio son muy adecuadas para esta aplicación ya que, a diferencia de muchos plásticos20, son compatibles con sustancias hidrofóbicas como los anestésicos volátiles, su superficie es plana (a diferencia de las placas de plástico típicas), lo que permite la adhesión de la tira de silicona, y tienen fondos transparentes (a diferencia del teflón y algunas placas de plástico). Las placas de pocillos de cuarzo pueden proporcionar una mayor claridad óptica para experimentos en los que se justifica la obtención de imágenes de mayor resolución. Todos los datos de ejemplo presentados aquí se obtuvieron en placas de vidrio de 96 pocillos, y otras placas similares están disponibles comercialmente en formatos de pocillos más grandes, pero estos no fueron probados por los autores. Más soluciones en un pozo más grande puede aumentar la duración potencial de un experimento con esta técnica debido a una mayor disponibilidad de oxígeno y también puede facilitar los experimentos con peces cebra más viejos, pero la modificación de un experimento de esta manera requeriría una mayor validación. Otras modificaciones de esta técnica incluyen la aplicación de esta técnica a otros paradigmas conductuales (p. ej., estímulos como la luz)21, diversos modelos genéticos, otros tipos de estudios farmacológicos (p. ej., coadministración de fármacos) y quizás incluso la adaptación para estudios de imagen.
Este método proporciona un método simple y accesible para la administración de compuestos volátiles al pez cebra con el propósito de observar el comportamiento. El pez cebra es un modelo cada vez más popular para el estudio de los anestésicos, en particular los anestésicos intravenosos (IV) (propofol, etomidato, ketamina, etc.). Esto se debe, en parte, a la facilidad de administración del fármaco, pero también hay consideraciones farmacocinéticas reducidas en comparación con la administración de anestésicos intravenosos a modelos animales no acuáticos (gusanos, moscas, roedores, humanos, etc.) que requieren modelos de infusión controlada por objetivos para la administración en estado estacionario2. Esto es comparable a la administración de agentes volátiles en estos animales, que es tan simple como poner al animal en una caja y hacer que respire el agente mezclado con oxígeno/aire. La administración de agentes volátiles a animales acuáticos (pez cebra, renacuajos) es más complicada ya que requiere un ambiente acuoso sellado. Este diferencial tiende a dividir el uso de ciertos modelos animales para ciertos anestésicos, pero con el método presentado aquí, ambas clases de anestésicos pueden administrarse fácilmente al mismo modelo animal. Ser capaz de comparar fácilmente varios paradigmas experimentales en un solo modelo a pesar de las vías de administración dispares. Esto también podría adaptarse para el uso de anestésicos volátiles de una manera que utilice las otras fortalezas del pez cebra, incluida su trazabilidad genética, desarrollo rápido y embriones transparentes, que facilitan la observación en tiempo real de las respuestas fisiológicas. Comprender el impacto de los anestésicos volátiles, como el isoflurano y el sevoflurano, en el pez cebra puede mejorar la comprensión de sus mecanismos de acción y efectos secundarios. Esta novedosa metodología proporciona un marco sólido para la investigación de anestésicos volátiles en el pez cebra.
Divulgaciones
Los autores no tienen conflictos que revelar.
Agradecimientos
Este trabajo fue financiado por la Fundación para la Educación e Investigación en Anestesia (FAER). La figura 1 se crea en BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Referencias
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados