Method Article
Verabreichung von flüchtigen Anästhetika an Zebrafischlarven zur Verhaltensbeobachtung
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine zugängliche Methode zur Schaffung einer gasdichten Umgebung dar, um Zebrafischlarven für Verhaltensexperimente flüchtige Anästhetika zu verabreichen.
Zusammenfassung
Diese Studie beschreibt eine einzigartige Methode zur Verabreichung von flüchtigen Anästhetika wie Isofluran und Sevofluran an Zebrafischlarven während Verhaltensexperimenten. Während Zebrafische als Modellorganismus für Wirbeltiere zahlreiche Vorteile bieten - darunter komplexe Verhaltensweisen, genetische Rückverfolgbarkeit, transparente Embryonen und schnelle Entwicklung -, war ihr Einsatz bei der Erforschung flüchtiger Anästhetika bisher begrenzt. Die Verabreichung von flüchtigen Anästhetika erfordert oft komplexe oder umständliche Apparaturen, die möglicherweise nicht allgemein zugänglich sind, was zu Hindernissen für die pharmakologische Untersuchung von flüchtigen Anästhetika in wässrigen Modellorganismen führt. Diese Methode stellt eine einfache Technik dar, bei der selbstklebende Silikonfolien verwendet werden, um eine gasdichte Versiegelung auf 96-Well-Glasplatten zu erzeugen. Die Validierung erfolgte durch die Bewertung der spontanen Bewegung, die über einen Zeitraum von 90 Minuten keine signifikanten Unterschiede zwischen versiegelten und offenen Vertiefungen zeigte. Darüber hinaus blieb die Anästhesiekonzentration über die Zeit stabil, gemessen durch HPLC. Zu den repräsentativen Ergebnissen gehört die experimentelle Bestimmung der medianen effektiven Konzentration (EC50) für Sevofluran. Diese Studie bietet einen einfachen und zugänglichen Ansatz für pharmakologische Experimente mit flüchtigen Anästhetika, der leicht angepasst werden kann, um andere flüchtige Wirkstoffe und experimentelle Endpunkte zu untersuchen.
Einleitung
Nicht-Wassertiermodelle (Würmer, Fliegen, Nagetiere, Kaninchen, Primaten usw.) waren in der Vergangenheit die Modelle, die am häufigsten zur Untersuchung der Anästhesiepharmakologie verwendet wurden. Bei jeder dieser Spezies sind flüchtige Anästhetika (die durch Inhalation von Gas verabreicht werden) weitaus weniger schwierig als die Verabreichung von intravenösen Anästhetika (die entweder intravenös oder intraperitoneal verabreicht werden)1. Neben der technischen Herausforderung der einfachen Verabreichung der intravenösen Medikamente ist das Erreichen eines stationären Narkosezustands mit flüchtigen Mitteln viel einfacher als mit intravenösen Mitteln2.
Die Verabreichung von intravenösen Anästhetika an aquatische Larvenarten kann durch Diffusion aus ihrem umgebenden wässrigen Medium 3,4 erreicht werden und ist daher eher mit der Verabreichung von flüchtigen Anästhetika für nichtwässrige Spezies vergleichbar. Viele Jahre lang waren Kaulquappen (Xenopus laevis) das Modell der Wahl für die Erforschung von Anästhetika, da die Verabreichung des Medikaments einfach zu verabreichen war und die Pharmakokinetik im stationären Zustand durch einfache Badzugabe des Anästhetikums zu ihrem künstlichen Teichwasser erreicht wurde 5,6. Es gibt jedoch relativ wenige Beispiele für die Untersuchung flüchtiger Anästhetika in diesem Modell, da gasdichte Apparaturen erforderlich sind, die oft speziell angefertigt werden und umständlich zu verwenden sein können 7,8.
In den letzten Jahren hat sich der Zebrafisch zu einem bevorzugten Modell für die Untersuchung von intravenösen Anästhetika entwickelt, da die Verabreichung des Arzneimittels ebenso einfach ist und andere Vorteile wie ihre gut beschriebenen komplexen Verhaltensweisen und die Verfügbarkeit kommerzieller Einheiten zur Beobachtungdieser Verhaltensweisen 9. Viele neuere Studien haben solche kommerziell erhältlichen Beobachtungseinheiten verwendet, um nach neuroaktiven Verbindungen, einschließlich Anästhetika, zu suchen, wobei 96-Well- und 24-Well-Plattenformate verwendet wurden, um das Verhalten der Zebrafischlarvenzu quantifizieren 4,10,11,12,13,14,15 . Die Larvenstadien eignen sich aufgrund ihrer Fähigkeit, viele Verhaltensreaktionen zu bewerten, ihrer geringen Größe, ihrer hohen Durchsatzkompatibilität und ihrer gut charakterisierten neuronalen Schaltkreise besonders gut für pharmakologische Studien 9,16,17. Eine wesentliche Einschränkung in diesen Studien zu Anästhetika im Zebrafischmodell ist jedoch die relative Schwierigkeit bei der Verabreichung von flüchtigen Anästhetika. Diese Einschränkung hat zu wenigen Beispielen für einen Vergleich zwischen flüchtigen und intravenösen Wirkstoffen geführt 4,15,18. Die Möglichkeit, beide Klassen von Anästhetika in einem einzigen Tiermodell einfach zu untersuchen und zu vergleichen, ist ein wichtiges Instrument, um die Untersuchung der Anästhesiepharmakologie über alle Klassen hinweg zu erleichtern.
Traditionell erforderte die Untersuchung von intravenösen Anästhetika bei einer aquatischen Spezies spezialisierte, oft kundenspezifische Geräte, die schwierig zu bedienen sein können oder möglicherweise nicht ausreichend gasdicht sind, um den Verlust des Anästhetikums für die Dauer des Experiments zu verhindern. Das hier beschriebene Verfahren stellt eine leicht zugängliche Alternative dar, um eine gasdichte Versiegelung in einer Glaskammer herzustellen, die für die Beobachtung des Verhaltens von Zebrafischlarven mit einer kommerziellen Beobachtungseinheit geeignet ist (siehe Materialtabelle).
Protokoll
Alle Zebrafischversuche wurden in Übereinstimmung mit den vom Institutional Animal Care and Use Committee (IACUC) genehmigten Tierverwendungsprotokollen durchgeführt. Erwachsene Zebrafische wurden in der Wasseranlage der University of Pennsylvania unter der Aufsicht des University Laboratory Animal Resources (ULAR) gehalten. Tübinger Langflossen-Wildtyp-Zebrafische wurden für alle Versuche im eigenen Haus gezüchtet und unter Standard-Haltungsbedingungen mit einem 13/11-h-Hell-Dunkel-Zyklus bis zum Erreichen der 5-Tage-Nachbefruchtung (dpf) gehalten. Die Experimente wurden mit biologischen Replikaten durchgeführt, wobei die Gelege von unterschiedlichen Paarungspaaren abgeleitet wurden, um eine angemessene biologische Vielfalt zu gewährleisten. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Herstellung von selbstklebenden Silikonplatten
HINWEIS: Äquivalente dieses Materials (Silikonfolie plus Klebstoff) können kommerziell bezogen werden, aber oft mit höheren Kosten und geringerer Verfügbarkeit.
- Legen Sie die 0,5 mm starke Silikonplatte auf eine saubere, ebene Fläche.
- Untersuchen Sie die Blätter auf Falten und vermeiden Sie diese, wenn möglich.
HINWEIS: Silikonfolien mit Falten haften möglicherweise nicht ausreichend auf dem Klebeband und können zu einer unzureichenden Abdichtung der Vertiefungen und/oder einer schlechten Sicht auf den Zebrafisch führen. - Reinigen Sie die Laken mit 70% Alkohol, um Öl oder Schmutz zu entfernen, und lassen Sie sie trocknen.
- Tragen Sie mit einem Applikator, z. B. einem Pinsel, eine dünne, gleichmäßige Schicht Haftgrundierung auf die Silikonfolie auf. Um ein Überauftragen zu vermeiden, in kleineren Abschnitten arbeiten, da der Klebstoff schnell trocknet (in 1-5 s aushärtet).
HINWEIS: Ohne diesen Haftungsverstärker haftet das Klebeband nicht ausreichend auf der Silikonfolie. - Sobald der Klebstoff aufgetragen ist, richten Sie das doppelseitige Klebeband mit der Silikonfolie aus, wobei die Papierunterlage nach oben zeigt.
- Tragen Sie das Klebeband nach und nach mit einer Rolle auf das Silikon auf, um die Oberfläche zu glätten und Luftblasen zu entfernen (nach dem ersten Auftragen hilft das Arbeiten mit der Silikonseite nach oben bei der Visualisierung und Entfernung von Luftblasen).
- Lassen Sie den Haftvermittler 24 h lang auf einer ebenen Fläche vollständig aushärten.
- Schneiden Sie das selbstklebende Silikon in mindestens 10 mm breite Streifen (7,5 mm Vertiefungsdurchmesser plus Überlappung auf jeder Seite).
HINWEIS: Wenn jede zweite Reihe der Well-Platte verwendet wird, wirkt sich eine größere Varianz der Streifen nicht negativ auf die Wells in benachbarten Reihen aus, was nicht nur die Anwendung erleichtern kann, sondern auch notwendig ist, um eine Abdichtung um den gesamten Umfang des Wells zu erreichen.- Stellen Sie sicher, dass die Streifen lang genug sind, um mindestens die Breite einer Reihe der Well-Platte abzudecken.
HINWEIS: Wenn Sie eine Well-Platte verwenden, die nicht 96-Well-Platte ist, wie z. B. eine 24-Well- oder 48-Well-Platte, können die Streifengrößen an die spezifischen Abmessungen der Platte angepasst oder zugeschnitten werden, um eine ordnungsgemäße Abdeckung unabhängig von der Plattengröße zu gewährleisten.
- Stellen Sie sicher, dass die Streifen lang genug sind, um mindestens die Breite einer Reihe der Well-Platte abzudecken.
2. Vorbereitung der Lösungen
HINWEIS: Alle Stamm- und Testlösungen von flüchtigen Anästhetika wurden unmittelbar vor dem Experiment hergestellt, um einen Verlust der Konzentration flüchtiger Verbindungen zu vermeiden.
- Geben Sie für jede Lösung (Stamm- oder Arbeitslösung) ein Volumen nichtflüchtiges Lösungsmittel (E3-Embryowasser, DMSO usw.) in ein HPLC- oder Szintillationsfläschchen, das in Kombination mit der abschließenden Verdünnung des flüchtigen Anästhetikums das Gesamtvolumen ausreichend ausfüllt und nur minimalen Kopfraum verlässt (siehe Abbildung 1A).
- Fügen Sie ein flüchtiges Anästhetikum mit einer gasdichten Hamilton-Spritze hinzu und verschließen Sie das Fläschchen schnell.
HINWEIS: Stammlösungen in Fläschchen mit Septumdeckel können verwendet werden, um weitere Verdünnungen durch das Umfüllen der Lösung mit gasdichten Spritzen zu erleichtern. - Mischen Sie dann die Fläschchen (Vortex, Beschallung) nach Bedarf und lagern Sie sie zwischen, während Sie die Zebrafischplatten zubereiten.
3. Aufbau des Verhaltensexperiments
HINWEIS: Dieser Schritt des Protokolls kann etwas Übung erfordern. Es wird empfohlen, ohne Fisch oder Lösungen, die wertvolles Material enthalten, zu arbeiten, bis Sie sich mit der Technik vertraut gemacht haben.
- Übertragen Sie eine Zebrafischlarve (5 dpf) in jede zweite Reihe der 96-Well-Glasplatte.
HINWEIS: Wenn Sie jede zweite Reihe leer lassen, kann das Kontaminationspotenzial benachbarter Bohrlöcher durch Überlaufen verringert werden, da die Bohrlöcher in Schritt 3.4 versiegelt werden. - Entferne die E3-Lösung vorsichtig aus jeder Vertiefung. Dies kann eine Reihe nach der anderen oder auf der gesamten Platte erfolgen, wenn es schnell gehen kann.
HINWEIS: Die Zeit, für die sich die Larven außerhalb der Lösung aufhielten, wurde minimiert, um potenziellen Stress zu reduzieren. Alternative Verfahren können auf der Grundlage unterschiedlicher experimenteller Anforderungen verwendet werden, einschließlich einer nur teilweisen Entfernung der Lösung vor der Zugabe der arzneimittelhaltigen Lösung, um den Stress zu minimieren. Das Protokoll sollte an die Erfordernisse des Versuchs angepasst werden, einschließlich der den Tieren eingeräumten Äquilibrierungszeit zum Ausgleich von potenziellem Stress, der Effizienz des Mischens der Lösung und der Genauigkeit der Konzentrationen einer arzneimittelhaltigen Lösung, wenn nicht das gesamte E3 vor der Zugabe der Arbeitslösung entfernt wird. - Verwenden Sie als Nächstes eine Transferpipette, um jede Vertiefung in der Reihe mit der experimentellen Lösung zu füllen. Achten Sie darauf, keine Blasen einzuführen. Überfüllen Sie jede Vertiefung (Abbildung 1B).
- Drücken Sie den Streifen mit den in Schritt 1 hergestellten Silikonklebestreifen schnell nach unten (Abbildung 1C). Dies hilft, Blasenbildung zu verhindern und verhindert, dass Fische in benachbarte Brunnen überlaufen.
- Drücken Sie fest auf die Oberseite der Platte, um sicherzustellen, dass jede Vertiefung versiegelt ist.
- Wiederholen Sie die Schritte 2 bis 5, bis die Lösung ausgetauscht und die Vertiefungen für jede zweite Reihe der Vertiefungsplatte versiegelt sind (Abbildung 1D).
- Drehen Sie die Platte vorsichtig um und untersuchen Sie sie auf Luftblasen.
HINWEIS: Das Vorhandensein von Luftblasen verdeckt die Visualisierung der Bewegung des Zebrafisches. - Setzen Sie die Platte in die Verhaltensbeobachtungseinheit ein (Silikonkleber mit der Klebeseite nach unten) und führen Sie das Verhaltensexperiment durch (siehe Abschnitt Ergebnisse für Details).
Ergebnisse
Vergleich mit traditioneller Open-Well-Beobachtung
Um zu beurteilen, ob die Klebeversiegelung einen Einfluss auf die spontane Bewegung hat, wurde ein Vergleich zwischen den Kontrollen in offenen und verschlossenen Vertiefungen durchgeführt. Wie in Abbildung 2A zu sehen ist, wurde kein statistisch signifikanter Unterschied in der Bewegung zwischen diesen Gruppen für die Standarddauer von ~30 Minuten beobachtet, die in den in diesem Artikel beschriebenen Experimenten verwendet wurde. In Anbetracht der Tatsache, dass andere experimentelle Paradigmen möglicherweise eine längere experimentelle Exposition erfordern, wurde ein 2-stündiger Zeitverlauf durchgeführt, der keinen statistischen Unterschied in der Bewegung bis zur 2-Stunden-Marke zeigte (siehe Abbildung 2B). Eine längere Versuchsdauer würde wahrscheinlich zu einem noch größeren Unterschied in der Bewegung führen. Frühere Studien haben die nachteilige Wirkung von Hypoxie auf das Schwimmverhalten quantifiziert19, was letztendlich die Integrität der experimentellen Ergebnisse beeinträchtigt. Daher wird die Hypothese aufgestellt, dass Hypoxie und/oder CO2 -Produktion die wahrscheinlichsten Ursachen für diese Abweichung der SM im Vergleich zu Open-Well-Kontrollen sind. Leider verhindert die gasdichte Versiegelung, die den Verlust von flüchtigem Anästhetikum aus der geschlossenen Vertiefung verhindert, auch die Diffusion anderer Gase in oder aus der eingeschlossenen Lösung. Dies bedeutet natürlich eine eingeschränkte Diffusion von CO2 und Sauerstoff, da sie jeweils von den Fischen produziert und konsumiert werden. Dies ist eine wichtige Einschränkung in Bezug auf die mit dieser Methode mögliche Versuchsdauer. Es ist auch wichtig zu beachten, dass sich mit der Zeit kleine Blasen in zuvor blasenfreien Vertiefungen zu bilden beginnen, vermutlich aufgrund des Stoffwechsels. Während des Tests behinderten diese Blasen jedoch nicht die Verfolgung des Zebrafisches durch die Software. Experimente von bis zu 1,5 h (plus Äquilibrierungszeit) scheinen keinen signifikanten Einfluss auf das SM-Tracking dieser Wildtyp-Zebrafische zu haben, aber Fische, die mehr Bewegung zeigen oder andere erhöhte metabolische Anforderungen haben, sind möglicherweise nicht für Experimente dieser Länge geeignet.
Flüchtige Anästhesiekonzentration im Laufe der Zeit
Um eine gleichbleibende Konzentration des flüchtigen Anästhetikums über die Zeit zu gewährleisten, wurden Vertiefungen ohne Zebrafisch verwendet, um den zeitlichen Verlauf der Anästhesiekonzentration zu messen, wie er durch HPLC bestimmt wurde. In jede Vertiefung wurde die gleiche Lösung gegeben, und die Konzentration von Sevofluran oder Isofluran wurde 3 Stunden lang alle 15 Minuten gemessen (jede Messung aus einer anderen Vertiefung, im Gegensatz zu wiederholten Messungen aus derselben Vertiefung). Wie in Abbildung 3 zu sehen ist, ging während des gesamten Zeitverlaufs praktisch kein Anästhetikum mit Sevofluran (Dampfdruck von 197 mmHg bei 25 °C) verloren, das einen niedrigeren Dampfdruck aufweist als Isofluran (Dampfdruck von 238 mmHg bei 25 °C), das nach 3 h einen Verlust von 4 % aufwies. Keines der flüchtigen Anästhetika zeigte einen nennenswerten Verlust im Intervall von 30 bis 60 Minuten, was für viele Verhaltensexperimente typisch ist.
Wirksamkeit von Sevofluran bei Zebrafischlarven
Diese Technik wurde verwendet, um die Wirksamkeit von flüchtigen Anästhetika bei Zebrafischen zu messen15 und könnte anderen zuvor verwendeten Methoden überlegen sein4. Die mediane effektive Konzentration (EC50) für Sevofluran durch Messungen der spontanen Bewegung (SM) und der ausgelösten Bewegung (EM) ist in Abbildung 4 dargestellt. Mit der Sealed-Well-Technik wurden EC50-Werte von 62 μM (95 % KI: 49-81) für SM und 126 μM (95 % KI: 81-193) für EM bestimmt. Der SM-Wert ist vergleichbar mit dem zuvor berichteten EC50 von 76 μM (95%-KI: 50-114). Der zuvor berichtete Wert von 240 μM (95%-KI: 169-328) für EM ist jedoch fast doppelt so hoch wie der hier erhaltene Wert4. Ohne eine ähnliche HPLC-Studie dieser Methodik (Vakuumfett und ein Glasdeckglas zur Herstellung eines luftdichten Verschlusses) kann nicht mit Sicherheit gesagt werden, ob dieser Unterschied auf einen Verlust des flüchtigen Anästhetikums im Laufe der Zeit zurückzuführen ist. Es handelt sich jedoch um eine rationale Hypothese, insbesondere angesichts der Tatsache, dass der Stimulus für EM (akustisches Klopfen) am Ende der Verhaltensbeobachtungszeit aufgezeichnet wird. Unabhängig von der Methode der Versiegelung des Bohrlochs hätte ein Verlust der Sevoflurankonzentration zu späteren Zeitpunkten die größten Auswirkungen. Natürlich könnten diese Unterschiede auch auf andere zugrundeliegende Faktoren zurückzuführen sein, wie zum Beispiel den genetischen Hintergrund des Zebrafisches.
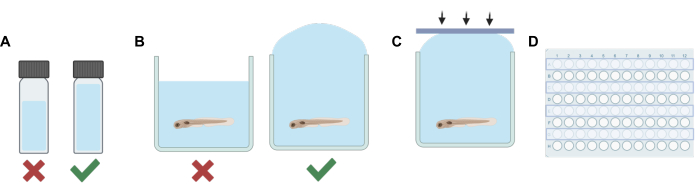
Abbildung 1: Wichtigste Verfahrensschritte. (A) Bei der Arbeit mit flüchtigen Lösungen wird die Verdünnungsplanung durchgeführt, um den Kopfraum in jedem Fläschchen zu minimieren. (B) Eine Überfüllung der Vertiefungen wird durchgeführt, wenn experimentelle Lösungen zu Brunnen hinzugefügt werden, die Zebrafische enthalten, um Luftblasen zu beseitigen. (C) Silikonklebestreifen werden von einer Seite der Platte auf die andere aufgebracht, um Lufteinschlüsse zu verhindern. (D) Jede zweite Reihe wird für Versuche verwendet, um eine Kontamination benachbarter Brunnen zu verhindern. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Vergleich der Bewegung in verschlossenen und offenen Vertiefungen. (A) Die gesamte spontane Bewegung von 0 min bis 4 min nach einer 15-minütigen Äquilibrierung in der Verhaltenseinheit wird verglichen. Die Bewegung von Zebrafischen 5 Tage nach der Befruchtung (dpf) in offenen Vertiefungen (254 mm, 95% CI: 185-322) und verschlossenen Vertiefungen (257 mm, 95% CI: 186-326) zeigt keinen signifikanten Unterschied (P = 0,374). (B) Nach einer 15-minütigen Akklimatisierungsphase im Verhaltenssystem des Zebrafisches werden Fische (N ≥ 36) über einen Zeitraum von 4 Minuten zu Beginn jeder halben Stunde auf spontane Bewegung (zurückgelegte Gesamtstrecke) beobachtet. Die Daten werden als prozentuale Kontrolle (offene Vertiefungen) dargestellt, wobei statistische Vergleiche (ANOVA) zum 0-h-Zeitpunkt durchgeführt werden. Bei einem P-Wert-Schwellenwert von <0,05 wird bei der 2-Stunden-Marke (P = 0,0139) ein signifikanter Unterschied in der Bewegung zwischen offenen und verschlossenen Vertiefungen beobachtet, der rot hervorgehoben ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Wiederfindung von Sevofluran im Laufe der Zeit. Die Konzentrationen von Sevofluran und Isofluran in silikonklebenden, mit Silikon versiegelten Glas-Well-Platten werden mittels Hochleistungsflüssigkeitschromatographie (HPLC) über einen Zeitraum von 3 Stunden bestimmt. Die prozentuale Erholung, die als Durchschnitt von drei Replikationen berechnet wird, wird im unteren Teil des Diagramms angezeigt. Isofluran weist nach 3 h einen Konzentrationsverlust von bis zu 4 % auf, was wahrscheinlich auf seinen höheren Dampfdruck (238 mmHg bei 25 °C) im Vergleich zu Sevofluran (197 mmHg bei 25 °C) zurückzuführen ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
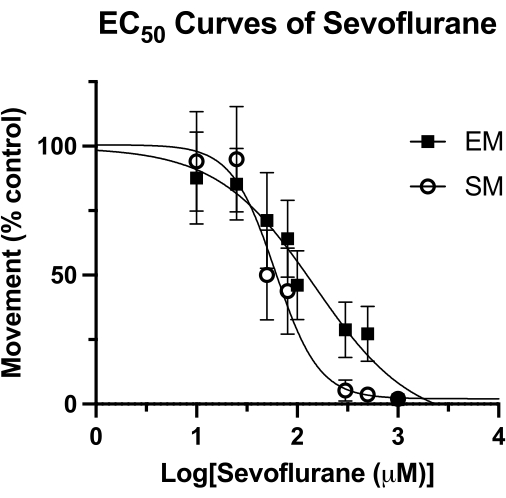
Abbildung 4: Sevofluran EC50-Kurven . Eine Sevofluran-EC50-Kurve in versiegelten Vertiefungen wird auf der Grundlage einer spontanen Bewegung (über einen Zeitraum von 4 Minuten) und einer ausgelösten Bewegung (1 Sekunde nach einem akustischen Abklopfen) von 5 dpf Zebrafischen bestimmt. Die Bewegung wird auf reine DMSO-Steuerelemente skaliert. Der endgültige EC50-Wert wird mit 62 μM (95 % KI: 49-81) für spontane Bewegung (SM) und 126 μM (95 % KI: 81-193) für ausgelöste Bewegung (EM) berechnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieser Artikel beschreibt eine Methode zur einfachen Verabreichung von flüchtigen Anästhetika wie Sevofluran an Zebrafischlarven, die zur Quantifizierung der Wirksamkeit flüchtiger Anästhetika bei Wildtyp-Fischen verwendet wurde. Obwohl diese Technik konzeptionell einfach ist, kann es Übung erfordern, eine ausreichend abgedichtete, blasenfreie Reihe von Bohrlöchern in einem kurzen Zeitrahmen zu gewährleisten und den Verlust flüchtiger Wirkstoffe zu minimieren. Da diese Methode für flüchtige Verbindungen vorgesehen ist, erfordert sie nicht nur ein sorgfältiges Auftragen des Silikonklebers auf die Well-Platte, sondern auch eine sorgfältige Vorbereitung experimenteller Lösungen, um die Genauigkeit der Konzentrationen flüchtiger Verbindungen zu optimieren.
Lufteinschlüsse können eine genaue Visualisierung und Verfolgung behindern. Neben der praktischen Versiegelung ist das sorgfältige Befüllen und Prüfen jeder Vertiefung von entscheidender Bedeutung, da es unwahrscheinlich ist, dass vor der Versiegelung vorhandene Blasen während des Versiegelungsprozesses entfernt werden. Eine Überfüllung der Brunnen trägt auch dazu bei, den Einschluss von Luft in jedem Brunnen zu verhindern. Eine zu starke Überfüllung kann jedoch dazu führen, dass Fische unbeabsichtigt in benachbarte Brunnen umgefüllt werden. Versuchen Sie in diesem Fall, weniger zu füllen. Die Minimierung einer überschüssigen Überfüllung hilft nicht nur dabei, Fische unbeabsichtigt in benachbarte Brunnen zu bringen, sondern kann auch die Wirksamkeit des Klebstoffs verbessern, der zum Abdichten in Gegenwart großer Mengen überschüssiger Lösung verwendet wird. Obwohl der Klebstoff zum Teil speziell wegen seiner Fähigkeit ausgewählt wurde, auf nassen Oberflächen zu haften, stellt die Verwendung einer sauberen und trockenen Platte sicher, dass keine anderen Substanzen die Haftung beeinträchtigen, wodurch die Gesamtintegrität des Versuchsaufbaus verbessert wird. Wenn trotz des Fehlens von Blasen lange vor dem Klebstoffauftrag, der Optimierung der Überfüllung und der Technik zum Auftragen von Silikonklebstoffen immer noch Blasen vorhanden sind, kann dies an der Verwendung von zu schmalen Klebestreifen liegen. Streifen, die nicht breit genug sind, können entweder nicht oder nur unzureichend abdichten, um das Eindringen von Luft während oder nach dem Auftragen zu verhindern. Eine weitere mögliche Fehlerursache bei dieser Technik ist die Qualität der Abdichtung durch die selbstklebenden Silikonstreifen, die durch Falten im Silikon, unzureichende Abdichtung des Klebstoffs (unzureichende Haftgrundierung, Aushärtungszeit oder Reinigung der Oberflächen vor dem Auftragen von Silikon) verursacht werden kann. Obwohl der Klebstoff selbst eine ausreichend dichte Abdichtung zu bieten scheint, kann es sein, dass der Klebstoff allein ohne das Silikon als Schutzrückseite keine ausreichende Wasserbeständigkeit bietet, um über die Dauer eines Experiments vor dem zirkulierenden Wasserbad zu schützen.
Glasplatten eignen sich gut für diese Anwendung, da sie im Gegensatz zu vielen Kunststoffen20 mit hydrophoben Substanzen wie flüchtigen Anästhetika kompatibel sind, ihre Oberfläche flach ist (im Gegensatz zu typischen Kunststoff-Well-Platten), was eine Haftung des Silikonstreifens ermöglicht, und transparente Böden haben (im Gegensatz zu Teflon und einigen Kunststoffplatten). Quarz-Well-Platten können eine erhöhte optische Klarheit für Experimente bieten, bei denen eine Bildgebung mit höherer Auflösung gerechtfertigt ist. Alle hier vorgestellten Beispieldaten wurden in 96-Well-Glasplatten gewonnen, und andere ähnliche Platten sind in größeren Well-Formaten kommerziell erhältlich, aber diese wurden von den Autoren nicht getestet. Mehr Lösungen in einer größeren Vertiefung können die potenzielle Dauer eines Experiments mit dieser Technik aufgrund der größeren Verfügbarkeit von Sauerstoff verlängern und auch Experimente mit älteren Zebrafischen erleichtern, aber eine Modifikation eines Experiments auf diese Weise würde eine weitere Validierung erfordern. Andere Modifikationen dieser Technik umfassen die Anwendung dieser Technik auf andere Verhaltensparadigmen (z. B. Reize wie Licht)21, verschiedene genetische Modelle, andere Arten von pharmakologischen Studien (z. B. die gleichzeitige Verabreichung von Medikamenten) und vielleicht sogar die Anpassung für bildgebende Studien.
Diese Methode bietet eine einfache und zugängliche Methode zur Verabreichung von flüchtigen Verbindungen an Zebrafische zum Zwecke der Verhaltensbeobachtung. Zebrafische sind ein immer beliebteres Modell für die Untersuchung von Anästhetika, insbesondere von intravenösen (IV) Anästhetika (Propofol, Etomidat, Ketamin usw.). Dies liegt zum Teil an der einfachen Verabreichung des Arzneimittels, aber es gibt auch weniger pharmakokinetische Überlegungen im Vergleich zur Verabreichung von IV-Anästhetika an nicht-aquatische Tiermodelle (Würmer, Fliegen, Nagetiere, Menschen usw.), die zielkontrollierte Infusionsmodelle für die Steady-State-Verabreichung erfordern2. Dies ist vergleichbar mit der Verabreichung von flüchtigen Mitteln bei diesen Tieren, die so einfach ist, wie das Tier in eine Box zu setzen und es das mit Sauerstoff/Luft vermischte Mittel einatmen zu lassen. Die Verabreichung von flüchtigen Stoffen an Wassertiere (Zebrafische, Kaulquappen) ist komplizierter, da sie ein abgeschlossenes wässriges Milieu erfordert. Dieser Unterschied tendiert dazu, die Verwendung bestimmter Tiermodelle für bestimmte Anästhetika aufzuteilen, aber mit dem hier vorgestellten Verfahren können beide Klassen von Anästhetika ohne weiteres an dasselbe Tiermodell abgegeben werden. In der Lage zu sein, verschiedene experimentelle Paradigmen in einem einzigen Modell trotz unterschiedlicher Verabreichungswege leicht zu vergleichen. Dies könnte auch für die Verwendung von flüchtigen Anästhetika in einer Weise angepasst werden, die die anderen Stärken des Zebrafisches nutzt, einschließlich seiner genetischen Lenkbarkeit, seiner schnellen Entwicklung und seiner transparenten Embryonen, die die Echtzeitbeobachtung physiologischer Reaktionen erleichtern. Das Verständnis der Auswirkungen von flüchtigen Anästhetika wie Isofluran und Sevofluran auf Zebrafische kann das Verständnis ihrer Wirkmechanismen und Nebenwirkungen verbessern. Diese neuartige Methodik bietet einen robusten Rahmen für die Untersuchung flüchtiger Anästhetika im Zebrafisch.
Offenlegungen
Die Autoren haben keine Konflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von der Foundation for Anesthesia Education and Research (FAER) finanziert. Abbildung 1 wird in BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 96 well glass microplates | Zinsser North America | 3600500 | "These glass microplates are made from special high purity, temperature resistant borosilicate glass and the surfaces are acid polished. Plates are rectangular in the standard SBS microplate footprint (85 x 127 mm).These glass reactor microplates are designed primarily for use with chemistry applications and are resistant to temperatures up to 530° C. They can be autoclaved. They are machined from a homogeneous glass sheet and feature uniform geometry and shape to provide consistent temperatures from well to well (within 0.2 degrees C typical)." |
| 2.0 mL Clear, Large Opening, 9 mm Thread Vials | Chemglass Life Sciences | CV-1150-1232 | "With a 40% larger opening, these vials are specifically designed to work in robotic arm auto samplers. They also incorporate the unique Step Vial design that precisely centers a limited volume insert in the neck of the vial. " |
| 3M Double Coated Tape 9490LE | AbbVie Inc | 24WG90 | "3M Double Coated Tape 9490LE with 3M Laminating Adhesive 300LSE provides high bond strength to most surfaces, including many low surface energy plastics such as polypropylene and powder coated paints. The acrylic adhesive also provides excellent adhesion to surfaces contaminated lightly with oil typically used with machine parts. 3M double coated tape 9490LE offers the added feature of 3M Laminating Adhesive 300MP on one side to provide excellent bond strength to a variety of foam and fabric materials (6 in x 5 yd)" |
| DanioVision Observation Chamber | Noldus | DVOC-0041 | "DanioVision is a complete system, designed for the high-throughput testing of zebrafish larvae in multi-well plates. It includes the Observation Chamber and renowned EthoVision XT video tracking software." |
| DanioVision Temperature Control Unit | Noldus | DVTCU-0011 | "The DanioVision Temperature Control Unit is a flow-through system: water flows evenly underneath the well plate at the temperature of your choice. The temperature is the same all throughout the well plate." |
| Ethovision XT16 software | Noldus | NSE-EV-BASE | "EthoVision XT is the most widely applied video tracking software that tracks and analyzes the behavior, movement, and activity of any animal, trademarked by Noldus" |
| Isoflurane | Piramal Critical Care | NDC # 66794-017-10 | Liquid for inhalation, a nonflammable nonexplosive inhalation anesthetic, containing 100 mL isoflurane. Stored at controlled room temperature 20º to 25º C |
| Scotch-Weld Instant Adhesive Primer AC79 Clear | 3M | "62-3916-0860-1 (Product ID) C2103N (Lot)" | "3M Scotch-Weld Instant Adhesive Primer AC79 is designed for use on difficult-to-bond low surface energy elastomers, such as EPDM, silicone and other rubbers. Surface preparation and application are straightforward and the adhesive primer is fast drying to keep jobs moving quickly." |
| Silicone Sheets 0.5 mm thick | various suppliers | N/A | translucent silicone sheets were purchased from multiple suppliers |
| Speedball Pop-in Hard Rubber Brayer with Plastic Frame, 4 Inches" | Speedball | 793728 | "The Speedball Pop-In Hard Brayer has a roller that snaps out for easy cleaning. Plastic, one piece frame with detachable 4 inch wide roller. Made from pure natural gum rubber with a ground finish. The hard rubber brayer is 4 inches wide with a sturdy plastic frame and great for glue application" |
| SureSTART 9 mm Screw Caps, Level 2 High-throughput Applications, Type: AVCS Screw Cap Black PP, White Silicone/RED PTFE Septa 1.0 mm | Thermo Scientific | 6ASC9ST1B | "Use Thermo Scientific SureSTART 9 mm Screw Caps with screw vials that have a 9 mm opening. The performance Level 2 caps are manufactured and tested to ensure low bleeding, robustness, and reproducibility of results for y routine GC-MS and LC-MS analyses. Choose from polypropylene caps with all-purpose silicone/PTFE septa of various hardness values designed to reduce autosampler needle issues. Our AVCS caps incorporate Advanced Vial Closure System technology to ensure optimal seal compression when closing a vial." |
| Ultane Sevoflurane | AbbVie Inc | NDC # 0074-4456-04 | Volatile Liquid for Inhalation, is packaged in amber colored bottles containing 250 mL sevoflurane. Stored at controlled room temperature 15º to 30º C |
| Wheaton Liquid Scintillation Vials, Caps Attached to Vials, Glass, Metal Foil / Pulp, 24-400, 20 mL | DWK Life Sciences | 986561 | 20 mL scintillation vials converted from Type I borosilicate glass tubing, PET, or HDPE. Available with cap attached. |
Referenzen
- Wasilczuk, A. Z., Maier, K. L., Kelz, M. B. The mouse as a model organism for assessing anesthetic sensitivity. Methods Enzymol. 602, 211-228 (2018).
- Shortal, B. P., et al. Development and validation of brain target-controlled infusion of propofol in mice. PLoS One. 13, 1-14 (2018).
- Halbach, K., et al. Yolk sac of zebrafish embryos as backpack for chemicals. Environ Sci Technol. 54 (16), 10159-10169 (2020).
- Bedell, V. M., Meng, Q. C., Pack, M. A., Eckenhoff, R. G. A vertebrate model to reveal neural substrates underlying the transitions between conscious and unconscious states. Sci Rep. 10, 1-10 (2020).
- Stetter, M. D., et al. Isoflurane anesthesia in amphibians: Comparison of five application methods. In American Association of Zoo Veterinarians. , Puerto Vallarta, Mexico. 255-257 (1996).
- Woll, K. A., Eckenhoff, R. G. High-throughput screening to identify anesthetic ligands using Xenopus laevis tadpoles. Methods Enzymol. 602, 177-187 (2018).
- Meyer, H. Zur Theorie der Alkoholnarkose. Arch Exp Pathol Pharmakol. 46, 338-346 (1901).
- Downes, H., Courogen, P. M. Contrasting effects of anesthetics in tadpole bioassays. J Pharmacol Exp Ther. 278, 284-296 (1996).
- Kalueff, A. V., et al. Towards a comprehensive catalog of zebrafish behavior 1.0 and beyond. Zebrafish. 10, 70-86 (2013).
- Abramova, V., et al. Effects of pregnanolone glutamate and its metabolites on GABAA and NMDA receptors and zebrafish behavior. ACS Chem Neurosci. 14, 1870-1883 (2023).
- Germann, A. L., et al. Comparison of behavioral effects of GABAergic low-and high-efficacy neuroactive steroids in the zebrafish larvae assay. ACS Chem Neurosci. 15, 909-915 (2024).
- Hoyt, H., et al. Photomotor responses in zebrafish and electrophysiology reveal varying interactions of anesthetics targeting distinct sites on gamma-aminobutyric acid type A receptors. Anesthesiology. 137, 568(2022).
- Li, F., et al. Characterization of the locomotor activities of zebrafish larvae under the influence of various neuroactive drugs. Annals Trans Med. 6, 173(2018).
- McCarroll, M. N., Gendelev, L., Kinser, R. Zebrafish behavioural profiling identifies GABA and serotonin receptor ligands related to sedation and paradoxical excitation. Nat Commun. 10, 4078(2019).
- Plasencia, D. M., Rodgers, L. H., Knighton, A. R., Eckenhoff, R. G., White, E. R. Antagonism of propofol anesthesia by alkyl-fluorobenzene derivatives. Sci Rep. 14, 15943(2024).
- Dash, S. N., Lipika, P. Flight for fish in drug discovery: A review of zebrafish-based screening of molecules. Biology Lett. 19, 20220541(2023).
- Nelson, J. C., Michael, G. Zebrafish behavior as a gateway to nervous system assembly and plasticity. Development. 149, 177998(2022).
- Zhang, L., et al. Sevoflurane postconditioning ameliorates cerebral hypoxia/reoxygenation injury in zebrafish involving the Akt/GSK-3β pathway activation and the microtubule-associated protein 2 promotion. Biomed Pharmacother. 175, 116693(2024).
- Abdallah, S. J., Thomas, B. S., Jonz, M. G. Aquatic surface respiration and swimming behaviour in adult and developing zebrafish exposed to hypoxia. J Exp Biol. 218, 1777-1786 (2015).
- Targ, A. G., Yasuda, N., Eger, E. I. Solubility of I-653, sevoflurane, isoflurane, and halothane in plastics and rubber composing a conventional anesthetic circuit. Anesth Analg. 69, 218-225 (1989).
- Yang, X., et al. Drug-selective Anesthetic insensitivity of zebrafish lacking γ-aminobutyric acid Type A receptor β3 subunits. Anesthesiology. 131, 1276-1291 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten