Method Article
간세포 암종을 치료하기 위한 포털 영역에 기반한 간 세그먼트 VIII의 최소 침습적 해부학적 절제술
* 이 저자들은 동등하게 기여했습니다
요약
이 연구는 복강경 S8 분절 절제술 기술에 대해 자세히 설명하며, 문맥 척추경 탐색에 의해 안내되는 부분 절제술에서 해부학적 절제술로의 전환을 강조합니다. 향상된 3D 해부학적 이해, 개선된 최소 침습 기술 및 수술 중 초음파 숙달은 절차의 정밀도와 안전성을 향상시켜 합병증을 줄이는 동시에 체계화된 해부학적 절제 프로토콜을 통해 간 수술 결과를 최적화했습니다.
초록
간절제술은 간세포암종(HCC)의 일차 치료법으로 절제 정도에 따라 해부학적 간절제술과 비해부학적 간절제술로 분류됩니다. 해부학적 간절제술은 종양이 있는 PT(portal territory) 간 분절 또는 하위 분절을 기본 해부학적 단위로 사용하여 종양이 있는 PT를 체계적으로 절제하고 이 영역을 공급하고 경계하는 Glisson 시스템을 완전히 제거하여 종양학적 효능을 향상시킵니다. 비해부학적 간절제술은 근치적 종양학적 절제술의 원칙을 따르며, 종양 가장자리에서 1cm 이상 떨어진 간 조직을 제거하는 것을 강조합니다. 정밀 수술 개념의 대중화와 함께 PT를 기반으로 한 최소 침습적 해부학적 간절제술이 널리 적용되고 있습니다. 그러나 간 S8 분절의 최소 침습적 절제술은 여전히 가장 어려운 간 절제 중 하나로 간주됩니다. 수술 중 초음파, 형광 복강경 검사 및 Lannaec 막 박리 기술을 사용하여 간의 문맥 영역 세그먼트 S8에 대한 해부학적 절제를 성공적으로 수행하여 단기적으로 우수한 임상 결과를 달성했습니다.
서문
흔히 간암으로 알려진 간세포암은 중국에서 가장 흔한 악성 종양 중 하나입니다. 2022년 중국에서는 367,700명의 새로운 간암 환자가 발생하여 발병률 측면에서 네 번째로 높았습니다. 사망자 수는 316,500명에 달하여 암 관련 사망의 두 번째 주요 원인이다1. 간절제술은 간암제2종 환자의 장기 생존을 위한 가장 좋은 기회 중 하나를 제공합니다. 간 절제술은 절제 정도에 따라 해부학적 간 절제술(AR)과 비해부학적 간 절제술(NAR)로 분류할 수 있습니다. AR은 종양이 있는 문맥 가지 내의 간 실질과 함께 해부학적으로 독립적인 간 분절 또는 결합된 분절을 완전히 절제하여 더 나은 종양학적 결과를 달성하고 잔류 허혈성 또는 울혈 부위로 인한 합병증을 피하는 것입니다. AR의 장점은 종양 절제의 철저함과 나머지 간의 유입 및 유출 간관의 완전한 보존에 반영됩니다3. 한편, 불규칙 간 절제술이라고도 하는 NAR은 종양학적 근치적 절제 원칙에 따라 종양 가장자리에서 1cm 이상 떨어진 간 조직을 절제하는 것을 말합니다. 이 수술 방법은 간의 해부학적 분절을 엄격하게 고수하는 것이 아니라 종양의 위치와 크기에 따라 맞춤화되어 종양 절제를 위한 안전한 여유를 확보하면서 가능한 한 많은 정상 간 조직을 보존하는 것을 목표로 합니다.
정밀 수술 개념의 발전과 간의 해부학에 대한 깊은 이해로 문맥 영역(PT-AR)을 기반으로 한 해부학적 간 절제술의 이론과 실습은 최근 몇 년 동안 인정을 받고 초기 홍보를 받았습니다4. PT-AR에는 수술 전 3차원 재건 및 유역 분석이 포함되어 종양 보유 문맥 영역(PT)을 식별하고 그에 따라 수술을 계획합니다. 수술 중 분지 내의 간 분절 또는 하위 분절은 기본 해부학적 단위로 사용되며, 인도시아닌 녹색(ICG) 형광 염색 탐색이 기본 방법이며 대표적인 분절간 간정맥(IHV)을 노출하여 보완됩니다. 그런 다음 생리학적 균열을 따라 간을 절개하여 종양 보유 문맥 분지를 완전히 절제하는 동시에 미래 간 잔여물(FLR)의 무결성과 기능적 보존을 보장합니다. 표적 간 척추경의 결찰 후 문맥 양성 염색 또는 역행성 염색을 위한 중첩된 수술 중 초음파 유도 천자는 PT-AR을 달성하기 위한 기본 기술 요구 사항입니다.
복강경 간 절제술은 전통적인 개복 수술과 비교할 때 최소 침습적 접근 방식과 우수한 회복 결과로 인정받고 있습니다. 그러나 서로 다른 간 분절을 절제하는 복잡성은 다양합니다. 간 VIII의 간정맥 및 하대정맥 근처 상복부 깊숙한 곳에 위치한 간절제술은 분절 VIII의 글리소니안 척추경에 직접 접근해야 하는 문제와 함께 복강경 해부학적 간 절제술을 이 분절 5,6,7,8,9에서 특히 어렵게 만듭니다.
이 연구는 간세포 암종에 대한 간 세그먼트 S8의 문맥 부위 해부학적 절제를 보여줍니다. 우리의 목표는 Lannaec 막을 기반으로 한 복강경 초음파 유도 천자 기술 및 간 척추경 절제 기술을 포함하여 이 수술의 기술과 주요 단계를 자세히 설명하는 것입니다. 이 프로토콜을 공유함으로써 S8 간세포암 치료에서 복강경 문맥 정맥 부위 해부학적 간 절제술의 타당성과 안전성을 뒷받침하는 증거를 제공하여 궁극적으로 환자 치료 결과를 개선할 수 있기를 희망합니다.
프로토콜
세그먼트 8(LALR-S8)에 대한 복강경 해부학적 간 절제술과 관련된 연구는 표준 윤리 관행을 고수했습니다. 선전시킴(�shenzhen people's hospital) 윤리위원회(LL-KY-2020462)의 승인을 받았습니다. 또한 각 환자로부터 정보에 입각한 서면 동의를 얻어 연구가 의료 윤리 규범 및 요구 사항을 준수하는지 확인했습니다.
1. 환자 선택
- 다음 포함 기준을 사용합니다.
- 양성 또는 악성 간 종양 환자에게 LALR-S8을 수행하고 표준 심폐 평가, 혈액 검사 및 생화학적 평가를 받도록 합니다. 수술이나 마취에 대한 금기 사항이 없는지 확인하십시오.
- 복부 CT 혈관 조영술, 간 및 혈관 구조의 3차원 재건, 향상된 MRI, 잔여 및 표준 간 용적 계산을 포함한 수술 전 영상을 수행합니다.
- 다음 제외 기준을 사용하십시오: Pugh-Child Class C로 분류된 간 기능이 있는 환자; 전신 마취를 견딜 수 없는 사람; 간내 또는 간외 전이가 있는 환자; 개복 수술을 받은 사람; 및 분절 절제 또는 기타 복합 수술 치료를 받은 환자.
2. 수술 전 준비, 수술 자세 및 마취
- 수술 전 준비
- 병력 및 신체 검사: 간 기능, 응고 프로파일, ICG 제거 검사 및 전반적인 건강 상태를 평가합니다.
- 이미징: 상세한 수술 전 영상(예: 향상된 복부 CT, MRI, 간 및 혈관 구조의 3차원 재건)을 확보하여 간과 혈관 구조의 8번 부분의 해부학적 구조를 설명합니다(그림 1).
- 금식: 환자가 일반적으로 수술 전날 자정부터 시작하는 단식 지침을 준수하도록 합니다.
- 약물: 필요한 경우 예방적 항생제를 투여하고 출혈이나 간 기능에 영향을 줄 수 있는 약물을 검토합니다.
- 정보에 입각한 동의 및 교육: 방법, 위험 및 이점을 포함하여 복강경 절차를 설명하고 정보에 입각한 동의를 얻습니다.
- 수술 자세
- 누운 자세: 환자를 누운 자세로 수술대에 놓습니다.
- 트렌델렌부르크 자세 반전: 간에 쉽게 노출되고 접근할 수 있도록 수술대를 약간 기울입니다.
참고: 이 자세는 간을 위쪽으로 이동하고 상복부에서 멀어지게 하는 데 도움이 됩니다. - 안정화: 시술 중 움직임을 방지하기 위해 환자를 수술대에 고정합니다.
- 마취
- 전신 마취: 전신 마취를 시행하여 환자가 수술 내내 의식을 잃고 편안하게 지낼 수 있도록 합니다.
- 유도 및 유지: 삽관을 위해 정맥 주사제(예: 프로포폴)와 근육 이완제(예: 석시닐콜린)를 사용합니다. 흡입제(예: 세보플루란)와 보조 진통제(예: 펜타닐)로 마취를 유지합니다. 적절한 마취와 환자의 안전을 보장하기 위해 마취 깊이를 조정합니다.
- 모니터링: 심박수, 혈압, 혈중 산소 포화도 및 호기말 이산화탄소 수치를 지속적으로 모니터링합니다.
3. 수술 기법
- 정맥 흡입 마취 후 머리를 들어 올리고 다리를 벌린 상태에서 환자를 30° 왼쪽 측면 욕창 자세로 배치합니다. 간 절제술을 위해 흡입 압력을 11-13mmHg, 중심 정맥 압력을 3-5cmH2O로 유지하고, 프링글 조작을 적용하여 10-15분 교합 후 5분 방출을 적용한 5포트 접근법을 사용합니다.
- 배꼽 오른쪽 가장자리 아래 2cm를 수직으로 절개하고 복벽층을 순차적으로 열어 복부에 접근합니다. 12mm 투관침을 삽입하여 폐복막을 확립한 다음 복강경을 복강에 삽입합니다.
- 다음과 같이 5개의 투관침을 배치하십시오: 관찰을 위해 1개의 12mm 투관침을 상부 영역에 놓습니다. 오른쪽 전방 겨드랑이 라인에 5mm 투관침 1개; 오른쪽 내측 쇄골 아래 12mm 투관침 1개; xiphoid 프로세스 아래 2cm 수평으로 5mm 투관침 1개; 배꼽 위 2cm 높이의 12mm 투관침 1개(그림 2).
참고: 간 절제술에 사용되는 일반적인 수술 기구에는 수술 중 복강경 초음파, 고조파 메스 및 양극성 응고 장치가 포함됩니다. - 수술 중 복강경 초음파(LUS)를 사용하여 천자를 안내하고, 간 분절 S8의 해부학적 절제술에 대한 양성 염색을 위해 ICG를 사용합니다.
- 주변 인대 해부 및 P8 식별: 오른쪽 간엽의 주변 인대를 해부하고 LUS 프로브를 사용하여 세그먼트 8(P8)의 문맥 분기를 식별하고 필요에 따라 천자 위치와 바늘 각도를 조정합니다.
- 초음파 프로브 삽입 및 ICG를 사용한 양성 염색: 12mm 투관침 포트를 통해 BK 복강경 초음파 프로브를 삽입합니다. LUS에 의해 유도되는 21G 경피적 간담관조영술(PTC) 바늘로 P8에 구멍을 뚫습니다. 니들을 통해 5-10mL의 1.25% ICG를 주입하여 세그먼트 VIII를 염색하여 인접 세그먼트로 역류가 흐르지 않도록 합니다(그림 3)
- hilar 접근법을 통한 간 세그먼트 S8의 해부학적 절제술의 음성 염색:
- S8 간 척추경 해부: 게이트 VI와 게이트 V10 사이의 Lannaec 막을 기반으로 오른쪽 전방 간 힐럼을 노출시킵니다. 그런 다음 오른쪽 전방 간 척추경의 복부 쪽을 따라 해부하고 왼쪽의 두부 쪽으로 절개하여 S8 간 척추경을 노출시킵니다. 이 척추경을 움직이고 들어 올리십시오.
- 지혈 및 음성 염색: 문턱 절제 후 S8 간 척추경의 지혈을 위해 혈관 클램프를 적용하고(그림 4) 종양을 포함하는 S8 분절의 허혈선을 확인합니다. 말초 정맥을 통해 5-10mL의 1.25% ICG를 주입합니다. 5분 후에 형광으로 묘사될 세그먼트 VIII를 찾습니다(그림 5).
- 형광 인터페이스에 의한 간 절제술: 형광을 모니터링하여 염색된 부분이 종양을 덮고 있는지 확인합니다. 초음파 메스 또는 CUSA를 사용하여 형광 영역과 비형광 영역 사이의 계면을 따라 절개하면서 분절간 간 정맥을 보존합니다(그림 6).
참고: 종양과 PT 간 분절 또는 하위 분절은 모두 이러한 방식으로 완전히 절제할 수 있습니다. - 지혈 및 검사: 병변 절제 후 전기 소작 또는 봉합으로 지혈을 달성합니다. 절제 부위를 검사하여 잔류 출혈이나 담즙 누출이 없는지 확인합니다. 단면에서 분절간 정맥과 P8 분절 끝을 관찰합니다(그림 7).
결과
2022년 1월부터 2023년 12월 사이에 총 17명의 환자가 S8 세그먼트의 간 절제술을 받았습니다. 이 중 7례는 비해부학적 절제술, 6례는 간 실질 접근법을 통한 해부학적 절제술, 4례는 문맥 영역 해부학적 절제술이었습니다. 수술 전 Child-Pugh 점수, 종양 크기 및 간 예비 기능에는 그룹 간에 유의한 차이가 없었습니다. PT 해부학적 절제술 그룹의 수술 시간은 비해부학적 절제 및 간 실질 접근법 해부학적 절제 그룹의 수술 시간보다 길었는데, 이는 주로 해당 간 분절의 상대적으로 까다로운 문맥 천자 또는 절제가 더 많은 시간이 필요했기 때문입니다. 두 그룹 간에 수술 중 출혈에는 유의한 차이가 없었지만, 문맥 영역 해부학적 절제술 그룹에서 수술 후 최대 ALT 수치가 다른 두 그룹에 비해 낮았는데, 이는 이 그룹이 비기능 간 조직의 잔여 상태가 적었기 때문인 것으로 보입니다. 모든 수술 가장자리는 1cm를 초과했으며, PT 해부학적 절제 그룹은 다른 두 그룹보다 가장자리가 더 컸습니다. 어떤 경우에도 담즙 누출은 발생하지 않았으며 계획되지 않은 재수술도 없었습니다. 계수 데이터에는 일원 분산 분석이 사용되었고, 측정 데이터에는 순위합 검정이 활용되었습니다. 구체적인 결과는 표 1에 자세히 설명되어 있습니다.
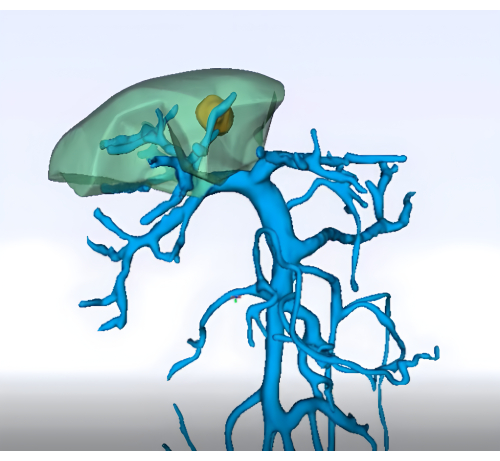
그림 1: 3차원 재구성 기술을 사용한 문맥 영역의 수술 전 분석. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 복강경 간분절 VIII 절제술의 투관침 배치. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
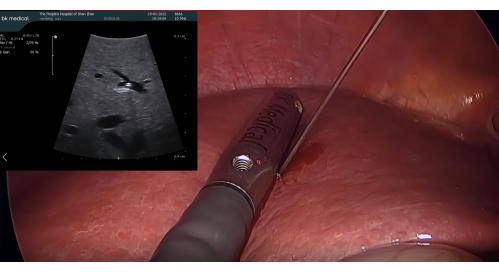
그림 3: 복강경 초음파 프로브에 의해 유도되는 21G PTC 바늘을 사용한 P8의 천공. 약기 : PTC = percutaneous transhepatic cholangiography. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
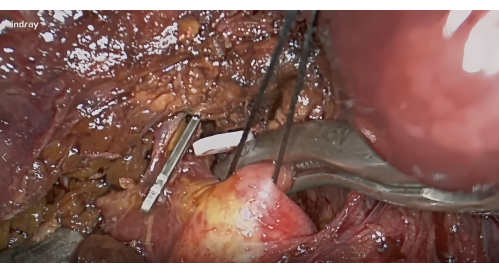
그림 4: Lannaec 막을 따라 VIII 분절의 간 척추경을 해부하고 혈관 클램프로 봉쇄합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 음성 염색 후 절제선 표시. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
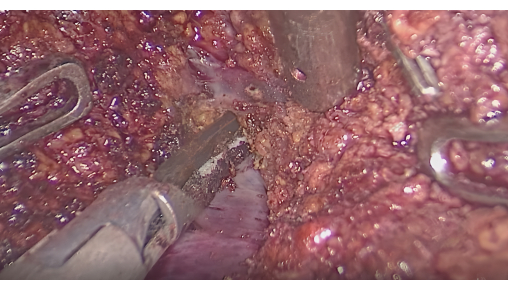
그림 6: 분절간 정맥 사이의 간 실질 절제.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 절제절제술의 분절간 정맥과 P8 그루터기.이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 비해부학적 절제술(n=7) | 실질 접근법을 통한 해부학적 절제술(n=6) | 문맥 영역 기반 해부학적 절제술(N=4) | F 값/χ2 | p-값 | |
| 수술 전 Child-Pugh 점수 | 5.4±0.8 | 5.2±0.4 | 5.3±0.5 | 0.306 | 0.741 |
| 종양 크기(cm) | 3.4±1.5 무늬 | 3.1±0.8 | 2.8±0.6 | 0.454 | 0.644 |
| 수술 전 ICG 15분 잔류율(%) | - | - | - | 0.195 | 0.907 |
| 작동 시간(분) | 189±52년 | 201±36님 | 268±51년 | 3.826 | 0.047 |
| 출혈(mL) | 228±135년 | 175±52 | 170±24년 | 0.716 | 0.506 |
| 최소 수술 마진(cm) | 1.3±0.5 | 1.7±0.3 | 2.0±0.4 | 3.972 | 0.043 |
| 수술 후 최대 ALT(U/L) | 328±109년 | 219±45년 | 152±38 | 7.045 | 0.008 |
| 수술 후 5일차 빌리루빈 수치(μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| 수술 후 퇴원 시간(일) | 7.5±1.3 | 6.7±0.8 | 6.3±1.0 무늬 | 2.279 | 0.139 |
| 수술 후 담즙 누출 | 0 | 0 | 0 | - | - |
| 계획되지 않은 재작업 | 0 | 0 | 0 | - | - |
표 1: 서로 다른 그룹 간의 임상 데이터 비교.
토론
간의 S8 분절, 특히 해부학적 절제술은 여전히 중요한 과제로 남아 있다11. 문맥 척추 기반 해부학적 간절제술의 이론적 기초는 아직 간외과 커뮤니티에서 널리 받아들여지지 않았습니다. 따라서 간담도 외과 의사들은 해부학적 간 절제술의 치료적 가치를 객관적으로 평가하기 위해 강력한 임상 증거를 계속 추구하고 있습니다. 최근 간 해부학적 재개념화의 발전, 특히 Laennec의 캡슐 및 6섹터 이론과 관련하여 이론적으로 특정 세그먼트 또는 하위 세그먼트에 해당하는 개별 간 척추경을 정확하게 식별하고 해부할 수 있게 되었습니다. 형광 복강경 검사와 복강경 초음파 검사의 통합은 복강경 해부학적 간절제술의 실현을 더욱 촉진하여 영역 관류 경계와 수술 중 탐색을 실시간으로 시각화할 수 있게 했습니다. 2021년 도쿄 전문가 합의 회의에 따르면12, 해부학적 절제술은 3차 문맥 가지로 묘사된 특정 문맥 영역과 관련된 간 부분을 완전히 제거하는 것으로 정의됩니다. 해부학적 간 절제술은 해부학적으로 독립적인 간 분절, 하위 분절 또는 결합된 분절을 완전히 절제하는 것이 특징이다11,13. 비해부학적 간 절제술과 비교했을 때, 해부학적 절제술은 관련 문맥 분지 영역과 관련된 해당 간 분절을 동시에 제거하여, 이론적으로 영향을 받은 간 분절에서 문맥 혈류를 통한 종양 전파 위험을 줄이고 수술 후 합병증을 최소화합니다. 결과적으로, 현재 간암에 대해 선호되는 수술 방법으로 간주되고 있다14.
간의 분절 간 또는 분절 평면은 문맥 영역의 경계에 의해 결정됩니다. 이러한 평면을 가로지르는 간정맥은 분절간 정맥(intersegmental veins)이라고 불리며, 이는 간 절제 시 중요한 이정표(landmark)로서 작용하며, 절단면(15)에서 지속적인 노출을 통해 정확한 식별을 가능하게 한다. 이 방법을 사용하려면 간 초음파 영상에 대한 전문 지식, LUS의 능숙한 사용 및 천자 기술이 필요하며 학습 곡선이 필요합니다. 우리의 경험에 비추어 볼 때, 수술 중 초음파의 숙련된 적용은 수술 성공률과 환자 안전을 향상시키는 데 매우 중요합니다. 모든 수준의 외과의는 일상적인 경피적 초음파 중재를 통해 초음파 영상 인식 및 해석에 익숙해지고 기본 수술 기술을 습득하는 것으로 시작해야 합니다. 그 후, 그들은 개복 수술에 초음파를 적용하는 단계로 나아가야 하며, 간 절제를 안내하고 간 종양을 평가하기 위해 초음파를 활용하는 방법을 배워야 합니다. 이 교육 단계는 수술 중 해부학적 구조에 대한 외과의의 이해를 강화할 것입니다. 궁극적으로, 실무자들은 복강경 시술에서 수술 중 초음파를 사용하는 방법을 숙달하여 특히 시각화가 제한된 상황에서 더 높은 정밀도를 달성하는 것을 목표로 해야 합니다. 이러한 점진적인 학습과 실습 과정을 통해 외과의는 복잡한 수술에 초음파 기술을 사용하는 데 능숙해져서 안전성과 효능을 크게 향상시킬 수 있습니다.
LALR-S8 기법은 세그먼트 S8에 대한 혈관 공급을 효과적으로 찾고 분절 간 평면을 정의하는 것을 목표로 합니다. Makuuchi 등은 초음파 유도 하에 문맥을 표적으로 하는 방법을 최초로 제안한 후 종양 분절3의 관류를 명확히 하기 위해 염료 주입을 했습니다. 2008년, Aoki 등은 간 수술 중 분절 국소화를 위한 형광 이미징 기술의 응용을 개척했습니다16. 현재 LUS에 따른 ICG 형광 유도 방법은 복강경 해부학적 간 절제술의 정확도를 높이기 위한 표준 기술이 되었습니다17. 이 접근 방식은 간 표면에서만 볼 수 있는 허혈선의 한계를 해결할 뿐만 아니라 분절 간 평면에서 명확한 형광 경계선의 실시간 시각화를 제공합니다. ICG 형광 염색을 통한 Glissonean 접근법은 기능적 잔여 간 조직의 보존을 극대화하고 수술 중 출혈을 최소화하면서 해부학적 간 절제를 가능하게 합니다.
Makuuchi는 세그먼트 S8에 대한 해부학적 간 절제에는 다음 4단계가 포함되어야 한다고 제안했습니다: (1) 염색 또는 혈류 폐색 기술을 사용하여 표면에 간 세그먼트 경계를 표시; (2) 해당 간 분절의 랜드마크 정맥을 경계로 사용하여 초음파에 의해 유도되는 간 실질 절제술을 수행합니다. (3) 간 절단 표면에서 중요한 정맥의 완전한 노출을 달성하는 것; (4) 간 분절의 뿌리 근처에서 Glisson 시스템을 결찰3. 세그먼트 S8의 문맥 가지는 주로 배쪽과 등쪽 가지로 구성됩니다. 세그먼트 S8의 등쪽 가지는 일반적으로 오른쪽 전방 문맥의 뿌리 근처에서 분기되는 반면, 세그먼트 S5의 포털 정맥 분기는 말단 쪽에서 분기되어 복부 및 등쪽 가지에 대해 별도의 천자 염색이 필요합니다. S8 분절의 등쪽 가지와 오른쪽 전방 문맥 사이에 흐르는 중간 간 정맥(V8)의 두드러진 가지가 있으며, S8의 정맥 배액을 담당합니다. 세그먼트 S8의 전체 절제 후 절단면에서 중간 간 정맥, 오른쪽 간 정맥 및 하대정맥을 볼 수 있습니다.
2022년 1월부터 2023년 12월까지 총 17명의 환자가 간 S8 분절 절제술을 받았습니다. 모든 환자는 회복되어 큰 합병증 없이 퇴원했습니다. 간 수술에 대한 우리의 경험은 이론적 지식과 실용적인 기술의 통합을 강조하며, 특히 상세한 간내 해부학 학습에서 시체 간을 사용한 해부 실습을 권장합니다. 또한 시뮬레이션 교육과 최소 침습 절차에 대한 참여를 통해 복강경 기술을 습득하는 것의 중요성을 강조합니다. 고조파 메스 및 수술 중 초음파와 같은 다양한 내시경 기구에 대한 지식이 중요합니다. 또한, 해부학적 간 절제술의 이론과 기법을 이해하기 위해 현장 교육 및 외과 디브리핑을 활용하는 것이 필수적이며, 점차적으로 절차상의 복잡성을 증가시키고 궁극적으로 단순화를 달성하는 데 중점을 둡니다. 수술 중 초음파의 능숙한 적용, 수술 팀 내 긴밀한 협력, 수술 성과에 대한 철저한 자체 검토도 마찬가지로 중요합니다. 효과적인 수술 중 구조 메커니즘이 필수적이며, 필요한 경우 적시에 개복 수술로 전환하고 선임 외과의의 지원을 확보하여 절차적 성공을 향상시키는 것이 중요합니다.
우리의 경험에서 우리는 다음과 같은 통찰력을 얻었습니다 : (1) Glissonean pedicle microdissection에 초점을 맞춘 사체 교육을 통한 3D 분절 해부학 마스터. (2) 기구 정밀도를 위한 시뮬레이션 기반 최소 침습 드릴을 통해 복강경 기술을 연마합니다. (3) 안전한 실질 절편을 위해 에너지 장치(초음파 메스/CUSA/ICG 형광)를 최적화합니다. (4) AR 전략 최적화를 위해 비디오 분석과 사례 디브리핑을 결합한 멀티모달 러닝(Multimodal Learning)을 구현합니다. (5) 마취과 의사가 관리하는 CVP 제어 및 능숙한 수술 지원으로 팀 시너지를 강화합니다. (6) 개방 전환 임계값과 선임 외과의 에스컬레이션 경로를 정의하는 구조 프로토콜을 수립합니다.
그러나 이 연구는 소수의 사례만 다루기 때문에 몇 가지 제한 사항이 있습니다. 또한 이 연구는 후향적이며 환자 선택이 제한적입니다. 다양한 최소 침습적 간 절제 기술의 장점과 단점을 더 자세히 비교하기 위해 보다 정밀하게 설계된 전향적 연구가 필요합니다. 보다 신뢰할 수 있는 데이터를 얻는 대로 즉시 경험을 공유하겠습니다.
공개
저자는 공개할 이해 상충이나 재정적 유대 관계가 없습니다.
감사의 말
이 작업은 광둥성 기초 및 응용 기초 연구 기금 프로젝트(No. 2023A1515220114)의 보조금으로 지원되었습니다. 심천시 과학기술혁신위원회(No.KJZD20230923114120038), 선전시 중점의료분야건설기금(No.SZXK015)의 과학기술 전공 프로젝트; 광동성 및 국가 핵심 임상 전문 건설 프로젝트 및 국가 핵심 임상 전문 건설 프로젝트.
자료
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
참고문헌
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유