Method Article
肝細胞癌を治療するための門脈領域に基づく肝臓セグメントの低侵襲解剖学的切除VIII
* これらの著者は同等に貢献しました
要約
この研究では、腹腔鏡下 S8 センジュメンテクトミー技術について詳しく説明し、門脈椎弓根ナビゲーションによって導かれる部分切除術から解剖学的切除への移行を強調しています。3D解剖学的理解の向上、洗練された低侵襲スキル、術中超音波の習得により、手技の精度と安全性が向上し、合併症を軽減しながら、体系化された解剖学的切除プロトコルを通じて肝臓の手術結果を最適化しました。
要約
肝切除術は、肝細胞がん(HCC)の主要な治療法であり、切除の程度に基づいて解剖学的肝切除術と非解剖学的肝切除術に分類されます。解剖学的肝切除術は、門脈領域 (PT) 肝臓セグメントまたはサブセグメントを基本的な解剖学的単位として利用し、腫瘍担存 PT を体系的に切除し、この領域を供給および境界決定する Glisson システムを完全に除去して腫瘍学的有効性を高めます。非解剖学的肝切除術は、根治的腫瘍学的切除術の原則に従い、腫瘍縁から1cm以上離れた肝臓組織の切除に重点を置いています。精密手術の概念の普及に伴い、PTに基づく低侵襲解剖学的肝切除術が広く適用されています。しかし、肝臓のセグメントS8の低侵襲切除は、依然として最も困難な肝臓切除の1つと考えられています。術中超音波、蛍光腹腔鏡検査、およびLannaec膜解剖技術を使用して、肝臓の門脈領域セグメントS8の解剖学的切除に成功し、良好な短期臨床結果を達成しました。
概要
肝臓がんとして一般に知られている肝細胞がんは、中国で最も一般的な悪性腫瘍の1つです。2022年、中国では367,700人の肝臓がんの新規症例があり、発生率で4番目に高くなっています。死亡者数は316,500人に達し、がん関連死の第2位となっています1。肝切除術は、HCC2 患者の長期生存のための最良の機会の 1 つを提供します。肝臓切除は、切除の程度に基づいて、解剖学的肝切除術(AR)と非解剖学的肝切除術(NAR)に分類できます。ARは、解剖学的に独立した肝臓セグメントまたは結合セグメント、および腫瘍担持門脈枝内の肝実質の完全な切除を含み、より良い腫瘍学的転帰を達成し、残存虚血性または混雑領域からの合併症を回避します。ARの利点は、腫瘍切除の徹底性と、残りの肝臓3の流入および流出肝管の完全な保存に反映されています。一方、NARは不規則性肝切除術とも呼ばれ、腫瘍学的根治切除の原理に基づいて腫瘍縁から1cm以上離れた肝臓組織を切除することを指します。この外科的方法は、肝臓の解剖学的セグメンテーションに厳密に準拠するのではなく、腫瘍の位置とサイズに応じて調整され、腫瘍切除のための安全なマージンを確保しながら、できるだけ多くの正常な肝臓組織を保存することを目的としています。
精密手術の概念の進歩と肝臓の解剖学的構造のより深い理解により、門脈領域 (PT-AR) に基づく解剖学的肝臓切除の理論と実践は、近年認識され、最初の推進を得ています4。PT-ARは、術前の三次元再構成と流域分析を行い、腫瘍担存門脈領域(PT)を特定し、それに応じて手術を計画します。術中では、流域内の肝臓セグメントまたはサブセグメントが基本的な解剖学的単位として使用され、インドシアニングリーン(ICG)蛍光染色ナビゲーションが主な方法であり、代表的なセグメント間肝静脈(IHV)を露出させることによって補完されます。次に、肝臓を生理学的裂傷に沿って解剖し、腫瘍担持門脈を完全に切除すると同時に、将来の肝残存物(FLR)の完全性と機能的保存を確保します。標的肝椎弓根の結紮後の門脈陽性染色または逆行性染色のための重ね合わせた術中超音波ガイド下穿刺は、PT-ARを達成するための基本的な技術要件です。
腹腔鏡下肝切除術は、従来の開腹手術と比較して、その低侵襲アプローチと優れた回復結果で認められています。ただし、さまざまな肝臓セグメントを切除する複雑さはさまざまです。肝臓のセグメントVIIIは、上腹部の奥深く、肝静脈と下大静脈の近くに位置し、セグメントVIIIのグリッソーニアン椎弓根に直接アクセスするという課題とともに、腹腔鏡下解剖学的肝臓切除をこのセグメント5,6,7,8,9にとって特に困難にします。
この研究は、肝細胞癌に対する肝臓セグメントS8の門脈領域解剖学的切除を示しています。私たちの目的は、腹腔鏡下超音波ガイド下穿刺技術やLannaec膜に基づく肝椎弓根解剖技術など、この手術の技術と主要なステップを詳述することです。このプロトコルを共有することにより、S8肝細胞癌の治療における腹腔鏡下門脈静脈局所解剖学的肝切除の実現可能性と安全性を裏付ける証拠を提供し、最終的に患者の治療転帰を改善することを望んでいます。
プロトコル
セグメント 8 (LALR-S8) の腹腔鏡下解剖学的肝切除術を含む研究は、標準的な倫理的慣行を順守しています。深セン人民病院の倫理委員会(LL-KY-2020462)から承認を受けました。さらに、各患者から書面によるインフォームドコンセントが得られ、研究が医療倫理の規範と要件に準拠していることを確認しました。
1. 患者様の選択
- 以下の選択基準を使用してください。
- 良性または悪性の肝腫瘍の患者に対して LALR-S8 を実行し、標準的な心肺評価、血液検査、および生化学的評価を受けることを確認します。彼らが手術や麻酔の禁忌を持っていないことを確認してください。
- 腹部CT血管造影、肝臓と血管系の三次元再建、強化されたMRIなどの術前イメージング、および残存および標準肝臓量の計算を行います。
- 次の除外基準を使用してください: ピューチャイルドクラスCに分類された肝機能を持つ患者;全身麻酔に耐えられない人。肝内または肝外転移のある患者;開腹手術を受けた方部分切除またはその他の併用外科的治療を受けた患者。
2. 術前準備、手術体位、麻酔
- 術前準備
- 病歴と身体検査:肝機能、凝固プロファイル、ICGクリアランステスト、および全体的な健康状態を評価します。
- イメージング:詳細な術前イメージング(強化腹部CT、MRI、肝臓と血管系の3次元再構成など)を取得して、肝臓のセグメント8とその血管系の解剖学的構造を描写します(図1)
- 断食:患者が断食の指示を守っていることを確認します。通常は手術の前日の深夜から開始されます。
- 薬:必要に応じて予防的抗生物質を投与し、出血や肝機能に影響を与える可能性のある薬を検討します。
- インフォームドコンセントと教育:腹腔鏡手術の方法、リスク、利点などを説明し、インフォームドコンセントを取得します。
- 手術位置
- 仰臥位:患者を手術台に仰臥位で配置します。
- リバーストレンデレンブルグポジション:手術台をわずかに傾けて、肝臓への露出とアクセスを容易にします。
注:この位置は、肝臓を上腹部から上向きに動かすのに役立ちます。 - 安定化:患者を手術台に固定して、手術中の動きを防ぎます。
- 麻酔
- 全身麻酔:全身麻酔を施して、手術中ずっと患者が意識がなく快適であることを保証します。
- 導入と維持:静脈内導入薬(プロポフォールなど)と筋 ?? 緩薬(サクシニルコリンなど)を挿管に使用します。.吸入剤(セボフルランなど)と補助鎮痛薬(フェンタニルなど)で麻酔を維持します。.麻酔の深さを調整して、適切な麻酔と患者の安全を確保します。
- モニタリング:心拍数、血圧、血中酸素飽和度、および呼気終末二酸化炭素レベルを継続的に監視します。
3.外科技術
- 静脈内吸入麻酔後、患者を左30°の左側褥位に置き、頭を持ち上げ、脚を離します。肝切除には 5 ポート アプローチを使用し、送気圧を 11-13 mmHg に維持し、中心静脈圧を 3-5 cmH2O に維持し、プリングル マヌーバを 10-15 分間の閉塞に適用した後、5 分間の解放を行います。
- 臍の右端から2cm下に垂直に切開し、腹壁層を順次開いて腹部にアクセスします。12 mm のトロカールを挿入して気腹を確立し、腹腔鏡を腹腔内に導入します。
- 次のように5つのトロカールを配置します:観察のために1つの12mmトロカールを臼上領域に置きます。右前腋窩線に5mmトロカール1個。右内側鎖骨の下に1つの12 mmトロカール。剣状突起の2cm下に水平に5mmのトロカールが1つ。臍の2cm上に12mmのトロカールが1つある(図2)。
注:肝臓切除に使用される一般的な手術器具には、術中の腹腔鏡超音波、ハーモニックメス、およびバイポーラ凝固装置が含まれます。 - 術中腹腔鏡下超音波 (LUS) を使用して穿刺をガイドし、ICG を使用して肝臓セグメント S8 の解剖学的切除の陽性染色を行います。
- 周囲の靭帯の解剖とP8の同定:右肝葉の周囲の靭帯を解剖し、LUSプローブを使用してセグメント8(P8)の門脈枝を特定し、必要に応じて穿刺位置と針の角度を調整します。
- 超音波プローブの挿入とICGによる陽性染色:BK腹腔鏡下超音波プローブを12mmトロカールポートに挿入します。LUSに誘導された21Gの経皮的経肝胆管造影(PTC)針でP8を穿刺します。1.25% ICG を 5-10 mL の 1.25% ICG を針を通して注入し、セグメント VIII を染色し、隣接するセグメントへの逆行性の流れがないことを確認します(図 3)。
- 肺門アプローチによる肝セグメントS8の解剖学的切除の陰性染色:
- S8 肝椎弓根の解剖: ゲート VI とゲート V10 の間の Lannaec 膜に基づいて、右前肝門を露出させます。次に、右前肝椎弓根の腹側に沿って、左側の頭側に向かって解剖して、S8肝椎弓根を露出させます。この茎を動員して持ち上げます。
- 止血と陰性染色:門郭清後、S8肝椎弓根の止血のために血管クランプを適用し(図4)、セグメントS8の虚血線が腫瘍を含むことを確認します。末梢静脈から5〜10mLの1.25%ICGを注入します。5分後に蛍光によって描かれるセグメントVIIIを探します(図5)。
- 蛍光界面による肝切除:蛍光をモニターして、染色領域が腫瘍を覆っていることを確認します。超音波メスまたはCUSAを使用して、蛍光領域と非蛍光領域の間の界面に沿って切開を行い、セグメント間肝静脈を温存します(図6)。
注:腫瘍とPT肝セグメントまたはサブセグメントの両方をこの方法で完全に切除できます。 - 止血と検査:病変切除後の電気焼灼または縫合により止血を達成します。切除部位を検査し、残留出血や胆汁漏れがないことを確認します。断面で、セグメント間静脈とP8セグメントの端を観察します(図7)。
結果
2022年1月から2023年12月の間に、合計17人の患者がセグメントS8の肝切除術を受けました。これらのうち、7例は非解剖学的切除を含み、6例は肝実質的アプローチによる解剖学的切除であり、4例は門脈領域解剖学的切除であった。術前のChild-Pughスコア、腫瘍の大きさ、および肝臓予備機能にグループ間で有意差はありませんでした。PT解剖学的切除群の手術時間は、非解剖学的切除群および肝実質的アプローチ解剖学的切除群の手術時間よりも長かったが、これは主に、対応する肝臓セグメントの門脈穿刺または解剖が比較的困難であり、より多くの時間を必要としたためである。術中の失血量に群間で有意差は認められなかったが、術後のピークALTレベルは門脈領域解剖学的切除群で他の2つの群に比べて低かった。すべての手術断端が1cmを超え、PT解剖学的切除群は他の2つの群よりも断端が大きかった。いずれの場合も胆汁漏れは発生せず、予定外の再手術もありませんでした。カウントデータには一元配置ANOVA分析が使用され、測定データにはランクサム検定が使用されました。具体的な結果を 表1に示します。
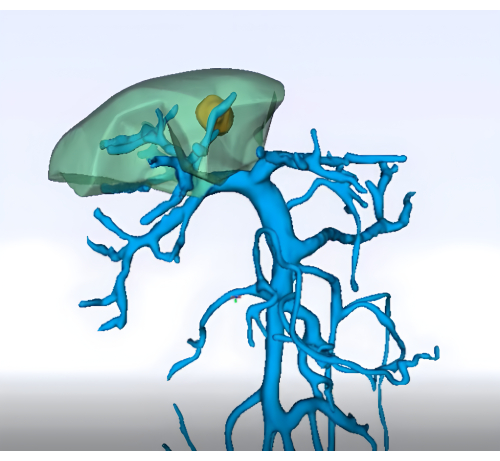
図1:3次元再構成技術を用いた門脈領域の術前解析。 この図の拡大版を表示するには、ここをクリックしてください。

図2:腹腔鏡下肝セグメントVIII切除術のトロカール留置。 この図の拡大版を表示するには、ここをクリックしてください。
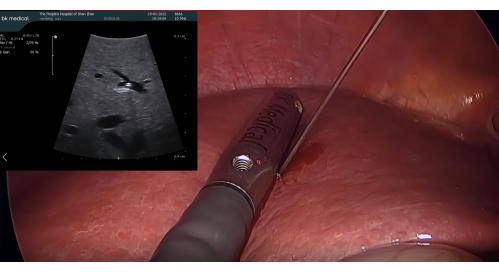
図3:腹腔鏡超音波プローブによってガイドされた21G PTC針によるP8の穿刺。 略称:PTC=経皮的経肝胆管造影。 この図の拡大版を表示するには、ここをクリックしてください。
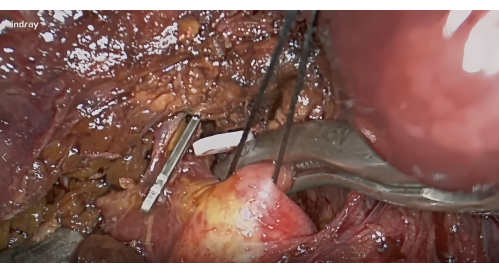
図4:Lannaec膜に沿ったセグメントVIIIの肝椎弓根の解剖と血管クランプによる封鎖。 この図の拡大版を表示するには、ここをクリックしてください。

図5:陰性染色後の切除線のマーキング。 この図の拡大版を表示するには、ここをクリックしてください。
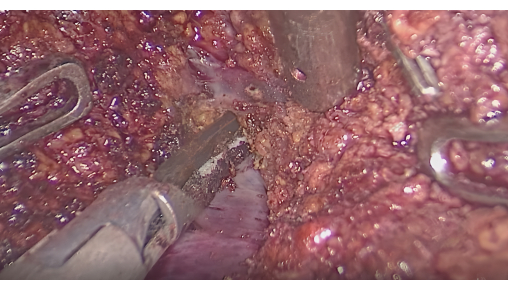
図6:セグメント間静脈間の肝実質の解剖。 この図の拡大版を表示するには、ここをクリックしてください。

図7:切除切片の分節間静脈とP8断端。 この図の拡大版を見るには、ここをクリックしてください。
| 非解剖学的切除術 (n=7) | 実質的アプローチによる解剖学的切除術 (n=6) | 門脈領域に基づく解剖学的切除術 (n=4) | F 値/χ2 | p値 | |
| 術前Child-Pughスコア | 5.4±0.8 | 5.2±0.4 | 5.3±0.5 | 0.306 | 0.741 |
| 腫瘍サイズ(cm) | 3.4±1.5 | 3.1±0.8 | 2.8±0.6 | 0.454 | 0.644 |
| 術前ICG 15分保持率(%) | - | - | - | 0.195 | 0.907 |
| 手術時間(分) | 189±52 | 201±36 | 268±51 | 3.826 | 0.047 |
| 失血(mL) | 228±135 | 175±52 | 170±24 | 0.716 | 0.506 |
| 最小手術マージン(cm) | 1.3±0.5 | 1.7±0.3 | 2.0±0.4 | 3.972 | 0.043 |
| 術後ALT(U / L)のピーク | 328±109 | 219±45 | 152±38 | 7.045 | 0.008 |
| 術後5日目のビリルビン値(μmol/L) | 17.2±8.2 | 18.1±4.2 | 14.7±4.3 | 0.389 | 0.685 |
| 術後退院時間(日) | 7.5±1.3 | 6.7±0.8 | 6.3±1.0 | 2.279 | 0.139 |
| 術後の胆汁漏出 | 0 | 0 | 0 | - | - |
| 予定外の再手術 | 0 | 0 | 0 | - | - |
表1:異なるグループ間の臨床データの比較。
ディスカッション
肝臓のセグメントS8の切除、特に解剖学的切除は、依然として重要な課題である11。門脈椎弓根ベースの解剖学的肝切除術の理論的基礎は、肝臓外科コミュニティ内でまだ広く受け入れられていません。その結果、肝胆道外科医は、解剖学的肝切除の治療的価値を客観的に評価するために、確固たる臨床的証拠を追求し続けています。肝臓の解剖学的再概念化における最近の進歩、特にラエネックのカプセルと6セクター理論に関する進歩により、理論的には、特定のセグメントまたはサブセグメントに対応する個々の肝椎弓根の正確な同定と解剖が可能になりました。蛍光腹腔鏡検査と腹腔鏡下超音波検査の統合により、腹腔鏡下解剖学的肝切除術の実現がさらに容易になり、領土灌流境界のリアルタイムな視覚化と術中ナビゲーションが可能になりました。202112 年の東京専門家コンセンサス会議によると、解剖学的切除は、特定の門脈領域に関連する肝臓部分を完全に切除することと定義され、三次門脈枝によって描かれています。解剖学的肝臓切除術は、解剖学的に独立した肝臓セグメント、サブセグメント、または結合セグメント11,13の完全切除によって特徴付けられる。非解剖学的肝切除と比較して、解剖学的切除は、関連する門脈枝領域に関連する対応する肝臓セグメントを同時に除去し、理論的には、影響を受けた肝臓セグメントの門脈血流を介した腫瘍播種のリスクを減らし、術後合併症を最小限に抑えます。その結果、現在、肝臓がん14の好ましい外科的アプローチと見なされています。
肝臓の分節間または分節面は、門脈領域の境界によって決定されます。これらの平面を横切る肝静脈は、節間静脈と呼ばれ、肝臓切除中の重要な目印として機能し、切断面15での連続的な曝露を通じて正確な同定を可能にする。この方法では、肝臓超音波画像診断、LUSの熟練した使用、および学習曲線を必要とする穿刺技術の専門知識が必要です。私たちの経験に基づいて、術中超音波の熟練した適用は、手術の成功率と患者の安全性を高めるために重要です。すべてのレベルの外科医は、日常的な経皮的超音波介入を通じて超音波画像の認識と解釈に慣れ、基本的な操作スキルを習得することから始める必要があります。その後、開腹手術での超音波の応用に進み、肝臓切除の指導や肝腫瘍の評価に超音波を利用する方法を学ぶ必要があります。トレーニングのこのフェーズは、術中の解剖学的構造に対する外科医の理解を強化します。最終的に、開業医は、腹腔鏡手術での術中超音波の使用を習得して、特に視覚化が限られている状況でより高い精度を達成することを目指す必要があります。この段階的な学習と実践のプロセスを通じて、外科医は複雑な手術に超音波技術を採用することに長け、安全性と有効性の両方を大幅に向上させることができます。
LALR-S8 技術は、セグメント S8 への血管供給を効果的に特定し、セグメント間平面を定義することを目的としています。幕内らは、超音波ガイド下で門脈を標的とする方法を最初に提案し、続いて腫瘍セグメントの灌流を明らかにするために色素注入を提案しました3。2008年、青木らは、肝臓手術中のセグメント局在化のための蛍光イメージング技術の応用を先駆的に開始しました16。現在、LUSの下でのICG蛍光ガイド法は、腹腔鏡下解剖学的肝臓切除術17の精度を向上させるための標準的な技術となっています。このアプローチは、虚血線が肝臓表面にのみ見えるという制限に対処するだけでなく、セグメント間平面上の明確な蛍光境界線をリアルタイムで視覚化します。ICG 蛍光染色によるグリッソーニアン アプローチにより、解剖学的肝臓切除が可能になり、機能的な残留肝臓組織の保存を最大化し、術中の出血を最小限に抑えることができます。
幕内氏は、セグメントS8の解剖学的肝臓切除には4つのステップを含めるべきであると提案しました:(1)染色または血流閉塞技術を使用して表面上の肝臓セグメント境界をマークします。(2)その肝臓セグメントのランドマーク静脈を境界として使用して、超音波によって誘導される肝実質切除を行う。(3)肝臓の切断面で重要な静脈の完全な露出を達成する。(4)肝臓セグメント3の根元付近でグリッソン系を結紮する。セグメントS8の門脈枝は、主に腹側と背側の枝で構成されています。セグメントS8の背側枝は通常、右前門脈の根元近くで分岐しますが、セグメントS5の門脈枝はその末端側で分岐するため、腹側と背側に別々の穿刺染色が必要です。セグメントS8の背側枝と右前門脈との間には、S8からの静脈ドレナージを担う中肝静脈(V8)の顕著な枝があります。セグメントS8の完全切除後、切断面に中肝静脈、右肝静脈、および下大静脈が見られます。
2022年1月から2023年12月までに、合計17人の患者が肝臓S8セグメント切除術を受けました。すべての患者は回復し、大きな合併症もなく退院しました。肝臓外科における私たちの経験は、特に詳細な肝内解剖学の学習において、理論的知識と実践的なスキルの統合を強調しており、死体肝臓を使用した解剖実践を推奨しています。さらに、シミュレーショントレーニングと低侵襲手術への参加を通じて腹腔鏡技術を習得することの重要性を強調しています。ハーモニックメスや術中超音波など、さまざまな内視鏡器具に精通していることは非常に重要です。さらに、解剖学的肝切除の理論と技術を理解するためには、現場でのトレーニングと外科的デブリーフィングを活用することが不可欠であり、手続きの複雑さを徐々に増やし、最終的には簡素化を達成することに焦点を当てています。術中超音波の熟練した適用、外科チーム内での緊密な協力、および手術パフォーマンスの徹底的な自己レビューも同様に重要です。効果的な術中レスキューメカニズムが不可欠であり、必要に応じて開腹手術へのタイムリーな転換を確保し、上級外科医からのサポートを確保して手続きの成功を高めます。
私たちの経験から、私たちは次の洞察を持っています:(1)グリッソーニアン椎弓根顕微鏡解剖に焦点を当てた死体トレーニングによるマスター3Dセグメント解剖学。(2)シミュレーションベースの低侵襲ドリルを通じて腹腔鏡技術を磨き、器具の精度を高めます。(3)エネルギーデバイス(超音波メス/ CUSA/ICG蛍光)を最適化して、安全な実質離滅離死を実現します。(4) AR戦略最適化のためのビデオ分析とケースデブリーフィングを組み合わせたマルチモーダルラーニングを実装する。(5)麻酔科医が管理するCVPコントロールと熟練した外科的支援により、チームの相乗効果を強化します。(6)オープンコンバージョンの閾値と上級外科医のエスカレーション経路を定義するレスキュープロトコルを確立します。
ただし、この研究にはいくつかのケースしか含まれていないため、いくつかの制限があります。さらに、この研究はレトロスペクティブであり、患者の選択は限られています。さまざまな低侵襲肝切除術の長所と短所をさらに比較するには、より正確に設計された前向き研究が必要です。より信頼性の高いデータを取得したら、迅速に経験を共有します。
開示事項
著者には、開示すべき利益相反や金銭的なつながりはありません。
謝辞
この研究は、広東省基礎応用基礎研究基金プロジェクト(No.2023A1515220114)からの助成金によって支援されました。深セン市科学技術革新委員会の科学技術主要プロジェクト(第KJZD20230923114120038号)、深セン主要医療規律建設基金(第SZXK015号)。広東省および国家重点臨床専門建設プロジェクトおよび国家重点臨床専門建設プロジェクト。
資料
| Name | Company | Catalog Number | Comments |
| Bipolar electric coagulation forceps | Mindray | Seal 7 | For blood vessel coagulation and division |
| Fluorescence Endoscopic camera system | Mindray | R1 | An endoscopic camera system with 4K fluorescence imaging |
| Intraoperative Ultrasonic imaging system | ALOKA | UST-5418 | With the four-directional flexible linear array ultrasonic laparoscopic transducer, the intraoperative ultrasound support ultrasonic elastography, contrast ultrasound, and magnetic navigation guided puncture |
| Intraoperative Ultrasonic imaging system | Mindray | LAP13-4Cs | Four-directional flexible linear array ultrasonic laparoscopic transducer which supports support ultrasonic elastography and contrast ultrasound |
| SPSS 20.0 | statistical analysis software | ||
| Ultrasonic scalpel | Johnson & Johnson | ETHICON GEN11 | For blood vessel coagulation and division |
参考文献
- Zheng, R. S., et al. Cancer incidence and mortality in China, 2022. Chinese Journal of Oncology. 46 (3), 221-231 (2024).
- Qin, S. Primary liver cancer diagnosis and treatment Expert Panel of the Chinese Ministry of Health Guidelines on the diagnosis and treatment of primary liver cancer (2011 edition). Chin Clin Oncol. 1 (1), 10(2012).
- Makuuchi, M., Hasegawa, H., Yamazaki, S. Ultrasonically guided subsegmentectomy. Surg Gynecol Obstet. 161 (4), 346-350 (1985).
- Wang, X., Cao, J., Li, J. Anatomic liver resection based on portal territory with margin priority for hepatocellular carcinoma. JAMA Surg. 159 (6), 710-711 (2024).
- Urade, T., et al. Laparoscopic anatomical liver resection using indocyanine green fluorescence imaging. Asian J Surg. 43 (1), 362-368 (2020).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Morimoto, M., et al. Minimally invasive anatomic liver resection: Results of a survey of world experts. J Hepatobiliary Pancreat Sci. 29 (1), 33-40 (2022).
- Goh, E. L., Chidambaram, S., Ma, S. Laparoscopic vs open hepatectomy for hepatocellular carcinoma in patients with cirrhosis: A meta-analysis of the long-term survival outcomes. Int J Surg. 50, 35-42 (2018).
- Ban, D., et al. A novel difficulty scoring system for laparoscopic liver resection. J Hepatobiliary Pancreat Sci. 21 (10), 745-753 (2014).
- Sugioka, A., Kato, Y., Tanahashi, Y. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec's capsule: proposal of a novel comprehensive surgical anatomy of the liver. J Hepatobiliary Pancreat Sci. 24 (1), 17-23 (2017).
- Xie, Q., Gao, F. A commentary on 'approaches of laparoscopic anatomical liver resection of segment 8 for hepatocellular carcinoma: a retrospective cohort study of short-term results at multiple centers in China'. Int J Surg. 111 (1), 1646-1647 (2023).
- Ciria, R., et al. Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery. J Hepatobiliary Pancreat Sci. 29 (1), 41-50 (2022).
- Morimoto, M., et al. and Study group of Precision Anatomy for Minimally Invasive Hepato-Biliary-Pancreatic surgery (PAM-HBP surgery). Glissonean approach for hepatic inflow control in minimally invasive anatomic liver resection: A systematic review. J Hepatobiliary Pancreat Sci. 29 (1), 51-65 (2022).
- Fuks, D., Aldrighetti, L., Jiao, L. R., Wakabayashi, G., Limongelli, P. Laparoscopic management of hepatocellular carcinoma: A critical reappraisal. Surg Laparosc Endosc Percutan Tech. 27 (4), 203-205 (2017).
- Monden, K., et al. Landmarks and techniques to perform minimally invasive liver surgery: A systematic review with a focus on hepatic outflow. J Hepatobiliary Pancreat Sci. 29 (1), 66-81 (2022).
- Kang, L. -M., Zhang, F. -W., Yu, F. -K., Xu, L. Pay attention to the application of indocyanine green fluorescence imaging technology in laparoscopic liver cancer resection. World J Clin Cases. 12 (23), 5288-5293 (2024).
- Cassinotti, E., et al. European Association for Endoscopic Surgery (EAES) consensus on Indocyanine Green (ICG) fluorescence-guided surgery. Surg Endosc. 37 (3), 1629-1648 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved