Method Article
조잡한 복막 삼출액 세포와 자연 항원 자극을 사용한 Ex vivo 비만 세포 탈과립 분석
* 이 저자들은 동등하게 기여했습니다
요약
당사는 마우스에서 분리한 미가공 복막 삼출물 세포를 배양하고, 관심 약리제로 처리하고, 운반체 단백질에 DNP를 사용하여 미리 항디니트로페놀(DNP) IgE를 투여하여 수행하는 생체 외 비만 세포 탈과립 분석을 확립했습니다.
초록
비만세포 안정제는 알레르기 약물의 필수적인 부분입니다. 수동태 전신 아나필락시스(PSA)는 생체 내에서 비만 세포에 대한 관심 약리학적 제제의 효과를 조사하는 데 널리 사용되는 동물 분석법입니다. 아나필락시스 증상은 주로 비만세포에서 추출한 과립의 외세포작용(exocytosis)에 기인하기 때문에, 증상을 완화시키는 물질은 비만세포를 안정화시키는 활성을 갖는 것으로 생각된다. 그럼에도 불구하고, 치료 후 비만 세포의 기능적 활성이 감소하는 것을 직접 입증하여 활성을 확인하는 것이 현명합니다. 이를 위해 불멸화된 비만 세포주 또는 배양된 1차 비만 세포를 사용하는 체외 탈과립 분석이 일상적으로 사용됩니다. in vitro 및 in vivo 분석의 결과가 항상 서로 유사한 것은 아닙니다. 그러나 in vitro assay의 처리 조건(예: treatment dose, time, 주변 환경)은 PSA와 같은 in vivo assay의 처리 조건과 구별되는 경우가 많습니다. in vivo 세포에 대한 약리학적 제제의 효과를 보다 밀접하게 반영하기 위한 in vitro(또는 ex vivo) 분석을 추구하기 위해, 당사는 마우스에서 분리한 조잡한 복막 삼출물 세포(PEC)를 제제로 처리하고 항-디니트로페놀(DNP) IgE를 투여한 후 운반체 단백질에서 DNP와 함께 직접 배양하는 ex vivo 비만 세포 탈과립 분석을 고안했습니다. 이 분석법은 in vivo 분석에 의해 표시된 약리학적 제제의 비만 세포 안정화 활성을 검증하는 데 유용할 뿐만 아니라 실용적이고 재현성이 높은 것으로 나타났습니다.
서문
비만 세포는 알레르기에서 중심적인 역할을 합니다 1,2. IgE에 대한 친화성이 높은 수용체(FcεRI)와의 상호작용을 통해 비만 세포 표면에 위치한 IgE가 동족 알레르기 항원을 만나면 신호 연쇄 반응이 유도되어 과립의 방출을 촉진합니다. 그 결과, 모노아민(예: 히스타민, 세로토닌), 사이토카인(예: TNF-α) 및 단백질 분해 효소(예: 트립타제, 키마제)를 포함한 다양한 알레르기 효과 분자가 방출되어 일련의 면역학적, 신경학적 및 혈관근 반응을 일으킵니다 3,4.
비만 세포 안정제(mast cell stabilizer)라고 하는 의약품 종류는 비만 세포 기능을 약화시켜 알레르기 증상을 완화합니다5. 수동적 전신 아나필락시스(PSA)는 약리학적 제제의 비만 세포 안정화 활성을 조사하는 데 자주 사용되는 동물 모델입니다. 아나필락시스 증상은 주로 수동적으로 전달된 합텐 특이적 IgE와 나중에 동물에 주입된 운반 단백질의 합텐의 상호 작용에 따른 비만세포의 활성화로 인해 발생하기 때문에, 관심 약리학적 제제의 치료가 증상의 개선으로 이어질 때 비만세포 안정화 활성을 지닌다는 것은 잘 받아들여지고 있습니다6. 그럼에도 불구하고, 증상의 개선이 비만 세포 기능의 억제 이외의 메커니즘에서 파생될 가능성을 배제하기 위해 별도의 실험에서 제제에 의한 비만 세포 기능의 손상을 직접 입증하는 것이 필수적인 경우가 많습니다.
비만 세포 표면에 FcεRI와 복합체를 형성하는 IgE의 특정 항원 또는 화학 시약으로 비만 세포를 자극하여 분비 과립의 외세포작용(즉, 탈과립)을 유도하는 방식으로 수행되는 비만 세포 탈과립 분석법은 일반적으로 in vitro7 약리학 시약의 비만 세포 안정화 활성을 측정하는 데 사용됩니다. 이 분석에는 쥐 호염기성 백혈병(RBL) 세포주8, 골수 유래 비만 세포(BMMC)9 및 복막 세포 유래 비만 세포(PCMC)10를 포함한 여러 유형의 세포가 사용됩니다. RBL은 많은 수의 세포를 쉽게 얻을 수 있기 때문에 유용하지만, 세포 특성이 더 이상 신체의 비만 세포와 유사하지 않은 불멸의 암 세포주입니다. 충분한 수의 BMMC 또는 PCMC를 획득하는 것은 세포 특성이 신체의 비만 세포와 더 유사할 수 있음에도 불구하고 종종 비용이 많이 들고 시간이 많이 걸립니다.
정제된 1차 비만 세포를 사용한 탈과립 분석법은 바람직한 대안입니다11. 그럼에도 불구하고, 이러한 분석법의 사용은 동물 조직, 특히 마우스 조직에서 비만 세포를 높은 수율로 정제하기 위한 손쉬운 방법으로 널리 보급되어 있지 않으며 순도는 아직 사용할 수 없습니다. 더욱이, 비만 세포 기능을 in vitro에서 억제하기 위한 약리학적 제제를 사용한 치료의 농도 및 기간이 in vivo와 항상 일치하지 않을 수 있기 때문에 in vitro 탈과립 분석으로 얻은 결과는 PSA와 같은 in vivo 분석의 결과를 잘못 나타낼 수 있으며 그 반대의 경우도 마찬가지입니다. 따라서 생체 내에서 발생하는 비만 세포 활성화 방식을 밀접하게 모방할 뿐만 아니라 생체 내 비만 세포에 가해지는 약리학적 시약의 효과를 정확하게 반영하는 새로운 탈과립 분석에 대한 수요가 높습니다. 이러한 요구를 충족하기 위해 당사는 마우스에서 분리한 복막 삼출액 세포(PEC)의 비만 세포를 관심 약리제로 처리한 후 사전에 디니트로페놀(DNP)에 특이적인 IgE를 투여한 후 DNP 접합 소 혈청 알부민(BSA)으로 자극하는 생체 외 비만 세포 탈과립 분석을 고안했습니다.
프로토콜
모든 동물실험은 충남대학교 IACUC(Institutional Animal Care and Use Committee)에서 제공한 지침(동물의정서번호: CNU-00996)에 따라 수행되었다.
1. 미처리 PEC의 용해물에서 비만 세포 특이적 분자 정량화
- 마우스 복막강(peritoneal cavity)12에서 세포를 분리한다.
- 생쥐(생후 8주령, 수컷, BALB/C)를 이소플루란으로 마취합니다. 경추 탈구를 통해 안락사시킵니다.
- 폼 블록에 마우스를 놓습니다. 70% 에탄올로 복부를 닦습니다.
- 뭉툭한 가장자리 가위로 복부 피부를 세로로 자릅니다. 집게와 가위를 사용하여 마우스의 피부를 벗겨냅니다.
- 10mL 주사기와 26G 바늘을 사용하여 얼음처럼 차가운 Tyrode의 B 버퍼13 6mL를 복강에 주입합니다. 장기를 찌르지 않도록 바늘을 부드럽게 삽입하십시오.
- 마우스의 복부를 60-90초 동안 마사지하여 복막 세포를 Tyrode의 B 완충액으로 모읍니다. 혈관이 손상되지 않도록 부드럽게 하십시오.
- 10mL 주사기에 부착된 바늘(20G)을 삽입하여 베벨을 위로 향하게 합니다. 복막강에서 액체를 천천히 흡인합니다(일반적으로 5-6mL).
- 주사기에서 바늘을 제거합니다. 복막액을 50mL 원뿔형 튜브에 분주합니다. 튜브를 얼음 위에 두십시오.
- 1.1.4 - 1.1.7단계를 반복합니다.
- 튜브를 300 x g 에서 10°C에서 5분 동안 원심분리합니다. 1 mL의 1x 적혈구(RBC) 용해 완충액에 세포를 재현탁합니다. 세포를 얼음 위에 3분 동안 두십시오.
- 세포 현탁액을 Tyrode의 B 완충액 2mL로 희석합니다. 튜브를 300 x g 에서 10°C에서 5분 동안 원심분리합니다.
- 상층액을 제거합니다. 0.5mL의 Tyrode's A buffer13에 세포를 재현탁시킵니다.
- 혈구계로 세포를 세십시오. Tyrode의 A 버퍼를 사용하여 셀 수를 5 x 106/mL로 조정합니다.
- 자기 세포 정제 시스템을 사용하여 비만 세포가 고갈된 PEC를 준비합니다14.
- 원심분리기 5 x 10 5 조PECs를 300 x g에서 10 °C에서 5분 동안 사용합니다. 200μL의 PBSBE 세포 정제 완충액(0.5% BSA, 2mM EDTA, 1 x PBS, pH 7.4)에 펠릿을 재현탁합니다.
- 세포에 1μL의 Fc 차단제(0.5mg/mL)를 추가하여 다음에 추가될 anti-c-kit 단일클론 항체(mAb)의 비특이적 결합을 방지합니다. 세포를 얼음 위에 5분 동안 두십시오.
- 1μL의 비오틴화 안티 마우스 c-kit mAb15 (0.5mg/mL)를 추가합니다. 셀을 10분 동안 얼음 위에 두십시오.
- PBSBE 완충액 2mL를 추가합니다. 300 x g 에서 10°C에서 10분 동안 셀을 원심분리합니다.
- 상층액을 제거합니다. PBSBE 완충액 2mL로 세포를 다시 세척합니다.
- 90μL의 PBSBE 완충액에 세포를 재현탁합니다. 10μL의 스트렙타비딘 접합 마이크로비드를 추가합니다. 세포를 15분 동안 얼음 위에 두십시오.
- PBSBE 완충액 2mL를 추가합니다. 300 x g 에서 10°C에서 10분 동안 셀을 원심분리합니다.
- 스핀 중에 중간 마그네틱 컬럼에 500μL의 PBSBE 버퍼를 로드합니다. 버퍼가 열을 통해 흐르도록 허용합니다.
- 원심분리 후 상층액을 제거합니다. 500μL의 PBSBE 완충액에 세포를 재현탁합니다.
- 열에 셀을 로드합니다. 컬럼을 자유롭게 통과하는 셀을 수집합니다.
- 500μL의 PBSBE 완충액으로 컬럼을 세척합니다. 열을 통과하는 셀을 다시 수집합니다.
- 1.2.11단계를 반복합니다.
- 1.2.9-1.2.11 단계의 셀을 하나의 튜브에 결합합니다. 300 x g 에서 10°C에서 10분 동안 셀을 원심분리합니다.
- Tyrode의 A 버퍼에서 셀을 다시 suspend합니다. 세포를 세십시오. 셀 수를 5 x 106 cells/mL로 조정합니다.
- PEC의 용해물을 준비합니다.
- 플레이트 PEC(예: 5 x 105)를 각각 둥근 바닥 96웰 플레이트에 넣습니다. 300 x g 에서 10°C에서 2분 동안 플레이트를 원심분리하여 세포를 수집합니다. 피펫으로 상층액을 조심스럽게 제거합니다.
- 세포 펠릿에 100μL의 세포 용해 완충액을 추가합니다. 여러 번 부드럽게 위아래로 피펫팅하여 세포를 재현탁시킵니다. 접시를 얼음 위에 60분 동안 보관합니다.
- 300 x g 에서 10°C에서 5분 동안 플레이트를 원심분리하여 세포 파편을 제거합니다. 상층액(세포 용해물)을 새로운 96웰 플레이트로 옮깁니다.
- β-hexosaminidase16의 효소 활성을 측정합니다.
- 96웰 마이크로플레이트에서 예열된 β-hexosaminidase 기질 용액(50μL)에 세포 용해물(50μL)을 추가합니다. 피펫으로 부드럽게 섞으십시오.
- 37°C 인큐베이터에서 플레이트를 배양합니다. 30분 후 50μL의 정지 용액(100mM 글리신, pH 10.7)을 첨가하여 효소 반응을 종료합니다.
- 이중 파장 설정에서 UV-VIS 흡광도 마이크로플레이트 리더를 사용한 반응 혼합물의 O.D.를 판독합니다. 효소 반응 수준을 결정하기 위한 405nm와 자동 배경 빼기를 위한 620nm.
- 히스타민의 농도를 측정하십시오17.
- 투명화된 세포 용해물 100μL를 히스타민 ELISA 키트와 함께 제공된 항히스타민 mAb로 코팅된 플레이트로 옮깁니다. 제조업체의 설명서에 따라 경쟁력 있는 히스타민 ELISA 분석을 수행합니다.
- 450nm 파장에서 UV-VIS 흡광도 마이크로플레이트 리더로 샘플의 O.D.를 판독합니다.
- 유세포분석을 통한 PEC의 비만세포 비율을 측정합니다18.
- 1 x 105 조잡한 또는 비스트 셀이 고갈된 PEC를 둥근 바닥 96 웰 플레이트로 옮깁니다. 플레이트를 300 x g 에서 10°C에서 2분 동안 원심분리합니다.
- 50μL의 FACS 완충액에 세포를 재현탁합니다. 1μL의 anti-mouse c-kit(0.5mg/mL) 및 anti-mouse IgE mAb(0.5mg/mL)를 추가합니다.
- 세포를 잠시 소용돌이치십시오. 어둠 속에서 20분 동안 세포를 얼음 위에 두십시오.
- 웰에 150μL의 FACS 완충액을 채웁니다. 플레이트를 300 x g 에서 10°C에서 2분 동안 원심분리합니다. 플레이트를 빠르게 뒤집어 버퍼를 버립니다.
- 프로피듐 요오드화물(1μg/mL)을 함유한 150μL의 FACS 완충액으로 세포를 재현탁합니다. 유세포 분석기로 세포를 분석합니다.
2. 조잡한 PEC를 사용한 비만 세포 탈과립 분석
- 비만 세포 탈과립(% degranulation)의 정도를 측정합니다.
- BALB/C 마우스 3마리(생후 8주령, 수컷) 3마리에게 3μg의 anti-DNP mAb(마우스 IgE)를 정맥 주사합니다. Ab 주사 후 하루 후에 PEC를 분리합니다(1.1단계 참조).
- 90μL의 조PEC(5.5 x 106/mL)를 평평한 바닥 96웰 플레이트(총 4웰)에 플레이트합니다. 37 oC 가습 CO2 인큐베이터에서 30 분 동안 플레이트를 배양합니다.
- PEC가 포함된 웰에 10μL의 DNP-BSA(1x PBS에서 5ng/mL)를 추가합니다. 37°C CO2 인큐베이터에서 10분 동안 플레이트를 배양합니다.
- 배양 직후 300 x g 에서 10°C에서 5분 동안 플레이트를 원심분리합니다. 피펫으로 상층액(100 μL)을 조심스럽게 복용합니다. 얼음 위의 새로운 둥근 바닥 96 웰 플레이트에 보관하십시오.
- PEC가 포함된 마이크로플레이트 웰에 100μL의 세포 용해 완충액(1 x PBS의 0.1% Triton X-100, pH 7.4)을 추가합니다. 접시를 얼음 위에 60분 동안 보관합니다.
- β-hexosaminidase 분석을 수행합니다.
- 탈과립 분석 후 얼음에 보관된 4개 중 2세트의 상등액과 해당 세포 용해물을 각각 취합니다(2.1.4 및 2.1.5 단계 참조). 분석 복제를 위해 상등액과 세포 용해물을 두 개의 별도 웰(각각 50μL)로 분리합니다.
- 각 웰에 50μL의 β-hexosaminidase 기질 용액을 추가합니다. 플레이트를 37°C에서 30분 동안 배양합니다. 반응 혼합물에 50μL의 정지 용액(100mM 글리신, pH 10.7)을 추가합니다.
- 반응 혼합물의 O.D.를 읽습니다(단계 1.4.3 참조). 다음과 같이 비만 세포 탈과립의 정도를 계산합니다.
% 탈과립 = OD상등액 / (OD상등액 + OD용해물) X 100 %
- 히스타민 분석을 수행합니다.
- 100μL의 1x PBS를 상층액의 다른 두 웰과 탈과립 후 저장된 해당 세포 용해물에 추가하여 샘플의 총 부피를 200μL로 만듭니다. 각 샘플을 히스타민 ELISA 키트와 함께 제공된 히스타민 ELISA 플레이트에 있는 두 개의 별도 웰로 나눕니다.
- 제조업체의 설명서에 따라 ELISA 분석을 수행합니다. 450nm 파장에서 UV-VIS 흡광도 마이크로플레이트 리더로 샘플의 O.D.를 판독합니다. 2.1.6.3과 같이 탈과립의 정도를 계산합니다.
% 탈과립 = [히스타민]sup /([히스타민]sup + [히스타민]용해물) X 100%
- ex vivo 비만 세포 탈과립 분석을 통해 in vivo에서 발휘된 비만 세포에 대한 항알레르기 약물의 효과를 평가합니다.
- 덱사메타손19 (DEX) 및 케토티펜20(KET) 200μL 를 마우스(6주령, 수컷)에게 3일 동안 하루에 한 번씩 경구(p.o.) 투여합니다(6마리/그룹).
- 3차 치료 후 3μg의 항DNP IgE를 마우스에 정맥 주사(i.v.)합니다. 각 마우스 그룹을 두 개의 개별 케이지(3개의 마우스/케이지)로 나눕니다. 하나는 PSA 분석용이고 다른 하나는 ex vivo 비만 세포 탈과립 분석용입니다.
- PSA 분석 수행
- 항-DNP IgE 주입 하루 후 1일 후에 DNP-BSA(80μg)를 마우스에 주입합니다. DNP-BSA 주사 직후부터 1시간 동안 15분마다 직장 체온계로 체온을 측정합니다.
- DNP-BSA의 주입 후에 1 일 혈액을 가지고 가십시오. ELISA로 혈청 내 MCPT-1 수치를 측정합니다.
- ex vivo 비만 세포 탈과립 분석을 수행합니다.
- 항-DNP IgE 주입 하루 후 마우스에서 PEC를 분리합니다. 격리된 PEC의 수를 계산합니다.
- 96웰 플레이트(마우스당 4웰)에 90μL의 미처리 PEC(5.5 x10 6/mL)를 플레이트화합니다. 37°C 가습된 CO2 인큐베이터에서 30분 동안 플레이트를 배양합니다.
- DNP-BSA 10μL(5ng/mL)를 추가합니다. 37°C 가습 CO2 인큐베이터에서 10분 동안 플레이트를 배양합니다.
- 플레이트를 300 x g 에서 10°C에서 5분 동안 원심분리합니다. 상층액(100μL)을 조심스럽게 취하고 세포는 웰에 남겨둡니다.
- 100μL의 세포 용해 완충액을 웰에 추가합니다. 얼음 위에서 60분 동안 접시를 배양합니다.
- 2.1.6 및 2.1.7에 설명된 대로 β-hexosaminidase 분석 및 histamine ELISA 분석을 수행합니다. 2.1.6.3단계에서와 같이 % 탈과립을 계산합니다.
결과
ex vivo mast cell degranulation assay를 위한 최적의 PEC 수 결정
비만 세포(c-kit+· IgE+ 이중 양성 세포)15 는 PEC의 약 2%에 불과합니다(그림 1A). PEC의 비만 세포에 의해 과립이 100% 방출된다는 가정하에 배양 상등액에서 검출될 수 있는 비만 세포 특이적 분자의 최대 수준을 추정하고, 서로 다른 수의 PEC으로 준비한 총 세포 용해물에서 β-hexosaminidase16 및 histamine17 의 양을 측정했습니다: 2.5 x 105, 5 x 105 및 1 x 106 PECs, 각각. 그림 1B에서 볼 수 있듯이, 2.5 x 105 PEC로 용해물을 준비한 경우에도 β-hexosamindase 및 histamine의 상당한 수준이 검출되었으며, 세포 용해물 준비에 사용되는 PEC의 수가 증가함에 따라 그 수준이 비례적으로 증가했습니다.
이러한 결과를 염두에 두고, 다음과 같은 이유로 ex vivo 비만 세포 탈과립 분석에서 5 x 105 PEC를 사용하기로 결정했습니다. 한 마리의 마우스(8주령)에서 3 x 106 PECs만 분리되었고 96-well microplate(β-hexosamindase의 경우 2 well, 히스타민 분석의 경우 각각 2 well)에서 4개의 개별 well에 균일하게 도말해야 한다는 점을 고려할 때, well당 1 x 106 PEC를 도금하면 세포 부족이 발생할 수 있습니다. 또한, 위에 나타난 결과는 탈과립 분석을 수행하기에 충분한 수의 비만 세포가 5 x 105 조의 PEC에 있음을 나타냅니다. 즉, 이러한 결과에 의하면 과립의 약 30 내지 40%만이 비만세포에 의해 방출되는 경우에도, 탈과립 분석 후 배양 상등액에서 검출된 β-hexosamindase 및 histamine의 수치는 정확하게 정량화할 수 있을 만큼 충분히 높을 것으로 예상되었습니다.
다음으로, PEC의 용해물에서 검출된 β-hexosamindase 및 histamine이 PEC의 비만 세포에서만 유래한 것임을 확인하려고 했습니다. 이를 위해 자기 세포 정제 컬럼을 사용하여 PEC에서 비만 세포를 고갈시켰습니다(1.2단계 참조). 예상대로, 컬럼을 통해 날아다니는 표지되지 않은 PEC에는 비만 세포가 전혀 없었습니다(그림 1C). 또한, 예상대로 비만 세포가 고갈된 PEC로 제조된 세포 용해물에서 β-hexosamindase 또는 histamine이 검출되지 않았습니다(그림 1D).
미처리 PEC를 사용한 Ex vivo 비만 세포 탈과립 분석
다음으로 PEC의 비만 세포에서 방출되는 β-hexosaminase와 histamine의 실제 수치를 조사했으며, 그 표면에 IgE의 특정 항원이 있었습니다. 이를 위해 항-DNP-IgE를 주입한 마우스에서 PEC를 분리하고 DNP-BSA(0.5ng/mL)로 배양(5 x 105)했습니다. 도 2A에서 볼 수 있듯이, 배양 5분 이내에 배양 상층액에서 유의한 수준의 β-hexosamindase가 검출되기 시작하였으며, 배양 기간이 길어짐에 따라 지속적으로 증가하였다. 그럼에도 불구하고, 배양 10분 후 증가율이 빠르게 감소했고, 탈과립 정도는 30-40분 후에 약 50%에서 점차 고원에 도달했습니다. 배양 중 비만 세포에서 방출되는 히스타민의 수치를 조사했을 때도 유사한 결과가 얻어졌습니다(그림 2B). 이러한 결과를 바탕으로 다음 분석에서 DNP-BSA로 PEC을 10분 동안 배양하기로 결정했습니다.
ex vivo 탈과립 분석을 통해 비만 세포에 대한 KET 및 DEX의 in vivo 효과를 확인합니다.
케토티펜(KET)은 항히스타민 활성이 있는 알레르기 약물입니다. 그러나 기존의 다른 항히스타민제와 달리 항히스타민제 활성과 함께 비만세포 안정화 활성을 가진 이중작용 항히스타민제로 알려져 있습니다. KET의 비만 세포 안정화 활성이 탐구되었습니다21,22; 그러나 대부분 in vitro 연구와 in vivo 세포에 어떤 영향을 미치는지 보여주는 연구는 부족합니다. 덱사메타손(DEX)은 또 다른 유형의 알레르기 약물입니다23. DEX는 다양한 유형의 면역 세포의 기능적 활동을 손상시켜 광범위한 면역 반응을 억제하는 것으로 알려져 있습니다24. in vivo 비만 세포의 활성에 대한 KET 및 DEX의 효과를 확인하기 위해 둘 중 하나로 처리된 마우스에서 분리된 PEC를 사용하여 ex vivo 비만 세포 탈과립 분석을 수행했습니다.
ex vivo mast cell degranulation assay에 앞서, 먼저 PSA 모델에서 수동적으로 전달된 DNP 특이적 IgE 및 DNP-BSA에 의해 유도된 아나필락시스 반응에 대한 DEX 및 KET의 효과를 조사했습니다. 예상대로, KET 또는 DEX를 사용한 치료는 용량 의존적 방식으로 아나필락시스 증상을 개선했으며(보충 그림 1), 이는 비만 세포의 기능 활성이 치료에 의해 손상되었음을 나타냅니다.
또한 두 화합물 중 하나로 처리된 마우스에서 분리된 PEC의 수와 PEC에서 비만 세포의 비율을 조사했습니다(그림 3A). KET를 사용한 치료는 치료에 사용된 용량에 관계없이 마우스에서 분리된 PECS 수에 눈에 띄는 변화를 일으키지 않았습니다. 대조적으로, DEX를 투여한 마우스에서 분리된 PEC의 수는 4.5mg/kg 용량으로 처리했을 때 크게 감소했는데, 이는 DEX 처리가 복막 세포의 생존력에 영향을 미쳤음을 나타냅니다. 그럼에도 불구하고, 비만 세포의 비율은 치료에 사용된 약물 및 용량에 관계없이 약 2%로 일정하게 유지되었다는 점에 유의해야 합니다(그림 3A). 또한 동일한 수의 조PEC로 제조된 총 세포 용해물에서 그 양을 측정하여 복막강에서 비만 세포가 발현하는 β-hexosamindase 및 histamine 수준에 대한 DEX 및 KET의 효과를 조사했습니다(그림 3B). 주목할 점은 β-hexosamindase와 histamine의 수치가 모두 4.5mg/kg의 용량으로 DEX로 치료한 후 증가한 것으로 밝혀졌다는 것입니다. KET 치료는 그 수치에서 거의 변화를 가져오지 않았습니다.
다음으로, 생체 외 비만 세포 탈과립 분석을 수행했습니다(그림 4). 먼저, PEC의 세포 밀도를 5.5 x 106 cells/mL로 균일하게 조정하여 분석에 동일한 수의 비만 세포가 사용되도록 했습니다. 그런 다음 PEC(90μL)를 96웰 마이크로플레이트에 도말하고 DNP-BSA와 함께 10분 동안 배양했습니다. DEX 또는 KET의 고용량으로 처리된 마우스의 PEC를 DNP-BSA로 배양했을 때, 배양 상등액에서 검출된 β-hexosamindase 및 histamine의 수치는 DNP-BSA로 가짜 처리된 마우스에서 PEC를 배양한 후 검출된 수치에 비해 현저히 낮아진 것으로 나타났습니다(그림 4). 배양 상등액에서 검출된 분자의 수준과 마우스 치료에 사용된 DEX 및 KET의 용량 사이에도 역상관관계가 분명했습니다. 따라서, 치료에 사용된 용량이 높을수록 배양 후 배양 상등액에서 검출된 β-hexosamindase 및 histamine의 수치가 낮아졌습니다.
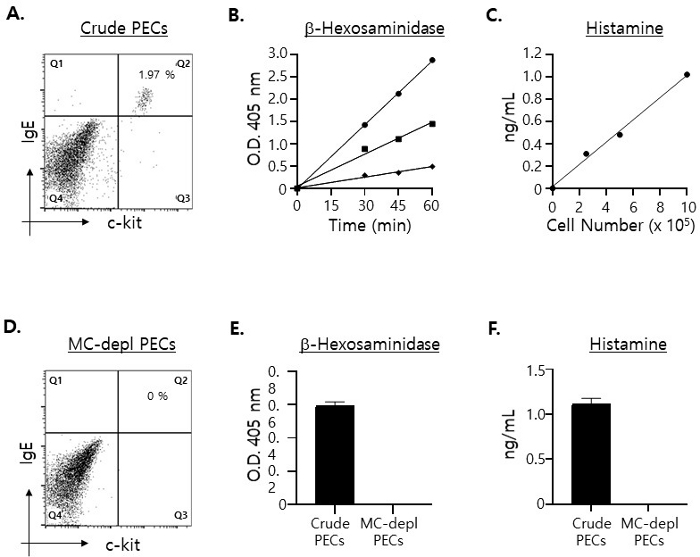
그림 1: 다양한 수의 PEC로 준비된 용해물에 포함된 비만 세포 특이적 분자의 수준을 정량화합니다.
(A) PEC를 FITC 표지 anti-mouse c-kit 및 PE 표지 항 마우스 IgE mAb로 염색하고 유세포 분석으로 분석했습니다. 비만 세포(즉, c-kit+· IgE+ 이중 양성 세포)는 오른쪽 상단 사분면에 표시됩니다. (B) 세포 용해물을 각각 1 x 106 (원), 5 x 105 (정사각형) 및 2.5 x 105 (다이아몬드) PEC로 준비하고, 총 용해물의 절반을 표시된 대로 일정 기간 동안 β-hexosamiminase의 기질로 배양했습니다. 효소 반응에 의한 색 변화의 정도는 405nm 파장에서 96웰 마이크로플레이트 리더로 측정했습니다. 분석은 중복으로 수행되었습니다. (C) 세포 용해물은 (B)와 같이 제조하고, 용해물 내의 히스타민 농도는 ELISA로 측정하였다. (D) 비만 세포가 고갈된 PEC는 (A)에서와 같이 mAb로 염색되었습니다. (E) 세포 용해물을 각각 5 x 105 미정제(채워진 막대) 및 비만 세포 고갈(열린 막대) PEC로 제조하고, 반응 종료 전 30분 동안 β-hexosaminidase 기질로 배양했습니다. (F) (E)에서와 같이 제조된 세포 용해물 내 히스타민의 농도를 측정하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: DNP-BSA를 이용한 PEC 배양 중 비만 세포에서 방출되는 비만 세포 특이적 분자의 양 측정.
항-DNP IgE(원형) 또는 단지 1 x PBS(삼각형)를 주입한 마우스에서 분리한 PEC(5 x 10,5)를 표시된 대로 일정 기간 동안 DNP-BSA로 배양했습니다. 각 시점에서 상층액에서 검출된 β-hexosamindase (A, 왼쪽) 및 histamine (B, 왼쪽)의 수치를 그래프로 표시하였다. 탈과립의 정도는 각각 상층액으로 방출된 β-헥소사미니다아제(A, 오른쪽) 및 히스타민(B, 오른쪽)의 양과 세포 내부에 남아 있는 양(세포 용해물)으로 계산되었습니다. 다음 방정식은 탈과립(%)의 정도를 계산하는 데 사용되었습니다. 탈과립(%) = [X]sup /([X]sup + [X]용해물) X 100 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
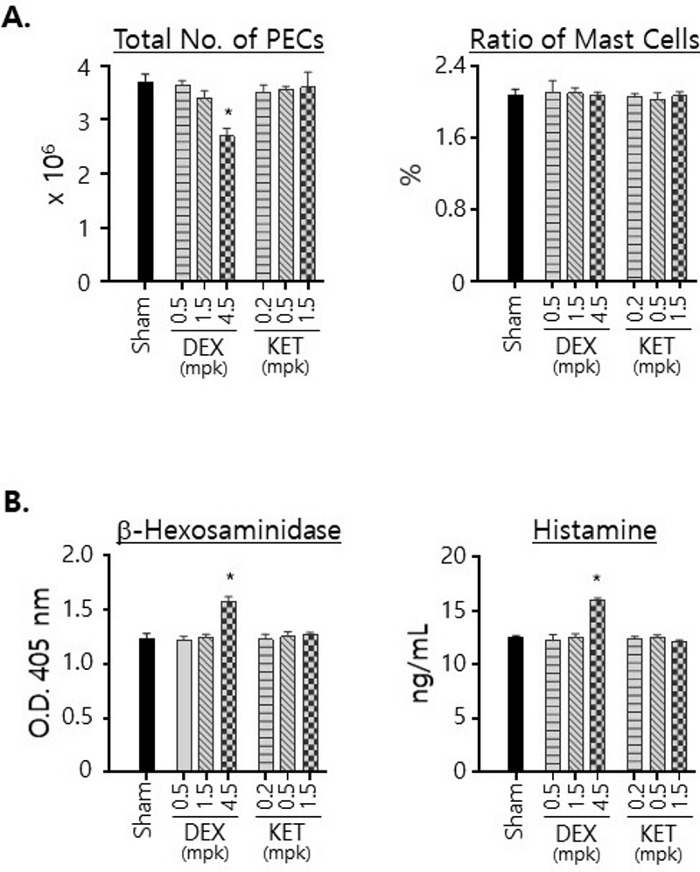
그림 3: DEX와 KET가 복막강 내 비만세포의 생존력과 b-hexosaminidase 및 histamine 발현 수준에 미치는 영향.
(A) PEC는 비히클 단독으로(가짜) 또는 표시된 용량의 DEX 또는 KET로 3일 동안 P.O. 처리된 마우스로부터 분리되었습니다. 총 세포 수는 혈구계로 계산되었으며 평균 수는 표준 편차(왼쪽)와 함께 계산되고 표시되었습니다. PEC는 FITC 표지된 anti-c-kit 및 PE 표지된 anti-IgE mAbs로 염색하고 유세포 분석으로 분석했습니다. 총 PEC에 대한 이중 양성 세포(즉, 비만 세포)의 비율이 표시되었습니다(오른쪽). (B) PEC는 (A)에서와 같이 분리하고, 세포 용해물은 동일한 수(5 x 105)의 PEC로 제조되었습니다. 이러한 용해물에서 β-hexosamindase (왼쪽)와 histamine (오른쪽)의 양을 측정하고 표시했습니다. 모든 실험은 그룹당 3마리의 마우스로 수행되었습니다. 통계적 유의성은 일원 분산 분석(one-way anova)을 사용하여 계산되었습니다. * p < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: DEX 또는 KET로 처리한 마우스에서 분리된 미처리 PEC를 사용한 생체 외 비만 세포 탈과립 분석.
PEC를 비히클 단독(나이브 및 가짜) 또는 표시된 용량의 DEX 또는 KET로 3일 동안 P.O. 처리한 마우스에서 분리한 다음 PBS(나이브) 또는 항-DNP-IgE를 IV로 주입했습니다. 그런 다음 DNP-BSA로 10분 동안 배양하고, 배양 상등액으로 방출되는 β-헥소사미니다아제(A) 및 히스타민(B)의 수준을 기준으로 탈과립 정도를 계산했습니다. 모든 실험은 그룹당 3마리의 마우스로 수행되었습니다. 통계적 유의성은 일원 분산 분석(one-way anova)을 사용하여 계산되었습니다. * p < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 완충기 | 처방 | 코멘트/설명 | |
| 0.1M Na-구연산염 완충액 | 45.6mM 구연산나트륨 이수화물, 54.4mM 구연산, pH 4.5 | 2-8°C에서 보관 | |
| 10x RBC 용해 버퍼 | 80 mg/mL NH4Cl, 8.4 mg/mL NaHCO3, 3.7 mg/mL EDTA (디소듐) | 2-8°C에서 보관하고 6개월을 초과하지 마십시오. | |
| 세포 용해 완충액 | 0.1 % Triton X-100, 1 x 인산염 완충 식염수(PBS) pH 7.4 | 2-8°C에서 보관 | |
| ELISA 정지 솔루션 | 100mM 글리신, pH 10.7 | 상온 보관 | |
| FACS 버퍼 | PBS 1개, 5% 말 혈청, 1% BSA, 10mM HEPES, 2mM EDTA, pH 7.2 | 2-8°C에서 보관하고 2개월을 초과하지 마십시오. | |
| PBSBE 완충액(MACS 세포 정제 완충액) | 1x PBS, 0.5% BSA, 2mM EDTA, pH 7.2 | 2-8°C에서 보관하고 2개월을 초과하지 마십시오. | |
| 티로드의 A 버퍼 | 10 mM 헤페스, 130 mM NaCl, 5.6 mM 포도당, 5 mM KCl, 1 mM MgCl2, 1.4 mM CaCl2, 1% 소 혈청 알부민(BSA) pH 7.4 | 2-8°C에서 보관하고 2개월을 초과하지 마십시오. | |
| 티로드의 B 버퍼 | 137 mM NaCl, 5.6 mM 포도당, 12 mM NaHCO 3,2.7 mM KCl, 0.3 mM NaH2PO4, 1 mM MgCl2, 1.8 mM CaCl2, 0.1 % 젤라틴, pH 7.4 | 2-8°C에서 보관하고 2개월을 초과하지 마십시오. | |
표 1: 버퍼 조성.
보충 그림 1: 수동적으로 전달된 항-DNP-IgE 및 DNP-BSA로 인한 아나필락시스 반응에 대한 DEX 및 KET의 효과. 3일 동안 매일 차량 단독으로 치료(naive, sham) 또는 표시된 용량의 DEX 또는 KET를 투여한 마우스에게 PBS(naive) 또는 anti-DNP-IgE mAb를 투여했습니다. 항체 주입 하루 후, 마우스는 PBS(나이브) 또는 DNP-BSA를 주입(i.v.)했습니다. DNP-BSA 주입 후 30분 후에 측정된 마우스의 체온을 표시하였다(A). DNP-BSA의 주입 후에 1 일, 혈액은 쥐에서 당겨지고 MCPT-1의 수준은 ELISA (B)로 측정되었다. 실험은 그룹당 3마리의 마우스로 수행되었습니다. 통계적 유의성은 일원 분산 분석(one-way ANOVA)을 사용하여 계산되었습니다. * p < 0.05. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
비만 세포 탈과립 분석이 상대적으로 적은 수의 조잡한 마우스 PEC로 수행될 수 있다는 발견은 중요합니다. PEC는 1차 마우스 비만 세포의 훌륭한 공급원임에 틀림없지만, PEC에서 비만 세포를 정제하는 것이 까다롭습니다. Percoll25 와 같은 밀도 구배 배지는 쥐 PEC에서 비만 세포를 정제하는 데 성공적으로 사용되었지만, 쥐 복막 비만 세포의 정제를 위한 사용은 쥐와 마우스 비만 세포의 밀도 차이로 인해 제한되었습니다. Histodenz26 과 같은 또 다른 구배 배지는 마우스 복막 비만 세포의 정제에 사용되었으나 성공은 제한적이었습니다. 정제의 결과는 마우스의 조건(예: 연령)에 따라 달라지는 것으로 나타났습니다. 자기 세포 정제 시스템과 같은 새로운 세포 분리 시스템조차도 마우스 비만 세포의 부분적인 정제만 수행했습니다(저자의 미발표 데이터). 여기에서 우리는 복막 비만 세포의 정제가 비만 세포 탈과립 분석에 필요하지 않다는 것을 보여줍니다.
조잡한 PEC의 비만 세포가 IgE의 동족 항원에 의해 유발될 수 있다는 결과는 in vivo에서 발생하는 탈과립 현상을 충실히 모방하기 위해 ex vivo assay를 추구하는 데 고무적입니다. 그러나 비만 세포 외에도 호염기구는 FcεRI27을 발현합니다. 따라서, 여기서 한 가지 주의할 점은 PEC에 있는 소수의 호염기구도 분석 중 배양 상층액의 히스타민 농도 증가에 기여할 수 있다는 것입니다. 그러나 c-kit 발현 세포(즉, 비만 세포)가 고갈된 PEC가 분석에 사용되었을 때 배양 상등액에서 측정 가능한 수준의 히스타민이 검출되지 않았기 때문에 가능성은 낮아 보입니다. 이러한 결과는 비만 세포가 DNP-BSA로 조잡한 PEC를 배양한 후 배양 상등액에서 검출된 히스타민의 방출에 전적으로 책임이 있음을 확인했습니다.
약리학적 제제에 의한 비만 세포 기능 억제를 조사하기 위한 체외 비만 세포 탈과립 분석의 결과를 해석하는 데 있어 흥미로운 문제는 이러한 체외 결과(예: 테스트 화합물의 IC50 )를 PSA와 같은 생체 내 동물 연구에서 파생된 생체 내 결과(예: ED50)와 연관시키는 방법입니다. 일차 비만 세포를 사용하는 경우에도 in vitro 및 in vivo 분석 중에 만나게 되는 주변 환경 조건이 서로 크게 다르다는 점을 고려할 때 이러한 연구에서 얻은 결과가 항상 서로 유사하지는 않을 수 있습니다. 따라서 in vitro assay의 결과를 in vivo 실험으로 또는 그 반대로 외삽하는 데 주의가 필요합니다. 본 연구에서 기술된 생체 외 탈과립 분석에 사용된 비만 세포는 생체 내 분석과 동일한 환경에서 테스트 화합물로 처리되고 동물로부터 분리된 직후 자연 리간드로 배양되기 때문에 생체 외 분석의 결과는 생체 내 분석 중에 신체의 비만 세포가 화합물에 의해 어떻게 영향을 받는지를 정확하게 반영한다고 생각됩니다.
이 연구의 주요 초점은 생체 외 분석을 사용하여 잠재적인 항알레르기 약물의 실제 비만 세포 안정화 활성을 생체 내에서 확인하는 방법이었지만, 이 분석은 비만 세포 기능에 대한 특정 유전자 녹아웃의 영향을 조사하는 목적으로도 사용될 수 있다는 점에 유의해야 합니다. 예를 들어, 이 분석법은 비만 세포 기능에 대한 T 세포의 특정 부분 집합의 분화에 결정적으로 관여하는 특정 유전자의 결실의 영향을 조사하는 데 유용할 것입니다. 또한, 본 원고에서는 모델 시스템으로 수동적인 전신 아나필락시스만을 사용했지만, 마우스의 적극적 면역 후 얻은 PECs로 동일한 분석을 수행할 수 있을 것으로 추정합니다.
요약하면, 이 분석법은 다음과 같은 몇 가지 고유한 특징을 가지고 있습니다. 첫째, 미처리 PEC가 사용되기 때문에 분석이 빠르고 용이합니다. 둘째, 관련 in vivo 동물 연구가 수행되는 환경에서 비만 세포를 시험 화합물로 처리하기 때문에 ex vivo 탈과립 분석의 결과는 동물 연구 중에 비만 세포에 가해진 화합물의 효과를 충실히 반영합니다. 셋째, 이 분석에는 PEC의 비만 세포의 비율과 수에 대한 유동 분석이 수반되기 때문에 생체 내 비만 세포의 생존율에 대한 시험 화합물의 영향도 다룰 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이원희 씨와 이은주 씨의 기술적, 행정적 도움에 감사드립니다. 또한 Thi Minh Nguyet Nguyen 박사의 사려 깊은 의견에 감사드립니다. 본 연구는 충남대학교의 연구비(CNU 연구비 2017-2098-01)와 한국연구재단의 연구비(NRF-2019R1F1A1061894, NRF-2019M3A9G4067293)의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | 1757589701 | ||
| 1.5 mL micro tube | Hisol | MT-15003 | |
| 10 mL syringe | 1757593161 | ||
| 15 mL conical tube | Thermo Fisher scientific | 14-959-53A | |
| 20xPBS | Tech & Innovation | BPB-9121-500mL | |
| 4-nitrophenyl-N-acetyl-β-D-glucosaminide | SIGMA | N9376 | |
| 5 mL polystyrene round-bottom tube | Life sciences | 352003 | |
| 50 mL conical tube | Thermo Fisher scientific | 14-959-49A | |
| Aluminium Fiol | BioFact | TS1-3330 | |
| Anti-mouse CD117(c-kit) | Biolegend | 135129 | keep at 2-8°C |
| Anti-mouse IgE mAbs | Thermo Fisher scientific | 11-5992-81 | keep at 2-8°C |
| Antiti-DNP-IgE | SIGMA | D8406-.2MG | keep at -20°C |
| Centrifuge | HANIL | 396150 | |
| D-(+)-gluouse | SIGMA | G8270 | |
| Dexamethasone | SIGMA | D2915-100MG | |
| DNP-BSA | Invitrogen | 2079360 | keep at -20°C |
| EDTA | Biofact | PB131-500 | |
| Fetal Bovine serum | Thermo Fisher scientific | 11455035 | |
| Gelatin | SIGMA | G1890 | |
| Glycine | JUNSEI | 27185-0350 | |
| hemocytometer | ZEISS | 176045 | |
| HEPES | Thermo Fisher scientific | 15630130 | |
| Histamine ELISA kit | Abcam | GK3275957-4 | keep at 2-8°C |
| Hotplate stirrer | Lab teach | zso-9001 | |
| Isoflurance | Troikaa | I29159 | |
| ketotifen fumarate salt | SIGMA | K2628 | |
| MCPT-1 ELISA kit | Thermo Fisher scientific | 88-7503-22 | keep at 2-8°C |
| Mouse Fc block | BD Biosciences | 553141 | keep at 2-8°C |
| Propidium iodiole | SIGMA | 81845 | keep at 2-8°C |
| RBC lysis buffer | Biolegend | 420301 | |
| Round-bottom 96 well | SPL-life sciences | 30096 | |
| Single use syringe filter | Startoriusag | 16555 | |
| Streptavidin microbeads | MilteryiBiotec | 130-048-101 | keep at 2-8°C |
| Triton X-100 | JUNSEIchemical | 49415-1601 | |
| TWEEN 20 | SIGMA | 9005-64-5 | |
| Water bath | CHANGSHINSCIENCE | 190107 |
참고문헌
- Amin, K. The role of mast cells in allergic inflammation. Respiratory Medicine. 106 (1), 9-14 (2012).
- Holgate, S., et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. Journal of Allergy and Clinical Immunology. 115 (3), 459-465 (2005).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693 (2012).
- Roth, K., Chen, W. M., Lin, T. J. Positive and negative regulatory mechanisms in high-affinity IgE receptor-mediated mast cell activation. Archivum Immunologiae et Therapiae Experimentalis. 56 (6), 385-399 (2008).
- Finn, D., Walsh, J. Twenty-first century mast cell stabilizers. British Journal of Pharmacology. 170 (1), 23-37 (2013).
- Lu, Y., et al. Emodin, a naturally occurring anthraquinone derivative, suppresses IgE-mediated anaphylactic reaction and mast cell activation. Biochemical Pharmacology. 82 (11), 1700-1708 (2011).
- Demo, S., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry: The Journal of the International Society for Analytical Cytology. 36 (4), 340-348 (1999).
- Passante, E., Ehrhardt, C., Sheridan, H., Frankish, N. RBL-2H3 cells are an imprecise model for mast cell mediator release. Inflammation Research. 58 (9), 611-618 (2009).
- Fukuishi, N., et al. Does β-hexosaminidase function only as a degranulation indicator in mast cells? The primary role of β-hexosaminidase in mast cell granules. The Journal of Immunology. 193 (4), 1886-1894 (2014).
- Malbec, O., et al. Peritoneal cell-derived mast cells: an in vitro model of mature serosal-type mouse mast cells. The Journal of Immunology. 178 (10), 6465-6475 (2007).
- Arock, M., Le Nours, A., Malbec, O., Daëron, M. . Innate Immunity. , 241-254 (2008).
- Befus, A., Pearce, F., Gauldie, J., Horsewood, P., Bienenstock, J. Mucosal mast cells. I. Isolation and functional characteristics of rat intestinal mast cells. The Journal of Immunology. 128 (6), 2475-2480 (1982).
- Yoon, S. C., et al. Anti-allergic and anti-inflammatory effects of aqueous extract of Pogostemon cablin. International Journal of Molecular Medicien. 37 (1), 217-224 (2016).
- Mierke, C. T., et al. Human endothelial cells regulate survival and proliferation of human mast cells. Journal of Experimental Medicien. 192 (6), 801-812 (2000).
- Hermes, B., et al. Altered expression of mast cell chymase and tryptase and of c-Kit in human cutaneous scar tissue. Journal of Investigative Dermatology. 114 (1), 51-55 (2000).
- Wendeler, M., Sandhoff, K. J. Hexosaminidase assays. Glycoconjugate Journal. 26 (8), 945-952 (2009).
- Russell, M., et al. Learned histamine release. Science. 225 (4663), 733-734 (1984).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Kitamura, Y., et al. Dexamethasone suppresses histamine synthesis by repressing both transcription and activity of HDC in allergic rats. Allergology International. 55 (3), 279-286 (2006).
- Grant, S. M., Goa, K. L., Fitton, A., Sorkin, E. M. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorder. Drugs. 40 (3), 412-448 (1990).
- Cook, E., Stahl, J., Barney, N., Graziano, F. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Current Drug Targets-Inflammation & Allergy. 1 (2), 167-180 (2002).
- Schoch, C. In vitro inhibition of human conjunctival mast-cell degranulation by ketotifen. Journal of Ocular Pharmacology and Therapeutics. 19 (1), 75-81 (2003).
- Franchimont, D., et al. Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. The Journal of Immunology. 164 (4), 1768-1774 (2000).
- Simmons, C. P., et al. The clinical benefit of adjunctive dexamethasone in tuberculous meningitis is not associated with measurable attenuation of peripheral or local immune responses. The Journal of Immunology. 175 (1), 579-590 (2005).
- Cavalher-Machado, S. C., et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. International Immunopharmacology. 8 (11), 1552-1560 (2008).
- Dhakal, H., et al. Gomisin M2 inhibits mast cell-mediated allergic inflammation via attenuation of FcεRI-mediated Lyn and Fyn activation and intracellular calcium levels. Frontiers in Pharmacology. 10, 869 (2019).
- Galli, S. J., Wedemeyer, J., Tsai, M. Analyzing the roles of mast cells and basophils in host defense and other biological responses. International Journal of Hematology. 75 (4), 363-369 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유