Method Article
使用粗腹膜渗出物细胞和天然抗原刺激的离体肥大细胞脱颗粒测定
摘要
我们已经建立了离体肥大细胞脱颗粒测定,方法是孵育从小鼠中分离的粗腹膜渗出物细胞,用感兴趣的药理学试剂处理并预先施用抗二硝基苯酚 (DNP) IgE,在载体蛋白上施用 DNP。
摘要
肥大细胞稳定剂是过敏药物的重要组成部分。被动全身性过敏反应 (PSA) 是一种动物试验,广泛用于研究感兴趣的药理学药物对体内肥大细胞的影响。由于过敏症状主要归因于肥大细胞颗粒的胞吐作用,因此认为改善症状的药物具有肥大细胞稳定活性。尽管如此,通过直接证明肥大细胞处理后功能活性的下降来确认活性是谨慎的。为此,通常使用永生化肥大细胞系或培养的原代肥大细胞进行体外脱颗粒测定。体外和体内测定的结果可能并不总是彼此相似;然而,由于体外测定的治疗条件(例如,治疗剂量、时间、周围环境)通常与体内测定(如 PSA)的治疗条件不同。为了追求体外(或离体)测定以更紧密地反映药理学试剂对体内肥大细胞的影响,我们设计了离体肥大细胞脱颗粒测定,其中从小鼠中分离的粗腹膜渗出细胞 (PEC),用该试剂处理并施用抗二硝基苯酚 (DNP) IgE,直接与 DNP 在载体蛋白上孵育。事实证明,该测定不仅有助于验证体内测定指示的药理学试剂的肥大细胞稳定活性,而且实用且具有高度可重复性。
引言
肥大细胞在过敏中起着核心作用 1,2。当通过与 IgE 高亲和力受体 (FcεRI) 相互作用位于肥大细胞表面的 IgE 遇到同源过敏原时,会引发信号级联反应以促使颗粒释放。结果,释放各种过敏效应分子,包括单胺(例如组胺、血清素)、细胞因子(例如 TNF-α)和蛋白水解酶(例如类胰蛋白酶、凝乳酶),以引起一系列免疫、神经和血管反应 3,4。
一类药物称为肥大细胞稳定剂,它通过减弱肥大细胞功能来缓解过敏症状5。被动全身性过敏反应 (PSA) 是一种动物模型,通常用于探测药物的肥大细胞稳定活性。由于过敏症状主要是由于被动转移的半抗原特异性 IgE 与后来注射到动物体内的载体蛋白上的半抗原相互作用后肥大细胞的激活引起的,因此当感兴趣的药理学试剂的治疗导致症状改善时,其具有肥大细胞稳定活性,这是公认的6.尽管如此,通常必须直接在单独的实验中证明药物对肥大细胞功能的损害,以排除症状改善来自抑制肥大细胞功能以外的机制的可能性。
肥大细胞脱颗粒测定是通过用化学试剂或 IgE 的特异性抗原刺激肥大细胞在肥大细胞表面与 FcεRI 形成复合物以诱导分泌颗粒的胞吐作用(即脱颗粒)进行的,通常用于测定体外药理试剂的肥大细胞稳定活性7。该检测使用了几种类型的细胞,包括大鼠嗜碱性白血病 (RBL) 细胞系8、骨髓来源的肥大细胞 (BMMC)9 和腹膜细胞来源的肥大细胞 (PCMC)10。虽然很容易获得大量细胞,因此很有用,但 RBL 是一种永生化癌细胞系,其细胞特性不再类似于体内肥大细胞的细胞特性。获得足够数量的 BMMC 或 PCMC,即使它们的细胞特性可能更接近体内肥大细胞的细胞特性,通常既昂贵又耗时。
使用纯化的原代肥大细胞的脱颗粒测定是一种理想的替代方案11。尽管如此,这种测定法的使用并不广泛,因为这是一种从动物组织(特别是小鼠组织)中纯化肥大细胞的简单方法,产量高,并且纯度尚不可用。此外,由于在体外用药物抑制肥大细胞功能的浓度和持续时间可能并不总是与体内一致,因此通过体外脱颗粒测定获得的结果可能会歪曲体内测定(如 PSA)的结果,反之亦然。因此,一种新型脱颗粒测定法的需求量很大,它不仅密切模拟了肥大细胞活化在体内发生的方式,而且准确反映了药理试剂在体内对肥大细胞的作用。为了满足这些需求,我们设计了一种离体肥大细胞脱颗粒测定法,其中从小鼠中分离的腹膜渗出物细胞 (PEC) 中的肥大细胞,用感兴趣的药理学试剂处理并预先施用对二硝基苯酚 (DNP) 具有特异性的 IgE,用 DNP 偶联的牛血清白蛋白 (BSA) 刺激。
研究方案
所有动物实验均按照忠南道大学 IACUC(机构动物护理和使用委员会)提供的指南(动物协议编号:CNU-00996)进行。
1. 定量粗 PEC 裂解物中的肥大细胞特异性分子
- 从小鼠腹膜腔中分离细胞12.
- 用异氟醚麻醉小鼠 (8 周龄,雄性,BALB/C)。通过颈椎脱位实施安乐死。
- 将鼠标放在泡沫块上。用 70% 乙醇擦拭腹部。
- 用钝边剪刀纵向剪断腹侧皮肤。用镊子和剪刀剥掉老鼠的皮肤。
- 使用带有 6 G 针头的 10 mL 注射器将 13 mL 冰冷的 Tyrode B 缓冲液26 注入腹膜腔。轻轻插入针头,以免刺伤任何器官。
- 按摩小鼠的腹部 60-90 秒,以将腹膜细胞收集到 Tyrode 的 B 缓冲液中。轻轻地做,不要损伤血管。
- 将连接到 10 mL 注射器的针头 (20 G) 斜向上插入。从腹膜腔缓慢吸出液体(通常为 5-6 mL)。
- 从注射器中取出针头。将腹膜液分配到 50 mL 锥形管中。将试管放在冰上。
- 重复步骤 1.1.4 - 1.1.7。
- 将试管在 10 °C 下以 300 x g 离心 5 分钟。 将细胞重悬于 1 mL 的 1x 红细胞 (RBC) 裂解缓冲液中。将细胞在冰上放置 3 分钟。
- 用 2 mL Tyrode 的 B 缓冲液稀释细胞悬液。将试管在 10 °C 下以 300 x g 离心 5 分钟。
- 去除上清液。将细胞重悬于 0.5 mL 的 Tyrode A 缓冲液13 中。
- 用血细胞计数器计数细胞。使用 Tyrode 的 A 缓冲液将细胞数量调整为 5 x 106/mL。
- 使用磁性细胞纯化系统制备肥大细胞耗尽的 PEC14。
- 在 10 °C 下以 300 x g 离心 5 x 105 个粗 PEC,离心 5 分钟。 将沉淀重悬于 200 μL PBSBE 细胞纯化缓冲液(0.5% BSA、2 mM EDTA、1 x PBS,pH 7.4)中。
- 向细胞中加入 1 μL Fc 阻滞剂 (0.5 mg/mL),以防止接下来添加的抗 c-kit 单克隆抗体 (mAb) 的非特异性结合。将细胞在冰上放置 5 分钟。
- 加入 1 μL 生物素化抗小鼠 c-kit mAb15 (0.5 mg/mL)。将细胞在冰上放置 10 分钟。
- 加入 2 mL PBSBE 缓冲液。将细胞在 10 °C 下以 300 x g 离心 10 分钟。
- 去除上清液。用 2 mL PBSBE 缓冲液再次洗涤细胞。
- 将细胞重悬于 90 μL PBSBE 缓冲液中。加入 10 μL 链霉亲和素偶联的微珠。将细胞在冰上放置 15 分钟。
- 加入 2 mL PBSBE 缓冲液。将细胞在 10 °C 下以 300 x g 离心 10 分钟。
- 在离心过程中,将 500 μL PBSBE 缓冲液加载到中等磁柱上。让缓冲液流过色谱柱。
- 离心后去除上清液。将细胞重悬于 500 μL PBSBE 缓冲液中。
- 将细胞加载到色谱柱上。收集自由通过色谱柱的细胞。
- 用 500 μL PBSBE 缓冲液洗涤色谱柱。再次收集通过色谱柱的单元格。
- 重复步骤 1.2.11。
- 将步骤 1.2.9-1.2.11 中的细胞合并在一个管中。将细胞在 10 °C 下以 300 x g 离心 10 分钟。
- 在 Tyrode 的 A 缓冲液中重悬细胞。计数细胞。将细胞数量调整为 5 x 106 个细胞/mL。
- 准备 PEC 的裂解物。
- 分别在圆底 96 孔板中板 PEC(例如,5 x 105)。将板在 10 °C 下以 300 x g 离心 2 分钟以收集细胞。用移液管小心地去除上清液。
- 向细胞沉淀中加入 100 μL 细胞裂解缓冲液。通过轻轻上下吹打数次来重悬细胞。将板放在冰上 60 分钟。
- 将板在 10 °C 下以 300 x g 离心 5 分钟以去除细胞碎片。将上清液(细胞裂解物)转移到新的 96 孔板中。
- 测量 β-己糖胺酶16 的酶活性。
- 将细胞裂解物 (50 μL) 添加到 96 孔微孔板中预热的 β-己糖胺酶底物溶液 (50 μL) 中。用移液管轻轻混合。
- 将板在 37 °C 培养箱中孵育。30 分钟后加入 50 μL 终止液(100 mM 甘氨酸,pH 10.7)以终止酶反应。
- 在双波长设置下,用紫外可见光吸光度酶标仪读取反应混合物的外径;405 nm 用于测定酶反应水平,620 nm 用于自动背景扣除。
- 测量组胺17 的浓度。
- 将 100 μL 澄清的细胞裂解物转移到组胺 ELISA 试剂盒随附的抗组胺 mAb 包被板中。按照制造商的手册进行竞争性组胺 ELISA 测定。
- 使用 450 nm 波长的紫外可见光吸光度酶标仪读取样品的外径。
- 用流式细胞术18 确定 PEC 中肥大细胞的比例。
- 在圆底 96 孔板中转移 1 x 105 个粗制或肥大细胞耗尽的 PEC。将板在 10 °C 下以 300 x g 离心 2 分钟。
- 将细胞重悬于 50 μL FACS 缓冲液中。添加 1 μL 抗小鼠 c-kit (0.5 mg/mL) 和抗小鼠 IgE mAb (0.5 mg/mL)。
- 短暂涡旋细胞。将细胞在冰上避光放置 20 分钟。
- 用 150 μL 的 FACS 缓冲液填充孔。将板在 10 °C 下以 300 x g 离心 2 分钟。 通过快速翻转板丢弃缓冲液。
- 用 150 μL 含有碘化丙啶 (1 μg/mL) 的 FACS 缓冲液重悬细胞。用流式细胞仪分析细胞。
2. 使用粗 PEC 的肥大细胞脱颗粒测定
- 确定肥大细胞脱颗粒的程度(% 脱颗粒)。
- 用 3 μg 抗 DNP mAb(小鼠 IgE)静脉注射 3 只 BALB/C 小鼠(8 周龄,雄性)。抗体注射后 1 天分离 PEC(参见步骤 1.1)。
- 将 90 μL 粗 PEC (5.5 x 106/mL) 接种在平底 96 孔板(共 4 孔)中。将板在 37 °C 加湿的 CO2 培养箱中孵育 30 分钟。
- 向含有 PEC 的孔中加入 10 μL DNP-BSA(5 ng/mL 在 1x PBS 中)。将板在 37 °C CO2 培养箱中孵育 10 分钟。
- 孵育后立即在 10 °C 下以 300 x g 离心板 5 分钟。用移液管小心地取上清液 (100 μL)。将它们保存在冰上的新圆底 96 孔板中。
- 将 100 μL 细胞裂解缓冲液(0.1% Triton X-100 在 1 x PBS 中,pH 7.4)添加到含有 PEC 的微孔板孔中。将板放在冰上 60 分钟。
- 进行 β-己糖酶测定。
- 从脱颗粒测定后储存在冰中的四种上清液和相应的细胞裂解物中分别取两组上清液和相应的细胞裂解物(参见步骤 2.1.4 和 2.1.5)。将上清液和细胞裂解物分成两个单独的孔(每个孔 50 μL)以重复检测。
- 向每个孔中加入 50 μL β-己糖酶底物溶液。将板在 37 °C 下孵育 30 分钟。向反应混合物中加入 50 μL 终止液(100 mM 甘氨酸,pH 10.7)。
- 读取反应混合物的外径(参见步骤1.4.3)。计算肥大细胞脱颗粒的程度如下。
脱颗粒 % = OD上清液 /(OD上清液 + OD裂解液) X 100%
- 进行组胺测定。
- 将 100 μL 的 1x PBS 添加到上清液的另外两个孔中,并在脱颗粒后保存相应的细胞裂解物,使样品的总体积达到 200 μL。将每个样品分成组胺 ELISA 试剂盒随附的组胺 ELISA 板中的两个单独的孔。
- 按照制造商的手册进行 ELISA 检测。使用 450 nm 波长的紫外可见光吸光度酶标仪读取样品的外径。计算脱颗粒的程度,如 2.1.6.3 所示。
脱颗粒百分比 = [组胺] sup /([组胺]sup + [组胺]裂解物) X 100%
- 通过离体肥大细胞脱颗粒测定评估抗过敏药物对体内发挥的肥大细胞的影响。
- 分别向小鼠(6 周龄,雄性)口服 (po) 200 μL 地塞米松19 (DEX) 和酮替芬20 (KET),每天一次,持续 3 天(6 只小鼠/组)。
- 第 3 次处理后,用 3 μg 抗 DNP IgE 静脉内 (i.v.) 注射小鼠。将每组小鼠分成两个单独的笼子(3 只小鼠/笼);一个用于 PSA 测定,另一个用于离体肥大细胞脱颗粒测定。
- 进行 PSA 检测
- 注射抗 DNP IgE 后一天,用 DNP-BSA (80 μg) 注射小鼠。注射 DNP-BSA 后立即开始,每 15 分钟用直肠温度计测量体温 1 小时。
- 注射 DNP-BSA 后一天取血。用 ELISA 测量血清中 MCPT-1 的水平。
- 进行离体肥大细胞脱颗粒测定。
- 注射抗 DNP IgE 后一天从小鼠中分离 PEC。计算隔离的 PEC 的数量。
- 在 96 孔板(每只小鼠 4 个孔)中接种 90 μL 粗 PEC(5.5 x 106/mL)。将板在 37 °C 加湿的 CO2 培养箱中孵育 30 分钟。
- 添加 10 μL DNP-BSA (5 ng/mL)。将板在 37 °C 加湿 CO2 培养箱中孵育 10 分钟。
- 将板在 10 °C 下以 300 x g 离心 5 分钟。 小心地取取上清液 (100 μL),将细胞留在孔中。
- 向孔中加入 100 μL 细胞裂解缓冲液。将板在冰上孵育 60 分钟。
- 如 2.1.6 和 2.1.7 中所述进行 β-己糖胺酶测定和组胺 ELISA 测定。如步骤 2.1.6.3 中计算 % 脱颗粒。
结果
确定离体肥大细胞脱颗粒测定的最佳 PEC 数量
肥大细胞 (c-kit+·IgE + 双阳性细胞)15 仅占 PEC 的 2% 左右(图 1A)。假设 PEC 中肥大细胞释放 100% 的颗粒,估计培养上清液中要检测到的肥大细胞特异性分子的最大水平,我们测量了用不同数量的 PEC 制备的总细胞裂解物中 β-己糖胺酶16 和组胺17 的量:2.5 x 105、5 x 105 和 1 x 106 PEC, 分别。如图 1B 所示,即使用 2.5 x 105 PEC 制备裂解物,也能检测到显著水平的 β-己糖胺酶和组胺,并且它们的水平随着用于制备细胞裂解物的 PEC 数量的增加而成比例增加。
牢记这些结果,我们决定在离体肥大细胞脱颗粒测定中使用 5 x 105 个 PEC,原因如下。考虑到从一只小鼠(8 周龄)中仅分离出略高于 3 x 106 个 PEC,并且将它们均匀地接种在 96 孔微孔板的 4 个单独孔中(2 个孔用于 β-己糖胺酶,另外两个孔用于组胺测定),每孔接种 1 x 10个 6 个 PEC 可能会导致细胞短缺。此外,上述结果表明,5 x 105 个粗 PEC 中存在足够数量的肥大细胞,用于进行脱颗粒测定。也就是说,根据这些结果,预计即使在肥大细胞仅释放约 30% 至 40% 的颗粒的情况下,在脱颗粒测定后在培养上清液中检测到的 β-己糖胺酶和组胺的水平也将足够高,可以准确定量。
接下来,我们试图确认在 PECs 裂解物中检测到的 β-己糖胺酶和组胺完全来自 PECs 中的肥大细胞。为此,我们使用磁性细胞纯化柱从 PEC 中去除肥大细胞(参见步骤 1.2)。出乎意料的是,飞过色谱柱的未标记 PEC 完全没有肥大细胞(图 1C)。此外,出乎意料的是,在用肥大细胞耗尽的 PEC 制备的细胞裂解物中未检测到 β-己糖胺酶和组胺(图 1D)。
使用粗 PEC 的离体肥大细胞脱颗粒测定
接下来,我们检查了 PEC 中肥大细胞释放的 β-己糖胺酶和组胺的实际水平,其表面有 IgE 的特异性抗原。为此,我们从注射了抗 DNP-IgE 的小鼠中分离出 PEC,并用 DNP-BSA (0.5 ng/mL) 培养它们 (5 x 105)。如图 2A 所示,在培养后 5 分钟内开始在培养上清液中检测到显著水平的 β-己糖酶,并随着培养时间的延长而持续增加。然而,培养 10 分钟后增加速率迅速降低,30 至 40 分钟后脱颗粒程度逐渐达到 50% 左右的平台期。当检查肥大细胞在培养过程中释放的组胺水平时,也获得了类似的结果(图 2B)。基于这些结果,我们决定在以下测定中用 DNP-BSA 培养 PEC 10 分钟。
通过离体脱颗粒测定验证 KET 和 DEX 对肥大细胞的体内影响。
Ketotifen (KET) 是一种具有抗组胺能活性的过敏药物。然而,与其他常规抗组胺药不同的是,它被称为双效抗组胺药,除了抗组胺能活性外,还具有肥大细胞稳定活性。KET 的肥大细胞稳定活性已被探索21,22;然而,主要是体外研究和显示它对体内肥大细胞影响的研究很少。地塞米松 (DEX) 是另一种类型的过敏药物23.已知 DEX 会损害各种类型免疫细胞的功能活性,从而抑制广泛的免疫反应24。为了验证 KET 和 DEX 对体内肥大细胞活性的影响,我们将使用从用其中任何一种处理的小鼠中分离的 PEC 进行离体肥大细胞脱颗粒测定。
在离体肥大细胞脱颗粒测定之前,我们首先检查了 DEX 和 KET 对 PSA 模型中被动转移 DNP 特异性 IgE 和 DNP-BSA 引发的过敏反应的影响。预期中,用 KET 或 DEX 治疗导致过敏症状以剂量依赖性方式改善(补充图 1),表明肥大细胞的功能活性受到其治疗的影响。
我们还检查了从用任一化合物处理的小鼠中分离的 PEC 的数量以及 PEC 中肥大细胞的比例(图 3A)。用 KET 治疗,无论治疗中使用的剂量如何,都不会导致从小鼠中分离的 PECS 数量发生明显变化。相反,当以 4.5 mg/kg 剂量处理时,从 DEX 处理的小鼠中分离的 PEC 数量显着减少,表明 DEX 处理对腹膜细胞的活力有影响。尽管如此,必须注意的是,无论用于治疗的药物和剂量如何,肥大细胞的比例都保持在 2% 左右(图 3A)。我们还通过测量用相同数量的粗 PEC 制备的总细胞裂解物中的含量,检测了 DEX 和 KET 对腹膜腔中肥大细胞表达的 β-己糖胺酶和组胺水平的影响(图 3B)。值得注意的是,发现 β-己糖胺酶和组胺的水平在用 4.5 mg/kg 剂量的 DEX 处理后都有所增加。KET 治疗导致这些水平几乎没有变化。
接下来,我们进行了离体肥大细胞脱颗粒测定(图 4)。首先,我们将 PECs 的细胞密度均匀调整为 5.5 x 106 个细胞/mL,以确保在测定中使用相同数量的肥大细胞。然后将 PEC (90 μL) 接种在 96 孔微孔板中,并与 DNP-BSA 孵育 10 分钟。当用高剂量 DEX 或 KET 处理的小鼠的 PEC 与 DNP-BSA 一起孵育时,发现在培养上清液中检测到的 β-己糖胺酶和组胺的水平与用 DNP-BSA 孵育假处理小鼠的 PEC 后检测到的水平相比显着降低(图 4)。在培养上清液中检测到的那些分子的水平与用于治疗小鼠的 DEX 和 KET 剂量之间也存在明显的负相关。因此,用于治疗的剂量越高,孵育后在培养上清液中检测到的 β-己糖胺酶和组胺水平越低。
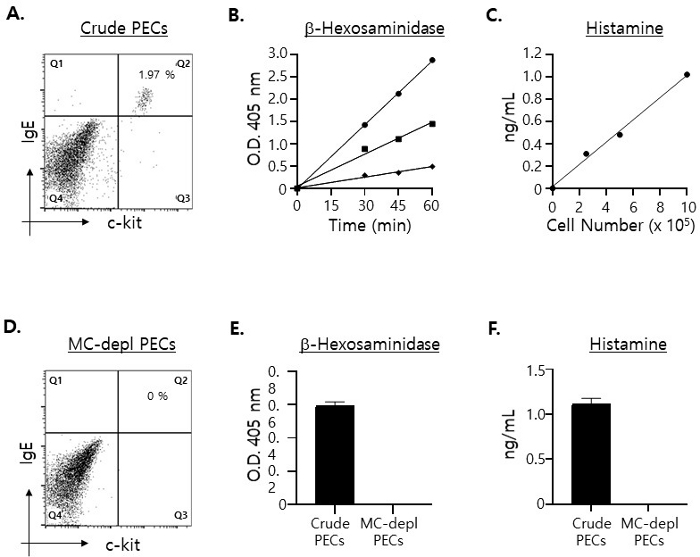
图 1:定量用不同数量的 PEC 制备的裂解物所含的肥大细胞特异性分子的水平。
(A) 用 FITC 标记的抗小鼠 c-kit 和 PE 标记的抗小鼠 IgE mAb 对 PEC 进行染色,并用流式细胞术分析。肥大细胞(即 c-kit+·IgE + 双阳性细胞)显示在右上象限。(B) 分别用 1 x 106 (圆形)、5 x 105 (方形)和 2.5 x 105 (菱形)PEC 制备细胞裂解物,并将总裂解物的一半与 β-己糖胺酶底物一起孵育一段时间,如图所示。使用 96 孔酶标仪在 405 nm 波长下测量酶反应的颜色变化程度。检测一式两份进行。(C) 如 (B) 中制备细胞裂解物,并用 ELISA 测量裂解物中的组胺浓度。(D) 肥大细胞耗尽的 PEC 用 mAb 染色,如 (A) 所示。(E) 分别用 5 x 105 粗制(填充棒)和肥大细胞耗尽(开棒)PEC 制备细胞裂解物,并在反应终止前与 β-己糖胺酶底物孵育 30 分钟。(F) 测量 (E) 中制备的细胞裂解物中组胺的浓度。 请单击此处查看此图的较大版本。

图 2:测量肥大细胞在使用 DNP-BSA 培养 PEC 期间释放的肥大细胞特异性分子的量。
从注射抗 DNP IgE(圆圈)或仅注射 1 x PBS(三角形)的小鼠中分离的 PEC (5 x 10,5) 用 DNP-BSA 培养一段时间,如图所示。绘制每个时间点上清液中检测到的 β-己糖胺酶 (A,左) 和组胺 (B,左) 的水平。分别用释放到上清液和残留在细胞内(细胞裂解物)的 β-己糖胺酶(A,右)和组胺(B,右)的量来计算脱颗粒的程度。以下公式用于计算脱颗粒程度 (%)。脱粒 (%) = [X]sup /([X]sup + [X]裂解物) X 100 请点击此处查看此图的较大版本。
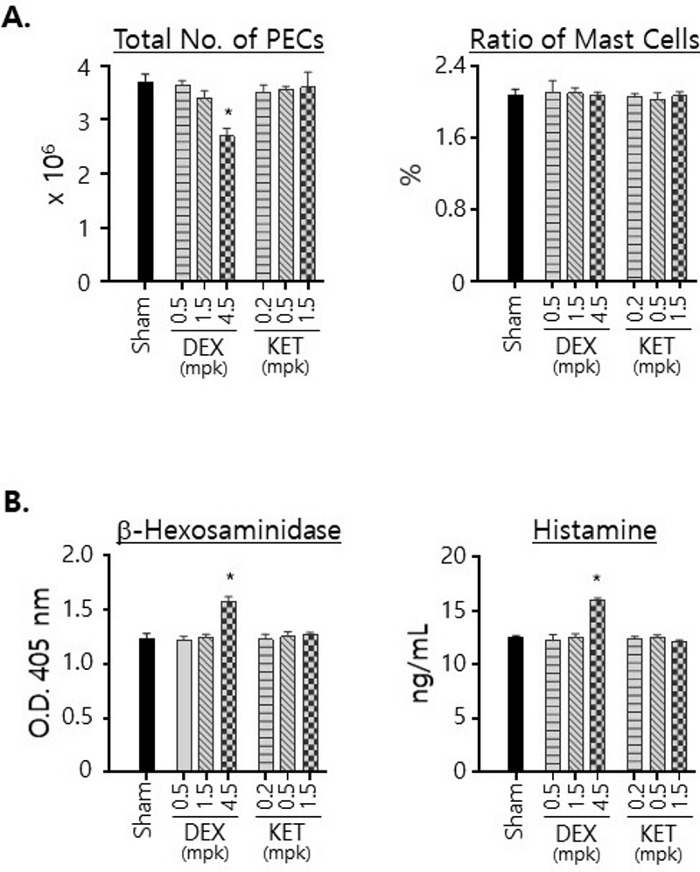
图 3:DEX 和 KET 对腹膜腔中肥大细胞活力以及 β-己糖胺酶和组胺表达水平的影响。
(A) 从单独使用载体(假)或指定剂量的 DEX 或 KET 口服 3 天的小鼠中分离 PEC。用血细胞计数器计数总细胞数,计算平均数并与标准差一起绘制(左)。PEC 用 FITC 标记的抗 c-kit 和 PE 标记的抗 IgE mAb 染色,并用流式细胞术分析。绘制了双阳性细胞(即肥大细胞)与总 PEC 的比率(右)。(B) 按照 (A) 方法分离 PEC,并使用相同数量 (5 x 105) 的 PEC 制备细胞裂解物。测量并绘制这些裂解物中 β-己糖胺酶(左)和组胺(右)的量。所有实验均以每组 3 只小鼠进行。使用单因素方差分析计算统计显着性;* p < 0.05。 请单击此处查看此图的较大版本。

图 4:使用从用 DEX 或 KET 处理的小鼠中分离的粗 PEC 进行离体肥大细胞脱颗粒测定。
从单独使用载体 (初始和假) 或指定剂量的 DEX 或 KET 口服 3 天的小鼠中分离 PEC,然后静脉注射 PBS (初始) 或抗 DNP-IgE。然后将它们与 DNP-BSA 孵育 10 分钟,并根据分别释放到培养上清液中的 β-己糖胺酶 (A) 和组胺 (B) 的水平计算脱颗粒程度。所有实验均以每组 3 只小鼠进行。使用单因素方差分析计算统计显着性;* p < 0.05。 请单击此处查看此图的较大版本。
| 缓冲区 | 食谱 | 评论/描述 | |
| 0.1 M 柠檬酸钠缓冲液 | 45.6 mM 柠檬酸钠二水合物,54.4 mM 柠檬酸,pH 4.5 | 在 2-8°C 下储存 | |
| 10x RBC 裂解缓冲液 | 80 mg/mL NH4Cl、8.4 mg/mL NaHCO3、3.7 mg/mL EDTA(二钠) | 在 2-8°C 下储存,不超过 6 个月 | |
| 细胞裂解缓冲液 | 0.1 % Triton X-100,1 x 磷酸盐缓冲盐水 (PBS) pH 7.4 | 在 2-8°C 下储存 | |
| ELISA 终止液 | 100 mM 甘氨酸,pH 10.7 | 常温储存 | |
| FACS 缓冲区 | 1 x PBS、5 % 马血清、1 % BSA、10 mM HEPES、2 mM EDTA,pH 7.2 | 在 2-8°C 下储存,不超过两个月 | |
| PBSBE 缓冲液(MACS 细胞纯化缓冲液) | 1x PBS,0.5% BSA,2 mM EDTA,pH 7.2 | 在 2-8°C 下储存,不超过两个月 | |
| Tyrode 的 A 缓冲区 | 10 mM HEPES、130 mM NaCl、5.6 mM 葡萄糖、5 mM KCl、1 mM MgCl2、1.4 mM CaCl2、 1 % 牛血清白蛋白 (BSA) pH 7.4 | 在 2-8°C 下储存,不超过两个月 | |
| Tyrode 的 B 缓冲液 | 137 mM 氯化钠、5.6 mM 葡萄糖、12 mM 氯化钠 3.2.7 mM 氯化钾、0.3 mM 氯化钠2PO4、1 mM 氯化镁2、1.8 mM 氯化钙2、0.1 % 明胶,pH 7.4 | 在 2-8°C 下储存,不超过两个月 | |
表 1:缓冲液成分。
补充图 1:DEX 和 KET 对被动转移抗 DNP-IgE 和 DNP-BSA 引起的过敏反应的影响。 每天用载体 (幼稚、假) 或指定剂量的 DEX 或 KET 处理 (p.o.) 小鼠 (p.o.) 每天 3 天,施用 (静脉注射) PBS(幼稚)或抗 DNP-IgE mAb。抗体注射后 1 天,小鼠注射 (i.v.) PBS (幼稚) 或 DNP-BSA。绘制 DNP-BSA 注射后 30 分钟测得的小鼠体温图 (A)。注射 DNP-BSA 后 1 天,从小鼠中抽取血液,并用 ELISA (B) 测量 MCPT-1 水平。实验每组 3 只小鼠进行。使用单因素方差分析计算统计显着性;* p < 0.05。 请点击此处下载此图表。
讨论
肥大细胞脱颗粒测定可以用相对较少的粗小鼠 PEC 进行,这一发现具有重要意义。尽管 PEC 必须是原代小鼠肥大细胞的极好来源,但纯化 PEC 中的肥大细胞是很高的要求。尽管 Percoll25 等密度梯度培养基已成功用于从大鼠 PEC 中纯化肥大细胞,但其用于纯化小鼠腹膜肥大细胞的使用受到限制,这可能是由于大鼠和小鼠肥大细胞密度的差异。另一种梯度培养基(如 Histodenz26 )已用于纯化小鼠腹膜肥大细胞,但成功率有限;纯化的结果似乎取决于小鼠的条件 (例如,年龄)。即使是像磁性细胞纯化系统这样的新型细胞分离系统也只能部分纯化小鼠肥大细胞(作者未发表的数据)。我们在这里表明,腹膜肥大细胞的纯化对于肥大细胞脱颗粒测定是不必要的。
粗 PEC 中的肥大细胞可以由 IgE 的同源抗原触发的结果令人鼓舞,用于追求离体测定以忠实模拟体内发生的脱颗粒事件。然而,除了肥大细胞外,嗜碱性粒细胞还表达 FcεRI27。因此,这里需要注意的是,PEC 中的少量嗜碱性粒细胞也可能有助于在测定过程中培养上清液中组胺浓度的增加。然而,这似乎不太可能,因为在测定中使用耗尽表达 c-kit 的细胞 (即肥大细胞) 的 PEC 时,在培养上清液中没有检测到可测量水平的组胺。这些结果确保肥大细胞完全负责用 DNP-BSA 培养粗 PEC 后在培养上清液中检测到的组胺的释放。
在解释用于探测药物对肥大细胞功能的抑制的体外肥大细胞脱颗粒测定的结果时,一个有趣的问题是如何将此类体外结果(例如,测试化合物的 IC50 )与来自体内动物研究(如 PSA)的体内结果(例如,ED50)相关联。即使在使用原代肥大细胞的情况下,考虑到它们在体外和体内分析过程中遇到的周围环境条件彼此截然不同,从这些研究中获得的结果可能并不总是彼此相似。因此,将体外测定的结果外推到体内实验需要谨慎,反之亦然。由于本研究中描述的离体脱颗粒测定中使用的肥大细胞在与体内测定相同的环境中用测试化合物处理,并在从动物中分离后立即与天然配体一起孵育,因此认为离体测定的结果准确反映了体内肥大细胞在体内测定期间如何受化合物的影响。
虽然本研究的主要重点是如何使用离体测定来确认潜在抗过敏药物在体内的实际肥大细胞稳定活性,但必须注意的是,该测定也可用于检查特定基因敲除对肥大细胞功能的影响。例如,该测定将有助于检查关键参与 T 细胞特定亚群分化的特定基因缺失对肥大细胞功能的影响。此外,尽管我们在这份手稿中仅使用被动全身性过敏反应作为模型系统,但我们假设可以用小鼠主动免疫后获得的 PEC 进行相同的测定。
总之,该测定具有以下几个独特功能。首先,由于使用了粗 PEC,因此该检测既快速又简单。其次,由于肥大细胞在进行相关体内动物研究的环境中用测试化合物处理,因此离体脱颗粒测定的结果忠实地反映了动物研究期间化合物对肥大细胞的影响。第三,由于该测定伴随着 PEC 中肥大细胞的比例和数量的流动分析,因此也可以解决测试化合物对体内肥大细胞活力的影响。
披露声明
作者没有什么可披露的。
致谢
我们感谢 Wonhee Lee 先生和 Eunjoo Lee 女士提供的技术和行政帮助。我们还感谢 Thi Minh Nguyet Nguyen 博士的深思熟虑的评论。这项工作得到了忠清南国立大学(CNU 研究资助 2017-2098-01)和韩国国家研究基金会(NRF-2019R1F1A1061894 和 NRF-2019M3A9G4067293)的研究资助。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | 1757589701 | ||
| 1.5 mL micro tube | Hisol | MT-15003 | |
| 10 mL syringe | 1757593161 | ||
| 15 mL conical tube | Thermo Fisher scientific | 14-959-53A | |
| 20xPBS | Tech & Innovation | BPB-9121-500mL | |
| 4-nitrophenyl-N-acetyl-β-D-glucosaminide | SIGMA | N9376 | |
| 5 mL polystyrene round-bottom tube | Life sciences | 352003 | |
| 50 mL conical tube | Thermo Fisher scientific | 14-959-49A | |
| Aluminium Fiol | BioFact | TS1-3330 | |
| Anti-mouse CD117(c-kit) | Biolegend | 135129 | keep at 2-8°C |
| Anti-mouse IgE mAbs | Thermo Fisher scientific | 11-5992-81 | keep at 2-8°C |
| Antiti-DNP-IgE | SIGMA | D8406-.2MG | keep at -20°C |
| Centrifuge | HANIL | 396150 | |
| D-(+)-gluouse | SIGMA | G8270 | |
| Dexamethasone | SIGMA | D2915-100MG | |
| DNP-BSA | Invitrogen | 2079360 | keep at -20°C |
| EDTA | Biofact | PB131-500 | |
| Fetal Bovine serum | Thermo Fisher scientific | 11455035 | |
| Gelatin | SIGMA | G1890 | |
| Glycine | JUNSEI | 27185-0350 | |
| hemocytometer | ZEISS | 176045 | |
| HEPES | Thermo Fisher scientific | 15630130 | |
| Histamine ELISA kit | Abcam | GK3275957-4 | keep at 2-8°C |
| Hotplate stirrer | Lab teach | zso-9001 | |
| Isoflurance | Troikaa | I29159 | |
| ketotifen fumarate salt | SIGMA | K2628 | |
| MCPT-1 ELISA kit | Thermo Fisher scientific | 88-7503-22 | keep at 2-8°C |
| Mouse Fc block | BD Biosciences | 553141 | keep at 2-8°C |
| Propidium iodiole | SIGMA | 81845 | keep at 2-8°C |
| RBC lysis buffer | Biolegend | 420301 | |
| Round-bottom 96 well | SPL-life sciences | 30096 | |
| Single use syringe filter | Startoriusag | 16555 | |
| Streptavidin microbeads | MilteryiBiotec | 130-048-101 | keep at 2-8°C |
| Triton X-100 | JUNSEIchemical | 49415-1601 | |
| TWEEN 20 | SIGMA | 9005-64-5 | |
| Water bath | CHANGSHINSCIENCE | 190107 |
参考文献
- Amin, K. The role of mast cells in allergic inflammation. Respiratory Medicine. 106 (1), 9-14 (2012).
- Holgate, S., et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. Journal of Allergy and Clinical Immunology. 115 (3), 459-465 (2005).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693 (2012).
- Roth, K., Chen, W. M., Lin, T. J. Positive and negative regulatory mechanisms in high-affinity IgE receptor-mediated mast cell activation. Archivum Immunologiae et Therapiae Experimentalis. 56 (6), 385-399 (2008).
- Finn, D., Walsh, J. Twenty-first century mast cell stabilizers. British Journal of Pharmacology. 170 (1), 23-37 (2013).
- Lu, Y., et al. Emodin, a naturally occurring anthraquinone derivative, suppresses IgE-mediated anaphylactic reaction and mast cell activation. Biochemical Pharmacology. 82 (11), 1700-1708 (2011).
- Demo, S., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry: The Journal of the International Society for Analytical Cytology. 36 (4), 340-348 (1999).
- Passante, E., Ehrhardt, C., Sheridan, H., Frankish, N. RBL-2H3 cells are an imprecise model for mast cell mediator release. Inflammation Research. 58 (9), 611-618 (2009).
- Fukuishi, N., et al. Does β-hexosaminidase function only as a degranulation indicator in mast cells? The primary role of β-hexosaminidase in mast cell granules. The Journal of Immunology. 193 (4), 1886-1894 (2014).
- Malbec, O., et al. Peritoneal cell-derived mast cells: an in vitro model of mature serosal-type mouse mast cells. The Journal of Immunology. 178 (10), 6465-6475 (2007).
- Arock, M., Le Nours, A., Malbec, O., Daëron, M. . Innate Immunity. , 241-254 (2008).
- Befus, A., Pearce, F., Gauldie, J., Horsewood, P., Bienenstock, J. Mucosal mast cells. I. Isolation and functional characteristics of rat intestinal mast cells. The Journal of Immunology. 128 (6), 2475-2480 (1982).
- Yoon, S. C., et al. Anti-allergic and anti-inflammatory effects of aqueous extract of Pogostemon cablin. International Journal of Molecular Medicien. 37 (1), 217-224 (2016).
- Mierke, C. T., et al. Human endothelial cells regulate survival and proliferation of human mast cells. Journal of Experimental Medicien. 192 (6), 801-812 (2000).
- Hermes, B., et al. Altered expression of mast cell chymase and tryptase and of c-Kit in human cutaneous scar tissue. Journal of Investigative Dermatology. 114 (1), 51-55 (2000).
- Wendeler, M., Sandhoff, K. J. Hexosaminidase assays. Glycoconjugate Journal. 26 (8), 945-952 (2009).
- Russell, M., et al. Learned histamine release. Science. 225 (4663), 733-734 (1984).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Kitamura, Y., et al. Dexamethasone suppresses histamine synthesis by repressing both transcription and activity of HDC in allergic rats. Allergology International. 55 (3), 279-286 (2006).
- Grant, S. M., Goa, K. L., Fitton, A., Sorkin, E. M. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorder. Drugs. 40 (3), 412-448 (1990).
- Cook, E., Stahl, J., Barney, N., Graziano, F. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Current Drug Targets-Inflammation & Allergy. 1 (2), 167-180 (2002).
- Schoch, C. In vitro inhibition of human conjunctival mast-cell degranulation by ketotifen. Journal of Ocular Pharmacology and Therapeutics. 19 (1), 75-81 (2003).
- Franchimont, D., et al. Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. The Journal of Immunology. 164 (4), 1768-1774 (2000).
- Simmons, C. P., et al. The clinical benefit of adjunctive dexamethasone in tuberculous meningitis is not associated with measurable attenuation of peripheral or local immune responses. The Journal of Immunology. 175 (1), 579-590 (2005).
- Cavalher-Machado, S. C., et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. International Immunopharmacology. 8 (11), 1552-1560 (2008).
- Dhakal, H., et al. Gomisin M2 inhibits mast cell-mediated allergic inflammation via attenuation of FcεRI-mediated Lyn and Fyn activation and intracellular calcium levels. Frontiers in Pharmacology. 10, 869 (2019).
- Galli, S. J., Wedemeyer, J., Tsai, M. Analyzing the roles of mast cells and basophils in host defense and other biological responses. International Journal of Hematology. 75 (4), 363-369 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。