Method Article
Un test ex vivo de dégranulation des mastocytes à l’aide de cellules d’exsudat péritonéale brutes et d’une stimulation antigénique naturelle
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Nous avons mis au point un test de dégranulation ex vivo des mastocytes réalisé en incubant des cellules d’exsudat péritonéale brutes isolées chez la souris, traitées avec un agent pharmacologique d’intérêt et administrées au préalable des IgE anti-dinitrophénols (DNP), avec du DNP sur une protéine porteuse.
Résumé
Les stabilisateurs de mastocytes sont un élément essentiel des médicaments contre les allergies. L’anaphylaxie systémique passive (APS) est un test animal largement utilisé pour étudier l’effet d’un agent pharmacologique d’intérêt sur les mastocytes in vivo. Comme les symptômes anaphylactiques sont principalement attribués à l’exocytose des granules des mastocytes, on conçoit que l’agent qui provoque l’amélioration des symptômes a une activité stabilisatrice des mastocytes. Malgré le fait, il est prudent de confirmer l’activité en démontrant directement le déclin de l’activité fonctionnelle des mastocytes suite à son traitement. Des essais de dégranulation in vitro utilisant une lignée de mastocytes immortalisés ou des mastocytes primaires cultivés sont couramment utilisés à cette fin. Les résultats des essais in vitro et in vivo ne sont pas toujours semblables ; Cependant, les conditions de traitement (p. ex., dose de traitement, temps, environnement environnant) pour les essais in vitro sont souvent distinctes de celles pour les essais in vivo, comme l’APS. Dans le but de réaliser un test in vitro (ou ex vivo) pour refléter plus fidèlement l’effet d’un agent pharmacologique sur les mastocytes in vivo, nous avons conçu le test de dégranulation ex vivo des mastocytes dans lequel des cellules d’exsudat péritonéale (PEC) brutes isolées des souris, traitées avec l’agent et auxquelles on a administré des IgE anti-dinitrophénols (DNP), ont été incubées directement avec du DNP sur une protéine porteuse. Il s’est avéré que le test était non seulement utile pour valider l’activité stabilisatrice des mastocytes d’un agent pharmacologique indiqué par le test in vivo, mais aussi pratique et hautement reproductible.
Introduction
Les mastocytes jouent un rôle central dans l’allergie 1,2. Lorsque les IgE localisées à la surface des mastocytes via l’interaction avec le récepteur de haute affinité pour les IgE (FcεRI) rencontrent un allergène apparenté, une cascade de signalisation est déclenchée pour provoquer la libération des granules. Par conséquent, diverses molécules effectrices d’allergies, y compris les monoamines (p. ex., histamine, sérotonine), les cytokines (p. ex., TNF-α) et les enzymes protéolytiques (p. ex., tryptase, chymase), sont libérées pour provoquer une série de réactions immunologiques, neurologiques et vasomusculaires 3,4.
Une classe de produits pharmaceutiques est appelée stabilisateur de mastocytes qui atténue les symptômes d’allergie en atténuant la fonction des mastocytes5. L’anaphylaxie systémique passive (APS) est un modèle animal souvent utilisé pour sonder l’activité stabilisatrice des mastocytes des agents pharmacologiques. Comme les symptômes anaphylactiques résultent principalement de l’activation des mastocytes à la suite de l’interaction d’IgE spécifiques de l’haptène passivement transférées avec l’haptène sur une protéine porteuse injectée ultérieurement dans l’animal, il est bien admis qu’un agent pharmacologique d’intérêt a une activité stabilisatrice des mastocytes lorsque son traitement entraîne une amélioration des symptômes6. Pourtant, il est souvent impératif de démontrer directement l’altération de la fonction des mastocytes par l’agent dans une expérience distincte afin d’exclure la possibilité que l’amélioration des symptômes soit dérivée d’un mécanisme autre que la suppression de la fonction des mastocytes.
Le dosage de la dégranulation des mastocytes, qui est effectué en stimulant les mastocytes avec un réactif chimique ou un antigène spécifique d’IgE formant un complexe avec le FcεRI à la surface des mastocytes pour induire l’exocytose des granules sécrétoires (c’est-à-dire la dégranulation), est généralement utilisé pour déterminer l’activité stabilisatrice des mastocytes d’un réactif pharmacologique in vitro7. Plusieurs types de cellules sont utilisés dans ce test, notamment la lignée cellulaire8 de la leucémie basophile du rat (RBL), les mastocytes dérivés de la moelle osseuse (BMMC)9 et les mastocytes dérivés des cellules péritonéales (PCMC)10. Bien qu’utile car un grand nombre de cellules peut être facilement obtenu, RBL est une lignée cellulaire cancéreuse immortalisée dont les propriétés cellulaires ne sont plus similaires à celles des mastocytes dans le corps. L’acquisition d’un nombre suffisant de BMMC ou de PCMC, même si leurs propriétés cellulaires peuvent ressembler davantage à celles des mastocytes dans le corps, est souvent coûteuse et prend du temps.
Un test de dégranulation utilisant des mastocytes primaires purifiés est une alternative souhaitable11. Néanmoins, l’utilisation d’un tel test n’est pas répandue en tant que méthode facile pour purifier les mastocytes des tissus animaux, en particulier des tissus de souris, avec un rendement élevé, et la pureté n’est pas encore disponible. De plus, étant donné que la concentration et la durée du traitement par un agent pharmacologique pour inhiber la fonction des mastocytes in vitro ne coïncident pas toujours avec celles obtenues in vivo, les résultats obtenus avec un test de dégranulation in vitro peuvent fausser ceux d’un test in vivo tel que le PSA, et vice versa. Par conséquent, un nouveau test de dégranulation, qui non seulement imite étroitement la façon dont l’activation des mastocytes se produit in vivo, mais reflète également avec précision les effets d’un réactif pharmacologique exercé sur les mastocytes in vivo, est très demandé. Afin de répondre à ces besoins, nous avons conçu un test de dégranulation des mastocytes ex vivo où les mastocytes dans les cellules exsudatives péritonéales (PEC) isolées des souris, traitées avec un agent pharmacologique d’intérêt et auxquelles on a préalablement administré des IgE spécifiques du dinitrophénol (DNP), sont stimulées avec de l’albumine sérique bovine (BSA) conjuguée au DNP.
Protocole
Toutes les expériences sur les animaux ont été effectuées conformément aux directives fournies par l’IACUC (Institutional Animal Care and Use Committee) de l’Université nationale de Chungnam (numéro de protocole animal : CNU-00996).
1. Quantifier les molécules spécifiques des mastocytes dans le lysat des CEE brutes
- Isolez les cellules de la cavité péritonéale de la souris12.
- Anesthésier une souris (âgée de 8 semaines, mâle, BALB/C) avec de l’isoflurane. Euthanasier par luxation cervicale.
- Placez la souris sur un bloc de mousse. Essuyez l’abdomen avec de l’éthanol à 70 %.
- Coupez la peau ventrale longitudinalement avec des ciseaux à bord émoussé. Décollez la peau de la souris à l’aide d’une pince et de ciseaux.
- Injecter 6 mL de tampon B13 de Tyrode dans la cavité péritonéale à l’aide d’une seringue de 10 mL munie d’une aiguille de 26 G. Insérez l’aiguille doucement pour éviter de piquer des organes.
- Massez l’abdomen de la souris pendant 60 à 90 secondes pour recueillir les cellules péritonéales dans le tampon B de Tyrode. Faites-le doucement pour ne pas endommager les vaisseaux sanguins.
- Insérez l’aiguille (20 G) fixée à une seringue de 10 mL et levez-la. Aspirez lentement le liquide de la cavité péritonéale (généralement 5 à 6 ml).
- Retirez l’aiguille de la seringue. Versez le liquide péritonéal dans un tube conique de 50 ml. Gardez le tube sur de la glace.
- Répétez les étapes 1.1.4 à 1.1.7.
- Centrifuger le tube à 300 x g pendant 5 min à 10 °C. Remettre les cellules en suspension dans 1 mL de 1 tampon de lyse des globules rouges (GR). Gardez les cellules sur la glace pendant 3 min.
- Diluez la suspension cellulaire avec 2 mL de tampon B de Tyrode. Centrifuger le tube à 300 x g pendant 5 min à 10 °C.
- Retirez le surnageant. Remettre les cellules en suspension dans 0,5 mL de tampon A13 de Tyrode.
- Comptez les cellules à l’aide d’un hémocytomètre. Ajustez le numéro de cellule à 5 x 106/mL avec la mémoire tampon A de Tyrode.
- Préparer des CEE appauvries en mastocytes à l’aide d’un système de purification magnétiquedes cellules 14.
- Centrifugeuse 5 x 105 CEE bruts à 300 x g pendant 5 min à 10 °C. Remettre la pastille en suspension dans 200 μL de tampon de purification cellulaire PBSBE (0,5 % BSA, 2 mM EDTA, 1 x PBS, pH 7,4).
- Ajouter 1 μL d’inhibiteur Fc (0,5 mg/mL) dans les cellules pour empêcher la liaison non spécifique de l’anticorps monoclonal (mAb) anti-c-kit à ajouter ensuite. Gardez les cellules sur la glace pendant 5 min.
- Ajouter 1 μL de c-kit anti-souris biotinylé mAb15 (0,5 mg/mL). Gardez les cellules sur de la glace pendant 10 min.
- Ajouter 2 mL de tampon PBSBE. Centrifuger les cellules à 300 x g pendant 10 min à 10 °C.
- Retirez le surnageant. Lavez à nouveau les cellules avec 2 mL de tampon PBSBE.
- Remettre les cellules en suspension dans 90 μL de tampon PBSBE. Ajouter 10 μL de microbilles conjuguées à la streptavidine. Gardez les cellules sur de la glace pendant 15 min.
- Ajouter 2 mL de tampon PBSBE. Centrifuger les cellules à 300 x g pendant 10 min à 10 °C.
- Chargez 500 μL de tampon PBSBE sur une colonne magnétique moyenne pendant le spin. Laissez la mémoire tampon s’écouler à travers la colonne.
- Retirer le surnageant après centrifugation. Remettre les cellules en suspension dans 500 μL de tampon PBSBE.
- Chargez les cellules sur la colonne. Récupérez les cellules qui passent librement dans la colonne.
- Laver la colonne avec 500 μL de tampon PBSBE. Récupérez à nouveau les cellules passant par la colonne.
- Répétez l’étape 1.2.11.
- Combinez les cellules des étapes 1.2.9 à 1.2.11 dans un seul tube. Centrifuger les cellules à 300 x g pendant 10 min à 10 °C.
- Remettez les cellules en suspension dans le tampon A de Tyrode. Comptez les cellules. Ajustez le numéro de cellule à 5 x 106 cellules/ml.
- Préparez le lysat des CEE
- Plaquez les CEE (p. ex., 5 x 105) dans une plaque à fond rond à 96 puits, respectivement. Centrifuger la plaque à 300 x g pendant 2 min à 10 °C pour recueillir les cellules. Retirez le surnageant avec précaution à l’aide d’une pipette.
- Ajouter 100 μL de tampon de lyse cellulaire à la pastille cellulaire. Remettez les cellules en suspension en les pipetant plusieurs fois de haut en bas doucement. Gardez l’assiette sur de la glace pendant 60 min.
- Centrifuger la plaque à 300 x g pendant 5 min à 10 °C pour éliminer les débris cellulaires. Transférez le surnageant (le lysat cellulaire) dans une nouvelle plaque à 96 puits.
- Mesurer l’activité enzymatique de la β-hexosaminidase16.
- Ajouter le lysat cellulaire (50 μL) à une solution de substrat préchauffé de β-hexosaminidase (50 μL) dans une microplaque de 96 puits. Mélangez-les délicatement à l’aide d’une pipette.
- Incuber la plaque dans un incubateur à 37 °C. Ajouter 50 μL de solution d’arrêt (100 mM de glycine, pH 10,7) après 30 min pour terminer la réaction enzymatique.
- Lire le diamètre extérieur des mélanges réactionnels avec un lecteur de microplaques à absorbance UV-visible en réglage à double longueur d’onde ; 405 nm pour déterminer le niveau de la réaction enzymatique et 620 nm pour la soustraction automatique du bruit de fond, respectivement.
- Mesurez la concentration d’histamine17.
- Transférez 100 μL des lysats cellulaires éliminés dans la plaque recouverte d’anticorps monoclonaux antihistaminiques fournie avec le kit ELISA d’histamine. Effectuer un test ELISA compétitif de l’histamine en suivant le manuel du fabricant.
- Lisez le diamètre extérieur des échantillons à l’aide d’un lecteur de microplaques à absorbance UV-visible à une longueur d’onde de 450 nm.
- Déterminer le rapport des mastocytes dans les CEE avec la cytométrie en flux18.
- Transvaser 1 x 105 CEE bruts ou appauvris en mastocytes dans une plaque à fond rond à 96 puits. Centrifuger la plaque à 300 x g pendant 2 min à 10 °C.
- Remettre les cellules en suspension dans 50 μL de tampon FACS. Ajouter 1 μL de c-kit anti-souris (0,5 mg/mL) et d’anticorps monoclonaux IgE anti-souris (0,5 mg/mL).
- Vortex les cellules brièvement. Gardez les cellules sur la glace pendant 20 minutes dans l’obscurité.
- Remplissez les puits avec 150 μL de tampon FACS. Centrifuger la plaque à 300 x g pendant 2 min à 10 °C. Jetez le tampon en retournant rapidement la plaque.
- Remettre les cellules en suspension avec 150 μL de tampon FACS contenant de l’iodure de propidium (1 μg/mL). Analysez les cellules à l’aide d’un cytomètre en flux.
2. Dosage de la dégranulation des mastocytes à l’aide de CEE bruts
- Déterminer l’étendue de la dégranulation des mastocytes ( % de dégranulation).
- Injecter 3 μg d’anticorps monoclonaux anti-DNP (IgE de souris) chez 3 souris BALB/C (mâles de 8 semaines) avec 3 μg d’anticorps monoclonaux anti-DNP. Isolez les CEE un jour après l’injection d’Ab (voir l’étape 1.1).
- Plaque de 90 μL de CEE brut (5,5 x 106/mL) dans une plaque à fond plat de 96 puits (total de 4 puits). Incuber la plaque dans un incubateur de CO2 humidifié à 37 °C pendant 30 minutes.
- Ajouter 10 μL de DNP-BSA (5 ng/mL dans 1x PBS) dans les puits contenant des CEE Incuber la plaque pendant 10 min dans un incubateur à 37 °C CO2 .
- Centrifuger la plaque à 300 x g pendant 5 min à 10 °C immédiatement après l’incubation. Prélever délicatement les surnageants (100 μL) à l’aide d’une pipette. Conservez-les dans une nouvelle assiette à fond rond de 96 puits sur de la glace.
- Ajouter 100 μL de tampon de lyse cellulaire (0,1 % de Triton X-100 dans 1 x PBS, pH 7,4) dans les puits de microplaques contenant des CEE Gardez l’assiette sur de la glace pendant 60 min.
- Effectuer le dosage de la β-hexosaminidase.
- Prélever respectivement deux séries de surnageants et les lysats cellulaires correspondants sur quatre qui ont été stockés dans la glace après l’essai de dégranulation (voir les étapes 2.1.4 et 2.1.5). Divisez le surnageant et le lysat cellulaire en deux puits distincts (50 μL chacun) pour la duplication du test.
- Ajouter 50 μL de solution de substrat de β-hexosaminidase dans chaque puits. Incuber la plaque à 37 °C pendant 30 min. Ajouter 50 μL de solution stop (100 mM de glycine, pH 10,7) au mélange réactionnel.
- Lire D.E. des mélanges réactionnels (se référer à l’étape 1.4.3). Calculez l’étendue de la dégranulation des mastocytes comme suit.
% de dégranulation =surnageant de DO /(surnageant de DO +lysat de D) X 100 %
- Effectuez le dosage de l’histamine.
- Ajoutez 100 μL de 1x PBS dans deux autres puits des surnageants et les lysats cellulaires correspondants enregistrés après la dégranulation pour porter le volume total des échantillons à 200 μL. Divisez chaque échantillon dans deux puits distincts dans une plaque ELISA d’histamine fournie avec le kit ELISA d’histamine.
- Effectuez le test ELISA en suivant le manuel du fabricant. Lisez le diamètre extérieur des échantillons à l’aide d’un lecteur de microplaques à absorbance UV-visible à une longueur d’onde de 450 nm. Calculer l’étendue de la dégranulation comme indiqué à la section 2.1.6.3.
% de dégranulation = [histamine]sup /([histamine]sup + [histamine]lysat) X 100 %
- Évaluer les effets des médicaments antiallergiques sur les mastocytes exercés in vivo à l’aide du test de dégranulation des mastocytes ex vivo.
- Administrer par voie orale (p.o.) 200 μL de dexaméthasone19 (DEX) et de kétotifène20 (KET), respectivement, à des souris (mâles de 6 semaines) une fois par jour pendant 3 jours (6 souris/groupe).
- Injectez aux souris par voie intraveineuse (i.v.) 3 μg d’IgE anti-DNP après le 3ème traitement. Divisez chaque groupe de souris en deux cages distinctes (3 souris/cage) ; l’un pour le dosage de l’APS et l’autre pour le dosage ex vivo de la dégranulation des mastocytes.
- Effectuer le dosage de l’APS
- Injectez aux souris du DNP-BSA (80 μg) un jour après l’injection d’IgE anti-DNP. Mesurer la température corporelle à l’aide d’un thermomètre rectal toutes les 15 minutes pendant 1 h à partir de l’immédiat après l’injection de DNP-BSA.
- Prélever le sang un jour après l’injection de DNP-BSA. Mesurez les niveaux de MCPT-1 dans le sérum avec ELISA.
- Effectuer un test de dégranulation des mastocytes ex vivo.
- Isolez les CEE des souris un jour après l’injection d’IgE anti-DNP. Comptez le nombre de CEE isolés.
- Plaque de 90 μL de CEE brut (5,5 x 106/mL) dans une plaque de 96 puits (4 puits par souris). Incuber les plaques dans un incubateur au CO2 humidifié à 37 °C pendant 30 min.
- Ajouter 10 μL de DNP-BSA (5 ng/mL). Incuber la plaque pendant 10 min à 37 °C dans un incubateur de CO2 humidifié.
- Centrifuger la plaque à 300 x g pendant 5 min à 10 °C. Prélevez les surnageants (100 μL) avec précaution, en laissant les cellules dans les puits.
- Ajouter 100 μL de tampon de lyse cellulaire dans les puits. Incuber l’assiette sur de la glace pendant 60 min.
- Effectuer le dosage de la β-hexosaminidase et le dosage ELISA de l’histamine comme décrit aux sections 2.1.6 et 2.1.7. Calculez le % de dégranulation comme à l’étape 2.1.6.3.
Résultats
Détermination du nombre optimal de CEE pour l’essai de dégranulation ex vivo des mastocytes
Mastocytes (c-kit+· IgE+ double positive)15 ne représentent qu’environ 2 % des CEE (Figure 1A). En estimant les niveaux maximaux de molécules spécifiques des mastocytes à détecter dans les surnageants de culture en supposant que 100 % des granules étaient libérés par les mastocytes dans les CEE, nous avons mesuré les quantités de β-hexosaminidase16 et d’histamine17 dans les lysats cellulaires totaux préparés avec différents nombres de CEE : 2,5 x 105, 5 x 105 et 1 x 106 CEE, respectivement. Comme le montre la figure 1B, des niveaux significatifs de β-hexosaminidase et d’histamine ont été détectés même lorsque le lysat a été préparé avec 2,5 x 105 CEE, et leurs niveaux ont augmenté proportionnellement à mesure que le nombre de CEE utilisés pour la préparation du lysat cellulaire augmentait.
En gardant ces résultats à l’esprit, nous avons décidé d’utiliser 5 x 105 PEC dans le test de dégranulation ex vivo des mastocytes pour les raisons suivantes. Étant donné qu’un peu plus de 3 x 106 CEE ont été isolés chez une souris (âgée de 8 semaines) et qu’ils devaient être placés uniformément dans 4 puits distincts dans une microplaque de 96 puits (2 puits pour la β-hexosaminidase et deux autres puits pour les dosages d’histamine, respectivement), le placage de 1 x 106 CEE par puits provoquerait probablement une pénurie de cellules. De plus, les résultats présentés ci-dessus ont indiqué qu’il y avait un nombre suffisant de mastocytes dans 5 x 105 CEE bruts pour effectuer le test de dégranulation. En d’autres termes, selon ces résultats, on s’attendait à ce que, même dans le cas où seulement environ 30 à 40 % des granules étaient libérés par les mastocytes, les niveaux de β-hexosaminidase et d’histamine détectés dans les surnageants de culture après l’essai de dégranulation seraient suffisamment élevés pour être quantifiés avec précision.
Ensuite, nous avons tenté de confirmer que la β-hexosaminidase et l’histamine détectées dans les lysats des CEE étaient dérivées exclusivement des mastocytes des CEE d’origine. Pour ce faire, nous avons appauvri les mastocytes des CEE à l’aide d’une colonne de purification cellulaire magnétique (reportez-vous à l’étape 1.2). Comme on pouvait s’y attendre, les CEE non étiquetées qui ont traversé la colonne étaient complètement dépourvues de mastocytes (Figure 1C). De plus, comme on pouvait s’y attendre, ni la β-hexosaminidase ni l’histamine n’ont été détectées dans le lysat cellulaire préparé avec des CEE appauvries en mastocytes (figure 1D).
Essai ex vivo de dégranulation de mastocytes à l’aide de CEE bruts
Nous avons ensuite examiné les niveaux réels de β-hexosaminidase et d’histamine libérés par les mastocytes dans les CEE pendant la culture avec un antigène spécifique d’IgE à leur surface. Pour ce faire, nous avons isolé les CEE des souris injectées avec des anti-DNP-IgE et les avons cultivées (5 x 105) avec du DNP-BSA (0,5 ng/mL). Comme le montre la figure 2A, une concentration significative de β-hexosaminidase a commencé à être détectée dans le surnageant de culture dans les 5 minutes suivant la culture et a augmenté continuellement à mesure que la période de culture se prolongeait. Néanmoins, le taux d’augmentation a diminué rapidement après 10 min de culture, et l’étendue de la dégranulation a progressivement atteint le plateau à environ 50 % après 30 à 40 min. Des résultats similaires ont également été obtenus lorsque les niveaux d’histamine libérés par les mastocytes pendant la culture ont été examinés (Figure 2B). Sur la base de ces résultats, nous avons décidé de cultiver des CEE avec du DNP-BSA pendant 10 minutes dans les tests suivants.
Vérification des effets in vivo du KET et du DEX sur les mastocytes à l’aide du test de dégranulation ex vivo.
Le kétotifène (KET) est un médicament contre les allergies ayant une activité antihistaminergique. Différent des autres antihistaminiques conventionnels, cependant, il est connu comme un antihistaminique à double action qui a également une activité stabilisatrice des mastocytes en plus de l’activité antihistaminergique. L’activité stabilisatrice des mastocytes de KET a été explorée21,22 ; Cependant, la plupart des études in vitro et des études montrant comment il a un effet sur les mastocytes in vivo sont rares. La dexaméthasone (DEX) est un autre type de médicament contre les allergies23. La DEX est connue pour altérer les activités fonctionnelles de divers types de cellules immunitaires afin de supprimer un large spectre de réponses immunitaires24. Pour vérifier l’effet du KET et du DEX sur l’activité des mastocytes in vivo, nous devions réaliser le test de dégranulation ex vivo des mastocytes avec des CEE isolées chez les souris traitées avec l’un ou l’autre d’entre eux.
Avant l’essai ex vivo de dégranulation des mastocytes, nous avons d’abord examiné les effets de DEX et de KET sur les réactions anaphylactiques provoquées par des IgE et DNP-BSA spécifiques du DNP transférées passivement dans un modèle PSA. Comme on pouvait s’y attendre, le traitement par KET ou DEX a entraîné une amélioration des symptômes anaphylactiques d’une manière dose-dépendante (figure supplémentaire 1), indiquant que l’activité fonctionnelle des mastocytes était compromise par leurs traitements.
Nous avons également examiné le nombre de CEE isolées chez les souris traitées avec l’un ou l’autre composé et le rapport des mastocytes dans les CEE (Figure 3A). Les traitements par KET, quelles que soient les doses utilisées dans les traitements, n’ont entraîné aucun changement notable dans le nombre de PECS isolés chez les souris. En revanche, le nombre de CEE isolées chez les souris traitées au DEX a diminué de manière significative lorsqu’elles étaient traitées à une dose de 4,5 mg/kg, ce qui indique que le traitement au DEX a eu un effet sur la viabilité des cellules péritonéales. Il faut tout de même noter que le rapport des mastocytes est resté constant à environ 2 % quels que soient les médicaments et les doses utilisés pour le traitement (Figure 3A). Nous avons également examiné les effets de DEX et de KET sur les niveaux de β-hexosaminidase et d’histamine exprimés par les mastocytes dans la cavité péritonéale en mesurant leurs quantités dans les lysats cellulaires totaux préparés avec les mêmes nombres de CEE bruts (Figure 3B). Il convient de noter que les taux de β-hexosaminidase et d’histamine ont été augmentés après le traitement par DEX à la dose de 4,5 mg/kg. Les traitements KET ont entraîné peu de changement dans ces niveaux.
Ensuite, nous avons effectué le test de dégranulation ex vivo des mastocytes (Figure 4). Tout d’abord, nous avons ajusté la densité cellulaire des CEE uniformément à 5,5 x 106 cellules/ml pour nous assurer que le même nombre de mastocytes était utilisé dans le test. Les CEE (90 μL) ont ensuite été plaquées dans une microplaque de 96 puits et incubées avec du DNP-BSA pendant 10 min. Lorsque les CEE des souris traitées avec la dose élevée de DEX ou de KET ont été incubées avec du DNP-BSA, les concentrations de β-hexosaminidase et d’histamine détectées dans les surnageants de culture se sont avérées significativement inférieures à celles détectées après l’incubation de CEE de souris traitées avec du DNP-BSA (figure 4). Une corrélation inverse était également apparente entre les niveaux de ces molécules détectées dans les surnageants de culture et les doses de DEX et de KET utilisées pour les traitements des souris. Ainsi, plus la dose utilisée pour le traitement était élevée, plus les taux de β-hexosaminidase et d’histamine détectés dans les surnageants de culture après l’incubation étaient faibles.
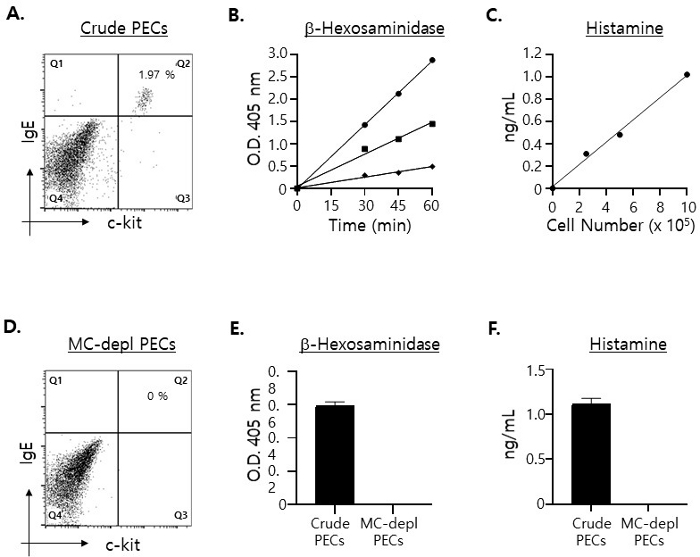
Figure 1 : Quantification des niveaux de molécules spécifiques aux mastocytes contenus dans les lysats préparés avec différents nombres de CEE
(A) Les CEE ont été colorées avec des c-kit anti-souris marqués au FITC et des anticorps IgE anti-souris marqués au PE et analysées par cytométrie en flux. Les mastocytes (c’est-à-dire c-kit+· cellules IgE+ double positives) sont illustrées dans le quadrant supérieur droit. (B) Les lysats cellulaires ont été préparés avec 1 x 106 (cercle), 5 x 105 (carré) et 2,5 x 105 (diamant), respectivement, et la moitié des lysats totaux a été incubée avec le substrat de β-hexosaminidase pendant une période de temps indiquée. L’étendue des changements de couleur par la réaction enzymatique a été mesurée avec un lecteur de microplaques à 96 puits à une longueur d’onde de 405 nm. Les analyses ont été effectuées en double. (C) Les lysats cellulaires ont été préparés comme en (B) et les concentrations d’histamine dans les lysats ont été mesurées avec ELISA. (D) Les CEE appauvries en mastocytes ont été colorées avec les mAbs comme en (A). (E) Les lysats cellulaires ont été préparés avec 5 x 105 CEE bruts (bar rempli) et appauvris en mastocytes (bar ouvert), respectivement, et incubés avec le substrat β-hexosaminidase pendant 30 minutes avant la fin des réactions. (F) Les concentrations d’histamine dans les lysats cellulaires préparés comme en (E) ont été mesurées. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Mesure des quantités de molécules spécifiques aux mastocytes libérées par les mastocytes lors de la culture de CEE avec DNP-BSA.
Des CEE (5 x 105) isolées chez les souris injectées avec des IgE anti-DNP (cercle) ou avec seulement 1 x PBS (triangle) ont été cultivées avec du DNP-BSA pendant une période de temps indiquée. Les niveaux de β-hexosaminidase (A, à gauche) et d’histamine (B, à gauche) détectés dans les surnageants à chaque point de temps ont été tracés. L’étendue de la dégranulation a été calculée en fonction des quantités de β-hexosaminidase (A, à droite) et d’histamine (B, à droite) libérées aux surnageants et restant à l’intérieur des cellules (lysat cellulaire), respectivement. L’équation suivante a été utilisée pour calculer l’étendue de la dégranulation ( %). Dégranulation ( %) = [X]sup /([X]sup + [X]lysat) X 100 Cliquez ici pour voir une version agrandie de cette figure.
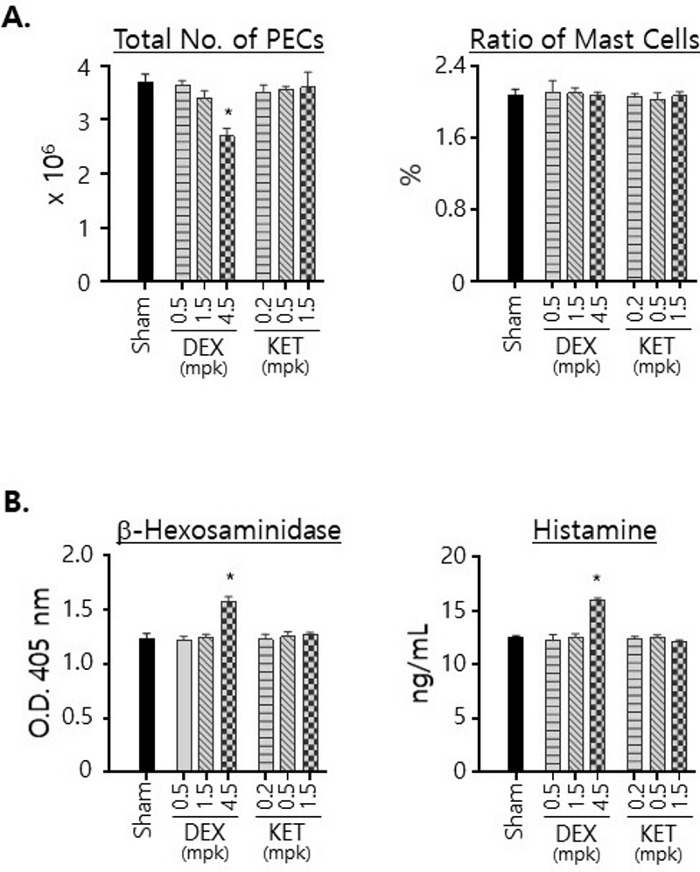
Figure 3 : Effets de DEX et KET sur la viabilité des mastocytes dans la cavité péritonéale et les niveaux d’expression de la b-hexosaminidase et de l’histamine.
(A) Des CEE ont été isolées chez les souris traitées p.o. pendant 3 jours avec le véhicule seul (simulacre) ou avec des doses indiquées de DEX ou de KET. Le nombre total de cellules a été compté à l’aide d’un hémocytomètre et les nombres moyens ont été calculés et tracés avec les écarts-types (à gauche). Les CEE ont été colorées avec des anticorps anti-c-kit marqués FITC et des anticorps anti-IgE marqués au PE et analysées par cytométrie en flux. Les rapports entre les cellules doubles positives (c’est-à-dire les mastocytes) et les CEE totales ont été tracés (à droite). (B) Les CEE ont été isolées comme en (A), et des lysats cellulaires ont été préparés avec le même nombre (5 x 105) de CEE Les quantités de β-hexosaminidase (à gauche) et d’histamine (à droite) dans ces lysats ont été mesurées et tracées. Toutes les expériences ont été réalisées avec 3 souris par groupe. Les significations statistiques ont été calculées à l’aide de l’anova à un facteur ; * p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Essai de dégranulation ex vivo de mastocytes à l’aide de CEE bruts isolés chez les souris traitées avec DEX ou KET.
Des CEE ont été isolées chez les souris traitées pendant 3 jours avec du véhicule seul (naïf et simulé) ou avec des doses indiquées de DEX ou de KET, puis injectées par voie intraveineuse avec du PBS (naïf) ou des anti-DNP-IgE. Ils ont ensuite été incubés avec du DNP-BSA pendant 10 minutes, et l’étendue de la dégranulation a été calculée sur la base des niveaux de β-hexosaminidase (A) et d’histamine (B), respectivement, libérés dans les surnageants de culture. Toutes les expériences ont été réalisées avec 3 souris par groupe. Les significations statistiques ont été calculées à l’aide de l’anova à un facteur ; * p < 0,05. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Tampon | Recette | Commentaires/Description | |
| Tampon de na-citrate de 0,1 M | 45,6 mM de citrate de sodium dihydraté, 54,4 mM d’acide citrique, pH 4,5 | Conserver à une température de 2 à 8 °C | |
| 10x tampon de lyse des globules rouges | 80 mg/mL NH4Cl, 8,4 mg/mL NaHCO3, 3,7 mg/mL EDTA (disodique) | Conserver à une température de 2 à 8 °C, ne pas dépasser six mois | |
| Tampon de lyse cellulaire | 0,1 % Triton X-100, 1 x solution saline tamponnée au phosphate (PBS) pH 7,4 | Conserver à une température de 2 à 8 °C | |
| Solution d’arrêt ELISA | 100 mM de glycine, pH 10,7 | Stockage à température normale | |
| Tampon FACS | 1 x PBS, 5 % de sérum de cheval, 1 % de BSA, 10 mM d’HEPES, 2 mM d’EDTA, pH 7,2 | Conserver entre 2 et 8 °C, ne pas dépasser deux mois | |
| Tampon PBSBE (tampon de purification de cellules MACS ) | 1x PBS, 0,5 % BSA, 2 mM EDTA, pH 7,2 | Conserver entre 2 et 8 °C, ne pas dépasser deux mois | |
| Le tampon A de Tyrode | 10 mM HEPES, 130 mM NaCl, 5,6 mM glucose, 5 mM KCl, 1 mM MgCl2, 1,4 mM CaCl2, 1 % d’albumine sérique bovine (BSA) pH 7,4 | Conserver entre 2 et 8 °C, ne pas dépasser deux mois | |
| Tampon B de Tyrode | 137 mM NaCl, 5,6 mM de glucose, 12 mM de NaHCO 3,2,7 mM de KCl, 0,3 mM de NaH2PO4, 1 mM de MgCl2, 1,8 mM de CaCl2, 0,1 % de gélatine, pH de 7,4 | Conserver entre 2 et 8 °C, ne pas dépasser deux mois | |
Tableau 1 : Compositions des zones tampons.
Figure supplémentaire 1 : Effets de DEX et de KET sur les réactions anaphylactiques causées par les anti-DNP-IgE et DNP-BSA transférés passivement. Des souris traitées (p.o.) quotidiennement pendant 3 jours avec le véhicule seul (naïf, simulacre) ou avec des doses indiquées de DEX ou de KET, ont reçu (i.v.) du PBS (naïf) ou des anticorps monoclonaux anti-DNP-IgE. Un jour après l’injection d’anticorps, les souris ont reçu une injection (i.v.) de PBS (naïf) ou de DNP-BSA. Les températures corporelles des souris mesurées 30 minutes après l’injection de DNP-BSA ont été tracées (A). Un jour après l’injection de DNP-BSA, le sang a été prélevé sur les souris et les niveaux de MCPT-1 ont été mesurés avec ELISA (B). L’expérience a été réalisée avec 3 souris par groupe. Les significations statistiques ont été calculées à l’aide de l’ANOVA à un facteur ; * p < 0,05. Veuillez cliquer ici pour télécharger cette figure.
Discussion
La découverte que le test de dégranulation des mastocytes peut être effectué avec un nombre relativement faible de CEE de souris brutes est significative. Même si les CEE doivent être une excellente source de mastocytes primaires de souris, il est difficile de purifier les mastocytes dans les CEE. Bien qu’un milieu à gradient de densité tel que Percoll25 ait été utilisé avec succès pour la purification des mastocytes à partir des CEE de rat, son utilisation pour la purification des mastocytes péritonéaux de souris a été limitée, probablement en raison de la différence de densité des mastocytes de rat et de souris. Un autre milieu à gradient tel que Histodenz26 a été utilisé pour la purification des mastocytes péritonéaux de souris avec un succès limité ; Le résultat de la purification semblait dépendre de l’état des souris (par exemple, l’âge). Même un nouveau système d’isolement cellulaire comme le système de purification magnétique des cellules n’a conduit qu’à une purification partielle des mastocytes de souris (données non publiées des auteurs). Nous montrons ici que la purification des mastocytes péritonéaux n’est pas nécessaire pour le dosage de la dégranulation des mastocytes.
Le résultat selon lequel les mastocytes dans les CEE brutes pourraient être déclenchés par un antigène apparenté des IgE est encourageant dans la poursuite d’un test ex vivo pour imiter fidèlement l’événement de dégranulation qui se produit in vivo. En plus des mastocytes, cependant, les basophiles expriment également FcεRI27. Ainsi, une mise en garde ici est qu’un petit nombre de basophiles dans les CEE pourrait également contribuer à l’augmentation de la concentration d’histamine dans le surnageant de culture pendant le test. Cela semble peu probable, cependant, car aucun niveau mesurable d’histamine n’a été détecté dans le surnageant de culture lorsque des CEE appauvries en cellules exprimant le c-kit (c’est-à-dire des mastocytes) ont été utilisées dans l’essai. Ces résultats ont assuré que les mastocytes étaient entièrement responsables de la libération d’histamine détectée dans le surnageant de culture après la culture de CEE brutes avec DNP-BSA.
Une question intrigante dans l’interprétation du résultat d’un essai de dégranulation in vitro des mastocytes pour sonder l’inhibition de la fonction des mastocytes par un agent pharmacologique est de savoir comment relier un tel résultat in vitro (p. ex., CI50 d’un composé d’essai) au résultat in vivo (p. ex., ED50) dérivé d’une étude in vivo sur des animaux comme l’APS. Même dans le cas où des mastocytes primaires sont utilisés, étant donné que les conditions environnementales environnantes qu’ils rencontrent lors des essais in vitro et in vivo sont profondément différentes les unes des autres, les résultats obtenus de ces études peuvent ne pas toujours être similaires les uns aux autres. Par conséquent, il faut faire preuve de prudence avant d’extrapoler les résultats de l’essai in vitro à l’expérience in vivo et vice versa. Étant donné que les mastocytes utilisés dans l’essai de dégranulation ex vivo décrit dans cette étude sont traités avec un composé d’essai dans les mêmes environnements que ceux de l’essai in vivo et incubés avec un ligand naturel immédiatement après l’isolement de l’animal, on pense que les résultats de l’essai ex vivo reflètent avec précision comment les mastocytes dans le corps sont affectés par le composé pendant l’essai in vivo.
Bien que l’objectif principal de cette étude soit de savoir comment utiliser le test ex vivo pour confirmer l’activité stabilisatrice réelle des mastocytes d’un médicament antiallergique potentiel in vivo, il convient de noter que ce test peut également être utilisé dans le but d’examiner les effets de l’inactivation de gènes spécifiques sur la fonction des mastocytes. Par exemple, ce test sera utile pour examiner les effets de la délétion de gènes spécifiques impliqués de manière critique dans la différenciation de sous-ensembles spécifiques de lymphocytes T sur la fonction des mastocytes. De plus, même si nous n’avons utilisé que l’anaphylaxie systémique passive comme système modèle dans ce manuscrit, nous supposons que le même test peut être effectué avec des CEE obtenues après immunisation active de souris.
En résumé, ce test présente plusieurs caractéristiques uniques comme suit. Tout d’abord, l’analyse est rapide et facile car des CEE brutes sont utilisées. Deuxièmement, comme les mastocytes sont traités avec un composé d’essai dans les environnements où une étude animale in vivo pertinente est menée, les résultats de l’essai de dégranulation ex vivo reflètent fidèlement les effets du composé exercé sur les mastocytes au cours de l’étude animale. Troisièmement, comme le test est accompagné d’une analyse de flux pour le rapport et le nombre de mastocytes dans les CEE, les effets du composé testé sur la viabilité des mastocytes in vivo peuvent également être abordés.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions M. Wonhee Lee et Mme Eunjoo Lee pour leur assistance technique et administrative. Nous remercions également la Dre Thi Minh Nguyet Nguyen pour ses commentaires réfléchis. Ce travail a été soutenu par les subventions de recherche de l’Université nationale de Chungnam (CNU Research Grant 2017-2098-01) et de la Fondation nationale de la recherche de Corée (NRF-2019R1F1A1061894 et NRF-2019M3A9G4067293).
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | 1757589701 | ||
| 1.5 mL micro tube | Hisol | MT-15003 | |
| 10 mL syringe | 1757593161 | ||
| 15 mL conical tube | Thermo Fisher scientific | 14-959-53A | |
| 20xPBS | Tech & Innovation | BPB-9121-500mL | |
| 4-nitrophenyl-N-acetyl-β-D-glucosaminide | SIGMA | N9376 | |
| 5 mL polystyrene round-bottom tube | Life sciences | 352003 | |
| 50 mL conical tube | Thermo Fisher scientific | 14-959-49A | |
| Aluminium Fiol | BioFact | TS1-3330 | |
| Anti-mouse CD117(c-kit) | Biolegend | 135129 | keep at 2-8°C |
| Anti-mouse IgE mAbs | Thermo Fisher scientific | 11-5992-81 | keep at 2-8°C |
| Antiti-DNP-IgE | SIGMA | D8406-.2MG | keep at -20°C |
| Centrifuge | HANIL | 396150 | |
| D-(+)-gluouse | SIGMA | G8270 | |
| Dexamethasone | SIGMA | D2915-100MG | |
| DNP-BSA | Invitrogen | 2079360 | keep at -20°C |
| EDTA | Biofact | PB131-500 | |
| Fetal Bovine serum | Thermo Fisher scientific | 11455035 | |
| Gelatin | SIGMA | G1890 | |
| Glycine | JUNSEI | 27185-0350 | |
| hemocytometer | ZEISS | 176045 | |
| HEPES | Thermo Fisher scientific | 15630130 | |
| Histamine ELISA kit | Abcam | GK3275957-4 | keep at 2-8°C |
| Hotplate stirrer | Lab teach | zso-9001 | |
| Isoflurance | Troikaa | I29159 | |
| ketotifen fumarate salt | SIGMA | K2628 | |
| MCPT-1 ELISA kit | Thermo Fisher scientific | 88-7503-22 | keep at 2-8°C |
| Mouse Fc block | BD Biosciences | 553141 | keep at 2-8°C |
| Propidium iodiole | SIGMA | 81845 | keep at 2-8°C |
| RBC lysis buffer | Biolegend | 420301 | |
| Round-bottom 96 well | SPL-life sciences | 30096 | |
| Single use syringe filter | Startoriusag | 16555 | |
| Streptavidin microbeads | MilteryiBiotec | 130-048-101 | keep at 2-8°C |
| Triton X-100 | JUNSEIchemical | 49415-1601 | |
| TWEEN 20 | SIGMA | 9005-64-5 | |
| Water bath | CHANGSHINSCIENCE | 190107 |
Références
- Amin, K. The role of mast cells in allergic inflammation. Respiratory Medicine. 106 (1), 9-14 (2012).
- Holgate, S., et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. Journal of Allergy and Clinical Immunology. 115 (3), 459-465 (2005).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693 (2012).
- Roth, K., Chen, W. M., Lin, T. J. Positive and negative regulatory mechanisms in high-affinity IgE receptor-mediated mast cell activation. Archivum Immunologiae et Therapiae Experimentalis. 56 (6), 385-399 (2008).
- Finn, D., Walsh, J. Twenty-first century mast cell stabilizers. British Journal of Pharmacology. 170 (1), 23-37 (2013).
- Lu, Y., et al. Emodin, a naturally occurring anthraquinone derivative, suppresses IgE-mediated anaphylactic reaction and mast cell activation. Biochemical Pharmacology. 82 (11), 1700-1708 (2011).
- Demo, S., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry: The Journal of the International Society for Analytical Cytology. 36 (4), 340-348 (1999).
- Passante, E., Ehrhardt, C., Sheridan, H., Frankish, N. RBL-2H3 cells are an imprecise model for mast cell mediator release. Inflammation Research. 58 (9), 611-618 (2009).
- Fukuishi, N., et al. Does β-hexosaminidase function only as a degranulation indicator in mast cells? The primary role of β-hexosaminidase in mast cell granules. The Journal of Immunology. 193 (4), 1886-1894 (2014).
- Malbec, O., et al. Peritoneal cell-derived mast cells: an in vitro model of mature serosal-type mouse mast cells. The Journal of Immunology. 178 (10), 6465-6475 (2007).
- Arock, M., Le Nours, A., Malbec, O., Daëron, M. . Innate Immunity. , 241-254 (2008).
- Befus, A., Pearce, F., Gauldie, J., Horsewood, P., Bienenstock, J. Mucosal mast cells. I. Isolation and functional characteristics of rat intestinal mast cells. The Journal of Immunology. 128 (6), 2475-2480 (1982).
- Yoon, S. C., et al. Anti-allergic and anti-inflammatory effects of aqueous extract of Pogostemon cablin. International Journal of Molecular Medicien. 37 (1), 217-224 (2016).
- Mierke, C. T., et al. Human endothelial cells regulate survival and proliferation of human mast cells. Journal of Experimental Medicien. 192 (6), 801-812 (2000).
- Hermes, B., et al. Altered expression of mast cell chymase and tryptase and of c-Kit in human cutaneous scar tissue. Journal of Investigative Dermatology. 114 (1), 51-55 (2000).
- Wendeler, M., Sandhoff, K. J. Hexosaminidase assays. Glycoconjugate Journal. 26 (8), 945-952 (2009).
- Russell, M., et al. Learned histamine release. Science. 225 (4663), 733-734 (1984).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Kitamura, Y., et al. Dexamethasone suppresses histamine synthesis by repressing both transcription and activity of HDC in allergic rats. Allergology International. 55 (3), 279-286 (2006).
- Grant, S. M., Goa, K. L., Fitton, A., Sorkin, E. M. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorder. Drugs. 40 (3), 412-448 (1990).
- Cook, E., Stahl, J., Barney, N., Graziano, F. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Current Drug Targets-Inflammation & Allergy. 1 (2), 167-180 (2002).
- Schoch, C. In vitro inhibition of human conjunctival mast-cell degranulation by ketotifen. Journal of Ocular Pharmacology and Therapeutics. 19 (1), 75-81 (2003).
- Franchimont, D., et al. Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. The Journal of Immunology. 164 (4), 1768-1774 (2000).
- Simmons, C. P., et al. The clinical benefit of adjunctive dexamethasone in tuberculous meningitis is not associated with measurable attenuation of peripheral or local immune responses. The Journal of Immunology. 175 (1), 579-590 (2005).
- Cavalher-Machado, S. C., et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. International Immunopharmacology. 8 (11), 1552-1560 (2008).
- Dhakal, H., et al. Gomisin M2 inhibits mast cell-mediated allergic inflammation via attenuation of FcεRI-mediated Lyn and Fyn activation and intracellular calcium levels. Frontiers in Pharmacology. 10, 869 (2019).
- Galli, S. J., Wedemeyer, J., Tsai, M. Analyzing the roles of mast cells and basophils in host defense and other biological responses. International Journal of Hematology. 75 (4), 363-369 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon