Method Article
בדיקת גרנולציה של תאי תורן ex vivo באמצעות תאי הפרשה צפקית גולמיים וגירוי אנטיגן טבעי
* These authors contributed equally
In This Article
Summary
הקמנו בדיקת דה-גרנולציה של תאי פיטום ex vivo שבוצעה על ידי דגירה של תאי הפרשה צפקית גולמיים שבודדו מהעכברים, טופלו בחומר פרמקולוגי מעניין וניתנו IgE אנטי-דיניטרופנול (DNP) לפני כן, עם DNP על חלבון נשא.
Abstract
מייצבי תאי פיטום הם חלק חיוני בתרופות לאלרגיה. אנפילקסיס מערכתית פסיבית (PSA) היא בדיקה בבעלי חיים הנמצאת בשימוש נרחב לחקירת ההשפעה של חומר פרמקולוגי מעניין על תאי פיטום in vivo. מכיוון שהתסמינים האנפילקטיים מיוחסים בעיקר לאקסוציטוזיס של הגרגירים מתאי פיטום, נתפס כי לחומר הגורם לשיפור הסימפטומים יש פעילות מייצבת תאי פיטום. למרות העובדה, זה נבון לאשר את הפעילות על ידי הדגמה ישירה של הירידה בפעילות התפקודית של תאי פיטום לאחר הטיפול בו. בדיקות דה-גרנולציה במבחנה באמצעות קו תאי פיטום אימורטליים או תאי פיטום ראשוניים מתורבתים משמשים באופן שגרתי למטרה זו. התוצאות ממבחני in vitro ו-in vivo עשויות לא תמיד להיות דומות זו לזו; עם זאת, מכיוון שתנאי הטיפול (למשל, מינון טיפול, זמן, סביבות מסביב) עבור מבחני מבחנה נבדלים לרוב מאלה של מבחן in vivo כגון PSA. במרדף אחר מבחן in vitro (או ex vivo) כדי לשקף מקרוב יותר את ההשפעה של חומר פרמקולוגי על תאי פיטום in vivo, תכננו את בדיקת degranulation של תאי פיטום ex vivo שבה תאי הפרשה צפקית גולמיים (PECs) שבודדו מהעכברים, טופלו בחומר וניתנו IgE אנטי-דיניטרופנול (DNP), הודגרו ישירות עם DNP על חלבון נשא. התברר כי הבדיקה הייתה שימושית לא רק באימות הפעילות המייצבת של תאי פיטום של חומר פרמקולוגי שצוין על ידי הבדיקה in vivo, אלא גם מעשית וניתנת לשחזור מאוד.
Introduction
תאי פיטום ממלאים תפקיד מרכזי באלרגיה 1,2. כאשר IgE הממוקם על פני תאי פיטום באמצעות אינטראקציה עם הקולטן בעל הזיקה הגבוהה ל-IgE (FcεRI) נתקל באלרגן קוגנטי, נוצר מפל איתות כדי לזרז את שחרור הגרגירים. כתוצאה מכך, מגוון מולקולות אפקטור אלרגיה, כולל מונואמינים (למשל, היסטמין, סרוטונין), ציטוקינים (למשל, TNF-α) ואנזימים פרוטאוליטיים (למשל, טריפטאז, כימז), משתחררים כדי לגרום לסדרה של תגובות אימונולוגיות, נוירולוגיות וכלי דם 3,4.
סוג של תרופות נקרא מייצב תאי פיטום המקל על תסמיני האלרגיה על ידי החלשת תפקוד תאי הפיטום5. אנפילקסיס מערכתית פסיבית (PSA) היא מודל של בעלי חיים המשמש לעתים קרובות לבדיקת פעילות מייצבת של תאי פיטום של חומרים פרמקולוגיים. מכיוון שהתסמינים האנפילקטיים נובעים בעיקר מהפעלת תאי פיטום בעקבות אינטראקציה של IgE ספציפי להפטן המועבר באופן פסיבי עם הפטן על חלבון נשא המוזרק לבעל החיים מאוחר יותר, מקובל היטב כי חומר פרמקולוגי מעניין נושא פעילות מייצבת של תאי פיטום כאשר הטיפול בו מביא לשיפור הסימפטומים6. ובכל זאת, לעתים קרובות הכרחי להדגים ישירות פגיעה בתפקוד תאי הפיטום על ידי הסוכן בניסוי נפרד כדי לשלול את האפשרות ששיפור הסימפטומים נובע ממנגנון אחר מלבד דיכוי תפקוד תאי הפיטום.
בדיקת דה-גרנולציה של תאי פיטום, המתבצעת על ידי גירוי תאי פיטום עם מגיב כימי או אנטיגן ספציפי של IgE היוצר קומפלקס עם FcεRI על פני תאי פיטום כדי לגרום לאקסוציטוזיס של גרגירי הפרשה (כלומר, דה-גרנולציה), משמשת בדרך כלל לקביעת פעילות מייצבת של תאי פיטום של מגיב פרמקולוגי במבחנה7. בבדיקה זו נעשה שימוש במספר סוגים של תאים,כולל קו התאים 8 של לוקמיה בזופילית של חולדות (RBL), תאי פיטום שמקורם במח עצם (BMMC)9 ותאי פיטום שמקורם בתאי צפק10. בעוד שהוא שימושי מכיוון שניתן להשיג בקלות מספר רב של תאים, RBL הוא קו תאי סרטן אימורטליזציה שתכונותיו התאיות כבר אינן דומות לאלו של תאי פיטום בגוף. רכישת מספר מספיק של BMMC או PCMC, למרות שתכונותיהם התאיות עשויות להיות דומות יותר לאלו של תאי פיטום בגוף, היא לעתים קרובות יקרה וגוזלת זמן.
בדיקת דה-גרנולציה באמצעות תאי פיטום ראשוניים מטוהרים היא חלופה רצויה11. עם זאת, השימוש בבדיקה כזו אינו נפוץ כשיטה קלה לטיהור תאי פיטום מרקמות בעלי חיים, במיוחד מרקמת עכבר, עם תפוקה גבוהה, והטוהר עדיין אינו זמין. יתרה מכך, מכיוון שהריכוז ומשך הטיפול בחומר תרופתי לעיכוב תפקוד תאי הפיטום במבחנה לא תמיד חופפים לאלה in vivo, התוצאות המתקבלות עם בדיקת דה-גרנולציה במבחנה עלולות להציג באופן שגוי את אלה מבדיקת in vivo כגון PSA, ולהיפך. לפיכך, בדיקת דה-גרנולציה חדשנית, לא רק מחקה מקרוב את אופן הפעלת תאי הפיטום המתרחשת in vivo אלא גם משקפת במדויק את ההשפעות של מגיב פרמקולוגי המופעל על תאי פיטום in vivo, מבוקשת מאוד. על מנת לענות על צרכים אלה, תכננו בדיקת דה-גרנולציה של תאי פיטום ex vivo שבה תאי פיטום בתאי הפרשה צפקית (PECs) שבודדו מהעכברים, טופלו בחומר פרמקולוגי מעניין וניתנו IgE ספציפי לדיניטרופנול (DNP) לפני כן, מגורים עם אלבומין בסרום בקר מצומד DNP (BSA).
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם להנחיות שסופקו על ידי IACUC (הוועדה המוסדית לטיפול ושימוש בבעלי חיים) של האוניברסיטה הלאומית של צ'ונגנאם (מספר פרוטוקול בעלי חיים: CNU-00996).
1. כימות מולקולות ספציפיות לתאי פיטום בליזאט של PECs גולמיים
- בודד את התאים מחלל הצפק של העכבר12.
- להרדים עכבר (בן 8 שבועות, זכר, BALB/C) עם איזופלורן. המתת חסד באמצעות פריקת צוואר הרחם.
- הנח את העכבר על גוש קצף. נגב את הבטן עם 70% אתנול.
- חותכים את עור הגחון לאורך בעזרת מספריים קהים. מקלפים את עור העכבר בעזרת מלקחיים ומספריים.
- הזרקו 6 מ"ל של מאגר B13 קר כקרח לחלל הצפק באמצעות מזרק של 10 מ"ל עם מחט 26 גרם. הכנס את המחט בעדינות כדי למנוע דקירה של איברים כלשהם.
- עסו את בטן העכבר במשך 60-90 שניות כדי לאסוף תאי צפק לתוך מאגר B של Tyrode. עשה זאת בעדינות כדי לא לפגוע בכלי הדם.
- הכנס את המחט (20 גרם) המחוברת לשיפוע מזרק של 10 מ"ל כלפי מעלה. שאפו את הנוזל לאט מחלל הצפק (בדרך כלל 5-6 מ"ל).
- הסר את המחט מהמזרק. הוציאו את נוזל הצפק לצינור חרוטי של 50 מ"ל. שמור את הצינור על קרח.
- חזור על שלבים 1.1.4 - 1.1.7.
- צנטריפוגה את הצינור ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס. השעו מחדש את התאים ב-1 מ"ל של מאגר ליזה של תאי דם אדומים (RBC). שמור את התאים על קרח למשך 3 דקות.
- יש לדלל את תרחיף התאים עם 2 מ"ל של מאגר B של Tyrode. צנטריפוגה את הצינור ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס.
- הסר את ה-supernatant. השעו מחדש את התאים ב-0.5 מ"ל של מאגר A13 של Tyrode.
- ספרו את התאים בעזרת המוציטומטר. התאם את מספר התא ל-5 x 106/mL עם מאגר A של Tyrode.
- הכן PECs מדוללי תאי פיטום באמצעות מערכת טיהור תאים מגנטיים14.
- צנטריפוגה 5 x 105 PECs גולמיים ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס. השעו מחדש את הגלולה ב-200 מיקרוליטר של מאגר טיהור תאים PBSBE (0.5% BSA, 2 מ"מ EDTA, 1 x PBS, pH 7.4).
- הוסף 1 מיקרוליטר של חוסם Fc (0.5 מ"ג/מ"ל) לתאים כדי למנוע קשירה לא ספציפית של נוגדן חד שבטי נגד c-kit (mAb) שיתווסף לאחר מכן. שמור את התאים על קרח למשך 5 דקות.
- הוסף 1 מיקרוליטר של ערכת c נגד עכבר ביוטיניל mAb15 (0.5 מ"ג/מ"ל). שמור את התאים על קרח למשך 10 דקות.
- הוסף 2 מ"ל של מאגר PBSBE. צנטריפוגה את התאים ב-300 x גרם למשך 10 דקות ב-10 מעלות צלזיוס.
- הסר את ה-supernatant. שוטפים את התאים שוב עם 2 מ"ל של מאגר PBSBE.
- השעו מחדש את התאים ב-90 מיקרוליטר של מאגר PBSBE. הוסף 10 מיקרוליטר של מיקרו-חרוזים מצומדים לסטרפטווידין. שמור את התאים על קרח למשך 15 דקות.
- הוסף 2 מ"ל של מאגר PBSBE. צנטריפוגה את התאים ב-300 x גרם למשך 10 דקות ב-10 מעלות צלזיוס.
- טען 500 מיקרוליטר של מאגר PBSBE על עמוד מגנטי בינוני במהלך הסיבוב. אפשר למאגר לזרום דרך העמודה.
- הסר את הסופרנטנט לאחר הצנטריפוגה. השעו מחדש את התאים ב-500 מיקרוליטר של מאגר PBSBE.
- טען את התאים בעמודה. אסוף את התאים העוברים בחופשיות דרך העמודה.
- שטפו את העמוד עם 500 מיקרוליטר של מאגר PBSBE. אסוף שוב את התאים העוברים דרך העמודה.
- חזור על שלב 1.2.11.
- שלב את התאים משלבים 1.2.9-1.2.11 בצינור אחד. צנטריפוגה את התאים ב-300 x גרם למשך 10 דקות ב-10 מעלות צלזיוס.
- השעו מחדש את התאים במאגר A של טירוד. ספור את התאים. התאם את מספר התא ל- 5 x 106 תאים/מ"ל.
- הכן את הליזאט של PECs.
- צלחת PECs (למשל, 5 x 105) בצלחת עגולה תחתונה 96 בארות, בהתאמה. צנטריפוגה את הצלחת ב-300 x גרם למשך 2 דקות ב-10 מעלות צלזיוס כדי לאסוף את התאים. הסר את הסופרנטנט בזהירות בעזרת פיפטה.
- הוסף 100 מיקרוליטר של מאגר ליזה תאים לגלולת התא. השעו מחדש את התאים על ידי פיפטינג למעלה ולמטה מספר פעמים בעדינות. שמור את הצלחת על קרח למשך 60 דקות.
- צנטריפוגה את הצלחת ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס כדי להסיר פסולת תאים. העבירו את הסופרנטנט (ליזאט התא) לצלחת חדשה של 96 בארות.
- למדוד את הפעילות האנזימטית של β-הקסוזמינידאז16.
- הוסף את ליזאט התא (50 מיקרוליטר) לתמיסת מצע β-הקסוזמינידאז שחוממה מראש (50 מיקרוליטר) במיקרופלטה של 96 בארות. מערבבים אותם בעדינות עם פיפטה.
- דגרו את הצלחת בחממה של 37 מעלות צלזיוס. הוסף 50 מיקרוליטר של תמיסת עצירה (100 מ"מ גליצין, pH 10.7) לאחר 30 דקות כדי לסיים את תגובת האנזים.
- קרא OD של תערובות התגובה עם קורא מיקרו-פלטות ספיגה גלוי UV בהגדרת אורך גל כפול; 405 ננומטר לקביעת רמת תגובת האנזים ו-620 ננומטר לחיסור רקע אוטומטי, בהתאמה.
- מדוד את ריכוז ההיסטמין17.
- העבר 100 מיקרוליטר של התא המנוקה ללוח המצופה mAb אנטי-היסטמין המסופק עם ערכת ELISA של היסטמין. בצע בדיקת ELISA היסטמין תחרותית בהתאם למדריך היצרן.
- קרא OD של הדגימות עם קורא מיקרו-פלטות ספיגה גלוי UV באורך גל של 450 ננומטר.
- קבע את היחס בין תאי פיטום ב-PECs עם ציטומטריית זרימה18.
- העבר 1 x 105 PECs גולמיים או מדוללי תאי תורן בצלחת תחתונה עגולה של 96 בארות. צנטריפוגה את הצלחת ב-300 x גרם למשך 2 דקות ב-10 מעלות צלזיוס.
- השעו מחדש את התאים ב-50 מיקרוליטר של מאגר FACS. הוסף 1 מיקרוליטר של ערכת C נגד עכבר (0.5 מ"ג/מ"ל) ו-IgE mAbs נגד עכבר (0.5 מ"ג/מ"ל).
- מערבולת התאים בקצרה. שמור את התאים על קרח למשך 20 דקות בחושך.
- מלאו את הבארות ב-150 מיקרוליטר של מאגר FACS. צנטריפוגה את הצלחת ב-300 x גרם למשך 2 דקות ב-10 מעלות צלזיוס. השליכו את המאגר על ידי היפוך מהיר של הצלחת.
- השעו מחדש את התאים עם 150 מיקרוליטר של מאגר FACS המכיל פרופידיום יודיד (1 מיקרוגרם/מ"ל). נתח את התאים בעזרת ציטומטר זרימה.
2. בדיקת פירוט תאי פיטום באמצעות PECs גולמיים
- קבע את מידת פירוק תאי הפיטום (% דה-גרנולציה).
- יש להזריק 3 עכברי BALB/C (בני 8 שבועות, זכר) תוך ורידי (i.v.) עם 3 מיקרוגרם של anti-DNP mAb (IgE של עכבר). יש לבודד PECs יום אחד לאחר הזרקת Ab (עיין בשלב 1.1).
- צלחת 90 מיקרוליטר של PECs גולמיים (5.5 x 106/מ"ל) בצלחת שטוחה של 96 בארות (סה"כ 4 בארות). דגרו את הצלחת בחממת CO2 לחה של 37 מעלות צלזיוסלמשך 30 דקות.
- הוסף 10 מיקרוליטר של DNP-BSA (5 ננוגרם/מ"ל ב-1x PBS) לבארות המכילות PECs. דגרו את הצלחת למשך 10 דקות בחממת CO2 של 37 מעלות צלזיוס.
- צנטריפוגה את הצלחת ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס מיד לאחר הדגירה. קח את הסופרנטנטים (100 מיקרוליטר) בזהירות עם פיפטה. שמור אותם בצלחת חדשה עם 96 בארות על קרח.
- הוסף 100 מיקרוליטר של מאגר ליזיס תאים (0.1% Triton X-100 ב-1 x PBS, pH 7.4) לבארות המיקרופלייט המכילות PECs. שמור את הצלחת על קרח למשך 60 דקות.
- בצע את בדיקת β-hexosaminidase.
- קח שתי קבוצות של הסופרנטנטים והליזטים התאים המתאימים, בהתאמה, מתוך ארבעה שאוחסנו בקרח לאחר בדיקת הדה-גרנולציה (עיין בשלבים 2.1.4 ו-2.1.5). פצל את הסופרנטנט ואת התא ליזאט לשתי בארות נפרדות (50 מיקרוליטר כל אחת) לשכפול הבדיקה.
- הוסף 50 מיקרוליטר של תמיסת מצע β-הקסוזמינידאז לכל באר. דגרו את הצלחת בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות. הוסף לתערובת התגובה 50 מיקרוליטר של תמיסת עצירה (100 מ"מ גליצין, pH 10.7).
- קרא OD של תערובות התגובה (עיין בשלב 1.4.3). חשב את מידת פירוט תאי הפיטום באופן הבא.
% דה-גרנולציה =OD supernatant /(OD supernatant + ODlysate) X 100%
- בצע את בדיקת ההיסטמין.
- הוסף 100 מיקרוליטר של 1x PBS לשתי בארות נוספות של הסופרנטנטים וליזטים התאים המתאימים שנשמרו לאחר הדה-גרנולציה כדי להביא את הנפח הכולל של הדגימות ל-200 מיקרוליטר. חלקו כל דגימה לשתי בארות נפרדות בצלחת היסטמין ELISA המסופקת עם ערכת ELISA של היסטמין.
- בצע את בדיקת ELISA בהתאם למדריך היצרן. קרא OD של הדגימות עם קורא מיקרו-פלטות ספיגה גלוי UV באורך גל של 450 ננומטר. חשב את מידת הגרנולציה כמו ב- 2.1.6.3.
% דה-גרנולציה = [היסטמין]סאפ /([היסטמין]סאפ + [היסטמין]ליזאט) X 100%
- להעריך את ההשפעות של תרופות נגד אלרגיה על תאי פיטום המופעלים in vivo עם בדיקת פירנולציה של תאי פיטום ex vivo.
- מתן דרך הפה (p.o.) 200 מיקרוליטר של דקסמתזון19 (DEX) וקטוטיפן20 (KET), בהתאמה, לעכברים (בני 6 שבועות, זכר) פעם ביום למשך 3 ימים (6 עכברים / קבוצה).
- יש להזריק לעכברים דרך הווריד (i.v.) 3 מיקרוגרם של anti-DNP IgE לאחר הטיפולהשלישי . חלקו כל קבוצת עכברים לשני כלובים נפרדים (3 עכברים/כלוב); האחד לבדיקת PSA והשני לבדיקת גרנולציה של תאי פיטום ex vivo.
- בצע בדיקת PSA
- הזרקו לעכברים DNP-BSA (80 מיקרוגרם) יום אחד לאחר הזרקת anti-DNP IgE. מדוד את טמפרטורת הגוף עם מדחום רקטלי כל 15 דקות למשך שעה החל מיד לאחר הזרקת DNP-BSA.
- קח את הדם יום לאחר הזרקת DNP-BSA. מדוד את רמות MCPT-1 בסרום עם ELISA.
- בצע בדיקת פירוט תאי פיטום ex vivo.
- בודד PECs מהעכברים יום לאחר הזרקת anti-DNP IgE. ספרו את המספרים של PECs מבודדים.
- צלחת 90 מיקרוליטר של PECs גולמיים (5.5 x 106/מ"ל) בצלחת של 96 בארות (4 בארות לעכבר). דגרו את הצלחות בחממת CO2 לחה של 37 מעלות צלזיוס למשך 30 דקות.
- הוסף 10 מיקרוליטר של DNP-BSA (5 ננוגרם/מ"ל). דגרו את הצלחת למשך 10 דקות בחממת CO2 לחה של 37 מעלות צלזיוס.
- צנטריפוגה את הצלחת ב-300 x גרם למשך 5 דקות ב-10 מעלות צלזיוס. קחו את הסופרנטנטים (100 מיקרוליטר) בזהירות, והשאירו את התאים מאחור בבארות.
- הוסף 100 מיקרוליטר של מאגר ליזה תאים לבארות. דגרו את הצלחת על קרח למשך 60 דקות.
- בצע בדיקת β-hexosaminidase ובדיקת היסטמין ELISA כמתואר ב-2.1.6 ו-2.1.7. חשב % דה-גרנולציה כמו בשלב 2.1.6.3.
תוצאות
קביעת המספר האופטימלי של PECs לבדיקת פירוט תאי פיטום ex vivo
תאי פיטום (c-kit+· תאים חיוביים כפולים IgE+ 15 מייצגים רק כ-2% מה-PECs (איור 1A). הערכנו את הרמות המקסימליות של מולקולות ספציפיות לתאי פיטום שיזוהו בתרבית העל בהנחה ש-100% מהגרגירים שוחררו על ידי תאי פיטום ב-PECs, מדדנו את הכמויות של β-הקסוזמינידאז16 והיסטמין17 בסך הליזטים של התאים שהוכנו עם מספרים שונים של PECs: 2.5 x 105, 5 x 105 ו-1 x 106 PEC, בהתאמה. כפי שמוצג באיור 1B, רמות משמעותיות של β-הקסוזמינידאז והיסטמין זוהו גם כאשר הליזאט הוכן עם 2.5 x 105 PECs, ורמותיהם עלו באופן יחסי ככל שמספר ה-PECs המשמשים להכנת הליזאט של התא גדל.
בהתחשב בתוצאות אלה, החלטנו להשתמש ב-5 x 105 PECs בבדיקת דה-גרנולציה של תאי פיטום ex vivo מהסיבות הבאות. בהתחשב בכך שרק קצת יותר מ-3 x 106 PECs בודדו מעכבר אחד (בן 8 שבועות) ושהם היו אמורים להיות מצופים באופן שווה ב-4 בארות נפרדות במיקרו-פלטה של 96 בארות (2 בארות עבור β-הקסוזמינידאז ועוד שתי בארות לבדיקות היסטמין, בהתאמה), ציפוי של 1 x 106 PECs לבאר יגרום ככל הנראה למחסור בתאים. בנוסף, התוצאות המוצגות לעיל הצביעו על כך שמספר מספיק של תאי פיטום היה ב-5 x 105 PECs גולמיים לביצוע בדיקת הדה-גרנולציה. כלומר, על פי תוצאות אלה, היה צפוי שגם במקרה שרק כ-30 עד 40% מהגרגירים שוחררו על ידי תאי פיטום, רמות β-הקסוזמינידאז והיסטמין שזוהו בסופרנטנטים של התרבית לאחר בדיקת הדגרנולציה יהיו גבוהות מספיק כדי לכמת אותן במדויק.
לאחר מכן, ניסינו לאשר כי β-הקסוזמינידאז והיסטמין שזוהו בליזטים של PECs נגזרו אך ורק מתאי פיטום ב-PECs. כדי לעשות זאת, רוקנו תאי פיטום מ-PECs באמצעות עמודת טיהור תאים מגנטיים (ראו שלב 1.2). כצפוי, PECs לא מסומנים שעפו דרך העמודה היו נטולי תאי פיטום לחלוטין (איור 1C). כמו כן, כצפוי, לא זוהו β-הקסוזמינידאז ולא היסטמין בליזאט התא שהוכן עם PECs מדוללי תאי פיטום (איור 1D).
בדיקת פירוט תאי פיטום Ex vivo באמצעות PECs גולמיים
לאחר מכן בחנו את הרמות האמיתיות של β-הקסוזמינידאז והיסטמין המשתחררים על ידי תאי פיטום ב-PECs במהלך תרבית עם אנטיגן ספציפי של IgE על פני השטח שלהם. כדי לעשות זאת, בודדנו PECs מהעכברים שהוזרקו להם אנטי-DNP-IgE ותרבית אותם (5 x 105) עם DNP-BSA (0.5 ננוגרם/מ"ל). כפי שמוצג באיור 2A, רמה משמעותית של β-הקסוזמינידאז החלה להתגלות בתרבית תוך 5 דקות מהתרבית וגדלה בהתמדה ככל שתקופת התרבית התארכה. עם זאת, קצב הגידול הצטמצם במהירות לאחר 10 דקות של תרבית, והיקף הדגרנולציה הגיע בהדרגה לרמה בסביבות 50% לאחר 30 עד 40 דקות. תוצאות דומות התקבלו גם כאשר נבדקו רמות ההיסטמין ששוחררו על ידי תאי פיטום במהלך התרבית (איור 2B). בהתבסס על תוצאות אלה, החלטנו לתרבית PECs עם DNP-BSA למשך 10 דקות במבחנים הבאים.
אימות ההשפעות in vivo של KET ו-DEX על תאי פיטום באמצעות בדיקת degranulation ex vivo.
קטוטיפן (KET) היא תרופה לאלרגיה עם פעילות אנטי-היסטמינרגית. עם זאת, בשונה מאנטיהיסטמינים קונבנציונליים אחרים, הוא ידוע כאנטיהיסטמין בעל פעולה כפולה שיש לו גם פעילות מייצבת תאי פיטום בנוסף לפעילות האנטי-היסטמינרגית. הפעילות המייצבת של תאי פיטום של KET נחקרה 21,22; עם זאת, בעיקר מחקרי מבחנה והמחקרים המראים כיצד יש לו השפעה על תאי פיטום in vivo הם נדירים. דקסמתזון (DEX) הוא סוג נוסף של תרופות לאלרגיה23. ידוע כי DEX פוגע בפעילות התפקודית של סוגים שונים של תאי חיסון כדי לדכא ספקטרום רחב של תגובות חיסוניות24. כדי לאמת את ההשפעה של KET ו-DEX על הפעילות של תאי פיטום in vivo, היינו אמורים לבצע את בדיקת הדה-גרנולציה של תאי פיטום ex vivo עם PECs שבודדו מהעכברים שטופלו בכל אחד מהם.
לפני בדיקת הדגרנולציה של תאי פיטום ex vivo, בחנו לראשונה את ההשפעות של DEX ו-KET על תגובות אנפילקטיות הנובעות מ-IgE ו-DNP-BSA ספציפיים ל-DNP שהועברו באופן פסיבי במודל PSA. כצפוי, טיפול ב-KET או ב-DEX הביא לשיפור בתסמינים אנפילקטיים באופן תלוי מינון (איור משלים 1), מה שמצביע על כך שהפעילות התפקודית של תאי פיטום נפגעה על ידי הטיפולים שלהם.
בחנו גם את מספר ה-PECs שבודדו מהעכברים שטופלו בתרכובות כלשהן, ואת היחס בין תאי הפיטום ב-PECs (איור 3A). טיפולים ב-KET, ללא קשר למינונים ששימשו בטיפולים, לא הביאו לשינוי ניכר במספר ה-PECS שבודדו מהעכברים. לעומת זאת, מספר ה-PECs שבודדו מהעכברים שטופלו ב-DEX ירד משמעותית כאשר טופלו במינון של 4.5 מ"ג/ק"ג, מה שמצביע על כך שלטיפול ב-DEX הייתה השפעה על הכדאיות של תאי הצפק. עם זאת, יש לציין כי היחס בין תאי הפיטום נשאר קבוע בסביבות 2% ללא קשר לתרופות ולמינונים ששימשו לטיפול (איור 3A). בחנו גם את ההשפעות של DEX ו-KET על רמות β-הקסוזמינידאז והיסטמין המתבטאות על ידי תאי פיטום בחלל הצפק על ידי מדידת כמויות שלהם בסך הליזטים של התאים שהוכנו עם אותם מספרים של PECs גולמיים (איור 3B). יש לציין כי הרמות של β-הקסוזמינידאז והיסטמין נמצאו מוגברות לאחר טיפול ב-DEX במינון של 4.5 מ"ג/ק"ג. טיפולי KET הביאו לשינוי מועט ברמות אלה.
לאחר מכן, ביצענו את בדיקת הדגרנולציה של תאי פיטום ex vivo (איור 4). ראשית, התאמנו את צפיפות התאים של PECs באופן שווה ל-5.5 x 106 תאים/מ"ל כדי להבטיח שנעשה שימוש באותו מספר של תאי פיטום בבדיקה. לאחר מכן צופו PECs (90 מיקרוליטר) במיקרו-פלטה של 96 בארות והודגרו עם DNP-BSA למשך 10 דקות. כאשר PECs מהעכברים שטופלו במינון גבוה של DEX או KET הודגרו עם DNP-BSA, נמצא כי רמות ה-β-hexosaminidase והיסטמין שזוהו בסופרנטנטים בתרבית היו נמוכות באופן משמעותי בהשוואה לאלו שזוהו לאחר הדגירה של PECs מעכברים שטופלו בדמה עם DNP-BSA (איור 4). מתאם הפוך ניכר גם בין רמות המולקולות שזוהו בתרבית העל לבין מינוני DEX ו-KET המשמשים לטיפול בעכברים. לפיכך, ככל שהמינון ששימש לטיפול היה גבוה יותר, כך רמות β-הקסוזמינידאז והיסטמין שזוהו בתרבית לאחר הדגירה היו נמוכות יותר.
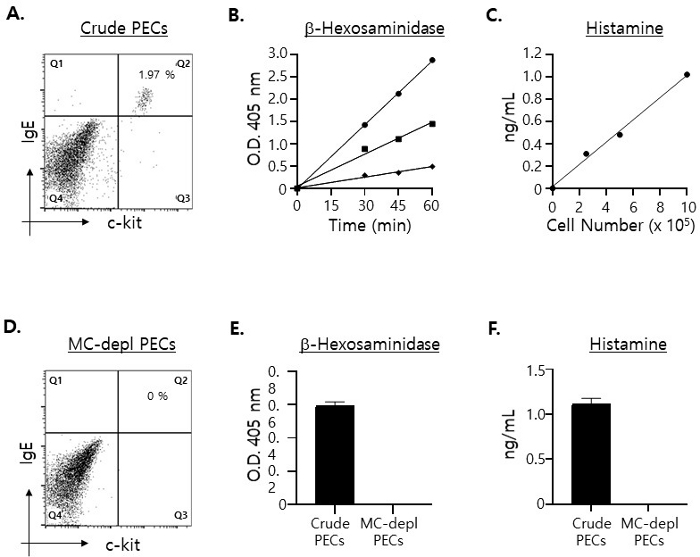
איור 1: כימות רמות המולקולות הספציפיות לתאי פיטום הכלולות על ידי הליזטים שהוכנו עם מספרים שונים של PECs.
(A) PECs הוכתמו ב-c-kit נגד עכבר עם תווית FITC בתוספת IgE mAbs נגד עכברים עם תווית PE ונותחו עם ציטומטריית זרימה. תאי פיטום (כלומר, c-kit+· תאים חיוביים כפולים IgE+ ) מוצגים ברביע הימני העליון. (B) ליזטים של תאים הוכנו עם 1 x 106 (עיגול), 5 x 105 (ריבוע) ו-2.5 x 105 (יהלום), בהתאמה, ומחצית מכלל הליזטים הודגרו עם המצע של β-הקסוזמינידאז למשך פרק זמן כפי שצוין. היקף שינויי הצבע על ידי תגובת האנזים נמדד עם קורא מיקרו-פלטות 96 בארות באורך גל של 405 ננומטר. הבדיקות נערכו בכפולות. (C) ליזטים של תאים הוכנו כמו ב-(B) וריכוזי ההיסטמין בליזטים נמדדו עם ELISA. (D) PECs מדוללי תאי פיטום הוכתמו ב-mAbs כמו ב-(A). (E) ליזטים של תאים הוכנו עם 5 x 105 PECs גולמיים (מוט מלא) ומדולדל תאי תורן (מוט פתוח), בהתאמה, והודגרו עם מצע β-הקסוזמינידאז למשך 30 דקות לפני סיום התגובות. (F) ריכוזי ההיסטמין בליזאטים של התאים שהוכנו כמו ב-(E) נמדדו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מדידת כמויות המולקולות הספציפיות לתאי פיטום שמשתחררות על ידי תאי פיטום במהלך תרבית של PECs עם DNP-BSA.
PECs (5 x 105) שבודדו מהעכברים שהוזרקו עם anti-DNP IgE (מעגל) או עם 1 x PBS (משולש) בלבד תורבו עם DNP-BSA לפרק זמן כפי שצוין. רמות ה-β-hexosaminidase (A, משמאל) והיסטמין (B, משמאל) שזוהו בסופרנטנטים בכל נקודת זמן תווו. היקפי הדגרנולציה חושבו עם כמויות β-הקסוזמינידאז (A, מימין) והיסטמין (B, מימין) ששוחררו לסופרנטנטים ונשארו בתוך התאים (ליזאט התא), בהתאמה. המשוואה הבאה שימשה לחישוב מידת הדגרנולציה (%). דה-גרנולציה (%) = [X]sup /([X]sup + [X]lysate) X 100 אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
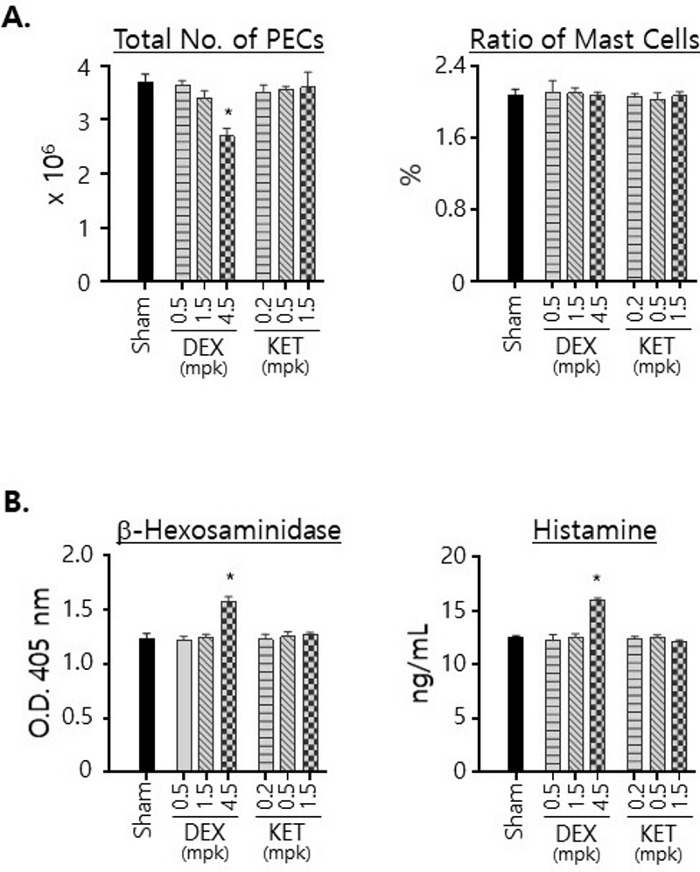
איור 3: ההשפעות של DEX ו-KET על הכדאיות של תאי פיטום בחלל הצפק ועל רמות ביטויי b-hexosaminidase והיסטמין.
(A) PECs בודדו מהעכברים שטופלו ב-p.o. במשך 3 ימים עם רכב בלבד (דמה) או עם מינונים מסומנים של DEX או KET. מספרי התאים הכוללים נספרו באמצעות המוציטומטר והמספרים הממוצעים חושבו ושורטטו יחד עם סטיות תקן (משמאל). PECs הוכתמו ב-anti-c-kit עם תווית FITC בתוספת mAbs נגד IgE עם תווית PE ונותחו עם ציטומטריית זרימה. היחסים בין התאים החיוביים הכפולים (כלומר, תאי פיטום) לסך ה-PECs שורטטו (מימין). (B) PECs בודדו כמו ב-(A), וליזטים של תאים הוכנו עם אותו מספר (5 x 105) של PECs. כמויות β-הקסוזמינידאז (משמאל) והיסטמין (מימין) בליזטים אלה נמדדו ושורטטו. כל הניסויים בוצעו עם 3 עכברים בקבוצה. מובהקות סטטיסטית חושבו באמצעות אנובה חד-כיוונית; * עמ ' < 0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: בדיקת דה-גרנולציה של תאי פיטום ex vivo באמצעות PECs גולמיים שבודדו מהעכברים שטופלו ב-DEX או KET.
PECs בודדו מהעכברים שטופלו ב-p.o. במשך 3 ימים עם רכב בלבד (נאיבי ומזויף) או עם מינונים מסומנים של DEX או KET ולאחר מכן הוזרקו ל-i.v. PBS (נאיבי) או אנטי-DNP-IgE. לאחר מכן הם הודגרו עם DNP-BSA למשך 10 דקות, והיקפי הדגרנולציה חושבו על סמך רמות β-הקסוזמינידאז (A) והיסטמין (B), בהתאמה, ששוחררו לתרבית. כל הניסויים בוצעו עם 3 עכברים בקבוצה. מובהקות סטטיסטית חושבו באמצעות אנובה חד-כיוונית; * עמ ' < 0.05. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מאגר | מתכון | הערות/תיאור | |
| 0.1 מ' מאגר Na-ציטראט | 45.6 מ"מ נתרן ציטראט דיהידרט, 54.4 מ"מ חומצת לימון, pH 4.5 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס | |
| מאגר ליזה 10x RBC | 80 מ"ג/מ"ל NH4Cl, 8.4 מ"ג/מ"ל NaHCO3, 3.7 מ"ג/מ"ל EDTA (דיסודיום) | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס, אין לחרוג משישה חודשים | |
| מאגר ליזה תאים | 0.1% טריטון X-100, 1 x תמיסת מלח עם חוצץ פוספט (PBS) pH 7.4 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס | |
| פתרון עצירת ELISA | 100 מ"מ גליצין, pH 10.7 | אחסון בטמפרטורה רגילה | |
| מאגר FACS | 1 x PBS, 5% סרום סוסים, 1% BSA, 10 מ"מ HEPES, 2 מ"מ EDTA, pH 7.2 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס, אין לחרוג מחודשיים | |
| מאגר PBSBE (מאגר טיהור תאי MACS ) | 1x PBS, 0.5% BSA, 2 מ"מ EDTA, pH 7.2 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס, אין לחרוג מחודשיים | |
| חוצץ A של טירוד | 10 מ"מ HEPES, 130 מ"מ NaCl, 5.6 מ"מ גלוקוז, 5 מ"מ KCl, 1 מ"מ MgCl2, 1.4 מ"מ CaCl2, 1% אלבומין בסרום בקר (BSA) pH 7.4 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס, אין לחרוג מחודשיים | |
| מאגר B של טירוד | 137 מ"מ NaCl, 5.6 מ"מ גלוקוז, 12 מ"מ NaHCO 3,2.7 מ"מ KCl, 0.3 מ"מ NaH2PO4, 1 מ"מ MgCl2, 1.8 מ"מ CaCl2, 0.1% ג'לטין, pH 7.4 | יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס, אין לחרוג מחודשיים | |
טבלה 1: קומפוזיציות חיץ.
איור משלים 1: ההשפעות של DEX ו-KET על התגובות האנפילקטיות הנגרמות על ידי העברה פסיבית של אנטי-DNP-IgE ו-DNP-BSA. עכברים, שטופלו (p.o.) מדי יום במשך 3 ימים ברכב בלבד (נאיבי, מזויף) או במינונים מסומנים של DEX או KET, קיבלו (i.v.) PBS (נאיבי) או anti-DNP-IgE mAb. יום לאחר הזרקת הנוגדנים, העכברים הוזרקו (i.v.) עם PBS (נאיבי) או עם DNP-BSA. טמפרטורות הגוף של העכברים שנמדדו 30 דקות לאחר הזרקת DNP-BSA תווו (A). יום אחד לאחר הזרקת DNP-BSA, הדם נלקח מהעכברים ורמות MCPT-1 נמדדו באמצעות ELISA (B). הניסוי בוצע עם 3 עכברים בקבוצה. מובהקות סטטיסטית חושבו באמצעות ANOVA חד-כיווני; * עמ' < 0.05. אנא לחץ כאן להורדת איור זה.
Discussion
הממצא כי ניתן לבצע בדיקת דה-גרנולציה של תאי פיטום עם מספר קטן יחסית של PECs עכברים גולמיים הוא משמעותי. למרות ש-PECs חייבים להיות מקור מצוין לתאי פיטום ראשוניים של עכברים, הם דורשים לטהר תאי פיטום ב-PEC. למרות שאמצעי שיפוע צפיפות כמו Percoll25 שימש בהצלחה לטיהור תאי פיטום מ-PECs של חולדות, השימוש בו לטיהור תאי פיטום צפקי של עכברים הוגבל ככל הנראה בגלל ההבדל בצפיפות של תאי פיטום של חולדות ועכברים. מדיום שיפוע נוסף כמו היסטודנז26 שימש לטיהור תאי פיטום פריטונאליים של עכברים בהצלחה מוגבלת; תוצאת הטיהור נראתה תלויה בתנאים של עכברים (למשל, גיל). אפילו מערכת בידוד תאים חדשה כמו מערכת טיהור תאים מגנטיים הובילה לטיהור חלקי בלבד של תאי פיטום של עכברים (נתונים שלא פורסמו על ידי המחברים). אנו מראים כאן כי טיהור תאי פיטום צפקי אינו הכרחי לבדיקת דה-גרנולציה של תאי פיטום.
התוצאה שתאי פיטום ב-PECs גולמיים יכולים להיות מופעלים על ידי אנטיגן קוגנטי של IgE מעודדת במרדף אחר מבחן ex vivo כדי לחקות נאמנה את אירוע הדגרנולציה המתרחש in vivo. עם זאת, בנוסף לתאי פיטום, בזופילים מבטאים גם FcεRI27. לפיכך, אזהרה אחת כאן היא שמספר קטן של בזופילים ב-PECs עשוי גם לתרום לעלייה בריכוז ההיסטמין בתרבית העל-טבעית במהלך הבדיקה. עם זאת, נראה לא סביר, מכיוון שלא זוהתה רמה מדידה של היסטמין בתרבית העל כאשר נעשה שימוש ב-PECs מדוללים מתאים המבטאים c-kit (כלומר, תאי פיטום) בבדיקה. תוצאות אלה הבטיחו שתאי פיטום היו אחראים לחלוטין לשחרור היסטמין שזוהה בתרבית לאחר תרבית של PECs גולמיים עם DNP-BSA.
נושא מסקרן בפירוש התוצאה של בדיקת דה-גרנולציה של תאי פיטום במבחנה לבדיקת עיכוב תפקוד תאי פיטום על ידי חומר פרמקולוגי הוא כיצד לקשר תוצאה כזו במבחנה (למשל, IC50 של תרכובת בדיקה) לתוצאה in vivo (למשל, ED50) הנגזרת ממחקר בבעלי חיים in vivo כגון PSA. גם במקרה שבו נעשה שימוש בתאי פיטום ראשוניים, בהתחשב בכך שהתנאים הסביבתיים הסובבים אותם להיתקל במהלך מבחני in vitro ו- in vivo שונים זה מזה באופן מהותי, התוצאות המתקבלות ממחקרים אלה עשויות לא תמיד להיות דומות זו לזו. לפיכך, נדרשת זהירות כדי להוציא את התוצאות מהבדיקה החוץ גופית לניסוי in vivo ולהיפך. מכיוון שתאי פיטום המשמשים בבדיקת הגרנולציה ex vivo המתוארת במחקר זה מטופלים בתרכובת בדיקה בסביבות זהות לאלו של בדיקת in vivo ומודגרים עם ליגנד טבעי מיד לאחר הבידוד מהחיה, סבורים כי התוצאות מבדיקת ex vivo משקפות במדויק כיצד תאי פיטום בגוף מושפעים מהתרכובת במהלך בדיקת in vivo.
בעוד שהמוקד העיקרי של מחקר זה היה כיצד להשתמש במבחן ex vivo כדי לאשר את הפעילות המייצבת בפועל של תאי פיטום של תרופה פוטנציאלית נגד אלרגיה in vivo, יש לציין כי ניתן להשתמש בבדיקה זו גם לצורך בחינת ההשפעות של נוק-אאוט של גנים ספציפיים על תפקוד תאי פיטום. לדוגמה, בדיקה זו תהיה שימושית בבחינת ההשפעות של מחיקה של גנים ספציפיים המעורבים באופן קריטי בהתמיינות של תת-קבוצות ספציפיות של תאי T על תפקוד תאי פיטום. בנוסף, למרות שהשתמשנו רק באנפילקסיס מערכתית פסיבית כמערכת מודל בכתב יד זה, אנו מניחים שניתן לבצע את אותה בדיקה עם PECs המתקבלים לאחר חיסון פעיל של עכברים.
לסיכום, לבדיקה זו יש מספר מאפיינים ייחודיים כדלקמן. ראשית, הבדיקה מהירה וקלה מכיוון שנעשה שימוש ב-PEC גולמי. שנית, מכיוון שתאי פיטום מטופלים בתרכובת בדיקה בסביבות שבהן מתבצע מחקר רלוונטי בבעלי חיים, תוצאות מבדיקת הדגרנולציה ex vivo משקפות נאמנה את השפעות התרכובת המופעלת על תאי פיטום במהלך המחקר בבעלי חיים. שלישית, מכיוון שהבדיקה מלווה בניתוח זרימה עבור היחס ומספר תאי הפיטום ב-PECs, ניתן להתייחס גם להשפעות של תרכובת הבדיקה על הכדאיות של תאי פיטום in vivo.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים למר וונהי לי ולגב' יונג'ו לי על הסיוע הטכני והאדמיניסטרטיבי שלהם. אנו מודים גם לד"ר טי מין נגוייט נגוין על הערותיה המתחשבות. עבודה זו נתמכה על ידי מענקי המחקר מהאוניברסיטה הלאומית של צ'ונגנאם (מענק מחקר CNU 2017-2098-01) ומקרן המחקר הלאומית של קוריאה (NRF-2019R1F1A1061894 ו-NRF-2019M3A9G4067293).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | 1757589701 | ||
| 1.5 mL micro tube | Hisol | MT-15003 | |
| 10 mL syringe | 1757593161 | ||
| 15 mL conical tube | Thermo Fisher scientific | 14-959-53A | |
| 20xPBS | Tech & Innovation | BPB-9121-500mL | |
| 4-nitrophenyl-N-acetyl-β-D-glucosaminide | SIGMA | N9376 | |
| 5 mL polystyrene round-bottom tube | Life sciences | 352003 | |
| 50 mL conical tube | Thermo Fisher scientific | 14-959-49A | |
| Aluminium Fiol | BioFact | TS1-3330 | |
| Anti-mouse CD117(c-kit) | Biolegend | 135129 | keep at 2-8°C |
| Anti-mouse IgE mAbs | Thermo Fisher scientific | 11-5992-81 | keep at 2-8°C |
| Antiti-DNP-IgE | SIGMA | D8406-.2MG | keep at -20°C |
| Centrifuge | HANIL | 396150 | |
| D-(+)-gluouse | SIGMA | G8270 | |
| Dexamethasone | SIGMA | D2915-100MG | |
| DNP-BSA | Invitrogen | 2079360 | keep at -20°C |
| EDTA | Biofact | PB131-500 | |
| Fetal Bovine serum | Thermo Fisher scientific | 11455035 | |
| Gelatin | SIGMA | G1890 | |
| Glycine | JUNSEI | 27185-0350 | |
| hemocytometer | ZEISS | 176045 | |
| HEPES | Thermo Fisher scientific | 15630130 | |
| Histamine ELISA kit | Abcam | GK3275957-4 | keep at 2-8°C |
| Hotplate stirrer | Lab teach | zso-9001 | |
| Isoflurance | Troikaa | I29159 | |
| ketotifen fumarate salt | SIGMA | K2628 | |
| MCPT-1 ELISA kit | Thermo Fisher scientific | 88-7503-22 | keep at 2-8°C |
| Mouse Fc block | BD Biosciences | 553141 | keep at 2-8°C |
| Propidium iodiole | SIGMA | 81845 | keep at 2-8°C |
| RBC lysis buffer | Biolegend | 420301 | |
| Round-bottom 96 well | SPL-life sciences | 30096 | |
| Single use syringe filter | Startoriusag | 16555 | |
| Streptavidin microbeads | MilteryiBiotec | 130-048-101 | keep at 2-8°C |
| Triton X-100 | JUNSEIchemical | 49415-1601 | |
| TWEEN 20 | SIGMA | 9005-64-5 | |
| Water bath | CHANGSHINSCIENCE | 190107 |
References
- Amin, K. The role of mast cells in allergic inflammation. Respiratory Medicine. 106 (1), 9-14 (2012).
- Holgate, S., et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. Journal of Allergy and Clinical Immunology. 115 (3), 459-465 (2005).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693 (2012).
- Roth, K., Chen, W. M., Lin, T. J. Positive and negative regulatory mechanisms in high-affinity IgE receptor-mediated mast cell activation. Archivum Immunologiae et Therapiae Experimentalis. 56 (6), 385-399 (2008).
- Finn, D., Walsh, J. Twenty-first century mast cell stabilizers. British Journal of Pharmacology. 170 (1), 23-37 (2013).
- Lu, Y., et al. Emodin, a naturally occurring anthraquinone derivative, suppresses IgE-mediated anaphylactic reaction and mast cell activation. Biochemical Pharmacology. 82 (11), 1700-1708 (2011).
- Demo, S., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry: The Journal of the International Society for Analytical Cytology. 36 (4), 340-348 (1999).
- Passante, E., Ehrhardt, C., Sheridan, H., Frankish, N. RBL-2H3 cells are an imprecise model for mast cell mediator release. Inflammation Research. 58 (9), 611-618 (2009).
- Fukuishi, N., et al. Does β-hexosaminidase function only as a degranulation indicator in mast cells? The primary role of β-hexosaminidase in mast cell granules. The Journal of Immunology. 193 (4), 1886-1894 (2014).
- Malbec, O., et al. Peritoneal cell-derived mast cells: an in vitro model of mature serosal-type mouse mast cells. The Journal of Immunology. 178 (10), 6465-6475 (2007).
- Arock, M., Le Nours, A., Malbec, O., Daëron, M. . Innate Immunity. , 241-254 (2008).
- Befus, A., Pearce, F., Gauldie, J., Horsewood, P., Bienenstock, J. Mucosal mast cells. I. Isolation and functional characteristics of rat intestinal mast cells. The Journal of Immunology. 128 (6), 2475-2480 (1982).
- Yoon, S. C., et al. Anti-allergic and anti-inflammatory effects of aqueous extract of Pogostemon cablin. International Journal of Molecular Medicien. 37 (1), 217-224 (2016).
- Mierke, C. T., et al. Human endothelial cells regulate survival and proliferation of human mast cells. Journal of Experimental Medicien. 192 (6), 801-812 (2000).
- Hermes, B., et al. Altered expression of mast cell chymase and tryptase and of c-Kit in human cutaneous scar tissue. Journal of Investigative Dermatology. 114 (1), 51-55 (2000).
- Wendeler, M., Sandhoff, K. J. Hexosaminidase assays. Glycoconjugate Journal. 26 (8), 945-952 (2009).
- Russell, M., et al. Learned histamine release. Science. 225 (4663), 733-734 (1984).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Kitamura, Y., et al. Dexamethasone suppresses histamine synthesis by repressing both transcription and activity of HDC in allergic rats. Allergology International. 55 (3), 279-286 (2006).
- Grant, S. M., Goa, K. L., Fitton, A., Sorkin, E. M. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorder. Drugs. 40 (3), 412-448 (1990).
- Cook, E., Stahl, J., Barney, N., Graziano, F. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Current Drug Targets-Inflammation & Allergy. 1 (2), 167-180 (2002).
- Schoch, C. In vitro inhibition of human conjunctival mast-cell degranulation by ketotifen. Journal of Ocular Pharmacology and Therapeutics. 19 (1), 75-81 (2003).
- Franchimont, D., et al. Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. The Journal of Immunology. 164 (4), 1768-1774 (2000).
- Simmons, C. P., et al. The clinical benefit of adjunctive dexamethasone in tuberculous meningitis is not associated with measurable attenuation of peripheral or local immune responses. The Journal of Immunology. 175 (1), 579-590 (2005).
- Cavalher-Machado, S. C., et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. International Immunopharmacology. 8 (11), 1552-1560 (2008).
- Dhakal, H., et al. Gomisin M2 inhibits mast cell-mediated allergic inflammation via attenuation of FcεRI-mediated Lyn and Fyn activation and intracellular calcium levels. Frontiers in Pharmacology. 10, 869 (2019).
- Galli, S. J., Wedemeyer, J., Tsai, M. Analyzing the roles of mast cells and basophils in host defense and other biological responses. International Journal of Hematology. 75 (4), 363-369 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved