Method Article
粗腹膜滲出液細胞と天然抗原刺激を用いたEx vivo Mast Cell Degranulation Assay
要約
私たちは、マウスから単離した粗腹膜滲出液細胞をインキュベートし、目的の薬理学的薬剤で処理し、事前に抗ジニトロフェノール(DNP)IgEをキャリアタンパク質にDNPを投与することにより、ex vivo肥満細胞脱顆粒アッセイを確立しました。
要約
肥満細胞安定剤は、アレルギー治療薬の重要な部分です。受動的全身アナフィラキシー(PSA)は、in vivoで肥満細胞に対する目的の薬理学的薬剤の効果を調査するために広く使用されている動物アッセイです。アナフィラキシー症状は主に肥満細胞由来の顆粒のエキソサイトーシスに起因することから、症状の改善を引き起こす薬剤は肥満細胞安定化活性を有すると考えられる。事実にもかかわらず、その治療後の肥満細胞の機能活性の低下を直接示すことによって活性を確認することが賢明です。そのために、不死化マスト細胞株または培養初代マスト細胞を用いたin vitro脱顆粒アッセイが日常的に行われています。in vitro アッセイと in vivo アッセイの結果は、必ずしも互いに類似しているとは限りません。ただし、in vitroアッセイの治療条件(治療用量、時間、周辺環境など)は、PSAなどのin vivoアッセイとは異なることがよくあります。in vivoでの肥満細胞に対する薬理学的薬剤の影響をより密接に反映するin vitro(またはex vivo)アッセイを追求するために、マウスから単離された粗腹膜滲出液細胞(PEC)を薬剤で処理し、抗ジニトロフェノール(DNP)IgEを投与したところ、キャリアタンパク質上でDNPと直接インキュベートするex vivo肥満細胞脱顆粒アッセイを考案しました。その結果、このアッセイは、in vivoアッセイで示された薬理学的薬剤の肥満細胞安定化活性の検証に有用であるだけでなく、実用的で再現性が高いことがわかりました。
概要
肥満細胞はアレルギーにおいて中心的な役割を果たします1,2。高親和性IgE受容体(FcεRI)との相互作用を介して肥満細胞の表面に位置するIgEが同族のアレルゲンに遭遇すると、シグナル伝達カスケードが誘発され、顆粒の放出が促されます。その結果、モノアミン(ヒスタミン、セロトニンなど)、サイトカイン(TNF-αなど)、タンパク質分解酵素(トリプターゼ、キマーゼなど)など、さまざまなアレルギーエフェクター分子が放出され、一連の免疫反応、神経反応、血管筋反応を引き起こします3,4。
医薬品のクラスは、肥満細胞の機能を弱めることによりアレルギー症状を緩和する肥満細胞安定剤と呼ばれます5。受動的全身性アナフィラキシー(PSA)は、薬理学的薬剤の肥満細胞安定化活性を調べるためによく使用される動物モデルです。アナフィラキシー症状は、主に受動的に伝達されたハプテン特異的IgEとハプテンとの相互作用に続くマスト細胞の活性化に起因するため、その治療が症状の改善をもたらす場合、関心のある薬理学的物質がマスト細胞安定化活性を有することはよく受け入れられています6.それでも、症状の改善が肥満細胞機能の抑制以外のメカニズムに由来する可能性を排除するために、別の実験で薬剤による肥満細胞機能の障害を直接示すことがしばしば不可欠です。
マスト細胞の脱顆粒アッセイは、化学試薬またはIgEの特定の抗原でマスト細胞を刺激し、マスト細胞の表面にFcεRIと複合体を形成して分泌顆粒のエキソサイトーシスを誘導すること(すなわち、脱顆粒)によって行われ、一般に、薬理学的試薬のマスト細胞安定化活性をin vitroで測定するために使用されます7。このアッセイでは、ラット好塩基性白血病(RBL)細胞株8、骨髄由来肥満細胞(BMMC)9、腹膜細胞由来肥満細胞(PCMC)10など、いくつかの種類の細胞が使用されます。RBLは、多数の細胞を容易に入手できるという有用性がありますが、不死化がん細胞株であり、その細胞特性はもはや体内の肥満細胞の細胞特性とは異なります。十分な数のBMMCまたはPCMCを取得することは、その細胞特性が体内の肥満細胞の特性により似ている場合でも、多くの場合、費用と時間がかかります。
精製された初代肥満細胞を用いた脱顆粒アッセイは、望ましい代替手段である11。それにもかかわらず、このようなアッセイの使用は、動物組織、特にマウス組織から肥満細胞を高収率で精製するための簡便な方法として普及しておらず、純度はまだ得られていません。さらに、in vitroで肥満細胞の機能を阻害する薬理学的薬剤による治療の濃度と期間は、in vivoのものと必ずしも一致するとは限らないため、in vitroの脱顆粒アッセイで得られた結果は、PSAなどのin vivoアッセイの結果と誤って表現される可能性があり、その逆も同様です。したがって、in vivoで発生する肥満細胞の活性化方法を厳密に模倣するだけでなく、in vivoで肥満細胞に及ぼされる薬理学的試薬の効果を正確に反映する新しい脱顆粒アッセイは、高い需要があります。そこで、マウスから単離した腹膜滲出液細胞(PEC)の肥満細胞を目的の薬理学的薬剤で処理し、事前にジニトロフェノール(DNP)に特異的なIgEを投与した上で、DNP標識ウシ血清アルブミン(BSA)で刺激するex vivoマスト細胞脱顆粒アッセイを考案しました。
プロトコル
すべての動物実験は、忠南大学校のIACUC(Institutional Animal Care and Use Committee)のガイドライン(動物プロトコル番号:CNU-00996)に従って行われました。
1. 粗PECのライセート中の肥満細胞特異的分子の定量
- マウス腹腔12から細胞を単離する。
- マウス(8週齢、雄、BALB/C)にイソフルランを麻酔します。頸部脱臼による安楽死。
- マウスを発泡スチロールブロックの上に置きます。腹部を70%エタノールで拭きます。
- 鈍いエッジハサミで腹側の皮膚を縦方向に切ります。鉗子とハサミを使用してマウスの皮膚を剥がします。
- 26 Gの針が付いた10 mLのシリンジを使用して、6 mLの氷冷Tyrode's Bバッファー13 を腹腔に注入します。.臓器を刺さないように、針をそっと挿入します。
- マウスの腹部を60〜90秒間マッサージして、腹膜細胞をTyrodeのBバッファーに集めます。血管を傷つけないように優しく行ってください。
- 10mLシリンジのベベルアップに取り付けられた針(20G)を挿入します。腹腔から液体をゆっくりと吸引します(通常は5〜6 mL)。
- 注射器から針を取り出します。腹膜液を50mLのコニカルチューブに分注します。チューブを氷の上に保ちます。
- 手順1.1.4〜1.1.7を繰り返します。
- チューブを300 x g で10°Cで5分間遠心分離します。 細胞を1x赤血球(RBC)溶解バッファー1mLに再懸濁します。細胞を氷上に3分間置きます。
- 細胞懸濁液を2 mLのTyrode's Bバッファーで希釈します。チューブを300 x g で10°Cで5分間遠心分離します。
- 上清を取り除きます。細胞を0.5 mLのTyrode's Aバッファー13に再懸濁します。
- 血球計算盤で細胞を数えます。細胞数を5 x 106/mLに調整し、Tyrode's Aバッファーを使用します。
- 磁気細胞精製システム14を用いて、マスト細胞が枯渇したPECを調製する。
- 5 x 105 個の粗 PEC を 300 x g で 10 °C で 5 分間遠心分離します。 ペレットを200 μLのPBSBE細胞精製バッファー(0.5% BSA、2 mM EDTA、1 x PBS、pH 7.4)に再懸濁します。
- 1 μLのFcブロッカー(0.5 mg/mL)を細胞に添加して、次に添加する抗c-kitモノクローナル抗体(mAb)の非特異的結合を防ぎます。細胞を氷上に5分間置きます。
- 1 μL のビオチン化抗マウス c-kitmAb 15 (0.5 mg/mL) を添加します。細胞を氷上に10分間置きます。
- PBSBEバッファー2mLを添加します。細胞を300 x g で10分間、10°Cで遠心分離します。
- 上清を取り除きます。細胞を2mLのPBSBEバッファーで再度洗浄します。
- 細胞を90 μLのPBSBEバッファーに再懸濁します。10 μLのストレプトアビジン標識マイクロビーズを添加します。細胞を氷上に15分間置きます。
- PBSBEバッファー2mLを添加します。細胞を300 x g で10分間、10°Cで遠心分離します。
- スピン中に500 μLのPBSBEバッファーを中磁気カラムにロードします。バッファーが列を流れるのを待ちます。
- 遠心分離後、上清を除去します。細胞を500 μLのPBSBEバッファーに再懸濁します。
- 列にセルをロードします。カラムを自由に通過するセルを収集します。
- カラムを500 μLのPBSBEバッファーで洗浄します。カラムを通過するセルを再度収集します。
- 手順1.2.11を繰り返します。
- ステップ1.2.9-1.2.11のセルを1つのチューブに結合します。細胞を300 x g で10分間、10°Cで遠心分離します。
- Tyrode の A バッファー内のセルを再懸濁します。セルを数えます。細胞数を5 x 106 細胞/mLに調整します。
- PECのライセートを調製します。
- プレートPEC(例えば、5 x 105)をそれぞれ丸底の96ウェルプレートに入れます。プレートを300 x g で10°Cで2分間遠心分離し、細胞を回収します。ピペットで上清を慎重に取り除きます。
- 細胞ペレットに100 μLの細胞溶解バッファーを添加します。細胞を数回ピペッティングして、穏やかにピペッティングします。プレートを氷の上に置いて60分間保管します。
- プレートを300 x g で5分間、10°Cで遠心分離し、細胞の破片を除去します。上清(細胞溶解物)を新しい96ウェルプレートに移します。
- β-ヘキソサミニダーゼ16の酵素活性を測定します。
- 細胞ライセート(50 μL)を、96ウェルマイクロプレート内の予熱したβ-ヘキソサミニダーゼ基質溶液(50 μL)に加えます。ピペットでやさしく混ぜます。
- プレートを37°Cのインキュベーターでインキュベートします。30分後に50 μLの停止溶液(100 mMグリシン、pH 10.7)を加えて、酵素反応を終了します。
- 反応混合物のO.D.を、2波長設定の紫外可視吸光度マイクロプレートリーダーで読み取ります。酵素反応のレベルを決定するために405 nm、自動バックグラウンド減算のためにそれぞれ620 nm。
- ヒスタミン17の濃度を測定します。
- 透明化した細胞ライセート100 μLを、ヒスタミンELISAキットに付属の抗ヒスタミンmAbコーティングプレートに移します。競合するヒスタミンELISAアッセイは、メーカーのマニュアルに従って行ってください。
- UV可視吸光度マイクロプレートリーダーでサンプルのO.D.を450nmの波長で読み取ります。
- PEC中の肥満細胞の比率をフローサイトメトリーで決定します18。
- 1 x 105 の粗細胞またはマスト細胞が枯渇したPECを丸底の96ウェルプレートに移します。プレートを300 x g で10°Cで2分間遠心分離します。
- 細胞を50μLのFACSバッファーに再懸濁します。1 μL の抗マウス c-kit (0.5 mg/mL) および抗マウス IgE mAb (0.5 mg/mL) を添加します。
- 細胞を短時間ボルテックスします。細胞を暗闇で20分間氷上に保ちます。
- ウェルに150μLのFACSバッファーを充填します。プレートを300 x g で10°Cで2分間遠心分離します。 プレートをすばやく裏返して、バッファーを廃棄します。
- ヨウ化プロピジウム(1μg/mL)を含む150μLのFACSバッファーで細胞を再懸濁します。フローサイトメーターで細胞を解析します。
2. 粗PECを用いた肥満細胞の脱顆粒アッセイ
- 肥満細胞の脱顆粒の程度を決定します(%脱顆粒)。
- 3匹のBALB / Cマウス(8週齢、雄)に3μgの抗DNP mAb(マウスIgE)を静脈内(i.v.)注射します。Ab注入の1日後にPECを分離します(ステップ1.1を参照)。
- 90 μL の粗 PEC (5.5 x 106/mL) を平底 96 ウェルプレート (合計 4 ウェル) にプレートします。プレートを37 °C加湿CO2 インキュベーターで30分間インキュベートします。
- 10 μL の DNP-BSA (1x PBS に 5 ng/mL) を PEC を含むウェルに加えます。プレートを37°CのCO2 インキュベーターで10分間インキュベートします。
- インキュベーション直後に、プレートを300 x g で10°Cで5分間遠心分離します。上清(100μL)をピペットで慎重に取ります。氷上の新しい丸底96ウェルプレートに保存します。
- 100 μLの細胞溶解バッファー(0.1% Triton X-100 in 1 x PBS、pH 7.4)をPECを含むマイクロプレートウェルに加えます。プレートを氷の上に置いて60分間保管します。
- β-ヘキソサミニダーゼアッセイを実施します。
- 脱顆粒アッセイ後に氷に保存された4セットの上清と対応する細胞溶解物をそれぞれ2セット取り出します(ステップ2.1.4および2.1.5を参照)。上清と細胞ライセートを2つの別々のウェル(各50 μL)に分割して、アッセイを複製します。
- 各ウェルに50 μLのβ-ヘキソサミニダーゼ基質溶液を添加します。プレートを37°Cで30分間インキュベートします。反応混合物に50 μLの停止溶液(100 mMグリシン、pH 10.7)を加えます。
- 反応混合物の外径を読み取ります(ステップ1.4.3を参照)。マスト細胞の脱顆粒の程度は次のように計算します。
% 脱顆粒 = OD上清 / (OD上清 + ODライセート) X 100%
- ヒスタミンアッセイを実施します。
- 上清の別の2つのウェルに1x PBS100 μLを加え、脱顆粒後に保存された対応する細胞溶解物を加えて、サンプルの総容量を200 μLにします。ヒスタミンELISAキットに付属のヒスタミンELISAプレートで、各サンプルを2つの別々のウェルに分割します。
- ELISAアッセイは、メーカーのマニュアルに従って行ってください。UV可視吸光度マイクロプレートリーダーでサンプルのO.D.を450nmの波長で読み取ります。2.1.6.3のように脱粒度を計算します。
% 脱顆粒 = [ヒスタミン]sup /([ヒスタミン]sup + [ヒスタミン]ライセート) X 100%
- ex vivo 肥満細胞脱顆粒アッセイにより、in vivo で発揮される肥満細胞に対する抗アレルギー薬の効果を評価します。
- デキサメタゾン19 (DEX)とケトチフェン20 (KET)の200μLをそれぞれマウス(6週齢、雄)に1日1回3日間(6匹/グループ)経口投与します。
- 3回目の 治療後、マウスに3μgの抗DNP IgEを静脈内(i.v.)注射します。マウスの各グループを2つの別々のケージ(3匹のマウス/ケージ)に分けます。1つはPSAアッセイ用、もう1つはex vivoマスト細胞脱顆粒アッセイ用です。
- PSAアッセイの実施
- 抗DNP IgEの注射の1日後にマウスにDNP-BSA(80μg)を注入します。DNP-BSAの注射直後から1時間、直腸体温計で体温を測定します。.
- DNP-BSAの注射の1日後に血液を採取します。ELISAを使用して血清中のMCPT-1のレベルを測定します。.
- ex vivo 肥満細胞の脱顆粒アッセイを実施します。
- 抗DNP IgEの注射の1日後にマウスからPECを分離します。分離されたPECの数を数えます。
- 90 μL の粗 PEC (5.5 x 106/mL) を 96 ウェルプレート (マウスあたり 4 ウェル) にプレートします。プレートを37°C加湿CO2 インキュベーターで30分間インキュベートします。
- DNP-BSA(5 ng/mL)10 μLを添加します。プレートを37°C加湿CO2 インキュベーターで10分間インキュベートします。
- プレートを300 x g で10°Cで5分間遠心分離します。 上清(100μL)を慎重に取り、細胞をウェルに残します。
- 100 μLの細胞溶解バッファーをウェルに加えます。プレートを氷上で60分間インキュベートします。
- 2.1.6および2.1.7に記載されているように、β-ヘキソサミニダーゼアッセイおよびヒスタミンELISAアッセイを実施します。ステップ2.1.6.3のように脱顆粒率を計算します。
結果
ex vivo 肥満細胞脱顆粒アッセイに最適な PEC 数の決定
肥満細胞(c-kit+·IgE+ ダブルポジティブセル)15 は、PECの約2%に過ぎません(図1A)。顆粒の100%がPEC中の肥満細胞によって放出されたと仮定して、培養上清中に検出される肥満細胞特異的分子の最大レベルを推定し、異なる数のPECで調製した全細胞溶解物中のβ-ヘキソサミニダーゼ16 およびヒスタミン17 の量を測定しました:2.5 x 105、5 x 105 、および1 x 106 PECs、 それぞれ。 図1Bに示すように、ライセートを2.5×105 PECで調製した場合でも、β-ヘキソサミニダーゼおよびヒスタミンの両方の有意なレベルが検出され、細胞ライセートの調製に使用されるPECの数が増加するにつれて、それらのレベルは比例して増加しました。
これらの結果を踏まえ、以下の理由から、ex vivo マスト細胞脱顆粒アッセイに 5 x 105 PEC を使用することを決定しました。1匹のマウス(8週齢)から単離されたPECは3 x 106 個強で、96ウェルマイクロプレート(それぞれβ-ヘキソサミニダーゼ用の2ウェルとヒスタミンアッセイ用の2ウェル)の4つの別々のウェルに均等に播種されることになっていたことを考えると、ウェルあたり1 x 106 個のPECをプレーティングすると、細胞が不足する可能性があります。さらに、上述の結果は、脱顆粒アッセイを実施するのに十分な数の肥満細胞が5×105 粗PEC中に存在していたことを示しました。すなわち、これらの結果によれば、肥満細胞から顆粒の30〜40%程度しか放出されなかった場合でも、脱顆粒アッセイ後に培養上清で検出されるβ-ヘキソサミニダーゼとヒスタミンのレベルは、正確に定量できるほど高いことが予想されました。
次に、PECのライセートから検出されたβ-ヘキソサミニダーゼとヒスタミンが、PECの肥満細胞のみに由来することを確認しようとしました。そのために、磁気細胞精製カラムを使用してPECから肥満細胞を空にしました(ステップ1.2を参照)。予想通り、カラムを透過した標識されていないPECには、肥満細胞がまったく存在しませんでした(図1C)。また、予想通り、マスト細胞が枯渇したPECで調製した細胞溶解物では、β-ヘキソサミニダーゼもヒスタミンも検出されませんでした(図1D)。
粗PECを用いたex vivoマスト細胞脱顆粒アッセイ
次に、IgEの特異的抗原が表面にあるPECの培養中に肥満細胞から放出されるβ-ヘキソサミニダーゼとヒスタミンの実際のレベルを調べました。そのために、抗DNP-IgEを注入したマウスからPECを単離し、DNP-BSA(0.5 ng/mL)で培養(5 x 105)しました。 図2Aに示すように、培養後5分以内に培養上清中に有意なレベルのβ-ヘキソサミニダーゼが検出され始め、培養期間が長くなるにつれて継続的に増加しました。それにもかかわらず、培養10分後には増加速度が急速に減少し、脱顆粒の程度は30〜40分後には徐々に50%前後のプラトーに達しました。培養中に肥満細胞から放出されるヒスタミンのレベルを調べた場合も、同様の結果が得られました(図2B)。これらの結果を踏まえ、以下のアッセイでPECをDNP-BSAで10分間培養することとしました。
ex vivo脱顆粒アッセイにより、肥満細胞に対するKETおよびDEXのin vivo効果を検証しています。
ケトチフェン(KET)は、抗ヒスタミン作用を持つアレルギー薬です。しかし、他の従来の抗ヒスタミン薬とは異なり、抗ヒスタミン作用に加えて肥満細胞安定化活性を有する二重作用型抗ヒスタミン薬として知られています。KETの肥満細胞安定化活性が調査されています21,22;しかし、ほとんどがin vitroでの研究であり、それがin vivoで肥満細胞にどのように影響を与えるかを示す研究は乏しいです。デキサメタゾン(DEX)は、アレルギー薬23の別のタイプです。DEXは、さまざまな種類の免疫細胞の機能活性を損なって、広範囲の免疫応答を抑制することが知られています24。KETとDEXがin vivoで肥満細胞の活性に及ぼす影響を確認するために、いずれかで処理したマウスから単離したPECを用いてex vivo肥満細胞脱顆粒アッセイを行うことになった。
ex vivo 肥満細胞脱顆粒アッセイに先立ち、まず、PSA モデルで受動的に転移した DNP 特異的 IgE および DNP-BSA によって誘発されるアナフィラキシー反応に対する DEX および KET の効果を調べました。予想通り、KETまたはDEXによる治療は、用量依存的にアナフィラキシー症状の改善をもたらし(補足図1)、肥満細胞の機能活性がそれらの治療によって損なわれたことを示しています。
また、いずれかの化合物で処理したマウスから単離されたPECの数と、PEC中の肥満細胞の割合を調べました(図3A)。KETによる治療は、治療に使用された用量に関係なく、マウスから単離されたPECSの数に顕著な変化をもたらさなかった。一方、DEX投与マウスから単離されたPECsは、4.5mg/kg投与で投与すると有意に減少し、DEX投与が腹膜細胞の生存率に影響を及ぼしたことが示されました。それでも、肥満細胞の比率は、治療に使用した薬剤や用量に関係なく、約2%で一定に保たれていたことに注意する必要があります(図3A)。また、腹腔内の肥満細胞が発現するβ-ヘキソサミニダーゼとヒスタミンのレベルに対するDEXとKETの影響を、同じ数の粗PECで調製した全細胞ライセート中の量を測定することにより調べました(図3B)。注目すべきは、β-ヘキソサミニダーゼとヒスタミンの両方のレベルが、4.5 mg / kgの用量でDEXで治療した後に増加することがわかりました。.KET治療では、これらのレベルにはほとんど変化がありませんでした。
次に、ex vivo 肥満細胞の脱顆粒アッセイを行いました(図 4)。まず、PECの細胞密度を5.5 x 106 細胞/mLに均等に調整して、アッセイで同じ数の肥満細胞が使用されるようにしました。次に、PEC(90 μL)を96ウェルマイクロプレートに播種し、DNP-BSAと10分間インキュベートしました。高用量のDEXまたはKETで処理したマウスのPECをDNP-BSAとインキュベートしたところ、培養上清で検出されたβ-ヘキソサミニダーゼとヒスタミンのレベルは、DNP-BSAで偽処理したマウスのPECをインキュベートした後に検出されたものと比較して大幅に低下することがわかりました(図4)。培養上清で検出されたこれらの分子のレベルと、マウスの治療に使用されたDEXおよびKETの用量との間には、逆相関も明らかでした。したがって、治療に用いた用量が高ければ高いほど、インキュベーション後の培養上清で検出されるβ-ヘキソサミニダーゼおよびヒスタミンのレベルは低かった。
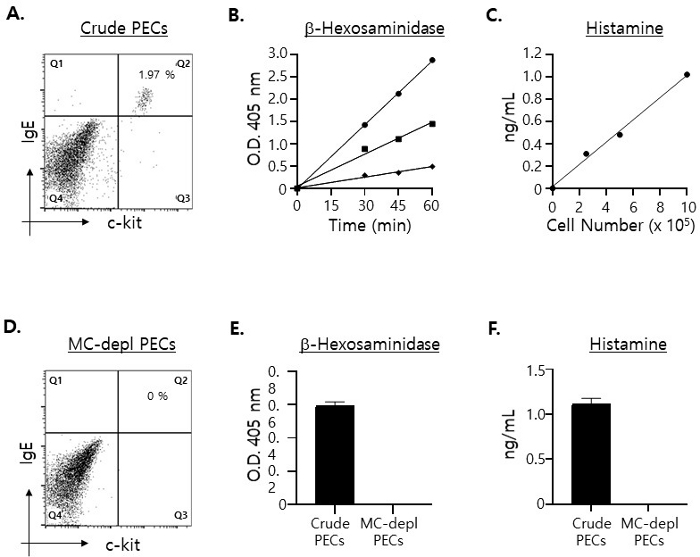
図1:異なる数のPECで調製したライセートに含まれる肥満細胞特異的分子のレベルを定量化。
(A)PECをFITC標識抗マウスc-kitとPE標識抗マウスIgEモノクローナル抗体で染色し、フローサイトメトリーで分析しました。肥満細胞(すなわち、c-kit+·IgE+ ダブルポジティブセル)は右上の象限に示されています。(B)細胞ライセートをそれぞれ1 x 106 (円)、5 x 105 (正方形)、および2.5 x 105 (ダイヤモンド)PECで調製し、全ライセートの半分をβ-ヘキソサミニダーゼの基質と示された時間インキュベートしました。酵素反応による色の変化の程度は、波長405nmの96ウェルマイクロプレートリーダーで測定しました。アッセイは二重に実施しました。(C)細胞ライセートを(B)と同様に調製し、ライセート中のヒスタミン濃度をELISAで測定した。(D)マスト細胞が枯渇したPECを(A)のようにmAbで染色した。(E)細胞ライセートを、5 x 105 の粗(充填バー)PECおよびマスト細胞枯渇(オープンバー)PECで調製し、反応終了前にβ-ヘキソサミニダーゼ基質と30分間インキュベートしました。(F)(E)のように調製した細胞溶解物中のヒスタミン濃度を測定した。 この図の拡大版を表示するには、ここをクリックしてください。

図2:DNP-BSAによるPECの培養中に肥満細胞から放出される肥満細胞特異的分子の量の測定。
抗DNP IgE(円)またはわずか1 x PBS(三角形)を注入したマウスから単離されたPEC(5 x 105)を、示されている期間DNP-BSAで培養しました。各時点で上清中に検出されたβ-ヘキソサミニダーゼ(A、左)とヒスタミン(B、左)のレベルをプロットしました。脱顆粒の程度は、上清に放出され、細胞内に残っているβ-ヘキソサミニダーゼ(A、右)とヒスタミン(B、右)の量(細胞溶解物)で計算されました。脱顆粒の程度(%)を計算するために、次の式を使用しました。脱顆粒 (%) = [X]sup /([X]sup + [X]lysate) X 100 この図の拡大版を表示するには、ここをクリックしてください。
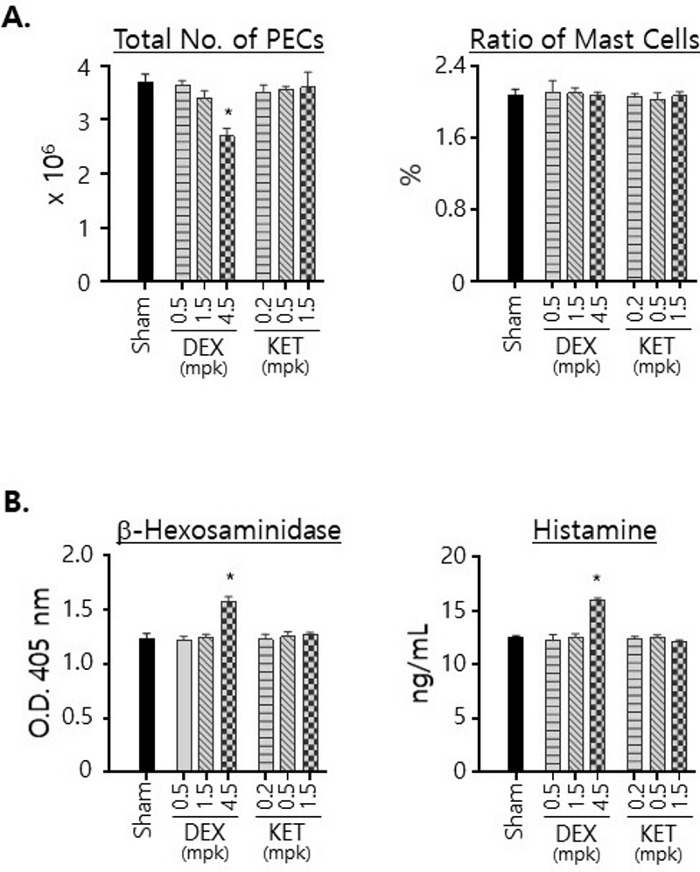
図3:腹腔内の肥満細胞の生存率とb-ヘキソサミニダーゼとヒスタミンの発現レベルに対するDEXとKETの影響。
(A)PECは、ビヒクル単独(偽)または指示用量のDEXまたはKETを使用して3日間p.o.処理されたマウスから単離されました。全細胞数を血球計算盤でカウントし、平均数を計算して標準偏差とともにプロットしました(左)。PECは、FITC標識抗c-kitとPE標識抗IgEモノクローナル抗体で染色し、フローサイトメトリーで分析しました。ダブルポジティブセル(すなわち、肥満細胞)と総PECsの比率をプロットした(右)。(B)PECを(A)と同様に単離し、同数(5×105)のPECを用いて細胞溶解物を調製した。これらの溶解物中のβ-ヘキソサミニダーゼ(左)とヒスタミン(右)の量を測定し、プロットしました。すべての実験は、グループごとに3匹のマウスで行われました。統計的有意性は、一元配置分散法を用いて計算した。* p < 0.05. この図の拡大版を表示するには、ここをクリックしてください。

図4:DEXまたはKETで処理したマウスから単離した粗PECを用いたex vivoマスト細胞脱顆粒アッセイ。
PEC は、ビヒクルのみ (ナイーブおよび偽) または指示用量の DEX または KET で 3 日間 p.o. 処理したマウスから単離され、その後、PBS (ナイーブ) または抗 DNP-IgE を静脈内注射しました。その後、DNP-BSAと10分間インキュベートし、培養上清に放出されたβ-ヘキソサミニダーゼ(A)とヒスタミン(B)のそれぞれレベルに基づいて脱顆粒の程度を計算しました。すべての実験は、グループごとに3匹のマウスで行われました。統計的有意性は、一元配置分散法を用いて計算した。* p < 0.05. この図の拡大版を表示するには、ここをクリックしてください。
| バッファ | レシピ | コメント/説明 | |
| 0.1 M クエン酸ナトリウムバッファー | 45.6 mM クエン酸ナトリウム二水和物、54.4 mM クエン酸、pH 4.5 | 2〜8°Cで保存 | |
| 10x RBC溶解バッファー | 80 mg/mL NH4Cl、8.4 mg/mL NaHCO3、3.7 mg/mL EDTA(二ナトリウム) | 2〜8°Cで保管し、6か月を超えないようにしてください | |
| 細胞溶解バッファー | 0.1 % Triton X-100、1 x リン酸緩衝生理食塩水(PBS)pH 7.4 | 2〜8°Cで保存 | |
| ELISAストップソリューション | 100 mM グリシン、pH 10.7 | 常温保存 | |
| FACSバッファ | 1 x PBS、5 % 馬用血清、1 % BSA、10 mM HEPES、2 mM EDTA、pH 7.2 | 2〜8°Cで保管し、2か月を超えないようにしてください | |
| PBSBEバッファー(MACS 細胞精製バッファー) | 1x PBS、0.5 % BSA、2 mM EDTA、pH 7.2 | 2〜8°Cで保管し、2か月を超えないようにしてください | |
| タイロードのAバッファ | 10 mM HEPES、130 mM NaCl、5.6 mMグルコース、5 mM KCl、1 mM MgCl2、1.4 mM CaCl2、 1 % ウシ血清アルブミン (BSA) pH 7.4 | 2〜8°Cで保管し、2か月を超えないようにしてください | |
| Tyrode の B バッファー | 137 mM NaCl、5.6 mM グルコース、12 mM NaHCO 3,2.7 mM KCl、0.3 mM NaH2PO4、1 mM MgCl2、1.8 mM CaCl2、0.1 % ゼラチン、pH 7.4 | 2〜8°Cで保管し、2か月を超えないようにしてください | |
表1:バッファー組成物。
補足図1:受動的に転移した抗DNP-IgEおよびDNP-BSAによって引き起こされるアナフィラキシー反応に対するDEXおよびKETの影響。 マウスを、ビヒクルのみ (ナイーブ、偽) または指示用量の DEX または KET で 3 日間毎日治療 (p.o.) し、PBS (ナイーブ) または抗 DNP-IgE mAb を投与しました (i.v.) PBS (ナイーブ) mAb.抗体注射の1日後、マウスにPBS(ナイーブ)またはDNP-BSAを注射しました(i.v.)。DNP-BSA注射の30分後に測定したマウスの体温をプロットした(A)。DNP-BSAの注射の1日後、マウスから採血を行い、ELISAでMCPT-1のレベルを測定しました(B)。実験は、グループごとに3匹のマウスで行われました。統計的有意性は、一元配置分散分析を使用して計算されました。* p < 0.05. この図をダウンロードするには、ここをクリックしてください。
ディスカッション
マスト細胞の脱顆粒アッセイが比較的少数の粗マウスPECで実施できるという発見は重要です。PECsは初代マウス肥満細胞の優れた供給源でなければなりませんが、PECsの肥満細胞を精製することは要求されています。Percoll25 のような密度勾配培地は、ラットPECsからの肥満細胞の精製に成功裏に使用されてきましたが、マウス腹膜肥満細胞の精製には、ラットとマウスの肥満細胞の密度の違いのために、その使用はおそらく制限されています。Histodenz26 などの別のグラジエント培地は、マウス腹膜肥満細胞の精製に使用されてきましたが、成功は限られています。精製の結果は、マウスの状態(例えば、年齢)に依存しているように見えました。磁気細胞精製システムのような新しい細胞単離システムでさえ、マウス肥満細胞の部分的な精製にしか至らなかった(著者らの未発表データ)。ここでは、腹膜肥満細胞の精製が肥満細胞の脱顆粒アッセイに不要であることを示します。
粗PEC中の肥満細胞がIgEの同族抗原によって引き起こされる可能性があるという結果は、in vivoで起こる脱顆粒イベントを忠実に模倣するex vivoアッセイを追求する上で有望です。しかし、好塩基球は肥満細胞に加えて、FcεRI27も発現します。したがって、ここでの注意点の1つは、PEC中の少数の好塩基球も、アッセイ中の培養上清中のヒスタミン濃度の増加に寄与する可能性があるということです。しかし、c-kit発現細胞(すなわち、肥満細胞)が枯渇したPECがアッセイで使用されたとき、培養上清で測定可能なレベルのヒスタミンが検出されなかったため、その可能性は低いと思われます。これらの結果から、DNP-BSAによる粗PECの培養後に培養上清で検出されたヒスタミンの放出には、肥満細胞が全面的に関与していることが確実になりました。
薬理学的薬剤によるマスト細胞機能の阻害を調査するためのin vitroマスト細胞脱顆粒アッセイの結果を解釈する際の興味深い問題は、そのようなin vitro結果(例えば、試験化合物のIC50 )をPSAなどのin vivo動物試験から得られたin vivo結果(例えば、ED50)にどのように関連付けるかです。初代肥満細胞を用いた場合でも、in vitroとin vivoのアッセイで出会う周囲の環境条件が大きく異なることを考えると、これらの研究から得られる結果は必ずしも類似しているとは限りません。したがって、in vitroアッセイからin vivo実験に、またはその逆に結果を外挿するには注意が必要です。本研究で紹介したex vivo脱顆粒法で用いた肥満細胞は、in vivo試験と同じ環境で試験化合物で処理し、動物から単離した直後に天然リガンドとインキュベートするため、ex vivo試験の結果は、in vivo試験中に体内の肥満細胞が物質によってどのように影響を受けるかを正確に反映していると考えられます。
この研究の主な焦点は、ex vivoアッセイを使用して、潜在的な抗アレルギー薬の実際の肥満細胞安定化活性を確認する方法でしたが、このアッセイは、特定の遺伝子ノックアウトが肥満細胞機能に及ぼす影響を調べる目的にも使用できることに注意する必要があります。例えば、このアッセイは、T細胞の特定サブセットの分化に決定的に関与する特定の遺伝子の欠失が肥満細胞の機能に及ぼす影響を調べるのに役立ちます。また、本稿では受動全身性アナフィラキシーのみをモデル系として用いていますが、マウスの能動免疫後に得られたPECについても同様のアッセイが実施できると推測します。
要約すると、このアッセイには次のようないくつかのユニークな特徴があります。まず、アッセイは、粗PECが使用されるため、迅速で容易です。次に、関連するin vivo動物試験が実施される環境で肥満細胞を試験化合物で処理すると、ex vivo脱顆粒アッセイの結果は、動物試験中に肥満細胞に及ぼされた化合物の影響を忠実に反映します。第三に、このアッセイにはPEC中の肥満細胞の比率と数のフロー分析が伴うため、in vivoでの肥満細胞の生存率に対する試験化合物の影響にも対処できます。
開示事項
著者は何も開示していません。
謝辞
ウォンヒ・リー氏とイ・ウンジュ氏の技術・管理支援に感謝します。また、Thi Minh Nguyet Nguyen博士の思慮深いコメントにも感謝します。本研究は、忠南大学校(CNU Research Grant 2017-2098-01)および韓国国立研究財団(NRF-2019R1F1A1061894およびNRF-2019M3A9G4067293)の研究助成を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | 1757589701 | ||
| 1.5 mL micro tube | Hisol | MT-15003 | |
| 10 mL syringe | 1757593161 | ||
| 15 mL conical tube | Thermo Fisher scientific | 14-959-53A | |
| 20xPBS | Tech & Innovation | BPB-9121-500mL | |
| 4-nitrophenyl-N-acetyl-β-D-glucosaminide | SIGMA | N9376 | |
| 5 mL polystyrene round-bottom tube | Life sciences | 352003 | |
| 50 mL conical tube | Thermo Fisher scientific | 14-959-49A | |
| Aluminium Fiol | BioFact | TS1-3330 | |
| Anti-mouse CD117(c-kit) | Biolegend | 135129 | keep at 2-8°C |
| Anti-mouse IgE mAbs | Thermo Fisher scientific | 11-5992-81 | keep at 2-8°C |
| Antiti-DNP-IgE | SIGMA | D8406-.2MG | keep at -20°C |
| Centrifuge | HANIL | 396150 | |
| D-(+)-gluouse | SIGMA | G8270 | |
| Dexamethasone | SIGMA | D2915-100MG | |
| DNP-BSA | Invitrogen | 2079360 | keep at -20°C |
| EDTA | Biofact | PB131-500 | |
| Fetal Bovine serum | Thermo Fisher scientific | 11455035 | |
| Gelatin | SIGMA | G1890 | |
| Glycine | JUNSEI | 27185-0350 | |
| hemocytometer | ZEISS | 176045 | |
| HEPES | Thermo Fisher scientific | 15630130 | |
| Histamine ELISA kit | Abcam | GK3275957-4 | keep at 2-8°C |
| Hotplate stirrer | Lab teach | zso-9001 | |
| Isoflurance | Troikaa | I29159 | |
| ketotifen fumarate salt | SIGMA | K2628 | |
| MCPT-1 ELISA kit | Thermo Fisher scientific | 88-7503-22 | keep at 2-8°C |
| Mouse Fc block | BD Biosciences | 553141 | keep at 2-8°C |
| Propidium iodiole | SIGMA | 81845 | keep at 2-8°C |
| RBC lysis buffer | Biolegend | 420301 | |
| Round-bottom 96 well | SPL-life sciences | 30096 | |
| Single use syringe filter | Startoriusag | 16555 | |
| Streptavidin microbeads | MilteryiBiotec | 130-048-101 | keep at 2-8°C |
| Triton X-100 | JUNSEIchemical | 49415-1601 | |
| TWEEN 20 | SIGMA | 9005-64-5 | |
| Water bath | CHANGSHINSCIENCE | 190107 |
参考文献
- Amin, K. The role of mast cells in allergic inflammation. Respiratory Medicine. 106 (1), 9-14 (2012).
- Holgate, S., et al. The anti-inflammatory effects of omalizumab confirm the central role of IgE in allergic inflammation. Journal of Allergy and Clinical Immunology. 115 (3), 459-465 (2005).
- Galli, S. J., Tsai, M. IgE and mast cells in allergic disease. Nature Medicine. 18 (5), 693 (2012).
- Roth, K., Chen, W. M., Lin, T. J. Positive and negative regulatory mechanisms in high-affinity IgE receptor-mediated mast cell activation. Archivum Immunologiae et Therapiae Experimentalis. 56 (6), 385-399 (2008).
- Finn, D., Walsh, J. Twenty-first century mast cell stabilizers. British Journal of Pharmacology. 170 (1), 23-37 (2013).
- Lu, Y., et al. Emodin, a naturally occurring anthraquinone derivative, suppresses IgE-mediated anaphylactic reaction and mast cell activation. Biochemical Pharmacology. 82 (11), 1700-1708 (2011).
- Demo, S., et al. Quantitative measurement of mast cell degranulation using a novel flow cytometric annexin-V binding assay. Cytometry: The Journal of the International Society for Analytical Cytology. 36 (4), 340-348 (1999).
- Passante, E., Ehrhardt, C., Sheridan, H., Frankish, N. RBL-2H3 cells are an imprecise model for mast cell mediator release. Inflammation Research. 58 (9), 611-618 (2009).
- Fukuishi, N., et al. Does β-hexosaminidase function only as a degranulation indicator in mast cells? The primary role of β-hexosaminidase in mast cell granules. The Journal of Immunology. 193 (4), 1886-1894 (2014).
- Malbec, O., et al. Peritoneal cell-derived mast cells: an in vitro model of mature serosal-type mouse mast cells. The Journal of Immunology. 178 (10), 6465-6475 (2007).
- Arock, M., Le Nours, A., Malbec, O., Daëron, M. . Innate Immunity. , 241-254 (2008).
- Befus, A., Pearce, F., Gauldie, J., Horsewood, P., Bienenstock, J. Mucosal mast cells. I. Isolation and functional characteristics of rat intestinal mast cells. The Journal of Immunology. 128 (6), 2475-2480 (1982).
- Yoon, S. C., et al. Anti-allergic and anti-inflammatory effects of aqueous extract of Pogostemon cablin. International Journal of Molecular Medicien. 37 (1), 217-224 (2016).
- Mierke, C. T., et al. Human endothelial cells regulate survival and proliferation of human mast cells. Journal of Experimental Medicien. 192 (6), 801-812 (2000).
- Hermes, B., et al. Altered expression of mast cell chymase and tryptase and of c-Kit in human cutaneous scar tissue. Journal of Investigative Dermatology. 114 (1), 51-55 (2000).
- Wendeler, M., Sandhoff, K. J. Hexosaminidase assays. Glycoconjugate Journal. 26 (8), 945-952 (2009).
- Russell, M., et al. Learned histamine release. Science. 225 (4663), 733-734 (1984).
- Darzynkiewicz, Z., et al. Features of apoptotic cells measured by flow cytometry. Cytometry. 13 (8), 795-808 (1992).
- Kitamura, Y., et al. Dexamethasone suppresses histamine synthesis by repressing both transcription and activity of HDC in allergic rats. Allergology International. 55 (3), 279-286 (2006).
- Grant, S. M., Goa, K. L., Fitton, A., Sorkin, E. M. Ketotifen. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic use in asthma and allergic disorder. Drugs. 40 (3), 412-448 (1990).
- Cook, E., Stahl, J., Barney, N., Graziano, F. Mechanisms of antihistamines and mast cell stabilizers in ocular allergic inflammation. Current Drug Targets-Inflammation & Allergy. 1 (2), 167-180 (2002).
- Schoch, C. In vitro inhibition of human conjunctival mast-cell degranulation by ketotifen. Journal of Ocular Pharmacology and Therapeutics. 19 (1), 75-81 (2003).
- Franchimont, D., et al. Inhibition of Th1 immune response by glucocorticoids: dexamethasone selectively inhibits IL-12-induced Stat4 phosphorylation in T lymphocytes. The Journal of Immunology. 164 (4), 1768-1774 (2000).
- Simmons, C. P., et al. The clinical benefit of adjunctive dexamethasone in tuberculous meningitis is not associated with measurable attenuation of peripheral or local immune responses. The Journal of Immunology. 175 (1), 579-590 (2005).
- Cavalher-Machado, S. C., et al. The anti-allergic activity of the acetate fraction of Schinus terebinthifolius leaves in IgE induced mice paw edema and pleurisy. International Immunopharmacology. 8 (11), 1552-1560 (2008).
- Dhakal, H., et al. Gomisin M2 inhibits mast cell-mediated allergic inflammation via attenuation of FcεRI-mediated Lyn and Fyn activation and intracellular calcium levels. Frontiers in Pharmacology. 10, 869 (2019).
- Galli, S. J., Wedemeyer, J., Tsai, M. Analyzing the roles of mast cells and basophils in host defense and other biological responses. International Journal of Hematology. 75 (4), 363-369 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved