Method Article
마이크로 계산된 Tomography 이미징을위한 준비로서 역행 관류 및 마우스 관상 Vasculature의 작성
요약
관상 혈관의 시각화는 심장 혈관 질병의 우리의 이해를 증진하기 위해 중요합니다. 여기에서 우리는 마이크로 계산된 Tomography (μCT) 이미징을위한 준비, radiopaque 실리콘 고무 (Microfil)로 murine 관상 vasculature을 perfusing위한 방법을 설명합니다.
초록
vasculature의 시각화는 여러 질병 상태를 이해를 위해 점점 더 중요 해지고 있습니다. 여러 기법 이미징 vasculature을 위해 존재하지만, 몇몇 작은 혈관의 1,2를 포함 해상도로 확대하면서 전체적으로 혈관 네트워크를 시각화 할 수 있습니다. 또한 많은 혈관 주조 기법 예제 3-5의 자세한 분석을 방지, 주변 조직을 파괴. 이러한 문제를 circumvents 한 가지 방법은 마이크로 계산된 Tomography (μCT)입니다. μCT 영상은 해상도 <10 미크론에서 스캔 혈관 네트워크의 3 차원 reconstructions를 생산 할 수 있으며 (예 : 조직학 및 morphometry) 후속 분석을 위해 그대로 6-11을 조직을 떠날 수 있습니다. 그러나 전직 생체내 μCT 방법에 의한 이미징 혈관 혈관이 radiopaque 화합물로 가득해야합니다. 따라서 μCT 이미징 제작한 vasculature의 정확한 표현이 조건으로하고있다혈관의 신뢰성과 완벽한 충전. 이 프로토콜에서는 μCT 이미징을위한 준비 마우스 관상 동맥 혈관을 작성을위한 기법을 설명합니다.
두 predominate 기술은 관상 vasculature 가득 채우는 것은 존재 : Langendorff 재관류 시스템을 통해 15-17 cannulation과 역행 대동맥의 관류 (또는 대동맥 아치 해제 지점) 12-14, 또는 전직 생체내 통해 생체내 인치 여기에서 우리는 특별히 모든 선박에 대해 작성하도록 설계되었습니다 생체내의 대동맥 cannulation 방법에 대해 설명합니다. 우리 모두는 모세 혈관뿐만 아니라, 혈관 네트워크의 동맥과 정맥의 양쪽 모두를 채우기 위해 작은 혈관을 통해 perfuse 수 Microfil라는 낮은 점도의 radiopaque 화합물을 사용합니다. 혈관이 압력 관류 시스템을 사용하여 버퍼로 perfused 후 Microfil으로 가득합니다. 그 Microfil가 작은 높은 저항 혈관을 채우고 확보하기 위해 대규모 지점 emanatin ligatecoronaries로 Microfil을 산란 대동맥에서 g. 일단 충전 일부 표본 Microfil을 짜면 심장 조직의 탄성 특성을 방지하기 위해, 완료 즉시 충전 후 접근이 주요 혈관 출구 포인트를 ligate. 따라서, 우리의 기술은 완전한 관상 혈관 네트워크의 시각화을 사용, 충전 대리인의 완전한 충전과 최대 보존에 최적화되어 있습니다 - 동맥, 모세 혈관과 정맥이 비슷하다.
프로토콜
1. 시작하기 전에 준비
- 각각 PBS에서 Vasodilator 버퍼 (4mg / L Papaverine + 1g / L은 PBS에 아데노신) 또는 4 % Paraformaldehyde (PFA)로 압력 재관류 장치의 각 측면을 채웁니다.
- 1:100 헤파린의 0.1 ML (5000U/ml 주식)로 작성하고 최대 베벨과 함께 ~ 120도 각도로 바늘을 벤딩하여 1/2cc 인슐린 주사기를 (영구적으로 연결된 29G ½ "바늘로) 준비합니다. 수행 0.3 ML 포화 KCl 용액으로 가득 한 ML의 주사기 (26G ½ "바늘로)와 동일.
2. 가슴을 노출하고 대동맥을 cannulating
- 선택의 마취제를 사용하여 마우스를 마취. (우리는 케타민을 / Xylazine 혼합물의 과다 사용합니다. 130 밀리그램 / kg 케타민을와 염분의 8.8 밀리그램 / kg Xylazine의 IP 주사)
- 해부 트레이, 복부 측면까지에 anesthetized 마우스를 핀. 중간선 절개로 복강을 열고 피부를 철회장기를 노출합니다. 후부 베나 카바 (PVC)의 영역을 폭로 한쪽으로 창자를 이동합니다.
- PVC로 헤파린 용액을 주사. 당신은 바늘을 추출로 누출되는 것을 방지하고 PVC 벽의 혈전 및 밀봉 때까지 몇 초 동안 누르고있는 솜 스쳐지나 작은 주걱과 바늘 구멍을 포괄합니다. 마우스 순환에 걸쳐 분산하기 위해 헤파린을위한 2-3분 기다립니다.
- 당신이 고동 치는 심장을 관찰할 수 있도록 격막과 흉곽 해부. 천천히 심장 체포 때까지 PVC에 KCl 용액을 주입.
- 피임기구의 지역 앞부분은 그대로두고, 격막 및 소비세 마우스 후부 부분 아래의 모든 장기를 제거합니다. 심장에 근위 부분은 후속 단계에서 찾을 수 있도록 쉽고 피임기구 근처 PVC 이발하는데 신중하다고, 횡경막을 제거합니다.
- 대동맥의 컷 끝을 찾습니다. 대동맥 아래 앞부분 몇 mm 아프로 6-0 꼰 실크 봉합사 중 하나 긴 길이를 놓으십시오m 봉합이 다시 자체 배로되는 등 컷 끝. 대동맥 아래에서 봉합사의 2 가지가되도록 반으로이 더 이상 봉합 잘라. 대동맥 (그림 1A, B)의 절단 끝에 angiocatheter를 넣고 제자리에 angiocatheter 잡고 밖으로 새어에서 대동맥 내의 백 압력을 방지하기 위해 이중 매듭으로 각 봉합을 묶어.
3. 관류 및 Microfil 분사
- 압력 재관류 장치 (그림 2)에 angiocatheter를 연결하고 100-110 mmHg의 운전 압력으로 관류 장치를 펌핑하여 vasodilator 버퍼 (그림 1C)와 혈관을 perfusing 시작합니다. 버퍼가 액체를 확보하여 coronaries 통해 perfusing되었는지 확인 더블은 PVC에서 종료됩니다. 최소 3 분 동안 perfuse 계속 또는 PVC를 종료 유체는 분명까지. (perfusing하면서 다음 단계를 계속합니다.)
- 갈비와 핀 뒤로 (또는 제거) 가슴을 노출하는 ribcage 해부. 일단 노출, CA 수심장이 거즈의 버퍼 젖은 부분에서 마음에 버퍼의 방울을 쥐어 의해 말리면 않도록 reful. 대동맥 아치를 폭로 thymus을 치워. 액체를 보장하기 위해 6-0 꼰 실크 봉합사를 사용하여 세 가지 주요 대동맥 가지를 Ligate 것은 오히려 이러한 큰, 낮은 저항 혈관 (그림의 1D)를 통해보다 coronaries 통해 우회합니다.
- 15 분동안 정착액과 함께 마음을 Perfuse 후 최소한 2 분 동안 Vasodilation 버퍼와 린스. 한편, 주사 후 심장 (그림 1E) 밖으로 유출 Microfil을 방지하기 위해 양쪽 앞부분 베나 Cavae을 ligate. 장소 PVC 및 대동맥 주위 봉합하지만, 충전 후 때까지 그들을 조여하지 않습니다.
- Microfil을 준비합니다 (시약의 테이블에서 지정한)와 1 ML의 주사기에 그 파일을로드합니다. 카테터를 (Microfil 주사기로 관류 관에서 전환할 때 기포의 도입을 방지하기 위해있는만큼) 충당하기 위해 충분한 물을 절개 트레이를 채웁니다. 재관류 AP의 연결을 해제카테터의 paratus하고 준비된 Microfil에 주사기를 연결합니다.
- 관상 동맥의 좋은 충전합니다 (무화과 1 층, 3A) 분명 때까지 대동맥으로 Microfil을 주사 : 동맥 먼저 작성되며, 다음 Microfil는 Microfil의 색상과 조직 플러시으로서 모세 혈관에 "누설"합니다. 일단 정맥쪽에, Microfil의 소수성 자연은 작은 혈관에서 나온다로서 초기에는 독립된 분야로 표시하기 위하여 그것을 일으 킵니다. 연속 열이 혈관을 가득 채우고 때까지 Microfil을 주입 계속합니다. Microfil이 혈관 내에서 지속되면 완전 충전이 분명있을 것이고, 그것은 PVC로 종료됩니다.
- 충전이 완료되면 신속하게 이전에 혈관 밖으로 Microfil을 짜면 심장 조직의 탄성 특성을 방지하기 위해 PVC와 대동맥 주위에 배치했습니다 봉합을 조입니다.
- (해부 트레이에서 물에 젖었 서부 유럽 표준시 거즈로 마음을 커버)은 밖으로 건조를 방지하고, Microfil가 polymerized 때까지 그것이 실온에서 약 1 시간 동안 앉아 알려주세요. 같은 리프팅이나 심장의 뒤쪽에 채워 선박의 초기보기를 얻기 위해 시도에 마음을 돌려 같은 중합 과정 동안 마음에 어떤 외부 압력을 피하십시오. 이것은 Microfil에서 봐야 원인, 심장보다 탄성 영역으로 일부 선박에서 Microfil를 당겨 수 있습니다.
- 마음을 제거하고 4에서 하룻밤 4% PFA에 게시 - 수리 ° C. 그렇다면 4 ° C.에 70 % 에탄올에 저장 심장 vasculature 이제 μCT 이미징을위한 준비가되었습니다.
4. 대표 결과
효과적 Microfil 의해 perfused되는 선박은 선박에 걸쳐 지속 깨지지 Microfil (그림 3A)를해야합니다. 관상 혈관의 작성의 범위는 눈으로에서 재판받을 수 있으며, 정맥은 epicardially 18에 위치하고 있으며, 쉽게 (그림 3A, 화살촉) 관찰 수 있으며, 동맥,이것은 18보다 intramyocardial있는 심장의 표면 (그림 3A, 화살표)를 통해도 볼 수 있습니다. 심장 조직은 모세 혈관의 매우 높은 밀도를 가지고로서 모세관 충전은 또한 분명하다, 따라서, 언제 모세 혈관 채우기는 심장 조직 Microfil의 색상 (그림 3A, 별표)로 플러시됩니다. 따라서 작성하는 데 실패하는 혈관 네트워크는 Microfil의 부족 (그림 3B, C)로 인해 눈에 띄게 될 것이다.
Microfil의 소수성 자연이 그 자체로 계약 가득한 혈관 내에서 "휴식"을 일으키는 원인이되므로 Microfil (그림 3B 관련 별표)에 불연속은 종종 나타납니다. 혈관 내의 압력이 심장에서 혈관 출구 포인트의 타이 오프 적정을 통해 유지하는 경우이 "휴식"이 감소될 수있다. 다른 불연속은 microfil 내의 기포로 인해 발생할 수 있습니다. 재관류 AP에서 전환할 때 공기의 도입을 방지하기 위해 angiocatheter이 완전히 물에 빠져들되어 있는지 확인 Microfil 주사기로 paratus. 공기 방울이 도입되면, 그것은 종종 거품이 관상 동맥 혈관의 통해 밀고 나가는 때까지 Microfil 재관류를 계속하여 간단하게 제거할 수 있습니다.
혈관 침대 부분 (그림 3B, 화살표)가 차단되는 경우 혈관 네트워크는 완전히 채울 수 없습니다. 헤파린은 혈전의 형성을 억제하지만, 가끔 막혀 여전히 이전 절차, 기타 알려지지 않은 요인으로 인해를 시작으로 불완전하게 헤파린 재관류로 인해 발생할 수 있습니다. 차단이 발생하면 혈관 채우기를 완료하기 위해 차단을 dislodging위한 방법은, 우리의 지식,이 없습니다. 너무 작은 압력 Microfil 모든 혈관 침대와 모세관 네트워크 (그림 3C)에 강제되지 않습니다 충전 중에 사용하는 경우 불완전한 충전도 발생할 수 있습니다. 반대로, 너무 많은 압력은 모세 혈관은 (그림 3D) 주변 조직에 Microfil을 터뜨릴하고 extravasate시킬 수 있습니다.
files/ftp_upload/3740/3740fig1.jpg "고도 ="그림 1 "/>
1 그림. Microfil 재관류 제도의 개요. () 대동맥과 PVC는 다이어프램의 약 수준에서 잘라 있습니다. (B) 오름차순 대동맥은 angiocatheter로 cannulated있다. (D) 대동맥 아치 오프 세 가지 주요 지점은 출혈도 잡았하는 동안 (C) Vasodilation 버퍼는 압력 재관류 장치 (사진에 없음)에 의한 혈관,를 통해 perfused됩니다. 모두 앞쪽에 베나의 Cavas은 출혈도 잡았하는 동안 (E) 4% PFA는 coronaries 통해 perfused됩니다. 그것은 PVC에서 종료 관찰되기 전까지 (F) 주사기를 사용하여 Microfil는 coronaries 통해 perfused됩니다.

그림 2. 관류 장치가. 두 Erlenmeyer의 flasks, Vasodilation 버퍼 또는 4퍼센트 PFA 하나 가득 각각은 입사하고 sidearms에 연결된 튜브를 통해 압력됩니다. 시스템의 펌핑 매뉴얼을 통해 가압전구 및 압력 게이지는 모니터링 및 압력의 유지를 허용하도록 flasks 중 하나에 연결됩니다. 작은 튜브가 고무 stoppers 통해 아래 각 플라스크에 액체로 확대. 압력이 작은 튜브 밖으로 각 플라스크에서 sidearms 펌프 유체으로 들어갔다. 튜브 그러면 한 번에 하나의 플라스크에서 흘러 유체 있습니다 꼭지에 병합.
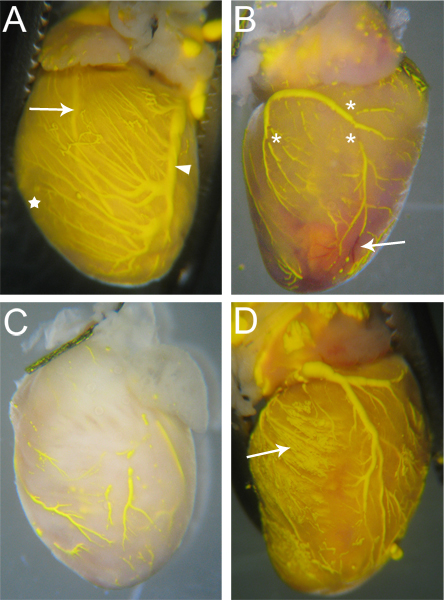
그림 3. Microfilled 하트를 드셔보세요. () 잘 채워진다 선박은 (있는 경우) Microfil에서 봐야을 몇 가지게 될 것이며, 심장 조직이 채워진 모세관 (별표 및 C 비교)에 의한 Microfil의 물들어 색이 될 것입니다. 두 동맥 (화살표 - 왼쪽 앞부분 내림차순 동맥)과 정맥 (화살촉 - 왼쪽 관상 정맥)은 심장 표면을 통해 볼 수 있습니다. (B) 완전한 마이크를 방해 일부 선박의 microfil에서 봐야 (별표)뿐만 아니라 막혀있는 마음침투력을 rofil. 차단된 혈관은 혈액이 재관류 과정에서 밖으로 플러시되지 않았습니다으로, 빨강 (화살표) 남아 있습니다. 불완전하게 가득 차 있었다 혈관과 (C) 심장. 조직은 Microfil가 모세 혈관으로 침투하지 않은 나타내는 Microfil의 노란 색깔에 찍은되지 않았습니다납니다. (D) 마음이 어디 Microfil가 주변 조직 (화살표)으로 누출 원인, 채우는 동안 모세관 파열.
토론
심장 조직은 매우 높은 신진 대사 수요를 가지고 있으며, 따라서 관상 vasculature에 의해 전달되는 혈액의 영양분과 산소의 지속적인 공급이 필요합니다. 선박 협착과 막힘으로 인해 관상 동맥 기능을 감소 관상 혈관, 환자는 조직 hypoxia와 국소 빈혈을 초래할, 그리고 심근 경색과 심장 근육에 치유할 수없는 손상에 대한 위험에 영향을받는 환자를 넣을 수 있습니다. 이러한 혈관의 질병 상태에 대한 이해가 필요하고, 관상 혈관을 공부하는 능력에 중요한 것은 vasculature의 시각화입니다. 여기서는 radiopaque 소재로 vasculature를 작성하여 전직의 생체내 이미징을위한 murine 관상 vasculature을 준비하기위한 방법을 제시한다. 이 프로토콜은 특히 모세 혈관을 포함한 모든 관상 동맥 혈관의 완전한 충전과 이후 시각화를 보장하기 위해 설계되었습니다.
모든 모세 혈관을 완전히 충전, 충전 agen을 보장하려면t, Microfil은 혈관 네트워크 내에서 작은, 높은 저항 혈관에 Microfil을 강요하게 될 부분적으로 폐쇄 시스템으로 주입해야합니다. 시스템을 작성 생체내에서 우리 안에 이러한 부분적인 폐쇄를 만들려면, 우리는 대동맥 아치에서 분기 세 크고, 낮은 저항 동맥 ligate. 이것은 다른 모든 잠재적인 "누설"점, 나머지 혈관 (주로 늑간 동맥) 제외하지는 않지만 어떤 압력이 관상 동맥 혈관 시스템의 완전한 충전을 방해하지 않는 그들을 통해 잃어버린 것을 충분히 작은 수 있습니다. Microfil 마음의 모든 혈관을 perfused되면 심장과 혈관 조직의 타고난 탄성 자연은 어떤 선박의 Microfil 뽑는 것입니다. Microfil의 손실을 방지하기 위해, 우리는 관상 vasculature 완전히 perfused 후 모든 크고 접근 출구 지점, 즉 모두 우수한 베나 cavae, 후부 대정 맥과 대동맥을 ligate. 이러한 방법으로 압력 미터Microfil가 Microfil 정상적인 생리적 혈압 아래 혈관 구조에 부합 수 있도록 polymerizes 때까지 마음에 aintained.
모세 혈관의 시각화가 필요하지 않은 경우 또는, 그것은 단지 동맥 또는 유일한 정맥 혈관 침대를 채울 수도 있습니다. Microfil 더보기 점성 버전은 높은 점도 희석제를 (FlowTech에서 제공)을 사용하여 혼합 수 있습니다. 더 많은 점성 perfusate은 모세 혈관을 뚫을 수없는, 그리고 정맥 측면에서 perfused 따라서에만 동맥, 또는 유일한 혈관의 시각화 수 있습니다. 또한, 프로토콜은 쉽게 다른 종의 또는 비상 성인 생쥐에 적용할 수 있습니다 여기서 제시. 적절하게 동물의 크기와 일치하도록 절차를 축소하는 것은 단순히 누수 최소화하고 스트레칭을하거나 위반을 방지하기 위해 같은 있도록 카테터 및 재관류 튜빙은 동물의 대동맥에 적절하게 크기가 필요합니다. 체액의 볼륨 (예 : 헤파린, 주입포화 KCl, 그리고 Microfil)도 적절하게 조정해야합니다.
우리의 프로토콜은 특별히 μCT 의해 Microfil 및 이미징의 주입을 위해 설계되었습니다 그러나, 그것은 쉽게 μCT 분석, 또는 다른 전직의 생체내 이미징 기법을위한하거나, 다른 충전 대리인에 맞게 조정 할 수 있습니다. μCT 호환 fillers를 찾는 경우 radiopaque 염료의 몇 가지 옵션이 다른 이미징 방법 (예 : 아크릴)를 통해 vasculature를 작성하고 연구에 사용되는 많은 물질로있다 같은 리드 안료 9 또는 오스뮴 솔루션으로 무선 불투명 재료로 들어갈 수 있습니다 3. 에 관계없이 활용 충전 에이전트, μCT 이미지는 결과가 혈관 측정을 제공할뿐만 아니라 채워진 관상 혈관 6,7,14,19의 분기 패턴에 대한 구조적인 정보를 3D 모델로 복원 할 수있는 장점을 제공합니다. 또한, μCT에 의한 영상 따라서 추가를 위해 수 있도록 주위의 조직을 유지스캔 후 alyses. 따라서 채워 및 스캔의 마음은 histological 분석을 위해 처리될 수 있으며, 다양한 마커에 대해 묻다 섹션은 동맥 / 정맥 정체성, 평활근 코트의 존재, 또는 추가 histological 인덱스 신원을 확인하도록 μCT 데이터를 정렬하실 수 있습니다.
기타 일반적인 혈관 이미징 기술은 또한 혈관 충전을 필요로하고 우리 프로토콜은 쉽게 이러한 다른 충전 요원의로 coronaries을 perfusing위한 적응하실 수 있습니다. 전자 현미경을 스캔하면 (SEM) 혈관을 충전 후 부식 캐스팅이라는 과정에서 설립 혈관 캐스트에서 떨어져 부드러운 조직을 해소해야합니다. 주변의 연부 조직의 지원없이 혈관의 모양을 유지하기 위해서는 충전 에이전트 강하고 아닌 취성이어야합니다 : 흔히 아크릴 수지 (예 : Mercox, Batson의) 3,20,21. SEM은 μCT 이미징 22 그것과 크게 우세 스캔 해상도, 부식 캐스트를 제공하고 있지만ING 절차는 별도의 조직 분석을 방지할 조직을 파괴합니다. 관상 vasculature의 전직의 생체내 이미징, 광학 프로젝션 Tomography (OPT), 또 다른 방법은 알칼리성 인산 가수 분해 효소에 의해 생산되는 자주색 침전물 같은 precipitates 표시 또는 니어 가시 광선을 감지하고, 따라서 chromogenic 외에도 형광 신호의 검출을 허용 수 BCIP / NBT의 전환 (5 - 브로모 -4 - 클로로 -3 - 인돌릴 phosphate/4-nitro 블루 tetrazolium) 23-25. 형광이나 중 통해 이러한 전체 마운트 면역과 같은 방법을, 또는를 통해 비 작성 : 선박의 시각화 따라서 형광 물질 (dextran 26 풍의 폴리 우레탄 수지 3 또는 플루오레신 예 PU4ii)로 작성하여 어느 수행할 수 histochemical chromogenic 석출물 (예 BCIP / NBT) 23. OPT 이미징은 μCT (1 주변 마이크론까지)의 그것보다 약간 더 좋은 해상도를 얻을 수 있지만, 충전 및 immunodete 모두ction 방법은 주변의 연부 조직은 화학적으로 histological 분석 사후 검사에 대한 몇 가지 항원을 혼란 수도, 삭제되어야합니다.
이 영상 혈관 충전하거나 면역이 필요하지 않습니다 관상 vasculature을위한 여러 가지 방법도 있으며, 그러한는 생체내에서 수행할 수 있습니다. 한 기술, 대비 향상된 고해상도 초음파 (CEHRUS)은 대비 요원으로 기체 충전 microbubbles을 활용합니다. 혈류에 이러한 microbubbles의 사출 다운 모세관 수준에 실시간으로 유량 측정과 혈액의 흐름을 시각화은 가능하지만, 그것은 몇 군데 혈관 2,27-31의 3D보기를 제공하지 않습니다. 또 다른 방법은, 자기 공명 혈관 조영술 (MRA)도 이미지 관상 동맥 혈관 32-34과 MRA의 최근 발전에 사용되고 실시간 혈류 측정들에게 35,36을 얻기 위해 자사의 이미징 기능을 확장했습니다. MRA는 몇번의 3D reconstructions를 만들 수 있지만ssels 군데, MRA의 해상도는 현재 약 100 미크론으로 제한, 따라서 작은 혈관 (모세 혈관, arterioles 및 venules)를 식별하는 데 실패합니다.
CEHRUS과 MRA 모두 살아있는 동물을 수행할 수 있기 때문에, 그들은 반복과 비 invasively 모니터링 혈류와 혈관 개발의 이점을 제공합니다. 그러나 MRA의 비교적 낮은 해상도와 CEHRUS에서 3D 성능의 부족은 전체적으로 관상 네트워크의 이미징을 배제. 생체내 기술의이 시간이 지남에 혈관 네트워크의 기능에 관한 중요한 정보 (즉, 유량 데이터)를 제공하는 동안 따라서, 혈관 충전 대리인 또는 면역을 필요로 전직 생체내 이미징 기법, 관상 혈관 시스템의 고해상도 3 차원 정보를 얻기위한 중요 . 끝점 예 생체내 이미징과 생체내 시간 코스 분석에 결합하면 관상 vasculature 연구를위한 강력한 시스템을 제공합니다.
공개
마우스는, 워싱턴 대학의 기관 동물 케어 및 사용위원회에 의해 건강의 미국 국립 연구소 (NIH 발행 번호 85-23으로 출판 실험실 동물의 관리 및 이용 안내에 따라 승인된 방법으로 처리되었습니다 ) 1996 개정.
감사의 말
우리는 프로토콜 박사 마이클 Simon 씨의, 닥터 킵의 Hauch, 그리고 일반적인 토론을위한 그들의 실험실의 두 구성원들의 초기 실험 용 박사 켈리 스티븐스 감사드립니다.
이 작품은 NIH 보조금 HL087513 및 P01 HL094374에 의해 지원입니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 |
| 한 ML의 주사기 | Becton 디킨슨 | BD-309602 | |
| 영구적으로 연결된 29G ½ '바늘과 1/2cc 인슐린 주사기 | Becton 디킨슨 | BD-309306 | |
| 2 "X 2"거즈 패드 | Med101store.com | SKU 2,208 | |
| 24G 잡았다 "Angiocath IV 카테터 | Becton 디킨슨 | BD-381112 | |
| 26G ½ "게이지 바늘 | 여윈 "> Becton 디킨슨 | BD-305111 | |
| 아데노신 | 시그마 | A9251 | 1g / Vasodilation 버퍼를위한 PBS에서 L (Papaverine 포함) |
| 각도 Graefe의 집게 | 파인 과학 도구 | 11052-10 | |
| 면과 스쳐 applicators : 6 "이외의 멸균 | 추기경 건강 | C15055-006 | |
| 곡선 외과 가위 | 파인 과학 도구 | 14085-09 | |
| 해부 입체경 및 광원 | 니콘 | NA | NA |
| 해부 트레이, 11.5 X 7.5 인치 | 콜 - Parmer | 요 - 10915-12 | 마우스를 아래로 달아 위해 타르로 가득 |
| 파인 곡선 집게 | Aesculap | FD281R | 게 2 |
| 헤파린 5000 U / ML 주식 | APP 제약 LLC | NDC 63323-047-10 | 물에 1:100 희석 |
| KCl | 어부 | P217 | H2O의 포화 용액 |
| Ketamin (Ketaset), 100 밀리그램 / ML 주식 | 포트 닷지, 오버랜드 파크, 캔사스, 미국 | NDC 0856-2013-01 | 0.9 % s에 Xylazine과 함께, 130 밀리그램 / kg 체중으로 혼합일직선으로하다 |
| Microfil | 흐름 테크 | MV-122 (노랑). 기타 색 옵션도 사용할 수 있습니다. | 경화 요원의 부피에 의해 10 %, 중량으로 1:1 섞는다. 그것이 잘 혼합한지 단지 분사하고, 소용돌이 전에 준비 |
| 비 멸균 봉합해 : 6 대 0으로 꼰 명주실 | 하버드 장치 | 723,287 | |
| Papaverine | 미국 리젠트 주식 회사 | NDC 0517-4010-01 | 4mg / Vasodilation 버퍼를위한 PBS에서 L (아데노신 포함) |
| Paraformaldehyde | 시그마 | P6148 | 4 % 용액의 준비 |
| 관류 장치 | 그림 2 참조 | ||
| 봄 가위 | 파인 과학 도구 | 15018-10 | |
| Xylazine (Anased), 20 밀리그램 / GL 주식 | 로이드 실험실 | 나다 # 139-236 | 0.9 %의 식염수에 Ketamin과 8.8 밀리그램 / kg 체중으로 혼합 |
참고문헌
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유