Method Article
脆弱Xメッセンジャーリボ核タンパク質を欠くヒト人工多能性幹細胞由来アストロサイトの作製とキャラクタリゼーション
要約
ここでは、ヒト人工多能性幹細胞の機能的な前脳特異的アストロサイトへの分化を促進するプロトコルについて説明します。これにより、脆弱X症候群などの神経発達障害の病因におけるグリア細胞の役割を調査し、他の脳障害のモデリングが可能になります。
要約
自閉症スペクトラム障害と知的障害の主要な遺伝性原因である脆弱X症候群(FXS)は、げっ歯類モデルを使用して広く研究されています。最近では、ヒト幹細胞由来のモデルシステムも、FXSの病態生理学に関するメカニズムの洞察を得るために使用されています。しかし、これらの研究は、ほぼニューロンのみに焦点を当てています。さらに、健康や疾患における神経機能におけるグリアの重要な役割についての証拠が増えているにもかかわらず、ヒトのアストロサイトがFXSによってどのように影響を受けるかについてはほとんど知られていません。
そこで、本研究では、脳の発達における主要な時空間的マイルストーンを捉え、神経膠形成のプロセスとも整合するプロトコルの開発に成功しました。これらを組み合わせることで、神経発達障害の研究に役立つフレームワークが提供されます。まず、ヒト人工多能性幹細胞を、デカペンタプレッグ(SMAD)阻害に対する母親の二重サプレッサーと小分子を用いて神経外胚葉系譜にパターン化しました。その後、特異的な成長因子とサイトカインを利用して、コントロール(CTRL)とFXS患者由来の星状細胞前駆細胞(APC)を作製しました。分化性サイトカインである毛様体神経栄養因子によるAPCの治療は、前駆細胞を調節し、アストロサイト成熟に向けて推進し、前脳特異的なグリア線維性酸性タンパク質発現アストロサイトをもたらしました。
これらのアストロサイトは、ATPの適用に対するカルシウム応答からも明らかなように機能的であり、FXSでは解糖系およびミトコンドリア代謝の調節不全を示すことがわかりました。まとめると、これらの知見は、神経発達障害によって引き起こされるアストロサイト機能の変化の細胞自律的および非細胞自律的結果を調査するためのヒト起源の有用な実験プラットフォームを提供します。
概要
脆弱X症候群(FXS)は、知的障害および自閉症スペクトラム障害(ASD)の一般的な遺伝型であり、脆弱Xメッセンジャーリボ核タンパク質1(FMR1)遺伝子(OMIM:#300624、https://www.omim.org/entry/300624)によって産生される脆弱Xメッセンジャーリボ核タンパク質(FMRP)の欠如によって引き起こされます。FMRPは、mRNA翻訳の制御、mRNA顆粒の形成と輸送、およびマイクロRNAを介した遺伝子発現の制御に役割を果たします1。したがって、FMRPの喪失は、脳の発達だけでなく、成人の脳機能にも影響を及ぼします。FMR1のmRNA転写レベルと脳内のFMRPの免疫染色の両方で、ニューロンの発現が高く、グリア細胞でも有意に発現していることが示されています2。しかし、FXSの動物モデルを用いた初期の研究の大部分は、主にニューロンとその機能の異常に焦点を当てていました。そのため、FXS3におけるグリアの役割についてはほとんど知られていません。伝統的に「受動的支持」細胞4と考えられてきたが、アストロサイトがシナプス形成の促進7、神経回路の発達の精緻化8、神経伝達物質のリサイクル9など、幅広い神経機能5,6を媒介する上で重要であることを示す証拠が蓄積されている。並行して、疾患の病因におけるアストロサイトの役割についての証拠が増えており、多くの神経学的状態がアストロサイト機能障害と関連しています10。
FXSの動物モデルを用いた初期の研究の多くは、FXSを治療するためのニューロンのさまざまな分子標的の同定と検証に重点を置いていましたが、これらの前臨床所見は必ずしも成功した臨床結果につながったわけではありません。さらに、最近の臨床試験の挫折も、人間ベースのモデルシステムの必要性を強調しています。ヒト幹細胞由来脳細胞に基づく神経疾患のモデルは、動物実験からのメカニズムの洞察と患者の臨床転帰の限定的な成功との間のギャップを埋める強力な戦略を提供します。しかし、これらの研究のうち、アストロサイトに焦点を当てたものはほんの一握りで、それも主に脊髄起源のアストロサイトに焦点を当てています。これは、アストロサイトの構造と機能が脳領域間で異なることを示す研究に照らして関連性があります11,12。したがって、ヒトのアストロサイトにおける疾患による変化をより深く理解するためには、アストロサイトのこれらの脳領域特異的な違いも考慮に入れる必要があります。しかし、前脳に特異的なヒト幹細胞由来アストロサイトを用いた神経発達障害のモデルは、まだ比較的研究が進んでいない13。したがって、これらのギャップに対処するために、FXS変異を持つ患者由来の人工多能性幹細胞(iPSC)から前脳特異的星状細胞を生成するためのプロトコルについて説明します。さらに、アストロサイトが機能的であり、代謝の変化を示すことを示します。
プロトコル
ヒト人工多能性幹細胞(hiPSC)(表1)を用いたすべての実験は、適切な施設の規制当局の承認を得た後に実施しました。 図1A は、成熟した前脳特異的アストロサイトに対するhiPSCの完全な分化プロトコルを表しています。
1. ヒトiPS細胞の維持・拡大
- iPS細胞をプレーティングする1日前に、6ウェルディッシュに1:60で希釈したマトリゲル(細胞外マトリックス[ECM])をAdvanced DulbeccoのModified Eagle Medium/Ham's F-12(DMEM/F12)でコーティングし、2〜8°Cで保存します。
注:マトリゲルコーティングされたディッシュを2〜8°Cで>5日間保管すると、時間の経過とともにECMのタンパク質分解を引き起こす可能性があるため、避けてください。ディッシュの乾燥を避けるために、6ウェルディッシュの1ウェルあたり最低1mLの1:60希釈マトリゲルをコーティングし、ディッシュ全体に均等に広げます。同じ日に使用する場合は、プレートを加湿インキュベーターに37°C、5%CO2 で1時間保管してください。 - hiPSCを培養する日には、コーティング材を剥がし、1 mLの完全Essential 8培地(E8基礎培地とEssential 8サプリメント)をROCKインヒビターとともに最終濃度の1倍で加え、37°C、5%CO2 インキュベーターに皿を保管してから、hiPSCを添加します。
- ヒトiPSCを完全なE8培地にROCK阻害剤とともに最終濃度の1倍で再懸濁し、コロニーの付着を改善します。
注:大量の培地を調製しないでください。最大3〜4日間のみ準備し、2〜8°Cで保存します。 - 翌日、細胞が80%コンフルエントになるまで(約4〜5日)、ROCK阻害剤を含まない完全なE8培地を補充します。
- それらが80%のコンフルエントに達したら、コロニーを酵素的に分離します。
- iPS細胞を継代するには、使用済み培地をディッシュから取り出し、コラゲナーゼ(2 mg/mL)とディスパーゼ(1 mg/mL)を1:1の割合で温めた(37°C)混合物をウェルあたり1 mLずつ加え、37°Cで20〜30分以上インキュベートしてiPS細胞コロニーを浮き上がらせます。
注:皿を37°Cに20〜30分以上放置しないでください。この期間を過ぎると、コロニーは崩壊し、細胞は死滅します。
- iPS細胞を継代するには、使用済み培地をディッシュから取り出し、コラゲナーゼ(2 mg/mL)とディスパーゼ(1 mg/mL)を1:1の割合で温めた(37°C)混合物をウェルあたり1 mLずつ加え、37°Cで20〜30分以上インキュベートしてiPS細胞コロニーを浮き上がらせます。
- コロニーが持ち上がり始めたら、インキュベーターから皿を取り出し、2 mLのダルベッコリン酸緩衝生理食塩水(DPBS)を追加して酵素活性を中和します。
- DPBSでコロニーをこすり落とし、広口径の10 mL血清ピペットを使用して懸濁液を15 mLコニカルチューブに回収します。
- 懸濁液を2〜3回穏やかに回転させ、10mLの血清ピペットを使用してコロニーを分解し、コロニーが落ち着くまで待ちます。
注:コロニーを単一細胞にしないでください。これにより、細胞が皿に付着せず、細胞死が増える可能性があります。さらに、それらを大きなコロニーとして残さないでください。これにより、後でコロニーがより分化されます。 - コロニーが落ち着いたら(約2分後)、DPBS酵素混合物を吸引し、チューブ内に約1 mLを残します。
- チューブに2mLのDPBSを加え、軽くたたいてコロニーを混合し、コロニーを沈殿させます。この2回を繰り返して、コロニーからすべての残留酵素を取り除きます。2回目の 洗浄後、できるだけ多くの上清を取り除き、コロニーを1 mLの完全E8培地に再懸濁し、手順1.2〜1.3で説明したように、新しく準備した皿にプレートします。
- あるいは、将来の拡張と使用のために、10%ジメチルスルホキシド(DMSO)を凍結保護溶液として使用して、コロニーの一部を凍結保存します。
- 凍結保護剤溶液として90%完全E8培地と10%DMSOを混合して、新たに凍結保存培地を調製し、使用するまで2〜8°Cで保存します。
- 凍結保存するには、手順1.5〜1.10に従います。
- ステップ1.10では、2回目の 洗浄後、コロニーが沈殿し、上清が除去されるのを待ちます。コロニーに、新たに調製した冷凍結保存培地1 mLを加え、クライオバイアルに移します。
注:凍結保存培地をコロニーに加えた後、内容物を速やかにクライオバイアルに移します。DMSOは細胞に損傷を与える可能性のある凍結保護剤であるため、遅延すると復活率が低下する可能性があります。 - すぐにクライオバイアルをクライオボックスに移し、-80°Cの冷凍庫で一晩保管します。
- 翌日、将来の使用のために、すべてのクライオバイアルを液体窒素タンク(LN2 タンク)に移します。
注:hiPSCは、異常がないかGバンディング(補足図S1)を使用して定期的に核型を決定し、多能性のために免疫細胞化学を使用して特徴付け(図1B)、マイコプラズマについてテストする必要があります。- 免疫細胞化学を用いて iPSC を解析するには、1:60 マトリゲルコーティングを施したオートクレーブ処理した 13 mm ガラスカバースリップにコロニーをプレートします。40%コンフルエントになったら、細胞をPBS-T(PBS-0.1% Tween 20)で洗浄し、4%パラホルムアルデヒドで10分間固定し、0.3% Triton X-100をPBSに10分間浸透させ、PBSに3%ウシ血清アルブミン(BSA)を1時間かけてブロックして、非特異的結合を防ぎます。
- ブロッキング後、培養物を一次抗体と1時間インキュベートした後、PBS-Tで3回各5分間洗浄し、続いて対応する二次抗体(Table of Materials)を暗所で1時間洗浄します。
- 封入剤でスライドガラスにカバーガラスをマウントし、405nm、488nm、561nm、633nmの共焦点レーザースキャンで画像を取得します。512 x 512ピクセルで画像をキャプチャします。Zステップサイズを0.5μm、ピンホール径を1エアリー単位で設定します。
2. アストロサイト前駆細胞(APC)の作製と評価
- ステップ 1.5-1.10 で述べたように hiPSC を酵素的に持ち上げ、50% Iscove's Modified Dulbecco's Medium (IMDM)、50% Ham's F-12 Nutrient Mix (F12)、5 mg/mL BSA、1% Chemically Defined Lipid Concentrate (CD-Lipid)、450 μM モノチオグリセロール、7 μg/mL インスリン、15 μg/mL トランスフェリン、 前脳パターニングマイトジェンN-アセチルシステイン(1 mM)、LDN 193189(0.1 μM)、およびSB431542(10 μM)を7日間補充した1%ペニシリン-ストレプトマイシン。
注:低分子阻害剤SB431542およびLDN-193189(LDN)は、骨形成タンパク質およびトランスフォーミング成長因子-βシグナル伝達経路の阻害剤です。
この時点から、培地は 2 日に 1 回、または月曜日/水曜日/金曜日のプロトコルに従って補充されました。 - 細胞懸濁液を40rpmの眼窩シェーカーに7日間常酸素条件下で置き、皮質圏の発達を助けます(図1A)。
- 8日目に、皮質圏を、1%抗生物質-抗真菌薬、1%N2サプリメント、1%グルタミン代替品、0.1%B27サプリメント、および2.5 ng / mL塩基性線維芽細胞成長因子(bFGF)を含むAdvanced DMEM / F12を含む細胞増殖培地に7日間移します。
- 1% Antibiotic-Antimycotic、1% N2、1% glutaine substitute、0.1% B27 supplement、20 ng/mL 上皮成長因子 (EGF)、bFGF-H (20 ng/mL bFGF-5 mg/mL ヘパリン) を含む Advanced DMEM/F12 を含む Glial 濃縮培地に 2 週間さらして、グリア仕様の球体を誘導します (図 1A)。
- 初期の膠球を成熟させるには、bFGF-Hを20 ng/mLの白血病抑制因子(LIF)に置き換え、球体を4週間維持します。
- 成熟培地で4週間後、球体をグリア濃縮培地で長期間維持します。凝集と生存能力の喪失を防ぐために、2週間ごとに滅菌工業用ブレードを使用して神経膠球を機械的に刻み、培地全体をDNase Iに置き換えて、刻みから生成されたDNA断片を取り除きます。
- Papain解離キットを使用して神経膠球をAPCの単層に解離し、1:80に希釈したマトリゲルコーティングを施した細胞培養処理した接着皿にプレートします。
- APCをグリア濃縮培地で80%コンフルエントになるまで増殖させ、酵素細胞剥離培地を使用してAPCを酵素的に継代します( 材料の表を参照)。
- パッセージへ:
- 使用済みのメディアを取り出し、円錐形のチューブに集めます。細胞に酵素細胞剥離培地を加え、1〜2分待ちます。細胞が剥離し始めたら、使用済みの培地を加えて酵素活性を中和します。
- 細胞懸濁液を回収し、800 x ɡ で2分間遠心分離します。
- 上清を吸引し、細胞をグリア濃縮培地に再懸濁し、約1 x 106 細胞/ウェルを1:80マトリゲルコーティング6ウェルディッシュに播種します。
- 凍結保存の場合:
- 90%皮質球増殖培地(bFGFなし)と10%凍結保護剤の冷混合物に細胞を再懸濁します。再懸濁した細胞をクライオバイアルに移します。
- すぐにクライオバイアルをクライオボックスに移し、-80°Cの冷凍庫で一晩保管します。
- 翌日、将来の使用のために、すべてのクライオバイアルを液体窒素タンク(LN2 タンク)に移します。
注:APCは、通過番号6まで10%DMSOを使用して凍結保存されました。
- ビメンチンおよび核因子IA(NFIA)マーカー(図1C、D)による免疫染色(ステップ1.15.1-1.15.3で述べたように)により、解離したAPCを特徴付けます(希釈については 、材料の表 を参照)。
- ヒトiPS細胞由来APCの前脳領域特異性を確認するために、ヒトフォークヘッドボックスG1(hFOXG1)などの前脳マーカー(陽性)およびヒトホメオボックスB4(hHOXB4)などの後脳マーカー(陰性)について、リアルタイムqPCRを用いて細胞を試験します(図1E、F)。
注:これらの実験に使用したプライマー配列は、 補足表S1に記載されています。
3. 前脳特異的アストロサイトの均質集団の生成と特性評価
- アストロサイトとAPCの鑑別
- アストロサイト分化培地(ADM)を14日間使用して、APCをアストロサイトに分化します。アストロサイト分化培地には、ニューロベース、1% 抗生物質 - 抗真菌薬、1% グルタミン代替物、1% N2 サプリメント、0.2% B27 サプリメント、1% 非必須アミノ酸培地 (NEAA)、および 10 ng/mL 繊毛神経栄養因子 (CNTF) が含まれています。
- Glial fibrillary acidic protein(GFAP)およびS100β発現マーカー(図2A、B)を用いた免疫染色(ステップ1.15.1-1.15.3で述べた)を用いて、アストロサイトの同一性を確認します。
- APCおよびアストロサイトにおけるde novoタンパク質合成
- 滅菌済みのオートクレーブ処理した13 mmガラスカバースリップ上にhiPSC由来の前脳APCとアストロサイトを維持し、ステップ1.15.1-1.15.3で述べたように免疫染色します。
- de novoタンパク質合成には、ステップ3.2.3-3.2.6(図3A)で簡単に説明した蛍光非標準アミノ酸標識(FUNCAT)法を使用します。
- メチオニンの欠乏を確実にするために、培養液から増殖培地を取り出し、1 mM L-アジドホモアラニン(AHA)を混合したメチオニンおよびシステインフリーの培地と交換し、37°Cおよび5%CO2で30分間。
- 培養物をPBS-Tで洗浄し、4%パラホルムアルデヒドで10分間固定し、0.3% Triton X-100をPBSに10分間浸透させ、PBSに3% BSAで1時間ブロックして非特異的結合を防ぎます。
- Click細胞化学反応ミックスとAlkyne Alexa Fluor 647を使用して、室温で1時間暗所で培養物をインキュベートし、続いて一次抗体を1時間、対応する二次抗体(材料表)を1時間インキュベートします(図3B)。
- カバースリップを封入剤でスライドガラスにマウントし、さらなる画像解析に使用します。
- 405 nm、488 nm、561 nm、および633 nmの共焦点レーザースキャンにより画像を取得します。
- 512 x 512ピクセルで画像をキャプチャします。Zステップサイズを0.5μm、ピンホール径を1エアリー単位で設定します。
- 顕微鏡検査とイメージングのパラメーターを、細胞の種類間で一定の設定に維持します。同じセッションで各生物学的複製の画像をキャプチャします。
- 標準的な画像解析ソフトウェア(フィジーやイマリスなど)を使用して強度測定を行います。Imarisでは、SURFACESモジュールを使用して、ビメンチン(APCs)およびGFAP(アストロサイト)による蛍光非標準アミノ酸標識(FUNCAT)シグナルに陽性の細胞体の体積測定を行い、ボクセル範囲(250-350)を制限してデブリを除去します。
注:両方の細胞タイプのすべての生物学的複製にわたってパラメータを維持します。
- アデノシン5′-三リン酸(ATP)誘起振動カルシウム波
- ガラス底皿(35 mm)にアストロサイトを5×103 細胞/皿でプレート化し、ATPに対する細胞応答を測定します。
- 細胞をガラス底に24時間接着させ、HBSS(20 mM HEPES、137 mM NaCl、5 mM KCl、10 mM Glucose、1 mM MgCl2、pH = 7.3)でカルシウムなしで3回洗浄し、5 μM比のメートル色素Fura-2AMおよび0.02% Pluronics F127を含む培養培地で室温で1時間インキュベートします。
注:Fura-2AMは、光と温度に敏感な化学物質です。-20°Cで保存してください。 - インキュベーション後、培地で2倍洗浄し、HBSSを含む2 mM Ca2+ と交換し、フォーカスドリフト補正倒立顕微鏡で60倍オイル対物レンズ(1.35 NA)を使用して2 FPSの速度で細胞をイメージングします。
- 25th sで最終濃度5 mMのATPを浴中で適用することにより、ATP誘発性カルシウム応答を記録します(図4A)。
- Fiji/ImageJを使用して各セルの周囲に関心領域を描画し、すべての時点におけるF340/F380の比率を計算します(図4B)。
- 細胞代謝アッセイ
注:生細胞の酸素消費率(OCR)と細胞外酸性化率(ECAR)は、メーカーのプロトコルに従って測定されました( 材料の表を参照)。- アッセイの1日前に、アストロサイトをCNTF培地のマイクロプレート(1.5 × 104 播種密度)に接着させ、5% CO2で37°Cでインキュベートします。
- 解糖ストレスアッセイの場合:
- 細胞培養培地を2 mMグルタミン(pHを7.4に調整)を添加したベース培地と交換し、37°Cの非CO2 チャンバーで1時間インキュベートします。
注:pHは37°Cのウォーターバスで調整する必要があります。 - カートリッジプレートを機器に挿入して、センサーを校正します。キャリブレーション後、カートリッジプレートを細胞培養プレートと交換し、キット成分10 mMグルコース、1 μMオリゴマイシン、および50 mM 2-デオキシグルコース(2-DG)の最終濃度にします(図5A)。
- 試験の最後に、細胞を溶解し、総タンパク質含有量を推定します。
- 細胞培養培地を2 mMグルタミン(pHを7.4に調整)を添加したベース培地と交換し、37°Cの非CO2 チャンバーで1時間インキュベートします。
- ミトコンドリアストレスアッセイの場合:
- CNTF培地を、37°Cの水浴中で2 mMグルタミン、1 mMピルビン酸、10 mMグルコース(pH 7.4に調整)を添加したベース培地と交換します。
- プレートを非CO2 チャンバー内で37°Cで1時間インキュベートします。その間、カートリッジプレートを機器に挿入して、センサーを校正します。
- キャリブレーション後、カートリッジプレートを、1.5 μMオリゴマイシン、1 μMカルボニルシアン化物-4(トリフルオロメトキシ)フェニルヒドラゾン(FCCP)、および0.5 μMロテノン/アンチマイシンA(図5C)の最終濃度の細胞培養プレートと交換します。
- 試験の最後に、細胞を溶解し、総タンパク質含有量を推定します。
結果
ヒト人工多能性幹細胞(hiPSC)コロニーは、市販の既定培地を使用して維持し、多能性マーカーであるOct4およびNanogを免疫染色しました(図1B)。FXSおよびCTRL APCは、ビメンチンおよびNFIAに対して免疫陽性の細胞の同等の高濃縮割合を示しました(図1C、D)。その結果、健常者およびFXSのhiPSCに由来するAPCは、HOXB4と比較してFOXG1の大幅なアップレギュレーションを示し(図1F)、前脳の優勢な同一性と一致することがわかりました。FXS群では、S100β発現アストロサイトの数に影響を与えることなく、CTRLアストロサイトと比較してGFAP発現アストロサイトの数が大幅に減少することが観察されました(図2B)。ウェスタンブロット分析では、両方のFXSラインから生成されたアストロサイトはFMRPの発現を欠いていたことが示されました(図2C、D)。新たに合成されたタンパク質の定量では、APCまたはアストロサイトのいずれにおいても、CTRL系統とFXS系統との間に有意差は認められませんでした(図3C)。しかし、タンパク質合成は、各系統のAPCの方がそれぞれのアストロサイトよりも一貫して高いことがわかりました(図3C)。これらの結果は、FXS株とCTRL株の両方で、APCからアストロサイトへのde novoタンパク質合成の段階特異的な減少を示唆しています。
コントロール、およびFXSアストロサイトは、ATP誘発性カルシウム過渡現象を示しました(図4A)。しかし、より詳細な解析により、CTRL、FXS1、およびFXS2アストロサイトから記録された個々のカルシウム過渡現象の間には、いくつかの重要な違いがあることが明らかになりました(図4B)。アストロサイトを、カルシウム応答の有無に基づいて、ATPに対する応答型と非応答型にそれぞれ分類しました(図4C)。FXS1 と FXS2 のレスポンダー数は CTRL よりも有意に少なかった。具体的には、ATP 適用後に誘発される最初のカルシウム過渡現象のピーク振幅が両方の FXS アストロサイト株で有意に減少したことが観察されました(図 4D)。さらに、最初のカルシウム過渡現象の合計持続時間は、FXS1およびFXS2ラインでCTRLよりも有意に短かった(図4E)。ただし、カルシウムイベントの数(250秒あたりのイベントの総数として定量化されます。 図4F)は、行間で同等であった。これらの知見をまとめると、hiPSC由来FXSアストロサイトにおけるATPによって誘発されるカルシウム応答の変化が明らかになります。ECARの結果は、hiPSC由来FXSアストロサイトにおける解糖系、解糖能、および解糖系予備能の割合が高いことを示唆しています(図5A、B)。CTRLアストロサイトとFXSアストロサイトの基礎呼吸に有意差は認められなかった。細胞ATP産生は、CTRLアストロサイトとFXSアストロサイトの間に有意差を示さなかった。FCCP刺激は、FXSアストロサイトの最大呼吸数をCTRLアストロサイトよりも有意に低く誘発しました(図5C、D)。

図1:hiPSCsからの前脳特異的アストロサイト前駆細胞の誘導 (A)hiPSCsからのアストロサイト作製のための例示的なワークフロー。(B)CTRL系統とFXS系統でOct4/Nanogの同等の発現を示すhiPSCの代表的な画像。(C)ヒトiPS細胞由来APCの均質な集団は、同数のビメンチン陽性細胞とNFIA陽性細胞を発現していた。(D)ビメンチンとNFIAの発現に、CTRLとFXS APCで有意差は認められなかった。統計分析は、2因子ANOVAとそれに続くTukeyのペアワイズ比較を使用して行われました。(E)in vivoでの発生中のFOXG1およびHOXB4の領域特異的発現を示す模式図。(F)遺伝子型全体でのHOXB4と比較したFOXG1発現のグラフ表現(qRT-PCRを使用)は、前脳系統への傾向を示唆しています。2因子ANOVAとそれに続くSidakの多重比較検定による統計分析。すべての実験で、N = 3 の生物学的複製。p < 0.001 です。スケールバー = 50 μm。エラーバーはSEMを表します。略語:hiPSCs = ヒト人工多能性幹細胞;CTRL = コントロール;FXS = 脆弱 X 症候群;APCs = 星状細胞前駆細胞。この図の拡大版を表示するには、ここをクリックしてください。

図2:グリア線維性酸性タンパク質陽性のhiPSC由来FXSアストロサイトの減少 (A)S100βおよびGFAP発現を示すhiPSC由来アストロサイトの代表的な画像。(B)GFAP陽性アストロサイトの割合は、FXS由来アストロサイトの方がCTRLと比較して有意に低かったが、両者とも同様のS100β発現を示した。統計的有意性は、2因子分散分析とそれに続くテューキーのペアワイズ比較によって決定されます。(C)CTRLおよびFXS由来の星状細胞におけるFMRPの発現を表すイムノブロット。(D)hiPSC由来FXSアストロサイトにFMRPが存在しないことを示すグラフ。統計分析は、単一因子分散分析とテューキーのペアワイズ比較によって行われます。上記のすべての実験で、N = 3 の生物学的複製。スケールバー = 50 μm. ***p < 0.001.エラーバーはSEMを表します。略語:hiPSCs = ヒト人工多能性幹細胞;CTRL = コントロール;FXS = 脆弱 X 症候群;GFAP = グリア線維性酸性タンパク質;FMRP = 壊れやすいXメッセンジャーリボ核タンパク質。 この図の拡大版を表示するには、ここをクリックしてください。

図3:APCからアストロサイトへの分化によるタンパク質合成の減少 (A)FUNCAT 代謝標識を用いた hiPSC 由来の APC およびアストロサイトにおけるタンパク質合成の標識と可視化を示す概略ワークフロー。(B)CTRLおよびFXS由来細胞における(上)ビメンチン陽性hiPSC由来APCおよび(下)GFAP陽性アストロサイトのFUNCAT/human Nuclei Antibody(hNA)標識付きアストロサイトの代表画像。(C)FUNCAT/hiPSC由来APCの体積は、対応する派生アストロサイトよりも有意に高かった。すべての実験で、N = 3 の生物学的複製。スケールバー = 50 μm. **p < 0.01, ***p < 0.001.ウィスカーは1.5×IQRを表します。略語:hiPSCs =ヒト人工多能性幹細胞;CTRL = コントロール;FXS = 脆弱 X 症候群;GFAP = グリア線維性酸性タンパク質;FUNCAT = 蛍光非標準アミノ酸のタグ付け。 この図の拡大版を表示するには、ここをクリックしてください。

図4:hiPSC由来FXSアストロサイトにおけるATPによって誘発されるCa2+シグナル伝達の欠損。(A)25秒目にATPを外部から適用したときに個々のアストロサイトから記録されたCa2+トランジェントの代表的な痕跡 (B)ATP適用後250秒を超えるCa2+トランジェントを示す平均F340/F380比。(C)hiPSC由来FXSアストロサイトにおけるATPに対する非応答者の割合が高いことを示すグループ化データ。統計的有意性は、Tukeyのペアワイズ比較による2因子分散分析によって決定されます。(D-F)イベントの最初のピーク応答(振幅と持続時間)と頻度の定量化。(D)振幅の大幅な減少を示しています。単一因子分散分析とテューキーのペアワイズ比較、および (E) hiPSC 由来 FXS アストロサイトの持続時間によって決定された統計的有意性。ダンの多重比較検定によるKruskal-Wallis検定によって決定された統計的有意性。(F) hiPSC由来FXSアストロサイトにおけるCa2+過渡周波数のグラフ表現。Tukeyのペアワイズ比較による単一因子ANOVAによる統計分析。すべての実験で、N = 3 生物学的複製;n = 各細胞株につき19個の細胞。*p < 0.05、**p < 0.01、***p < 0.001。エラーバーはSEMを表します。# = 数値。略語:hiPSCs =ヒト人工多能性幹細胞;CTRL = コントロール;FXS = 脆弱 X 症候群;GFAP = グリア線維性酸性タンパク質。この図の拡大版を表示するには、ここをクリックしてください。
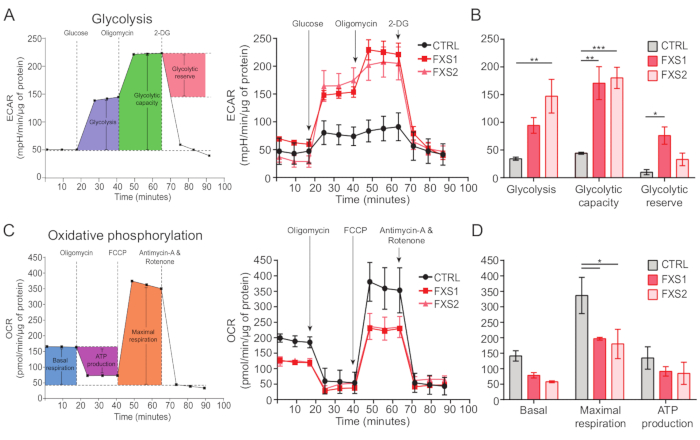
図5:hiPSC由来FXSアストロサイトにおける生体エネルギー欠損。 (A)10 mM Glucose、1 μM Oligomycin、50 mM 2-DGを順次添加した後のhiPSC由来アストロサイト(CTRLおよびFXS)の細胞外酸性化速度を折れ線グラフで表した折れ線グラフ。(B)解糖系、解糖能、および解糖系予備量の定量により、hiPSC由来のFXSアストロサイトの増加が示されました。Tukeyのペアワイズ比較を使用した2因子ANOVAによる統計分析。(C)1.5μMオリゴマイシン、1μMのFCCP、0.5μMのアンチマイシンAとロテノンを順次添加して酸素消費率を測定した折れ線グラフ。(D)ライングラフから基礎呼吸数、最大呼吸数、ATP産生を定量化したところ、hiPSC由来のFXSアストロサイトは、CTRLアストロサイトと比較して最大呼吸数が有意に減少したことが示されました。Tukeyのペアワイズ比較を使用した2因子ANOVAによる統計分析。すべての実験で、N = 2 の生物学的複製。*p < 0.05、**p < 0.01、***p < 0.001。エラーバーはSEMを表します。略語:hiPSCs = ヒト人工多能性幹細胞;CTRL = コントロール;FXS = 脆弱 X 症候群;ECAR = 細胞外酸性化率;2-DG = 2-デオキシグルコース;OCR = 酸素消費率;FCCP = シアン化カルボニル-4 (トリフルオロメトキシ) フェニルヒドラゾン。 この図の拡大版を表示するには、ここをクリックしてください。
| 原稿のID | ソースのID | 年齢 | 性 | 再プログラムされた細胞株名 | リプログラミング方法 | 開始セルタイプ | Gバンド核型 |
| (年) | |||||||
| Ctrl キー | ND30625 | 76 | M | CS25iCTR-18NXXの | エピソームベクター | 線維芽細胞 | 正常 |
| FXS1の | GM07072 | 22 | M | CS072iFXS-n4の | エピソームベクター | 線維芽細胞 | 正常 |
| FXS2の | GM05848 | 4 | M | CS848iFXS-n5の | エピソームベクター | 線維芽細胞 | 正常 |
表1:この研究で前脳特異的アストロサイトを作製するために使用した細胞株。
補足図S1:染色体解析レポート。(A)CTRL 46、XY、(B)FXS1 46、XY、および(C)FXS2 46、XYの通常のGTGバンディング核型。この図をダウンロードするには、ここをクリックしてください。
補足表S1:この研究で細胞の特性評価に使用したプライマー。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
ここでは、FXSによって誘発される機能変化を特徴付けるためのアッセイプラットフォームとして機能するヒトiPS細胞由来アストロサイトを作製する方法について説明します。これらのアストロサイトは、培養において機能的に生存可能であり、本研究で実施されたさまざまな測定によって証明されるように、さまざまな特性を示します。このプロトコルの重要なステップは、酵素リフティング法を使用してiPS細胞を皮質圏に最初に変換することです。この段階では、コラゲナーゼIV型およびディスパーゼのインキュベーション時間を最適化することが重要です。これを最適化しないと、iPS細胞が崩壊したり、単一細胞を形成したりして、皮質圏の形成が妨げられる可能性があります。これらの皮質圏は、デュアルSMAD阻害15 を用いて前脳特異性に向けてパターン化され、さらにアストロサイト前駆細胞(APC)に分化される。APCの個体数を増やすためには、神経膠球の機械的なチョッピングが重要です。リアルタイムqPCRを使用して、前脳の特異性を確認できます。前脳のマーカーである FOXG1は、脊髄のマーカーである HOXB4と比較して、有意な倍率変化の増加が観察されました。
次に、APCは、JAK-STATシグナル伝達経路の活性化因子であるCNTFを使用してアストロサイトに分化します16。この研究の結果は、FXS iPS細胞に由来する最終分化型アストロサイトはGFAPレベルが低いことを示しており、これは成熟障害を示唆しています。私たちの分析では、FXSアストロサイトとAPCのde novoタンパク質合成に対照群と比較して差は見られませんでしたが、FXS系統と対照系統の両方で、APCからアストロサイトへの移行におけるde novoタンパク質合成の減少が見つかりました。APCとアストロサイト間の翻訳の有意な低下は、ニューロンと神経前駆細胞について示された、より合理化されキュレーションされた翻訳と一致している17。異常なタンパク質合成を調べた以前の研究では、アストロサイトやAPCではなく、全脳組織、ニューロン、および患者由来の線維芽細胞が利用されていました18。患者由来の系統からのタンパク質合成に関する唯一の発表された報告は、アストロサイトではなく、リンパ芽球様細胞19および線維芽細胞20,21からのものである。これらの研究間のばらつきを考慮すると、今後の研究では、追加のFXS患者由来系統に由来するアストロサイトでFUNCAT測定を使用することが有益です。
細胞内カルシウム動態22と生体エネルギーを測定することにより、アストロサイトの機能を評価しました。FXSアストロサイトは、ATPによって誘発されるカルシウム過渡現象のピーク振幅と持続時間が減少し、対照のアストロサイトと比較してATPに応答する細胞が少なかった。まとめると、これらの変化は、FXSがヒトアストロサイトのカルシウム恒常性を破壊することを示唆しています。これらの結果は、FXS線維芽細胞におけるIP3受容体活性の障害を報告した以前の研究23,24と一致しています。さらに、FXSアストロサイトにおける解糖系、解糖能力、および解糖系予備力の増加、およびミトコンドリアの酸素消費率の低下が観察されました。
本研究では、患者由来のiPS細胞の力を活用して、FXSアストロサイトの新しい in vitro モデルの生成と特性評価について説明します。注目すべきは、ヒトのアストロサイトをヒトのニューロンと共培養した初期の研究を通じてのみ、ニューロンの電気生理学的表現型を決定するアストロサイトの重要な役割を明らかにした14。しかし、これらの研究は、ほぼ完全に疾患によるニューロン活動の変化に焦点を当てており、アストロサイトでは何も調査されていませんでした。ここで、このプロトコルは、アストロサイトの機能的変化に焦点を移すための新しいフレームワークを提供します。これにより、グルタミン酸シグナル伝達や電気的応答など、これまで解明されていなかったアストロサイトとニューロンの相互作用が明らかになります。現段階での私たちの結果は、今後の研究においてアストロサイトを優先する必要性を強調しています。
このプロトコルの限界を認識することが重要です。まず、機械的なチョッピングが伴い、DNAの断片化にもつながります。これにより、みじん切りにされた膠球が凝集し、最終的には細胞死につながる可能性があります。第二に、アストロサイトへの最終分化ステップにおけるAPCの播種密度は、接触を介した細胞間阻害を防ぐために不可欠です。培養容器の表面からの剥離を防ぐために、細胞株全体でこれを最適化することをお勧めします。
ここで、我々の知見は、ヒトアストロサイトにおける最初のそのような分析であり、過去のすべての研究は、リンパ芽球様細胞株やヒト線維芽細胞25などの他の細胞タイプに基づいていた。機能不全のエネルギー代謝は、自閉症スペクトラム障害の病因において、ヒト血漿乳酸のレベルの増加、顆粒球の酸素消費率の有意な低下26、およびASDの子供の前帯状回、運動皮質、視床、および小脳におけるミトコンドリア酸化的リン酸化遺伝子の発現の減少によって示されるように、知られているプレーヤーです27。エネルギー代謝の同様の変化は、パーキンソン病28 やアルツハイマー病29などの神経変性疾患でも見られ、解糖系の増加が機能機能の低下を補う可能性があることを示唆しています30。FXS患者由来のアストロサイトに見られる機能不全のエネルギー代謝に同様のメカニズムが作用しているかどうかを調査するには、今後の研究が必要です。
現在、前脳特異的なアストロサイトの生成は大きな成果ですが、将来の進歩により、皮質/海馬アストロサイトなどの領域特異的なグリアの作成が可能になる可能性があります。これにより、これらのアストロサイトが脳の局所機能、シナプス可塑性、ニューロンとグリアの相互作用において果たす明確な役割について、より深い洞察が得られるでしょう。このような領域特異的なアストロサイトを生成する能力は、神経発生と神経変性疾患のモデルを進歩させる可能性があります。最終的には、これは特定の脳領域のアストロサイトの機能障害を標的とするより正確な治療戦略につながる可能性があります。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
学内資金を提供してくれたSumantra Chattarji教授に感謝します。カルシウムイメージングのセットアップにアクセスしてくださったGaiti Hasan教授、校正と提案を提供してくださったCentral Imaging and Flow Facility-National Centre for Biological Sciences、校正と提案を提供してくださったPadmanabh Singh氏とPrangya Hota氏、そしてSeahorse XFアッセイの実施を支援してくださったLabmate Asiaチームに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
参考文献
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved