Method Article
توليد وتوصيف الخلايا النجمية المشتقة من الخلايا الجذعية متعددة القدرات المستحثة من الإنسان والتي تفتقر إلى البروتين النووي الريبي X messenger الهش
In This Article
Summary
نصف هنا بروتوكولا يسهل تمايز الخلايا الجذعية متعددة القدرات المستحثة البشرية إلى خلايا نجمية وظيفية خاصة بالدماغ الأمامي. يتيح ذلك إجراء تحقيقات في دور الخلايا الدبقية في التسبب في اضطرابات النمو العصبي ، مثل متلازمة X الهشة ، ونمذجة اضطرابات الدماغ الأخرى.
Abstract
تمت دراسة متلازمة X الهشة (FXS) ، وهي سبب وراثي رئيسي لاضطراب طيف التوحد والإعاقة الذهنية ، على نطاق واسع باستخدام نماذج القوارض. في الآونة الأخيرة ، تم أيضا استخدام أنظمة النماذج المشتقة من الخلايا الجذعية البشرية لاكتساب رؤى ميكانيكية حول الفيزيولوجيا المرضية ل FXS. ومع ذلك ، فقد ركزت هذه الدراسات بشكل حصري تقريبا على الخلايا العصبية. علاوة على ذلك ، على الرغم من الأدلة المتزايدة على الدور الرئيسي للخلايا الدبقية في وظيفة الخلايا العصبية في الصحة والمرض ، لا يعرف سوى القليل عن كيفية تأثر الخلايا النجمية البشرية ب FXS.
لذلك ، في هذه الدراسة ، نجحنا في تطوير بروتوكول يلتقط المعالم الزمانية المكانية الرئيسية لنمو الدماغ ويتوافق مع عملية تكوين الخلايا الدبقية أيضا. يوفر هذا معا إطارا مفيدا لدراسة اضطرابات النمو العصبي. أولا ، قمنا بتصميم الخلايا الجذعية متعددة القدرات المستحثة عن الإنسان في سلالة الأديم العصبي مع المثبط المزدوج للأمهات ضد تثبيط شلل عشري خماعي (SMAD) والجزيئات الصغيرة. بعد ذلك ، استخدمنا عوامل نمو وسيتوكينات محددة لتوليد التحكم (CTRL) والخلايا السلفية النجمية المشتقة من المريض (APCs). علاج APCs بعامل التغذية العصبية الهدبية ، وهو سيتوكين متمايز ، ينظم ويدفع الخلايا السلفية نحو النضج النجمي ، مما ينتج عنه خلايا نجمية تعبر عن البروتين الليفي الدبقي الخاص بالدماغ الأمامي.
وجدنا أن هذه الخلايا النجمية تعمل ، كما يتضح من استجاباتها للكالسيوم لتطبيق ATP ، وتظهر استقلاب محلل السكر والميتوكوندريا غير منظم في FXS. مجتمعة ، توفر هذه النتائج منصة تجريبية مفيدة من أصل بشري للتحقيق في العواقب المستقلة للخلايا وغير المستقلة للخلايا للتغيرات في الوظيفة النجمية الناجمة عن اضطرابات النمو العصبي.
Introduction
متلازمة X الهشة (FXS) ، وهي شكل وراثي شائع من الإعاقة الذهنية واضطراب طيف التوحد (ASD) ، ناتجة عن نقص البروتين النووي الريبي X messenger الهش (FMRP) الذي ينتجه جين البروتين النووي الريبي X messenger 1 (FMR1) الهش (OMIM: # 300624 ، https://www.omim.org/entry/300624). يلعب FMRP دورا في تنظيم ترجمة mRNA ، وتكوين حبيبات mRNA ونقلها ، والتنظيم بوساطة microRNA للتعبير الجيني1. وبالتالي ، فإن فقدان FMRP لا يؤثر فقط على نمو الدماغ ولكن أيضا على وظائف دماغ البالغين. أظهرت مستويات نسخ mRNA ل FMR1 والتلوين المناعي ل FMRP في الدماغ تعبيرا عصبيا عاليا ، إلى جانب التعبير الكبير في الخلايا الدبقية أيضا2. ومع ذلك ، ركزت الغالبية العظمى من الدراسات السابقة في النماذج الحيوانية ل FXS بشكل أساسي على الخلايا العصبية والانحرافات في وظيفتها. وبالتالي ، لا يعرف سوى القليل عن دور الخلايا الدبقية في FXS3. ينظر إليها تقليديا على أنها خلايا "دعم سلبي"4 ، وهناك أدلة متراكمة على أن الخلايا النجمية حاسمة في التوسط في مجموعة واسعة من وظائف الخلايا العصبية5،6 ، بما في ذلك تعزيز تكوين التشابكالعصبي 7 ، وصقل تطوير الدوائر العصبية8 ، وإعادة تدوير الناقلات العصبية9. في موازاة ذلك ، هناك أدلة متزايدة على دور الخلايا النجمية في التسبب في المرض وقد ارتبطت العديد من الحالات العصبية بالخلل الوظيفي النجمي10.
في حين أن الكثير من العمل السابق باستخدام النماذج الحيوانية ل FXS ركز على تحديد والتحقق من صحة الأهداف الجزيئية المختلفة في الخلايا العصبية لعلاج FXS ، فإن هذه النتائج قبل السريرية لم تؤد دائما إلى نتائج سريرية ناجحة. علاوة على ذلك ، تؤكد النكسات في التجارب السريرية الأخيرة أيضا الحاجة إلى أنظمة نموذجية قائمة على الإنسان. تقدم نماذج الاضطرابات العصبية القائمة على خلايا الدماغ المشتقة من الخلايا الجذعية البشرية استراتيجية قوية لسد هذه الفجوة بين الرؤى الميكانيكية من الدراسات التي أجريت على والنجاح المحدود مع النتائج السريرية للمرضى. ومع ذلك ، فقد ركزت حفنة فقط من هذه الدراسات على الخلايا النجمية وذلك في الغالب على الخلايا النجمية التي كانت في الأصل عمودي. وهذا بدوره مهم في ضوء الدراسات التي تظهر أن بنية ووظيفة الخلايا النجمية تختلف بين مناطق الدماغ11،12. وبالتالي ، فإن الفهم الأفضل للتغيرات الناجمة عن المرض في الخلايا النجمية البشرية يحتاج أيضا إلى مراعاة هذه الاختلافات الخاصة بمنطقة الدماغ في الخلايا النجمية. ومع ذلك ، فإن نماذج اضطرابات النمو العصبي التي تستخدم الخلايا النجمية المشتقة من الخلايا الجذعية البشرية الخاصة بالدماغ الأمامي لا تزال غير مستكشفة نسبيا13. ومن ثم, للبدء في معالجة هذه الفجوات, نصف بروتوكولات لتوليد الخلايا النجمية الخاصة بالدماغ الأمامي من الخلايا الجذعية المستحثة متعددة القدرات المستحثة من قبل المريض (iPSCs) التي تحمل طفرات FXS; علاوة على ذلك ، نظهر أن الخلايا النجمية تعمل وتظهر عملية التمثيل الغذائي المتغيرة.
Protocol
تم إجراء جميع التجارب باستخدام الخلايا الجذعية متعددة القدرات المستحثة البشرية (hiPSCs) (الجدول 1) بعد الحصول على الموافقات التنظيمية المؤسسية المناسبة. يمثل الشكل 1 أ بروتوكول التمايز الكامل لمركبات الدماغ المائية العالية إلى الخلايا النجمية الناضجة الخاصة بالدماغ الأمامي.
1. صيانة وتوسيع hiPSCs
- قبل يوم واحد من طلاء iPSCs, معطف طبق 6 آبار مع 1:60 مخفف Matrigel (مصفوفة خارج الخلية [ECM]) في وسط النسر المعدل Dulbecco المتقدم/F-12 هام (DMEM/F12) وتخزينها في 2-8 درجة مئوية.
ملاحظة: تجنب تخزين الأطباق المغلفة ب Matrigel لمدة >5 أيام عند 2-8 درجات مئوية ، لأن ذلك قد يتسبب في تدهور البروتين في ECM بمرور الوقت. لتجنب تجفيف الطبق ، قم بتغطية ما لا يقل عن 1 مل من 1:60 Matrigel المخفف لكل بئر واحد من طبق مكون من 6 آبار ووزعها بالتساوي عبر الطبق. إذا كنت تستخدم نفس اليوم ، احتفظ باللوحة في حاضنة رطبة عند 37 درجة مئوية و 5٪ ثاني أكسيد الكربون2 لمدة ساعة. - في يوم زراعة hiPSCs ، قم بإزالة مادة الطلاء وأضف 1 مل من وسط Essential 8 الكامل (الوسط القاعدي E8 مع مكمل أساسي 8) جنبا إلى جنب مع مثبط ROCK 1x التركيز النهائي واحتفظ بالطبق في حاضنة 37 درجة مئوية و 5٪ CO2 قبل إضافة hiPSCs.
- أعد تعليق hiPSCs في وسط E8 كامل جنبا إلى جنب مع مثبط ROCK بتركيز نهائي 1x لتحسين الالتصاق المستعمرات.
ملاحظة: لا تحضر كميات كبيرة من وسط الاستزراع. استعد فقط لمدة 3-4 أيام كحد أقصى وخزنها في درجة حرارة 2-8 درجة مئوية. - في اليوم التالي ، قم بتجديد وسط E8 الكامل بدون مثبط ROCK حتى تتلاقى الخلايا بنسبة 80٪ (حوالي 4-5 أيام).
- عندما تصل إلى 80٪ من التقاء ، افصل المستعمرات إنزيميا.
- لتمرير iPSCs, إزالة الوسائط المستهلكة من الطبق وإضافة 1 مل لكل بئر من التدفئة المسبقة (37 درجة مئوية) خليط من الكولاجيناز (2 ملغ/مل) وتباين (1 ملغ/مل) بنسبة 1:1 واحتضان عند 37 درجة مئوية لأكثر من 20-30 دقيقة للسماح لمستعمرات iPSC لرفع.
ملاحظة: لا تترك الأطباق عند 37 درجة مئوية لأكثر من 20-30 دقيقة ؛ بعد هذه الفترة ، سوف تتفكك المستعمرات وتموت الخلايا.
- لتمرير iPSCs, إزالة الوسائط المستهلكة من الطبق وإضافة 1 مل لكل بئر من التدفئة المسبقة (37 درجة مئوية) خليط من الكولاجيناز (2 ملغ/مل) وتباين (1 ملغ/مل) بنسبة 1:1 واحتضان عند 37 درجة مئوية لأكثر من 20-30 دقيقة للسماح لمستعمرات iPSC لرفع.
- عندما تبدأ المستعمرات في الرفع ، أخرج الأطباق من الحاضنة وقم بتحييد نشاط الإنزيم عن طريق إضافة 2 مل من محلول ملحي مخزن بالفوسفات (DPBS) من Dulbecco.
- اكشط المستعمرات باستخدام DPBS واجمع المعلق في أنبوب مخروطي سعة 15 مل باستخدام ماصة مصلية عريضة التجويف سعة 10 مل.
- قم بتقطيع المعلق برفق 2-3x لتفتيت المستعمرات باستخدام ماصة مصلية سعة 10 مل ، واترك المستعمرات تستقر.
ملاحظة: لا تجعل المستعمرات في خلايا مفردة. قد يؤدي ذلك إلى عدم التصاق الخلايا بالطبق ويسبب المزيد من موت الخلايا. علاوة على ذلك ، لا تتركهم كمستعمرات كبيرة. سيؤدي هذا إلى مستعمرات أكثر تمايزا لاحقا. - بمجرد أن تستقر المستعمرات (بعد دقيقتين تقريبا) ، قم بشفط خليط إنزيم DPBS مع ترك ما يقرب من 1 مل في الأنبوب.
- أضف 2 مل من DPBS إلى الأنبوب ، واخلط المستعمرات عن طريق النقر ، واتركها تستقر. كرر هذا 2x لإزالة كل الإنزيم المتبقي من المستعمرات. قم بإزالة أكبر قدر ممكن من المادة الطافيةبعد الغسيل الثاني ، وأعد تعليق المستعمرات في 1 مل من E8 Medium الكامل ، وقم بوضعها في طبق طازج كما هو مذكور في الخطوات 1.2-1.3.
- بدلا من ذلك ، الحفاظ على نسبة من المستعمرات بالتبريد باستخدام 10٪ من ثنائي ميثيل سلفوكسيد (DMSO) كمحلول تجميد للتوسع والاستخدام في المستقبل.
- قم بإعداد وسط الحفظ بالتبريد طازجا عن طريق خلط 90٪ من E8 المتوسط الكامل و 10٪ DMSO كمحلول تجميد ووضعه في درجة حرارة 2-8 درجة مئوية حتى الاستخدام.
- للحفظ بالتبريد، اتبع الخطوات 1.5-1.10.
- خلال الخطوة 1.10 ،بعد الغسيل الثاني ، اسمح للمستعمرات بالاستقرار وإزالة المادة الطافية. أضف إلى المستعمرات 1 مل من وسط الحفظ بالتبريد الطازج وانقله إلى المبردات.
ملاحظة: بعد إضافة وسيط الحفظ بالتبريد إلى المستعمرات ، انقل المحتويات بسرعة إلى cryovials. قد يؤدي التأخير إلى انخفاض معدل الإحياء لأن DMSO هو مادة حاصلة بالتبريد يمكن أن تلحق الضرر بالخلايا. - انقل المبردات على الفور إلى صندوق التبريد واحتفظ بها في فريزر -80 درجة مئوية طوال الليل.
- في اليوم التالي ، قم بتحويل جميع المواد المبردة إلى خزان النيتروجين السائل (خزان LN2 ) لاستخدامها في المستقبل.
ملاحظة: يجب أن يتم تنميط الخلايا العصبية العليا بشكل روتيني باستخدام G-banding (الشكل التكميلي S1) لأي تشوهات ، تتميز باستخدام كيمياء الخلايا المناعية لتعدد القدرات (الشكل 1 ب) ، واختبارها بحثا عن الميكوبلازما.- لتوصيف hiPSCs باستخدام الكيمياء الخلوية المناعية ، قم بلوحة المستعمرات على 1:60 مغلفة ب Matrigel ، وأغطية زجاجية مقاس 13 مم. بمجرد أن تصبح 40٪ ملتقية ، اغسل الخلايا باستخدام PBS-T (PBS-0.1٪ Tween 20) ، وثبتها بنسبة 4٪ بارافورمالدهيد لمدة 10 دقائق ، وتخلل 0.3٪ Triton X-100 في PBS لمدة 10 دقائق ، وقم بحظر ألبومين مصل الأبقار بنسبة 3٪ (BSA) في PBS لمدة ساعة واحدة لمنع الارتباط غير المحدد.
- بعد الحظر ، احتضن الثقافات بالأجسام المضادة الأولية لمدة ساعة واحدة ثم اغسل 3x باستخدام PBS-T لمدة 5 دقائق لكل منها ، متبوعة بالأجسام المضادة الثانوية المقابلة (جدول المواد) في الظلام لمدة 1 ساعة.
- قم بتركيب الأغطية على شرائح زجاجية ذات وسيط تثبيت واحصل على صور عن طريق المسح الضوئي بالليزر متحد البؤر عند 405 نانومتر و 488 نانومتر و 561 نانومتر و 633 نانومتر. التقاط الصور بدقة 512 × 512 بكسل ؛ اضبط حجم خطوة Z على 0.5 ميكرومتر مع وحدة واحدة جيدة التهوية بقطر الثقب.
2. توليد وتوصيف الخلايا السلفية النجمية (APCs)
- ارفع hiPSCs إنزيميا كما هو مذكور في الخطوات 1.5-1.10 وقم بوضعها على طبق ثقافة معلق غير ملتصق (100 مم) مع وسط محددكيميائيا 14 يحتوي على 50٪ من Iscove's Dulbecco's Medium (IMDM) ، و 50٪ من مزيج المغذيات F-12 من لحم الخنزير (F12) ، و 5 مجم / مل BSA ، و 1٪ مركز دهني محدد كيميائيا (CD-Lipid) ، 450 ميكرومتر أحادي الجلسرين ، 7 ميكروغرام / مل أنسولين ، 15 ميكروغرام / مل ترانسفيرين ، 1٪ بنسلين ستربتومايسين مكمل بميتوجينات نمط الدماغ الأمامي N-acetyl Cysteine (1 ملليمتر) ، LDN 193189 (0.1 ميكرومتر) ، و SB431542 (10 ميكرومتر) لمدة 7 أيام.
ملاحظة: مثبطات الجزيئات الصغيرة SB431542 و LDN-193189 (LDN) هي مثبطات للبروتين المورفولوجي للعظام وتحويل مسارات إشارات عامل النمو بيتا.
من هذه النقطة فصاعدا ، تم تجديد الوسيط مرة واحدة كل يومين أو باتباع بروتوكول الاثنين / الأربعاء / الجمعة. - ضع تعليق الخلية على شاكر مداري عند 40 دورة في الدقيقة لمدة 7 أيام في ظل ظروف طبيعية للمساعدة في تطوير القشرة القشرية (الشكل 1 أ).
- في اليوم 8 ، انقل القشرة إلى وسط تكاثر الخلايا يحتوي على DMEM / F12 المتقدم مع 1٪ مضاد حيوي ومضاد للفطريات ، ومكملات N2 ٪ ، وبديل جلوتامين 1٪ ، ومكملات B27 بنسبة 0.1٪ ، وعامل نمو الخلايا الليفية الأساسي (bFGF) لمدة 7 أيام.
- حث المجالات على المواصفات الدبقية عن طريق إخضاعها لوسط تخصيب الدبقي الذي يحتوي على DMEM / F12 المتقدم مع 1٪ مضاد حيوي مضاد للفطريات ، 1٪ N2 ، 1٪ بديل الجلوتامين ، 0.1٪ مكمل B27 ، 20 نانوغرام / مل عامل نمو البشرة (EGF) ، bFGF-H (20 نانوغرام / مل bFGF-5 مجم / مل من الهيبارين) لمدة أسبوعين للحصول على الغلاف الدبقي المبكر (الشكل 1 أ).
- لنضج الغلاف الدبقي المبكر ، استبدل bFGF-H بعامل مثبط لسرطان الدم 20 نانوغرام / مل (LIF) وحافظ على الكرات لمدة 4 أسابيع.
- بعد 4 أسابيع في وسط النضج ، حافظ على الكرات في وسط التخصيب الدبقي لفترات طويلة. لمنع التراكم وفقدان الجدوى ، كل أسبوعين ، قم بتقطيع الغلاف الدبقي ميكانيكيا باستخدام شفرة صناعية معقمة واستبدل الوسط بأكمله ب DNase I لإزالة شظايا الحمض النووي المتولدة عن التقطيع.
- قم بفصل الغلاف الدبقي إلى طبقات أحادية من ناقلات الجنود المدرعة باستخدام مجموعة تفكك غراء ولوحة على طبق ملتصق معالج بزراعة الخلايا مع تخفيف 1:80 من طلاء Matrigel.
- قم بنشر APCs في وسط تخصيب الدبقي حتى 80٪ من التقاء وتمريرها إنزيميا باستخدام وسط انفصال خلية الإنزيم (انظر جدول المواد).
- لتمرير:
- قم بإزالة الوسائط المستهلكة وجمعها في أنبوب مخروطي الشكل. إلى الخلايا ، أضف وسط انفصال خلية الإنزيم وانتظر لمدة 1-2 دقيقة. بمجرد أن تبدأ الخلايا في الانفصال ، أضف الوسائط المستهلكة لتحييد نشاط الإنزيم.
- اجمع تعليق الخلية وجهاز الطرد المركزي عند 800 × ɡ لمدة دقيقتين.
- استنشق المادة الطافية ، وأعد تعليق الخلايا في وسط التخصيب الدبقي ، وقم بوضع ما يقرب من 1 × 106 خلايا / بئر على طبق 6 آبار مطلي ب 1:80.
- للحفظ بالتبريد:
- أعد تعليق الخلايا في خليط بارد من وسط تكاثر القشرة القشرية بنسبة 90٪ (بدون bFGF) و 10٪ من المواد المبردة. نقل الخلايا المعلقة إلى cryovials.
- انقل المبردات على الفور إلى صندوق التبريد واحتفظ بها في فريزر -80 درجة مئوية طوال الليل.
- في اليوم التالي ، قم بتحويل جميع المواد المبردة إلى خزان النيتروجين السائل (خزان LN2 ) لاستخدامها في المستقبل.
ملاحظة: تم حفظ نادرات الجنود المدرعة بالتبريد باستخدام 10٪ DMSO حتى المقطع رقم 6.
- قم بتمييز APCs المنفصلة عن طريق التلوين المناعي (كما هو مذكور في الخطوات 1.15.1-1.15.3) بعلامات vimentin و Nuclear Factor IA (NFIA) (الشكل 1C ، D) (انظر جدول المواد للتخفيفات).
- لتأكيد الخصوصية الإقليمية للدماغ الأمامي لناقلات الجنود المدرعة المشتقة من hiPSC ، اختبر الخلايا بحثا عن علامة الدماغ الأمامي مثل صندوق الشوكة البشري G1 (hFOXG1) (إيجابي) وعلامة الدماغ الخلفي مثل Homeobox B4 البشري (hHOXB4) (سلبي) باستخدام qPCR في الوقت الفعلي (الشكل 1E ، F).
ملاحظة: تم إدراج التسلسلات التمهيدية المستخدمة في هذه التجارب في الجدول التكميلي S1.
3. توليد وتوصيف مجموعة متجانسة من الخلايا النجمية الخاصة بالدماغ الأمامي
- تمايز الخلايا النجمية عن الخلايا النادرة المدرعة
- استخدم وسط التمايز النجمي (ADM) لمدة 14 يوما للتمييز بين الخلايا النادرة المدرعة إلى خلايا نجمية. يحتوي وسط التمايز النجمي على Neurobasal ، و 1٪ مضاد حيوي - مضاد للفطريات ، و 1٪ بديل جلوتامين ، و 1٪ مكمل N2 ، و 0.2٪ مكمل B27 ، و 1٪ وسط من الأحماض الأمينية غير الأساسية (NEAA) ، و 10 نانوغرام / مل عامل التغذية العصبية الهدبي (CNTF).
- تأكد من الهوية النجمية باستخدام التلوين المناعي (كما هو مذكور في الخطوات 1.15.1-1.15.3.) مع البروتين الحمضي الليفي الدبقي (GFAP) وعلامات التعبير S100β (الشكل 2 أ ، ب).
- تخليق البروتين De novo في APCs والخلايا النجمية
- حافظ على ناقلات الجنود المدرعة والنجمية المشتقة من hiPSC على أغطية زجاجية معقمة مقاس 13 مم وقم بتلطيخها كما هو مذكور في الخطوات 1.15.1-1.15.3.
- لتخليق البروتين من جديد ، استخدم طريقة وضع العلامات على الأحماض الأمينية غير الفلورية غير الكنسية (FUNCAT) ، الموضحة بإيجاز في الخطوات 3.2.3-3.2.6 (الشكل 3 أ).
- لضمان نقص الميثيونين ، قم بإزالة وسط النمو من المزارع واستبدلها بوسط خال من الميثيونين والسيستين ممزوجا ب 1 ملي مولار L-azidohomoalanine (AHA) لمدة 30 دقيقة عند 37 درجة مئوية و 5٪ CO2.
- اغسل الثقافات باستخدام PBS-T ، وثبتها بنسبة 4٪ بارافورمالدهايد لمدة 10 دقائق ، وتخلل 0.3٪ Triton X-100 في PBS لمدة 10 دقائق ، وقم بكتلة 3٪ BSA في PBS لمدة ساعة واحدة لمنع الارتباط غير المحدد.
- احتضان الثقافات في الظلام لمدة ساعة واحدة في درجة حرارة الغرفة باستخدام مزيج تفاعل كيمياء الخلية Click و Alkyne Alexa Fluor 647 ، متبوعا بالأجسام المضادة الأولية لمدة ساعة واحدة والأجسام المضادة الثانوية المقابلة (جدول المواد) لمدة ساعة واحدة (الشكل 3 ب).
- قم بتركيب الغطاء على شرائح زجاجية مع وسيط تركيب واستخدمه لمزيد من تحليل الصورة.
- احصل على الصور عن طريق المسح بالليزر متحد البؤر عند 405 نانومتر و 488 نانومتر و 561 نانومتر و 633 نانومتر.
- التقاط الصور بدقة 512 × 512 بكسل ؛ اضبط حجم خطوة Z على 0.5 ميكرومتر مع وحدة واحدة جيدة التهوية بقطر الثقب.
- حافظ على معلمات الفحص المجهري والتصوير في إعداد ثابت عبر أنواع الخلايا. التقط صورا لكل نسخة مكررة بيولوجية في نفس الجلسة.
- قم بإجراء قياسات الشدة باستخدام أي برنامج قياسي لتحليل الصور (على سبيل المثال ، فيجي أو إيماريس). في Imaris ، استخدم وحدة SURFACES لإنتاج قياسات حجمية لأجسام الخلايا إيجابية لإشارة وضع العلامات على الأحماض الأمينية غير الفلورية (FUNCAT) مع Vimentin (APCs) و GFAP (الخلايا النجمية) التي تحد من نطاق voxel (250-350) لإزالة الحطام.
ملاحظة: الحفاظ على المعلمات عبر جميع التكرارات البيولوجية لكلا النوعين من الخلايا.
- الأدينوزين 5′-ثلاثي الفوسفات (ATP) موجات الكالسيوم التذبذبية الناجمة عن
- صفيحة الخلايا النجمية على طبق زجاجي القاع (35 مم) عند 5 × 103 خلايا / طبق لقياس الاستجابة الخلوية ل ATP.
- اسمح للخلايا بالالتصاق بالقاع الزجاجي لمدة 24 ساعة ، واغسلها 3 مرات باستخدام HBSS (20 ملي مولار HEPES ، 137 ملي كلوريد الصوديوم ، 5 ملي مولار KCl ، 10 ملي جلوكوز ، 1 ملي مولار MgCl2 ، الرقم الهيدروجيني = 7.3) بدون الكالسيوم ، واحتضن في وسط الاستزراع بنسبة 5 ميكرومتر صبغة مترية Fura-2AM و 0.02٪ Pluronics F127 لمدة ساعة واحدة في درجة حرارة الغرفة.
ملاحظة: Fura-2AM مادة كيميائية حساسة للضوء ودرجة الحرارة. يخزن في -20 درجة مئوية. - بعد الحضانة ، اغسل 2x بوسط الاستزراع واستبدله ب 2 ملي مولار Ca2+ يحتوي على HBSS وقم بتصوير الخلايا بسرعة 2 إطارا في الثانية باستخدام هدف زيت 60x (1.35 NA) في مجهر مقلوب يعوض الانجراف بتركيز.
- سجل استجابات الكالسيوم التي يسببها ATP عن طريق تطبيق حمام ATP عند التركيز النهائي البالغ 5 ملي مولار عند 25ثانية (الشكل 4 أ).
- ارسم مناطق الاهتمام حول كل خلية باستخدام Fiji / ImageJ واحسب نسبة F340 / F380 عبر جميع النقاط الزمنية (الشكل 4 ب).
- فحوصات التمثيل الغذائي للخلايا
ملاحظة: تم قياس معدل استهلاك الأكسجين (OCR) ومعدل التحمض خارج الخلية (ECAR) للخلايا الحية وفقا لبروتوكول الشركة المصنعة (انظر جدول المواد).- قبل يوم واحد من الفحص ، اسمح للخلايا النجمية بالالتصاق بالصفيحة الدقيقة (1.5 × 104 كثافة البذر) في وسط CNTF وتحتضن عند 37 درجة مئوية مع 5٪ ثاني أكسيدالكربون 2.
- لفحص إجهاد تحلل السكر:
- استبدل وسط زراعة الخلية بوسط أساسي مكمل ب 2 ملي مولار من الجلوتامين (تم تعديل الرقم الهيدروجيني إلى 7.4) واحتضانه في غرفة غير ثاني أكسيد الكربون2 عند 37 درجة مئوية لمدة 1 ساعة.
ملاحظة: يجب ضبط الرقم الهيدروجيني في حمام مائي 37 درجة مئوية. - أدخل لوحة الخرطوشة في الجهاز لمعايرة المستشعر. بعد المعايرة ، استبدل لوحة الخرطوشة بلوحة زراعة الخلية بتركيز نهائي لمكونات المجموعة التالية: 10 ملي مولار جلوكوز ، 1 ميكرومتر أوليغومايسين ، و 50 ملي مولار 2-ديوكسي جلوكوز (2-DG) (الشكل 5 أ).
- في نهاية الاختبار ، قم بتحليل الخلايا وتقدير محتوى البروتين الكلي.
- استبدل وسط زراعة الخلية بوسط أساسي مكمل ب 2 ملي مولار من الجلوتامين (تم تعديل الرقم الهيدروجيني إلى 7.4) واحتضانه في غرفة غير ثاني أكسيد الكربون2 عند 37 درجة مئوية لمدة 1 ساعة.
- لاختبار إجهاد الميتوكوندريا:
- يستبدل وسط CNTF بوسط أساسي مكمل ب 2 ملي مولار من الجلوتامين ، 1 ملي مولار بيروفات ، 10 ملي مولار جلوكوز (درجة الحموضة المعدلة إلى 7.4) في حمام مائي عند 37 درجة مئوية.
- احتضان اللوحة في غرفة غير CO2 عند 37 درجة مئوية لمدة 1 ساعة. في هذه الأثناء ، أدخل لوحة الخرطوشة في الجهاز لمعايرة المستشعر.
- بعد المعايرة ، استبدل لوحة الخرطوشة بلوحة زراعة الخلية بتركيز نهائي لمكونات المجموعة التالية: 1.5 ميكرومتر أوليغومايسين ، 1 ميكرومتر كربونيل سيانيد -4 (ثلاثي فلوروميثوكسي) فينيل هيدرازون (FCCP) ، و 0.5 ميكرومتر روتينون / أنتيمايسين أ (الشكل 5 ج).
- في نهاية الاختبار ، قم بتحليل الخلايا وتقدير محتوى البروتين الكلي.
النتائج
تم الحفاظ على مستعمرات الخلايا الجذعية متعددة القدرات المستحثة البشرية (hiPSC) باستخدام وسيط محدد متاح تجاريا ومنعي لعلامات متعددة القدرات ، Oct4 و Nanog (الشكل 1 ب). أظهرت مجدرات الجنود المدرعة FXS و CTRL نسبا عالية التخصيب للخلايا الإيجابية للمناعة للفيمنتين والخلايا غير الطبيعية (الشكل 1 ج ، د). وجدنا أن APCs المشتقة من hiPSCs الصحية و FXS أظهرت تنظيما كبيرا ل FOXG1 مقارنة ب HOXB4 (الشكل 1F) بما يتفق مع هوية الدماغ الأمامي السائدة. لاحظنا انخفاضا كبيرا في عدد الخلايا النجمية التي تعبر عن GFAP في مجموعات FXS مقارنة بالخلايا النجمية CTRL دون التأثير على عدد الخلايا النجمية التي تعبر عن S100β (الشكل 2 ب). أظهر تحليل اللطخة الغربية أن الخلايا النجمية المتولدة من كلا خطي FXS تفتقر إلى التعبير عن FMRP (الشكل 2C ، D). لم يكشف القياس الكمي للبروتينات المركبة حديثا عن أي فرق كبير بين خطوط CTRL مقابل FXS في APCs أو الخلايا النجمية (الشكل 3 ج). ومع ذلك ، وجدنا أن تخليق البروتين يكون أعلى باستمرار في APCs مقارنة بالخلايا النجمية لكل سطر (الشكل 3 ج). تشير هذه النتائج إلى انخفاض خاص بمرحلة في تخليق البروتين من جديد من APCs إلى الخلايا النجمية في كل من خطوط FXS و CTRL.
أظهرت التحكم ، وكذلك الخلايا النجمية FXS ، عابرات الكالسيوم الناجمة عن ATP (الشكل 4 أ). ومع ذلك ، كشف تحليل أكثر تفصيلا عن العديد من الاختلافات الرئيسية بين عابرات الكالسيوم الفردية المسجلة من الخلايا النجمية CTRL و FXS1 و FXS2 (الشكل 4 ب). قمنا بتصنيف الخلايا النجمية على أنها مستجيبة وغير مستجيبة ل ATP بناء على وجود أو عدم وجود استجابة الكالسيوم ، على التوالي (الشكل 4 ج). كان عدد المستجيبين في FXS1 و FXS2 أقل بكثير من CTRL. على وجه التحديد ، لاحظنا انخفاضا كبيرا في ذروة سعة أول عابر للكالسيوم تم استحضاره بعد تطبيق ATP في كل من خطوط الخلايا النجمية FXS (الشكل 4 د). علاوة على ذلك ، كانت المدة الإجمالية لأول عابر للكالسيوم أقصر بكثير في خطوط FXS1 و FXS2 منها في CTRL (الشكل 4E). ومع ذلك ، فإن عدد أحداث الكالسيوم (مقسوما كميا كإجمالي عدد الأحداث لكل 250 ثانية ؛ الشكل 4F) ، كان قابلا للمقارنة بين السطور. مجتمعة ، تكشف هذه النتائج عن تغيرات في استجابات الكالسيوم الناتجة عن ATP في الخلايا النجمية FXS المشتقة من hiPSC. تشير نتائج ECAR إلى معدل أعلى من تحلل السكر ، والقدرة على تحلل السكر ، واحتياطي تحلل السكر في الخلايا النجمية FXS المشتقة من hiPSC (الشكل 5 أ ، ب). لم نجد فرقا كبيرا في التنفس القاعدي في الخلايا النجمية CTRL و FXS. لم يظهر إنتاج ATP الخلوي فرقا كبيرا بين الخلايا النجمية CTRL و FXS. أثار تحفيز FCCP تنفسا قصوى أقل بكثير في الخلايا النجمية FXS مقارنة بالخلايا النجمية CTRL (الشكل 5C ، D).

الشكل 1: اشتقاق الخلايا السلفية النجمية الخاصة بالدماغ الأمامي من hiPSCs. (أ) سير العمل التوضيحي لتوليد الخلايا النجمية من hiPSCs. (ب) صور تمثيلية لمركبات العرض العالي عالية النطاقات تعرض تعبيرا مماثلا عن Oct4 / Nanog في خطوط CTRL و FXS. (ج) عبرت مجموعة متجانسة من APCs المشتقة من hiPSC عن عدد مماثل من الخلايا الإيجابية للفيمنتين والNFIA. (د) لا يوجد فرق كبير في التعبير عن Vimentin- و NFIA عبر CTRL و FXS APCs. تم إجراء التحليل الإحصائي باستخدام ANOVA ثنائي العوامل متبوعا بمقارنة Tukey الزوجية. (ه) تخطيطي يوضح التعبير الخاص بالمنطقة الخاصة ب FOXG1 و HOXB4 أثناء التطوير في الجسم الحي. (F) التمثيل الرسومي لتعبير FOXG1 مقارنة ب HOXB4 (باستخدام qRT-PCR) عبر الأنماط الجينية التي تشير إلى الميل نحو سلالة الدماغ الأمامي. التحليل الإحصائي عن طريق ANOVA ثنائي العوامل متبوعا باختبار المقارنة المتعددة لسيداك. بالنسبة لجميع التجارب ، N = 3 مكررات بيولوجية. ص < 0.001. شريط المقياس = 50 ميكرومتر. تمثل أشرطة الخطأ SEM. الاختصارات: hiPSCs = الخلايا الجذعية متعددة القدرات التي يسببها الإنسان. CTRL = التحكم ؛ FXS = متلازمة X الهشة ؛ APCs = الخلايا السلفية للخلايا النجمية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: انخفاض عدد الخلايا النجمية الليفية الدبقية الحمضية الإيجابية للبروتين الحمضي المشتق من hiPSC. (أ) صور تمثيلية للخلايا النجمية المشتقة من hiPSC التي تظهر تعبير S100β و GFAP. (ب) كانت النسبة المئوية للخلايا النجمية الإيجابية ل GFAP أقل بكثير في الخلايا النجمية المشتقة من FXS مقارنة ب CTRL ، على الرغم من أن كلاهما أظهر تعبيرا مشابها ل S100β. يتم تحديد الدلالة الإحصائية بواسطة ANOVA ثنائي العامل متبوعا بمقارنة Tukey الزوجية. (ج) اللطخة المناعية التي تمثل تعبيرا عن FMRP في الخلايا النجمية من CTRL و FXS. (د) الرسوم البيانية التي توضح عدم وجود FMRP في الخلايا النجمية FXS المشتقة من hiPSC. تم إجراء التحليل الإحصائي بواسطة ANOVA أحادي العامل مع مقارنة Tukey الزوجية. بالنسبة لجميع التجارب المذكورة أعلاه ، N = 3 مكررات بيولوجية. شريط المقياس = 50 ميكرومتر. *** ص < 0.001. تمثل أشرطة الخطأ SEM. الاختصارات: hiPSCs = الخلايا الجذعية متعددة القدرات التي يسببها الإنسان. CTRL = التحكم ؛ FXS = متلازمة X الهشة ؛ GFAP = البروتين الحمضي الليفي الدبقي ؛ FMRP = البروتين النووي الريبي X رسول الهش. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: انخفاض تخليق البروتين بسبب التمايز من APCs إلى الخلايا النجمية. (أ) سير العمل التخطيطي الذي يصور وضع العلامات والتصور لتخليق البروتين في APCs والخلايا النجمية المشتقة من hiPSC باستخدام وضع العلامات الأيضية FUNCAT. (ب) صور تمثيلية لناقلات الجنود المدرعة المشتقة من hiPSC الإيجابية (في الأعلى) والخلايا النجمية الإيجابية ل GFAP (في الأسفل) مع تسمية FUNCAT / الأجسام المضادة للنواة البشرية (hNA) في الخلايا المشتقة من CTRL و FXS. (ج) كان FUNCAT / حجم APCs المشتقة من hiPSC أعلى بكثير من الخلايا النجمية المشتقة المقابلة. بالنسبة لجميع التجارب ، N = 3 مكررات بيولوجية. شريط المقياس = 50 ميكرومتر. ** ص < 0.01 ، *** ص < 0.001. تمثل الشعيرات 1.5 × IQR. الاختصارات: hiPSCs = الخلايا الجذعية متعددة القدرات المستحثة من قبل الإنسان. CTRL = التحكم ؛ FXS = متلازمة X الهشة ؛ GFAP = البروتين الحمضي الليفي الدبقي ؛ FUNCAT = وضع علامات على الأحماض الأمينية الفلورية غير القانونية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: إشارات Ca 2+ الناقصة التي أثارها ATP في الخلايا النجمية FXS المشتقة من hiPSC. (أ) الآثار التمثيلية للعابرين Ca2 + المسجلة من الخلايا النجمية الفردية عند التطبيق الخارجي ل ATP عند 25ثانية. (ب) متوسط نسب F340 / F380 التي تصور عابرين Ca2 + على مدى 250 ثانية بعد تطبيق ATP. (ج) بيانات مجمعة تظهر نسبة مئوية أعلى من غير المستجيبين ل ATP في الخلايا النجمية FXS المشتقة من hiPSC. تم تحديد الدلالة الإحصائية بواسطة ANOVA ثنائي العوامل مع مقارنة Tukey الزوجية. (D-F) القياس الكمي لاستجابة الذروة الأولى (السعة والمدة) وتواتر الأحداث. (د) يظهر انخفاضا كبيرا في السعة. تم تحديد الدلالة الإحصائية بواسطة ANOVA أحادي العامل مع المقارنة الزوجية ل Tukey و (E) المدة في الخلايا النجمية FXS المشتقة من hiPSC. الدلالة الإحصائية التي حددها اختبار Kruskal-Wallis مع اختبار المقارنة المتعددة ل Dunn ؛ يتم تمثيل مجموعة البيانات كرتب متوسطة مع SEM. (F) التمثيل الرسومي للتردد العابر Ca2+ في الخلايا النجمية FXS المشتقة من hiPSC. التحليل الإحصائي بواسطة ANOVA أحادي العامل مع مقارنة Tukey الزوجية. لجميع التجارب N = 3 مكررات بيولوجية. ن = 19 خلية لكل خط خلية. * ص < 0.05 ، ** ص < 0.01 ، *** ص < 0.001. تمثل أشرطة الخطأ SEM. # = الرقم. الاختصارات: hiPSCs = الخلايا الجذعية متعددة القدرات المستحثة من قبل الإنسان. CTRL = التحكم ؛ FXS = متلازمة X الهشة ؛ GFAP = البروتين الحمضي الليفي الدبقي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
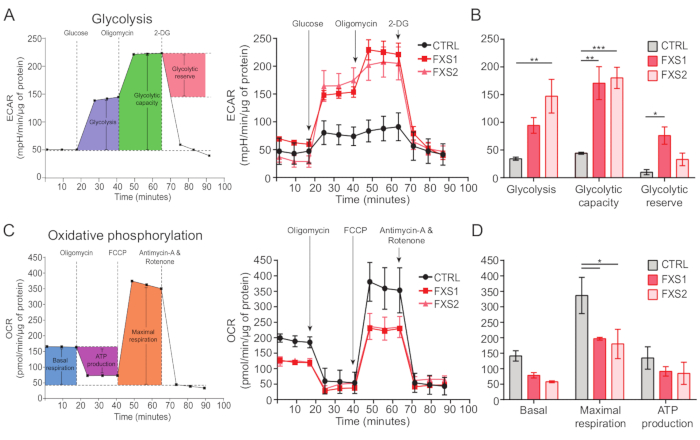
الشكل 5: عجز الطاقة الحيوية في الخلايا النجمية FXS المشتقة من hiPSC. (أ) رسم بياني خطي يمثل معدل التحمض خارج الخلية للخلايا النجمية المشتقة من hiPSC (CTRL و FXS) بعد إضافة 10 ملي مولار من الجلوكوز ، و 1 ميكرومتر من الأوليغومايسين ، و 50 ملي مولار 2-DG بالتتابع ورسمها على رسم بياني خطي. (ب) أظهر تحلل السكر ، والقدرة على تحلل السكر ، والقياس الكمي لاحتياطي تحلل السكر زيادة في الخلايا النجمية FXS المشتقة من hiPSC. تم إجراء التحليل الإحصائي بواسطة ANOVA ثنائي العنصر مع المقارنة الزوجية ل Tukey. (ج) رسم بياني خطي يصور قياس معدل استهلاك الأكسجين عن طريق الإضافة المتسلسلة ل 1.5 ميكرومتر من الأوليغومايسين ، و 1 ميكرومتر FCCP ، و 0.5 ميكرومتر من مضادات المايسين A والروتينون. (د) تم قياس التنفس القاعدي والتنفس الأقصى وإنتاج ATP من الرسم البياني الخطي وأظهرت الخلايا النجمية FXS المشتقة من hiPSC انخفاضا كبيرا في التنفس الأقصى مقارنة بالخلايا النجمية CTRL. تم إجراء التحليل الإحصائي بواسطة ANOVA ثنائي العنصر مع المقارنة الزوجية ل Tukey. بالنسبة لجميع التجارب ، N = 2 مكررات بيولوجية. * ص < 0.05 ، ** ص < 0.01 ، *** ص < 0.001. تمثل أشرطة الخطأ SEM. الاختصارات: hiPSCs = الخلايا الجذعية متعددة القدرات التي يسببها الإنسان. CTRL = التحكم ؛ FXS = متلازمة X الهشة ؛ ECAR = معدل التحمض خارج الخلية ؛ 2-DG = 2-deoxyglucose. OCR = معدل استهلاك الأكسجين ؛ FCCP = كربونيل سيانيد -4 (ثلاثي فلوروميثوكسي) فينيل هيدرازون الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الهوية في المخطوطة | الهوية في المصدر | عمر | جنس | اسم خط الخلية المعاد برمجته | طريقة إعادة البرمجة | نوع الخلية المبتدئة | النمط النووي لنطاق G |
| (سنوات) | |||||||
| CTRL | ND30625 | 76 | M | CS25iCTR-18nxx | النواقل العرضية | الخلايا الليفية | عادي |
| FXS1 | GM07072 | 22 | M | CS072iFXS-n4 | النواقل العرضية | الخلايا الليفية | عادي |
| FXS2 | GM05848 | 4 | M | CS848iFXS-n5 | النواقل العرضية | الخلايا الليفية | عادي |
الجدول 1: خطوط الخلايا المستخدمة في هذه الدراسةلتوليد الخلايا النجمية الخاصة بالدماغ الأمامي.
الشكل التكميلي S1: تقرير تحليل الكروموسومات. النمط النووي العادي لنطاقات GTG من (أ) CTRL 46 و XY و (B) FXS1 46 و XY و (C) FXS2 46 و XY. الرجاء النقر هنا لتنزيل هذا الرقم.
الجدول التكميلي S1: البادئات المستخدمة في هذه الدراسة لتوصيف الخلايا. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
هنا ، نصف طريقة لتوليد الخلايا النجمية البشرية المشتقة من iPSC والتي تعمل كمنصة فحص لتوصيف التغييرات الوظيفية التي يسببها FXS. هذه الخلايا النجمية قابلة للحياة وظيفيا في الثقافة وتظهر خصائص مختلفة ، كما يتضح من مجموعة من القياسات التي أجريت في هذه الدراسة. خطوة حاسمة في هذا البروتوكول هي التحويل الأولي ل iPSCs إلى الغلاف الجوي باستخدام طريقة الرفع الأنزيمية. في هذه المرحلة ، يعد تحسين وقت الحضانة للكولاجيناز من النوع الرابع والتباين أمرا بالغ الأهمية. إذا لم يتم تحسين ذلك, قد يتسبب ذلك في تفكك iPSCs أو تشكيل خلايا مفردة, مما سيمنع تكوين القشرة القشرية. تم تصميم هذه القشرة القشرية نحو خصوصية الدماغ الأمامي باستخدام تثبيط SMAD المزدوج15 ويتم تمييزها بشكل أكبر إلى خلايا سلفية للخلايا النجمية (APCs). لتحقيق عدد كبير من ناقلات الجنود المدرعة ، يعد التقطيع الميكانيكي للغلاف الدبقي أمرا بالغ الأهمية. يمكن استخدام qPCR في الوقت الفعلي لتأكيد خصوصية الدماغ الأمامي. لاحظنا زيادة كبيرة في تغيير الطية في FOXG1 ، وهي علامة للدماغ الأمامي ، مقارنة ب HOXB4 ، وهي علامة للحبل الشوكي.
ثم يتم تمييز APCs إلى خلايا نجمية باستخدام CNTF ، وهو منشط لمسار إشاراتJAK-STAT 16. تشير نتائج هذه الدراسة إلى أن الخلايا النجمية المتمايزة نهائيا المشتقة من FXS iPSCs لها مستويات أقل من GFAP ، مما يشير إلى ضعف النضج. على الرغم من أن تحليلاتنا لم تجد أي فرق في تخليق البروتين من جديد في الخلايا النجمية FXS و APCs مقارنة بالضوابط ، إلا أننا وجدنا انخفاضا في تخليق البروتين دي نوفو في الانتقال من APCs إلى الخلايا النجمية في كل من FXS وخطوط التحكم. يتوافق الانخفاض الكبير في الترجمة بين APCs والخلايا النجمية مع ترجمة أكثر انسيابية وتنظيما والتي تم إظهارها للخلايا العصبية مقابل الخلايا السليفةالعصبية 17. استخدم العمل السابق الذي فحص تخليق البروتين الشاذ أنسجة المخ الكاملة والخلايا العصبية والخلايا الليفية المشتقة من المريض ، وليس الخلايا النجمية أو APCs18. التقارير الوحيدة المنشورة عن تخليق البروتين من الخطوط المشتقة من المريض ليست في الخلايا النجمية ، ولكن من الخلايا الأرومية الليمفاوية19 والخلايا الليفية20،21. في ضوء هذه الاختلافات عبر الدراسات ، ستستفيد الدراسات المستقبلية من استخدام قياسات FUNCAT في الخلايا النجمية المشتقة من خطوط إضافية مشتقة من مريض FXS.
قمنا بتقييم وظائف الخلايا النجمية عن طريق قياس ديناميكيات الكالسيوم داخل الخلايا22 والطاقة الحيوية. أظهرت الخلايا النجمية FXS انخفاضا في سعة الذروة ومدة عابرة الكالسيوم التي يسببها ATP ، مع وجود عدد أقل من الخلايا التي تستجيب ل ATP عند مقارنتها بالخلايا النجمية المتحكمة. تشير هذه التعديلات معا إلى أن FXS يعطل توازن الكالسيوم في الخلايا النجمية البشرية. تتوافق هذه النتائج مع دراسة سابقة23،24 أبلغت عن ضعف نشاط مستقبلات IP3 في الخلايا الليفية FXS. علاوة على ذلك ، لاحظنا زيادة تحلل السكر ، والقدرة على تحلل السكر ، واحتياطي تحلل السكر في الخلايا النجمية FXS ، إلى جانب انخفاض معدلات استهلاك الأكسجين في الميتوكوندريا.
تصف الدراسة الحالية توليد وتوصيف نموذج جديد في المختبر للخلايا النجمية FXS من خلال الاستفادة من قوة iPSCs المشتقة من المريض. والجدير بالذكر أنه فقط من خلال دراسة سابقة باستخدام الخلايا النجمية البشرية المزروعة مع الخلايا العصبية البشرية ، اكتشفنا الدور الحاسم للخلايا النجمية في تحديد النمط الظاهري الفيزيولوجي الكهربي للخلاياالعصبية 14. ومع ذلك ، ركزت هذه الدراسات بالكامل تقريبا على التغيرات الناجمة عن المرض في نشاط الخلايا العصبية ، ولم يتم استكشاف أي شيء في الخلايا النجمية. هنا ، يقدم هذا البروتوكول إطارا جديدا لتحويل تركيزنا إلى التعديلات الوظيفية في الخلايا النجمية. وهذا بدوره سيسلط الضوء على تفاعلات الخلايا النجمية والخلايا العصبية التي لم يتم استكشافها سابقا ، مثل إشارات الغلوتامات والاستجابات الكهربائية. تؤكد نتائجنا في هذه المرحلة على الحاجة إلى إعطاء الأولوية للخلايا النجمية في الأبحاث المستقبلية.
من الأهمية بمكان الاعتراف بقيود هذا البروتوكول. أولا ، يتضمن التقطيع الميكانيكي ، مما يؤدي إلى تجزئة الحمض النووي أيضا. يمكن أن يتسبب ذلك في تكتل الغلاف الدبقي المفروم ، مما يؤدي في النهاية إلى موت الخلايا. ثانيا ، تعد كثافة بذر APCs أثناء خطوة التمايز النهائي للخلايا النجمية ضرورية لمنع تثبيط الخلايا الخلوية بوساطة الاتصال. يوصى بتحسين ذلك عبر خطوط الخلايا لمنع الانفصال عن سطح وعاء الاستزراع.
هنا ، النتائج التي توصلنا إليها هي أول تحليل من نوعه في الخلايا النجمية البشرية حيث استندت جميع الدراسات السابقة إلى أنواع أخرى من الخلايا مثل خطوط الخلايا الليمفاوية والأرومات الليفيةالبشرية 25. يعد استقلاب الطاقة المختل لاعبا معروفا في مسببات اضطرابات طيف التوحد كما يتضح من زيادة مستويات لاكتات البلازما البشرية ، وانخفاض معدل استهلاك الأكسجين بشكل ملحوظ في الخلايا المحببة26 ، وانخفاض التعبير عن جينات الفسفرة المؤكسدة للميتوكوندريا في القشرة الأمامية المتزامنة ، والقشرة الحركية ، والمهاد ، والمخيخ للأطفال المصابين باضطراب طيفالتوحد 27. تظهر تغييرات مماثلة في استقلاب الطاقة في الاضطرابات التنكسية العصبية مثل مرض باركنسون28 ومرض الزهايمر29 ، مما يشير إلى أن زيادة تحلل السكر قد تعوض عن انخفاض الوظيفةالوظيفية 30. هناك حاجة إلى دراسات مستقبلية لاستكشاف ما إذا كانت هناك آليات مماثلة تلعب دورا في استقلاب الطاقة المختل الوظيفي الذي شوهد في الخلايا النجمية المشتقة من مريض FXS.
في الوقت الحاضر ، يعد توليد الخلايا النجمية الخاصة بالدماغ الأمامي إنجازا مهما ، لكن التطورات المستقبلية يمكن أن تسمح بإنشاء الخلايا الدبقية الخاصة بالمنطقة ، مثل الخلايا النجمية القشرية / الحصينية. سيوفر هذا رؤى أعمق حول الأدوار المميزة التي تلعبها هذه الخلايا النجمية في وظائف الدماغ الإقليمية ، واللدونة المشبكية ، والتفاعلات العصبية الدبقية. يمكن أن تؤدي القدرة على توليد مثل هذه الخلايا النجمية الخاصة بالمنطقة إلى تطوير نماذج النمو العصبي والأمراض التنكسية العصبية. في النهاية ، يمكن أن يؤدي هذا إلى استراتيجيات علاجية أكثر دقة تستهدف ضعف الخلايا النجمية في مناطق معينة من الدماغ.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإفصاح عنه.
Acknowledgements
نشكر البروفيسور سومانترا تشاتارجي على الأموال الداخلية. نشكر البروفيسور جايتي حسن على الوصول إلى إعداد تصوير الكالسيوم ، ومرفق التصوير والتدفق المركزي - المركز الوطني للعلوم البيولوجية ، وبادماناب سينغ وبرانگیا هوتا للتدقيق اللغوي والاقتراحات ، وفريق Labmate Asia لمساعدتهم في إجراء فحوصات Seahorse XF.
Materials
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
References
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved