Method Article
יצירה ואפיון של אסטרוציטים שמקורם בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם וחסרים ריבונוקלאופרוטאין שליח X שביר
In This Article
Summary
כאן אנו מתארים פרוטוקול המאפשר התמיינות של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם לאסטרוציטים פונקציונליים ספציפיים למוח הקדמי. זה מאפשר לחקור את תפקידם של תאי גליה בפתוגנזה של הפרעות נוירו-התפתחותיות, כגון תסמונת ה-X השביר, ומודלים של הפרעות מוח אחרות.
Abstract
תסמונת ה-X השביר (FXS), גורם תורשתי מוביל להפרעת הספקטרום האוטיסטי ולמוגבלות שכלית, נחקרה בהרחבה באמצעות מודלים של מכרסמים. לאחרונה, נעשה שימוש גם במערכות מודל שמקורן בתאי גזע אנושיים כדי להשיג תובנות מכניסטיות לגבי הפתופיזיולוגיה של FXS. עם זאת, מחקרים אלה התמקדו כמעט אך ורק בנוירונים. יתר על כן, למרות הראיות ההולכות וגדלות לתפקיד מפתח של גליה בתפקוד עצבי בבריאות ובמחלות, מעט ידוע על האופן שבו אסטרוציטים אנושיים מושפעים מ-FXS.
לכן, במחקר זה, פיתחנו בהצלחה פרוטוקול הלוכד אבני דרך מרחביות-זמניות מרכזיות בהתפתחות המוח ומיישר קו גם עם תהליך הגליוגנזה. יחד זה מציע מסגרת שימושית לחקר הפרעות נוירו-התפתחותיות. ראשית, עיצבנו את תאי הגזע הפלוריפוטנטיים המושרים על ידי בני אדם לשושלת הנוירו-אקטודרמלית עם מדכא כפול של אמהות כנגד עיכוב דקפנטפלגי (SMAD) ומולקולות קטנות. לאחר מכן, השתמשנו בגורמי גדילה וציטוקינים ספציפיים כדי ליצור תאי אב אסטרוציטים שמקורם בחולה (CTRL) ו-FXS. טיפול ב-APCs עם גורם נוירוטרופי רירי, ציטוקין מבדיל, מווסת והניע את תאי האב לקראת התבגרות אסטרוציטית, והניב אסטרוציטים המבטאים חלבון חומצי סיבי גליה ספציפי למוח הקדמי.
מצאנו כי אסטרוציטים אלה מתפקדים, כפי שמעידים תגובות הסידן שלהם ליישום ATP, והם מציגים מטבוליזם גליקוליטי ומיטוכונדריאלי לא מווסת ב-FXS. יחד, ממצאים אלה מספקים פלטפורמה ניסויית שימושית ממוצא אנושי לחקירת השלכות אוטונומיות תאיות ולא אוטונומיות של תאים של שינויים בתפקוד האסטרוציטי הנגרמים על ידי הפרעות נוירו-התפתחותיות.
Introduction
תסמונת X שביר (FXS), צורה תורשתית נפוצה של מוגבלות שכלית והפרעת הספקטרום האוטיסטי (ASD), נגרמת על ידי היעדר ריבונוקלאופרוטאין שליח X שביר (FMRP) המיוצר על ידי הגן ריבונוקלאופרוטאין שליח X שביר 1 (FMR1) (OMIM: #300624, https://www.omim.org/entry/300624). FMRP ממלא תפקיד בוויסות תרגום mRNA, היווצרות והובלה של גרגירי mRNA וויסות בתיווך microRNA של ביטוי גנים1. לפיכך, אובדן FMRP משפיע לא רק על התפתחות המוח אלא גם על תפקוד המוח של מבוגרים. גם רמות תעתיק mRNA של FMR1 וגם צביעה חיסונית עבור FMRP במוח הראו ביטוי עצבי גבוה, לצד ביטוי משמעותי גם בתאי גליה2. עם זאת, הרוב המכריע של המחקרים הקודמים במודלים של בעלי חיים של FXS התמקדו בעיקר בתאי עצב וסטיות בתפקודם. כתוצאה מכך, מעט ידוע על תפקידה של גליה ב-FXS3. באופן מסורתי נחשב לתאי "תמיכה פסיבית"4, ישנן עדויות מצטברות לכך שאסטרוציטים הם קריטיים בתיווך מגוון רחב של תפקודים עצביים 5,6, כולל קידום סינפטוגנזה7, חידוד של מעגלים עצביים מתפתחים8 ומיחזור נוירוטרנסמיטורים9. במקביל, ישנן עדויות הולכות וגדלות לתפקידם של אסטרוציטים בפתוגנזה של מחלות ומצבים נוירולוגיים רבים נקשרו לתפקוד לקוי של אסטרוציטים10.
בעוד שחלק ניכר מהעבודה המוקדמת יותר שהשתמשה במודלים של בעלי חיים של FXS התמקדה בזיהוי ואימות מטרות מולקולריות שונות בתאי עצב לטיפול ב-FXS, ממצאים פרה-קליניים אלה לא תמיד הובילו לתוצאות קליניות מוצלחות. יתר על כן, כישלונות בניסויים הקליניים האחרונים מדגישים גם את הצורך במערכות מודלים מבוססות אדם. מודלים של הפרעות נוירולוגיות המבוססים על תאי מוח שמקורם בתאי גזע אנושיים מציעים אסטרטגיה רבת עוצמה לגשר על הפער הזה בין תובנות מכניסטיות ממחקרים בבעלי חיים לבין הצלחה מוגבלת בתוצאות קליניות עבור חולים. עם זאת, רק קומץ מהמחקרים הללו התמקדו באסטרוציטים וגם זה בעיקר באסטרוציטים שמקורם בעמוד השדרה. זה, בתורו, רלוונטי לאור מחקרים המראים כי המבנה והתפקוד של אסטרוציטים משתנים בין אזורי מוח11,12. לכן, הבנה טובה יותר של שינויים שנגרמים על ידי מחלות באסטרוציטים אנושיים צריכה גם לקחת בחשבון את ההבדלים הספציפיים לאזור המוח הזה באסטרוציטים. עם זאת, מודלים של הפרעות נוירו-התפתחותיות המשתמשות באסטרוציטים שמקורם בתאי גזע אנושיים הספציפיים למוח הקדמי נותרו לא נחקרים באופן יחסי13. לפיכך, כדי להתחיל לטפל בפערים אלה, אנו מתארים פרוטוקולים ליצירת אסטרוציטים ספציפיים למוח הקדמי מתאי גזע פלוריפוטנטיים מושרים (iPSCs) שמקורם בחולה הנושאים מוטציות FXS; יתר על כן, אנו מראים שאסטרוציטים מתפקדים ומציגים חילוף חומרים שונה.
Protocol
כל הניסויים בתאי גזע פלוריפוטנטיים מושרים אנושיים (hiPSCs) (טבלה 1) בוצעו לאחר קבלת אישורים רגולטוריים מוסדיים מתאימים. איור 1A מייצג פרוטוקול התמיינות מלא של hiPSCs לאסטרוציטים בוגרים ספציפיים למוח הקדמי.
1. תחזוקה והרחבה של hiPSCs
- יום אחד לפני ציפוי ה-iPSCs, צפו צלחת של 6 בארות במטריג'ל מדולל 1:60 (מטריצה חוץ-תאית [ECM]) ב-Modified Eagle Medium/F-12 של Ham (DMEM/F12) של Advanced Dulbecco ואחסנו בטמפרטורה של 2-8 מעלות צלזיוס.
הערה: הימנע מאחסון כלים מצופים מטריג'ל למשך >5 ימים בטמפרטורה של 2-8 מעלות צלזיוס, מכיוון שהדבר עלול לגרום לפירוק החלבון ב-ECM לאורך זמן. כדי למנוע ייבוש של המנה, מצפים מינימום 1 מ"ל של מטריג'ל מדולל 1:60 לבאר אחת של צלחת בת 6 בארות ומורחים באופן שווה על פני המנה. אם משתמשים באותו יום, יש לשמור את הצלחת בחממה לחה בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 למשך שעה. - ביום גידול ה-hiPSCs, הסר את חומר הציפוי והוסף 1 מ"ל של מדיום Essential 8 שלם (מדיום בסיסי E8 עם תוסף Essential 8) יחד עם מעכב ROCK בריכוז סופי פי 1 ושמור את המנה באינקובטור של 37 מעלות צלזיוס ו-5% CO2 לפני הוספת ה-hiPSCs.
- השעו מחדש את ה-hiPSCs במדיום E8 שלם יחד עם מעכב ROCK בריכוז סופי פי 1 להיצמדות טובה יותר של המושבות.
הערה: אין להכין כמויות גדולות של מדיום תרבית. מכינים רק 3-4 ימים לכל היותר ושומרים בטמפרטורה של 2-8 מעלות צלזיוס. - למחרת, יש לחדש את מדיום E8 המלא ללא מעכב ROCK עד שהתאים מתכנסים ב-80% (כ-4-5 ימים).
- כאשר הם מגיעים למפגש של 80%, נתקו את המושבות באופן אנזימטי.
- כדי להעביר את ה-iPSCs, הוציאו את החומר המשומש מהצלחת והוסיפו 1 מ"ל לכל באר של תערובת קולגנאז (2 מ"ג/מ"ל) מחוממת מראש (37 מעלות צלזיוס) ודיספאזה (1 מ"ג/מ"ל) ביחס של 1:1 ודגירה בטמפרטורה של 37 מעלות צלזיוס למשך יותר מ-20-30 דקות כדי לאפשר למושבות ה-iPSC להתרומם.
הערה: אין להשאיר את הכלים בטמפרטורה של 37 מעלות צלזיוס למשך יותר מ-20-30 דקות; מעבר לתקופה זו, המושבות יתפרקו והתאים ימותו.
- כדי להעביר את ה-iPSCs, הוציאו את החומר המשומש מהצלחת והוסיפו 1 מ"ל לכל באר של תערובת קולגנאז (2 מ"ג/מ"ל) מחוממת מראש (37 מעלות צלזיוס) ודיספאזה (1 מ"ג/מ"ל) ביחס של 1:1 ודגירה בטמפרטורה של 37 מעלות צלזיוס למשך יותר מ-20-30 דקות כדי לאפשר למושבות ה-iPSC להתרומם.
- כאשר המושבות מתחילות להתרומם, הוציאו את הכלים מהאינקובטור ונטרלו את פעילות האנזים על ידי הוספת 2 מ"ל של תמיסת מלח פוספט (DPBS) של Dulbecco.
- מגרדים את המושבות עם DPBS ואוספים את המתלה בצינור חרוטי של 15 מ"ל באמצעות פיפטה סרולוגית רחבה של 10 מ"ל.
- יש לשלש בעדינות את התרחיף פי 2-3 כדי לפרק את המושבות באמצעות פיפטה סרולוגית של 10 מ"ל, ולאפשר למושבות להתייצב.
הערה: אל תהפוך את המושבות לתאים בודדים; זה עלול לגרום לכך שהתאים לא ייצמדו לצלחת ולגרום למוות נוסף של תאים. יתר על כן, אל תשאירו אותם כמושבות גדולות; זה יוביל למושבות מובחנות יותר בהמשך. - לאחר שהמושבות מתייצבות (בערך לאחר 2 דקות), שאבו את תערובת האנזים DPBS והשאירו כ-1 מ"ל בצינור.
- הוסף 2 מ"ל DPBS לצינור, ערבב את המושבות על ידי הקשה ואפשר להן להתייצב. חזור על פעולה זו פעמיים כדי להסיר את כל שאריות האנזים מהמושבות. הסר כמה שיותר סופרנטנט לאחר הכביסההשנייה , השהה מחדש את המושבות ב -1 מ"ל של E8 בינוני שלם, וצלחת בכלי טרי שהוזכר בשלבים 1.2-1.3.
- לחלופין, שימור בהקפאה של חלק מהמושבות תוך שימוש ב-10% דימתיל סולפוקסיד (DMSO) כתמיסה להגנה מפני הקפאה להרחבה ושימוש עתידיים.
- הכן מדיום שימור בהקפאה טרי על ידי ערבוב של 90% מדיום E8 שלם ו-10% DMSO כתמיסה להגנה מפני הקפאה והנח אותו בטמפרטורה של 2-8 מעלות צלזיוס עד לשימוש.
- כדי לשמר בהקפאה, בצע את שלבים 1.5-1.10.
- במהלך שלב 1.10, לאחר הכביסההשנייה , אפשר למושבות להתיישב ולהסיר את הסופרנטנט. למושבות מוסיפים 1 מ"ל של מדיום שימור קר טרי שהוכן ומעבירים לקריוביאלים.
הערה: לאחר הוספת אמצעי השימור בהקפאה למושבות, העבירו במהירות את התכולה לקריוביאלים. עיכוב עלול לגרום לקצב תחייה נמוך יותר מכיוון ש-DMSO הוא חומר מגן בהקפאה שעלול לפגוע בתאים. - העבירו מיד את הקריוביאלים לקריובוקס ושמרו במקפיא של -80 מעלות צלזיוס למשך הלילה.
- למחרת, העבירו את כל הקריוביאלים למיכל חנקן נוזלי (מיכל LN2 ) לשימוש עתידי.
הערה: יש לבצע קריוטיפ שגרתי של hiPSCs באמצעות פס G (איור משלים S1) עבור כל חריגה, המאופיין באמצעות אימונוציטוכימיה לפלוריפוטנטיות (איור 1B), ולבדוק מיקופלזמה.- כדי לאפיין hiPSCs באמצעות אימונוציטוכימיה, יש לצלחת את המושבות על כיסויי זכוכית 13 מ"מ מצופים מטריג'ל 1:60. לאחר שהם מתכנסים ב-40%, שטפו את התאים עם PBS-T (PBS-0.1% Tween 20), התקנו עם 4% פרפורמלדהיד למשך 10 דקות, חלחלו עם 0.3% טריטון X-100 ב-PBS למשך 10 דקות, וחסמו עם 3% אלבומין בסרום בקר (BSA) ב-PBS למשך שעה אחת כדי למנוע קשירה לא ספציפית.
- לאחר החסימה, יש לדגור על התרביות עם נוגדנים ראשוניים למשך שעה אחת ולאחר מכן לשטוף 3 פעמים עם PBS-T למשך 5 דקות כל אחת, ולאחר מכן נוגדנים משניים מתאימים (טבלת חומרים) בחושך למשך שעה.
- הרכיבו את הכיסויים על שקופיות זכוכית עם אמצעי הרכבה והשיגו תמונות על ידי סריקת לייזר קונפוקלית ב-405 ננומטר, 488 ננומטר, 561 ננומטר ו-633 ננומטר. צלם תמונות ברזולוציה של 512 x 512 פיקסלים; הגדר את גודל צעד Z ל-0.5 מיקרומטר עם יחידה אוורירית אחת בקוטר חור סיכה.
2. יצירה ואפיון של תאי אב אסטרוציטים (APCs)
- הרם אנזימטית את ה-hiPSCs כפי שהוזכר בשלבים 1.5-1.10 וצלח אותם על צלחת תרבית תרחיף שאינה נדבקת (100 מ"מ) עם מדיום14 מוגדר כימית המכיל 50% מדיום Dulbecco שונה של Iscove (IMDM), 50% תערובת חומרים מזינים F-12 של חזיר (F12), 5 מ"ג/מ"ל BSA, 1% תרכיז ליפידים מוגדר כימית (CD-Lipid), 450 מיקרומטר מונותיוגליצרול, 7 מיקרוגרם/מ"ל אינסולין, 15 מיקרוגרם/מ"ל טרנספרין, 1% פניצילין-סטרפטומיצין בתוספת מיטוגנים לדפוס המוח הקדמי N-אצטיל ציסטאין (1 מ"מ), LDN 193189 (0.1 מיקרומטר) ו-SB431542 (10 מיקרומטר) למשך 7 ימים.
הערה: מעכבי מולקולות קטנות SB431542 ו-LDN-193189 (LDN) הם מעכבים של חלבון מורפוגנטי בעצם ומסלולי איתות של גורם גדילה-בטא.
מנקודה זו ואילך, המדיום התחדש אחת ליומיים או לפי פרוטוקול שני/רביעי/שישי. - הנח את תרחיף התא על שייקר אורביטלי במהירות של 40 סל"ד למשך 7 ימים בתנאים נורמוקסיים כדי לסייע בהתפתחות קורטיקוספירות (איור 1A).
- ביום השמיני, העבירו את הקורטיקוספרות למדיום שגשוג תאים המכיל DMEM/F12 מתקדם עם 1% אנטיביוטיקה-אנטי-פטריית, 1% תוסף N2, 1% תחליף גלוטמין, 0.1% תוסף B27 ו-2.5 ננוגרם/מ"ל גורם גדילה פיברובלסטים בסיסי (bFGF) למשך 7 ימים.
- עורר את הכדורים למפרט גליה על ידי חשיפתם למדיום העשרת גליה המכיל DMEM/F12 מתקדם עם 1% אנטיביוטיקה-אנטי-פטריית, 1% N2, 1% תחליף גלוטמין, 0.1% תוסף B27, 20 ננוגרם/מ"ל גורם גדילה אפידרמלי (EGF), bFGF-H (20 ננוגרם/מ"ל bFGF-5 מ"ג/מ"ל הפרין) למשך שבועיים כדי לקבל גליוספרות מוקדמות (איור 1A).
- להבשלה של גליוספרות מוקדמות, החלף את bFGF-H בגורם מעכב לוקמיה (LIF) של 20 ננוגרם/מ"ל ושמור על הכדורים למשך 4 שבועות.
- לאחר 4 שבועות במדיום ההתבגרות, שמור על הכדורים במדיום העשרת גליה לתקופות ממושכות. כדי למנוע צבירה ואובדן כדאיות, כל שבועיים, קוצצים מכנית את הגליוספירה באמצעות להב תעשייתי סטרילי ומחליפים את כל המדיום ב-DNase I כדי להסיר שברי DNA שנוצרו מהקיצוץ.
- לפרק את הגליוספירה לחד-שכבות של APCs באמצעות ערכת דיסוציאציה של פפאין וצלחת על צלחת דבק שטופלה בתרבית תאים עם דילול של 1:80 של ציפוי מטריג'ל.
- הפיצו את ה-APCs במדיום העשרת גליה עד ל-80% מתכנסים והעבירו אותם אנזימטית באמצעות מדיום ניתוק תאי האנזים (ראה טבלת החומרים).
- כדי לקטע:
- הסר את המדיה המושקעת ואסוף בצינור חרוטי. לתאים, הוסף את מדיום ניתוק תאי האנזים והמתן 1-2 דקות. ברגע שהתאים מתחילים להתנתק, הוסף את המדיה המושקעת כדי לנטרל את פעילות האנזים.
- אסוף את מתלה התא והצנטריפוגה ב 800 x ɡ למשך 2 דקות.
- שאפו את הסופרנטנט, השעו מחדש את התאים במדיום העשרת גליה, וצלחו כ-1 x 106 תאים/באר על צלחת 6 בארות מצופה מטריג'ל 1:80.
- לשימור בהקפאה:
- השעו מחדש את התאים בתערובת קרה של 90% מדיום התפשטות קורטיקוספירה (ללא bFGF) ו-10% קריופרוטקטנט. העבר את התאים המרחפים לקריוביאלים.
- העבירו מיד את הקריוביאלים לקריובוקס ושמרו במקפיא של -80 מעלות צלזיוס למשך הלילה.
- למחרת, העבירו את כל הקריוביאלים למיכל חנקן נוזלי (מיכל LN2 ) לשימוש עתידי.
הערה: נגמ"שים נשמרו בהקפאה באמצעות 10% DMSO עד למעבר מספר 6.
- אפיינו את ה-APCs המנותקים על ידי צביעה חיסונית (כפי שהוזכר בשלבים 1.15.1-1.15.3) עם סמני וימנטין וגורם גרעיני IA (NFIA) (איור 1C,D) (ראה טבלת החומרים לדילול).
- כדי לאשר את הספציפיות האזורית של המוח הקדמי של APCs שמקורם ב-hiPSC, בדוק את התאים עבור סמן מוח קדמי כגון תיבת ראש מזלג אנושי G1 (hFOXG1) (חיובי) וסמן מוח אחורי כגון Homeobox B4 אנושי (hHOXB4) (שלילי) באמצעות qPCR בזמן אמת (איור 1E,F).
הערה: רצפי הפריימר המשמשים לניסויים אלה מפורטים בטבלה משלימה S1.
3. יצירה ואפיון של אוכלוסייה הומוגנית של אסטרוציטים ספציפיים למוח הקדמי
- הבחנה בין אסטרוציטים לנגמ"שים
- השתמש במדיום התמיינות אסטרוציטי (ADM) במשך 14 יום כדי להבדיל APCs לאסטרוציטים. מדיום התמיינות אסטרוציטי מכיל נוירו-בזאלי, 1% אנטיביוטיקה-אנטי-פטריית, 1% תחליף גלוטמין, 1% תוסף N2, 0.2% תוסף B27, 1% מדיום חומצות אמינו לא חיוניות (NEAA) ו-10 ננוגרם/מ"ל גורם נוירוטרופי ריסני (CNTF).
- אשר את הזהות האסטרוציטית על ידי שימוש בצביעה חיסונית (כפי שהוזכר בשלבים 1.15.1-1.15.3.) עם חלבון חומצי סיבי גליה (GFAP) וסמני ביטוי S100β (איור 2A,B).
- סינתזת חלבון דה נובו ב-APCs ובאסטרוציטים
- שמור על נגמ"שים ואסטרוציטים במוח הקדמי שמקורם ב-hiPSC על כיסויי זכוכית סטריליים 13 מ"מ שעברו חיטוי והכתים אותם כאמור בשלבים 1.15.1-1.15.3.
- לסינתזה של חלבון דה נובו , השתמש בשיטת תיוג חומצות אמינו פלואורסצנטיות לא קנוניות (FUNCAT), שהוסברה בקצרה בשלבים 3.2.3-3.2.6 (איור 3A).
- כדי להבטיח מחסור במתיונין, הסר את מצע הגידול מהתרביות והחלף במדיום נטול מתיונין וציסטאין מעורבב עם 1 מ"מ L-azidohomoalanine (AHA) למשך 30 דקות ב-37 מעלות צלזיוס ו-5% CO2.
- שטפו את התרביות עם PBS-T, קבעו עם 4% פרפורמלדהיד למשך 10 דקות, חלחלו עם 0.3% טריטון X-100 ב-PBS למשך 10 דקות, וחסמו עם 3% BSA ב-PBS למשך שעה אחת כדי למנוע קשירה לא ספציפית.
- דגרו את התרביות בחושך למשך שעה אחת בטמפרטורת החדר עם תערובת תגובה כימית של תאי קליק ואלקין אלקסה פלואור 647, ואחריהם נוגדנים ראשוניים למשך שעה ונוגדנים משניים מתאימים (טבלת חומרים) למשך שעה אחת (איור 3B).
- הרכיבו את הכיסויים על שקופיות זכוכית עם אמצעי הרכבה והשתמשו בהם לניתוח תמונה נוסף.
- השג תמונות על ידי סריקת לייזר קונפוקלית ב-405 ננומטר, 488 ננומטר, 561 ננומטר ו-633 ננומטר.
- צלם תמונות ברזולוציה של 512 x 512 פיקסלים; הגדר את גודל צעד Z ל-0.5 מיקרומטר עם יחידה אוורירית אחת בקוטר חור סיכה.
- שמור על פרמטרי המיקרוסקופיה וההדמיה בהגדרה קבועה בין סוגי תאים. צלם תמונות עבור כל שכפול ביולוגי באותו מפגש.
- בצע מדידות עוצמה באמצעות כל תוכנת ניתוח תמונה סטנדרטית (למשל, פיג'י או אימריס). ב-Imaris, השתמש במודול SURFACES כדי להניב מדידות נפחיות של גופי תאים חיוביים לאות תיוג חומצות אמינו לא קנוניות פלואורסצנטיות (FUNCAT) עם וימנטין (APCs) ו-GFAP (אסטרוציטים) המגבילים את טווח הווקסל (250-350) להסרת פסולת.
הערה: שמור על הפרמטרים על פני כל השכפולים הביולוגיים עבור שני סוגי התאים.
- גלי סידן תנודתיים המושרים על ידי אדנוזין 5′-טריפוספט (ATP)
- צלחת אסטרוציטים על צלחת תחתית זכוכית (35 מ"מ) ב-5 ×-103 תאים/צלחת כדי למדוד את התגובה התאית ל-ATP.
- אפשר לתאים להיצמד לתחתית הזכוכית למשך 24 שעות, שטוף אותם פי 3 עם HBSS (20 מ"מ HEPES, 137 מ"מ NaCl, 5 מ"מ KCl, 10 מ"מ גלוקוז, 1 מ"מ MgCl2, pH = 7.3) ללא סידן, ודגר במדיום תרבית עם צבע מטרי ביחס של 5 מיקרומטר Fura-2AM ו-0.02% פלורוניקה F127 למשך שעה בטמפרטורת החדר.
הערה: Fura-2AM הוא כימיקל רגיש לאור ולטמפרטורה; יש לאחסן בטמפרטורה של -20 מעלות צלזיוס. - לאחר הדגירה, שטפו פי 2 עם מדיום תרבית והחליפו ב-2 מ"מ Ca2+ המכיל HBSS ודמו את התאים במהירות של 2 FPS באמצעות מטרת שמן פי 60 (1.35 NA) במיקרוסקופ הפוך מפצה על סחיפה ממוקדת.
- רשום תגובות סידן הנגרמות על ידי ATP על ידי יישום אמבטיה של ATP בריכוז הסופי של 5 מ"מבשנייה ה-25 (איור 4A).
- ציירו אזורי עניין סביב כל תא באמצעות Fiji/ImageJ וחשבו את היחס F340/F380 על פני כל נקודות הזמן (איור 4B).
- בדיקות מטבוליות של תאים
הערה: קצב צריכת החמצן (OCR) וקצב החמצה חוץ-תאית (ECAR) של תאים חיים נמדדו בהתאם לפרוטוקול היצרן (ראה טבלת החומרים).- יום אחד לפני הבדיקה, אפשר לאסטרוציטים להיצמד למיקרו-צלחת (צפיפות זריעה של 1.5 × 104 ) במדיום CNTF ולדגור בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2.
- לבדיקת מתח גליקוליזה:
- החלף את מדיום תרבית התאים במדיום בסיס בתוספת 2 מ"מ גלוטמין (pH מותאם ל-7.4) ודגר בתא שאינו CO2 ב-37 מעלות צלזיוס למשך שעה.
הערה: יש לכוונן את ה-pH באמבט מים של 37 מעלות צלזיוס. - הכנס את לוחית המחסנית למכשיר כדי לכייל את החיישן. לאחר הכיול, החלף את לוחית המחסנית בלוחית תרבית התאים בריכוז סופי של רכיבי הערכה הבאים: 10 מ"מ גלוקוז, 1 מיקרומטר אוליגומיצין ו-50 מ"מ 2-דאוקסי-גלוקוז (2-DG) (איור 5A).
- בסיום הבדיקה, יש ליז את התאים ולהעריך את תכולת החלבון הכוללת.
- החלף את מדיום תרבית התאים במדיום בסיס בתוספת 2 מ"מ גלוטמין (pH מותאם ל-7.4) ודגר בתא שאינו CO2 ב-37 מעלות צלזיוס למשך שעה.
- לבדיקת המתח של המיטוכונדריון:
- החלף את מדיום ה-CNTF במדיום בסיס בתוספת 2 מ"מ גלוטמין, 1 מ"מ פירובאט, 10 מ"מ גלוקוז (pH מותאם ל-7.4) באמבט מים ב-37 מעלות צלזיוס.
- דגרו את הצלחת בתא שאינו CO2 בטמפרטורה של 37 מעלות צלזיוס למשך שעה. בינתיים, הכנס את לוחית המחסנית למכשיר כדי לכייל את החיישן.
- לאחר הכיול, החלף את לוחית המחסנית בלוחית תרבית התאים בריכוז סופי של רכיבי הערכה הבאים: 1.5 μM אוליגומיצין, 1 μM קרבוניל ציאניד-4 (trifluoromethoxy) פנילהידרזון (FCCP), ו-0.5 μM רוטנון/אנטימיצין A (איור 5C).
- בסיום הבדיקה, יש ליז את התאים ולהעריך את תכולת החלבון הכוללת.
תוצאות
מושבות תאי גזע פלוריפוטנטיים מושרים אנושיים (hiPSC) נשמרו באמצעות מדיום מוגדר זמין מסחרית וצבוע חיסון עבור סמני פלוריפוטנטיות, Oct4 ו-Nanog (איור 1B). נגמ"שי FXS ו-CTRL הראו פרופורציות דומות של תאים מועשרים מאוד עבור וימנטין ו-NFIA (איור 1C,D). מצאנו כי APCs שמקורם ב-hiPSCs בריאים ו-FXS הראו ויסות משמעותי של FOXG1 בהשוואה ל-HOXB4 (איור 1F) התואם לזהות מוחית קדמית דומיננטית. ראינו ירידה משמעותית במספר האסטרוציטים המבטאים GFAP בקבוצות FXS בהשוואה לאסטרוציטים CTRL מבלי להשפיע על מספר האסטרוציטים המבטאים S100β (איור 2B). ניתוח כתמים מערביים הראה כי האסטרוציטים שנוצרו משני קווי ה-FXS חסרים ביטוי של FMRP (איור 2C,D). כימות של חלבונים שסונתזו לאחרונה לא גילה שום הבדל משמעותי בין קווי CTRL לעומת FXS ב-APCs או באסטרוציטים (איור 3C). אולם מצאנו שסינתזת החלבון גבוהה יותר באופן עקבי ב-APCs מאשר באסטרוציטים שלהם עבור כל קו (איור 3C). תוצאות אלו מצביעות על הפחתה ספציפית לשלב בסינתזת חלבון דה נובו מ-APCs לאסטרוציטים הן בקווי FXS והן ב-CTRL.
בקרה, כמו גם אסטרוציטים של FXS, הראו מעברי סידן המושרים על ידי ATP (איור 4A). אולם ניתוח מפורט יותר חשף כמה הבדלים עיקריים בין מעברי הסידן הבודדים שנרשמו מאסטרוציטים CTRL, FXS1 ו-FXS2 (איור 4B). סיווגנו את האסטרוציטים כמגיבים וכלא מגיבים ל-ATP בהתבסס על נוכחות או היעדר תגובת סידן, בהתאמה (איור 4C). מספר המגיבים ב-FXS1 ו-FXS2 היה נמוך משמעותית מ-CTRL. באופן ספציפי, ראינו ירידה משמעותית במשרעת השיא של חולף הסידן הראשון שהתעורר לאחר יישום ATP בשני קווי האסטרוציטים של FXS (איור 4D). יתר על כן, משך הזמן הכולל של חולף הסידן הראשון היה קצר משמעותית בקווי FXS1 ו-FXS2 מאשר ב-CTRL (איור 4E). עם זאת, מספר אירועי הסידן (מכומת כמספר הכולל של אירועים לכל 250 שניות; איור 4F), היה בר השוואה בין השורות. יחד, ממצאים אלה חושפים שינויים בתגובות הסידן שעורר ATP באסטרוציטים FXS שמקורם ב-hiPSC. תוצאות ECAR מצביעות על שיעור גבוה יותר של גליקוליזה, קיבולת גליקוליטית ורזרבה גליקוליטית באסטרוציטים FXS שמקורם ב-hiPSC (איור 5A,B). לא מצאנו הבדל משמעותי בנשימה הבסיסית באסטרוציטים CTRL ו-FXS. ייצור ATP סלולרי לא הראה הבדל משמעותי בין אסטרוציטים CTRL ו-FXS. גירוי FCCP עורר נשימה מקסימלית נמוכה משמעותית באסטרוציטים FXS מאשר באסטרוציטים CTRL (איור 5C,D).

איור 1: גזירה של תאי אב אסטרוציטים ספציפיים למוח הקדמי מ-hiPSCs. (A) תהליך עבודה להמחשה עבור יצירת אסטרוציטים מ-hiPSCs. (B) תמונות מייצגות של hiPSCs המציגות ביטוי דומה של Oct4/Nanog בקווי CTRL ו-FXS. (C) אוכלוסייה הומוגנית של APCs שמקורם ב-hiPSC ביטאה מספר דומה של תאים חיוביים ל-Vimentin ו-NFIA. (D) אין הבדל משמעותי בביטוי של Vimentin- ו-NFIA בין נגמ"שי CTRL ו-FXS. הניתוח הסטטיסטי נעשה באמצעות ANOVA דו-גורמי ואחריו ההשוואה הזוגית של טוקי. (E) סכמטי הממחיש ביטוי ספציפי לאזור של FOXG1 ו-HOXB4 במהלך פיתוח in vivo. (F) ייצוג גרפי של ביטוי FOXG1 בהשוואה ל-HOXB4 (באמצעות qRT-PCR) על פני גנוטיפים המרמזים על נטייה לשושלת המוח הקדמי. ניתוח סטטיסטי על ידי ANOVA דו-גורמי ואחריו מבחן ההשוואה המרובה של סידק. עבור כל הניסויים N = 3 שכפולים ביולוגיים. עמ' < 0.001. סרגל קנה מידה = 50 מיקרומטר. קווי שגיאה מייצגים SEM. קיצורים: hiPSCs = תאי גזע פלוריפוטנטיים מושרים אנושיים; CTRL = שליטה; FXS = תסמונת ה-X השביר; APCs = תאי אב אסטרוציטים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: מספר מופחת של אסטרוציטים FXS שמקורם בחלבון חומצי חומצי חיובי לחלבון סיבי גליה. (A) תמונות מייצגות של אסטרוציטים שמקורם ב-hiPSC המציגים ביטוי S100β ו-GFAP. (B) אחוז האסטרוציטים החיוביים ל-GFAP היה נמוך משמעותית באסטרוציטים שמקורם ב-FXS בהשוואה ל-CTRL, אף על פי ששניהם הראו ביטוי S100β דומה. מובהקות סטטיסטית נקבעת על ידי ANOVA דו-גורמי ואחריו ההשוואה הזוגית של טוקי. (C) כתם חיסוני שמייצג ביטוי של FMRP באסטרוציטים מ-CTRL ו-FXS. (D) גרפים שמראים היעדר FMRP באסטרוציטים FXS שמקורם ב-hiPSC. ניתוח סטטיסטי שנעשה על ידי ANOVA חד-גורמי עם ההשוואה הזוגית של טוקי. עבור כל הניסויים לעיל N = 3 ביולוגי משתכפל. סרגל קנה מידה = 50 מיקרומטר. ***p < 0.001. קווי שגיאה מייצגים SEM. קיצורים: hiPSCs = תאי גזע פלוריפוטנטיים מושרים אנושיים; CTRL = שליטה; FXS = תסמונת ה-X השביר; GFAP = חלבון חומצי סיבי גליה; FMRP = ריבונוקלאופרוטאין שליח X שביר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: סינתזת חלבון מופחתת עקב התמיינות מ-APCs לאסטרוציטים. (A) זרימת עבודה סכמטית המתארת תיוג והדמיה של סינתזת חלבונים ב-APCs ואסטרוציטים שמקורם ב-hiPSC באמצעות תיוג מטבולי של FUNCAT. (B) תמונות מייצגות של APCs שמקורם ב-hiPSC חיוביים לווימנטין (למעלה) ואסטרוציטים חיוביים ל-GFAP (למטה) עם תווית FUNCAT/Human Nuclei Antibody (hNA) בתאים שמקורם ב-CTRL ו-FXS. (C) FUNCAT/נפח של APCs שמקורם ב-hiPSC היה גבוה משמעותית מהאסטרוציטים הנגזרים המקבילים. עבור כל הניסויים N = 3 שכפולים ביולוגיים. סרגל קנה מידה = 50 מיקרומטר. **p < 0.01, ***p < 0.001. שפם מייצג 1.5 × IQR. קיצורים: hiPSCs = תאי גזע פלוריפוטנטיים מושרים אנושיים; CTRL = שליטה; FXS = תסמונת ה-X השביר; GFAP = חלבון חומצי סיבי גליה; FUNCAT = תיוג חומצות אמינו פלואורסצנטיות לא קנוניות. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: איתות Ca 2+ חסר המעורר על ידי ATP באסטרוציטים FXS שמקורם ב-hiPSC. (A) עקבות מייצגים של ארעי Ca2+ שתועדו מאסטרוציטים בודדים ביישום חיצוני של ATP ב-25שניות. (B) יחסי F340/F380 ממוצעים המתארים ארעי Ca2+ מעל 250 שניות לאחר יישום ATP. (C) נתונים מקובצים המראים אחוז גבוה יותר של לא מגיבים ל-ATP באסטרוציטים FXS שמקורם ב-hiPSC. מובהקות סטטיסטית שנקבעה על ידי ANOVA דו-גורמי עם ההשוואה הזוגית של טוקי. (ד-ו) כימות תגובת השיא הראשונה (משרעת ומשך זמן) ותדירות האירועים. (D) מראה ירידה משמעותית במשרעת. מובהקות סטטיסטית שנקבעה על ידי ANOVA חד-גורמי עם השוואה זוגית של טוקי ומשך (E) באסטרוציטים FXS שמקורם ב-hiPSC. מובהקות סטטיסטית שנקבעה על ידי מבחן קרוסקאל-וואליס עם מבחן ההשוואה המרובה של דאן; מערך נתונים מיוצג כדרגות ממוצעות עם SEM. (F) ייצוג גרפי של תדר חולף Ca2+ באסטרוציטים FXS שמקורם ב-hiPSC. ניתוח סטטיסטי על ידי ANOVA חד-גורמי עם ההשוואה הזוגית של טוקי. עבור כל הניסויים N = 3 שכפולים ביולוגיים; n = 19 תאים עבור כל שורת תא. *p < 0.05, **p < 0.01, ***p < 0.001. קווי שגיאה מייצגים SEM. # = מספר. קיצורים: hiPSCs = תאי גזע פלוריפוטנטיים מושרים אנושיים; CTRL = שליטה; FXS = תסמונת ה-X השביר; GFAP = חלבון חומצי סיבי גליה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
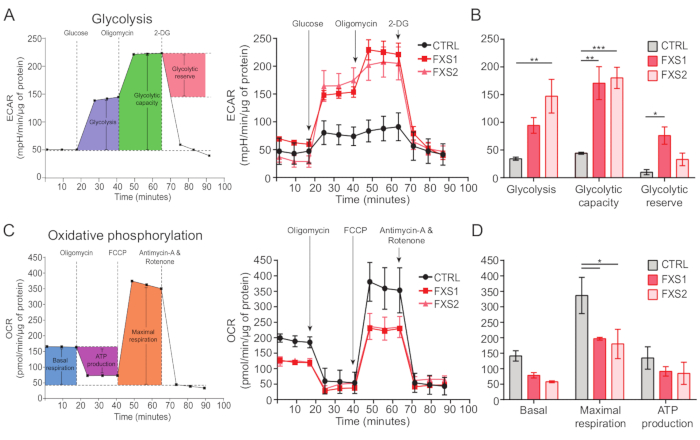
איור 5: גירעונות ביו-אנרגטיים באסטרוציטים FXS שמקורם ב-hiPSC. (A) גרף קו שמייצג את קצב ההחמצה החוץ-תאית של אסטרוציטים שמקורם ב-hiPSC (CTRL ו-FXS) לאחר הוספה של 10 מ"מ גלוקוז, 1 מיקרומטר אוליגומיצין ו-50 מ"מ 2-DG ברצף ומשורטט על גרף קו. (B) גליקוליזה, קיבולת גליקוליטית וכימות רזרבה גליקוליטית הראו עלייה באסטרוציטים FXS שמקורם ב-hiPSC. ניתוח סטטיסטי שנעשה על ידי ANOVA דו-גורמי עם ההשוואה הזוגית של טוקי. (C) גרף קו המתאר מדידת קצב צריכת חמצן על ידי הוספה רציפה של 1.5 מיקרומטר אוליגומיצין, 1 מיקרומטר FCCP ו-0.5 מיקרומטר אנטימיצין A ורוטנון. (D) נשימה בסיסית, נשימה מקסימלית וייצור ATP כומתו מגרף הקו ואסטרוציטים FXS שמקורם ב-hiPSC הראו ירידה משמעותית בנשימה המקסימלית בהשוואה לאסטרוציטים CTRL. ניתוח סטטיסטי שנעשה על ידי ANOVA דו-גורמי עם ההשוואה הזוגית של טוקי. עבור כל הניסויים N = 2 ביולוגי משתכפל. *p < 0.05, **p < 0.01, ***p < 0.001. קווי שגיאה מייצגים SEM. קיצורים: hiPSCs = תאי גזע פלוריפוטנטיים מושרים אנושיים; CTRL = שליטה; FXS = תסמונת ה-X השביר; ECAR = קצב החמצה חוץ-תאית; 2-DG = 2-דאוקסיגלוקוז; OCR = קצב צריכת חמצן; FCCP = קרבוניל ציאניד-4 (טריפלואורומטוקסי) פנילהידרזון. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| תעודת זהות בכתב יד | מזהה במקור | גיל | מין | שם שורת תא מתוכנת מחדש | שיטת תכנות מחדש | סוג תא התחלתי | קריוטיפ G band |
| (שנים) | |||||||
| CTRL | ND30625 | 76 | M | CS25iCTR-18nxx | וקטורים אפיזומליים | פיברובלסטים | רגיל |
| FXS1 | GM07072 | 22 | M | CS072iFXS-n4 | וקטורים אפיזומליים | פיברובלסטים | רגיל |
| FXS2 | GM05848 | 4 | M | CS848iFXS-n5 | וקטורים אפיזומליים | פיברובלסטים | רגיל |
טבלה 1: קווי תאים ששימשו במחקר הזהליצירת אסטרוציטים ספציפיים למוח הקדמי.
איור משלים S1: דוח ניתוח כרומוזומלי. קריוטיפ רצועות GTG רגיל של (A) CTRL 46, XY, (B) FXS1 46, XY, ו- (C) FXS2 46, XY. אנא לחץ כאן להורדת איור זה.
טבלה משלימה S1: פריימרים ששימשו במחקר זה לאפיון תאים. אנא לחץ כאן להורדת טבלה זו.
Discussion
כאן, אנו מתארים שיטה ליצירת אסטרוציטים אנושיים שמקורם ב-iPSC המשמשים כפלטפורמת בדיקה לאפיון שינויים תפקודיים הנגרמים על ידי FXS. אסטרוציטים אלה ברי קיימא מבחינה תפקודית בתרבית ומציגים תכונות שונות, כפי שמעידים מגוון מדידות שבוצעו במחקר הנוכחי. שלב קריטי בפרוטוקול זה הוא ההמרה הראשונית של iPSCs לקורטיקוספירות באמצעות שיטת ההרמה האנזימטית. בשלב זה, אופטימיזציה של זמן הדגירה עבור קולגנאז מסוג IV ודיספאזה היא קריטית. אם זה לא ממוטב, זה עלול לגרום ל-iPSCs להתפרק או ליצור תאים בודדים, מה שימנע היווצרות של קורטיקוספרות. קורטיקוספירות אלה מעוצבות לקראת ספציפיות המוח הקדמי באמצעות עיכוב SMADכפול 15 ומתמיינים עוד יותר לתאי אב אסטרוציטים (APCs). כדי להשיג אוכלוסייה גבוהה של נגמ"שים, הקיצוץ המכני של הגליוספרות הוא קריטי. ניתן להשתמש ב-qPCR בזמן אמת כדי לאשר את הספציפיות של המוח הקדמי; ראינו עלייה משמעותית בשינוי הקפל ב-FOXG1, סמן למוח הקדמי, בהשוואה ל-HOXB4, סמן לחוט השדרה.
לאחר מכן APCs מתמיינים לאסטרוציטים באמצעות CNTF, מפעיל של מסלול האיתות JAK-STAT16. תוצאות מחקר זה מצביעות על כך שלאסטרוציטים מובחנים סופניים שמקורם ב-FXS iPSCs יש רמות GFAP נמוכות יותר, מה שמרמז על פגיעה בבשלות. למרות שהניתוחים שלנו לא מצאו שום הבדל בסינתזת חלבון דה נובו באסטרוציטים FXS וב-APCs בהשוואה לביקורות, מצאנו ירידה בסינתזת חלבון דה נובו במעבר מ-APCs לאסטרוציטים הן ב-FXS והן בקווי הבקרה. הירידה המשמעותית בתרגום בין APCs לאסטרוציטים עולה בקנה אחד עם תרגום יעיל ואצור יותר שהוכח עבור נוירונים לעומת תאי קודמן עצביים17. עבודה קודמת שבחנה סינתזת חלבון חריגה השתמשה ברקמות מוח שלמות, נוירונים ופיברובלסטים שמקורם בחולה, ולא באסטרוציטים או APCs18. הדיווחים היחידים שפורסמו על סינתזת חלבונים מקווים שמקורם בחולה אינם באסטרוציטים, אלא מתאי לימפובלסטואיד19 ופיברובלסטים20,21. לאור הבדלים אלה בין מחקרים, מחקרים עתידיים יפיקו תועלת משימוש במדידות FUNCAT באסטרוציטים שמקורם בקווים נוספים שמקורם בחולה FXS.
הערכנו את הפונקציונליות של אסטרוציטים על ידי מדידת דינמיקת סידן תוך-תאית22 וביו-אנרגטיקה. אסטרוציטים FXS הראו ירידה במשרעת השיא ומשך הזמן של מעברי סידן המושרים על ידי ATP, עם פחות תאים המגיבים ל-ATP בהשוואה לאסטרוציטים בבקרה. יחד, שינויים אלה מצביעים על כך ש-FXS משבש הומאוסטזיס סידן באסטרוציטים אנושיים. תוצאות אלה עולות בקנה אחד עם מחקר קודם23,24 שדיווח על פעילות לקויה של קולטני IP3 בפיברובלסטים FXS. יתר על כן, ראינו גליקוליזה מוגברת, יכולת גליקוליטית ורזרבה גליקוליטית באסטרוציטים FXS, יחד עם שיעורי צריכת חמצן מיטוכונדריים מופחתים.
המחקר הנוכחי מתאר את היצירה והאפיון של מודל מבחנה חדש לאסטרוציטים FXS על ידי מינוף כוחם של iPSCs שמקורם בחולה. יש לציין שרק באמצעות מחקר קודם שהשתמש באסטרוציטים אנושיים בתרבית משותפת עם נוירונים אנושיים חשפנו את התפקיד הקריטי של אסטרוציטים הקובעים את הפנוטיפ האלקטרופיזיולוגי של הנוירונים14. עם זאת, מחקרים אלה התמקדו כמעט לחלוטין בשינויים הנגרמים על ידי מחלה בפעילות העצבית, ושום דבר לא נחקר באסטרוציטים. כאן, פרוטוקול זה מציע מסגרת חדשה להעברת המיקוד שלנו לשינויים תפקודיים באסטרוציטים. זה, בתורו, ישפוך אור על אינטראקציות אסטרוציטים-נוירונים שלא נחקרו בעבר, כגון איתות גלוטמט ותגובות חשמליות. התוצאות שלנו בשלב זה מדגישות את הצורך לתעדף אסטרוציטים במחקר עתידי.
זה קריטי להכיר במגבלות של פרוטוקול זה. ראשית, זה כרוך בקיצוץ מכני, מה שמוביל גם לפיצול DNA. זה יכול לגרום לגליוספירה הקצוצה להתגבש, ובסופו של דבר להוביל למוות של תאים. שנית, צפיפות הזריעה של APCs במהלך שלב ההתמיינות הסופית לאסטרוציטים חיונית למניעת עיכוב תא-תא מתווך מגע. מומלץ לייעל זאת על פני קווי תאים כדי למנוע ניתוק מפני השטח של כלי התרבית.
כאן, הממצאים שלנו הם הניתוח הראשון מסוג זה באסטרוציטים אנושיים, שכן כל המחקרים הקודמים התבססו על סוגי תאים אחרים כגון קווי תאים לימפובלסטואידים ופיברובלסטים אנושיים25. מטבוליזם אנרגטי לא מתפקד הוא שחקן ידוע באטיולוגיה של הפרעות בספקטרום האוטיסטי כפי שמוצג על ידי רמות מוגברות של לקטט בפלזמה אנושית, שיעור צריכת חמצן נמוך משמעותית בגרנולוציטים26, וביטוי מופחת של גנים לזרחן חמצוני מיטוכונדריאלי בקליפת המוח הקדמית, המוטורית, התלמוס והמוח הקטן של ילדים עם ASD27. שינויים דומים במטבוליזם האנרגיה נראים בהפרעות ניווניות כמו מחלת פרקינסון28 ומחלת אלצהיימר29, מה שמרמז על כך שגליקוליזה מוגברת עשויה לפצות על תפקוד תפקודי מופחת30. יש צורך במחקרים עתידיים כדי לחקור אם מנגנונים דומים פועלים במטבוליזם אנרגיה לא מתפקד הנראה באסטרוציטים שמקורם בחולי FXS.
נכון לעכשיו, יצירת אסטרוציטים ספציפיים למוח הקדמי היא הישג משמעותי, אך התקדמות עתידית עשויה לאפשר יצירת גליה ספציפית לאזור, כגון אסטרוציטים בקליפת המוח/היפוקמפוס. זה יספק תובנות עמוקות יותר לגבי התפקידים השונים שממלאים האסטרוציטים האלה בתפקודי מוח אזוריים, פלסטיות סינפטית ואינטראקציות עצביות-גליה. היכולת לייצר אסטרוציטים ספציפיים לאזור כזה יכולה לקדם מודלים של התפתחות נוירולוגית ומחלות ניווניות. בסופו של דבר, זה יכול להוביל לאסטרטגיות טיפוליות מדויקות יותר המכוונות לתפקוד לקוי של אסטרוציטים באזורים ספציפיים במוח.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
אנו מודים לפרופ' סומנטרה צ'אטרג'י על הכספים הפנימיים. אנו מודים לפרופ' גיטי חסן על הגישה למערך הדמיית הסידן, למתקן ההדמיה והזרימה המרכזי - המרכז הלאומי למדעי הביולוגיה, לפדמנב סינג ופרנגיה הוטה על ההגהה וההצעות, ולצוות Labmate Asia על הסיוע בביצוע בדיקות סוסון ים XF.
Materials
| Name | Company | Catalog Number | Comments |
| 1-Thioglycerol | Sigma-Aldrich | M6145 | |
| Accutase solution | Sigma-Aldrich | A6964 | Enzyme cell detachment medium |
| Adenosine 5′-triphosphate magnesium salt | Sigma-Aldrich | A9187 | |
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634010 | |
| Antibiotic-Antimycotic (100x) | ThermoFisher Scientific | 15240062 | |
| B-27 Supplement (50x), serum-free | ThermoFisher Scientific | 17504044 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418 | |
| Chemically Defined Lipid Concentrate | ThermoFisher Scientific | 11905031 | |
| Collagenase, Type IV, powder | ThermoFisher Scientific | 17104019 | |
| Deoxyribonuclease I | Worthington Biochemical Corporation | LK003170 | |
| Dimethyl sulfoxide | Sigma-Aldrich | D2650 | |
| Dispase II, powder | ThermoFisher Scientific | 17105041 | |
| DPBS, no calcium, no magnesium | ThermoFisher Scientific | 14190144 | |
| Essential 8 Medium | ThermoFisher Scientific | A1517001 | |
| FXS1, FXS2 | Coriell Institute of Medical Research | GM07072, GM05848 | FXS patient cells |
| GlutaMAX Supplement | ThermoFisher Scientific | 35050061 | glutamine substitute |
| Ham's F-12 Nutrient Mix | ThermoFisher Scientific | 11765054 | |
| Healthy control cells | Cedars-Sinai Medical Center | ND30625 | healthy control cells |
| Heparin sodium salt from porcine intestinal mucosa | Sigma-Aldrich | H3149 | |
| IMDM | ThermoFisher Scientific | 12440053 | |
| Insulin, human | Roche | 11376497001 | |
| LDN 193189 | Stratech Scientific | S2618-SEL | |
| Leukemia Inhibitory Factor human | Sigma-Aldrich | L5283 | |
| Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | Corning | 354230 | |
| MEM Non-Essential Amino Acids Solution (100x) | ThermoFisher Scientific | 11140050 | |
| Mouse FGF-basic (FGF-2/bFGF) Recombinant Protein | Peprotech | 450-33 | |
| Mr. Frosty freezing container | ThermoFisher Scientific | 5100-0001 | cryobox |
| N-2 Supplement (100x) | ThermoFisher Scientific | 17502048 | |
| N-Acetyl-L-cysteine | Sigma-Aldrich | A9165 | |
| Neurobasal Medium | ThermoFisher Scientific | 21103049 | |
| Nunc Biobanking and Cell Culture Cryogenic Tubes | ThermoFisher Scientific | 377267 | |
| Nunc Cell-Culture Treated 6 well dish | ThermoFisher Scientific | 140675 | |
| Papain Dissociation System | Worthington Biochemical Corporation | LK003150 | |
| Penicillin-Streptomycin | ThermoFisher Scientific | 15140122 | |
| Recombinant Human CNTF Protein, CF | R&D Systems | 257-NT-010 | |
| Recombinant Human EGF Protein, CF | R&D Systems | 236-EG-01M | |
| RevitaCell Supplement (100x) | ThermoFisher Scientific | A2644501 | |
| SB431542 | Tocris | 1614 | |
| Seahorse XFe24 Analyzer | Agilent Technologies | ||
| Seahorse XF Cell Mito Stress Test Kit | Agilent Technologies | 103015-100 | |
| Seahorse XF Glycolysis Stress Test Kit | Agilent Technologies | 103020-100 | |
| Tissue Culture Dishes-100 cm | Biostar Lifetech | TCD000100 | |
| Transferrin | Roche | 10652202001 | |
| VWR Razor Blades | VWR International | 55411-050 | |
| Antibodies | |||
| Primary antibody | Company | Catalog number | Dilution |
| Oct4 (C-10) | Santa Cruz Biotechnology | sc-5279 | Dilution: 1:250 Secondary antibody: Goat anti-Mouse IgG, Alexa Fluor 568 |
| Nanog | R & D Systems | AF1997 | Dilution: 1:100 Secondary antibody: Donkey anti-Goat IgG, Alexa Fluor 488 |
| Vimentin | Abcam | Ab5733 | Dilution: 1:500 Secondary antibody: Goat anti-Chicken IgY, Alexa Fluor 488 |
| NFIA | Abcam | Ab41851 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| GFAP-cy3 | Sigma | C9205 | Dilution: 1:500 Secondary antibody: NA |
| GFAP | DAKO | Z0334 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 568 |
| S100β | DAKO | IR504 | Dilution: 1:500 Secondary antibody: Goat anti-Rabbit IgG, Alexa Fluor 488 |
| Anti-Nuclei Antibody, clone 235-1 | Merck Millipore | MAB1281 | Dilution: 1:1000 Secondary antibody: Goat anti-Mouse IgG1, Alexa Fluor 555 |
| Secondary antibodies | Dilution | ||
| Goat anti-Mouse IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11004 | 1:1000 |
| Donkey anti-Goat IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11055 | 1:1000 |
| Goat anti-Chicken IgY, Alexa Fluor 488 | Thermo Fisher Scientific | A11039 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 568 | Thermo Fisher Scientific | A11011 | 1:1000 |
| Goat anti-Rabbit IgG, Alexa Fluor 488 | Thermo Fisher Scientific | A11034 | 1:1000 |
| Goat anti-Mouse IgG1, Alexa Fluor 555 | Thermo Fisher Scientific | A21127 | 1:1000 |
References
- Santoro, M. R., Bray, S. M., Warren, S. T. Molecular of fragile X syndrome: A twenty-year perspective. Annu Rev Pathol. 7, 219-245 (2012).
- Wang, H., et al. Developmentally-programmed FMRP expression in oligodendrocytes: A potential role of FMRP in regulating translation in oligodendroglia progenitors. Hum Mol Genet. 13 (1), 79-89 (2004).
- Pacey, L. K. K., Doering, L. C. Developmental expression of FMRP in the astrocyte lineage: Implications for fragile X syndrome. Glia. 55 (15), 1601-1609 (2007).
- Zhang, Y., et al. Purification and characterization of progenitor and mature human astrocytes reveals transcriptional and functional differences with mouse. Neuron. 89 (1), 37-53 (2016).
- Allen, N. J., Barres, B. A. Neuroscience: Glia - more than just brain glue. Nature. 457 (7230), 675-677 (2009).
- Khakh, B. S., McCarthy, K. D. Astrocyte calcium signaling: From observations to functions and the challenges therein. Cold Spring Harb Perspect Biol. 7 (4), a020404(2015).
- Allen, N. J., et al. Astrocyte glypicans 4 and 6 promote formation of excitatory synapses via GluA1 AMPA receptors. Nature. 486 (7403), 410-414 (2012).
- Chung, K., et al. Structural and molecular interrogation of intact biological systems. Nature. 497 (7449), 332-337 (2013).
- Rothstein, J. D., et al. Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and clearance of glutamate. Neuron. 16 (3), 675-686 (1996).
- Almad, A., Maragakis, N. J. A stocked toolbox for understanding the role of astrocytes in disease. Nat Rev Neurol. 14 (6), 351-362 (2018).
- Zhang, Y., Barres, B. A. Astrocyte heterogeneity: An underappreciated topic in neurobiology. Curr Opin Neurobiol. 20 (5), 588-594 (2010).
- Clarke, L. E., Barres, B. A. Emerging roles of astrocytes in neural circuit development. Nat Rev Neurosci. 14 (5), 311-321 (2013).
- Bradley, R. A., et al. Regionally specified human pluripotent stem cell-derived astrocytes exhibit different molecular signatures and functional properties. Development. 146 (13), dev170910(2019).
- Das Sharma, S., et al. Astrocytes mediate cell non-autonomous correction of aberrant firing in human FXS neurons. Cell Rep. 42 (4), 112344(2023).
- Chambers, S. M., et al. Highly efficient neural conversion of human ES and iPS cells by dual inhibition of SMAD signaling. Nat Biotechnol. 27 (3), 275-280 (2009).
- Hu, X., et al. The JAK/STAT signaling pathway: from bench to clinic. Sig Transduct Target Ther. 6, 402(2021).
- Baser, A., et al. Onset of differentiation is post-transcriptionally controlled in adult neural stem cells. Nature. 566 (7742), 100-104 (2019).
- Pal, R., Bhattacharya, A. Modelling protein synthesis as a biomarker in fragile x syndrome patient-derived cells. Brain Sci. 9 (3), 1-12 (2019).
- Gross, C., Bassell, G. J. Excess protein synthesis in FXS patient lymphoblastoid cells can be rescued with a p110β-selective inhibitor. J Mol Med. 18 (3), 336-345 (2012).
- Kumari, D., et al. Identification of fragile X syndrome specific molecular markers in human fibroblasts: A useful model to test the efficacy of therapeutic drugs. Hum Mutat. 35 (12), 1485-1494 (2014).
- Jacquemont, S., et al. Protein synthesis levels are increased in a subset of individuals with fragile X syndrome. Hum Mol Genet. 27 (12), 2039-2051 (2018).
- Bowser, D. N., Khakh, B. S. ATP excites interneurons and astrocytes to increase synaptic inhibition in neuronal networks. J Neurosci. 24 (39), 8606-8620 (2004).
- Schmunk, G., Boubion, B. J., Smith, I. F., Parker, I., Gargus, J. J. Shared functional defect in IP3R-mediated calcium signaling in diverse monogenic autism syndromes. Transl Psychiatry. 5 (9), e643-e710 (2015).
- Peteri, U. K., et al. Generation of the human pluripotent stem-cell-derived astrocyte model with forebrain identity. Brain Sci. 11 (2), 209(2021).
- Alvarez-Mora, M. I., et al. Impaired mitochondrial function and dynamics in the pathogenesis of FXTAS. Mol Neurobiol. 54 (9), 6896-6902 (2017).
- Giulivi, C., et al. Mitochondrial dysfunction in autism. JAMA. 304 (21), 2389-2396 (2010).
- Anitha, A., et al. Brain region-specific altered expression and association of mitochondria-related genes in autism. Mol Autism. 3 (1), 12(2012).
- Teves, J. M. Y., et al. Parkinson's disease skin fibroblasts display signature alterations in growth, redox homeostasis, mitochondrial function, and autophagy. Front Neurosci. 11, 737(2018).
- Yao, J., et al. Mitochondrial bioenergetic deficit precedes Alzheimer's pathology in female mouse model of Alzheimer's disease. Proc Natl Acad Sci USA. 106 (34), 14670-14675 (2009).
- Sonntag, K. C., et al. Late-onset Alzheimer's disease is associated with inherent changes in bioenergetics profiles. Sci Rep. 7 (1), 14038(2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved