Method Article
腹腔鏡下左アプローチによる尾状葉の切除
要約
ここでは、尾状葉内の傍騎静脈部分の近くに位置する腫瘍の腹腔鏡下切除を説明する外科的プロトコルを紹介します。
要約
腹腔鏡下尾状葉切除術(LCL)は、腹腔鏡下肝切除術の中で最も困難なタイプの1つです。主な困難は、尾状葉の深い解剖学的位置にあり、これは第1および第2の肝ポートおよび下大静脈に近接しており、手術中の大出血のリスクを高めます。尾状葉腫瘍の解剖学的構造、包括的な画像評価、および3次元再構成の徹底的な理解に加えて、外科的アプローチの柔軟な選択も、外科的困難を軽減し、安全性を向上させるための鍵となります。腹腔鏡下尾状葉切除術は、特に腫瘍が尾状葉の下大静脈に近い領域にある場合に、左側アプローチを使用して行います。この方法は、従来の前方アプローチで必要とされる視野を露出させるために肝臓物質を分割するステップを回避し、より大きな操作スペースと短い操作時間という利点があります。同時に、術前の三次元再建技術と組み合わせることで、重要な血管を損傷するリスクを大幅に減らし、尾状葉の腫瘍切除の成功率を高めました。
概要
尾状葉は肝臓の奥深くに位置し、その特定の被覆は下大静脈の前面から左、中、右の肝静脈の後ろに達し、3つの主要な肝静脈が下大静脈に収束する場所まで上向きに、そして下向きに肝門1にまで広がっています。
2006 年に Dulucq らが肝尾状葉の腹腔鏡下切除に関する先駆的な報告を行って以来、尾状葉の孤立した切除と分節切除を含む多数の症例が記録されています 2,3,4,5,6,7。ただし、腹腔鏡下尾状葉切除術の技術的な複雑さは、多くの要因の影響を受けます。これらには、外科的適応症の厳格な遵守、画像データの包括的な術前評価、腹腔鏡手術技術の習得、尾状葉の局所解剖学的構造に関する深い知識、および外科的アプローチの賢明な選択が含まれます。現在、尾状葉の切除には、左側アプローチ、右側アプローチ、左右複合アプローチ、および前方アプローチの4つの一般的なアプローチがあります。左側アプローチは、通常、シュピーゲル葉の切除、または左外側セグメントまたは左半肝の複合切除が必要な場合に使用されます。逆に、尾状突起の切除、または右半身の肝臓切除が必要な場合には、右側アプローチが好まれます。腫瘍が不釣り合いに大きいか、尾状葉に広範囲に浸潤しているため、左または右のアプローチによる曝露が複雑になる場合、左右を組み合わせたアプローチが不可欠になる可能性があります。下大静脈付近の腫瘍の切除には、最適な曝露と視覚化を容易にする前方アプローチが一般的に好まれます。
尾状葉の重要な部分であるパラカバルセグメントは、クイノーのセグメントIXとして広く認識されています。これは、本質的に肝臓の解剖学的構造の震源地であるセグメントIVの後ろに戦略的に配置されています。その背側表面は下大静脈と密接に接触しており、その下側境界は最初の肝ポートと密接に整列しています。このセグメントの頭側端は、中静脈と右肝静脈の起点と隣接しており、その腹側は中静脈の主幹に直接位置しています。その隠された位置と肝臓の主要な血管構造に隣接していることを考えると、この領域への外科的介入は本質的にリスクが高く、技術的に困難です。歴史的に、尾状葉の傍眼部分を標的とする外科的処置は、主に腹腔鏡下前方または右側アプローチを利用してきた8,9,10。左側アプローチに関する文献は不足していますが、これはおそらくこの領域の深い深さと左側からの視野が限られていること、そして近くの複雑な血管構造によって悪化しているためです。このような複雑さのため、手術医は解剖学に関する深い理解と豊富な外科的専門知識を持っている必要があります。3次元(3D)可視化再構成技術の進歩により、精密で鮮明な3次元肝臓モデル11の作成が可能になった。これらのモデルは、肝臓、腫瘍、肝臓血管系、および肝臓と隣接する臓器との間の空間的関係を明確に表現しています。この技術は、肝臓の特定の状態、腫瘍の正確な位置、および血管の複雑な相互作用について、術前に包括的に理解するのに役立ちます。
この論文では、革新的な外科的戦略を紹介します: 術前の 3 次元評価を活用し、腹腔鏡下左側アプローチを使用して傍眼領域の腫瘍を切除します。このアプローチは、最新のイメージング技術によって提供される詳細な解剖学的洞察を活用して、手術の精度と安全性を高めることを目的としています。
30歳の女性患者が珠江病院に入院し、1か月以上前に肝臓の空間占有病変が偶発的に発見されました。強化されたコンピューター断層撮影(CT)スキャンにより、約37 mm x 34 mmの低密度の影を持つ腫瘤が明らかになりました。予備診断には、限局性結節性過形成または肝腺腫が含まれ、これらはさらなる鑑別が必要です(図1)。術前の3次元可視化再構成を 図2に示します。患者の全血球計算、凝固プロファイル、肝機能検査はすべて正常範囲内でした。彼女には重大な病歴はなく、術前の評価では手術の禁忌は確認されていませんでした。肝腺腫に関連する悪性腫瘍の潜在的なリスクを考慮して、外科医は患者とその家族と詳細な話し合いを行い、十分な情報が得られるようにしました。外科的リスクと可能な治療結果を十分に理解した後、患者とその家族は、外科的治療を続行するための十分な情報に基づいた決定を下しました。彼らは、外科的インフォームドコンセントフォームに署名することで同意を提供し、手順を明確に理解し、患者の健康と幸福へのコミットメントを示しています。
プロトコル
この外科的処置は、南医科大学珠江病院の倫理委員会から許可を得ました。さらに、患者とその家族は、治療プロセスに関連する情報とデータを公に共有することについて、インフォームドコンセントを提供しました。これにより、医療上の意思決定プロセスにおける透明性が確保され、患者の自律性が尊重されます。
1. 術前準備
- 患者に8時間絶食してもらい、手術前の4時間は飲酒を控えてください。
- 全身麻酔を施し、気管内挿管を行う12.
注: 麻酔後と術中の両方で患者の状態を評価することにより、麻酔の有効性を評価します。主な指標には、感覚の完全なブロックを達成すること、手術中に追加の投薬を必要としないこと、手術全体を通して安定したバイタルサインを維持することが含まれます。 - 乳首から恥骨結合、大腿部の上部3分の1までの手術領域を、ヨウ素チンキ剤で3回消毒し、腋窩中部まで伸ばします。
2.手術手技
- 患者を仰臥位にして、足を広げ、頭を持ち上げ、右に15°傾けます。
- Veress針13で気腹を確立します。気腹圧を12-14 mmHg(1 mmHg = 0.133 kPa)に設定します。
- 観察口の臍端にNo.10の外科用メスの刃を装着し、10mmのトロカールを挿入して1cmの切開を行います( 資料表参照)。
- 直径5 mmと10 mmのトロカールを次の解剖学的ランドマークに挿入します:右前腋窩線に沿って肋骨縁から2 cm下、右鎖骨中央線に沿って肋骨縁から8 cm下、左鎖骨中央線に沿って肋骨縁から2 cmと6 cm下(図3)。
- 最初の腹腔鏡評価を実行して、尾状葉切除への左側アプローチの実現可能性を判断します。大網の腹腔内接着の程度、肝臓の表面の質感、左右の三角靭帯と鷹靭帯の位置を観察します。
- 超音波メス( 材料の表を参照)を使用して鎌状靭帯を横断し、胆嚢の三角形を明らかにします。その後、嚢胞性管を結紮し、胆嚢を解剖します。
- 超音波メスを使用して、小さな大網孔をクリアし、肝門を露出させ、肝肺門閉塞テープの確立を可能にします。
- 右肝葉を反転させて下大静脈を露出させ、3-0 Hem-o-lok で肝短静脈を結紮して横断します ( 材料表を参照)(図 4)。
- 尾状葉のSpiegel領域を露出させ、続いて肝肺門閉塞を行い、超音波メスを使用して尾状葉ノッチに沿って肝実質を横断します(図5)。
- 超音波メスと手術鉗子を使用して肝実質を切除し、下大静脈に隣接する腫瘍を露出させます(図6 および 図7)。
- 腫瘍を慎重に解剖し、凍結装置付きの超音波メスを使用して小さな静脈を凝固させ、中肝静脈を露出させます(図8)。
- 門脈を3-0 Hem-o-lokで右尾状葉に露出させて結紮し、続いて腫瘍の動員を行います(図9、 図10、 および図11)。
- 止血と検体の回収にはバイポーラ電気凝固術を使用します。800 mLの0.9% NaCl溶液を使用して腹腔内を洗浄し(図12)、ドレナージチューブを腹腔内に置いた状態で閉じます( 材料の表を参照)。
- 非吸収性縫合材料を使用して、創傷を層ごとに閉じます( 材料の表を参照)。
3. 術後の看護とモニタリング
- 術後最初の24時間以内に、心臓モニタリング( 材料の表を参照)を行い、3 L / minで継続的な低流量酸素療法を提供し、バイタルサインを綿密に監視します。.
- 術後の最初の日に、患者に半固形食を与え、患者に寝返り運動とベッド内での運動を行うように指示します。
注:術後ケアには、肝保護、抗感染、抗出血、鎮痛、アルブミン、および胃保護治療が含まれます。 - ドレナージチューブの色、量、およびビリルビンレベルの変化を監視します。ビリルビンレベルが正常に戻り、ドレナージが50 mL未満になったら、ドレナージチューブを取り外します。.
結果
手術(ビデオ1)は372分間続き、300mLの失血があり、輸血は必要ありませんでした。肝門脈閉塞のインスタンスは 5 回あり、合計 70 分でした。術後合併症はなく、術後8日間入院するなど順調に回復しました。病理学的検査では、肝臓の限局性結節性過形成(FNH)が示されました。ドレナージ液中のビリルビンのレベルは、術後 3 日目の 30.1 μmol/L から術後 5 日目の 21.4 μmol/L に減少しました ( 表 1 を参照)、ドレナージ チューブは術後 6 日目に抜かれました。術後画像と病理画像を 図13に示します。
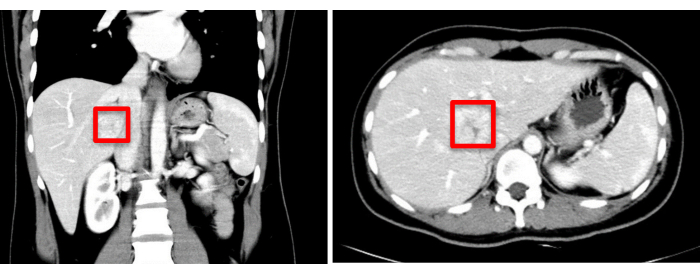
図1:術前画像評価(CT)は、赤い四角でマークされた腫瘍の位置を示します。この図の拡大版を表示するには、ここをクリックしてください。
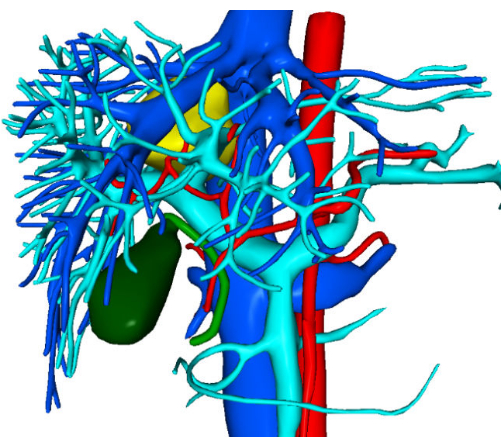
図2:術前の3次元視覚化再構成画像。この図の拡大版を表示するには、ここをクリックしてください。

図3:トロカール分布図。 この図の拡大版を表示するには、ここをクリックしてください。

図4:右肝腔から露出した下大静脈と、Hem-o-lokクリップで結紮され、切断された大きな短い肝静脈。 3次元再構成画像の赤い円は、対応する位置を示しています。略語:SHV:短い肝静脈。IVC:下大静脈。 この図の拡大版を表示するには、ここをクリックしてください。
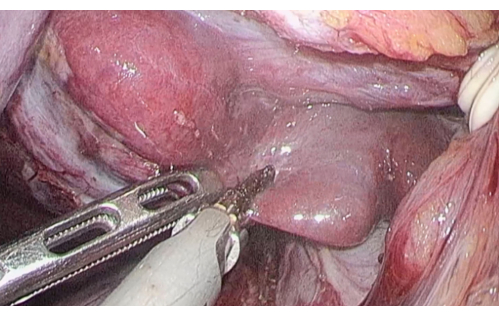
図5:超音波メスを使用して尾状突起に沿って横断された肝実質。 この図の拡大版を表示するには、ここをクリックしてください。
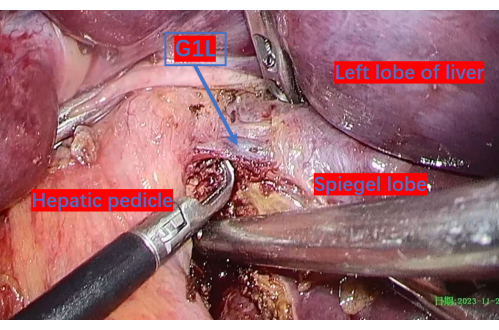
図6:左尾状葉(G1L)の最初の枝まで露出した門脈。 G1Lは、門脈の左尾状葉への最初の分岐です。 この図の拡大版を表示するには、ここをクリックしてください。

Figure 7: 慎重に露出した腫瘍により、その位置がはっきりと見え、その後の手術操作が容易になります。この図の拡大版を見るには、ここをクリックしてください。

図8:慎重に露出した中肝静脈。 赤い円は、3D 再構築画像上の対応する位置を示します。略語:MHV:中肝静脈、IVC:下大静脈。 この図の拡大版を表示するには、ここをクリックしてください。
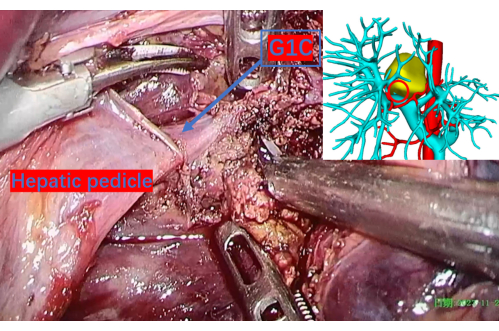
図9:慎重に切除された肝実質は、G1Cとして示される右尾状葉の最初の枝までの門脈を明らかにします。 3D 再構成画像上の赤い円はこの位置に対応しており、正確な基準点を提供します。G1Cは、門脈の右尾状葉への最初の分岐です。 この図の拡大版を表示するには、ここをクリックしてください。

図10:腫瘍の血液供給に関与するグリッソンシステム。 このシステムは露出し、クランプされ、切断されました。 この図の拡大版を表示するには、ここをクリックしてください。
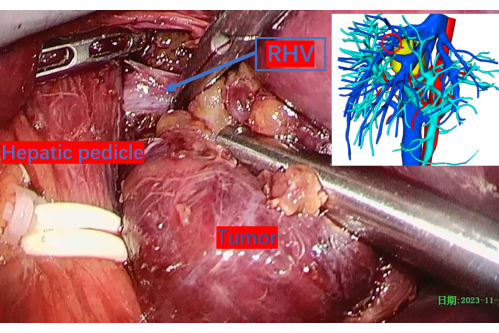
図11:腫瘍解剖中に露出した右肝静脈の主幹。 赤い円は、3D 再構築画像上の位置を示します。略語:RHV:右肝静脈。 この図の拡大版を表示するには、ここをクリックしてください。

図12:止血後の術野を徹底的に洗浄し、洗浄した状態。 略語:MHV:中肝静脈。RHV:右肝静脈。IVC:下大静脈。 この図の拡大版を表示するには、ここをクリックしてください。
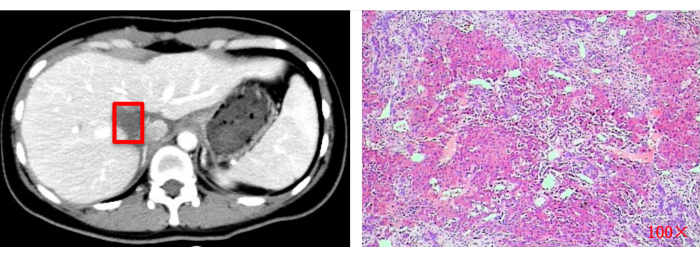
図13:術後画像評価(CT)と病理組織学的検査(100倍)。 赤い四角は元の腫瘍切除部位を示します。 この図の拡大版を表示するには、ここをクリックしてください。
| 項目 | 業績 |
| 動作時間(分) | 372 |
| 術中出血量 (mL) | 300 |
| 輸血量(mL) | 0 |
| 肝門脈閉塞の数 | 5 |
| 肝門脈閉塞時間 | 70 |
| 術後合併症 | 何一つ |
| 術後入院日数(日) | 8 |
| POD3 のドレーン ビリルビン レベル (U/L) | 30.1 |
| POD5のドレインビリルビンレベル(U / L) | 21.4 |
表1:患者の関連する結果。略語:POD =術後の日。
ビデオ1:腹腔鏡下左アプローチによる尾状葉切除術(外科的手技)。 略語と定義:SHV:短い肝静脈。G1L:門脈の最初の枝から左尾状葉への枝。MHV:中肝静脈。G1C:門脈の最初の枝から右尾状葉への枝。RHV:右肝静脈。IVC:下大静脈。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
肝臓は、代謝、免疫機能、および解毒に関与する重要な器官です14。肝臓の初代細胞である肝細胞は、通常、安定していますが、引き金になると不安定になり、肝臓組織の再生が開始されます。肝切除後、肝残量が不足すると、急性肝不全などの重篤な術後合併症を引き起こす可能性があります。したがって、肝切除後の肝機能の厳密な評価は、最も重要なことです15,16。研究によると、尾状葉は典型的な人体の肝臓の体積の約2%〜3%を占めています17。肝機能予備能の術前評価を考えると、尾状葉の切除だけでは一般に残りの肝容積が大幅に減少することはなく、急性肝不全などの術後合併症のリスクが軽減されます。
Kumonらの研究18 は、肝臓の尾状葉の血管解剖学的構造を解明し、左と右の2つの主要な肝椎弓根を特定しました。左の椎弓根はより一貫して配置され、シュピーゲル葉の中部から下部の3分の1あたりで尾状葉に入ります。逆に、右の椎弓根はより可変であり、傍畝または尾状突起領域に広がる可能性があり、存在しない可能性さえあります。尾状葉の門脈枝は複雑性を示し、多くの場合、独立した枝または共有幹として現れます。シュピーゲル葉の門脈はより安定しており、主に左門脈の堅牢な背側枝(G1L)から生じています。対照的に、右尾状突起および傍窩領域にサービスを提供する門脈は、主に右主門脈の枝に由来し、右尾状葉への最初の分岐(G1C)19と呼ばれる。Cho et alの20 の説明では、尾状葉動脈を 3 つの主要なタイプに詳しく説明しています: 独立した枝、総幹、および肝動脈吻合から生じる動脈。尾状葉の胆道ドレナージには通常、2つの主要な管が含まれ、シュピーゲル葉の2〜3の枝が左肝管に収束します。パラカバル領域には、一般に、2〜3本の管が右後部扇状管に合流しており、管間吻合が顕著に発生している18。尾状葉からの静脈ドレナージは、主に短い肝静脈を通って下大静脈に入ります。尾状突起静脈は、尾状突起と右後葉の間を横断し、主に尾状突起を排出し、後下大静脈の右下端を結合して、これらの領域間の境界を描きます。主尾状葉肝静脈は、シュピーゲル葉とパラカバル領域の間を走り、最終的に後下大静脈の中央左端に入り、シュピーゲルローブとパラカバル領域との間の解剖学的境界として機能します。私たちは、短い肝静脈、G1L、G1C、腫瘍に栄養を与える肝椎弓根など、主要な血管とその枝を細心の注意を払ってクランプし、横断しました。この精度により、外科的介入の安全性と有効性が保証されます。
尾状葉の特徴的な解剖学的構造は、肝臓の奥深くに位置し、下大静脈、中肝静脈、右肝静脈などの主要な血管系に隣接しており、外科的な課題を提示しています。肝臓のヒラに包まれているため、出血のリスクが高まり、切除が技術的に困難になります。先行研究21 は、肝静脈に隣接する尾状葉の悪性腫瘍に対して、尾状葉切除と組み合わせた拡張左肝切除術が好ましいことを示しました。しかし、これらの腫瘍に対する理解の進歩により、単純な尾状葉切除術や部分切除法の採用が増加しています。これらのアプローチは、肝機能を維持しながら根治的腫瘍の除去を促進します22。尾状葉の原発性および続発性肝悪性腫瘍の両方に対して、技術的に可能な場合は手術が適応となります。海綿状血管腫、限局性結節性過形成(FNH)、肝内胆管結石、肝腺腫などの尾状葉の良性腫瘍も全切除または部分切除に適しており、効果的な治療選択肢を提供します。
腹腔鏡下肝切除術は、肝胆道手術における一般的な技術として浮上しています23,24,25。この手順のトンネルビジョンと拡大機能は、尾状葉の切除に明確な利点を提供します。この視覚的な枠組みの中で、狭い空間でも下大静脈の周囲の解剖が促進され、より微細な肝短静脈の視覚化が強化されます。しかし、この技術には、触覚フィードバックの欠如、収縮能力の制限、解剖面の制約など、課題がないわけではありません。これらを克服するには、特に尾状葉の部分切除において、かなりの専門知識を持つ外科医が必要です。尾状葉切除の一般的なアプローチには、左アプローチ、右アプローチ、左右結合アプローチ、および前方アプローチが含まれます。左アプローチは、典型的には、シュピーゲル葉の切除に、または左外側セグメントまたは左半バーの切除と併用される。尾状突起の切除、または右半肝切除が検討される場合には、正しいアプローチが適応されます。腫瘍が広範囲に及ぶ場合、または尾状葉全体を含み、曝露が困難な場合は、左右を組み合わせたアプローチを採用することができます。前方アプローチは、正常な肝臓組織を分割することを含む傍眼領域の切除によく使用されます。この方法は、肝臓の外傷の表面積を拡大することにつながる可能性があり、胆管や血管の損傷のリスクを高めるだけでなく、術後出血や胆汁漏出の可能性を高めます。
伝統的に、傍眼腫瘍は腹腔鏡下前方または右側アプローチを用いて対処されてきたが、左側手技に関する文献は乏しい8,9,10。Feng et al. は、公開された症例報告26 で、尾状葉の良性血管腫の 2 つの症例に対して、開腹左側アプローチ切除を成功裏に実施しました。この研究は、尾状葉の3つの部分の分節切除ではなく、尾状葉の一括切除に焦点を当てました。良性病変の場合、この方法では不必要な肝実質切除術をより効果的に減らすことができず、それによって胆汁漏出のリスクが減少しました。現在、尾状葉の複雑な血管構造を考慮すると、腹腔鏡手術は微妙な血管構造をより明確に表示できるため、出血のリスクが軽減されます。さらに、Zhengらは「Huaxi解剖法」を初めて導入した研究を行った27。彼らは、腹腔鏡下左側アプローチを革新的に使用して、尾状葉の複雑な腫瘍を成功裏に切除しました。手術中、彼らは反時計回りの解剖と重ね合わせの方法を採用し、単純なものから複雑なものまで一定の順序で進行しました。このアプローチは、学習曲線を使用して外科的プロセスを簡素化するため、学者の学習と習得により役立ち、尾状葉切除の左側アプローチの実現可能性がさらに確認されます。
この左側の症例の不足は、傍騎兵腫瘍の根深い性質に起因する可能性があり、周囲の血管解剖学的構造が複雑であるため、左側からの完全な曝露を達成するのが困難です。しかし、術前画像法を活用して、傍眼腫瘍における限局性結節性過形成と肝腺腫の鑑別診断を行い、腫瘍縁の妥当性に対する懸念を軽減しました。「華西解剖法」とは異なり、当センターでは、尾状葉の大静脈に隣接する腫瘍に特化した腹腔鏡下左側アプローチ切除術を採用しています。術前は、手術の安全性を確保するために、3D再構成を使用して評価します。さらに、ここで説明する外科的方法は、左肝静脈の露出を回避し、左肝静脈からの裂傷や出血のリスクを軽減します。また、この方法は肝実質への不必要な損傷を最小限に抑え、術後の胆汁漏出の可能性を減らします。これらの洗練された外科的戦略により、尾状葉腫瘍のより安全で効果的な切除を目指しています。この技術により、前方アプローチのように肝臓組織を分割する必要がなくなります。これは、右側アプローチと比較して、より広い術野と短い手術時間などの利点を提供します。さらに、術前の三次元再建技術の使用により、主要な血管損傷のリスクが大幅に最小限に抑えられ、腫瘍切除の実現可能性が向上しました。手術は372分で効率的に完了し、失血はわずか300mLでした。術後経過は問題なく、術後8日目には順調に退院し、早期に回復した。
良性腫瘍を切除する必要性は、悪性変性の可能性と、大きな腫瘍サイズによる圧迫症状の存在にかかっていることを明確に認識する必要があります。悪性腫瘍の場合、左側外科的アプローチの適切性、および適切な曝露と十分な切除断端の保証は、さらなる調査を必要とする問題です。それにもかかわらず、私たちの研究と臨床経験に基づいて、腹腔鏡下左側アプローチ 良性パラカバル腫瘍の切除は、特に解剖学的知識と広範な外科的専門知識をしっかりと把握することで、完全に実行可能であるという結論に達しました。この外科的技術は、患者に低侵襲治療の選択肢を提供するだけでなく、外科的外傷を最小限に抑え、術後の回復期間を短縮しながら、腫瘍切除の安全性を確保します。
開示事項
著者には、開示すべき対立や金銭的なつながりはありません。
謝辞
本研究は、中国広東省基礎応用基礎研究基金会(2021B1515230011)、中国広州科学技術プロジェクト(2023B03J1247)、広東省重点地域研究開発プログラム(2023B1111020008)の支援を受けて行われました。
資料
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
参考文献
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved