Method Article
腹腔镜左入路尾状叶切除术
摘要
在这里,我们提出了一种手术方案,描述了位于尾状叶内腔旁部分附近的肿瘤的腹腔镜切除,采用左侧入路。
摘要
腹腔镜尾状叶切除术 (LCL) 是最具挑战性的腹腔镜肝脏切除术类型之一。主要难点在于尾状叶的深解剖位置,紧邻第一和第二肝端口以及下腔静脉,增加了手术过程中大出血的风险。除了对尾状叶肿瘤解剖结构的透彻了解、全面的影像学评估和三维重建外,手术途径的灵活选择也是降低手术难度和提高安全性的关键。我们使用左侧入路进行腹腔镜尾状核叶切除术,尤其是当肿瘤位于靠近下腔静脉的尾状叶区域时。该方法避免了传统前路所需的劈开肝脏物质以暴露视野的步骤,具有手术空间较大、手术时间短等优点。同时,结合术前三维重建技术,显著降低了重要血管损伤的风险,提高了尾状叶肿瘤切除的成功率。
引言
尾状叶位于肝脏深处,其特异性覆盖范围从下腔静脉的前部延伸到左、中、右肝静脉的后面,向上到三个主要肝静脉汇合到下腔静脉的地方,向下到肝门1。
自 Dulucq 等人于 2006 年发表关于腹腔镜肝尾状叶切除术的开创性报告以来,已记录了许多涉及尾状叶孤立切除术和节段性切除术的病例 2,3,4,5,6,7。然而,腹腔镜尾状核叶切除术的技术复杂性受多种因素的影响。这些包括严格遵守手术适应症、对影像学数据进行全面的术前评估、掌握腹腔镜手术技术、深入了解尾状叶的局部解剖结构以及明智地选择手术方法。目前,尾状叶切除有四种流行的方法:左侧入路、右侧入路、左右联合入路和前入路。左侧入路通常用于 Spiegel 肺叶的切除或需要联合切除左侧段或左半肝脏的情况。相反,右侧入路更适合尾状核过程的切除,或者在需要右半肝脏切除术的情况下。在肿瘤不成比例地大或广泛浸润尾状叶的情况下,从而使通过左或右入路的暴露复杂化,左-右入路相结合可能变得必不可少。对于下腔静脉附近的肿瘤切除,通常首选前路,因为它有助于最佳曝光和可视化。
腔旁节段是尾状叶的关键部分,被广泛认为是 Couinaud 的 IX 节。它战略性地位于 IV 段后面,本质上是肝脏解剖结构的中心。它的背表面与下腔静脉紧密接触,而其下边界与第一肝端口紧密对齐。该段的头端与肝中静脉和右静脉的起点相邻,其腹侧与肝中静脉的主干直接相连。鉴于其隐蔽的位置以及与肝脏主要血管结构的相邻,该区域的手术干预本身具有内在的风险和技术挑战。从历史上看,针对尾状叶腔旁段的外科手术主要使用腹腔镜前路或右侧入路 8,9,10。关于左侧入路的文献很少,可能是由于该区域的深度很深,左侧的视野有限,再加上附近错综复杂的血管结构。这种复杂性要求手术外科医生对解剖学有深刻的理解和丰富的外科专业知识。三维 (3D) 可视化重建技术的进步使创建精确生动的三维肝脏模型成为可能11。这些模型清晰地表示了肝脏、肿瘤、肝血管系统以及肝脏与邻近器官之间的空间关系。这项技术有助于术前全面了解肝脏的具体情况、肿瘤的精确位置以及血管错综复杂的相互作用。
在本文中,我们介绍了一种创新的手术策略:利用术前三维评估并采用腹腔镜左侧入路切除腔旁区域的肿瘤。这种方法旨在提高手术精度和安全性,利用现代成像技术提供的详细解剖学见解。
一名 30 岁的女性患者入住珠江医院,在一个多月前偶然发现肝脏占位性病变。增强型计算机断层扫描 (CT) 显示一个具有低密度阴影的肿块,尺寸约为 37 毫米 x 34 毫米。初步诊断包括局灶性结节性增生或肝腺瘤,需要进一步鉴别(图1)。术前 3D 可视化重建如图 2 所示。患者的全血细胞计数、凝血功能检查和肝功能检查均在正常范围内。她没有明显的病史,术前评估证实没有手术禁忌症。鉴于与肝腺瘤相关的恶性肿瘤潜在风险,外科医生与患者及其家人进行了详细讨论,确保他们充分了解情况。在彻底了解手术风险和可能的治疗结果后,患者及其家人做出了进行手术治疗的明智决定。他们通过签署手术知情同意书表示同意,表明他们对手术程序的清晰理解以及对患者健康和福祉的承诺。
研究方案
该手术程序获得了南方医科大学珠江医院伦理委员会的批准。此外,患者及其家人对公开分享与治疗过程相关的信息和数据提供了知情同意。这确保了透明度并尊重患者在医疗决策过程中的自主权。
1. 术前准备
- 手术前让患者禁食 8 小时,并在 4 小时内避免饮水。
- 进行全身麻醉并进行气管插管12.
注意:通过评估患者麻醉后和术中的状况来评估麻醉的有效性。关键指标包括实现完全的感觉阻滞,在手术过程中不需要额外的药物,以及在整个手术过程中保持稳定的生命体征。 - 对手术区域进行消毒,从到耻骨联合和大腿上三分之一,用碘酊消毒 3 次,一直延伸到腋中线。
2. 手术技术
- 让患者仰卧,双腿分开,抬高头部,向右倾斜 15°。
- 用 Veress 针建立气腹13.将气腹压力设置为 12-14 mmHg (1 mmHg = 0.133 kPa)。
- 在脐带边缘用 10 号手术刀刀片做一个 1 厘米的切口作为观察端口,插入 10 毫米套管针(见 材料表)。
- 将直径为 5 毫米和 10 毫米的套管针插入以下解剖标志:沿右腋前线在肋骨边缘下方 2 厘米,沿右锁骨中线在肋骨边缘下方 8 厘米,沿左锁骨中线在肋骨边缘下方 2 厘米和 6 厘米(图 3)。
- 进行初步腹腔镜评估,以确定左侧入路进行尾状叶切除术的可行性。观察网膜腹膜内粘连的程度、肝脏的表面纹理以及左右三角韧带和镰状韧带的位置。
- 使用超声手术刀( 材料 表)横切镰状韧带,露出胆囊三角形。随后,结扎胆囊管并解剖胆囊。
- 使用超声手术刀清理小网膜孔,暴露肝门,并建立肝门闭塞带。
- 翻转右肝叶以露出下腔静脉,并用 3-0 Hem-o-lok 结扎和横切肝短静脉(见 材料表)(图 4)。
- 暴露尾状叶的 Spiegel 区域,然后是肝门闭塞,然后使用超声手术刀沿尾状叶切迹切面肝实质(图 5)。
- 使用超声手术刀和手术钳切除肝实质,以暴露与下腔静脉相邻的肿瘤(图 6 和 图 7)。
- 仔细解剖肿瘤,使用带有冷冻装置的超声手术刀凝固小静脉,并暴露肝中静脉(图8)。
- 用 3-0 Hem-o-lok 将门静脉暴露并结扎到右尾状叶,然后进行肿瘤动员(图 9、 图 10 和 图 11)。
- 使用双极电凝法进行止血和标本回收。使用 800 mL 的 0.9% NaCl 溶液冲洗腹腔(图 12)并用放置在腹腔内的引流管关闭(参见 材料表)。
- 使用不可吸收的缝合材料逐层闭合伤口(见 材料表)。
3. 术后护理和监测
- 在手术后的前 24 小时内,进行心脏监测(见 材料表)并提供 3 L/min 的连续低流量氧疗,密切监测生命体征。
- 在术后第一天,给患者半固体饮食,并指导患者进行翻身和床上锻炼。
注意:术后护理包括保肝、抗感染、抗出血、镇痛、白蛋白和胃保护治疗。 - 监测引流管的颜色、体积和胆红素水平的变化。一旦胆红素水平恢复正常且引流量小于 50 mL,请拔除引流管。
结果
手术 (视频 1) 持续 372 min,失血 300 mL,无需输血。有 5 例肝门闭塞,总计 70 分钟。患者无术后并发症,恢复顺利,术后住院 8 d。病理检查提示肝脏局灶性结节性增生 (FNH)。引流液中胆红素水平从术后第 3 天的 30.1 μmol/L 下降到术后第 5 天的 21.4 μmol/L(见 表 1),术后第 6 天拔除引流管。术后影像学和病理图像如图 13 所示。
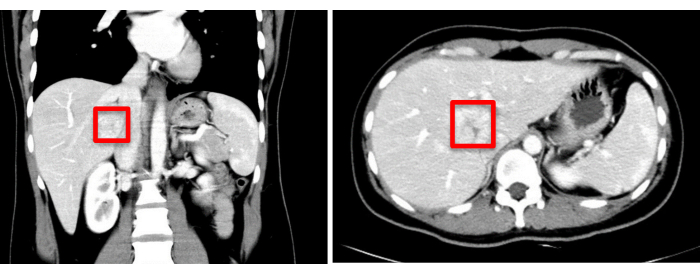
图 1:术前影像学评估 (CT) 显示肿瘤位置,用红色方块标记。请单击此处查看此图的较大版本。
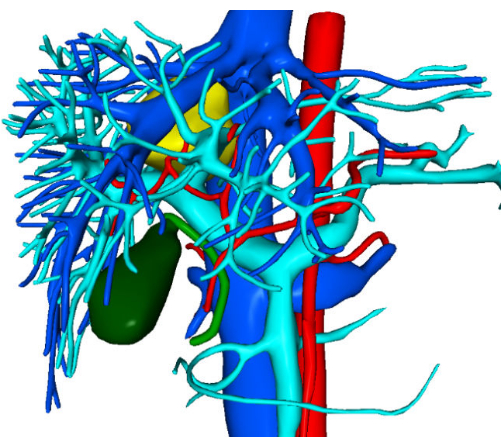
图 2:术前 3D 可视化重建图像。请单击此处查看此图的较大版本。

图 3:Trocar 分布图。 请单击此处查看此图的较大版本。

图 4:从右肝间隙暴露的下腔静脉和较大的短肝静脉用 Hem-o-lok 夹结扎并横切。 三维重建图像上的红色圆圈表示它们的相应位置。简称:SHV:short hepatic vein。IVC:下腔静脉。 请单击此处查看此图的较大版本。
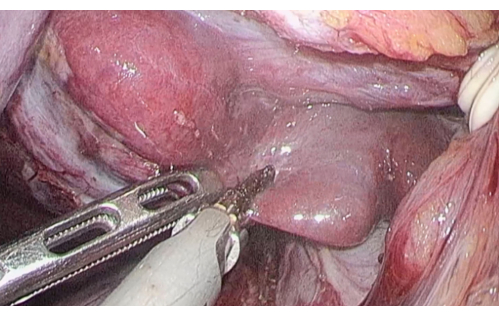
图 5:使用超声手术刀沿尾状核过程切分的肝实质。请点击此处查看此图的较大版本。
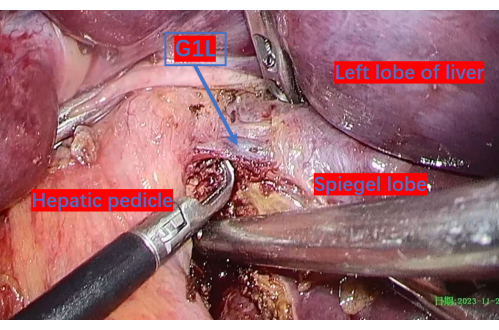
图 6:门静脉暴露至左尾状叶 (G1L) 的第一分支。 G1L 是门静脉通往左尾状叶的第一个分支。 请单击此处查看此图的较大版本。

图 7:仔细暴露的肿瘤,提供了其位置的清晰视图,并有助于后续的手术作。请单击此处查看此图的较大版本。

图 8:谨慎暴露的肝中静脉。 红色圆圈表示它在 3D 重建图像上的相应位置。缩写: MHV: Middle hepatic vein, IVC: 下腔静脉。 请单击此处查看此图的较大版本。
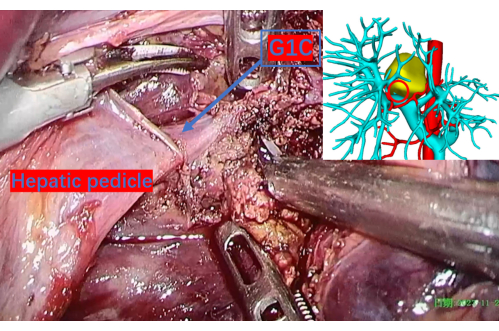
图 9:仔细横切的肝实质,显示门静脉直至右尾状叶的第一个分支,表示为 G1C。 3D 重建图像上的红色圆圈对应于此位置,提供了精确的参考点。G1C 是门静脉通往右尾状叶的第一个分支。 请单击此处查看此图的较大版本。

图 10:负责肿瘤血液供应的 Glisson 系统。 这个系统被暴露、夹紧和切断。 请单击此处查看此图的较大版本。
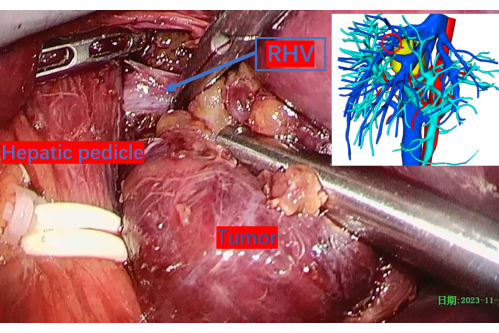
图 11:肿瘤解剖过程中暴露的右肝静脉主干。 红色圆圈标记了它在 3D 重建图像上的位置。缩写: RHV:右肝静脉。 请单击此处查看此图的较大版本。

图 12:止血后彻底冲洗和清洁手术区域。 缩写: MHV:肝中静脉。RHV:右肝静脉。IVC:下腔静脉。 请单击此处查看此图的较大版本。
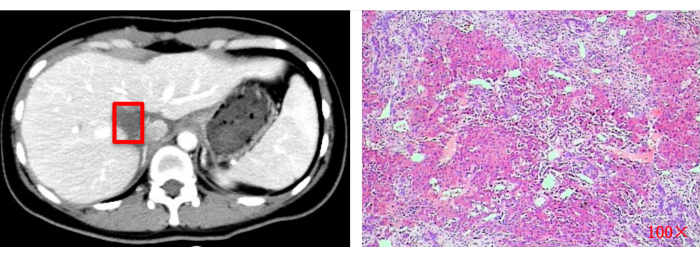
图 13:术后影像学评估 (CT) 和组织病理学检查 (100x)。 红色方块表示原始肿瘤切除部位。 请单击此处查看此图的较大版本。
| 项目 | 结果 |
| 作时间 (min) | 372 |
| 术中出血量 (mL) | 300 |
| 输血量 (mL) | 0 |
| 肝门闭塞次数 | 5 |
| 肝门闭塞时间 | 70 |
| 术后并发症 | 没有 |
| 术后住院时间(天) | 8 |
| 引流 POD3 上的胆红素水平 (U/L) | 30.1 |
| 引流 POD5 上的胆红素水平 (U/L) | 21.4 |
表 1:患者的相关结果。缩写:POD = 术后日。
视频 1:腹腔镜左入路尾状叶切除术(手术技术)。 缩写和定义: SHV:肝短静脉。G1L:门静脉的第一分支到左尾状叶。MHV: 肝中静脉。G1C:门脉的第一分支至右尾状叶。RHV:右肝静脉。IVC:下腔静脉。 请点击此处下载此视频。
讨论
肝脏是参与新陈代谢、免疫功能和解毒的重要器官14。肝细胞是肝脏的原代细胞,通常很稳定,但当触发时可能会变得不稳定,从而启动肝组织的再生。肝切除术后,肝脏残余量不足可能导致严重的术后并发症,例如急性肝衰竭。因此,对肝切除术后肝功能的严格评估至关重要15,16。研究表明,尾状叶约占正常人体肝脏体积的 2%-3%17。鉴于术前对肝功能储备的评估,单独切除尾状叶通常不会显着减少剩余肝脏体积,从而降低术后并发症(如急性肝衰竭)的风险。
Kumon 等人的研究18 阐明了肝脏尾状叶的血管解剖结构,确定了两个主要的肝蒂:左和右。左椎弓根的位置更一致,在 Spiegel 叶的中下三分之一附近进入尾状叶。相反,右椎弓根变化更大,可能延伸到腔旁或尾状突区域,甚至可能不存在。尾状叶中的门静脉分支表现出复杂性,通常表现为独立分支或共享主干。Spiegel 叶的门静脉更稳定,主要起源于左门静脉健壮的背支 (G1L)。相比之下,服务于右侧尾状核突和腔旁区域的门静脉主要起源于右侧主门静脉的分支,称为右侧尾状叶的第一个分支 (G1C)19。Cho 等人的20 篇描述将尾状叶动脉详细分为三种主要类型:独立分支、总干和源自肝动脉吻合口的动脉。尾状叶的胆道引流通常涉及两条主导管,Spiegel 叶中有 2 至 3 个分支汇合到左肝管中。腔旁区域通常有 2 至 3 个导管合并到右侧后扇形导管中,并显着发生导管间吻合18。从尾状叶的静脉引流主要通过肝短静脉进入下腔静脉。尾状突静脉穿过尾状突和右后叶之间,主要引流尾状突并加入后下腔静脉的右下缘,划定了这些区域之间的边界。主尾状叶肝静脉在 Spiegel 叶和腔旁区域之间延伸,最终进入后下腔静脉的左中缘,作为 Spiegel 叶和腔旁区域之间的解剖分界线。我们精心夹住并横切了关键血管及其分支,包括肝短静脉、G1L、G1C 和为肿瘤供血的肝蒂。这种精度确保了手术干预的安全性和有效性。
尾状叶独特的解剖结构位于肝脏深处,与关键脉管系统相邻,包括下腔静脉、肝中静脉和右肝静脉,这带来了手术挑战。它被肝门包裹会增加出血的风险,使切除在技术上要求很高。先前的研究21 表明,延长的左肝切除术联合尾状叶切除术更适合与肝静脉相邻的尾状叶的恶性肿瘤。然而,我们对这些肿瘤的理解的进步导致直接尾状叶切除术和部分切除术的采用越来越多。这些方法有助于根治性肿瘤切除,同时保留肝功能22。对于尾状叶的原发性和继发性肝恶性肿瘤,在技术上可行的情况下,应进行手术治疗。尾状叶的良性肿瘤,如海绵状血管瘤、局灶性结节性增生 (FNH)、肝内胆管结石和肝腺瘤,也适合完全或部分切除,提供有效的治疗选择。
腹腔镜肝切除术已成为肝胆手术中的一种流行技术 23,24,25。该手术的隧道视野和放大功能为尾状叶的切除提供了明显的优势。在这个视觉框架内,即使在狭小的空间内,也有利于下腔静脉周围的解剖,并且增强了更细小的肝短静脉的可视化。然而,该技术并非没有挑战,例如缺乏触觉反馈、有限的回缩能力以及解剖平面的限制。克服这些问题需要具有相当专业知识的外科医生,尤其是在尾状叶的部分切除方面。尾状叶切除术的常见方法包括左、右、左右联合和前入路。左侧入路通常用于 Spiegel 叶的切除或与左侧段或左半肝的切除联合使用。正确的方法适用于尾状核过程的切除或考虑右半球切除术的病例。在肿瘤广泛或涉及整个尾状叶,需要困难暴露的情况下,可以采用左右联合方法。前路通常用于切除腔旁区域,这涉及分裂正常的肝组织。这种方法会导致肝脏创伤的表面积更大,增加胆管和血管损伤的风险,以及增加术后出血和胆漏的可能性。
传统上,腔静脉旁肿瘤使用腹腔镜前路或右侧入路治疗,关于左侧手术的文献很少 8,9,10。Feng 等人在他们发表的病例报告26 中,成功地对两例尾状叶良性血管瘤进行了开放式左侧入路切除术。本研究的重点是尾状叶的整块切除,而不是尾状叶三个部分的节段性切除。对于良性病变,这种方法并没有更有效地减少不必要的肝实质切除,从而降低胆漏的风险。目前,考虑到尾状叶复杂的血管结构,腹腔镜手术可以更清楚地显示细微的血管结构,从而降低出血的风险。此外,Zheng 等人进行了一项研究,他们首次引入了“华西解剖法”27。他们创新性地使用腹腔镜左侧入路成功切除了尾状叶中的复杂肿瘤。在手术过程中,他们采用了逆时针解剖分层方法,按照固定的顺序从简单到复杂。这种方法利用学习曲线简化了手术过程,更有利于学者的学习和掌握,进一步证实了左侧入路进行尾状叶切除术的可行性。
左侧病例的缺乏可能归因于腔旁肿瘤的深部性质,由于周围血管解剖结构错综复杂,难以从左侧视图实现完全暴露。然而,利用术前影像学检查,我们对腔旁肿瘤中的局灶性结节性增生和肝腺瘤进行了鉴别诊断,减轻了对肿瘤边缘充分性的担忧。与“华西解剖法”不同,我们中心采用腹腔镜左侧入路切除技术,专门用于尾状叶腔静脉附近的肿瘤。术前,我们使用 3D 重建进行评估,以确保手术安全性。此外,此处描述的手术方法避免了左肝静脉的暴露,降低了左肝静脉撕裂和出血的风险。这种方法还可以最大限度地减少对肝实质的不必要损伤,从而降低术后胆汁渗漏的可能性。通过这些改进的手术策略,我们的目标是实现更安全、更有效的尾状叶肿瘤切除。这种技术避免了像前路入路那样分裂肝组织的需要。与右侧入路相比,它具有手术区域更宽敞、手术时间更短等优点。此外,术前三维重建技术的使用显着降低了主要血管损伤的风险,并增强了肿瘤切除的可行性。手术在 372 min 内高效完成,失血量仅为 300 mL。患者术后病程简单,术后第 8 天顺利出院,恢复迅速。
我们必须清楚地认识到,切除良性肿瘤的必要性取决于其恶性变性的可能性以及由于肿瘤较大而出现的压迫症状,这对于确定手术适应症至关重要。对于恶性肿瘤,左侧手术入路的适当性以及保证足够的暴露和足够的切除切缘是需要进一步研究的问题。尽管如此,根据我们的研究和临床经验,我们得出的结论是,腹腔镜左侧入路切除良性腔旁肿瘤是完全可行的,尤其是在扎实掌握解剖学知识和广泛的外科专业知识的情况下。这种手术技术不仅为患者提供了微创治疗选择,而且在保证肿瘤切除安全性的同时,最大限度地减少了手术创伤,缩短了术后恢复期。
披露声明
作者没有需要披露的冲突或财务关系。
致谢
本研究得到了广东省基础与应用基础研究基金 (2021B1515230011)、广州市科技项目 (2023B03J1247) 和广东省重点领域研究发展计划(2023B1111020008) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
参考文献
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。