Method Article
Résection laparoscopique par voie d’approche gauche du lobe caudé
Dans cet article
Résumé
Ici, nous présentons un protocole chirurgical décrivant la résection laparoscopique d’une tumeur située près de la partie paracavale dans le lobe caudé, en utilisant une approche du côté gauche.
Résumé
La lobectomie caudidée laparoscopique (LCL) est l’un des types les plus difficiles de résections hépatiques laparoscopique. La principale difficulté réside dans la position anatomique profonde du lobe caudé, qui est étroitement adjacent aux premier et deuxième ports hépatiques et à la veine cave inférieure, ce qui augmente le risque de saignement majeur pendant la chirurgie. En plus d’une compréhension approfondie de l’anatomie de la tumeur du lobe caudé, d’une évaluation complète de l’imagerie et d’une reconstruction tridimensionnelle, le choix flexible de l’approche chirurgicale est également essentiel pour réduire la difficulté chirurgicale et améliorer la sécurité. Nous effectuons une lobectomie caudidée laparoscopique en utilisant une approche du côté gauche, en particulier lorsque la tumeur est située dans la zone du lobe caudé proche de la veine cave inférieure. Cette méthode évite l’étape de séparation de la substance hépatique pour exposer le champ de vision requis par l’approche antérieure traditionnelle, avec les avantages d’un espace opératoire plus grand et d’une durée d’opération plus courte. Dans le même temps, combiné à la technologie de reconstruction tridimensionnelle préopératoire, nous avons considérablement réduit le risque d’endommager des vaisseaux sanguins importants et augmenté le taux de réussite de la résection des tumeurs dans le lobe caudé.
Introduction
Le lobe caudé est situé profondément dans le foie, sa couverture spécifique s’étendant de l’avant de la veine cave inférieure, atteignant derrière les veines hépatiques gauche, moyenne et droite, vers le haut jusqu’à l’endroit où les trois principales veines hépatiques convergent vers la veine cave inférieure, et vers le bas jusqu’au hile hépatique1.
Depuis le rapport pionnier de Dulucq et al. en 2006 sur les résections laparoscopique du lobe caudé hépatique, de nombreux cas impliquant des résections isolées du lobe caudé et des résections segmentaires ont été documentés 2,3,4,5,6,7. Cependant, la complexité technique de la lobectomie caudidée laparoscopique est soumise à une multitude de facteurs. Il s’agit notamment du respect strict des indications chirurgicales, de l’évaluation préopératoire complète des données d’imagerie, de la maîtrise des techniques chirurgicales laparoscopique, de la connaissance intime de l’anatomie locale du lobe caudé et du choix judicieux des approches chirurgicales. À l’heure actuelle, il existe quatre approches prédominantes pour la résection du lobe caudé : l’approche gauche, l’approche droite, l’approche combinée gauche-droite et l’approche antérieure. L’approche du côté gauche est généralement utilisée pour la résection du lobe de Spiegel ou lorsqu’une résection combinée du segment latéral gauche ou de l’hémisphère gauche du foie est nécessaire. À l’inverse, l’approche du côté droit est privilégiée pour la résection de l’apophyse caudée ou, dans les cas nécessitant une résection du foie de l’hémisphère droit. Dans les cas où la tumeur est disproportionnée ou s’infiltre largement dans le lobe caudé, compliquant ainsi l’exposition par l’approche gauche ou droite, une approche combinée gauche-droite peut devenir indispensable. Pour la résection de tumeurs à proximité de la veine cave inférieure, l’approche antérieure est généralement préférée, car elle facilite une exposition et une visualisation optimales.
Le segment paracaval, une partie cruciale du lobe caudé, est largement reconnu comme le segment IX de Couinaud. Il est stratégiquement positionné derrière le segment IV, essentiellement l’épicentre de l’anatomie du foie. Sa face dorsale est en contact intime avec la veine cave inférieure, tandis que sa limite inférieure est étroitement alignée avec le premier port hépatique. L’extrémité céphalique de ce segment est contiguë aux origines des veines hépatiques moyenne et droite, et sa face ventrale est en apposition directe au tronc principal de la veine hépatique moyenne. Compte tenu de son emplacement caché et de sa contiguïté aux principales structures vasculaires du foie, les interventions chirurgicales dans cette zone sont intrinsèquement risquées et techniquement difficiles. Historiquement, les interventions chirurgicales ciblant le segment paracave du lobe caudé ont principalement utilisé des approches laparoscopique antérieures ou droites 8,9,10. Il y a une pénurie de littérature sur les approches du côté gauche, probablement en raison de la profondeur profonde de cette région et du champ de vision restreint de la gauche, aggravé par l’architecture vasculaire complexe dans le voisinage. De telles complexités exigent que le chirurgien qui opère possède une compréhension approfondie de l’anatomie et une riche expertise chirurgicale. Les progrès de la technologie de reconstruction de la visualisation tridimensionnelle (3D) ont permis la création de modèles hépatiques tridimensionnels précis et vivants11. Ces modèles offrent une représentation claire du foie, de la tumeur, du système vasculaire hépatique et des relations spatiales entre le foie et les organes voisins. Cette technologie est essentielle pour fournir une compréhension préopératoire complète des conditions spécifiques du foie, de l’emplacement précis de la tumeur et de l’interaction complexe des vaisseaux sanguins.
Dans cet article, nous présentons une stratégie chirurgicale innovante : l’exploitation d’évaluations tridimensionnelles préopératoires et l’utilisation d’une approche laparoscopique du côté gauche pour l’excision des tumeurs dans la région paracavale. Cette approche vise à améliorer la précision et la sécurité chirurgicales, en capitalisant sur les informations anatomiques détaillées fournies par les techniques d’imagerie modernes.
Une patiente de 30 ans a été admise à l’hôpital de Zhujiang après la découverte fortuite d’une lésion du foie, détectée il y a plus d’un mois. La tomodensitométrie (TDM) améliorée a révélé une masse avec une ombre de faible densité, mesurant environ 37 mm x 34 mm. Les diagnostics préliminaires comprenaient une hyperplasie nodulaire focale ou un adénome hépatique, qui nécessitent une différenciation plus poussée (Figure 1). La reconstruction de la visualisation tridimensionnelle préopératoire est illustrée à la figure 2. La numération globulaire complète du patient, son profil de coagulation et les tests de la fonction hépatique étaient tous dans les limites normales. Elle n’avait pas d’antécédents médicaux importants et les évaluations préopératoires n’ont confirmé aucune contre-indication à la chirurgie. Compte tenu du risque potentiel de malignité associé aux adénomes hépatiques, les chirurgiens ont entamé des discussions approfondies avec la patiente et sa famille, en s’assurant d’être pleinement informés. Après une compréhension approfondie des risques chirurgicaux et des résultats thérapeutiques possibles, la patiente et sa famille ont pris la décision éclairée de procéder au traitement chirurgical. Ils ont donné leur consentement en signant le formulaire de consentement éclairé chirurgical, démontrant ainsi leur compréhension claire de l’intervention et leur engagement envers la santé et le bien-être du patient.
Protocole
L’intervention chirurgicale a reçu l’autorisation du comité d’éthique de l’hôpital Zhujiang de l’Université de médecine du Sud. De plus, la patiente et sa famille ont donné leur consentement éclairé pour partager publiquement des informations et des données pertinentes au processus de traitement. Cela garantit la transparence et le respect de l’autonomie du patient dans le processus de prise de décision médicale.
1. Préparation préopératoire
- Faites jeûner le patient pendant 8 h et abstenez-vous de boire pendant 4 h avant la chirurgie.
- Administrer une anesthésie générale et effectuer une intubation endotrachéale12.
REMARQUE : Évaluez l’efficacité de l’anesthésie en évaluant l’état du patient à la fois après l’anesthésie et pendant l’opération. Les indicateurs clés comprennent l’obtention d’un bloc complet de sensations, l’absence de médicaments supplémentaires pendant la procédure et le maintien de signes vitaux stables tout au long de la chirurgie. - Désinfectez la zone chirurgicale, des mamelons à la symphyse pubienne et au tiers supérieur des cuisses, avec de la teinture d’iode trois fois, en s’étendant jusqu’à la ligne axillaire médiane.
2. Technique chirurgicale
- Placez le patient en décubitus dorsal, les jambes écartées, la tête surélevée et une inclinaison de 15° vers la droite.
- Établir le pneumopéritoine à l’aide d’une aiguille Veress13. Réglez la pression du pneumopéritoine à 12-14 mmHg (1 mmHg = 0,133 kPa).
- Faites une incision de 1 cm avec une lame de scalpel chirurgical n°10 au bord de l’ombilical pour un port d’observation, avec un trocart de 10 mm inséré (voir tableau des matériaux).
- Insérez les trocarts, mesurant 5 mm et 10 mm de diamètre, aux points de repère anatomiques suivants : 2 cm sous le bord des côtes le long de la ligne axillaire antérieure droite, 8 cm sous le bord des côtes le long de la ligne médio-claviculaire droite, et 2 cm et 6 cm sous le bord des côtes le long de la ligne médio-claviculaire gauche, respectivement (figure 3).
- Effectuer l’évaluation laparoscopique initiale pour déterminer la faisabilité d’une approche du côté gauche de la résection du lobe caudé. Observez le degré d’adhésion intrapéritonéale de l’épiploon, la texture de la surface du foie et la position des ligaments triangulaires gauche et droit et des ligaments falciformes.
- Utilisez le scalpel à ultrasons (voir Tableau des matériaux) pour transecter le ligament falciforme, révélant le triangle de la vésicule biliaire. Par la suite, ligaturez le canal cystique et disséquez la vésicule biliaire.
- Utilisez le scalpel à ultrasons pour dégager le petit foramen omental, exposer le hile hépatique et permettre l’établissement d’une bande d’occlusion hilaire hépatique.
- Retournez le lobe hépatique droit pour exposer la veine cave inférieure, puis ligaturez et transectez les veines courtes hépatiques avec 3-0 Hem-o-lok (voir le tableau des matériaux) (figure 4).
- Exposez la zone de Spiegel du lobe caudé, suivie de l’occlusion hilaire hépatique, puis transectez le parenchyme hépatique le long de l’encoche du lobe caudé à l’aide du scalpel à ultrasons (Figure 5).
- À l’aide du scalpel à ultrasons et de la pince opératoire, on résecte le parenchyme hépatique afin d’exposer la tumeur adjacente à la veine cave inférieure (Figure 6 et Figure 7).
- Disséquez soigneusement la tumeur, utilisez un scalpel à ultrasons avec un équipement de congélation pour coaguler les petites veines et exposez la veine hépatique moyenne (Figure 8).
- Exposez et ligaturez la veine porte au lobe caudé droit avec 3-0 Hem-o-lok, suivi d’une mobilisation tumorale (Figure 9, Figure 10 et Figure 11).
- Utilisez l’électrocoagulation bipolaire pour l’hémostase et le prélèvement d’échantillons. Utiliser 800 mL de solution de NaCl à 0,9 % pour irriguer la cavité abdominale (figure 12) et fermer avec le tube de drainage placé à l’intérieur de la cavité abdominale (voir le tableau des matières).
- Fermez la plaie couche par couche à l’aide d’un matériau de suture non résorbable (voir le tableau des matériaux).
3. Soins infirmiers et surveillance postopératoires
- Dans les 24 premières heures suivant l’opération, effectuez une surveillance cardiaque (voir le tableau des matières) et administrez une oxygénothérapie continue à faible débit à 3 L/min, en surveillant de près les signes vitaux.
- Le premier jour postopératoire, donnez au patient un régime semi-solide et demandez-lui d’effectuer des exercices de retournement et au lit.
REMARQUE : Les soins postopératoires comprennent les traitements hépatoprotecteurs, anti-infectieux, anti-hémorragiques, analgésiques, à l’albumine et gastroprotecteurs. - Surveillez la couleur, le volume et les changements dans les taux de bilirubine dans les tubes de drainage. Retirez le tube de drainage une fois que le taux de bilirubine est revenu à la normale et que le drainage est inférieur à 50 ml.
Résultats
L’intervention chirurgicale (vidéo 1) a duré 372 minutes avec une perte de sang de 300 ml, et aucune transfusion sanguine n’a été nécessaire. Il y a eu cinq cas d’occlusion porte hépatique totalisant 70 min. Le patient n’a présenté aucune complication postopératoire et s’est rétabli en douceur, restant à l’hôpital pendant 8 jours après l’opération. L’examen pathologique a révélé une hyperplasie nodulaire focale (HNF) du foie. Le taux de bilirubine dans le liquide de drainage a diminué, passant de 30,1 μmol/L le troisième jour postopératoire à 21,4 μmol/L le cinquième jour postopératoire (voir le tableau 1), le tube de drainage ayant été retiré le sixième jour postopératoire. L’imagerie postopératoire et les images pathologiques sont illustrées à la figure 13.
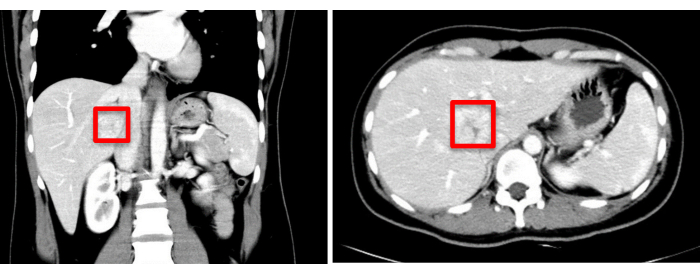
Figure 1 : L’évaluation de l’imagerie préopératoire (TDM) indique l’emplacement de la tumeur, marqué d’un carré rouge. Veuillez cliquer ici pour voir une version agrandie de cette figure.
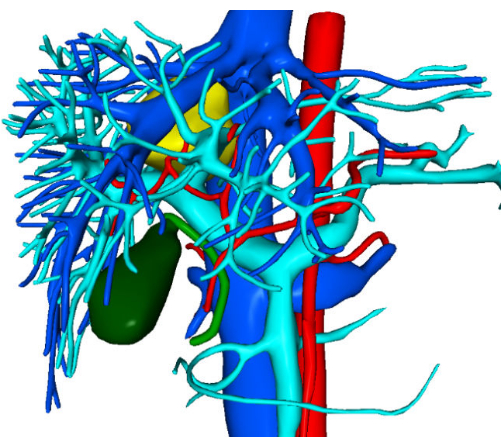
Figure 2 : Images de reconstruction de visualisation tridimensionnelle préopératoire. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Carte de distribution du trocart. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : La veine cave inférieure exposée à partir de l’espace hépatique droit et les veines hépatiques courtes plus grandes ligaturées avec des clips Hem-o-lok et transectées. Le cercle rouge sur l’image de reconstruction tridimensionnelle indique leurs positions correspondantes. Abréviation : SHV : veine hépatique courte. IVC : veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
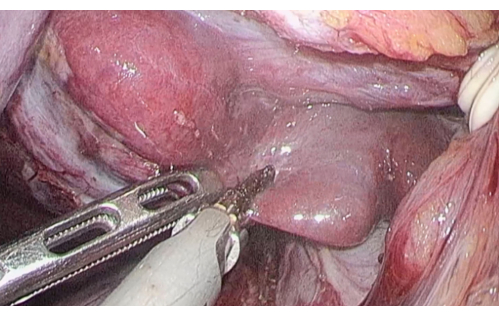
Figure 5 : Le parenchyme hépatique traversé le long de l’apophyse caudée à l’aide d’un scalpel à ultrasons. Veuillez cliquer ici pour voir une version agrandie de cette figure.
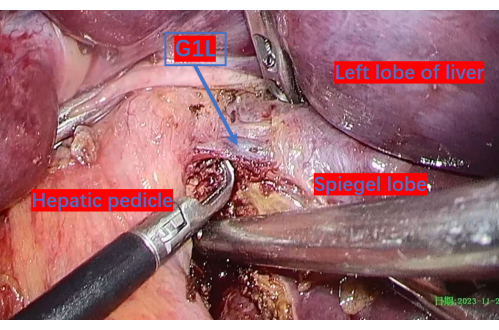
Figure 6 : La nervure porte exposée jusqu’à la première branche du lobe caudé gauche (G1L). G1L est la première branche de la veine porte vers le lobe caudé gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Tumeur soigneusement exposée, offrant une vue claire de son emplacement et facilitant les manœuvres chirurgicales ultérieures. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Veine hépatique moyenne exposée avec précaution. Le cercle rouge indique sa position correspondante sur l’image de reconstruction 3D. Abréviations : MHV : veine hépatique moyenne, IVC : veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
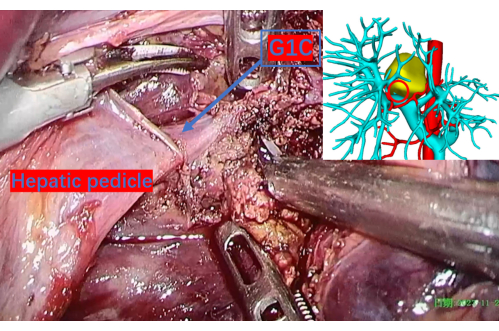
Figure 9 : Parenchyme hépatique soigneusement transecté révélant la veine porte jusqu’à la première branche du lobe caudé droit, notée G1C. Un cercle rouge sur l’image de reconstruction 3D correspond à cet emplacement, fournissant un point de référence précis. G1C est la première branche de la veine porte vers le lobe caudé droit. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 10 : Le système Glisson responsable de l’apport sanguin de la tumeur. Ce système a été exposé, serré et sectionné. Veuillez cliquer ici pour voir une version agrandie de cette figure.
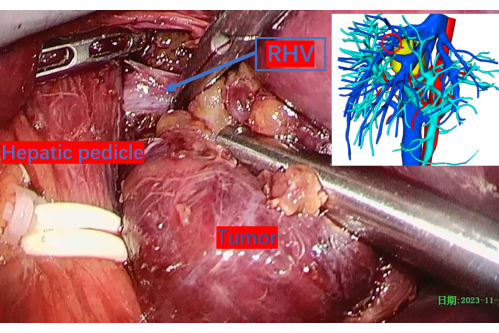
Figure 11 : Tronc principal exposé de la veine hépatique droite lors de la dissection tumorale. Le cercle rouge indique son emplacement sur l’image de reconstruction 3D. Abréviations : VRS : veine hépatique droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 12 : Champ chirurgical soigneusement irrigué et nettoyé après hémostase. Abréviations : MHV : veine hépatique moyenne. VRS : veine hépatique droite. IVC : veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
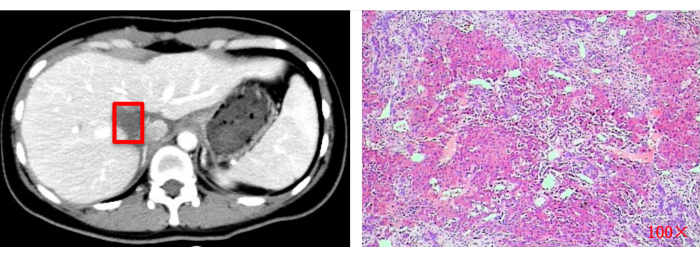
Figure 13 : Bilan d’imagerie postopératoire (TDM) et examen histopathologique (100x). Les carrés rouges indiquent le site de résection tumorale d’origine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Articles | Résultats |
| Temps de fonctionnement (min) | 372 |
| Volume de saignement peropératoire (mL) | 300 |
| Volume de transfusion sanguine (mL) | 0 |
| Nombre d’occlusion portale hépatique | 5 |
| Temps d’occlusion portale hépatique | 70 |
| Complication postopératoire | Aucun |
| Séjour postopératoire à l’hôpital (jour) | 8 |
| Drainer les niveaux de bilirubine sur POD3 (U/L) | 30.1 |
| Drainer les niveaux de bilirubine sur POD5 (U/L) | 21.4 |
Tableau 1 : Résultats pertinents du patient. Abréviations : POD = jour postopératoire.
Vidéo 1 : Résection par voie laparoscopique gauche du lobe caudé (technique chirurgicale). Abréviations et définitions : SHV : veine hépatique courte. G1L : la première branche de la veine porte vers le lobe caudé gauche. MHV : veine hépatique moyenne. G1C : la première branche de la veine porte du lobe caudé droit. VRS : veine hépatique droite. IVC : veine cave inférieure. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
Le foie est un organe crucial impliqué dans le métabolisme, la fonction immunitaire et la détoxification14. Les hépatocytes, les cellules primaires du foie, sont généralement stables, mais peuvent devenir instables lorsqu’ils sont déclenchés, initiant la régénération du tissu hépatique. Après une résection hépatique, un volume hépatique résiduel insuffisant peut entraîner des complications postopératoires graves telles qu’une insuffisance hépatique aiguë. Ainsi, une évaluation rigoureuse de la fonction hépatique après l’hépatectomie est d’une importance primordiale15,16. La recherche indique que le lobe caudé constitue environ 2 à 3 % du volume du foie dans un corps humain typique17. Compte tenu de l’évaluation préopératoire des réserves de la fonction hépatique, la résection du lobe caudé seule ne diminue généralement pas significativement le volume hépatique restant, atténuant ainsi le risque de complications postopératoires telles que l’insuffisance hépatique aiguë.
L’étude de Kumon et al.18 élucide l’anatomie vasculaire du lobe caudé du foie, en identifiant deux pédicules hépatiques primaires : le gauche et le droit. Le pédicule gauche est positionné de manière plus constante, entrant dans le lobe caudé autour du tiers moyen à inférieur du lobe de Spiegel. À l’inverse, le pédicule droit est plus variable, s’étendant potentiellement dans les zones d’apophyse paracavale ou caudée, et peut même être absent. Les branches veineuses portes du lobe caudé présentent une complexité, se manifestant souvent soit par des branches indépendantes, soit par un tronc partagé. La veine porte du lobe de Spiegel est plus stable, principalement à partir d’une branche dorsale robuste (G1L) de la veine porte gauche. En revanche, les nervures portes desservant l’apophyse caudée droite et la région paracavale proviennent principalement des branches de la veine porte principale droite, appelée la première branche du lobe caudé droit (G1C)19. Les20 descriptions de Cho et al détaillent les artères du lobe caudé en trois types principaux : les branches indépendantes, les troncs communs et celles résultant d’anastomoses artérielles hépatiques. Le drainage biliaire dans le lobe caudé implique généralement deux canaux principaux, avec 2 à 3 branches dans le lobe de Spiegel convergeant vers le canal hépatique gauche. La région paracavale comporte généralement 2 à 3 canaux qui se fondent dans le canal sectoriel postérieur droit, avec une occurrence significative d’anastomoses interductales18. Le drainage veineux du lobe caudé se fait principalement par les veines hépatiques courtes dans la veine cave inférieure. La veine de l’apophyse caudée traverse entre l’apophyse caudée et le lobe postérieur droit, drainant principalement l’apophyse caudée et rejoignant le bord inférieur droit de la veine cave inférieure postérieure, délimitant la limite entre ces régions. La veine hépatique principale du lobe caudé passe entre le lobe de Spiegel et la zone paracavale, entrant finalement dans le bord moyen gauche de la veine cave postérieure inférieure, servant de démarcation anatomique entre le lobe de Spiegel et la région paracavale. Nous avons méticuleusement clampé et transecté les principaux vaisseaux et leurs branches, y compris les veines hépatiques courtes, G1L, G1C et le pédicule hépatique alimentant la tumeur. Cette précision garantit la sécurité et l’efficacité des interventions chirurgicales.
L’anatomie distinctive du lobe caudé, niché profondément dans le foie et adjacent à la vascularisation clé, y compris la veine cave inférieure, la veine hépatique moyenne et la veine hépatique droite, présente un défi chirurgical. Son enfermement par la hila hépatique augmente le risque d’hémorragie, ce qui rend la résection techniquement exigeante. Des recherches antérieures21 ont indiqué qu’une hépatectomie gauche étendue associée à une résection du lobe caudé est préférable pour les tumeurs malignes du lobe caudé adjacent aux veines hépatiques. Cependant, les progrès de notre compréhension de ces tumeurs ont conduit à une adoption accrue des résections simples du lobe caudé et des résections partielles. Ces approches facilitent l’élimination radicale des tumeurs tout en préservant la fonction hépatique22. Pour les tumeurs malignes hépatiques primitives et secondaires du lobe caudé, la chirurgie est indiquée lorsque cela est techniquement possible. Les tumeurs bénignes du lobe caudé, telles que les hémangiomes caverneux, l’hyperplasie nodulaire focale (HFN), les calculs des canaux biliaires intrahépatiques et les adénomes hépatiques, se prêtent également à une résection totale ou partielle, offrant des options de traitement efficaces.
La résection hépatique laparoscopique est devenue une technique répandue en chirurgie hépatobiliaire 23,24,25. La vision en tunnel et les capacités de grossissement de la procédure offrent des avantages distincts pour l’excision du lobe caudé. Dans ce cadre visuel, la dissection autour de la veine cave inférieure est facilitée, même dans les espaces restreints, et la visualisation des veines hépatiques courtes plus fines est améliorée. Cependant, la technique n’est pas sans défis, tels que l’absence de retour haptique, les capacités de rétraction limitées et les contraintes des plans de dissection. Pour les surmonter, il faut faire appel à un chirurgien doté d’une grande expertise, notamment dans les résections partielles du lobe caudé. Les approches courantes pour la résection du lobe caudé comprennent les approches gauche, droite, gauche-droite et antérieure. L’approche gauche est généralement utilisée pour la résection du lobe de Spiegel ou en conjonction avec la résection du segment latéral gauche ou de l’hémilier gauche. L’approche de droite est indiquée pour la résection de l’apophyse caudée ou pour les cas où une résection de l’hémiliver droit est envisagée. Dans les cas où une tumeur est étendue ou implique l’ensemble du lobe caudé, nécessitant une exposition difficile, une approche combinée gauche-droite peut être utilisée. L’approche antérieure est souvent utilisée pour la résection de la région paracavale, qui implique la division du tissu hépatique normal. Cette méthode peut entraîner une plus grande surface de traumatisme hépatique, ce qui augmente le risque de lésions des voies biliaires et vasculaires, ainsi que la probabilité de saignements postopératoires et de fuites biliaires.
Traditionnellement, les tumeurs paracavales ont été traitées à l’aide d’approches laparoscopique antérieures ou droites, avec peu de littérature sur les procédures du côté gauche 8,9,10. Feng et al., dans leur rapport de cas publié26, ont réalisé avec succès des résections ouvertes par approche gauche sur deux cas d’hémangiomes bénins dans le lobe caudé. Cette étude s’est concentrée sur la résection en bloc du lobe caudé plutôt que sur les résections segmentaires des trois parties du lobe caudé. Pour les lésions bénignes, cette méthode n’a pas réduit plus efficacement la résection parenchymateuse hépatique inutile, diminuant ainsi le risque de fuite de bile. Actuellement, compte tenu de la structure vasculaire complexe du lobe caudé, la chirurgie laparoscopique peut mettre en évidence plus clairement les structures vasculaires subtiles, réduisant ainsi le risque de saignement. De plus, Zheng et al. ont mené une étude dans laquelle ils ont introduit pour la première fois la « méthode de dissection Huaxi »27. Ils ont utilisé de manière innovante une approche laparoscopique du côté gauche pour réséquer avec succès des tumeurs complexes dans le lobe caudé. Au cours de l’opération, ils ont utilisé une méthode de dissection et de superposition dans le sens inverse des aiguilles d’une montre, progressant de simple à complexe dans une séquence fixe. Cette approche simplifie le processus chirurgical en utilisant la courbe d’apprentissage, ce qui est plus propice à l’apprentissage et à la maîtrise des chercheurs, confirmant ainsi la faisabilité de l’approche du côté gauche pour la résection du lobe caudé.
Cette pénurie de cas du côté gauche peut être attribuée à la nature profonde des tumeurs paracavales, ce qui pose des difficultés à obtenir une exposition complète du côté gauche en raison de la complexité de l’anatomie vasculaire environnante. Cependant, en utilisant l’imagerie préopératoire, nous avons effectué un diagnostic différentiel de l’hyperplasie nodulaire focale et des adénomes hépatiques dans les tumeurs paracavales, atténuant ainsi les inquiétudes quant à l’adéquation de la marge tumorale. Contrairement à la « méthode de dissection Huaxi », notre centre utilise une technique de résection par approche laparoscopique du côté gauche, spécifiquement pour les tumeurs adjacentes à la veine cave dans le lobe caudé. En préopératoire, nous utilisons la reconstruction 3D pour l’évaluation afin d’assurer la sécurité chirurgicale. De plus, la méthode chirurgicale décrite ici évite l’exposition de la veine hépatique gauche, réduisant ainsi le risque de déchirure et de saignement de la veine hépatique gauche. Cette méthode minimise également les dommages inutiles au parenchyme hépatique, réduisant ainsi la probabilité de fuite biliaire postopératoire. Grâce à ces stratégies chirurgicales raffinées, nous visons à obtenir une résection plus sûre et plus efficace des tumeurs du lobe caudé. Cette technique évite d’avoir à diviser le tissu hépatique, comme dans l’approche antérieure. Il offre des avantages tels qu’un champ opératoire plus spacieux et une durée opératoire plus courte par rapport à l’approche du côté droit. De plus, l’utilisation de la technologie de reconstruction tridimensionnelle préopératoire a considérablement minimisé le risque de lésion vasculaire majeure et amélioré la faisabilité de la résection tumorale. L’opération a été réalisée efficacement en 372 minutes avec une perte de sang de seulement 300 ml. Le patient a eu une évolution postopératoire sans complication, a reçu son congé en douceur le huitième jour postopératoire et s’est rétabli rapidement.
Nous devons clairement reconnaître que la nécessité de réséquer des tumeurs bénignes dépend de leur potentiel de dégénérescence maligne et de la présence de symptômes compressifs dus à la grande taille de la tumeur, qui sont essentiels pour déterminer les indications chirurgicales. Pour les tumeurs malignes, la pertinence d’une approche chirurgicale du côté gauche et l’assurance d’une exposition adéquate et de marges de résection suffisantes sont des questions qui nécessitent une enquête plus approfondie. Néanmoins, sur la base de nos recherches et de notre expérience clinique, nous sommes parvenus à la conclusion que l’approche laparoscopique du côté gauche pour la résection des tumeurs paracavales bénignes est tout à fait viable, en particulier avec une solide compréhension des connaissances anatomiques et une expertise chirurgicale étendue. Cette technique chirurgicale offre non seulement aux patients une option de traitement peu invasive, mais garantit également la sécurité de l’excision tumorale tout en minimisant les traumatismes chirurgicaux et en raccourcissant les périodes de récupération postopératoire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit ou lien financier à divulguer.
Remerciements
Cette étude a été soutenue par la Fondation de recherche fondamentale et appliquée du Guangdong de Chine (2021B1515230011), des projets scientifiques et technologiques à Guangzhou de Chine (2023B03J1247) et le programme de recherche et de développement dans les domaines clés de la province du Guangdong (2023B1111020008).
matériels
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
Références
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon