Method Article
Laparoskopische Resektion des Kaudarmappens mit linksem Zugang
In diesem Artikel
Zusammenfassung
In dieser Arbeit stellen wir ein chirurgisches Protokoll vor, das die laparoskopische Resektion eines Tumors in der Nähe des parakavalen Teils innerhalb des Schwanzlappens unter Verwendung eines linksseitigen Zugangs beschreibt.
Zusammenfassung
Die laparoskopische Caudat-Lobektomie (LCL) ist eine der anspruchsvollsten Arten der laparoskopischen Leberresektion. Die Hauptschwierigkeit liegt in der tiefen anatomischen Position des Schwanzlappens, der eng an die erste und zweite Leberpforte und die untere Hohlvene angrenzt, was das Risiko schwerer Blutungen während der Operation erhöht. Neben einem gründlichen Verständnis der Anatomie des Schwanzlappentumors, einer umfassenden bildgebenden Beurteilung und dreidimensionalen Rekonstruktion ist auch die flexible Wahl des chirurgischen Ansatzes der Schlüssel zur Reduzierung der chirurgischen Schwierigkeiten und zur Verbesserung der Sicherheit. Die laparoskopische Lobektomie des Schwanzknochens führen wir mit einem linksseitigen Zugang durch, insbesondere wenn sich der Tumor im Bereich des Schwanzlappens in der Nähe der unteren Hohlvene befindet. Diese Methode vermeidet den Schritt der Spaltung der Lebersubstanz, um das für den traditionellen anterioren Zugang erforderliche Sichtfeld freizulegen, mit den Vorteilen eines größeren Operationsraums und einer kürzeren Operationszeit. Gleichzeitig haben wir in Kombination mit der präoperativen dreidimensionalen Rekonstruktionstechnologie das Risiko einer Schädigung wichtiger Blutgefäße deutlich reduziert und die Erfolgsrate bei der Resektion von Tumoren im Schwanzlappen erhöht.
Einleitung
Der Schwanzlappen befindet sich tief in der Leber, wobei sich seine spezifische Abdeckung von der Vorderseite der unteren Hohlvene hinter der linken, mittleren und rechten Lebervene nach oben bis zu der Stelle, an der die drei Hauptvenen der Lebervene in die untere Hohlvene und nach unten bis zum hepatischen Hilum1 erstreckt.
Seit dem bahnbrechenden Bericht von Dulucq et al. im Jahr 2006 über laparoskopische Resektionen des Leberkaudatatlappens wurden zahlreiche Fälle dokumentiert, in denen isolierte Resektionen des Schwanzlappens und segmentale Resektionen durchgeführt wurden 2,3,4,5,6,7. Die technische Komplexität der laparoskopischen Caudat-Lobektomie unterliegt jedoch einer Vielzahl von Faktoren. Dazu gehören die strikte Einhaltung der chirurgischen Indikationen, die umfassende präoperative Beurteilung der bildgebenden Daten, die Beherrschung laparoskopischer Operationstechniken, die genaue Kenntnis der lokalen Anatomie des Schwanzlappens und die umsichtige Auswahl der Operationsansätze. Gegenwärtig gibt es vier vorherrschende Zugänge für die Resektion des Schwanzlappens: den linksseitigen Zugang, den rechtsseitigen Zugang, den kombinierten Links-Rechts-Zugang und den vorderen Zugang. Der linksseitige Zugang wird typischerweise bei der Resektion des Spiegellappens eingesetzt oder wenn eine kombinierte Resektion des linken lateralen Segments oder der linken Hemileber erforderlich ist. Umgekehrt wird der rechtsseitige Zugang für die Resektion des Processus caudatus oder in Fällen, in denen eine Resektion der rechten Hemileber erforderlich ist, bevorzugt. In Fällen, in denen der Tumor unverhältnismäßig groß ist oder den Schwanzlappen großflächig infiltriert, wodurch die Exposition über den Links- oder Rechtszugang erschwert wird, kann ein kombinierter Links-Rechts-Zugang unumgänglich werden. Für die Resektion von Tumoren in der Nähe der unteren Hohlvene wird im Allgemeinen der anteriore Zugang bevorzugt, da er eine optimale Freilegung und Visualisierung ermöglicht.
Das paracavale Segment, ein wichtiger Teil des Schwanzlappens, ist weithin als Couinaud-Segment IX bekannt. Es ist strategisch hinter Segment IV positioniert, das im Wesentlichen das Epizentrum der Leberanatomie ist. Seine dorsale Oberfläche steht in engem Kontakt mit der unteren Hohlvene, während seine untere Grenze eng mit der ersten Leberpforte ausgerichtet ist. Das kopfale Ende dieses Segments grenzt an die Ursprünge der Vena middle und right hepatica und steht in direkter Apposition zum Hauptstamm der Vena bretica media. Aufgrund seiner verborgenen Lage und seiner Nähe zu den wichtigsten Gefäßstrukturen der Leber sind chirurgische Eingriffe in diesem Bereich von Natur aus riskant und technisch anspruchsvoll. In der Vergangenheit wurden bei chirurgischen Eingriffen, die auf das paracavale Segment des Schwanzlappens abzielen, überwiegend laparoskopische anteriore oder rechtsseitige Zugänge verwendet 8,9,10. Es gibt einen Mangel an Literatur über linksseitige Zugänge, wahrscheinlich aufgrund der tiefgreifenden Tiefe dieser Region und des eingeschränkten Sichtfeldes von links, das durch die komplizierte Gefäßarchitektur in der Umgebung noch verstärkt wird. Solche Komplexitäten erfordern vom operierenden Chirurgen ein tiefes Verständnis der Anatomie und eine Fülle von chirurgischem Fachwissen. Fortschritte in der dreidimensionalen (3D) Visualisierungsrekonstruktionstechnologie haben die Erstellung präziser und lebendiger dreidimensionaler Lebermodelle ermöglicht11. Diese Modelle bieten eine klare Darstellung der Leber, des Tumors, des hepatischen Gefäßsystems und der räumlichen Beziehungen zwischen der Leber und benachbarten Organen. Diese Technologie trägt maßgeblich dazu bei, ein umfassendes präoperatives Verständnis der spezifischen Bedingungen der Leber, der genauen Lage des Tumors und des komplizierten Zusammenspiels der Blutgefäße zu ermöglichen.
In dieser Arbeit stellen wir eine innovative Operationsstrategie vor: die Nutzung präoperativer dreidimensionaler Assessments und die Verwendung eines laparoskopischen linksseitigen Zugangs zur Exzision von Tumoren im paracavalen Bereich. Dieser Ansatz zielt darauf ab, die chirurgische Präzision und Sicherheit zu verbessern, indem er sich die detaillierten anatomischen Erkenntnisse moderner bildgebender Verfahren zunutze macht.
Eine 30-jährige Patientin wurde mit dem zufälligen Befund einer raumgreifenden Läsion in der Leber in das Krankenhaus von Zhujiang eingeliefert, die vor über einem Monat entdeckt worden war. Untersuchungen der erweiterten Computertomographie (CT) zeigten eine Masse mit einem Schatten geringer Dichte, die etwa 37 mm x 34 mm misst. Vorläufige Diagnosen waren die fokale noduläre Hyperplasie oder das hepatische Adenom, die einer weiteren Differenzierung bedürfen (Abbildung 1). Die präoperative dreidimensionale Visualisierungsrekonstruktion ist in Abbildung 2 dargestellt. Das vollständige Blutbild, das Gerinnungsprofil und die Leberfunktionstests des Patienten lagen alle innerhalb der normalen Grenzen. Sie hatte keine signifikante Krankengeschichte, und präoperative Untersuchungen bestätigten keine Kontraindikationen für eine Operation. Angesichts des potenziellen Malignitätsrisikos, das mit Leberadenomen verbunden ist, führten die Chirurgen detaillierte Gespräche mit der Patientin und ihren Angehörigen und stellten sicher, dass sie umfassend informiert waren. Nach einem gründlichen Verständnis der chirurgischen Risiken und der möglichen therapeutischen Ergebnisse trafen die Patientin und ihre Familie eine informierte Entscheidung, mit der chirurgischen Behandlung fortzufahren. Sie haben ihre Einwilligung gegeben, indem sie die chirurgische Einwilligungserklärung unterschrieben haben und damit ihr klares Verständnis des Verfahrens und ihr Engagement für die Gesundheit und das Wohlbefinden des Patienten unter Beweis stellen.
Protokoll
Der chirurgische Eingriff wurde von der Ethikkommission des Zhujiang Hospital der Southern Medical University genehmigt. Darüber hinaus gaben die Patientin und ihre Familie eine Einverständniserklärung für die öffentliche Weitergabe von Informationen und Daten, die für den Behandlungsprozess relevant sind. Dies sorgt für Transparenz und respektiert die Autonomie des Patienten im medizinischen Entscheidungsprozess.
1. Präoperative Vorbereitung
- Lassen Sie den Patienten 8 Stunden fasten und verzichten Sie 4 Stunden vor der Operation auf Alkoholkonsum.
- Vollnarkose durchführen und endotracheale Intubation durchführen12.
HINWEIS: Bewerten Sie die Wirksamkeit der Anästhesie, indem Sie den Zustand des Patienten sowohl nach der Anästhesie als auch intraoperativ beurteilen. Zu den wichtigsten Indikatoren gehören das Erreichen eines vollständigen Empfindungsblocks, das Fehlen zusätzlicher Medikamente während des Eingriffs und die Aufrechterhaltung stabiler Vitalparameter während der gesamten Operation. - Desinfizieren Sie den Operationsbereich, von den Brustwarzen bis zur Schambeinsymphyse und dem oberen Drittel der Oberschenkel, dreimal mit Jodtinktur, die sich bis zur mittleren Achsellinie erstreckt.
2. Operationstechnik
- Platzieren Sie den Patienten in Rückenlage mit gespreizten Beinen, erhobenem Kopf und einer Neigung von 15° nach rechts.
- Legen Sie ein Pneumoperitoneum mit einer Veress-Nadelan 13. Stellen Sie den Pneumoperitoneumdruck auf 12-14 mmHg (1 mmHg = 0,133 kPa) ein.
- Machen Sie einen 1 cm langen Schnitt mit einer chirurgischen Skalpellklinge Nr. 10 am Nabelrand für eine Beobachtungsöffnung, in die ein 10-mm-Trokar eingeführt wird (siehe Materialtabelle).
- Die Trokare mit einem Durchmesser von 5 mm und 10 mm werden an den folgenden anatomischen Orientierungspunkten eingesetzt: 2 cm unterhalb des Rippenrandes entlang der rechten vorderen Achsellinie, 8 cm unterhalb des Rippenrandes entlang der rechten Mittelklavikularlinie und 2 cm bzw. 6 cm unterhalb des Rippenrandes entlang der linken Mittelklavikularlinie (Abbildung 3).
- Führen Sie die erste laparoskopische Beurteilung durch, um die Machbarkeit eines linksseitigen Ansatzes zur Resektion des Schwanzlappens zu bestimmen. Beobachten Sie den Grad der intraperitonealen Adhäsion des Omentums, die Oberflächenbeschaffenheit der Leber und die Position der linken und rechten Dreiecksbänder und Falcate-Bänder.
- Verwenden Sie das Ultraschallskalpell (siehe Materialtabelle), um das falciforme Band zu durchtrennen und das Gallenblasendreieck freizulegen. Anschließend wird der Ductus cysticus ligiert und die Gallenblase präpariert.
- Verwenden Sie das Ultraschallskalpell, um das Foramen minor omentalis zu reinigen, legen Sie das hepatische Hilum frei und ermöglichen Sie die Etablierung eines hepatischen hilären Okklusionstapes.
- Drehen Sie den rechten Leberlappen um, um die untere Hohlvene freizulegen, und ligieren und transektieren Sie die kurzen Lebervenen mit 3-0 Hem-o-lok (siehe Materialtabelle) (Abbildung 4).
- Legen Sie den Spiegelbereich des Schwanzlappens frei, gefolgt von einem hepatischen hilären Verschluss, und durchschneiden Sie dann das Leberparenchym entlang der Kerbe des Schwanzlappens mit dem Ultraschallskalpell (Abbildung 5).
- Verwenden Sie das Ultraschallskalpell und die Operationszange, um das Leberparenchym zu resezieren und den Tumor neben der unteren Hohlvene freizulegen (Abbildung 6 und Abbildung 7).
- Präparieren Sie den Tumor vorsichtig, verwenden Sie ein Ultraschallskalpell mit Gefriergetriebe, um kleine Venen zu koagulieren, und legen Sie die mittlere Lebervene frei (Abbildung 8).
- Die Pfortader wird mit 3-0 Hem-o-lok zum rechten Schwanzlappen freigelegt und ligiert, gefolgt von einer Tumormobilisierung (Abbildung 9, Abbildung 10 und Abbildung 11).
- Verwenden Sie die bipolare Elektrokoagulation für die Blutstillung und Probenentnahme. Verwenden Sie 800 ml 0,9%ige NaCl-Lösung, um die Bauchhöhle zu spülen (Abbildung 12) und schließen Sie mit dem Drainageschlauch, der in der Bauchhöhle platziert wird (siehe Materialtabelle).
- Verschließen Sie die Wunde Schicht für Schicht mit nicht resorbierbarem Nahtmaterial (siehe Materialtabelle).
3. Postoperative Pflege und Überwachung
- Führen Sie innerhalb der ersten 24 Stunden nach der Operation eine Herzüberwachung durch (siehe Materialtabelle) und führen Sie eine kontinuierliche Low-Flow-Sauerstofftherapie mit 3 l/min durch, wobei die Vitalparameter genau überwacht werden.
- Geben Sie dem Patienten am ersten postoperativen Tag eine halbfeste Kost und weisen Sie ihn an, Dreh- und Bettübungen durchzuführen.
HINWEIS: Die postoperative Behandlung umfasst hepatoprotektive, antiinfektive, antihämorrhagische, analgetische, Albumin- und gastroprotektive Behandlungen. - Überwachen Sie die Drainageschläuche auf Farbe, Volumen und Veränderungen des Bilirubinspiegels. Entfernen Sie den Drainageschlauch, sobald sich der Bilirubinspiegel wieder normalisiert hat und die Drainage weniger als 50 ml beträgt.
Ergebnisse
Die Operation (Video 1) dauerte 372 Minuten mit einem Blutverlust von 300 ml, und es war keine Bluttransfusion erforderlich. Es gab fünf Fälle von hepatischen Portalverschlüssen mit einer Gesamtdauer von 70 Minuten. Der Patient hatte keine postoperativen Komplikationen und erholte sich reibungslos und blieb 8 Tage nach der Operation im Krankenhaus. Die pathologische Untersuchung ergab eine fokale noduläre Hyperplasie (FNH) der Leber. Der Bilirubinspiegel in der Drainageflüssigkeit sank von 30,1 μmol/l am dritten postoperativen Tag auf 21,4 μmol/l am fünften postoperativen Tag (siehe Tabelle 1), wobei der Drainageschlauch am sechsten postoperativen Tag entfernt wurde. Postoperative Bildgebung und pathologische Bilder sind in Abbildung 13 dargestellt.
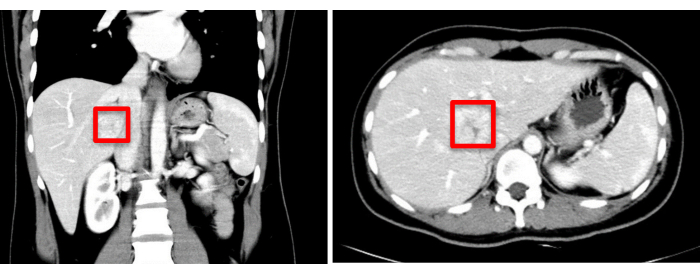
Abbildung 1: Die präoperative bildgebende Beurteilung (CT) zeigt die Tumorlokalisation, die mit einem roten Quadrat markiert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
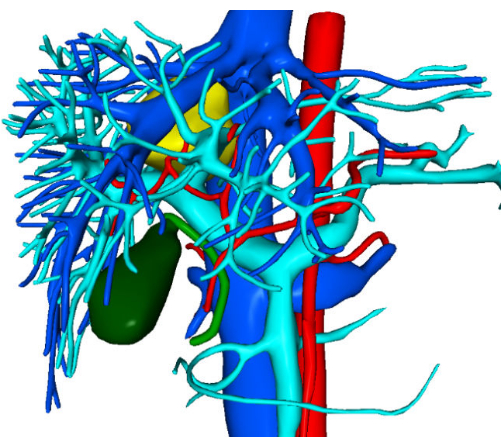
Abbildung 2: Präoperative dreidimensionale Visualisierungsrekonstruktionsbilder. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Karte der Trokarenverteilung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Die untere Hohlvene, die aus dem rechten Leberraum freigelegt wurde, und die größeren kurzen Lebervenen, die mit Hem-o-lok-Clips ligiert und durchtrennt wurden. Der rote Kreis auf dem dreidimensionalen Rekonstruktionsbild zeigt die entsprechenden Positionen an. Abkürzung: SHV: kurze Lebervene. IVC: untere Hohlvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
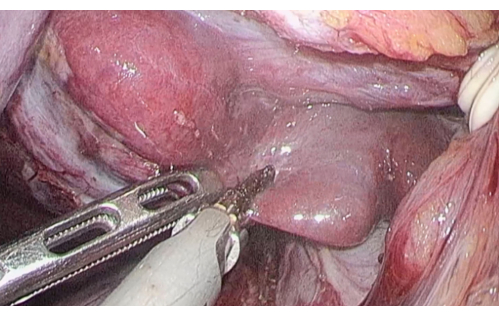
Abbildung 5: Das Leberparenchym wurde mit einem Ultraschallskalpell entlang des Processus caudatus durchtrennt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
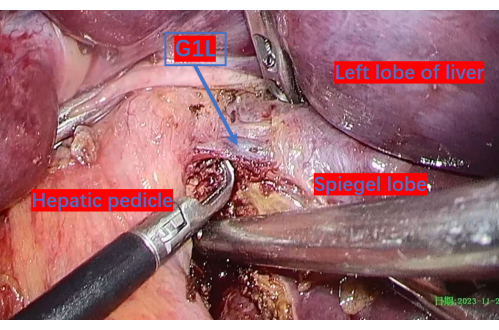
Abbildung 6: Die Pfortader, die bis zum ersten Ast des linken Schwanzlappens (G1L) freigelegt wurde. G1L ist der erste Ast der Pfortader zum linken Schwanzlappen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Sorgfältig freigelegter Tumor, der einen klaren Blick auf seine Lage bietet und nachfolgende chirurgische Eingriffe erleichtert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Vorsichtig freigelegte mittlere Lebervene. Der rote Kreis zeigt die entsprechende Position auf dem 3D-Rekonstruktionsbild an. Abkürzungen: MHV: mittlere Lebervene, IVC: untere Hohlvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
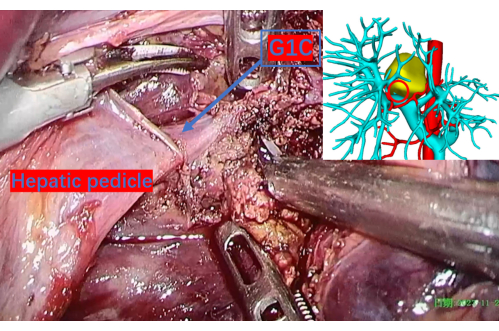
Abbildung 9: Sorgfältig durchtrenntes Leberparenchym, das die Pfortader bis zum ersten Ast des rechten Schwanzlappens freilegt, der als G1C bezeichnet wird. Ein roter Kreis auf dem 3D-Rekonstruktionsbild entspricht dieser Position und bietet einen genauen Referenzpunkt. G1C ist der erste Ast der Pfortader zum rechten Schwanzlappen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 10: Das Glisson-System, das für die Blutversorgung des Tumors verantwortlich ist. Dieses System wurde freigelegt, geklemmt und durchtrennt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
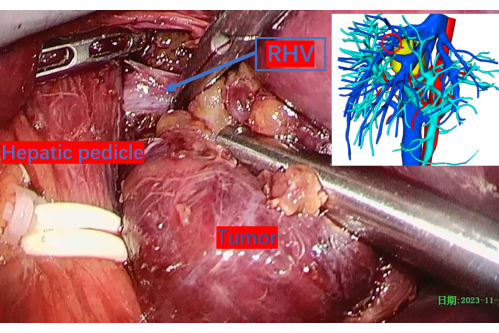
Abbildung 11: Freigelegter Hauptstamm der rechten Lebervene während der Tumordissektion. Der rote Kreis markiert seine Position auf dem 3D-Rekonstruktionsbild. Abkürzungen: RHV: rechte Lebervene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 12: Gründlich gespültes und gereinigtes Operationsfeld nach der Blutstillung. Abkürzungen: MHV: mittlere Lebervene. RHV: rechte Lebervene. IVC: untere Hohlvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
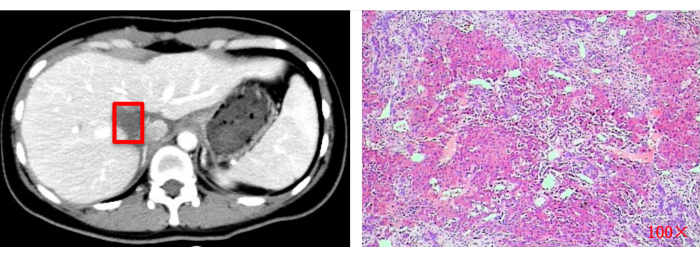
Abbildung 13: Postoperative bildgebende Beurteilung (CT) und histopathologische Untersuchung (100x). Rote Quadrate zeigen die ursprüngliche Tumorresektionsstelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Artikel | Befund |
| Betriebszeit (min) | 372 |
| Intraoperatives Blutungsvolumen (ml) | 300 |
| Bluttransfusionsvolumen (ml) | 0 |
| Anzahl der hepatischen Portalverschlüsse | 5 |
| Zeit des hepatischen Portalverschlusses | 70 |
| Postoperative Komplikation | Nichts |
| Postoperativer Krankenhausaufenthalt (Tag) | 8 |
| Lassen Sie den Bilirubinspiegel auf POD3 (U/L) ab | 30.1 |
| Lassen Sie den Bilirubinspiegel auf POD5 (U/L) ab | 21.4 |
Tabelle 1: Relevante Endpunkte des Patienten. Abkürzungen: POD = postoperativer Tag.
Video 1: Laparoskopische Resektion des Schwanzlappens mit linksem Zugang (Operationstechnik). Abkürzungen und Definitionen: SHV: kurze Lebervene. G1L: der erste Ast der Pfortader zum linken Schwanzlappen. MHV: mittlere Lebervene. G1C: der erste Ast der Pfortader zum rechten Schwanzlappen. RHV: rechte Lebervene. IVC: untere Hohlvene. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Die Leber ist ein wichtiges Organ, das am Stoffwechsel, der Immunfunktion und der Entgiftung beteiligt ist14. Hepatozyten, die primären Zellen der Leber, sind in der Regel stabil, können aber instabil werden, wenn sie ausgelöst werden, wodurch die Regeneration des Lebergewebes eingeleitet wird. Nach einer Leberresektion kann ein unzureichendes Restlebervolumen zu schweren postoperativen Komplikationen wie akutem Leberversagen führen. Daher ist eine strenge Bewertung der Leberfunktion nach der Hepatektomie von größter Bedeutung15,16. Untersuchungen zeigen, dass der Schwanzlappen in einem typischen menschlichen Körper etwa 2 % bis 3 % des Lebervolumens ausmacht17. Aufgrund der präoperativen Beurteilung der Leberfunktionsreserven führt die Resektion des Schwanzlappens allein in der Regel nicht zu einer signifikanten Verringerung des verbleibenden Lebervolumens, wodurch das Risiko postoperativer Komplikationen wie akutes Leberversagen gemindert wird.
Die Studie18 von Kumon et al. klärt die vaskuläre Anatomie des Schwanzlappens der Leber auf und identifiziert zwei primäre Leberstiele: den linken und den rechten. Der linke Stiel ist konsistenter positioniert und tritt etwa im mittleren bis unteren Drittel des Spiegellappens in den Schwanzlappen ein. Umgekehrt ist der rechte Stiel variabler und erstreckt sich möglicherweise bis in die Bereiche des processus paracaval oder caudatus und kann sogar fehlen. Die portalvenösen Äste im Schwanzlappen weisen eine Komplexität auf, die sich oft entweder als unabhängige Äste oder als gemeinsamer Stamm manifestiert. Die Pfortader des Spiegellappens ist stabiler und entspringt überwiegend einem robusten dorsalen Ast (G1L) der linken Pfortader. Im Gegensatz dazu stammen die Pfortadern, die den rechten Caudatfortsatz und die paracavale Region versorgen, hauptsächlich aus Ästen der rechten Hauptpfortader, die als erster Ast zum rechten Caudatlappen (G1C) bezeichnet wird19. Die20 Beschreibungen von Cho et al. beschreiben die Arterien des Schwanzlappens in drei Haupttypen: unabhängige Äste, gemeinsame Stämme und solche, die aus hepatischen arteriellen Anastomosen hervorgehen. Die Gallendrainage im Schwanzlappen umfasst typischerweise zwei Hauptgänge, wobei 2 bis 3 Äste im Spiegellappen in den linken Lebergang übergehen. Die parakavale Region weist im Allgemeinen 2 bis 3 Gänge auf, die in den rechten hinteren Ductus sectoralis übergehen, mit einem signifikanten Vorkommen von interduktalen Anastomosen18. Der venöse Abfluss aus dem Schwanzlappen erfolgt hauptsächlich durch die kurzen Lebervenen in die Vena cava inferior. Die Vena des Fortsatzes caudatus verläuft zwischen dem Processus caudatus und dem rechten hinteren Lappen, entwässert hauptsächlich den Processus caudatus und verbindet sich mit dem unteren rechten Rand der Vena cava posterior inferior, wodurch die Grenze zwischen diesen Regionen markiert wird. Die Lebervene des Schwanzlappens verläuft zwischen dem Spiegellappen und dem paracavalen Bereich und tritt schließlich in den mittleren linken Rand der Vena cava posterior inferior ein und dient als anatomische Abgrenzung zwischen dem Spiegellappen und der paracavalen Region. Wir haben die Schlüsselgefäße und ihre Äste, einschließlich der kurzen Lebervenen G1L, G1C und des Leberstiels, der den Tumor speist, sorgfältig geklemmt und durchtrennt. Diese Präzision gewährleistet die Sicherheit und Wirksamkeit der chirurgischen Eingriffe.
Die charakteristische Anatomie des Schwanzlappens, die tief in der Leber eingebettet ist und an wichtige Gefäße angrenzt, einschließlich der unteren Hohlvene, der mittleren Lebervene und der rechten Lebervene, stellt eine chirurgische Herausforderung dar. Die Umhüllung durch die Leberhila erhöht das Risiko einer Blutung, was die Resektion technisch anspruchsvoll macht. Frühere Forschungen21 deuteten darauf hin, dass eine erweiterte linke Hepatektomie in Verbindung mit einer Resektion des Schwanzlappens bei Malignomen im Schwanzlappen in der Nähe der Lebervenen vorzuziehen ist. Fortschritte in unserem Verständnis dieser Tumoren haben jedoch zu einer zunehmenden Einführung von einfachen Resektionen des Schwanzlappens und Teilresektionen geführt. Diese Ansätze ermöglichen die radikale Entfernung von Tumoren bei gleichzeitiger Erhaltung der Leberfunktion22. Sowohl bei primären als auch bei sekundären hepatischen Malignomen im Schwanzlappen ist eine Operation indiziert, wenn dies technisch machbar ist. Gutartige Tumoren des Schwanzlappens, wie z. B. kavernöse Hämangiome, fokale noduläre Hyperplasie (FNH), intrahepatische Gallengangssteine und hepatische Adenome, sind ebenfalls für eine vollständige oder teilweise Resektion geeignet und bieten effektive Behandlungsmöglichkeiten.
Die laparoskopische Leberresektion hat sich zu einer vorherrschenden Technik in der hepatobiliären Chirurgie entwickelt 23,24,25. Der Tunnelblick und die Vergrößerungsmöglichkeiten des Verfahrens bieten deutliche Vorteile für die Exzision des Schwanzlappens. Innerhalb dieses visuellen Rahmens wird die Dissektion um die Vena cava inferior auch auf engstem Raum erleichtert und die Visualisierung feinerer kurzer Lebervenen verbessert. Die Technik ist jedoch nicht ohne Herausforderungen, wie z. B. das Fehlen von haptischem Feedback, begrenzte Retraktionsmöglichkeiten und die Einschränkungen der Präparierebenen. Um diese zu überwinden, bedarf es eines Chirurgen mit großer Expertise, insbesondere bei Teilresektionen des Schwanzlappens. Zu den gängigen Ansätzen für die Resektion des Schwanzlappens gehören der linke, rechte, kombinierte Links-Rechts- und der anteriore Zugang. Der linke Zugang wird typischerweise für die Resektion des Spiegellappens oder in Verbindung mit der Resektion des linken lateralen Segments oder linken Hemilivers verwendet. Der richtige Ansatz ist indiziert für die Resektion des Processus caudatus oder für Fälle, in denen eine Resektion der rechten Hemiliver in Betracht gezogen wird. In Fällen, in denen ein Tumor großflächig ist oder den gesamten Schwanzlappen umfasst, was eine schwierige Exposition erfordert, kann ein kombinierter Links-Rechts-Ansatz angewendet werden. Der anteriore Zugang wird häufig für die Resektion der paracavalen Region verwendet, bei der normales Lebergewebe geteilt wird. Diese Methode kann zu einer größeren Oberfläche von Lebertraumata führen, was das Risiko von Gallengangs- und Gefäßverletzungen erhöht und die Wahrscheinlichkeit von postoperativen Blutungen und Gallenleckagen erhöht.
Traditionell wurden parakavale Tumoren mit laparoskopischen anterioren oder rechtsseitigen Zugängen behandelt, wobei es nur wenige Literatur zu linksseitigen Eingriffen gab 8,9,10. Feng et al. führten in ihrem veröffentlichten Fallbericht26 erfolgreich offene linksseitige Zugangsresektionen an zwei Fällen von gutartigen Hämangiomen im Schwanzlappen durch. Diese Studie konzentrierte sich auf die En-bloc-Resektion des Schwanzlappens und nicht auf die segmentale Resektion der drei Teile des Schwanzlappens. Bei gutartigen Läsionen reduzierte diese Methode die unnötige Leberparenchymresektion nicht effektiver, wodurch das Risiko eines Gallenlecks verringert wurde. Angesichts der komplexen Gefäßstruktur des Schwanzlappens kann die laparoskopische Chirurgie derzeit die feinstofflichen Gefäßstrukturen besser darstellen und dadurch das Blutungsrisiko verringern. Darüber hinaus führten Zheng et al. eine Studie durch, in der sie erstmals die "Huaxi-Dissektionsmethode" vorstellten27. Sie nutzten einen laparoskopischen linksseitigen Ansatz, um komplexe Tumoren im Schwanzlappen erfolgreich zu resezieren. Während der Operation wendeten sie eine Dissektions- und Schichtungsmethode gegen den Uhrzeigersinn an, die in einer festen Abfolge von einfach zu komplex überging. Dieser Ansatz vereinfacht den chirurgischen Prozess anhand der Lernkurve, was dem Lernen und Beherrschen der Wissenschaftler förderlicher ist und die Machbarkeit des linksseitigen Ansatzes für die Resektion des Schwanzlappens weiter bestätigt.
Dieser Mangel an linksseitigen Fällen kann auf die tiefsitzende Natur der parakavalen Tumoren zurückgeführt werden, die aufgrund der komplizierten umgebenden Gefäßanatomie Schwierigkeiten bei der vollständigen Freilegung aus der linksseitigen Sicht aufwirft. Mit Hilfe der präoperativen Bildgebung führten wir jedoch eine Differentialdiagnose der fokalen nodulären Hyperplasie und der hepatischen Adenome bei parakavalen Tumoren durch, um die Bedenken hinsichtlich der Angemessenheit des Tumorrandes zu mildern. Im Gegensatz zur "Huaxi-Dissektionsmethode" wird in unserem Zentrum eine laparoskopische linksseitige Resektionstechnik speziell für Tumore eingesetzt, die an die Kavalvene im Schwanzlappen angrenzen. Präoperativ verwenden wir die 3D-Rekonstruktion zur Beurteilung, um die chirurgische Sicherheit zu gewährleisten. Darüber hinaus vermeidet die hier beschriebene Operationsmethode eine Freilegung der linken Lebervene, wodurch das Risiko von Rissen und Blutungen aus der linken Lebervene verringert wird. Diese Methode minimiert auch unnötige Schäden am Leberparenchym und verringert so die Wahrscheinlichkeit eines postoperativen Gallenlecks. Mit diesen verfeinerten Operationsstrategien wollen wir eine sicherere und effektivere Resektion von Tumoren des Schwanzlappens erreichen. Diese Technik vermeidet die Notwendigkeit, Lebergewebe zu teilen, wie beim vorderen Zugang. Er bietet Vorteile wie ein größeres Operationsfeld und eine kürzere Operationsdauer im Vergleich zum rechtsseitigen Zugang. Darüber hinaus minimierte der Einsatz präoperativer dreidimensionaler Rekonstruktionstechnologie das Risiko einer schweren Gefäßverletzung erheblich und verbesserte die Durchführbarkeit einer Tumorresektion. Die Operation wurde in 372 Minuten mit einem Blutverlust von nur 300 ml effizient abgeschlossen. Der Patient verlief unkompliziert postoperativ, wurde am achten postoperativen Tag reibungslos entlassen und erholte sich schnell.
Wir müssen uns darüber im Klaren sein, dass die Notwendigkeit der Resektion gutartiger Tumoren von ihrem Potenzial für maligne Degeneration und dem Vorhandensein von Kompressionssymptomen aufgrund der großen Tumorgröße abhängt, die für die Bestimmung der chirurgischen Indikationen entscheidend sind. Bei bösartigen Tumoren sind die Angemessenheit eines linksseitigen Operationsansatzes und die Sicherstellung einer adäquaten Exposition und ausreichender Resektionsränder Fragen, die weitere Untersuchungen erfordern. Nichtsdestotrotz sind wir aufgrund unserer Forschung und klinischen Erfahrung zu dem Schluss gekommen, dass der laparoskopische linksseitige Zugang zur Resektion gutartiger parakavaler Tumoren durchaus praktikabel ist, insbesondere mit einem soliden Verständnis von anatomischem Wissen und umfangreicher chirurgischer Expertise. Diese Operationstechnik bietet den Patienten nicht nur eine minimalinvasive Behandlungsoption, sondern gewährleistet auch die Sicherheit der Tumorentfernung bei gleichzeitiger Minimierung des chirurgischen Traumas und der Verkürzung der postoperativen Erholungsphasen.
Offenlegungen
Die Autoren haben keine Konflikte oder finanziellen Bindungen offenzulegen.
Danksagungen
Diese Studie wurde unterstützt von der Guangdong Basic and Applied Basic Research Foundation of China (2021B1515230011), Science and Technology Projects in Guangzhou of China (2023B03J1247) und dem Key-Area Research and Development Program der Provinz Guangdong (2023B1111020008).
Materialien
| Name | Company | Catalog Number | Comments |
| Absorbable hemostat | Ethicon, LLC | W1913T | |
| Disposable spiral negative pressure drainage pipeline | Jiangsu Aiyuan Medical Technology Corp | 424280 | Drainage of abdominal residual fluid |
| Disposable trocar | Kangji Medica | 10004, 10006 | |
| Electrocardiographic monitor | Philips Goldway (SHENZHEN) Industrial, Inc | UT4000B | Postoperative ECG monitoring |
| Laparoscopic system | Olympus | WM-NP2 | |
| Non-absorbable polymer ligation clips (Hem-o-lok) | Teleflex Medical | 544230 | |
| Ultrasound scalpel | Johnson | GEN11 | Tools for liver resection |
| Vicryl rapide | Ethicon, LLC | 3-0, VCP345H 90010 | Suture incision and Trocar hole |
| Video system | Lenovo | GK309 |
Referenzen
- Kumon, M., Kumon, T., Sakamoto, Y. Demonstration of the right-side boundary of the caudate lobe in a liver cast. Glob Health Med. 4 (1), 52-56 (2022).
- Chen, K. H., Jeng, K. S., Huang, S. H., Chu, S. H. Laparoscopic caudate hepatectomy for cancer--an innovative approach to the no-man's land. J Gastrointest Surg. 17 (3), 522-526 (2013).
- Chen, L., et al. Laparoscopic extended right hepatectomy for posterior and completely caudate massive liver tumor (with videos). Hepatobiliary Pancreat Dis Int. 22 (3), 326-330 (2023).
- Dulucq, J. L., Wintringer, P., Stabilini, C., Mahajna, A. Isolated laparoscopic resection of the hepatic caudate lobe: Surgical technique and a report of 2 cases. Surg Laparosc Endosc Percutan Tech. 16 (1), 32-35 (2006).
- Huang, J., Xu, D., Li, X. Laparoscopic resection of the spiegel lobe using a modified caudate lobe-first approach. Asian J Surg. 46 (11), 5351-5352 (2023).
- Parikh, M., Han, H. -. S., Cho, J. Y., D'silva, M. Laparoscopic isolated caudate lobe resection. Scientific Reports. 11 (1), 4328 (2021).
- Xu, J., Wang, J., Liu, Z. 3d-laparoscopic total caudate lobectomy for liver metastases from colorectal cancer: A video article. Asian J Surg. 46 (10), 4525-4526 (2023).
- Wang, Z. G., et al. Anterior hepatic parenchymal transection for complete caudate lobectomy to treat liver cancer situated in or involving the paracaval portion of the caudate lobe. J Gastrointest Surg. 19 (5), 880-886 (2015).
- Xu, G., et al. Laparoscopic caudate lobectomy: A multicenter, propensity score-matched report of safety, feasibility, and early outcomes. Surg Endosc. 35 (3), 1138-1147 (2021).
- Yamamoto, J., et al. Anterior transhepatic approach for isolated resection of the caudate lobe of the liver. World J Surg. 23 (1), 97-101 (1999).
- Nanashima, A., et al. Three-dimensional fusion images of hepatic vasculature and bile duct used for preoperative simulation before hepatic surgery. Hepatogastroenterology. 59 (118), 1748-1757 (2012).
- Costi, R., et al. Partial splenectomy: Who, when and how. A systematic review of the 2130 published cases. J Pediatr Surg. 54 (8), 1527-1538 (2019).
- Liao, K., et al. Laparoscopic anatomical versus non-anatomical hepatectomy in the treatment of hepatocellular carcinoma: A randomised controlled trial. Int J Surg. 102, 106652 (2022).
- Trefts, E., Gannon, M., Wasserman, D. H. The liver. Curr Biol. 27 (21), R1147-R1151 (2017).
- Black, D. M., Behrns, K. E. A scientist revisits the atrophy-hypertrophy complex: Hepatic apoptosis and regeneration. Surg Oncol Clin N Am. 11 (4), 849-864 (2002).
- Michalopoulos, G. K., Bhushan, B. Liver regeneration: Biological and pathological mechanisms and implications. Nat Rev Gastroenterol Hepatol. 18 (1), 40-55 (2021).
- Zhou, X. P., Lu, T., Wei, Y. G., Chen, X. Z. Liver volume variation in patients with virus-induced cirrhosis: Findings on MDCT. AJR Am J Roentgenol. 189 (3), W153-W159 (2007).
- Kumon, M. Anatomical study of the caudate lobe with special reference to portal venous and biliary branches using corrosion liver casts and clinical application. Liver Cancer. 6 (2), 161-170 (2017).
- Kumon, M., et al. Definition of the caudate lobe of the liver based on portal segmentation. Glob Health Med. 2 (5), 328-336 (2020).
- Cho, A., et al. Relationship between right portal and biliary systems based on reclassification of the liver. Am J Surg. 193 (1), 1-4 (2007).
- Li, H., Wei, Y. Laparoscopic extended left hemi-hepatectomy plus caudate lobectomy for caudate lobe hepatocellular carcinoma. J Gastrointest Surg. 23 (3), 617 (2019).
- Fernandes, E. S. M., et al. Anterior transhepatic approach for total caudate lobectomy including spigelian lobe, paracaval portion and caudate process: A brazilian experience. Hepatobiliary Pancreat Dis Int. 17 (4), 371-373 (2018).
- Li, H. J., et al. Laparoscopic versus open hepatectomy for intrahepatic cholangiocarcinoma: Systematic review and meta-analysis of propensity score-matched studies. Eur J Surg Oncol. 49 (4), 700-708 (2023).
- Yang, S. Y., et al. Perioperative and long-term survival outcomes of laparoscopic versus laparotomic hepatectomy for BCLC stages 0-a hepatocellular carcinoma patients associated with or without microvascular invasion: A multicenter, propensity score matching analysis. Hepatol Int. 16 (4), 892-905 (2022).
- Zhang, X. P., et al. Short-term and long-term outcomes after robotic versus open hepatectomy in patients with large hepatocellular carcinoma: A multicenter study. Int J Surg. 110 (2), 660-667 (2024).
- Feng, X., et al. A left-sided approach for resection of hepatic caudate lobe hemangioma: Two case reports and a literature review. Int Surg. 100 (6), 1054-1059 (2015).
- Zheng, K., et al. A laparoscopic left-sided approach combined with the counterclockwise dissection method (huaxi dissection method) for complex tumors located in caudate lobe: A pilot study. J Gastrointest Surg. 28 (5), 754-756 (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten