Method Article
Demistificazione dell'ecografia in eccesso venoso (VExUS): acquisizione e interpretazione delle immagini
In questo articolo
Riepilogo
L'ecografia point-of-care (POCUS) viene spesso utilizzata per valutare il circuito emodinamico e rilevare la presenza di congestione venosa. Il sistema di punteggio Venous Excess Ultrasound (VExUS) è stato sviluppato per aiutare i medici a prevedere l'impatto della congestione venosa sulla disfunzione d'organo. Questo articolo ha lo scopo di descrivere l'acquisizione e l'interpretazione delle immagini VExUS.
Abstract
Gli operatori di molte specialità mediche devono valutare accuratamente il circuito emodinamico per fornire un'assistenza adeguata al paziente. La congestione venosa è sempre più implicata in una serie di complicanze multiorgano. Tuttavia, la valutazione emodinamica rimane impegnativa a causa della complessa fisiologia coinvolta e dell'accuratezza diagnostica incoerente degli strumenti convenzionali al letto del paziente e delle manovre dell'esame fisico. Sebbene il cateterismo cardiaco destro sia considerato il gold standard per la misurazione della pressione venosa sistemica, è invasivo e non facilmente ripetibile e, pertanto, rimane la necessità di alternative non invasive. Anche gli esami ecografici point-of-care della vena giugulare interna o della vena cava inferiore presentano limitazioni significative in termini di accuratezza della valutazione del volume intravascolare e di correlazione con la pressione venosa centrale. Per migliorare l'accuratezza dei medici al letto del paziente nella valutazione della congestione venosa, è stato sviluppato e convalidato un protocollo che utilizza i segnali Doppler a onde pulsate (PW) delle vene del fegato e dei reni per classificare il grado di congestione venosa presente nei pazienti. Sebbene questo sistema di punteggio, chiamato ecografia in eccesso venoso (VExUS), sia sempre più adottato in alcune sottospecialità della medicina, come la nefrologia e la terapia intensiva, rimane sottoutilizzato nella medicina nel suo complesso. Ciò è probabilmente dovuto, almeno in parte, alle lacune di conoscenza e alla mancanza di formazione in questa modalità emergente. Per colmare questa lacuna educativa, questo articolo descriverà l'acquisizione e l'interpretazione delle immagini VExUS.
Introduzione
La valutazione del circuito emodinamico al letto del paziente è fondamentale per la cura quotidiana dei pazienti acuti. Gli effetti deleteri del sovraccarico di liquidi sono sempre più riconosciuti anche al di fuori di sindromi cliniche più evidenti come l'insufficienza cardiaca, e ora ci sono diversi studi che dimostrano che un bilancio positivo dei liquidi è associato a un aumento della mortalità. C'è un numero crescente di prove che dimostrano che anche bassi livelli di congestione venosa sono associati a disfunzione d'organo2. Allo stesso modo, la decongestione tempestiva è associata a risultati migliori3. Questo circuito dinamico multiorgano coinvolge il cuore destro e sinistro, la resistenza vascolare sistemica, le pressioni dell'arteria polmonare e il ritorno venoso sequenziale del lato destro, che culmina nella vena cava. È complesso e la sua valutazione accurata rimane impegnativa per i medici al letto del paziente. I medici di una varietà di specialità prendono regolarmente decisioni sulla base di questa valutazione. Gli strumenti convenzionali al letto del paziente e le manovre di esame fisico, compresa la valutazione della pressione venosa giugulare, sono quasi sempre disponibili, ma rimangono inaffidabili 4,5,6,7,8,9. L'ecografia point of care (POCUS) è un esame ecografico limitato eseguito al letto del paziente e viene interpretato dal medico curante per rispondere a domande cliniche mirate. È integrato in tempo reale con l'anamnesi del paziente, l'esame fisico e altri dati disponibili per facilitare la diagnosi e la gestione. Negli ultimi anni, l'ecografia si è consolidata come un'estensione dell'esame fisico10, migliorando la capacità dei medici di rilevare la congestione venosa11,12. Inoltre, il POCUS può guidare la terapia decongestionante, che può potenzialmente influenzare positivamente gli esiti dei pazienti 2,3.
Un protocollo specifico che utilizza l'ecografia e che è stato convalidato per aiutare con la valutazione emodinamica è il punteggio dell'ecografia in eccesso venoso, o VExUS. Descritto per la prima volta da Beaubien-Souligny et al.13 nel 2020, questo sistema di punteggio è stato originariamente convalidato nei pazienti post-cardiochirurgia come predittore affidabile di danno renale acuto (AKI). Negli ultimi anni, VExUS ha anche dimostrato di aiutare con la valutazione del volume intravascolare in molti altri contesti clinici 14,15,16,17. VExUS valuta più vene intra-addominali per lo screening dei segni ecografici associati alla congestione. Questi segni ecografici di congestione compaiono e progrediscono in modo incrementale man mano che la congestione venosa peggiora, consentendo a VExUS sia di eseguire lo screening della congestione che potenzialmente di monitorare la sua risposta alla terapia nel tempo.
Sebbene i singoli componenti dell'esame VExUS siano stati a lungo in uso 18,19,20, la loro combinazione, così come il loro utilizzo per monitorare la terapia nel tempo, rimangono sottoutilizzati, in parte a causa della mancanza di familiarità degli operatori sanitari su come eseguire l'esame. Riteniamo che questa lacuna nelle conoscenze sia uno dei principali fattori che ha impedito l'adozione su larga scala di VExUS come alternativa primaria al monitoraggio cardiaco invasivo della pressione venosa.
Per tentare di colmare questa lacuna di conoscenza, questo articolo descrive un protocollo didattico per l'esecuzione dell'esame VExUS, che può fungere da guida passo passo per i medici al letto del paziente. Questo protocollo si basa sull'esperienza collettiva di un gruppo di medici che rappresentano diverse specialità mediche (nefrologia, terapia intensiva, medicina interna e anestesiologia) provenienti da diversi centri medici accademici per descrivere un approccio standardizzato all'acquisizione e all'interpretazione delle immagini VExUS.
Protocollo
Tutte le procedure eseguite negli studi che hanno coinvolto partecipanti umani hanno aderito agli standard etici del comitato di ricerca istituzionale e alla Dichiarazione di Helsinki, compresi i suoi successivi emendamenti o standard etici comparabili. Il consenso informato scritto è stato ottenuto dai partecipanti umani. La tecnica di scansione comprendeva la selezione del trasduttore, le impostazioni della macchina, il posizionamento del paziente, la scansione in modalità B e l'acquisizione delle immagini. Sono stati inclusi nello studio i pazienti con stato di volume non chiaro, sospetta congestione venosa, insufficienza cardiaca, danno renale acuto (AKI) e/o malattia renale cronica (CKD), mentre quelli con malattia renale allo stadio terminale in dialisi, cirrosi nota o trombosi della vena porta o qualsiasi condizione che impedisca l'uso sicuro della sonda sull'addome. I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei Materiali.
1. Selezione del trasduttore
- Selezionare un trasduttore a bassa frequenza: il trasduttore sector array (noto anche come "phased array"; 1-5 MHz) può essere selezionato per il suo ingombro ridotto21; il trasduttore curvilineo (2-5 MHz) può fungere da sostituto.
NOTA: Su alcune macchine, la sonda curvilinea disattiverà il gating ECG, mentre la sonda a matrice di settori consentirà il gating EKG. Ma se il gating ECG è disponibile con la sonda curvilinea o a settori, è preferibile utilizzare il curvilineo per massimizzare la visualizzazione del segnale color Doppler.
2. Impostazioni della macchina
- Per tutte le visualizzazioni, impostare la profondità in modo tale che l'obiettivo della scansione appaia nel terzo centrale dello schermo dell'ecografia (l'impostazione tipica è compresa tra 16 e 20 cm).
- Per tutte le visualizzazioni, impostare il guadagno in modo tale che il lume dei vasi sanguigni appaia anecoico (nero), le pareti dei vasi appaiano iperecogene (luminose) e le strutture circostanti appaiano intermedie tra questi estremi.
3. Posizionamento del paziente e dell'ecografista
- Per la maggior parte dell'esame, posizionare il paziente in posizione supina.
- Quando si esegue l'imaging della vena cava inferiore (IVC), chiedere al paziente di sollevare i piedi sul letto (cioè flettere i fianchi) per rilassare i muscoli addominali e consentire l'ottimizzazione dell'immagine.
- Quando si esegue l'imaging del rene destro, riposizionare il paziente in posizione sdraiata laterale sinistra per una migliore visualizzazione del rene destro.
- Prima della scansione, esporre la parte inferiore del torace e l'addome del paziente.
- Posizionare l'ecografo in modo che la mano dominante dell'ecografista possa tenere la sonda ecografica. Ciò consente una manipolazione più precisa della sonda ecografica e libera la mano non dominante per il funzionamento dell'ecografo. Ad esempio, gli ecografisti destrimani dovrebbero posizionarsi con il paziente sul lato destro e viceversa.
4. Modalità, preset e configurazione
- Selezionare la modalità bidimensionale (2D), detta anche modalità di luminosità (modalità B).
- Selezionare la preimpostazione Cardiaco .
- Impostare il gating ECG inserendo gli elettrocateteri nell'ecografo e posizionando gli elettrocateteri con l'orientamento standard sulla pelle del paziente.
NOTA: L'esame VExUS può essere eseguito sia con la preimpostazione cardiaca che con quella addominale , ma su molte macchine, la preimpostazione addominale disattiverà il gating ECG, mentre la preimpostazione cardiaca consentirà il gating ECG. Quindi, se il gating ECG è disponibile su una determinata macchina, è preferibile utilizzare qualsiasi preset consenta il gating EKG.
5. Imaging della vena cava inferiore (IVC)
- Gel
- Applicare il gel direttamente sulla sonda ecografica per massimizzare l'efficienza della scansione prima di acquisire ogni immagine.
- Vista subxifoidea
- Posizionare la sonda sotto il processo xifoideo con l'indicatore rivolto cranialmente (Figura 1).
- Regolare la posizione della sonda fino a quando l'IVC non è visibile nel suo diametro anteroposteriore massimo (Figura 2).
- Mantenendo l'IVC al centro dello schermo, ruotare la sonda di 90 gradi in senso antiorario per ottenere una vista dell'asse corto dell'IVC (Figura 3).
- Acquisizione di clip cinetiche: per le macchine configurate per l'acquisizione retrospettiva di immagini, fare clic su acquisisci dopo il passaggio 5.2.3. Per le macchine configurate per l'acquisizione prospettica delle immagini, fare clic su acquisisci prima del passaggio 5.2.3.
- Vista del fianco destro
- Nei pazienti con controindicazioni all'imaging subxifoideo, posizionare la sonda lungo la linea ascellare anteriore destra nel piano coronale del corpo con l'indicatore della sonda rivolto cranialmente (Figura 4).
- Regolare la posizione della sonda fino a quando l'IVC non è visibile nel suo diametro anteroposteriore massimo.
- Mantenendo l'IVC al centro dello schermo, ruotare la sonda di 90 gradi in senso antiorario per ottenere una vista dell'asse corto dell'IVC.
- Acquisizione di clip cinematografiche: per le macchine configurate per l'acquisizione retrospettiva di immagini, fare clic su acquisisci dopo il passaggio 5.3.3. Per le macchine configurate per l'acquisizione prospettica delle immagini, fare clic su acquisisci prima del passaggio 5.3.3.
- Valutazione IVC
- Se l'IVC ha un diametro massimo anteriore-posteriore di >2 cm (Figura 5), procedere al passaggio 6.
- Se IVC è <= 2 cm (Figura 3), VExUS non è indicato. Utilizzare il giudizio clinico o altri strumenti per valutare lo stato del volume.
6. Doppler della vena epatica
- Gel
- Applicare il gel direttamente sulla sonda ecografica per massimizzare l'efficienza della scansione prima di acquisire ogni immagine.
- Vista del fianco destro
- Posizionare la sonda lungo la linea ascellare anteriore destra nel piano coronale del corpo con l'indicatore della sonda rivolto cranialmente (Figura 4).
- Regolare la posizione della sonda fino a visualizzare lo svuotamento della vena epatica nell'IVC vicino alla giunzione cavo-atriale (Figura 6).
- Selezionare la modalità color Doppler sull'ecografo.
- Sposta la casella dei colori in modo che la maggior parte del recipiente si trovi all'interno dei suoi bordi.
- Selezionare la modalità PW Doppler sull'ecografo.
- Spostare la porta Doppler in modo che si trovi all'interno del lume della vena epatica.
- Attiva PW Doppler.
- Chiedi al paziente di trattenere il respiro alla fine dell'espirazione.
- Consentire l'esecuzione di una schermata completa del tracciamento PW Doppler, quindi fare clic su Blocca (o equivalente) (Figura 7).
- Fare clic su Acquisisci (o equivalente) per salvare le immagini fisse del tracciamento del flusso.
7. Doppler della vena porta
- Gel
- Applicare il gel direttamente sulla sonda ecografica per massimizzare l'efficienza della scansione prima di acquisire ogni immagine.
- Vista del fianco destro
- Posizionare la sonda lungo la linea ascellare anteriore destra nel piano coronale del corpo con l'indicatore della sonda rivolto cranialmente (Figura 4).
- Regolare la posizione della sonda fino a visualizzare la vena porta (Figura 8).
- Selezionare la modalità color Doppler sull'ecografo.
- Sposta la casella dei colori in modo che la maggior parte del recipiente si trovi all'interno dei suoi bordi.
- Selezionare la modalità PW Doppler sull'ecografo.
- Spostare il cancello Doppler in modo che si trovi all'interno del lume della vena porta.
- Attiva PW Doppler.
- Chiedi al paziente di trattenere il respiro alla fine dell'espirazione.
- Consentire l'esecuzione di una schermata completa del tracciamento PW Doppler, quindi fare clic su Blocca (o equivalente) (Figura 9).
- Fare clic su Acquisisci (o equivalente) per salvare le immagini fisse del tracciamento del flusso.
8. Imaging delle vene parenchimali renali
- Gel
- Applicare il gel direttamente sulla sonda ecografica per massimizzare l'efficienza della scansione prima di acquisire ogni immagine.
- Vista del fianco destro
- Posizionare la sonda lungo la linea ascellare anteriore destra nel piano coronale del corpo con l'indicatore della sonda rivolto cranialmente (Figura 4).
- Regolare la posizione della sonda fino a quando il rene destro non è visibile nell'asse lungo view.
- Selezionare la modalità color Doppler sull'ecografo.
- Ingrandire la scatola color Doppler per contenere la maggior parte della corteccia renale (Figura 10).
- Selezionare la modalità PW Doppler sull'ecografo.
- Spostare il cancello Doppler in una posizione all'interno della corteccia renale che abbia una lettura color Doppler.
- Attiva PW Doppler.
- Chiedi al paziente di trattenere il respiro alla fine dell'espirazione.
- Consentire l'esecuzione di una schermata completa del tracciamento PW Doppler, quindi fare clic su Blocca (o equivalente) (Figura 11).
- Fare clic su Acquisisci (o equivalente) per salvare le immagini fisse del tracciamento del flusso.
Risultati
Il primo passo per l'esame VExUS prevede l'imaging della vena cava inferiore (IVC) per determinare se ci sono segni di elevate pressioni atriali destre che qualificherebbero il paziente per il resto dell'esame. Quando si esegue l'imaging dell'IVC, è importante osservarlo sia dalla prospettiva longitudinale che da quella trasversale per vedere il vaso nella sua dimensione massima. Se l'IVC è maggiore di 2 cm nel suo diametro anteroposteriore massimo, è possibile eseguire il resto dell'esame.
Il passo successivo sarebbe quello di tracciare il flusso Doppler attraverso la vena epatica. Questo viene visualizzato in modo ottimale nella porzione della vena epatica più vicina all'IVC. Nei pazienti senza congestione venosa, il modello di flusso Doppler nella vena epatica assomiglia molto a un tracciato venoso centrale standard, con un'onda sistolica e diastolica (s e d, equivalenti alle onde x e y) che scorre al di sotto della linea mediana (cioè lontano dalla sonda, nell'IVC). Questo flusso è accompagnato da onde "a" e "v", che rappresentano rispettivamente la spinta atriale e l'atrio destro pieno.
Nei pazienti senza congestione venosa, il flusso sistolico della vena epatica è generalmente più veloce del flusso diastolico. Con l'aumentare della congestione venosa, il flusso di sangue dalla vena epatica all'IVC durante la sistole diventa più compromesso. In caso di congestione lieve, il flusso sistolico diventa più lento del flusso diastolico. Quando la congestione venosa diventa più grave, il flusso sistolico alla fine si inverte, in modo tale che vi sia un flusso all'indietro durante la sistole cardiaca. L'inversione del flusso sistolico è correlata a una congestione venosa da moderata a grave (Figura 12).
Il prossimo passo nell'esame VExUS è il tracciamento Doppler della vena porta. Tra le vene epatiche e le vene portanti si trovano le sinusoidi epatiche, che fungono da letto per assorbire le consuete fluttuazioni di flusso osservate nelle vene centrali, come le vene epatiche e giugulari. Quindi, il flusso venoso nella vena porta è generalmente continuo e unidirezionale verso la sonda. Ciò fa sì che il flusso venga misurato come positivo (cioè al di sopra della linea di base) sul tracciato Doppler. Il normale flusso della vena porta ha un indice di pulsatilità (PI) inferiore al 30%. Il PI è definito come la misura della variazione del flusso sanguigno durante il ciclo cardiaco. Si calcola dividendo la differenza tra la velocità massima e minima del flusso per la velocità massima del flusso. Man mano che un paziente diventa più congestionato, il flusso diventa più pulsante. La congestione lieve ha un PI del 30%-49% e il flusso da moderato a gravemente anormale è del >50% pulsatile (Figura 13).
Infine, si ottiene il tracciamento del flusso Doppler della vena intrarenale. Dopo aver trovato i reni, il color Doppler viene utilizzato per localizzare le regioni di flusso. Quindi, il cancello Doppler a onde pulsate viene posizionato su un'area di flusso all'interno del parenchima renale. I piccoli vasi nella corteccia renale sono in genere molto vicini l'uno all'altro, quindi è comune catturare contemporaneamente sia il flusso arterioso che quello venoso. Il flusso arterioso sarà positivo (al di sopra del basale) e può essere utilizzato per determinare l'indice resistivo renale (non parte dell'esame VExUS). Il flusso venoso sarà negativo (cioè al di sotto della linea di base). Il flusso venoso sarà negativo e, normalmente, dovrebbe apparire continuo. Con l'aumentare della congestione venosa, il flusso venoso intrarenale diventerà inizialmente pulsatile e bifasico con onde sistoliche e diastoliche, indicando una lieve congestione venosa. Con l'aumentare della gravità, il flusso sistolico alla fine cesserà, portando a un flusso pulsatile e monofasico solo durante la diastole (Figura 14).
Dopo che un paziente è stato inserito nell'esame VExUS con un IVC di diametro massimo >2 cm, viene eseguito l'intero esame per assegnare al paziente un grado VExUS. Ai tracciati normali viene assegnato un punteggio di 0, a quelli lievemente anormali un punteggio di 1 e a quelli da moderati a gravemente anormali un punteggio di 2. Il grado VExUS di un paziente è determinato dal numero di tracciati anomali. Un voto VExUS di 1 viene assegnato a coloro che hanno un IVC allargato e qualsiasi combinazione di punteggi 0 o 1. Un voto VExUS di 2 viene assegnato a coloro che hanno un IVC allargato e almeno un punteggio di 2. Un voto VExUS di 3 viene assegnato a coloro che hanno un IVC allargato e due o più punteggi di 2. Un grado VExUS di 3 è strettamente associato al rischio di AKI dovuto alla congestione venosa (Figura 15).
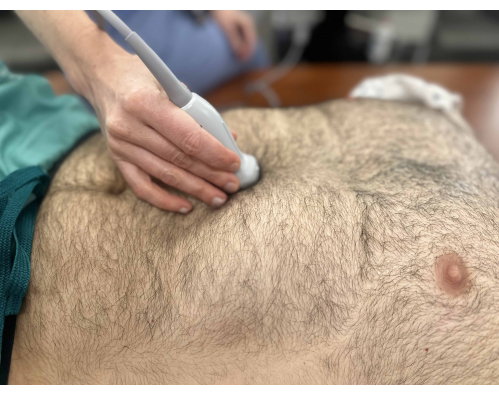
Figura 1: Trasduttore verso l'area subxifoidea per visualizzare la vena cava inferiore nella vista dell'asse lungo. Il marcatore della sonda punta verso la testa del paziente. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Vista dell'asse lungo della vena cava inferiore. Abbreviazioni: RA, atrio destro; HV, vena epatica; IVC, vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
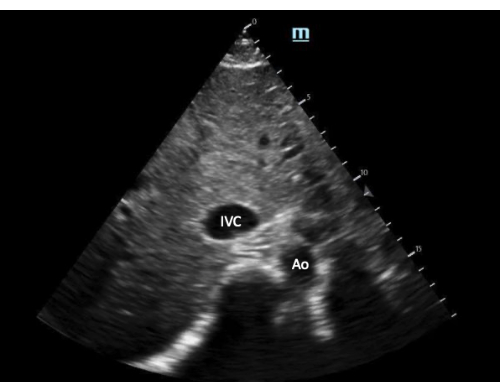
Figura 3: Vista dell'asse corto della vena cava inferiore. Abbreviazioni: Ao, aorta; IVC, vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Trasduttore sulla linea ascellare anteriore destra per visualizzare le vene epatiche, portali e intrarenali. Il marcatore della sonda punta verso la testa del paziente e quindi non è visibile nell'immagine. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Vista dell'asse corto della vena cava inferiore con un diametro anteroposteriore maggiore di 2,0 cm. Abbreviazioni: HV, vena epatica; IVC, vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.
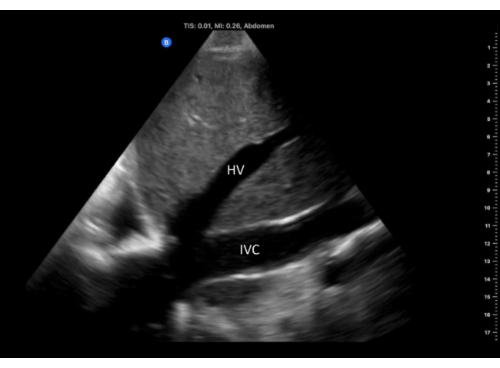
Figura 6: Vista dell'asse lungo dell'IVC con lo svuotamento della vena epatica al suo interno, ripresa dalla finestra del fianco destro. Abbreviazioni: HV, vena epatica; IVC, vena cava inferiore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 7: Gate Doppler a onde pulsate all'interno del lume della vena epatica con il tracciamento del flusso. Immagine con color Doppler attivato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8: Vista dell'asse lungo della vena porta, ripresa dalla finestra del fianco destro. Abbreviazioni: PV, vena porta. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 9: Gate Doppler a onde pulsate all'interno del lume della vena porta, con il tracciamento del flusso sottostante. Immagine con color Doppler attivato. Clicca qui per visualizzare una versione più grande di questa figura.
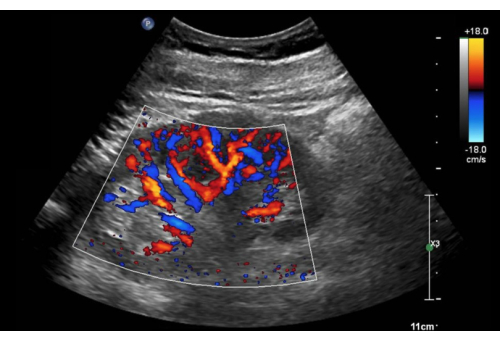
Figura 10: Vista dell'asse lungo del rene destro con il color Doppler attivato. Fare clic qui per visualizzare una versione più grande di questa figura.
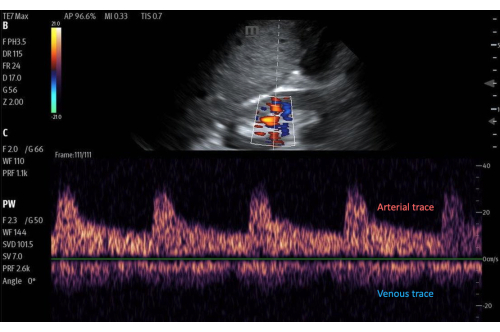
Figura 11: Gate Doppler a onde pulsate su un'area di flusso all'interno della corteccia renale, con il tracciamento del flusso sottostante. Immagine con color Doppler attivato. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 12: Diversi fenotipi della forma d'onda Doppler della vena epatica con vari gradi di congestione. Questa figura è stata riutilizzata da Koratala, A.22. Clicca qui per visualizzare una versione più grande di questa figura.
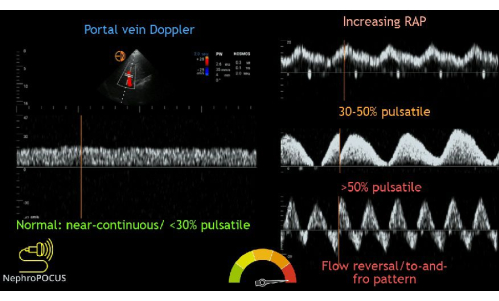
Figura 13: Diversi fenotipi della forma d'onda Doppler della vena porta con vari gradi di congestione. Questa figura è stata riutilizzata da Koratala, A.22. Clicca qui per visualizzare una versione più grande di questa figura.
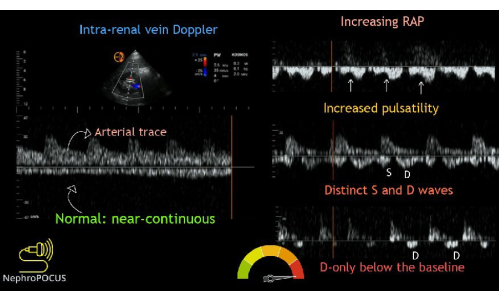
Figura 14: Diversi fenotipi della forma d'onda Doppler della vena intrarenale con vari gradi di congestione. Questa figura è stata riutilizzata da Koratala, A.22. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 15: Combinazione delle varie forme d'onda con una descrizione del sistema di punteggio VExUS. Questa figura è stata riutilizzata da Koratala, A.22. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Passaggi critici
VExUS è stato sviluppato in pazienti post-cardiochirurgici per quantificare la congestione venosa in modo non invasivo, ma l'utilità si è ampliata per il suo utilizzo per assistere nella valutazione della congestione venosa e nella valutazione dello stato dei fluidi in più contesti clinici. Per eseguire correttamente l'esame, è necessario considerare diversi passaggi critici. Innanzitutto, per massimizzare la resa diagnostica dell'esame, è necessario considerare i requisiti dell'esame VExUS quando si seleziona un trasduttore e un preset23. In particolare, la resa dell'esame è massimizzata utilizzando una sonda curvilinea che consente il gating ECG. Se la sonda curvilinea di un determinato dispositivo non consente il gating ECG ma sono disponibili cavi ECG compatibili, la scelta migliore è una sonda phased-array con gating ECG. Tuttavia, se i cavi ECG compatibili con il dispositivo non sono disponibili, è possibile utilizzare una sonda curvilinea in preimpostazione cardiaca o addominale.
In secondo luogo, è quasi sempre utile visualizzare l'IVC sia nella vista dell'asse lungo che in quella dell'asse corto. Questo è necessario per escludere o escludere nel modo più accurato i pazienti dal protocollo. La vista dell'asse lungo dell'IVC è notoriamente soggetta a errori, soprattutto per gli ecografisti meno esperti2. Se l'IVC non viene visualizzato nel piano corretto, si possono sottostimare le dimensioni del vaso. Per ridurre al minimo l'errore, visualizzarlo nella vista dell'asse corto non solo può mostrare in modo affidabile il diametro massimo, ma può anche aiutare a differenziare la vera collassabilità IVC dalla pseudo-collassabilità (ad esempio, il movimento fuori dal piano del recipiente11).
In terzo luogo, quando si ottengono tracciati del flusso venoso, è importante mantenere una mano di scansione stabile una volta attivato il PW Doppler. Contrariamente al Doppler a onda continua, il PW Doppler utilizza un "cancello" dal quale analizza i segnali ultrasonici provenienti da una posizione specifica nel tempo. Una volta attivato il PW Doppler, l'immagine mostrata all'ecografista è un'immagine statica ottenuta al momento dell'avvio della modalità PW Doppler. Se l'ecografista o il paziente si spostano l'uno rispetto all'altro, la posizione del cancello cambierà e altererà la precisione dell'immagine bidimensionale visualizzata. Pertanto, è fondamentale mantenere una mano di scansione stabile una volta che il vaso bersaglio è in vista e la modalità PW Doppler è attivata. Inoltre, avere un paziente sdraiato fermo e trattenere il respiro alla fine dell'espirazione per alcuni secondi aiuta a eliminare la variazione respiratoria durante l'utilizzo del PW Doppler.
Infine, è importante notare che gli esami VExUS non sono solo utili nella diagnosi di congestione venosa, ma sono anche utili nel monitorare la risposta al trattamento nel tempo24. Una delle principali utilità di questo sistema di punteggio è quando viene implementato in serie nel corso di un ricovero o di un ciclo di trattamento per valutare l'efficacia delle misure decongestionanti che si sono implementate.
Modifiche e risoluzione dei problemi
Due aspetti dell'esame VExUS che comunemente frustrano gli studenti sono (1) la mancanza di disponibilità dell'hardware di gating ECG e (2) l'incapacità di localizzare il flusso venoso intrarenale.
Nell'ambito dell'esame VExUS, l'interpretazione di tutte e tre le forme d'onda Doppler extra-cardiache è migliorata mediante gating ECG. Di queste tre forme d'onda, il gating ECG è la più essenziale per la valutazione del flusso venoso epatico12. Il tracciato del flusso venoso epatico contiene più onde, alcune al di sopra e altre al di sotto della linea di base. Pertanto, è spesso necessario utilizzare il gating ECG per identificare se ogni onda è normale o patologica e in particolare per determinare se la velocità sistolica o diastolica è più veloce. Ma, in assenza di gating ECG, nella maggior parte dei casi è possibile utilizzare i dati VExUS della vena non epatica per trarre conclusioni sullo stato di congestione di un paziente. In particolare, anche se viene eseguito solo il 75% dell'esame (IVC, vene porta e vene intrarenali), in molti casi è possibile effettuare una determinazione sufficiente sullo stato di congestione esistente in un determinato paziente, soprattutto perché solo 2 modelli di flusso gravemente anomali indicano il grado massimo di VExUS di 3. Tuttavia, è più probabile che un approccio privo di ECG generi dati VExUS inconcludenti per due motivi: (1) un tracciato Doppler della vena intrarenale senza ECG può essere difficile da interpretare se il segnale arterioso intrarenale non è prominente e (2) per la vena porta, il gating ECG può aiutare a differenziare la pulsatilità respiratoria da quella cardiaca. Per questi motivi, l'uso dell'ECG gating è preferito quando possibile.
In secondo luogo, trovare il segnale di flusso venoso intrarenale può essere difficile25. Se il rene si trova a una distanza superiore a circa 16 cm dalla sonda, una maggiore attenuazione delle onde ultrasoniche durante il loro viaggio tra il trasduttore e il rene può causare la degradazione del segnale Doppler (cioè la mancanza di colore). Questo può essere migliorato spostando la sonda più lateralmente e posteriormente sul corpo del paziente, avvicinando il rene al trasduttore. Se il flusso non viene ancora visualizzato, è possibile diminuire la scala Doppler in modo che rilevi un flusso più lento. Una velocità del flusso compresa tra 12 cm/s e 25 cm/s è in genere sufficiente per visualizzare la vascolarizzazione intrarenale. Inoltre, si può anche aumentare il guadagno Doppler per migliorare la sensibilità al flusso, aumentando la resa di questa parte della scansione. Quando si aumenta il guadagno, bisogna fare attenzione alla maggiore probabilità di visualizzare un artefatto che potrebbe essere scambiato per flusso. È possibile utilizzare anche la modalità Power Doppler, in quanto in genere è più adatta a rilevare un flusso più lento. Se, dopo queste modifiche, un ecografista ha ancora difficoltà a trovare il flusso nel rene a destra, può provare il rene controlaterale e implementare le stesse modifiche su quel lato.
Limitazioni
Sebbene VExUS sia emerso come un esame affidabile e non invasivo per aiutare a guidare la valutazione del lato destro del circuito emodinamico, presenta alcune importanti limitazioni. Innanzitutto, ci sono molte condizioni in cui la VExUS non è convalidata, tra cui la cirrosi e la malattia renale allo stadio terminale (ESKD)7. Nella cirrosi si verifica un'alterazione delle pressioni all'interno del fegato, dovuta al tessuto fibroso, che può alterare la capacità del tessuto epatico di fungere da "spugna" che assorbe le pressioni cardiache. Pertanto, sia il flusso epatico che quello della vena porta possono essere alterati. Inoltre, potrebbero esserci trombi epatici o della vena porta che, ancora una volta, potrebbero portare a un'interpretazione errata del flusso all'interno di questi vasi. Inoltre, nell'ESKD, i reni diventano atrofici con diminuzione del flusso sanguigno, rendendo difficile l'interpretazione del flusso venoso renale. Eppure, nonostante queste limitazioni, ci sono casi clinici che dimostrano che VExUS potrebbe potenzialmente avere valore anche nei pazienti con cirrosi26 e/o malattia renale allo stadioterminale 27, servendo come metodo per monitorare il trattamento della congestione venosa nel tempo.
In secondo luogo, è importante notare che VExUS è ancora un nuovo protocollo per stimare la congestione venosa e, quindi, ci sono alcuni dati che suggeriscono che non è il modo più affidabile o utile per stimare la congestione venosa. In uno studio osservazionale del 2023 pubblicato sul Journal of Critical Care, Andrei et al. hanno dimostrato che in una coorte di pazienti in terapia intensiva, non esisteva un'associazione significativa tra i punteggi VExUS e l'AKI o la mortalità a 28 giorni28. Si trattava di una piccola coorte; Tuttavia, la prevalenza complessiva di congestione venosa da moderata a grave era bassa. In un gruppo con una maggiore prevalenza di congestione venosa, come i pazienti con sindrome cardiorenale, Islas-Rodriguez et al.29 hanno dimostrato che mentre l'uso di VExUS per guidare la decongestione ha aiutato a raggiungere questo obiettivo, non ha aumentato la probabilità di recupero della funzione renale.
In terzo luogo, c'è una mancanza di consenso sull'interpretazione di VExUS in pazienti con preesistente disfunzione ventricolare destra e/o rigurgito tricuspidale significativo. Concettualmente, sembra ragionevole utilizzare VExUS come monitor di tendenza in tali pazienti per tentare di differenziare la disfunzione dall'insufficienza della circolazione cardiaca destra. Tuttavia, non siamo a conoscenza di studi fino ad oggi che abbiano convalidato questo concetto.
In quarto luogo, VExUS esclude i pazienti con IVC che misurano meno di 2,0 cm di diametro anteriore-posteriore, che possono non notare la congestione venosa nei pazienti con habitus corporeo piccolo. In altre parole, se una femmina di 5 piedi e un maschio di 7 piedi hanno ciascuno un IVC di 1,9 cm, questi due pazienti sono entrambi esclusi da ulteriori screening VExUS per la congestione venosa. Tuttavia, questo è in contrasto con altre pratiche ecocardiografiche che hanno sempre più incorporato l'indicizzazione alla superficie corporea per normalizzare le misurazioni ecografiche della taglia corporea30.
In quinto luogo, è probabile che il protocollo VExUS incontri problemi nei casi di ipertensione intra-addominale (IAH). Nell'IAH, è probabile che i pazienti abbiano una piccola IVC (<2,0 cm) perché è probabile che un'elevata pressione intra-addominale comprima estrinsecamente il vaso31. Ciò significa che la maggior parte dei pazienti con IAH sarà automaticamente esclusa da un'ulteriore valutazione VExUS una volta rilevata una IVC di piccole dimensioni. Tuttavia, l'IAH può essere causata da congestione venosa e tale congestione non verrebbe rilevata da VExUS a causa dell'esclusione automatica dei pazienti con IVC di piccolo calibro. Inoltre, i pazienti con IAH, in generale, sono probabilmente scarsi candidati per VExUS. Questo perché, nell'IAH, c'è una compressione estrinseca di tutte le vene intra-addominali e le forme d'onda Doppler di queste vene rifletteranno un equilibrio tra compressione estrinseca e congestione intra-murale, rendendo difficile l'interpretazione delle forme d'onda Doppler esclusivamente per la congestione.
Direzioni future
L'attuale iterazione del protocollo VExUS può evolversi nel tempo attraverso molteplici strade. Innanzitutto, l'attuale protocollo VExUS include solo una singola misurazione antero-posteriore dell'IVC ottenuta da una vista dell'asse lungo dell'IVC subxifoide. Tuttavia, questa singola visione può essere fuorviante e ci sono prove che una stima più robusta della pressione atriale destra può essere ottenuta aggiungendo una vista dell'asse corto IVC per misurare l'indice di sfericità IVC: rapporto tra un diametro laterale-mediale e un diametri antero-posteriore dell'IVC32. In secondo luogo, l'attuale protocollo VExUS misura solo il diametro massimo dell'IVC e non tiene conto della collassabilità dell'IVC. Quindi, il protocollo VExUS attualmente esclude i pazienti con una IVC di <=2 cm di diametro che tuttavia hanno IVC non collassabili. Al contrario, l'attuale protocollo VExUS tratta i pazienti con IVC pieghevole di grandi dimensioni (>2 cm) come aventi un certo grado di congestione venosa. Sono necessarie ricerche future per determinare se la collassabilità IVC debba essere utilizzata come criterio di screening per l'esame VExUS. In terzo luogo, le forme d'onda della vena femorale possono essere utili per coloro che hanno difficoltà a trattenere il respiro. Il flusso Doppler della vena femorale (FVD) dovrebbe essere continuo nei casi normali, ma all'aumentare della congestione venosa, il flusso diventa sempre più pulsante, portando a significative interruzioni del flusso. La FVD può emergere come un'utile espansione dell'attuale protocollo VExUS per consentire l'utilità di questo esame in una percentuale maggiore di pazienti33. In quarto luogo, ci sono prove che ci sono dati simili sulla congestione venosa forniti da entrambe le misurazioni della vena giugulare interna e IVC34. Studi futuri dovrebbero esaminare se i parametri della vena giugulare possono sostituire l'IVC nel protocollo VExUS in situazioni in cui l'IVC è difficile da visualizzare.
È probabile che il protocollo VExUS si evolva man mano che la tecnologia a ultrasuoni integra ampiamente più funzionalità, in particolare l'apprendimento automatico (ML) e l'intelligenza artificiale (AI)35. L'integrazione ML/AI nell'hardware e nel software a ultrasuoni dovrebbe essere in grado di automatizzare molti aspetti del protocollo VExUS che attualmente richiedono molto lavoro. Ad esempio, alcune macchine esistenti sono già in grado di misurare automaticamente la collassabilità dell'IVC e, in linea di principio, un giorno dovrebbero essere in grado di misurare anche la sfericità dell'IVC.
Inoltre, sarebbe molto vantaggioso per le macchine a ultrasuoni offrire una tecnologia di gating ECG virtuale assistita dall'intelligenza artificiale, poiché molte macchine a ultrasuoni point-of-care attualmente non dispongono di cavi ECG fisici. Ciò aiuterebbe notevolmente i medici a interpretare i modelli di flusso nella vena epatica in assenza di capacità di gating ECG.
Infine, l'intelligenza artificiale che ottiene automaticamente il tracciamento Doppler a onde pulsate di un vaso bersaglio può aiutare ad appiattire la curva di apprendimento già piuttosto ripida che esiste per VExUS36. Questa tecnologia esiste già per la stima della gittata cardiaca ottenendo automaticamente la misurazione integrale della velocità del tratto di efflusso LV (LVOT VTI), quindi espanderla ai vasi epatici, portali e intrarenali non è al di là delle possibilità in questa fase della tecnologia a ultrasuoni.
In sintesi, la valutazione del circuito emodinamico con POCUS è fondamentale nella gestione dei pazienti acuti37. Tuttavia, a causa della mancanza di una formazione standardizzata nell'acquisizione e nell'interpretazione delle immagini, VExUS rimane sottoutilizzato. Questa revisione presenta un quadro per l'acquisizione e l'interpretazione delle immagini dell'esame VExUS da un gruppo di medici che comprende una varietà di specialità. A sua volta, questo protocollo può essere utilizzato per insegnare e apprendere VExUS per migliorare la capacità dei medici di valutare la congestione venosa e monitorarne il trattamento nel tempo.
Divulgazioni
YSB riferisce di aver ricevuto onorari dall'American Society of Anesthesiologists per il lavoro del comitato editoriale sull'ecografia Point-of-Care e da OpenAnesthesia.org per la creazione di contenuti educativi relativi a POCUS. Gli altri autori non hanno divulgazioni.
Riconoscimenti
Nessuno.
Materiali
| Name | Company | Catalog Number | Comments |
| 5500P Ultrasound System | Philips | HC795143 | Used to obtain a subset of the Figures and Videos |
| Affiniti 70 Ultrasound System | Philips | HC795210 | Used to obtain a subset of the Figures and Videos |
| Curvilinear Transducer (C1-5-D) | GE | 5409287-R | 1-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-1) | Philips | HC989605412041 | 2-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-1) | SonoSite | https://www.sonosite.com/products/ultrasound-transducers/c5-1 | 1-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-2s) | Mindray | https://lysis.cc/products/mindray-c5-2s | 1-5 MHz, also called the abdominal probe |
| Edge 1 Ultrasound Machine | SonoSite | Used to obtain a subset of the Figures and Videos | |
| Handheld Probe (Butterfly iQ3) | Butterfly | https://www.butterflynetwork.com/iq3?srsltid=AfmBOorvY6WqHGbdeWW gtefztEJa8pt_xbwSOc6hQuB2s-Kb0wRlsCLR | Used to obtain a subset of the Figures and Videos |
| LOGIQ P9 Ultrasound System | GE | H42752LS | Used to obtain a subset of the Figures and Videos |
| Lumify Handheld Ultrasound | Philips | Used to obtain a subset of the Figures and Videos | |
| Phased-Array Transducer (3Sc-D) | GE | https://services.gehealthcare.in/gehcstorefront/p/5863286 | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (P4-2s) | Mindray | https://lysis.cc/products/mindray-p4-2s | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (P5-1) | SonoSite | https://www.sonosite.com/in/products/ultrasound-transducers/p5-1 | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (S4-1) | Philips | HC989605389271 | 1-5 MHz, also called the cardiac probe |
| TE7 Max Ultrasound System | Mindray | https://www.mindray.com/na/products/ultrasound/point-of-care/te-series/te-7-max-portable-ultrasound-machine/ | Used to obtain a subset of the Figures and Videos |
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon