Method Article
Démystifier l’échographie d’excès veineux (VExUS) : acquisition et interprétation d’images
Dans cet article
Résumé
L’échographie au point d’intervention (POCUS) est souvent utilisée pour évaluer le circuit hémodynamique et détecter la présence d’une congestion veineuse. Le système de notation VExUS (Venous Excess Ultrasound) a été développé pour aider les cliniciens à prédire l’impact de la congestion veineuse sur le dysfonctionnement des organes. Cet article vise à décrire l’acquisition et l’interprétation d’images VExUS.
Résumé
Les prestataires de nombreuses spécialités médicales doivent évaluer avec précision le circuit hémodynamique pour fournir des soins appropriés aux patients. La congestion veineuse est de plus en plus impliquée dans une série de complications multiviscérales. Cependant, l’évaluation hémodynamique reste difficile en raison de la physiologie complexe impliquée et de la précision diagnostique incohérente des outils de chevet conventionnels et des manœuvres d’examen physique. Bien que le cathétérisme cardiaque droit soit considéré comme l’étalon-or pour mesurer la pression veineuse systémique, il est invasif et difficilement reproductible, et il reste donc un besoin d’alternatives non invasives. Même les examens échographiques au point de service de la veine jugulaire interne ou de la veine cave inférieure présentent des limites importantes en termes de précision de l’évaluation du volume intravasculaire et de corrélation avec la pression veineuse centrale. Afin d’améliorer la précision des cliniciens dans l’évaluation de la congestion veineuse, un protocole a été élaboré et validé qui utilise les signaux Doppler à ondes pulsées (PW) des veines du foie et des reins pour évaluer le degré de congestion veineuse présent chez les patients. Bien que ce système de notation, appelé échographie veineuse en excès (VExUS), soit de plus en plus adopté dans certaines sous-spécialités de la médecine, telles que la néphrologie et les soins intensifs, il reste sous-utilisé dans l’ensemble de la médecine. Cela est probablement dû, du moins en partie, à des lacunes dans les connaissances et à un manque de formation dans cette modalité émergente. Pour combler cette lacune éducative, cet article décrira l’acquisition et l’interprétation des images VExUS.
Introduction
L’évaluation du circuit hémodynamique au chevet du patient est fondamentale pour les soins quotidiens des patients gravement malades. Les effets délétères de la surcharge liquidienne sont de plus en plus reconnus, même en dehors des syndromes cliniques les plus évidents tels que l’insuffisance cardiaque, et il existe maintenant de nombreuses études montrant qu’un équilibre hydrique positif est associé à une mortalité accrue1. De plus en plus de preuves montrent que même de faibles niveaux de congestion veineuse sont associés à un dysfonctionnement des organes2. De même, une décongestion rapide est associée à de meilleurs résultats3. Ce circuit dynamique multi-organes implique le cœur droit et le cœur gauche, la résistance vasculaire systémique, les pressions artérielles pulmonaires et le retour veineux séquentiel du côté droit, culminant dans la veine cave. Il s’agit d’un processus complexe et son évaluation précise demeure un défi pour les cliniciens au chevet du patient. Des cliniciens de diverses spécialités prennent régulièrement des décisions en fonction de cette évaluation. Des outils conventionnels au chevet du patient et des manœuvres d’examen physique, y compris l’évaluation de la pression veineuse jugulaire, sont presque toujours disponibles, mais restent peu fiables 4,5,6,7,8,9. L’échographie au point de service (POCUS) est un examen échographique limité effectué au chevet du patient et est interprété par le médecin traitant pour répondre à des questions cliniques ciblées. Il est intégré en temps réel aux antécédents du patient, à l’examen physique et à d’autres données disponibles pour faciliter le diagnostic et la prise en charge. Au cours des dernières années, l’échographie s’est imposée comme une extension de l’examen physique10, améliorant la capacité des cliniciens à détecter la congestion veineuse11,12. De plus, le POCUS peut guider le traitement décongestif, ce qui peut potentiellement affecter positivement les résultats des patients 2,3.
Un protocole spécifique utilisant l’échographie qui a été validé pour aider à l’évaluation hémodynamique est le score d’échographie d’excès veineux, ou VExUS. Décrit pour la première fois par Beaubien-Souligny et coll.13 en 2020, ce système de notation a été validé à l’origine chez les patients ayant subi une chirurgie cardiaque en tant que prédicteur fiable de l’insuffisance rénale aiguë (IRA). Au cours des dernières années, il a également été démontré que VExUS aide à l’évaluation du volume intravasculaire dans de multiples autres contextes cliniques 14,15,16,17. VExUS évalue plusieurs veines intra-abdominales pour dépister les signes échographiques associés à la congestion. Ces signes échographiques de congestion apparaissent et progressent de manière progressive à mesure que la congestion veineuse s’aggrave, ce qui permet à VExUS de dépister la congestion et de suivre potentiellement sa réponse au traitement au fil du temps.
Bien que les composants individuels de l’examen VExUS soient utilisés depuis longtemps 18,19,20, leur combinaison, ainsi que leur utilisation pour surveiller le traitement au fil du temps, restent sous-utilisées, en partie en raison du manque de familiarité des prestataires avec la façon de réaliser l’examen. Nous pensons que ce manque de connaissances est l’un des principaux facteurs qui ont empêché l’adoption à plus grande échelle de VExUS comme principale alternative à la surveillance cardiaque invasive de référence de la pression veineuse.
Pour tenter de combler ce manque de connaissances, cet article décrit un protocole d’instruction pour effectuer l’examen VExUS, qui peut servir de guide étape par étape pour les cliniciens au chevet du patient. Ce protocole s’appuie sur l’expérience collective d’un groupe de médecins représentant plusieurs spécialités médicales (néphrologie, soins intensifs, médecine interne et anesthésiologie) de plusieurs centres médicaux universitaires pour décrire une approche standardisée de l’acquisition et de l’interprétation d’images VExUS.
Protocole
Toutes les procédures effectuées dans les études impliquant des participants humains ont respecté les normes éthiques du comité de recherche institutionnel et la Déclaration d’Helsinki, y compris ses amendements ultérieurs ou des normes éthiques comparables. Le consentement éclairé écrit a été obtenu des participants humains. La technique de balayage comprenait la sélection de la sonde, les paramètres de la machine, le positionnement du patient, le balayage en mode B et l’acquisition d’images. Les patients présentant un statut volémique incertain, une congestion veineuse suspectée, une insuffisance cardiaque, une insuffisance rénale aiguë (IRA) et/ou une maladie rénale chronique (IRC) ont été inclus dans l’étude, tandis que ceux atteints d’une insuffisance rénale terminale sous dialyse, d’une cirrhose connue ou d’une thrombose de la veine porte, ou de toute affection empêchant l’utilisation sûre de la sonde sur l’abdomen ont été exclus. Les détails des réactifs et de l’équipement utilisés sont répertoriés dans le tableau des matériaux.
1. Sélection du transducteur
- Sélectionnez un transducteur basse fréquence : le transducteur à réseau sectoriel (alias « réseau phasé » ; 1-5 MHz) peut être sélectionné pour son encombrement plus petit21 ; le transducteur curviligne (2-5 MHz) peut servir de substitut.
REMARQUE : Sur certaines machines, la sonde curviligne désactivera le déclenchement de l’ECG, tandis que la sonde de réseau de secteurs autorisera le déclenchement de l’ECG. Mais si le déclenchement par ECG est disponible avec la sonde curviligne ou à réseau de secteurs, il est préférable d’utiliser la sonde curviligne pour maximiser la visualisation du signal Doppler couleur.
2. Paramètres de la machine
- Pour toutes les vues, réglez la profondeur de sorte que la cible du balayage apparaisse dans le tiers central de l’écran d’échographie (le réglage typique se situe entre 16 et 20 cm).
- Pour toutes les vues, réglez le gain de telle sorte que la lumière des vaisseaux sanguins apparaisse anéchoïque (noire), que les parois des vaisseaux apparaissent hyperéchoïques (brillantes) et que les structures environnantes apparaissent intermédiaires entre ces extrêmes.
3. Positionnement du patient et de l’échographiste
- Pendant la majeure partie de l’examen, positionnez le patient en décubitus dorsal.
- Lors de l’imagerie de la veine cave inférieure (VCI), demandez au patient de lever ses pieds sur le lit (c’est-à-dire de fléchir ses hanches) pour détendre ses muscles abdominaux et permettre l’optimisation de l’image.
- Lors de l’imagerie du rein droit, repositionnez le patient en position couchée latérale gauche pour une meilleure visualisation du rein droit.
- Avant le balayage, exposez le bas de la poitrine et l’abdomen du patient.
- Positionnez l’échographe de manière à ce que la main dominante de l’échographiste puisse tenir la sonde à ultrasons. Cela permet une manipulation plus fine de la sonde à ultrasons et libère la main non dominante pour l’utilisation de l’appareil à ultrasons. Par exemple, les échographistes droitiers doivent se positionner avec le patient sur son côté droit et vice versa.
4. Mode, préréglages et configuration
- Sélectionnez le mode bidimensionnel (2D), également appelé mode de luminosité (mode B).
- Sélectionnez le préréglage Cardiaque .
- Configurez le déclenchement par ECG en branchant les sondes sur l’échographe et en plaçant les sondes dans l’orientation standard sur la peau du patient.
REMARQUE : L’examen VExUS peut être effectué dans le préréglage cardiaque ou abdominal , mais sur de nombreuses machines, le préréglage abdominal désactivera le déclenchement de l’ECG, tandis que le préréglage cardiaque autorisera le déclenchement de l’ECG. Par conséquent, si le déclenchement par ECG est disponible sur une machine donnée, il est préférable d’utiliser le préréglage permettant le déclenchement par ECG.
5. Imagerie de la veine cave inférieure (VCI)
- Gel
- Appliquez du gel directement sur la sonde à ultrasons pour maximiser l’efficacité du balayage avant d’acquérir chaque image.
- Vue subxiphoïde
- Placez la sonde sous l’apophyse xiphoïde avec l’indicateur pointant vers le crâne (Figure 1).
- Ajustez la position de la sonde jusqu’à ce que l’IVC soit visible dans son diamètre antéropostérieur maximal (Figure 2).
- Tout en gardant l’IVC au centre de l’écran, faites pivoter la sonde de 90 degrés dans le sens inverse des aiguilles d’une montre pour obtenir une vue sur un petit axe de l’IVC (Figure 3).
- Acquisition de clips cinéma : Pour les machines configurées pour l’acquisition rétrospective d’images, cliquez sur acquérir après l’étape 5.2.3. Pour les machines configurées pour l’acquisition prospective d’images, cliquez sur acquérir avant l’étape 5.2.3.
- Vue du flanc droit
- Chez les patients présentant des contre-indications à l’imagerie subxiphoïde, placez la sonde le long de la ligne axillaire antérieure droite dans le plan coronal du corps, l’indicateur de la sonde pointant vers le crâne (Figure 4).
- Ajustez la position de la sonde jusqu’à ce que l’IVC soit visible dans son diamètre antéropostérieur maximal.
- Tout en gardant l’IVC au centre de l’écran, tournez la sonde de 90 degrés dans le sens inverse des aiguilles d’une montre pour obtenir une vue à court angle de l’IVC.
- Acquisition de clips cinéma : Pour les machines configurées pour l’acquisition rétrospective d’images, cliquez sur acquérir après l’étape 5.3.3. Pour les machines configurées pour l’acquisition d’images prospectives, cliquez sur acquérir avant l’étape 5.3.3.
- Évaluation de la VCV
- Si le diamètre maximal de la VCI est de >2 cm d’avant à arrière (figure 5), passez à l’étape 6.
- Si la VCI est de <= 2 cm (Figure 3), VExUS n’est pas indiqué. Utilisez le jugement clinique ou d’autres outils pour évaluer l’état du volume.
6. Doppler de la veine hépatique
- Gel
- Appliquez du gel directement sur la sonde à ultrasons pour maximiser l’efficacité du balayage avant d’acquérir chaque image.
- Vue du flanc droit
- Placez la sonde le long de la ligne axillaire antérieure droite dans le plan coronal du corps, l’indicateur de la sonde pointant vers le crâne (Figure 4).
- Ajustez la position de la sonde jusqu’à ce que la veine hépatique se vide dans la CVI près de la jonction cavo-auriculaire (Figure 6).
- Sélectionnez le mode Doppler couleur sur l’échographe.
- Déplacez la boîte de couleur de manière à ce que la majorité du récipient se trouve à l’intérieur de ses limites.
- Sélectionnez le mode PW Doppler sur l’échographe.
- Déplacez la porte Doppler de manière à ce qu’elle soit située dans la lumière de la veine hépatique.
- Activez le PW Doppler.
- Demandez au patient de retenir sa respiration à la fin de l’expiration.
- Laissez s’afficher en plein écran le traçage Doppler PW, puis cliquez sur Freeze (ou équivalent) (Figure 7).
- Cliquez sur Acquérir (ou équivalent) pour enregistrer des images fixes du suivi de flux.
7. Doppler de la veine porte
- Gel
- Appliquez du gel directement sur la sonde à ultrasons pour maximiser l’efficacité du balayage avant d’acquérir chaque image.
- Vue du flanc droit
- Placez la sonde le long de la ligne axillaire antérieure droite dans le plan coronal du corps, l’indicateur de la sonde pointant vers le crâne (Figure 4).
- Ajustez la position de la sonde jusqu’à ce que la veine porte soit visualisée (Figure 8).
- Sélectionnez le mode Doppler couleur sur l’échographe.
- Déplacez la boîte de couleur de manière à ce que la majeure partie du récipient se trouve à l’intérieur de ses bordures.
- Sélectionnez le mode PW Doppler sur l’échographe.
- Déplacez la porte Doppler de manière à ce qu’elle soit située dans la lumière de la veine porte.
- Activez le PW Doppler.
- Demandez au patient de retenir sa respiration à la fin de l’expiration.
- Laissez s’afficher un plein écran du traçage Doppler PW, puis cliquez sur Freeze (ou équivalent) (Figure 9).
- Cliquez sur Acquérir (ou équivalent) pour enregistrer des images fixes du suivi de flux.
8. Imagerie des veines parenchymateuses rénales
- Gel
- Appliquez du gel directement sur la sonde à ultrasons pour maximiser l’efficacité du balayage avant d’acquérir chaque image.
- Vue du flanc droit
- Placez la sonde le long de la ligne axillaire antérieure droite dans le plan coronal du corps, l’indicateur de la sonde pointant vers le crâne (Figure 4).
- Ajustez la position de la sonde jusqu’à ce que le rein droit soit visible dans la vue longitudinale.
- Sélectionnez le mode Doppler couleur sur l’échographe.
- Agrandir la boîte Doppler couleur pour contenir la majeure partie du cortex rénal (Figure 10).
- Sélectionnez le mode PW Doppler sur l’échographe.
- Déplacez la porte Doppler vers un endroit du cortex rénal qui a une lecture Doppler couleur.
- Activez le PW Doppler.
- Demandez au patient de retenir sa respiration à la fin de l’expiration.
- Laissez un plein écran du traçage Doppler PW s’exécuter, puis cliquez sur Freeze (ou équivalent) (Figure 11).
- Cliquez sur Acquérir (ou équivalent) pour enregistrer des images fixes du suivi de flux.
Résultats
La première étape de l’examen VExUS consiste à imager la veine cave inférieure (IVC) pour déterminer s’il y a des signes de pressions auriculaires droites élevées qui qualifieraient le patient pour le reste de l’examen. Lors de l’imagerie de l’IVC, il est important de la voir à la fois du point de vue longitudinal et transversal pour voir le vaisseau dans sa dimension maximale. Si la VCI est supérieure à 2 cm dans son diamètre antéropostérieur maximal, le reste de l’examen peut être effectué.
L’étape suivante consisterait à suivre le flux Doppler à travers la veine hépatique. Ceci est imagé de manière optimale dans la partie de la veine hépatique la plus proche de la CVI. Chez les patients sans congestion veineuse, le schéma de flux Doppler dans la veine hépatique ressemble le plus à un tracé veineux central standard, avec une onde systolique et diastolique (s et d, équivalente aux ondes x et y) s’écoulant sous la ligne médiane (c’est-à-dire en s’éloignant de la sonde, dans la VCI). Ce flux est accompagné d’ondes « a » et « v », qui représentent respectivement le coup de pied auriculaire et le fait que l’oreillette droite est pleine.
Chez les patients sans congestion veineuse, le flux systolique de la veine hépatique est généralement plus rapide que le flux diastolique. À mesure que la congestion veineuse augmente, le flux sanguin de la veine hépatique vers la VCI pendant la systole devient plus altéré. En cas de congestion légère, le débit systolique devient plus lent que le flux diastolique. Au fur et à mesure que la congestion veineuse s’aggrave, le flux systolique finit par s’inverser, de sorte qu’il y a un reflux pendant la systole cardiaque. L’inversion du flux systolique est corrélée à une congestion veineuse modérée à sévère (Figure 12).
Vient ensuite l’examen VExUS : le traçage Doppler de la veine porte. Entre les veines hépatique et porte se trouvent les sinusoïdes hépatiques, qui agissent comme un lit pour absorber les fluctuations de débit habituelles observées dans les veines centrales, telles que les veines hépatiques et jugulaires. Ainsi, l’écoulement veineux dans la veine porte est généralement continu et unidirectionnel vers la sonde. Cela fait que le débit est mesuré comme positif (c’est-à-dire au-dessus de la ligne de base) sur le tracé Doppler. Le flux veineux porte normal a un indice de pulsatilité (PI) inférieur à 30 %. L’IP est défini comme la mesure de la variation du débit sanguin au cours du cycle cardiaque. Il est calculé en divisant la différence entre les vitesses d’écoulement maximale et minimale par la vitesse d’écoulement maximale. Au fur et à mesure qu’un patient devient plus congestionné, le flux devient plus pulsatile. Une congestion légère a un IP de 30 % à 49 %, et un débit modéré à sévèrement anormal est de >50 % pulsatile (Figure 13).
Enfin, le traçage du flux Doppler de la veine intrarénale est obtenu. Après avoir trouvé les reins, le Doppler couleur est utilisé pour localiser les régions de flux. Ensuite, la porte Doppler à ondes pulsées est placée sur une zone d’écoulement à l’intérieur du parenchyme rénal. Les petits vaisseaux du cortex rénal sont généralement très proches les uns des autres, il est donc courant de capturer simultanément le flux artériel et veineux. Le débit artériel sera positif (au-dessus de la ligne de base) et peut être utilisé pour déterminer l’indice résistif rénal (ne faisant pas partie de l’examen VExUS). Le flux veineux sera négatif (c’est-à-dire inférieur à la ligne de base). Le flux veineux sera négatif et, normalement, devrait apparaître continu. Au fur et à mesure que la congestion veineuse augmente, le flux veineux intrarénal deviendra initialement pulsatile et biphasique avec des ondes systoliques et diastoliques, indiquant une légère congestion veineuse. Au fur et à mesure que la congestion augmente en gravité, le flux systolique finit par cesser, conduisant à un flux pulsatile et monophasique pendant la diastole uniquement (Figure 14).
Une fois qu’un patient a été admis à l’examen VExUS en ayant une VCI de >2 cm de diamètre maximal, l’intégralité de l’examen est effectuée pour donner au patient un grade VExUS. Les tracés normaux se voient attribuer un score de 0, les tracés légèrement anormaux un score de 1 et les tracés modérés à gravement anormaux un score de 2. Le grade VExUS d’un patient est déterminé par le nombre de tracés anormaux. Une note VExUS de 1 est attribuée aux personnes ayant une VCI élargie et toute combinaison de scores de 0 ou 1. Une note VExUS de 2 est attribuée aux personnes ayant une VCI élargie et au moins un score de 2. Une note VExUS de 3 est attribuée aux personnes ayant une VCI élargie et deux scores ou plus de 2. Un grade VExUS de 3 est étroitement associé au risque d’IRA due à la congestion veineuse (Figure 15).
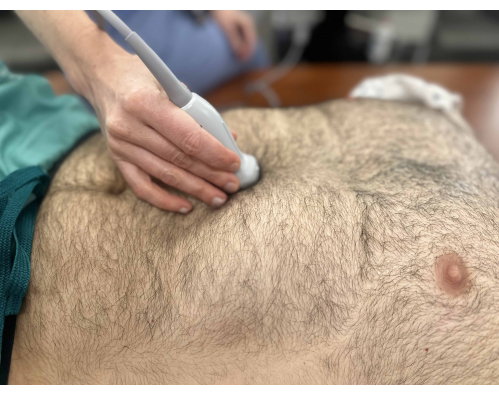
Figure 1 : Sonde vers la zone sous-xiphoïde pour visualiser la veine cave inférieure dans la vue grand axe. Le marqueur de la sonde pointe vers la tête du patient. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Vue longitudinale de la veine cave inférieure. Abréviations : RA, oreillette droite ; HV, veine hépatique ; IVC, veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
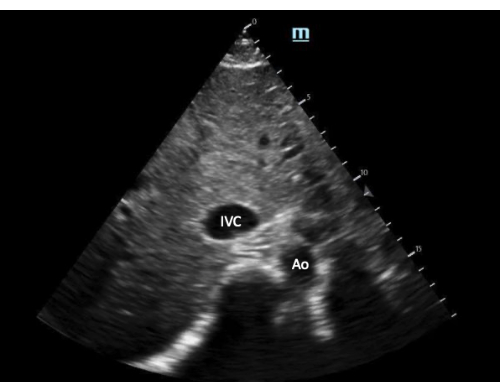
Figure 3 : Vue à court angle de la veine cave inférieure. Abréviations : Ao, aorte ; IVC, veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Sonde sur la ligne axillaire antérieure droite pour visualiser les veines hépatique, porte et intrarénale. Le marqueur de la sonde pointe vers la tête du patient et n’est donc pas visible sur l’image. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Vue à court angle de la veine cave inférieure avec un diamètre antéropostérieur supérieur à 2,0 cm. Abréviations : HV, veine hépatique ; IVC, veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
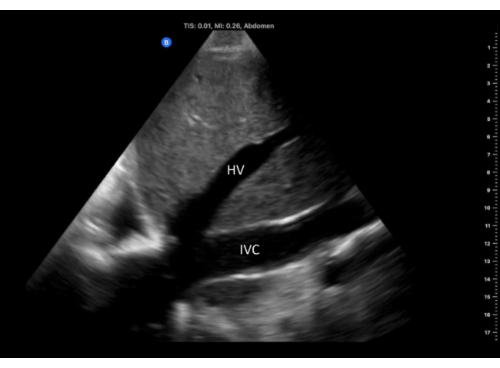
Figure 6 : Vue longitudinale de la VCI avec la veine hépatique qui s’y déverse, photographiée à partir de la fenêtre du flanc droit. Abréviations : HV, veine hépatique ; IVC, veine cave inférieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 7 : Porte Doppler à ondes pulsées dans la lumière de la veine hépatique avec le traçage d’écoulement. Image avec Doppler couleur activé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Vue longitudinale de la veine porte, photographiée à partir de la fenêtre du flanc droit. Abréviations : PV, nervure porte. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 9 : Porte Doppler à ondes pulsées dans la lumière de la veine porte, avec le tracé du flux ci-dessous. Image avec Doppler couleur activé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
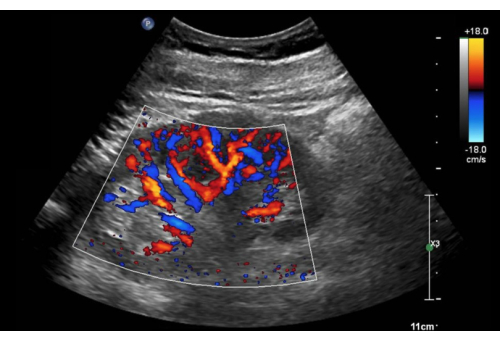
Figure 10 : Vue axiale du rein droit avec le Doppler couleur activé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
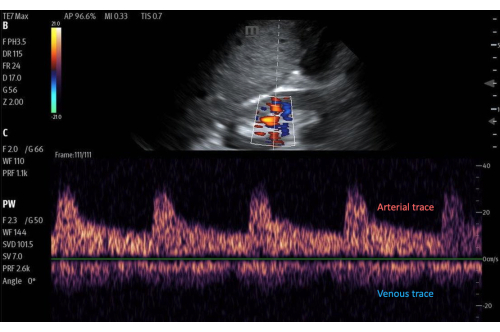
Figure 11 : Porte Doppler à ondes pulsées sur une zone de flux dans le cortex rénal, avec le tracé du flux en dessous. Image avec Doppler couleur activé. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 12 : Différents phénotypes de la veine hépatique Forme d’onde Doppler avec divers degrés de congestion. Cette figure a été réutilisée de Koratala, A.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
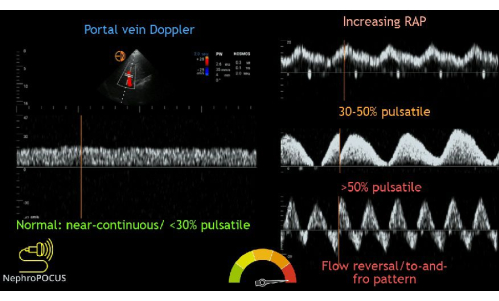
Figure 13 : Différents phénotypes de la forme d’onde Doppler de la veine porte avec divers degrés de congestion. Cette figure a été réutilisée de Koratala, A.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
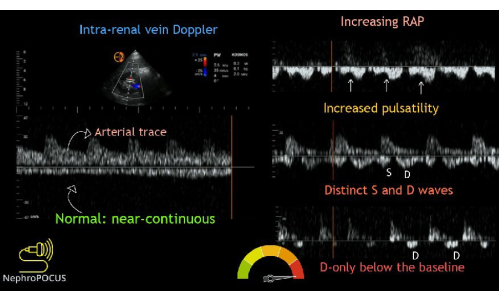
Figure 14 : Différents phénotypes de la veine intrarénale Forme d’onde Doppler avec divers degrés de congestion. Cette figure a été réutilisée de Koratala, A.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 15 : Combinaison des différentes formes d’onde avec une description du système de notation VExUS. Cette figure a été réutilisée de Koratala, A.22. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Étapes critiques
VExUS a été développé chez les patients post-chirurgie cardiaque pour quantifier la congestion veineuse de manière non invasive, mais l’utilité s’est élargie pour aider à l’évaluation de la congestion veineuse et à l’évaluation de l’état des fluides dans de multiples contextes cliniques. Pour bien réaliser l’examen, plusieurs étapes critiques doivent être prises en compte. Tout d’abord, pour maximiser le rendement diagnostique de l’examen, il faut tenir compte des exigences de l’examen VExUS lors de la sélection d’une sonde et d’un préréglage23. Plus précisément, le rendement de l’examen est maximisé en utilisant une sonde curviligne qui permet le déclenchement de l’ECG. Si la sonde curviligne d’un appareil donné ne permet pas le déclenchement par ECG mais que des fils ECG compatibles sont disponibles, le meilleur choix suivant est une sonde multiélément avec déclenchement par ECG. Cependant, si les fils ECG compatibles avec l’appareil ne sont tout simplement pas disponibles, une sonde curviligne préréglée cardiaque ou abdominale peut être utilisée.
Deuxièmement, il est presque toujours utile de visualiser l’IVC dans les vues à axe long et à court axe. Cela est nécessaire pour exclure le plus précisément possible les patients du protocole. La vue longitudinale de la VCI est notoirement sujette aux erreurs, en particulier pour les échographistes moins expérimentés2. Si l’IVC n’est pas visualisé dans le bon plan, on peut sous-estimer la taille du navire. Pour minimiser les erreurs, sa visualisation dans la vue à court axe peut non seulement vous montrer le diamètre maximal de manière fiable, mais elle peut également aider à différencier la véritable collapsibilité IVC de la pseudo-affabattabilité (c’est-à-dire le mouvement hors plan du récipient11).
Troisièmement, lors de l’obtention de tracés de flux veineux, il est important de maintenir une main de balayage stable une fois que le Doppler PW est activé. Contrairement au Doppler à ondes continues, le Doppler PW utilise une « porte » à partir de laquelle il analyse les signaux ultrasonores d’un endroit spécifique au fil du temps. Une fois le PW Doppler activé, l’image montrée à l’échographiste est une image statique obtenue au moment du lancement du mode PW Doppler. Si l’échographiste ou le patient se déplacent l’un par rapport à l’autre, l’emplacement de la porte changera et modifiera la précision de l’image bidimensionnelle affichée. Ainsi, il est essentiel de maintenir une main de balayage stable une fois que le vaisseau cible est en vue et que le mode PW Doppler est activé. De plus, le fait qu’un patient reste immobile et retienne sa respiration à la fin de l’expiration pendant quelques secondes aide à éliminer les variations respiratoires pendant l’utilisation du PW Doppler.
Enfin, il est important de noter que les examens VExUS sont non seulement utiles pour diagnostiquer la congestion veineuse, mais aussi pour surveiller la réponse au traitement au fil du temps24. L’une des principales utilités de ce système de notation est lorsqu’il est mis en œuvre en série au cours d’une hospitalisation ou d’un traitement pour évaluer l’efficacité des mesures décongestionnantes mises en œuvre.
Modifications et dépannage
Deux aspects de l’examen VExUS qui frustrent souvent les apprenants sont (1) le manque de disponibilité du matériel de déclenchement par ECG et (2) l’incapacité à localiser le flux veineux intrarénal.
Dans le cadre de l’examen VExUS, l’interprétation des trois formes d’onde Doppler extra-cardiaques est améliorée par le déclenchement de l’ECG. De ces trois formes d’onde, le déclenchement par ECG est le plus essentiel pour l’évaluation du flux veineux hépatique12. Le tracé du flux veineux hépatique contient plusieurs vagues, certaines au-dessus et d’autres en dessous de la ligne de base. Ainsi, il est souvent nécessaire d’utiliser le déclenchement par ECG pour identifier si chaque onde est normale ou pathologique et spécifiquement pour déterminer si la vitesse systolique ou diastolique est plus rapide. Mais, en l’absence d’un contrôle ECG, on peut utiliser les données VExUS de la veine non hépatique dans la plupart des cas pour tirer des conclusions sur l’état de la congestion d’un patient. Plus précisément, même si seulement 75 % de l’examen est effectué (IVC, veines portales et intrarénales), dans de nombreux cas, une détermination suffisante peut être faite sur l’état de congestion qui existe chez un patient donné, d’autant plus que seuls 2 modèles de flux gravement anormaux indiquent le grade VExUS maximum de 3. Cependant, une approche sans ECG est plus susceptible de générer des données VExUS non concluantes pour deux raisons : (1) un tracé Doppler de la veine intrarénale sans ECG peut être difficile à interpréter si le signal artériel intra-rénal n’est pas proéminent et (2) pour la veine porte, le déclenchement de l’ECG peut aider à différencier la pulsatilité respiratoire de la pulsatilité cardiaque. Pour ces raisons, l’utilisation d’un portique ECG est préférée dans la mesure du possible.
Deuxièmement, trouver le signal de flux veineux intrarénal peut être difficile25. Si le rein est situé à plus de 16 cm environ de la sonde, une atténuation accrue des ondes ultrasonores pendant leur trajet entre le transducteur et le rein peut entraîner une dégradation du signal Doppler (c’est-à-dire un manque de couleur). Cela peut être amélioré en déplaçant la sonde plus latéralement et postérieurement sur le corps du patient, rapprochant ainsi le rein du transducteur. Si le flux n’est toujours pas visualisé, on peut diminuer l’échelle Doppler afin qu’elle détecte un flux plus lent. Une vitesse d’écoulement comprise entre 12 cm/s et 25 cm/s est généralement suffisante pour visualiser le système vasculaire intrarénal. De plus, on peut également augmenter le gain Doppler pour améliorer la sensibilité au flux, augmentant ainsi le rendement de cette partie du balayage. Lors de l’augmentation du gain, il faut se méfier de la probabilité plus élevée de visualiser un artefact qui pourrait être confondu avec le flux. Le mode Doppler de puissance peut également être utilisé, car il est généralement meilleur pour détecter un débit plus lent. Si, après ces modifications, un échographiste a toujours du mal à trouver du flux dans le rein de droite, il peut essayer le rein controlatéral et mettre en œuvre les mêmes changements de ce côté.
Limitations
Bien que VExUS soit devenu un examen fiable et non invasif pour aider à guider l’évaluation du côté droit du circuit hémodynamique, il présente certaines limites importantes. Tout d’abord, il existe de nombreuses affections pour lesquelles VExUS n’est pas validé, notamment la cirrhose et l’insuffisance rénale terminale (IRT)7. Dans la cirrhose, il y a une altération des pressions dans le foie, en raison du tissu fibreux, qui peut altérer la capacité du tissu hépatique à servir d'« éponge » qui absorbe les pressions cardiaques. Ainsi, le flux veineux hépatique et porte peut être altéré. De plus, il pourrait y avoir des thrombus hépatiques ou de la veine porte qui, encore une fois, pourraient conduire à une mauvaise interprétation de l’écoulement à l’intérieur de ces vaisseaux. De plus, dans l’IRT, les reins deviennent atrophiques avec une diminution du flux sanguin, ce qui rend difficile l’interprétation du flux veineux rénal. Pourtant, malgré ces limites, il existe des rapports de cas démontrant que VExUS pourrait potentiellement avoir de la valeur même chez les patients atteints de cirrhose26 et/ou d’insuffisance rénaleterminale 27, servant de méthode pour surveiller le traitement de la congestion veineuse au fil du temps.
Deuxièmement, il est important de noter que VExUS est encore un nouveau protocole pour estimer la congestion veineuse, et donc, certaines données suggèrent que ce n’est pas la façon la plus fiable ou la plus utile d’estimer la congestion veineuse. Dans une étude observationnelle de 2023 publiée dans le Journal of Critical Care, Andrei et al. ont montré que dans une cohorte de patients en soins intensifs, il n’y avait pas d’association significative entre les scores VExUS et l’IRA ou la mortalité à 28 jours28. Il s’agissait d’une petite cohorte ; Cependant, la prévalence globale de la congestion veineuse modérée à sévère était faible. Dans un groupe présentant une prévalence plus élevée de congestion veineuse, comme les patients atteints de syndrome cardiorénal, Islas-Rodriguez et coll.29 ont montré que si l’utilisation de VExUS pour guider la décongestion aidait à atteindre cet objectif, elle n’augmentait pas la probabilité de récupération de la fonction rénale.
Troisièmement, il n’y a pas de consensus sur l’interprétation de VExUS chez les patients présentant une dysfonction ventriculaire droite préexistante et/ou une régurgitation tricuspide importante. Conceptuellement, il semble raisonnable d’utiliser VExUS comme moniteur de tendances chez de tels patients pour tenter de différencier le dysfonctionnement de l’échec de la circulation cardiaque droite. Cependant, nous n’avons connaissance d’aucune étude à ce jour qui ait validé ce concept.
Quatrièmement, VExUS exclut les patients dont le diamètre est inférieur à 2,0 cm d’avant à arrière, ce qui peut manquer de congestion veineuse chez les patients ayant un petit habitus corporel. En d’autres termes, si une femme de 5 pieds et un homme de 7 pieds ont chacun une VCI de 1,9 cm, ces deux patients sont tous deux exclus du dépistage ultérieur de la congestion veineuse VExUS. Cependant, cela est en contradiction avec d’autres pratiques échocardiographiques qui ont de plus en plus intégré l’indexation à la surface corporelle pour normaliser les mesures échographiques de la taille corporelle30.
Cinquièmement, le protocole VExUS est susceptible de rencontrer des problèmes en cas d’hypertension intra-abdominale (IAH). Dans l’IAH, les patients sont susceptibles d’avoir une petite VCI (<2,0 cm) car une pression intra-abdominale élevée est susceptible de comprimer extrinsèquement le vaisseau31. Cela signifie que la plupart des patients atteints d’HAI seront automatiquement exclus de l’évaluation VExUS ultérieure une fois qu’une petite taille de VCI est détectée. Cependant, l’HAI peut être causée par une congestion veineuse, et une telle congestion serait manquée par VExUS en raison de l’exclusion automatique des patients de petit calibre IVC. De plus, les patients atteints d’IAH, en général, sont probablement de mauvais candidats pour VExUS. En effet, dans l’IAH, il y a compression extrinsèque de toutes les veines intra-abdominales, et les formes d’onde Doppler de ces veines refléteront un équilibre entre la compression extrinsèque et la congestion intra-muros, ce qui rend difficile l’interprétation des formes d’onde Doppler uniquement pour la congestion.
Orientations futures
L’itération actuelle du protocole VExUS peut évoluer avec le temps de plusieurs façons. Tout d’abord, le protocole VExUS actuel ne comprend qu’une seule mesure antéro-postérieure de la VCI obtenue à partir d’une vue longitudinale de la VCI sous-xiphoïde. Cependant, cette vue unique peut être trompeuse, et il existe des preuves qu’une estimation plus robuste de la pression auriculaire droite peut être obtenue en ajoutant une vue IVC à axe court pour mesurer l’indice de sphéricité IVC : rapport entre les diamètres latéral-médial et antérieur-postérieur de la VCI32. Deuxièmement, le protocole VExUS actuel ne mesure que le diamètre maximal de l’IVC et ne prend pas en compte la réduction de l’IVC. Ainsi, le protocole VExUS exclut actuellement les patients ayant une VCI de < = 2 cm de diamètre qui ont néanmoins des VCI non pliables. À l’inverse, le protocole VExUS actuel traite les patients atteints d’une VCI pliable de grande taille (>2 cm) comme ayant un certain degré de congestion veineuse. Des recherches futures sont nécessaires pour déterminer si la réduction de l’IVC doit être utilisée comme critère de sélection pour l’examen VExUS. Troisièmement, les formes d’onde de la veine fémorale peuvent être utiles pour les personnes ayant des difficultés à retenir leur respiration. Le débit Doppler de la veine fémorale (FVD) devrait être continu dans les cas normaux, mais à mesure que la congestion veineuse augmente, le flux devient de plus en plus pulsatile, entraînant des interruptions de débit importantes. La FVD peut s’avérer être une extension utile du protocole VExUS actuel pour permettre l’utilité de cet examen chez une plus grande proportion de patients33. Quatrièmement, il existe des preuves qu’il existe des données similaires sur la congestion veineuse fournies par les mesures de la veine jugulaire interne et la VCI34. Des études futures devraient examiner si les paramètres de la veine jugulaire peuvent se substituer à la VCI dans le protocole VExUS dans des situations où la VCI est difficile à visualiser.
Le protocole VExUS est susceptible d’évoluer à mesure que la technologie des ultrasons intègre davantage de fonctionnalités, en particulier l’apprentissage automatique (ML) et l’intelligence artificielle (IA)35. L’intégration ML/AI dans le matériel et les logiciels d’échographie devrait permettre d’automatiser de nombreux aspects du protocole VExUS qui nécessitent actuellement beaucoup de main-d’œuvre. Par exemple, certaines machines existantes sont déjà capables de mesurer automatiquement la réductibilité IVC et devraient, en principe, un jour être également en mesure de mesurer la sphéricité IVC.
De plus, il serait très avantageux pour les appareils à ultrasons d’offrir une technologie de contrôle d’ECG virtuel assisté par l’IA, car de nombreux appareils à ultrasons au point de service manquent actuellement de câbles d’ECG physiques. Cela aiderait grandement les cliniciens à interpréter les modèles de flux dans la veine hépatique en l’absence de capacités de déclenchement de l’ECG.
Enfin, l’intelligence artificielle qui obtient automatiquement le traçage Doppler à ondes pulsées d’un vaisseau cible peut aider à aplatir la courbe d’apprentissage déjà assez abrupte qui existe pour VExUS36. Cette technologie existe déjà pour l’estimation du débit cardiaque en obtenant automatiquement la mesure intégrale de la vitesse du conduit d’écoulement du VG (LVOT VTI), de sorte que son extension aux vaisseaux hépatiques, portals et intrarénaux n’est pas hors de portée à ce stade de la technologie des ultrasons.
En résumé, l’évaluation du circuit hémodynamique avec POCUS est vitale dans la prise en charge des patients gravement malades37. Cependant, en raison d’un manque de formation standardisée en acquisition et en interprétation d’images, VExUS reste sous-utilisé. Cette revue présente un cadre pour l’acquisition et l’interprétation d’images d’examen VExUS à partir d’un groupe de médecins englobant une variété de spécialités. À son tour, ce protocole peut être utilisé pour enseigner et apprendre VExUS afin d’améliorer la capacité des cliniciens à évaluer la congestion veineuse et à surveiller son traitement au fil du temps.
Déclarations de divulgation
Le BSJ déclare avoir reçu des honoraires de l’American Society of Anesthesiologists pour son travail du comité de rédaction sur l’échographie au point de service et de OpenAnesthesia.org pour la création de contenu éducatif lié au POCUS. Les autres auteurs n’ont aucune divulgation.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| 5500P Ultrasound System | Philips | HC795143 | Used to obtain a subset of the Figures and Videos |
| Affiniti 70 Ultrasound System | Philips | HC795210 | Used to obtain a subset of the Figures and Videos |
| Curvilinear Transducer (C1-5-D) | GE | 5409287-R | 1-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-1) | Philips | HC989605412041 | 2-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-1) | SonoSite | https://www.sonosite.com/products/ultrasound-transducers/c5-1 | 1-5 MHz, also called the abdominal probe |
| Curvilinear Transducer (C5-2s) | Mindray | https://lysis.cc/products/mindray-c5-2s | 1-5 MHz, also called the abdominal probe |
| Edge 1 Ultrasound Machine | SonoSite | Used to obtain a subset of the Figures and Videos | |
| Handheld Probe (Butterfly iQ3) | Butterfly | https://www.butterflynetwork.com/iq3?srsltid=AfmBOorvY6WqHGbdeWW gtefztEJa8pt_xbwSOc6hQuB2s-Kb0wRlsCLR | Used to obtain a subset of the Figures and Videos |
| LOGIQ P9 Ultrasound System | GE | H42752LS | Used to obtain a subset of the Figures and Videos |
| Lumify Handheld Ultrasound | Philips | Used to obtain a subset of the Figures and Videos | |
| Phased-Array Transducer (3Sc-D) | GE | https://services.gehealthcare.in/gehcstorefront/p/5863286 | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (P4-2s) | Mindray | https://lysis.cc/products/mindray-p4-2s | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (P5-1) | SonoSite | https://www.sonosite.com/in/products/ultrasound-transducers/p5-1 | 1-5 MHz, also called the cardiac probe |
| Phased-Array Transducer (S4-1) | Philips | HC989605389271 | 1-5 MHz, also called the cardiac probe |
| TE7 Max Ultrasound System | Mindray | https://www.mindray.com/na/products/ultrasound/point-of-care/te-series/te-7-max-portable-ultrasound-machine/ | Used to obtain a subset of the Figures and Videos |
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon