Method Article
Modellazione dell'idrocefalo postemorragico del prematuro nei ratti
In questo articolo
Riepilogo
L'idrocefalo postemorragico del prematuro (PHHP) può essere modellato nei ratti neonatali combinando corioamnionite ed emorragia intraventricolare. La combinazione di questi eventi prenatali e postnatali ricapitola accuratamente i segni clinici distintivi della PHHP, tra cui macrocefalia, ventricolomegalia ed elevata pressione intracranica, per tutta la durata della vita.
Abstract
L'idrocefalo postemorragico del prematuro (PHHP) è una grave sequela di grave emorragia intraventricolare (IVH) nei neonati molto prematuri di età gestazionale (GA) di età inferiore alle 32 settimane. La PHHP è definita dall'accumulo di liquido cerebrospinale (CSF) associato a sintomi clinici di pressione intracranica elevata (ICP). I neonati con PHHP soffrono di dipendenza dallo shunt per tutta la vita, con la metà che richiede un intervento chirurgico ripetuto nel primo anno di vita e molti che richiedono più interventi chirurgici aggiuntivi nel corso della vita. La corioamnionite prenatale predispone i neonati prematuri a una grave IVH e alla necessità di un trattamento chirurgico delle tendenze della PHHP con sepsi neonatale. Queste caratteristiche cliniche suggeriscono che l'infiammazione sistemica è una componente integrante della fisiopatologia della PHHP.
Qui, definiamo un modello animale che ricapitola tutti gli aspetti clinici e le caratteristiche essenziali della PHHP nei ratti. L'obiettivo di questo protocollo è illustrare come la corioamnionite in utero e l'IVH postnatale utilizzando globuli rossi lisati possano essere combinate per produrre PHHP. Questo approccio preclinico produce macrocefalia progressiva e crani a cupola, elevata pressione intracranica e ventricolomegalia che possono essere rilevati tramite risonanza magnetica (MRI) o microscopia. Oltre all'interruzione prolungata delle dinamiche del liquido cerebrospinale, i ratti hanno anche ritardo cognitivo e disabilità funzionale nell'età adulta. Di conseguenza, questa piattaforma preclinica facilita studi traslazionali unici e senza precedenti di PHHP che possono incorporare misure di esito molecolari, cellulari, biochimiche, istologiche, di imaging e funzionali. Può anche essere utilizzato per un'analisi rigorosa del plesso coroideo, delle ciglia mobili ependimali e del sistema glinfatico in parallelo. Infine, può anche essere un prezioso strumento preclinico per lo studio di nuove strategie di intervento chirurgico e approcci terapeutici non chirurgici per il trattamento dell'idrocefalo.
Introduzione
L'idrocefalo postemorragico del prematuro (PHHP) rimane un problema sostanziale per la salute pubblica. Definita dall'accumulo sintomatico di liquido cerebrospinale (CSF) concomitante con elevata pressione intracranica (ICP) secondaria a emorragia intraventricolare (IVH), la PHHP è una grave manifestazione di encefalopatia del prematuro e contribuisce in modo significativo al carico globale del prematuro e dell'idrocefalo acquisito 1,2. A livello globale, circa 400.000 neonati ogni anno nascono o acquisiscono il peso permanente dell'idrocefalo3 e molti muoiono a causa della mancanza di trattamento3. La PHHP è comune nei paesi sviluppati nei neonati molto prematuri (<32 settimane di gestazione) con IVH grave e spesso colpisce i neonati più malati che già soffrono di altre comorbilità potenzialmente letali 4,5.
L'unico trattamento disponibile per l'idrocefalo è la chirurgia6. Le procedure chirurgiche producono una migliore longevità quando i neonati hanno più di 6 mesi al momento del primo intervento permanente, sia per uno shunt ventricoloperitoneale (VP) per deviare il liquido cerebrospinale (CSF), sia per la terza ventricolostomia endoscopica (ETV) o per l'ETV con coagulazione del plesso coroideo (ETV-CPC)7. L'opzione più comune, gli shunt VP, spesso fallisce entro un anno e predispone i bambini a una vita di complicazioni, interventi chirurgici ripetuti e ricoveri ospedalieri a un costo enorme per il bambino, la famiglia e la società. 8 In particolare, l'ansia derivante da uno shunt che potrebbe non funzionare in qualsiasi momento è gravosa per le famiglie9. L'assistenza ai bambini con idrocefalo sintomatico, compresi gli interventi chirurgici frequenti, è una delle principali cause di spesa sanitaria pediatrica 10,11,12,13,14. Il costo annuo stimato per le spese relative allo shunt nei bambini era di 2 miliardi di dollari nel 200315. Sebbene i bambini con shunt rappresentino solo lo 0,6% dei ricoveri ospedalieri, generano il 3,1% delle spese ospedaliere pediatriche15. Pertanto, la scoperta di terapie sicure e non chirurgiche per il trattamento della PHHP è fondamentale.
Nei neonati, la PHHP si sviluppa dopo IVH in un decorso clinico che dura settimane o mesi dopo l'identificazione iniziale dell'emorragia cerebrale. Uno studio condotto dall'Hydrocephalus Clinical Research Network (HCRN) ha confermato che gli shunt VP rimangono la migliore opzione chirurgica per i neonati con PHHP16. Anche per i bambini con PHHP nei paesi ad alto reddito con accesso a cure neurochirurgiche pediatriche qualificate, i risultati sono tutt'altro che ottimali, con il >50% degli shunt posizionati nei neonati con PHHP che richiedono una revisione chirurgica entro i primi 2 anni8. Nonostante la chiara necessità di identificare trattamenti più sicuri ed efficaci per la PHHP, la ricerca ha incontrato ostacoli. I progressi sono stati ostacolati in parte dal fatto che la letteratura preclinica sulla PHHP spesso non riesce a distinguere in modo appropriato la ventricolomegalia causata da idrocefalo ex vacuo 17,18 dall'idrocefalo sintomatico con macrocefalia19,20. Infatti, i modelli di sviluppo dell'idrocefalo dovrebbero includere la macrocefalia progressiva e/o la misurazione di ICP1 elevata.
L'unione di intuizioni cliniche e precliniche ha migliorato il disegno dello studio e ha spinto la nostra comprensione di PHHP2. Studi condotti in diversi centri in tutto il mondo hanno dimostrato che l'IVH è più comune nei neonati molto pretermine secondari alla corioamnionite 21,22,23,24,25,26,27,28. Oltre all'infezione e all'infiammazione della placenta, la sepsi neonatale è un ulteriore importante fattore di rischio e può svolgere un ruolo centrale nella progressione dall'IVH alla ventricolomegalia alla PHHP sintomatica e al successivo intervento chirurgico29. I dati preclinici e clinici supportano che l'infiammazione trasmessa per via ematica può causare idrocefalo20 e l'infiammazione sistemica aumenta la secrezione di liquido cerebrospinale da parte del plessocoroideo 30. Inoltre, gli adulti con emorragia subaracnoidea e IVH che soffrono anche di sepsi hanno molte più probabilità di richiedere uno shunt31. La letteratura più recente ha confermato che l'infiammazione riduce la propulsione delle ciglia mobili ependimali del liquido cerebrospinale 19,20,32 e il riassorbimento del liquido cerebrospinale da parte del sistema glinfatico 33,34,35,36. Nel complesso, l'infiammazione sistemica è un fattore fisiopatologico e clinico chiave nella PHHP1.
Considerando questi risultati, abbiamo creato un modello preclinico di PHHP adatto all'età. Questo modello combina l'IVH nel periodo postnatale immediato e precoce con la corioamnionite, la principale causa di parto pretermine19. Questo approccio sperimentale inizia in utero, con l'insufficienza placentare, l'infiammazione placentare e l'infiammazione intraamniotica che definisce la corioamnionite 7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,
23,24,25,26,27,28,29,30,31,32,33,34,35,36,37,38,39,40,41,42,
43,44,45. In particolare, ricapitoliamo una sindrome da risposta infiammatoria fetale, neutrofilia placentare e microambiente proinfiammatorio del SNC nel periodo pretermine tramite laparotomia addominale in madri di ratto gravide al giorno 18 (E18)37,38,39,40,41,42,43,44,45. La lesione intrauterina è indotta da un'occlusione bilaterale temporanea dell'arteria uterina che porta a ipossia-ischemia sistemica transitoria (TSHI) seguita da iniezione intraamniotica di lipopolisaccaride (LPS)37,38,39,40,41,42,43,44,45. Successivamente, per perturbare la dinamica del liquido cerebrospinale e catalizzare lo sviluppo dell'idrocefalo nei cuccioli nati vivi, l'IVH viene indotta il giorno postnatale 1. Ciò si ottiene con l'iniezione intracerebroventricolare bilaterale (ICV) di globuli rossi lisati (RBC) nei ventricoli laterali 19,37,44. I cuccioli vengono quindi studiati durante lo sviluppo dell'idrocefalo e per tutta la loro vita.
Protocollo
L'Animal Care and Use Committee (ACUC) della Johns Hopkins University ha approvato tutte le procedure sperimentali qui descritte. Questo protocollo utilizza madri di ratti Sprague-Dawley gravide e cuccioli di entrambi i sessi.
1. Induzione della corioamnionite su E18
NOTA: La parte relativa all'insulto in utero di questo protocollo è stata precedentemente pubblicata in dettaglio, è riassunta sopra ed è oggetto di un protocollo JOVE separato e di un video 19,37,38,39,40,41,42,43,44,46. In breve, le femmine di ratto Sprague-Dawley gravide vengono sottoposte a laparotomia addominale al giorno embrionale 18 (E18) per indurre la corioamnionite, che include la somministrazione di TSHI e LPS intraamniotico.
- Anestesia
- Indurre l'anestesia nella madre di ratto gravida E18 con isoflurano al 2-4%.
- Rimuovere la madre gravida dalla camera di induzione e posizionare il ratto in posizione supina su una coperta chirurgica drappeggiata di acqua circolante impostata a 37 °C.
- Applicare un unguento oftalmico per prevenire l'essiccazione corneale. Stringere delicatamente una zampa per confermare l'assenza del riflesso di pizzicamento delle dita. Monitorare la profondità dell'anestetico ogni 15-20 minuti e aumentare l'isoflurano in caso di una risposta positiva al pizzicamento delle dita.
- Somministrare buprenorfina a rilascio prolungato (0,1 mg/kg SC) sulla nuca.
- Preparazione chirurgica e scrub
- Utilizzando la tecnica sterile standard, radere l'addome.
- Strofinare l'addome 3 volte con betadina alternata ed etanolo al 70%.
- Avvolgere l'animale con teli chirurgici sterili.
- Laparotomia addominale
- Praticare un'incisione della linea mediana di 3 cm sulla pelle addominale preparata con un bisturi.
- Usa pinze e forbici chirurgiche per sostenere lo strato fasciale addominale e praticare un'incisione della linea alba avascolare dello strato muscolare per accedere alla cavità peritoneale.
- Esternalizzare l'utero.
- Isolare e bloccare le arterie uterine con clip per aneurisma per 60 minuti. Mantenere la temperatura e mantenere il contenuto intraaddominale umido con soluzione fisiologica sterile.
- Rimuovere le clip e iniettare 100 μL di LPS (4 μg/sacca di soluzione di LPS) in ciascun sacco amniotico di ciascun feto. Non disturbare il feto o la placenta.
- Irrigare le corna uterine e il campo generosamente 3 volte con soluzione fisiologica sterile.
- Chiusura della laparotomia
- Sostituire le corna uterine nella cavità peritoneale.
- Riapprossimare i bordi dello strato muscolo-fasciale e chiudere con una sutura 3-0 in esecuzione.
- Riapprossimare lo strato cutaneo e chiudere la pelle utilizzando una sutura 3-0 in esecuzione.
- Utilizzare un ago da 26 G per iniettare per via sottocutanea lo 0,125% di bupivacaina attorno ai bordi della ferita.
- Per i controlli fittizi, eseguire la laparotomia per lo stesso periodo di tempo per controllare la durata dell'anestesia. Non bloccare le arterie e non somministrare iniezioni intraamniotiche. Al termine della procedura, chiudere la laparotomia in due strati (fascia muscolare addominale e cute) utilizzando una sutura 3-0. In tutti i casi, i cuccioli nascono a termine (E21/22) e vengono accuditi dalla madre.
2. Preparazione dei globuli rossi lisati su P1
- Raccolta del sangue
- Prendi un cucciolo di ratto Sprague-Dawley maschio e una femmina al giorno 1 postnatale (P1) da una cucciolata che ha avuto corioamnionite su E18. Decapita rapidamente ogni cucciolo donatore con forbici chirurgiche dedicate.
NOTA: Utilizziamo 1 cucciolo maschio e 1 femmina per la raccolta del sangue per eliminare un potenziale pregiudizio sessuale rappresentando ciascuno nelle coorti di donatori. Inoltre, utilizziamo una coppia di sesso abbinato per garantire un volume e una resa sufficienti di globuli rossi lisati per iniettare i loro compagni di cucciolata. In genere, ogni cucciolo donatore produce abbastanza globuli rossi lisati per eseguire l'iniezione di ICV su un massimo di 4-5 cucciolate. - Raccogliere immediatamente il sangue in una provetta da microcentrifuga da 2 ml contenente 0,2 ml di soluzione fisiologica sterile, facendo attenzione a raccogliere solo il sangue a flusso libero dopo la decapitazione e a non raschiare o spremere per produrre più sangue poiché ciò porta a un'emolisi prematura. Vortice bene.
NOTA: La quantità esatta di sangue varia in base al singolo animale donatore e al peso, ma dovrebbe essere massima mantenendo le precauzioni di cui sopra. - Tritare/tritare i coaguli di sangue con piccole forbici chirurgiche.
- Centrifugare la sospensione ematica a 500 × g per 10 minuti a 4 oC, rimuovere il surnatante e risospendere il pellet in 0,2 mL di soluzione fisiologica sterile. Vortice bene.
- Tritare/tritare i coaguli di sangue residui post vortice con piccole forbici chirurgiche.
- Ripetere i passaggi 2.1.4-2.1.5 altre due volte per un totale di 3x, pulendo le forbici chirurgiche con spray di etanolo al 70% tra un ciclo di lisi e l'altro.
- Prendi un cucciolo di ratto Sprague-Dawley maschio e una femmina al giorno 1 postnatale (P1) da una cucciolata che ha avuto corioamnionite su E18. Decapita rapidamente ogni cucciolo donatore con forbici chirurgiche dedicate.
- Lisi dei globuli rossi
- Dopo la centrifugazione finale, aggiungere 0,25 mL di soluzione fisiologica sterile al pellet; vortice bene.
- Posizionare la sospensione su ghiaccio secco per 5 minuti.
- Togliere la sospensione dal ghiaccio secco, metterla in un'incubatrice a 37,5 oC per 5 minuti fino a completo scongelamento e agitare bene.
- Ripetere i cicli di congelamento e scongelamento per un totale di 3 volte (tre congelamenti e tre scongelamenti).
- Al termine dell'ultimo disgelo, vorticare ed eseguire un giro veloce. I globuli rossi sono ora lisati e pronti per l'uso.
NOTA: La miscela deve essere di un colore opaco simile al succo di pomodoro ed essere facilmente aspirabile nelle siringhe.
3. Iniezioni intracerebroventricolari di globuli rossi lisati su P1
- Anestesia mediante ipotermia
- Metti una piccola piattaforma sul ghiaccio bagnato per raffreddare.
- Metti sopra una salvietta da laboratorio asciutta per proteggere la pelle del cucciolo.
NOTA: Questa superficie piana e fredda viene utilizzata per l'anestetizzazione e l'iniezione dei cuccioli. - Trasferire sul cucciolo (di età P1) dal cuscinetto riscaldante sulla salvietta da lavoro sopra la piattaforma fredda per indurre l'anestesia per ipotermia.
- Confermare la profondità dell'anestesia stringendo una zampa e confermando l'assenza del riflesso di pizzicamento delle dita.
- Impostare una lampada chirurgica esterna sulle impostazioni più luminose.
- Con un assistente che usa l'indice e il medio per mantenere delicatamente la linea mediana della testa dell'animale, transillumina il cranio per visualizzare i ventricoli laterali attraverso il cranio. Identificare la bregma visualizzando il seno sagittale superiore (linea mediana) attraverso la pelle e la palpazione della sutura coronale con una pinza sottile come punti di riferimento intersecanti.
- Iniezione ICV
- Pulisci la testa del cucciolo anestetizzato con un batuffolo di cotone imbevuto di etanolo al 70%.
- Identificare e contrassegnare il sito di iniezione a 1 mm lateralmente dalla sutura sagittale, a metà strada tra lambda e bregma.
- Dopo la visualizzazione, utilizzare una siringa da insulina da 0,3 mL, lunga 8 mm, da 31 G con un ago percutaneo ultrasottile per iniettare 20 μL di globuli rossi lisati nel ventricolo laterale destro. Inserire l'ago verso il basso usando la tecnica a mano libera a una profondità di circa la metà della lunghezza dell'ago e iniettare e rimuovere l'ago lentamente (processo di iniezione e rimozione in circa 10-15 s).
- Lasciare l'ago in posizione per alcuni secondi dopo l'iniezione per evitare la fuoriuscita dei globuli rossi lisati iniettati.
- Ripetere con il ventricolo laterale sinistro e iniettare 20 μL di globuli rossi lisati.
- Posiziona il cucciolo su un tappetino riscaldante impostato a 37,5 oC per riprendersi dall'anestesia.
- Registra il sesso del cucciolo e assegna un identificatore univoco dell'animale.
- Riportare il cucciolo nella gabbia di casa solo dopo il completo recupero sul tappetino riscaldante e aver ripreso conoscenza in modo tale che l'animale possa mantenere in sicurezza la decubito sternale.
- Monitora quotidianamente tutti i cuccioli di ratto per la salute e il benessere.
4. Conferma del successo dell'emorragia intraventricolare bilaterale su P2
- Ecografia della testa
- Per prepararsi all'ecografia della testa, rimuovi i cuccioli di P2 dalla gabbia di casa.
- Posizionare il gel per ultrasuoni sulla sonda per ultrasuoni e posizionare la sonda sopra il cranio.
- Con una pressione estremamente leggera, muovere la sonda per visualizzare i ventricoli. Confermare l'iperecogenicità bilaterale nei ventricoli laterali che rappresentano l'IVH.
5. Conferma dell'esito positivo dell'idrocefalo postemorragico
- Misurazione della distanza intraaurale (IAD), un surrogato della circonferenza cranica, per confermare la macrocefalia
- Per prepararsi alla misurazione, procurarsi un piccolo metro a nastro adatto a misurare la circonferenza della testa, idealmente con designazioni millimetriche chiaramente visualizzate.
- Chiedi a un osservatore mascherato di rimuovere il cucciolo dalla gabbia di casa.
- Tenendo delicatamente il cucciolo, misurare la distanza da un orecchio all'altro (distanza intraaurale, IAD) e registrare il valore in millimetri.
- Ripeti IAD ogni giorno da P1 a P15 e rappresenta graficamente i valori. Traccia in serie l'IAD e misura di nuovo a P21 al momento del trasferimento dei cuccioli in nuove gabbie fisicamente separate dalla madre (che è il punto di tempo standard per lo svezzamento dei cuccioli). Ripetere successivamente IAD ogni 5 giorni a partire da P25 fino a P60.
- Misurazione della pressione di apertura per confermare l'elevata pressione intracranica
- Chiedi a un osservatore mascherato di rimuovere il cucciolo dalla sua gabbia domestica.
- Anestetizzare con 75-100 mg/kg di ketamina intraperitoneale (IP) e 5-10 mg/kg di xilazina IP in preparazione all'eutanasia.
- Controllare la profondità dell'anestesia stringendo una zampa e confermando l'assenza del riflesso del pizzicamento del dito del piede/pedale.
- Inserire un piccolo ago (31 G) collegato a un manometro nello spazio della giunzione cervico-midollare nel liquido cerebrospinale.
- Registrare la pressione di apertura sul manometro.
- Togliete l'ago e decapitate il ratto con delle forbici affilate e procedete con la raccolta dei tessuti.
- Risonanza magnetica (MRI) ex-vivo per la valutazione della ventricolomegalia
- Anestetizzare con 75-100 mg/kg di ketamina intraperitoneale (IP) e 5-10 mg/kg di xilazina IP in preparazione all'eutanasia.
- Controllare la profondità dell'anestesia stringendo una zampa e confermando l'assenza del riflesso del pizzicamento del dito del piede/pedale.
- Perfondere i ratti con soluzione salina tamponata con fosfato (PBS), seguita da paraformaldeide (PFA) al 4% fino a quando non si è ben fissata.
- Rimuovi il cervello e fissa il cervello al 4% di PFA
- Incorporare il cervello in agarosio al 2% in una provetta conica da 50 mL. Lasciate riposare a temperatura ambiente.
- Trasferire il cervello allo scanner MRI per la risonanza magnetica ex vivo .
- Eseguire la risonanza magnetica 11.7T come segue: T2 Turbo RARO; TE/TR = 30,0/3000 ms; media = 2; Spaziatura dell'eco = 10.000 ms; fattore RARE = 8; numero di fette = 30; spessore fetta = 1 mm; dimensione dell'immagine = 128 x 128; Campo visivo = 28 mm x 28 mm; risoluzione fetta = 0,219 x 0,219 mm2; FA = 90,0°.
NOTA: Sebbene la risonanza magnetica fornisca la prova del successo della modellazione PHHP, non è necessario eseguire la scansione di tutti i cervelli in una determinata coorte per verificare la PHHP. La misurazione IAM e ICP è sufficiente per verificare come descritto sopra. In definitiva, la capacità di un ricercatore di eseguire la risonanza magnetica in vivo o ex vivo dipenderà da una varietà di fattori come l'accesso allo scanner MRI, i fondi e le capacità tecniche. Questo passaggio è particolarmente utile per la convalida quando si incorpora il modello PHHP. È fondamentale notare che in assenza di segni documentati di aumento della pressione intracranica, come un'elevata pressione di apertura, i risultati isolati di ventricolomegalia all'imaging MRI non rappresentano l'idrocefalo.
Risultati
Utilizzando questo modello, l'idrocefalo si sviluppa nei giorni e nelle settimane successive all'iniezione di globuli rossi lisati. Una rappresentazione di un tipico disegno sperimentale e della progressione dell'idrocefalo è fornita nella Figura 1. Sono stati valutati 5-6 animali fittizi e 6-8 animali PHHP per gruppo. Da giovani, i ratti con PHHP mostravano macrocefalia (Figura 2), pressione intracranica elevata (Figura 3) e ventricolomegalia (Figura 4). La costellazione e la combinazione di questi reperti rappresentano l'idrocefalo. Questi ratti hanno anche un ritardo dello sviluppo19 e, da adulti, sopravvivono con difficoltà cognitive persistenti e ICP elevata. I maschi ottengono risultati peggiori delle femmine in questo modello19, che replica lo scenario clinico in cui i maschi sono più inclini a sviluppare l'idrocefalo 3,19. I ricercatori che utilizzano questa piattaforma sperimentale per studiare l'idrocefalo saranno in grado di confermare il completamento con successo della procedura visualizzando la macrocefalia progressiva e un cranio a cupola che si sviluppa nel corso di 5 giorni dopo l'induzione dell'IVH e si mantiene per tutta la durata della vita (Figura 2). La macrocefalia sostenuta è un segno essenziale, clinicamente importante e facilmente identificabile di una procedura di successo. Entro il 21° giorno postnatale (P21), sono quantificabili aumenti statisticamente significativi degli IAD (surrogato della circonferenza cranica utilizzato clinicamente) e della pressione di apertura (Figura 3). Allo stesso modo, la ventricolomegalia e l'aumento del volume ventricolare sono osservabili alla risonanza magnetica e all'istologia rispetto ai controlli fittizi (Figura 4)1,2,19. La quantificazione del volume ventricolare mediante risonanza magnetica strutturale o procedure istologiche standard come la violetta cresilica o la colorazione con ematossilina ed eosina è un eccellente complemento alla diffusione più sofisticata e all'imaging funzionale. Questi dati sono coerenti con le caratteristiche cliniche della PHHP, tra cui la macrocefalia, l'interruzione della dinamica del liquido cerebrospinale che porta all'espansione ventricolare e l'aumento dell'ICP.

Figura 1: Disegno sperimentale. Il protocollo per indurre la PHHP inizia con l'induzione della corioamnionite nei ratti al giorno 18 embrionale (E18) e dell'emorragia intraventricolare al giorno 1 postnatale (P1). L'idrocefalo si sviluppa ed evolve nel corso della vita e può essere valutato con più parametri, compresi i saggi funzionali, fino all'età adulta. Abbreviazioni: PHHP = idrocefalo postitemorragico della prematurità; IVH = emorragia intraventricolare. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Macrocefalia che caratterizza la PHHP. I ratti con PHHP hanno crani ingranditi, a cupola e macrocefalia rispetto ai controlli fittizi. Abbreviazione: PHHP = idrocefalo postemorragico della prematurità. Clicca qui per visualizzare una versione più grande di questa figura.
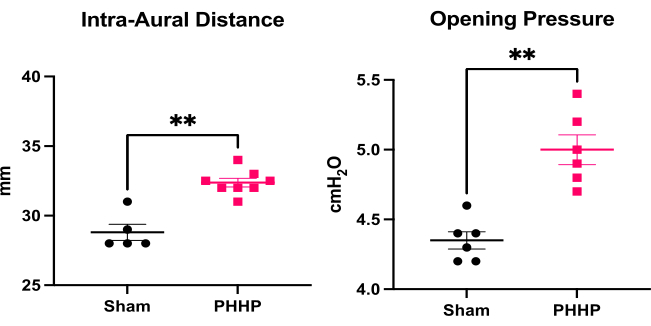
Figura 3: Quantificazione della macrocefalia e dell'elevata pressione intracranica. I ratti con PHHP (n=8) hanno un aumento della distanza intra-aurale (un surrogato della circonferenza della testa) e un aumento della pressione di apertura (pressione intracranica, n=6) il giorno 21 postnatale (P21) rispetto ai controlli fittizi (n=5-6). (T-test **p < 0,01, le barre di errore rappresentano l'errore standard della media). Abbreviazione: PHHP = idrocefalo postemorragico della prematurità. Clicca qui per visualizzare una versione più grande di questa figura.
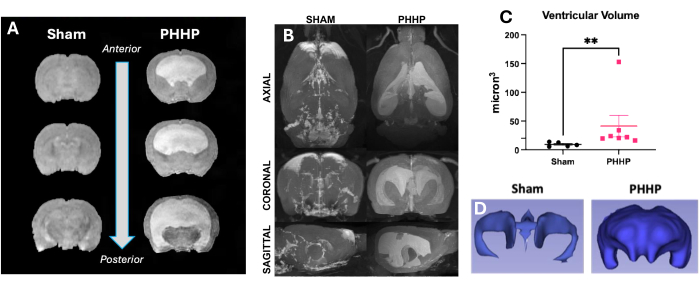
Figura 4: I ratti con PHHP presentano ventricolomegalia moderata-grave. I ratti con PHHP hanno ventricoli allargati e volume ventricolare aumentato rispetto ai controlli fittizi chiaramente identificabili alla risonanza magnetica. (A) L'imaging strutturale T2 mostra una dilatazione ventricolare nel piano coronale da anteriore a posteriore a P21. (B) Gli aumenti del volume ventricolare nei ratti PHHP rispetto agli animali fittizi sono visibili anche nei piani assiale, coronale e sagittale nei ratti adulti a P60. I volumi ventricolari possono essere quantificati utilizzando (C) la risonanza magnetica (n=5-7/gruppo) e abbinati alla (D) ricostruzione 3D del sistema ventricolare a qualsiasi età. (T-test **p < 0,01, le barre di errore rappresentano l'errore standard della media). Abbreviazione: PHHP = idrocefalo postemorragico della prematurità. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo protocollo per l'induzione della PHHP consente misure di esito rigorose, quantificabili e clinicamente traducibili della struttura e della funzione cerebrale in concomitanza con i segni fenotipici dell'idrocefalo, tra cui l'aumento cronico di ICP, ventricolomegalia e macrocefalia, dalla nascita all'età adulta4. I saggi biochimici, istologici e funzionali possono essere utilizzati per valutare la salute del plesso coroideo, dell'ependima e del sistema glinfatico, nonché della materia grigia e bianca19. Inoltre, questo modello può supportare l'integrazione dell'imaging funzionale del liquido cerebrospinale e delle ciglia a cellule vive con il neuroimaging multimodale e i risultati biocomportamentali. Può anche essere utilizzato per combinare studi meccanicistici che utilizzano la citometria a flusso multiparametrica e saggi dinamici su cellule neurali con l'istologia e l'immunochimica per valutare rigorosamente il microambiente ventricolare. Insieme alle valutazioni digitali dell'andatura e ai test touchscreen della cognizione e della funzione esecutiva 2,19, questo approccio può consentire la valutazione di biomarcatori cellulari, fluidi e neurocomportamentali non precedentemente utilizzati negli studi traslazionali di PHHP.
Per le famiglie di bambini con PHHP, la massima priorità dopo la funzione di shunt duratura è il miglioramento dell'esito cognitivo e la promessa di strategie di trattamento non chirurgiche 47,48,49. Lo sviluppo di farmacoterapie per rispondere a queste esigenze è il primo passo per trasformare la cura dei bambini con PHHP 2,47,48,49. Questo modello preclinico è suscettibile di testare regimi farmacologici e farmaci emergenti. È appropriato per la valutazione di interventi non chirurgici e trattamenti farmacologici progettati per modulare la dinamica del liquido cerebrospinale. Questi farmaci possono essere somministrati attraverso molteplici vie di somministrazione nei ratti (ad esempio, intraperitoneale, endovenosa, sottocutanea, minipompa osmotica) e il loro idrocefalo e ventricolomegalia possono essere tracciati, monitorati e quantificati per tutta la durata della vita utilizzando l'imaging e i segni clinici. È inoltre possibile analizzare molteplici aspetti della salute del cervello, tra cui il volume ventricolare, la perdita di sostanza bianca e la connettività funzionale. L'istologia, l'immunoistochimica, la qPCR e gli esperimenti associati possono essere eseguiti su raccolte di tessuti da regioni specifiche e da endpoint evolutivi distinti. Questa piattaforma per lo studio nei ratti può anche facilitare lo studio delle condizioni di comorbilità associate all'idrocefalo, tra cui la paralisi cerebrale, l'epilessia e il dolore cronico4.
La mortalità in questo modello è del 3-7% e si verifica più frequentemente nelle prime 48 ore dopo l'IVH19,44. Occasionalmente, i cuccioli di ratto non riescono ad aumentare di peso e a nutrirsi in modo efficace. Questa mancata crescita può essere il risultato diretto di una macrocefalia progressiva associata a una procedura di successo o di un'emorragia corticale/sottocorticale causata da una scarsa tecnica di iniezione di ICV. In assenza della necessaria precisione, si può osservare infarto emorragico corticale o trauma della base cranica. L'assistenza postnatale può essere interrotta dagli interventi prenatali o postnatali descritti poiché i cuccioli sono notevolmente diversi dai controlli fittizi per quanto riguarda la forma della testa, le dimensioni del corpo e il comportamento. Un'adeguata tecnica chirurgica e iniettiva, combinata con una competenza neuroanatomica avanzata, è fondamentale per garantire che i risultati rappresentativi di cui sopra siano pienamente realizzati.
Questa piattaforma preclinica richiede l'esecuzione di una laparotomia addominale aperta nei ratti gravidi. Ciò richiede competenze chirurgiche avanzate. Nel periodo postnatale, l'incapacità di iniettare accuratamente i globuli rossi lisati nei ventricoli laterali non comporterà IVH né PHHP e questi ratti non cresceranno per dimostrare macrocefalia progressiva, elevata pressione di apertura o ventricolomegalia. Il comfort con le iniezioni a mano libera e l'anatomia ventricolare dei roditori neonatali è essenziale. In particolare, le fontanelle aperte e i crani relativamente sottili rendono possibile la transilluminazione e facilitano l'identificazione di punti di riferimento neuroanatomici come la bregma e gli aspetti dorsali dei ventricoli laterali necessari per il corretto posizionamento dell'ago. L'IVH unilaterale è possibile se non si accede a entrambi i ventricoli laterali e ciò può produrre macrocefalia transitoria ma non persistente. L'uscita del liquido cerebrospinale dopo l'accesso ventricolare è un indicatore adatto del successo delle iniezioni. Allo stesso modo, l'aspirazione del liquido cerebrospinale nel mozzo dell'ago prima dell'iniezione dei globuli rossi lisati assicura che l'iniettore si trovi nello spazio ventricolare corretto per procedere con l'iniezione. Mentre la ventricolomegalia alla risonanza magnetica può essere presente in assenza di idrocefalo (encefalomalacia), la combinazione di questo reperto, insieme all'elevata pressione di apertura e ai deficit neurocognitivi, rappresenta il successo dell'esecuzione della tecnica PHHP.
L'analisi del successo procedurale può essere accertata confrontando le metriche rappresentative di cui sopra tra i cuccioli sottoposti a iniezione ICV di globuli rossi lisati e cuccioli fittizi o nei cuccioli sottoposti a iniezione di ICV rispetto ai cuccioli di controllo che hanno manifestato corioamnionite ma non iniezione ICV di globuli rossi lisati. È importante sottolineare che le madri fittizie subiscono esposizione all'isoflurano, nonché alla laparotomia e all'esternalizzazione uterina. A differenza del modello PHHP, tuttavia, le sacche amniotiche e l'utero vengono poi restituiti alla cavità addominale e la laparotomia completata senza occlusione dell'arteria uterina o iniezione di LPS. I cuccioli nati da queste finte madri in genere non ricevono iniezioni di globuli rossi lisati poiché è la combinazione specifica di TSHI + LPS in utero (che i feti fittizi non sperimentano) seguita da IVH che porta alla PHHP. Inoltre, avendo controlli abbinati per età e sesso che non sono esposti né a TSHI+LPS né a IVH, siamo in grado di convalidare il successo tecnico del modello e confrontare più direttamente i risultati delle coorti PHHP che hanno ricevuto l'intervento con i risultati delle loro controparti fittizie. Questo confronto consente di testare l'efficacia sia del modello che di qualsiasi intervento terapeutico in esso contenuto.
Nonostante le competenze tecniche richieste, questo modello è vantaggioso rispetto ad altri modelli di IVH precoce e idrocefalo perché è adatto all'età, incorpora l'infiammazione sistemica, ha sequele di PHHP in evoluzione fino all'età adulta e offre l'opportunità di valutare misure di esito traslazionali come sofisticati test funzionali e neuroimaging 30,50,51,52. Produce anche ventricolomegalia sostenuta e ICP elevata. L'uso di globuli rossi lisati aumenta la rilevanza traslazionale di questo modello. Ai neonati prematuri che soffrono di IVH viene rilasciato sangue intero nei ventricoli. Questo sangue rimane nel sistema liquorale ventricolare e si degrada nel corso di settimane (lisi dei globuli rossi) portando a una risposta infiammatoria persistente nei ventricoli, comunemente vista all'ecografia della testa di routine come iperecogenicità ependimica53,54. L'uso di globuli rossi lisati corrobora e sostanzia il lavoro precedente che valuta l'efficacia dei singoli prodotti / componenti del sangue nella creazione di idrocefalo e ventricolomegalia sostenuta55. A differenza dei globuli rossi impaccati, l'iniezione intraventricolare di globuli rossi lisati provoca un allargamento significativo dei ventricoli alla risonanza magnetica 24 ore dopo l'iniezione e oltrele 19,55. È stato riscontrato che l'iniezione di globuli rossi lisati sovraregola i livelli di emossigenasi-1 cerebrale e ferritina nello spazio periventricolare rispetto all'iniezione di globuli rossi concentrati o soluzione salina55. Questo è importante in quanto la fisiopatologia dell'IVH umana è in gran parte dovuta alla degradazione del sangue iniziale e al rilascio graduale di prodotti di degradazione del ferro e di altri componenti del sangue in concomitanza con il conseguente danno tissutale.
L'eme-ossigenasi 1 è un enzima importante nella degradazione dell'eme e la ferritina è una proteina di stoccaggio del ferro; pertanto, la loro maggiore concentrazione periventricolare dopo l'iniezione di globuli rossi lisati si allinea strettamente con l'eziologia dell'IVH umana. Infine, l'iniezione di ferro solo negli spazi ventricolari trascura altri componenti dei globuli rossi come l'anidrasi carbonica 29. Inoltre, l'iniezione di ferro non massimizza la potenziale gravità dell'IVH indotta, che è direttamente correlata alla probabilità di un successivo idrocefalo. Come la scelta di utilizzare i globuli rossi lisati, la logica alla base dell'iniezione di entrambi i ventricoli è quella di aumentare la traduzione. La letteratura clinica mostra un chiaro aumento dell'associazione tra IVH più grave e successiva PHHP. L'introduzione di emorragie bilateralmente in sé e per sé aumenta la gravità dell'IVH, nonché la probabilità di estensione dalla matrice germinale negli spazi ventricolari e la conseguente dilatazione ventricolare, un'altra caratteristica dell'IVH più grave. Inoltre, come descritto sopra, l'iniezione bilaterale consente anche una modalità per valutare la comunicazione del liquido cerebrospinale. Venti microlitri è il volume più basso per ottenere in modo affidabile l'idrocefalo sostenuto e senza un significativo coinvolgimento parenchimale, in modo tale che la mortalità dei cuccioli di ratto diventi una variabile complicante.
In conclusione, l'uso di un modello animale che ricapitola gli aspetti clinici della PHHP, tra cui la macrocefalia progressiva, l'elevata pressione intracranica, la ventricolomegalia e il ritardo cognitivo nell'età adulta, aggiunge rigore al campo e facilita studi unici e senza precedenti necessari per nuovi approcci terapeutici e una migliore comprensione meccanicistica della complessa fisiopatologia di questa forma comune di lesione cerebrale perinatale.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori sono grati per i finanziamenti forniti dal National Institutes of Health (R01HL139492), dal Congressionally Directed Medical Research Program (W81XWH1810166, W81XWH1810167, W81XWH2210461 e W81XWH2210462), dall'Hydrocephalus Association e dal Rudi Schulte Research Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Pharmco | 111000200 | Diluted to 70% |
| Betadine surgical scrub | Cardinal Health | NDC-67618-151-17 | |
| Blunt Forceps | Roboz | RS-8100 | |
| Bravmini Plus Cordless Rechargeable Trimmer | Wahl | 41590-0438 | |
| Carbon Steel Surgical blades | Bard-Parker | 371151-11 | |
| centrifuge | Eppendorf | 5424R | |
| Cotton Gauze Sponge | Fisherbrand | 22-362-178 | Small, 6 inch sterile |
| Cotton-tipped Applicators | Fisherbrand | 23-400-114 | 30 G 1 |
| Eye Lubricant | Refresh Lacri Lube | 75929 | |
| Far infrared warming pad | Kent scientific | RT-0501 | |
| Incubator - Genie Temp-Shaker 100 | Scientific Industries | SI-G100 | |
| Insulin Syringes | BD | 328438 | 0.3 cc 3 mm 31 G, ultrafine |
| Isoflurane | Covetrus | 11695067772 | |
| Ketamine hydrochloride injection | Dechra | 17033-101-10 | |
| Kimwipes | Kimtech Science | BXTNI141300 | |
| LPS 011B4 | Sigma | L2630 | |
| microcentrifuge tubes | Thermo Fisher Scientific | 3453 | 2.0 mL |
| Needle | BD | 305122 | 1 mL |
| Needle | BD | 305128 | 25 G 5/8 |
| Needle Holders | Kent Scientific Corp. | INS14109 | 12.5 CM STR |
| OR Towels | Cardinal Health | 287000-008 | |
| Paper measuring tape | Cardinal Health | SKU | |
| Saline Solution, 0.9% | Sigma | S8776 | |
| Scissors | Roboz | RS-6808 | |
| SomnoSuite | Kent Scientific | SS6823B | |
| Sterile Alcohol Prep Pads | Fisherbrand | 06-669-62 | Sterile |
| Surgical gloves | Biogel | 40870 | |
| Surgical Scissors | Roboz | RS-5880 | |
| Surgical Scissors | EST | 14002-16 | |
| Syringe | BD | 309628 | |
| T/Pump (Heat Therapy Pump) | Stryker Medical | TP700 | |
| Vessel Clips | Kent Scientific Corp. | INS14120 | 30 G Pressure |
| Xylazine injection | vet one | NDC 13985-704-10 |
Riferimenti
- Sevensky, R., Newville, J. C., Tang, H. L., Robinson, S., Jantzie, L. L. Cumulative damage: Cell death in posthemorrhagic hydrocephalus of prematurity. Cells. 10 (8), 1911 (2021).
- Robinson, S., Jantzie, L. L. Pathogenesis of posthemorrhagic hydrocephalus of prematurity: New horizons. Semin Perinatol. 46 (5), 151596 (2022).
- Dewan, M. C., et al. Global hydrocephalus epidemiology and incidence: systematic review and meta-analysis. J Neurosurg. 130 (4), 1065-1079 (2018).
- Robinson, S. Neonatal posthemorrhagic hydrocephalus from prematurity: pathophysiology and current treatment concepts. J Neurosurg Pediatr. 9 (3), 242-258 (2012).
- Gigi, M., Roth, J., Eshel, R., Constantini, S., Bassan, H. Health-related quality of life after post-haemorrhagic hydrocephalus in children born preterm. Dev Med Child Neurol. 61 (3), 343-349 (2019).
- Muir, R. T., Wang, S., Warf, B. C. Global surgery for pediatric hydrocephalus in the developing world: a review of the history, challenges, and future directions. Neurosurg Focus. 41 (5), E11 (2016).
- Kulkarni, A. V., et al. Endoscopic third ventriculostomy and choroid plexus cauterization in infant hydrocephalus: a prospective study by the Hydrocephalus Clinical Research Network. J Neurosurg Pediatr. 21 (3), 214-223 (2018).
- Riva-Cambrin, J., et al. Risk factors for shunt malfunction in pediatric hydrocephalus: a multicenter prospective cohort study. J Neurosurg Pediatr. 17 (4), 382-390 (2016).
- Agajany, N., et al. The impact of neonatal posthemorrhagic hydrocephalus of prematurity on family function at preschool age. Early Hum Dev. 137, 104827 (2019).
- Berry, J. G., et al. Characteristics of hospitalizations for patients who use a structured clinical care program for children with medical complexity. J Pediatr. 159 (2), 284-290 (2011).
- Berry, J. G., et al. Hospital utilization and characteristics of patients experiencing recurrent readmissions within children's hospitals. JAMA. 305 (7), 682-690 (2011).
- Berry, J. G., et al. Trends in resource utilization by children with neurological impairment in the United States inpatient health care system: a repeat cross-sectional study. PLoS Med. 9 (1), e1001158 (2012).
- Drake, J. M., et al. Randomized trial of cerebrospinal fluid shunt valve design in pediatric hydrocephalus. Neurosurgery. 43 (2), 294-303 (1998).
- Simon, T. D., et al. Cerebrospinal fluid shunt infection: Emerging paradigms in pathogenesis that affect `prevention and treatment. J Pediatr. 206, 13-19 (2019).
- Simon, T. D., et al. Hospital care for children with hydrocephalus in the United States: utilization, charges, comorbidities, and deaths. J Neurosurg Pediatr. 1 (2), 131-137 (2008).
- Riva-Cambrin, J., et al. Predictors of success for combined endoscopic third ventriculostomy and choroid plexus cauterization in a North American setting: a Hydrocephalus Clinical Research Network study. J Neurosurg Pediatr. 24 (2), 128-138 (2019).
- Emmert, A. S., et al. Characterization of a novel rat model of X-linked hydrocephalus by CRISPR-mediated mutation in L1cam. J Neurosurg. 132 (3), 945-958 (2019).
- Strahle, J. M., et al. Role of hemoglobin and iron in hydrocephalus after neonatal intraventricular hemorrhage. Neurosurgery. 75 (6), 696-705 (2014).
- Robinson, S., et al. Extended combined neonatal treatment with erythropoietin plus melatonin prevents posthemorrhagic hydrocephalus of prematurity in rats. Front Cell Neurosci. 12, 322 (2018).
- Yung, Y. C., et al. Lysophosphatidic acid signaling may initiate fetal hydrocephalus. Sci Transl Med. 3 (99), 99ra87 (2011).
- Moscuzza, F., et al. Correlation between placental histopathology and fetal/neonatal outcome: chorioamnionitis and funisitis are associated to intraventricular haemorrage and retinopathy of prematurity in preterm newborns. Gynecol Endocrinol. 27 (5), 319-323 (2011).
- Salas, A. A., et al. Histological characteristics of the fetal inflammatory response associated with neurodevelopmental impairment and death in extremely preterm infants. J Pediatr. 163 (3), 652-657 (2013).
- Arayici, S., et al. The effect of histological chorioamnionitis on the short-term outcome of preterm infants ≤32 weeks: a single-center study. J Matern Fetal Neonatal Med. 27 (11), 1129-1133 (2014).
- Shankaran, S., et al. Maternal race, demography, and health care disparities impact risk for intraventricular hemorrhage in preterm neonates. J Pediatr. 164 (5), 1005-1011.e3 (2014).
- Lu, H., Wang, Q., Lu, J., Zhang, Q., Kumar, P. Risk factors for intraventricular hemorrhage in preterm infants born at 34 weeks of gestation or less following preterm premature rupture of membranes. J Stroke Cerebrovasc Dis. 25 (4), 807-812 (2016).
- Stark, M. J., Hodyl, N. A., Belegar, V. K., Andersen, C. C. Intrauterine inflammation, cerebral oxygen consumption and susceptibility to early brain injury in very preterm newborns. Arch Dis Child Fetal Neonatal Ed. 101 (2), F137-F142 (2016).
- Lee, J., et al. A new anti-microbial combination prolongs the latency period, reduces acute histologic chorioamnionitis as well as funisitis, and improves neonatal outcomes in preterm PROM. J Matern Fetal Neonatal Med. 29 (5), 707-720 (2016).
- Edwards, J. M., Edwards, L. E., Swamy, G. K., Grotegut, C. A. Magnesium sulfate for neuroprotection in the setting of chorioamnionitis. J Matern Fetal Neonatal Med. 31 (9), 1156-1160 (2018).
- Alan, N., et al. Reduced ventricular shunt rate in very preterm infants with severe intraventricular hemorrhage: an institutional experience. J Neurosurg Pediatr. 10 (5), 357-364 (2012).
- Karimy, J. K., et al. Inflammation-dependent cerebrospinal fluid hypersecretion by the choroid plexus epithelium in posthemorrhagic hydrocephalus. Nat Med. 23 (8), 997-1003 (2017).
- Wessell, A. P., et al. A sustained systemic inflammatory response syndrome is associated with shunt-dependent hydrocephalus after aneurysmal subarachnoid hemorrhage. J Neurosurg. 130 (6), 1984-1991 (2018).
- Abdi, K., et al. Uncovering inherent cellular plasticity of multiciliated ependyma leading to ventricular wall transformation and hydrocephalus. Nat Commun. 9 (1), 1655 (2018).
- Goulding, D. S., et al. Neonatal hydrocephalus leads to white matter neuroinflammation and injury in the corpus callosum of Ccdc39 hydrocephalic mice. J Neurosurg Pediatr. 25 (5), 476-483 (2020).
- Hussain, R., et al. Potentiating glymphatic drainage minimizes post-traumatic cerebral oedema. Nature. 623 (7989), 992-1000 (2023).
- Cai, Y., et al. The relationship between inflammation, impaired glymphatic system, and neurodegenerative disorders: A vicious cycle. Neurobiol Dis. 192, 106426 (2024).
- Mogensen, F. L., Delle, C., Nedergaard, M. The glymphatic system (en)during inflammation. Int J Mol Sci. 22 (14), 7491 (2021).
- Jantzie, L. L., Winer, J. L., Maxwell, J. R., Chan, L. A., Robinson, S. Modeling encephalopathy of prematurity using prenatal hypoxia-ischemia with intra-amniotic lipopolysaccharide in rats. J Vis Exp. (105), e53196 (2015).
- Kitase, Y., et al. Chorioamnionitis disrupts erythropoietin and melatonin homeostasis through the placental-fetal-brain axis during critical developmental periods. Front Physiol. 14, 1201699 (2023).
- Maxwell, J. R., Denson, J. L., Joste, N. E., Robinson, S., Jantzie, L. L. Combined in utero hypoxia-ischemia and lipopolysaccharide administration in rats induces chorioamnionitis and a fetal inflammatory response syndrome. Placenta. 36 (12), 1378-1384 (2015).
- Ozen, M., et al. Chorioamnionitis precipitates perinatal alterations of heme-oxygenase-1 (HO-1) homeostasis in the developing rat brain. Int J Mol Sci. 22 (11), 5773 (2021).
- Yellowhair, T. R., et al. CXCR2 blockade mitigates neural cell injury following preclinical chorioamnionitis. Front Physiol. 10, 324 (2019).
- Yellowhair, T. R., et al. Chorioamnionitis in rats precipitates extended postnatal inflammatory lymphocyte hyperreactivity. Dev Neurosci. , 1-11 (2019).
- Yellowhair, T. R., et al. Preclinical chorioamnionitis dysregulates CXCL1/CXCR2 signaling throughout the placental-fetal-brain axis. Exp Neurol. 301 (Pt B), 110-119 (2018).
- Jantzie, L. L., et al. Complex pattern of interaction between in utero hypoxia-ischemia and intra-amniotic inflammation disrupts brain development and motor function. J Neuroinflammation. 11, 131 (2014).
- Jantzie, L. L., et al. Repetitive neonatal erythropoietin and melatonin combinatorial treatment provides sustained repair of functional deficits in a rat model of cerebral palsy. Front Neurol. , 233 (2018).
- Maxwell, J. R., et al. Prenatal alcohol exposure and chorioamnionitis results in microstructural brain injury in a preclinical investigation. Ann Pediatr Res. 4 (1), 1031 (2020).
- Karimy, J. K., et al. Outcomes of the 2019 hydrocephalus association workshop, "Driving common pathways: extending insights from posthemorrhagic hydrocephalus". Fluids Barriers CNS. 20 (1), 4 (2023).
- Jakopin, N. E., et al. Establishing ranked priorities for future hydrocephalus research. J Neurosurg. 139 (2), 492-501 (2022).
- Koschnitzky, J. E., et al. Opportunities in posthemorrhagic hydrocephalus research: outcomes of the Hydrocephalus Association Posthemorrhagic Hydrocephalus Workshop. Fluids Barriers CNS. 15 (1), 11 (2018).
- Strahle, J., et al. Mechanisms of hydrocephalus after neonatal and adult intraventricular hemorrhage. Transl Stroke Res. 3 (Suppl 1), 25-38 (2012).
- Segado-Arenas, A., et al. Cognitive impairment and brain and peripheral alterations in a murine model of intraventricular hemorrhage in the preterm newborn. Mol Neurobiol. 55 (6), 4896-4910 (2018).
- Li, Q., et al. Targeting germinal matrix hemorrhage-induced overexpression of sodium-coupled bicarbonate exchanger reduces posthemorrhagic hydrocephalus formation in neonatal rats. J Am Heart Assoc. 7 (3), e007192 (2018).
- Gaisie, G., Roberts, M. S., Bouldin, T. W., Scatliff, J. H. The echogenic ependymal wall in intraventricular hemorrhage: sonographic-pathologic correlation. Pediatr Radiol. 20 (5), 297-300 (1990).
- Mohammad, K., et al. Consensus approach for standardizing the screening and classification of preterm brain injury diagnosed with cranial ultrasound: A Canadian perspective. Front Pediatr. 618236, (2021).
- Gao, C., et al. Role of red blood cell lysis and iron in hydrocephalus after intraventricular hemorrhage. J Cereb Blood Flow Metab. 34 (6), 1070-1075 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon