Method Article
健康和受伤的肱三头肌形态的测量
摘要
超声成像在临床和研究环境中变得越来越容易获得,一致的方案将有利于研究之间的比较和临床解释。该超声评估方案是评估健康、肌腱病和断裂肌腱中跟腱形态的有效且可靠的方法。
摘要
跟腱损伤会在整个生命周期中发生,会对生活质量和整体健康产生负面影响。跟腱病通常被归类为与梭状肌腱增厚、新生血管形成和间质肌腱变相关的过度使用性损伤。目前的文献表明,从长远来看,这些结构变化与症状和较低的身体活动水平以及症状和下肢功能有关。手术和非手术治疗的跟腱断裂会导致肌腱横截面积 (CSA) 增加和跟腱拉长。这两种结构性结局都具有临床意义,因为较大的 CSA 正向预测功能,而肌腱延长增加预示着跟腱断裂后功能减退。鉴于跟腱损伤相关的结构变化在损伤严重程度和损伤恢复方面的关系,能够可靠、准确地量化跟腱结构至关重要。Silbernagel的团队已经建立了一种有效且可靠的方法,可以有效地评估肱三头肌、腱部肌肉和肌腱结构。在该方案中,B 型肌肉骨骼超声成像用于测量肱三头肌结构,包括跟腱厚度和 CSA、比目鱼肌厚度以及是否存在其他发现(钙化和滑囊炎)。B 模式扩展视野用于测量跟腱长度和腓肠肌解剖学 CSA。最后,使用功率多普勒技术识别肌腱内新生血管形成。肱三头肌结构的量化可以比较四肢之间的比较,以及健康个体和跟腱损伤个体对运动和治疗的纵向变化。迄今为止,该方案已被用于许多研究,并被证明对于理解肌腱结构与损伤发展、严重程度和恢复之间的关系很有价值。随着超声设备变得越来越实惠和便携,鉴于其快速有效的方法,该协议被证明作为一种临床工具很有希望。
引言
跟腱起源于腓肠肌和比目鱼肌的肌腱连接处,并插入跟骨后部。跟腱主要由密集堆积、有组织的胶原组织组成,这些胶原组织以分层方式排列,以最大限度地提高抗拉强度1。尽管跟腱能够承受重力,但跟腱在整个人的一生中都容易受到多种类型的伤害。这些损伤,如跟腱病和跟腱断裂,通常伴有肱三头肌和周围组织结构的变化。在跟腱病中,患者常表现出梭状肌腱增厚、肌腱变性、胶原蛋白紊乱和新生血管形成,这是血管和神经组织增殖到肌腱的过程2。此外,与跟腱病相关的病理变化包括副腱炎、肌腱内和/或肌腱内钙化以及滑囊炎 2,3。跟腱断裂后,无论治疗如何,结构变化都很常见,包括跟腱增厚和肌腱长度增加 4,5。此外,肌肉变化,如肱三头肌、肱三头肌、肌肉萎缩,也通常与跟腱损伤有关 5,6。
评估肱三头肌和周围组织结构的能力为了解结构完整性、组织质量和大小提供了有价值的见解,已知这些与症状、功能和预后有关 4,7,8,9。超声成像是这些结构的可靠且有效的评估工具,包括但不限于跟腱长度10、厚度 10,11、横截面积 (CSA)12、腓肠肌解剖学 CSA13 和新生血管形成14,15。对这些措施的评估为理解健康的肱三头肌组织以及量化结构改变以评估损伤风险、严重程度和恢复以及理解健康组织质量提供了宝贵的见解16.
尽管超声成像在评估肱三头肌结构方面具有临床和研究效用,但临床和研究在成像技术和测量参数方面往往存在差异17,18。因此,研究之间的比较是困难的。因此,本方法论文的目的是描述一种有效且可靠的协议,用于使用肌肉骨骼超声成像有效评估肱三头肌、肱三头肌和肌腱结构。该协议旨在证明将该工具全部或作为健康和受伤个体的特定部分纳入研究和临床环境的可行性。此外,还提供了健康和受伤肱三头肌的代表性值。
研究方案
以下协议遵循大学机构审查委员会制定并已批准的指导方针,以确保安全和合乎道德的人体研究。所有受试者都对参与研究和数据传播提供了知情同意。训练有素的超声医师大约需要 20 分钟才能完成完整的方案。但是,可以根据评估需求进行单独测量。
1.皮肤标记
- 要求参与者坐在底座的末端,双腿悬在桌子上。
- 在双侧触诊并标记胫骨内侧平台和内踝最远端。测量同侧标记之间的距离以确定胫骨长度。
- 计算胫骨长度的 25%。测量并标记从胫骨内侧平台远端的这个距离,以指示腓肠肌测量的位置(图1)。
- 计算胫骨长度的 30%。测量并标记该距离,从内踝最远端开始,以指示比目鱼肌测量的位置(图1)。
- 记录 25% 和 30% 的胫骨长度,以便在未来的评估中纵向测量同一位置。
- 要求参与者在底座上做出俯卧姿势,膝盖完全伸展,双脚放松地垂在底座边缘,脚踝处于休息位置(图 2)。
- 将腓肠肌和比目鱼肌标记转移到小腿的后侧。触诊并标记腓肠肌的中点(两个肌肉腹部之间的最远端点)。要求参与者轻轻地进行足底屈曲以抵抗手动阻力以触诊该位置。

图 1:皮肤测量标记。 胫骨长度的测量方法是从胫骨内侧平台到内踝最远端的距离。比目鱼肌厚度是在内踝最远端(蓝色标记)近端近端胫骨长度的 30% 处测量的。腓肠肌 CSA 在胫骨内侧平台远端胫骨长度的 25%(红色标记)处测量。 请点击这里查看此图的较大版本.
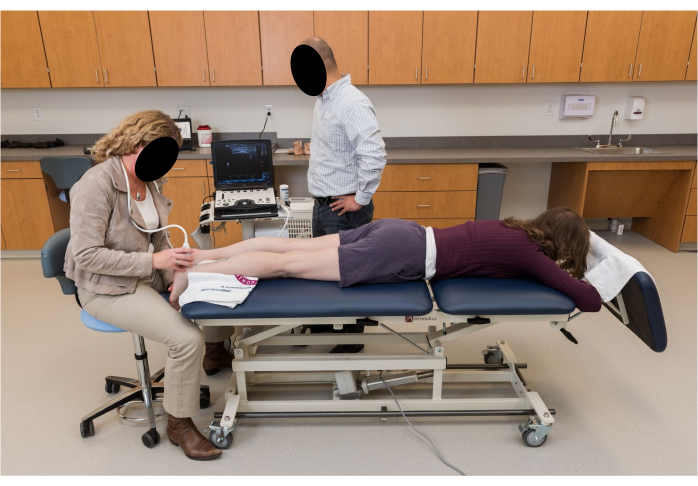
图 2:超声成像的参与者定位。 参与者俯卧,膝盖完全伸展,双脚放松地垂下,脚踝休息,远离底座边缘。 请点击这里查看此图的较大版本.
2. 超声成像
注意:所有图像都将在双腿上拍摄。所有图像都应沿跟腱中线拍摄。通过触诊跟腱的内侧和外侧边界来确定中线位置。
- 使用 B 型超声和 5 cm 线性阵列换能器,并设置参数以可视化肱三头肌。将频率设置为 10 MHz,将测量深度设置为 3.5 厘米,以便进行可视化。在 0.75 cm 和 1.75 cm 之间调整焦点,增益调整为 49,以获得最佳的组织可视化效果。
注意:深度、焦点和增益可以根据可视化情况进行调整。 - 将超声凝胶放在跟骨后部。将探头放在长轴上,观察近端跟骨切迹,并将切迹与超声探头的中点对齐。在皮肤上标记此位置(图3)。
- 用于测量跟腱厚度和 CSA 的皮肤标记将因参与者而异。使用以下准则来确定此位置。
- 对于健康个体,从跟骨切迹近端测量 2 厘米,并在皮肤上标记该位置。
- 对于跟腱病患者,用超声探头在长轴上观察跟腱最厚的部分,并在皮肤上标记该位置。在未来的评估中,记录该标记与跟骨切迹的距离,纵向测量同一位置。
- 对于没有可见梭状增厚的跟腱病患者,在触诊时在大多数肌腱疼痛的位置标记皮肤。记录该标记与跟骨切口近端的距离,以便在将来的评估中纵向测量同一位置。
- 对于跟腱断裂后的个体,使用超声探头在长轴上观察断裂的位置,并在皮肤上标记该位置。记录该标记与跟骨切口近端的距离,以便在将来的评估中纵向测量同一位置。
- 对于未受累的肢体,使皮肤在与受累肢体近端跟骨切迹的距离处做标记。
- 腓肠肌肌腱长度(全肌腱长度):使用扩展的视野并将探头保持在长轴上,通过观察跟腱插入来开始在跟骨处成像。将探头沿跟腱的中线向近端滑向腓肠肌中点的标记,直到看到肌腱交界处。这将结束图像。拍摄跟腱全长的三张图像(图4)。
- 比目鱼肌腱长度(游离肌腱长度):使用扩展的视野并将探头保持在长轴上,通过观察跟腱插入来开始在跟骨处成像。将探头沿跟腱的中线向比目鱼肌处的标记近端滑动,直到看到比目鱼肌强腱交界处。拍摄跟腱游离长度的三张照片。
- 跟腱厚度:使用 B 模式视图,将探头放在为跟腱厚度和 CSA 制作的皮肤标记的长轴上(步骤 2.3)。拍摄跟腱厚度的三张图像。
- 跟腱横截面积:使用 B 模式视图,在针对跟腱厚度和 CSA 制作的皮肤标记上放置凝胶支架垫(步骤 2.3)。将探头放在短轴上,拍摄跟腱横截面的三张图像。
注意:肌腱具有各向异性质量;根据声波的角度,它会反射回来,使其看起来很亮,或者反射掉,使其看起来很暗(图5)。因此,来回切换探头将有助于观察肌腱的边界。 - 比目鱼肌厚度:使用 B 模式视图,将探头放在为比目鱼肌制作的皮肤标记的长轴上(胫骨长度的 30%,距内踝远端)。观察比目鱼肌的前缘。为比目鱼肌厚度19 拍摄三张图像。
- 为了区分比目鱼肌和拇长屈肌,让参与者积极弯曲和伸展大脚趾。这将导致拇长屈肌纤维的运动,而不会移动比目鱼肌纤维。
- 腓肠肌横截面积:使用扩展的视野,将超声探头放在短轴上,并与腓肠肌的标记(距胫骨内侧平台长度的 25%)对齐。观察内侧腓肠肌的内侧边界,并通过将探头从内侧滑到外侧开始图像,直到看到外侧腓肠肌的外侧边界。为腓肠肌 CSA13 拍摄三张图像。
- 为了捕捉腓肠肌内侧的最内侧,可能需要要求参与者外展他们的腿并稍微内旋髋关节。如果需要这样做,请确保参与者没有足跖屈曲他们的脚,因为这会影响测量。
- 使用 B 模式视图,确定跟腱内(图 6D)和/或跟腱插入处(附着点; 图6C)。这些钙化与跟骨分离,表现为高回声区域,下方有阴影,存在于多个视野平面中。拍摄图像以确认调查结果。注意钙化是发生在跟腱内还是附着点处。
- 使用 B 模式视图,确定是否存在滑囊炎。这可以通过跟骨近端跟腱深处的低回声区域(跟骨后滑囊炎)和/或跟腱插入浅表(皮下跟骨滑囊炎)可见。拍摄图像以确认发现(图6B)。
- 在超声上使用多普勒设置,评估跟腱内是否存在新生血管。
- 将多普勒盒(即感兴趣区域)放在肌腱上,保持超声探头不动,并避免压下或扩张组织,因为这可能会阻塞并阻止血流的可视化。
- 扫描跟腱游离肌腱的长度,确保在不移动探针的情况下评估肌腱的每个部分,以防止伪影。如果在肌腱内部或与肌腱接触处可见脉管系统,请在血流量最大的区域拍摄三到三秒的视频(图6A)。

图 3:跟腱厚度和 CSA 测量位置。 (A) 健康和 (B) 肌腱病性跟腱的扩展视野超声图像。虚线表示肌腱边界。红色箭头表示测量位置。黄线表示近端跟骨切迹的距离(白色箭头)。在 2 cm 标记 (B) 处增厚的情况下,应在游离肌腱的健康区域(蓝色箭头)处测量健康的肌腱厚度。 请点击这里查看此图的较大版本.

图 4:跟腱长度测量值。 跟腱的扩展视野超声图像。游离肌腱长度(黄线)是从跟骨切迹近端跟腱插入到比目鱼肌腱交界处 (MTJ) 处测量的。全肌腱长度(红线)是从跟骨切迹近端跟腱插入处到腓肠肌肌腱交界处 (MTJ)10 测量的。 请点击这里查看此图的较大版本.

图 5:肌腱各向异性。 跟腱各向异性发生在超声波不垂直于结构时。倾斜超声探头会导致肌腱结构出现 (A) 高回声或 (B) 低回声,具体取决于超声波与肌腱的关系。虚线表示肌腱边界。 请点击这里查看此图的较大版本.
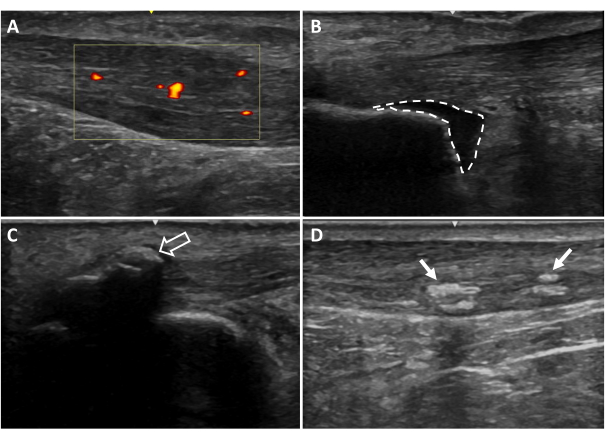
图 6:其他超声成像结果。 (A)新生血管形成,(B)跟骨后滑囊炎,(C)内凝石钙化,(D)肌腱内钙化。红色和黄色区域表示感兴趣的肌腱区域内的血流(黄色框)。虚线表示滑囊边界。箭头表示钙化20. 请点击这里查看此图的较大版本.
3. 超声波测量
注意: 可以根据相应超声波机器的设置和工具在机器上进行超声波测量。还可以导出图像,以便在Osirix DICOM查看器等软件上进行测量。每项措施的三项试验的平均值将用于分析。
- 腓肠肌肌腱长度(全肌腱长度):打开较长的扩展视野肌腱图像(在步骤 2.4 中拍摄)。从肌腱插入的最近端点(跟骨切迹)到腓肠肌肌右腱交界处进行测量(图4)。
- 比目鱼肌腱长度(游离肌腱长度):打开较短的扩展视野肌腱图像(在步骤 2.5 中拍摄)。从肌腱插入的最近端点(跟骨切迹)到比目鱼肌腱交界处进行测量(图 4)。
- 2 厘米处的肌腱厚度:打开拍摄器扩展的视场肌腱图像。从肌腱插入的最近端点(跟骨切迹)测量到 2 厘米,测量末端位于肌腱的深缘。从肌腱的深边界的这一点到肌腱的直接浅表方面进行测量,以获得 2 厘米的肌腱厚度。该指标应代表健康的肌腱厚度(图7A)。
- 在跟腱病的情况下,如果肌腱在这 2 厘米的距离处增厚,则在游离肌腱中找到一个健康区域进行测量并记录距跟骨切迹近端的距离(图 7B)。
注意:厚度用于描述肌腱从最浅到深的原始厚度。
- 在跟腱病的情况下,如果肌腱在这 2 厘米的距离处增厚,则在游离肌腱中找到一个健康区域进行测量并记录距跟骨切迹近端的距离(图 7B)。
- 肌腱横截面积:在步骤 2.7 中拍摄的打开图像。目视识别跟腱的边界并勾勒出肌腱的周长(图8A)。
- 肌腱厚度:在步骤 2.6 中拍摄的打开图像。在图像的中心,测量从肌腱浅缘到肌腱深缘的跟腱(图8B)。
- 比目鱼厚度:在步骤 2.8 中拍摄的打开图像。在图像的中心,从比目鱼肌的浅边界到深边界进行测量(图9)。
- 腓肠肌横截面积:在步骤 2.9 中拍摄的打开图像。观察腓肠肌内侧和外侧头部的边界,并勾勒出内侧腓肠肌,然后勾勒出外侧腓肠肌头(图10)。
- 跟腱增厚:使用此计算来确定跟腱病中肌腱增厚的程度。减去 2 cm 处的厚度(或调整的位置; 图7A)从肌腱厚度(图7B)得到肌腱增厚(在步骤3.5中测量减去在步骤3.3中测量)。

图 7:跟腱增厚。 跟腱增厚的计算方法是从 (B) 肌腱最厚部分的厚度中减去 (A) 肌腱健康部分的厚度31。虚线表示肌腱边界。红线表示肌腱厚度。黄线表示距跟骨切迹近端 2 cm 的距离。请点击这里查看此图的较大版本.

图 8:跟腱横截面积和厚度。 跟腱在(A)横截面和(B)最厚部分的纵向视图的超声图像。虚线表示肌腱边界。红线表示肌腱厚度。为清楚起见,显示了肌腱的横截面,有边框和无边框。 请点击这里查看此图的较大版本.

图 9:比目鱼肌厚度。 比目鱼肌的超声图像。虚线表示肌肉边界。红线表示肌肉厚度。 请点击这里查看此图的较大版本.

图 10:腓肠肌横截面积。 内侧和外侧腓肠肌横截面的扩展视野超声图像。虚线表示肌腱边界。 请点击这里查看此图的较大版本.
结果
该协议中的措施已被证明是可靠和有效的10,20。据报道,对于扩大视场的跟腱长度到腓肠肌(类间相关系数 (ICC):0.944)和跟腱长度到比目鱼肌 (ICC: 0.898)10,具有出色的可靠性。跟腱长度测量值在组水平(MDC组)的最小可检测变化为腓肠肌长度为 0.43 厘米,腓肠肌长度为0.41 厘米,比目鱼肌长度为 0.41 厘米。个体水平的 MDC(MDC个体)为腓肠肌长度为 1.83 厘米,到比目鱼肌10 的长度为 1.73 厘米。此外,通过扩展视场超声成像评估的跟腱长度测量值与尸体标本的物理测量值之间的比较显示,腓肠肌长度的有效性极好 (ICC: 0.895) 和比目鱼肌长度的中等至良好有效性 (ICC:0.744)10。跟腱厚度 (ICC: 0.898)10 和跟腱 CSA 测量值 (ICC: 0.986)20 也建立了出色的可靠性,MDC组的厚度为 0.007 cm (MDC个体 = 0.03 cm) 和 0.009 cm21 的 CSA21。
此前,Park 等人使用超声成像确定了腓肠肌解剖学 CSA 的可靠性和有效性13。肱三头肌超声成像测量也已被确定为可靠。在 10 名健康参与者的样本中,内侧(ICC:0.988,MDC组:0.305 cm 2,MDC个体:0.964 cm2)和外侧(ICC:0.838,MDC组:0.605 cm2,MDC 个体:1.91 cm2)腓肠肌 CSA 的可靠性极高。在相同的健康样品中,发现比目鱼肌厚度具有良好的可靠性(ICC:0.787,MDC组:0.093 cm,MDC个体:0.293 cm)。
代表性结果来自健康参与者(美国特拉华州)、跟腱病参与者(美国特拉华州)和跟腱断裂后 6 个月的参与者(美国特拉华州和瑞典斯德哥尔摩;表1)。同样重要的是要注意群体之间的人口统计学差异(表2)。与已发表的文献一致,跟腱断裂后的个体样本中男性与女性的比例更大,而跟腱病患者的男性和女性分布更接近均匀分布22,23。此外,在这个数据集中,健康的参与者比患有跟腱病和跟腱断裂的参与者年轻。
健康参与者的主要发现包括跟腱平均厚度为 0.47 cm 和 CSA 为 0.58 cm2,与 Jackson 等人 24 和 Schmidt 等人 25 的发现一致。虽然在健康个体的跟腱长度测量中没有显着差异10,但所有形态学值的范围都明显很大。肌腱厚度和 CSA 因体型、性别、年龄、运动和合并症而异 26,27,28,29。因此,在评估受伤患者时,使用未受累的一侧进行比较非常重要。此外,在比较个体时,使用肢体对称性有助于考虑体型、身体活动水平和其他因素。
对于跟腱病患者,这些发现与当前文献一致,显示与无症状肢体相比,肌腱更厚,CSA 更大30,以及有症状区域的肌腱增厚。虽然 CSA 和肌腱厚度在区域内不同,但结果还表明,与未受累肢体相比,跟腱断裂后的个体具有跟腱伸长、跟腱 CSA 较大和肱三头肌肱骨肌肉厚度/CSA 较低。
| 健康 | 跟腱病 | 跟腱断裂 | |||||||
| 时间点 | 初步评估 | 6 周5 | 6 个月4,5,20 | ||||||
| 边 | 右 (n=32) | 左 (n=32) | 涉及 (n=72) | 未参与 (n=72) | 涉及 | 不参与 | 涉及 | 不参与 | |
| AT 到腓肠肌的长度 (cm) 平均值±SD(最小值,最大值) | 20.1±2.0 (15.8, 23.9) | 20.1±2.0 (16.0, 23.8) | 20.85±2.39 (13.44,25.93) | 20.57±2.26 (14.10, 24.60) | 24.00±2.305 (18.86, 29.33) | 22.16±2.265 (17.20, 28.87) | 22.3±2.7 20 24.14±2.345 (18.05, 29.97) | 20.6±2.7 20 22.39±2.375 (17.53, 28.97) | |
| AT 到比目鱼长度 (cm) 平均值±SD(最小值,最大值) | 5.7±1.5 (2.9, 9.9) | 5.5±1.7 (2.1, 11.1) | 6.57±1.93 (3.17, 11.53) | 6.29±1.71 (2.88, 10.33) | |||||
| 在 CSA (cm 2) 均值±标差 | 0.58±0.10 (0.41, 0.79) | 0.58±0.12 (0.39, 0.79) | 0.91±0.49 (0.36, 2.49) | 0.70±0.25 (0.36, 1.61) | 3.31±1.004 2.77±0.655 | 0.61±0.124 0.59±0.155 | |||
| AT厚度(cm) 平均值±SD(最小值,最大值) | 0.47±0.06 (0.33, 0.58) | 0.47±0.6 (0.38, 0.65) | 0.74±0.28 (0.39, 1.63) | 0.57±0.14 (0.38, 0.97) | |||||
| AT增厚量(mm) 平均值±SD(最小值,最大值) | 2.60±2.35 (0.09, 11.96) | 1.05±0.88 (0.00, 4.18) | |||||||
| 比目鱼厚度 (cm) 平均值±SD(最小值,最大值) | 1.30±0.34 (0.65, 2.28) | 1.25±0.34 (0.60, 2.55) | 1.12±0.335 (0.41, 1.81) | 1.29±0.325 (0.67, 2.17) | 1.02±0.315 (0.30, 1.71) | 1.39±0.385 (0.58, 2.46) | |||
| 名爵 CSA (cm 2) 平均值±SD(最小值,最大值) | 14.08±4.39 (5.98, 30.85) | 14.09±4.29 (6.80, 28.02) | 11.85±2.935 (5.14, 18.71) | 14.37±3.225 (8.15, 21.60) | 13.54±3.335 (6.30, 21.45) | 15.22±3.365 (8.12, 22.84) | |||
| LG CSA (厘米 2) 平均值±SD(最小值,最大值) | 8.06±2.41 (3.93, 14.30) | 7.92±2.28 (4.08, 13.63) | 6.89±1.855 (3.63, 13.02) | 8.85±2.025 (5.38, 13.90) | 8.41±2.135 (4.28, 15.69) | 9.36±1.985 (5.32, 14.60) | |||
表 1:健康参与者、单侧跟腱病参与者和跟腱断裂后 6 个月参与者的代表性结果。 缩写:AT = 跟腱;CSA = 横截面积;MG = 内侧腓肠肌;LG = 腓肠肌外侧。合并组数据进行演示,6 周 n=54,6 个月 n=565.
| 性别,女性,n (%) | 年龄、岁月 | 体重指数,kg/m2 | 治疗 | |
| ATR:Zellers 等人 20 (n=27) | 6 (22%) | 39±11 | 27.9±4.4 | 22 手术,5 非手术 |
| ATR:Zellers 等人 4 (n=22) | 5 (23%) | 40±11 | 未报告 | 17 手术,5 非手术 |
| ATR:Aufwerber 等人 5 (n=56) | 12 (22%) | 38.4±8.2 | 25.1±2.9 | 56 外科手术 |
| 跟腱病 (n=72) | 37 (51%) | 46±14 | 28.1±5.9 | |
| 健康 (n=32) | 13 (41%) | 31±12 | 26.1±4.9 |
表2:每组代表性数据的人口统计学。 缩写:ATR = 跟腱断裂。4 中公布的受试者数据是20 年公布的受试者数据的部分样本。合并组数据以进行演示5.
讨论
协议中确保方法有效性和可靠性的关键步骤包括在参与者身上使用皮肤标记来指导超声检查,以及对执行研究中使用的测量的个体进行必要的培训。在特定记录位置的皮肤标记有助于随着时间的推移在同一个体的相同位置一致准确地评估感兴趣的变量。此外,以相同的系统方式将皮肤标记应用于不同的个体,可以比较个体之间的相同变量。所需的可靠性培训是该协议中的另一个关键步骤,允许在评估者之间比较发现。用作可靠性培训参考值的测量值来自一位具有超过 14 年经验的超声成像专家。在与研究参与者进行测量之前,研究人员应证明对感兴趣的研究人群中每个超声变量的可靠性至少为 0.800 (ICC2,k)。可靠性培训会带来大量的实践,从而更好地评估和执行测量结果。
当出现某些情况时,需要对这些方法进行修改和故障排除。常见情况包括对成长中的儿童和青少年、不同的身体成分和开放性伤口进行测量。儿童和青少年的肌肉骨骼生长需要在皮肤上添加额外的标记,以解释骨骼和肌腱长度随时间的变化。应在所有随访时间点测量胫骨长度,以考虑肱三头肌位置的差异。跟腱 CSA 应在肌腱沿线的多个点(例如,游离肌腱长度的 10%、20% 和 30%)进行评估,以解释肌腱大小的不均匀生长。身体成分(即肌肉大小、是否存在过多的脂肪组织等)可能需要对所使用的超声设置进行调整。通常,增加肌肉尺寸或过多的脂肪组织将需要增加所利用的深度,以便整个结构在图像32中可视化。增益和焦点位置也应进行调整,以优化可视化效果。最后,如果皮肤上有开口(即小而开放的切口),则必须对协议进行修改,以确保参与者和设备的卫生环境。在这些情况下,将无菌探针罩放置在超声换能器上,并使用无菌超声凝胶来保护参与者免受感染。
使用超声成像有一些限制。与其他成像模式一样,超声成像需要练习才能熟练掌握由此产生的图像质量,所得图像质量受成像师10技能的限制。虽然对设备的实践和熟练程度很重要,但同样重要的是对感兴趣结构的解剖学知识。练习和熟悉被检查的身体区域将是优化图像质量和确保协议效率的关键。此外,超声成像受到结构深度的限制。当观察更深的组织时,与更浅层的组织相比,即使有适当的设置和换能器选择,它也会导致较低的图像质量33。声学阴影,其中高回声区域下方的图像看起来是消声的,是成像肌腱钙化时存在的伪影34,35。由钙化引起的阴影使得很难或不可能看到它们下面的结构。设备也会出现限制。该协议利用扩展的视场设置来捕获大于/长于探头长度的结构。一些超声成像设备没有此设置,导致需要调整以评估跟腱长度和腓肠肌 CSA。
磁共振成像 (MRI) 通常用于可视化和量化软组织(如肌腱和肌肉)的结构特性。然而,MRI 有几个缺点可以使用,例如体积大、缺乏便携性和费用16。此外,作为一种静态成像工具,它不允许评估软组织的动态特性。该方案使用超声成像提供了一种替代其他成像方式的方法,作为一种动态、舒适、紧凑和更便宜的方法来可视化和测量肱三头肌结构和形态16。
超声成像提供实时成像,使用户能够在运动过程中观察结构。使用该协议,超声探头的切换用于区分具有不同回声性的组织。此外,让参与者积极弯曲第一个脚趾可以区分比目鱼肌和较深的拇长屈肌。为了获得最佳精度,应在图像捕获后立即进行测量,以可视化结构边界。超声成像的另一个好处是患者不受定位限制,例如其他成像方式(如 MRI),这些方式要求患者长时间在固定位置保持不动。最后,随着便携式超声成像设备变得越来越便宜,在临床实践和研究中使用超声成像越来越可行。
确定结构的恢复是跟腱损伤恢复的一个重要特征。此外,肱三头肌的结构测量可以深入了解一般跟腱健康状况,并可以预测症状的发展。该方案已用于临床以及涉及健康个体评估以及跟腱病患者和跟腱断裂后个体评估的研究。在研究中继续使用这种方法将有助于更深入地了解跟腱形态以及与损伤、其他疾病和恢复相关的结构变化。
披露声明
作者没有要披露的利益冲突。
致谢
作者要感谢特拉华州肌腱研究小组的过去和现在的成员,他们协助使用该协议收集数据。本出版物中报告的研究得到了美国国立卫生研究院国家关节炎、肌肉骨骼和皮肤病研究所的支持,奖项编号为 R01AR072034、R01AR078898、F31AR081663、R21AR067390,并由美国国立卫生研究院的 Eunice Kennedy Shriver 国家儿童健康和人类发展研究所支持,奖项编号为 T32HD007490。内容完全由作者负责,并不一定代表美国国立卫生研究院的官方观点。本出版物中报告的研究还得到了瑞典体育科学研究委员会、斯德哥尔摩郡议会(ALF 项目)和瑞典研究委员会提供的资助。这项工作也得到了物理治疗研究基金会的博士研究促进奖学金和风湿病研究基金会医学和研究生导师的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| Aquaflex Stand Off Pad | Parker Laboratories | E8317C | |
| Aquasonic ultrasound Gel | Parker Laboratories | E8365AF | |
| Linear Array Ultrasound Probe L4-12t-RS | GE Healthcare | 5495987 | |
| LOGIC e Ultrasound | GE Healthcare | E8349PA | |
| Osirix Dicom Viewer | Pixmeo SARL | Software for measurements |
参考文献
- Millar, N. L., et al. Tendinopathy. Nat Rev Dis Primers. 7 (1), 1 (2021).
- Silbernagel, K. G., Hanlon, S., Sprague, A. Current clinical concepts: Conservative management of Achilles tendinopathy. J Athl Train. 55 (5), 438-447 (2020).
- Chimenti, R. L., Cychosz, C. C., Hall, M. M., Phisitkul, P. Current concepts review update: insertional Achilles tendinopathy. Foot Ankle Int. 38 (10), 1160-1169 (2017).
- Zellers, J. A., Pohlig, R. T., Cortes, D. H., Grävare Silbernagel, K. Achilles tendon cross-sectional area at 12 weeks post-rupture relates to 1-year heel-rise height. Knee Surg Sports Traumatol Arthrosc. 28 (1), 245-252 (2020).
- Aufwerber, S., Edman, G., Grävare Silbernagel, K., Ackermann, P. W. Changes in tendon elongation and muscle atrophy over time after Achilles tendon rupture repair: a prospective cohort study on the effects of early functional mobilization. Am J Sports Med. 48 (13), 3296-3305 (2020).
- Heikkinen, J., et al. Tendon length, calf muscle atrophy, and strength deficit after acute Achilles tendon rupture: Long-term follow-up of patients in a previous study. J Bone Joint Surg Am. 99 (18), 1509-1515 (2017).
- Corrigan, P., Cortes, D. H., Pohlig, R. T., Grävare Silbernagel, K. Tendon morphology and mechanical properties are associated with the recovery of symptoms and function in patients with Achilles tendinopathy. Orthop J Sports Med. 8 (4), 2325967120917271 (2020).
- De Jonge, S., et al. Relationship between neovascularization and clinical severity in Achilles tendinopathy in 556 paired measurements. Scand J Med Sci Sports. 24 (5), 773-778 (2014).
- De Jonge, S., et al. The tendon structure returns to asymptomatic values in nonoperatively treated Achilles tendinopathy but is not associated with symptoms: A prospective study. Am J Sports Med. 43 (12), 2950-2958 (2015).
- Silbernagel, K. G., Shelley, K., Powell, S., Varrecchia, S. Extended field of view ultrasound imaging to evaluate Achilles tendon length and thickness: A reliability and validity study. Muscles Ligaments Tendons J. 6 (1), 104-110 (2016).
- Albano, D., et al. Magnetic resonance and ultrasound in Achilles tendinopathy: predictive role and response assessment to platelet-rich plasma and adipose-derived stromal vascular fraction injection. Eur J Radiol. 95, 130-135 (2017).
- Alghamdi, N. H., Killian, M., Aitha, B., Pohlig, R. T., Silbernagel, K. G. Quantifying the dimensions of Achilles tendon insertional area using ultrasound imaging a validity and reliability study. Muscles Ligaments Tendons J. 9 (4), 544-551 (2019).
- Park, E. S., Sim, E., Rha, D. W., Jung, S. Estimation of gastrocnemius muscle volume using ultrasonography in children with spastic cerebral palsy. Yonsei Med J. 55 (4), 1115-1122 (2014).
- Risch, L., et al. Is sonographic assessment of intratendinous blood flow in achilles tendinopathy patients reliable?: Consistency of Doppler ultrasound modes and intra- and inter-observer reliability. Ultrasound Int Open. 2 (1), E13-E18 (2016).
- Risch, L., et al. Reliability of evaluating Achilles tendon vascularization assessed with Doppler ultrasound advanced dynamic flow. J Ultrasound Med. 37 (3), 737-744 (2018).
- Forney, M. C., Delzell, P. B. Musculoskeletal ultrasonography basics. Cleve Clin J Med. 85 (4), 283-300 (2018).
- Dams, O. C., Reininga, I. H. F., Gielen, J. L., van den Akker-Scheek, I., Zwerver, J. Imaging modalities in the diagnosis and monitoring of Achilles tendon ruptures: A systematic review. Injury. 48 (11), 2383-2399 (2017).
- Fredberg, U., Bolvig, L., Andersen, N. T., Stengaard-Pedersen, K. Ultrasonography in evaluation of Achilles and patella tendon thickness. Ultraschall Med. 29 (1), 60-65 (2007).
- Dudley-Javoroski, S., McMullen, T., Borgwardt, M. R., Peranich, L. M., Shields, R. K. Reliability and responsiveness of musculoskeletal ultrasound in subjects with and without spinal cord injury. Ultrasound Med Biol. 36 (10), 1594-1607 (2010).
- Zellers, J. A., Cortes, D. H., Pohlig, R. T., Silbernagel, K. G. Tendon morphology and mechanical properties assessed by ultrasound show change early in recovery and potential prognostic ability for 6-month outcomes. Knee Surg Sports Traumatol Arthrosc. 27 (9), 2831-2839 (2019).
- Zellers, J. A., Bley, B. C., Pohlig, R. T., Alghamdi, N. H., Silbernagel, K. G. Frequency of pathology on diagnostic ultrasound and relationship to patient demographics in individuals with insertional Achilles tendinopathy. Int J Sports Phys Ther. 14 (5), 761-769 (2019).
- de Jonge, S., et al. Incidence of midportion Achilles tendinopathy in the general population. Br J Sports Med. 45 (13), 1026-1028 (2011).
- Lemme, N. J., Li, N. Y., DeFroda, S. F., Kleiner, J., Owens, B. D. Epidemiology of Achilles tendon ruptures in the United States: athletic and nonathletic injuries from 2012 to 2016. Orthop J Sports Med. 6 (11), 2325967118808238 (2018).
- Jackson, J. B., Chu, C. H., Williams, K. A., Bornemann, P. H. Normal ultrasonographic parameters of the posterior tibial, peroneal, and Achilles tendons. Foot Ankle Spec. 12 (5), 480-485 (2019).
- Schmidt, W. A., Schmidt, H., Schicke, B., Gromnica-Ihle, E. Standard reference values for musculoskeletal ultrasonography. Ann Rheum Dis. 63 (8), 988-994 (2004).
- Ackermann, P. W., Hart, D. A. . Metabolic Influences on Risk for Tendon Disorders. , (2016).
- Westh, E., et al. Effect of habitual exercise on the structural and mechanical properties of human tendon, in vivo, in men and women. Scand J Med Sci Sports. 18 (1), 23-30 (2008).
- Cassel, M., et al. Prevalence of Achilles and patellar tendinopathy and their association to intratendinous changes in adolescent athletes. Scand J Med Sci Sports. 25 (3), e310-e318 (2015).
- Hirschmüller, A., et al. Achilles tendon power Doppler sonography in 953 long distance runners - a cross sectional study. Ultraschall Med. 31 (4), 387-393 (2010).
- Radovanović, G., Bohm, S., Arampatzis, A., Legerlotz, K. In Achilles tendinopathy the symptomatic tendon differs from the asymptomatic tendon while exercise therapy has little effect on asymmetries-an ancillary analysis of data from a controlled clinical trial. J Clin Med. 12 (3), 1102 (2023).
- Corrigan, P., Cortes, D. H., Pontiggia, L., Silbernagel, K. G. The degree of tendinosis is related to symptom severity and physical activity levels in patients with midportion Achilles tendinopathy. Int J Sports Phys Ther. 13 (2), 196-207 (2018).
- Enriquez, J. L., Wu, T. S. An introduction to ultrasound equipment and knobology. Crit Care Clin. 30 (1), 25-45 (2014).
- Jacobson, J. A. . Fundamentals of Musculoskeletal Ultrasound 3rd Edition. , (2018).
- Scanlan, K. A. Sonographic artifacts and their origins. AJR Am J Roentgenol. 156 (6), 1267-1272 (1991).
- Gimber, L. H., et al. Artifacts at musculoskeletal US: resident and fellow education feature. Radiographics. 36 (2), 479-480 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。