Method Article
CRISPR/Cas9 Teknolojisi Kullanılarak Göçmen Locust'un Homozigot Mutantlarının İnşası
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu çalışma, homozigot çekirge mutantlarının CRISPR / Cas9 ribonükleaz bazlı yapımının sistematik olarak optimize edilmiş bir prosedürünün yanı sıra çekirge yumurtalarının kriyoprezervasyonu ve resüsitasyonu için ayrıntılı bir yöntem sunmaktadır.
Özet
Göçmen çekirge Locusta migratoria, sadece insanlara büyük ekonomik kayıplara neden olan dünya çapındaki veba çekirgelerinden biri değil, aynı zamanda böcek metamorfozu için önemli bir araştırma modelidir. CRISPR / Cas9 sistemi, belirli bir DNA lokusunda doğru bir şekilde konumlandırılabilir ve hedef bölge içindeki yarıklar, hedef gen nakavtını indüklemek veya yeni gen parçalarını spesifik lokusa entegre etmek için çift iplikçik kırılmalarını verimli bir şekilde tanıtabilir. CRISPR / Cas9 aracılı genom düzenleme, çekirge araştırmalarında karşılaşılan soruları ele almak için güçlü bir araç ve çekirge kontrolü için umut verici bir teknolojidir. Bu çalışma, göçmen çekirgelerde Cas9 proteini ve tek kılavuz RNA'lar (sgRNA'lar) kompleksi ile CRISPR / Cas9 aracılı gen nakavtı için sistematik bir protokol sunmaktadır. Hedef bölgelerin seçimi ve sgRNA'nın tasarımı ayrıntılı olarak açıklanmış, ardından in vitro sentez ve sgRNA'ların doğrulanması takip edilmiştir. Sonraki prosedürler arasında, düşük ölüm oranına sahip başarılı bir mikroenjeksiyon elde etmek için yumurta salının toplanması ve tabaklanmış yumurta ayrımı, yumurta kültürü, mutasyon oranının ön tahmini, çekirge yetiştiriciliği ve düzenlenmiş çekirgelerin popülasyon stabilitesini sağlamak için mutantların tespiti, korunması ve geçişi yer almaktadır. Bu yöntem, göçmen çekirgelerde ve diğer böceklerde CRISPR / Cas9 tabanlı gen düzenleme uygulamaları için referans olarak kullanılabilir.
Giriş
Gen düzenleme teknolojileri, hedef geni amaç1'de yapay olarak değiştirmek için belirli bir genom lokusuna eklemeler veya silmeler yapmak için kullanılabilir. Geçtiğimiz yıllarda, CRISPR / Cas9 teknolojisi hızla gelişti ve yaşam bilimlerinin çeşitli alanlarında giderek artan bir uygulama alanına sahip 2,3,4,5,6. CRISPR / Cas9 sistemi 19877'de keşfedildi ve bakteri ve arkelerde yaygın olarak bulundu. Daha ileri araştırmalar,fajlara karşı savaşmak için RNA güdümlü nükleaz Cas9'a bağlı prokaryotik bir adaptif bağışıklık sistemi olduğunu gösterdi 8. Yapay olarak modifiye edilmiş CRISPR / Cas9 sistemi esas olarak iki bileşenden, tek bir kılavuz RNA (sgRNA) ve Cas9 proteininden oluşur. SgRNA, hedef diziye tamamlayıcı bir CRISPR RNA'sından (crRNA) ve nispeten korunmuş bir yardımcı transaktive edici crRNA'dan (tracrRNA) oluşur. CRISPR / Cas9 sistemi aktive edildiğinde, sgRNA, Cas9 proteini ile bir ribonükleoprotein (RNP) oluşturur ve Cas9'u RNA-DNA etkileşimlerinin baz eşleşmesi yoluyla hedef bölgesine yönlendirir. Daha sonra, çift sarmallı DNA, Cas9 proteini tarafından parçalanabilir ve sonuç olarak, çift iplikçik kırılması (DSB), 9,10,11,12 hedef bölgesinin protospacer bitişik motifinin (PAM) yakınında ortaya çıkar. DSB'lerin neden olduğu hasarı azaltmak için, hücreler genomik hasarları etkili bir şekilde tespit etmek ve onarım prosedürünü başlatmak için kapsamlı DNA hasar tepkilerini aktive edecektir. Hücrede iki ayrı onarım mekanizması vardır: homolog olmayan uç birleştirme (NHEJ) ve homolojiye yönelik onarım (HDR). NHEJ, DNA çift iplikçik kırılmalarını hızlı bir şekilde onarabilen ve hücre apoptozunu önleyen en yaygın onarım yoludur. Bununla birlikte, DSB'lerin yakınında küçük ekleme ve silme parçaları (indel) bıraktığı için hataya eğilimlidir, bu da genellikle açık bir okuma çerçevesi kaymasına neden olur ve bu nedenle gen nakavtına yol açabilir. Buna karşılık, homolog onarım oldukça nadir görülen bir olaydır. DSB bağlamına homolog dizilere sahip bir onarım şablonu olması koşuluyla, hücreler bazen yakındaki şablona göre genomik kırılmayı onarır. HDR'nin sonucu, DSB'nin tam olarak onarılmasıdır. Özellikle, şablondaki homolog diziler arasında ek bir dizi varsa, HDR aracılığıyla genoma entegre edilir ve bu şekilde, spesifik gen eklemeleri gerçekleştirilebilir13.
SgRNA yapılarının ve Cas9 protein varyantlarının optimizasyonu ve geliştirilmesi ile CRISPR / Cas9 tabanlı genetik düzenleme sistemi, Drosophila melanogaster, Aedes aegypti, Bombyx mori, Helicoverpa Armigera, Plutella xylosella ve Locusta migratoria 14,15,16,17,18 dahil ancak bunlarla sınırlı olmamak üzere böceklerin araştırılmasında da başarıyla uygulanmıştır ,19. Yazarların bilgisine göre, Cas9 proteini ve in vitro transkribe edilmiş sgRNA'dan oluşan RNP'ler çekirge genomu düzenlemesi için kullanılmış olsa da20,21,22, göçmen çekirgenin homozigot mutantlarının CRISPR / Cas9 ribonükleaz aracılı inşası için sistematik ve ayrıntılı bir protokol hala eksiktir.
Göçmen çekirge, küresel bir dağılıma sahip olan ve gıda üretimi için önemli tehditler oluşturan, özellikle buğday, mısır, pirinç ve darı gibi graminli bitkilere zararlı olan önemli bir tarım zararlısıdır23. Genom düzenleme teknolojilerine dayanan gen fonksiyon analizi, göçmen çekirgelerin kontrolü için yeni hedefler ve yeni stratejiler sağlayabilir. Bu çalışma, göçmen çekirge genlerinin CRISPR / Cas9 sistemi aracılığıyla yok edilmesi için, hedef bölgelerin seçimi ve sgRNA'ların tasarımı, sgRNA'ların in vitro sentezi ve doğrulanması, yumurtaların mikroenjeksiyonu ve kültürü, embriyonik aşamada mutasyon oranının tahmini, mutantların tespiti ve mutantların geçişi ve korunması dahil olmak üzere ayrıntılı bir yöntem önermektedir. Bu protokol, çekirge genlerinin büyük çoğunluğunun manipülasyonu için bazal bir referans olarak kullanılabilir ve diğer böceklerin genom düzenlemesi için değerli referanslar sağlayabilir.
Protokol
1. Hedef yer seçimi ve sgRNA tasarımı
- Literatür araştırması ve / veya NCBI ve çekirge veritabanı24'te genin mRNA'sını veya kodlayan DNA dizisini (CDS) arayarak ilgilenilen gen için mümkün olduğunca fazla dizi bilgisi toplayın.
- Ekzon ve intron bölgelerini ayırt etmek için ilgili genin dizisini genomik DNA dizisiyle karşılaştırın.
- Araştırma amacına dayalı olarak hedef site tasarımı için bir aday bölge seçin. Aday bölge parçasını büyütmek ve PCR ürününün analizini sıralayarak vahşi tip dizisini doğrulamak için astar çiftleri tasarlayın.
NOT: Aday hedef bölgenin seçimi için farklı stratejiler vardır. Örneğin, çoğu gen / protein fonksiyonu araştırmasında, genom düzenlemesinden sonra tüm protein / RNA fonksiyonunun kaybolmasını sağlamak için aday bölge olarak başlangıç kodonuna yakın ekzon fragmanını kullanın (yani, gen nakavtı). Belirli bir etki alanının işlev analizi için, etki alanının başında (veya her iki ucunda) aday bölgeyi seçin. - Aday hedef bölgedeki potansiyel hedef siteleri aramak için E-CRISP Design25 gibi çevrimiçi kaynakları kullanın.
- Referans genomların açılır listesinden "Drosophila melanogaster BDGP6" yı (veya başka bir böceği) seçin ve ardından hedef bölgenin dizisini metin kutusuna yapıştırarak (FASTA formatında) "Giriş FASTA dizisidir" i seçin.
- Olası hedef siteleri elde etmek için "Orta" ve "tek tasarım" ile "sgRNA aramasını başlat" a basarak uygulamayı başlatın. Tahmin edilen skorlarına göre sonuçlardan 1-3 potansiyel hedef seçin ve karşılık gelen sgRNA'ları buna göre tasarlayın.
NOT: CRISPR tasarımı için CRISPOR, CHOPCHOP, CRISPRdirect, ZiFiT ve benzeri birçok çevrimiçi platform vardır (bkz. Bazıları, genomik sekans verileri veritabanlarında bulunan türler için özgüllük kontrolü işlevine sahiptir. Bununla birlikte, çekirgelerin genomik dizisi herhangi bir çevrimiçi web sitesinde bulunmamıştır. Çekirgelerde CRISPR tasarımı için birden fazla çevrimiçi araç kullanmak daha iyidir. Kapsamlı bir şekilde, farklı web sitelerinden gelen sonuçları göz önünde bulundurun ve en yüksek özgüllük, en yüksek verimlilik ve en az uyumsuzluk oranı ilkesine göre sonuçlardan sgRNA'yı seçin (Şekil 1A, B).
2. sgRNA'nın in vitro sentezi ve doğrulanması
- Üreticinin el kitabına (Malzeme Tablosu) göre sgRNA sentez kitlerini kullanarak sgRNA'yı sentezleyin. Bu prosedür genellikle üç adım içerir: DNA şablon amplifikasyonu, in vitro transkripsiyon ve sgRNA saflaştırma21. Sentezlenen sgRNA'yı nükleaz içermeyen su ile daha fazla kullanım için 300 ng / μL'lik bir depolama konsantrasyonuna seyreltin.
- CRISPR / Cas9 sisteminin in vitro bölünme testinin substratı olarak hizmet etmek için hedef gen parçasını güçlendirin ve saflaştırın. Üreticinin yönergelerini izleyerek bu adımları uygulayın.
- Satın alınan Cas9 proteinini nükleaz içermeyen su ile 300 ng / μL'ye seyreltin. 1 μL sgRNA (300 ng/μL) ve 1 μL Cas9 proteinini (300 ng/μL) 37 °C'de bölünme tamponunda 200 ng saflaştırılmış hedef parça ile 1 saat boyunca inkübe edin (toplam hacmin 10 μL'si; bakınız Tablo 1). Agaroz jel elektroforezi ile sgRNA ile indüklenen Cas9 bölünmesinin etkinliğini tahmin edin (Şekil 1C). Aşağıdaki mikroenjeksiyon için yüksek aktiviteye sahip sgRNA'ları seçin.
NOT: Agaroz jel elektroforezinin sonuçları, görüntü işleme yazılımı ile gri tonlamalı görüntülere dönüştürülebilir ve bölünme verimliliği, speküle edilen boyutlardaki bantların gri tonlamasına göre tahmin edilir.
3. Mikroenjeksiyon ve yumurtaların kültürü
- Cam kılcal damarları mikropipet çektirme makinesi ile çekerek enjeksiyon iğnelerini hazırlayın (Malzeme Tablosu). Parametreleri şu şekilde ayarlayın: Isı 588'e, Çekme 90'a, Hız 60'a ve Süre 40'a. Enjeksiyon iğnesinin ucunu bir mikro öğütücü ile öğütün (Malzeme Tablosu).
NOT: İdeal iğne uçları açık ve keskin kenarlıdır (Şekil 2A). Deneyler için ek iğneler hazırlanması şiddetle tavsiye edilir, çünkü iğneler bazen enjeksiyonlar sırasında bloke edilir veya yanlışlıkla kırılır. - Enjeksiyon için RNP'leri elde etmek için 1 μL Cas9 proteinini (300 ng / μL) 1 μL doğrulanmış sgRNA (300 ng / μL) ile karıştırın. Karışımın son hacmini 10 μL'ye çıkarmak için 8 μL RNaz içermeyen steril su ekleyin. çözeltiyi iyice karıştırın ve buz üzerinde tutun.
NOT: Cas9 proteininin ve sgRNA'ların nihai konsantrasyonları, düzenleme sonuçlarına göre optimize edilebilir. Hazırlanan RNP çözeltisinin tekrar tekrar dondurulmasından ve çözülmesinden kaçının ve hemen kullanılması önerilir. - Erkek ve dişi yetişkin çekirgeleri 30 ° C'de 16 (açık):8 (karanlık) fotoperiyotla birlikte destekleyin ve yiyecek olarak yeterli taze buğday fidesi sağlayın. Bu çekirgeleri günlük olarak gözlemleyin ve çekirgeler çiftleştikten sonra yumurtlamak için yetiştirme kafesine bir yumurtlama kabı (ıslak steril kumla doldurulmuş plastik bir saksı veya bardak) koyun.
NOT: Genellikle, bir yetiştirme kafesinde (40 cm x 40 cm x 40 cm) yetiştirilen 100 çift yetişkin çekirge, tek bir geni yok etmek için yumurta üretmek için yeterlidir. Daha fazla yumurtaya ihtiyaç duyulursa kültür ek çekirge çiftleri. - Taze serilmiş yumurta kabuklarını yumurtlama kabından toplayın ve yumurta tabaklama için yaklaşık 30 dakika bekleyin. Yumurtaları ince bir fırça kullanarak yumurta kabuklarından suda nazikçe izole edin ve üç kez steril suyla yıkayın. Yumurtaları bir Petri kabında tutun ve nemli tutmak için steril su ekleyin.
NOT: Yeni serilmiş yumurtaların tabaklanması mutant verimliliğini önemli ölçüde artırabilir21. - Bir enjeksiyon iğnesini hazırlanan RNP çözeltisi ile doldurun ve mikromanipülatöre yükleyin (Malzeme Tablosu).
- Mikroenjeksiyon parametrelerini aşağıdaki gibi ayarlayın: enjeksiyon basıncının (pi) 300 hPa'sı, enjeksiyon süresinin (ti) 0,5 s'si ve kompanzasyon basıncının (pc) 25 hPa'sı.
- Enjekte edilen çözeltinin hacmini değerlendirmek için pedala basın. Enjeksiyon hacminin yaklaşık 50-100 nL olduğundan emin olmak için enjeksiyon basıncını ve enjeksiyon süresini ayarlayın.
NOT: Enjeksiyon çözeltisini mümkün olduğunca sürekli ve kontrol edilebilir hale getirmek için iğnedeki artık havayı boşaltın. İğnenin ve mikromanipülatörün bağlantısının sıkı olması gerekir.
- Steril yumurtaları enjeksiyon pedine düzenli olarak yerleştirin (Şekil 2B,C) ve pedi mikroskobun nesne tablasına yerleştirin (Şekil 3A). Yumurtalar gözlenene kadar mikroskobun büyütmesini ayarlayın. Mikroenjeksiyon iğnesini, enjeksiyon ucu görünene kadar mikroskop altında ayarlayın ve enjekte edilecek yumurtanın yanına yerleştirin.
- Enjeksiyonu uygun bir yükseklikte ve 30-45 derecelik bir açıyla başlatın. Ucu yumurtanın mikropillerinin yanına dikkatlice yumurtanın içine yerleştirin (Şekil 3B) ve enjeksiyonu gerçekleştirmek için pedala basın. İğneyi hızlı bir şekilde geri çekin ve bir sonraki yumurtanın enjeksiyonu için enjeksiyon pedini hareket ettirin.
NOT: Mikroenjeksiyon sırasında yumurtada hafif bir genişleme gözlenmelidir. İğne deliğinde az miktarda sitoplazmik sızıntı kabul edilebilir. Enjeksiyon iğnesini yenisiyle değiştirin veya sıvı çıkışı çok fazlaysa enjeksiyon açısını ayarlayın. - Enjekte edilen yumurtaları bir kültür kabına (nemli filtre kağıdı parçası olan bir Petri kabı) aktarın ve 30 ° C'de bir inkübatöre yerleştirin.
NOT: Bu enjekte edilen yumurtalardan nimflerin yumurtadan çıkması yaklaşık 13-14 gün sürecektir (hedef genin mutasyonunun embriyoların gelişimini etkilememesi şartıyla) (Şekil 3C). Belirli bir geni nakavt etmek için yeterli kuluçka ve eklosyon miktarını sağlamak için en az 100 yumurta enjekte edin.
4. Mutasyon oranı tahmini ve mutantların taranması
- Enjeksiyondan sonra her gün enjekte edilen yumurtaların gelişimini kontrol edin. Enjekte edilen yumurtaları ilk 5 günde her 24 saatte bir yeni bir kültür kabına aktarın.
- Enjeksiyondan sonraki 6. günde ( veya daha sonra), rastgele 10 yumurtayı toplayıp bir tüpe aktarın ve yumurtaları bir öğütücü kullanarak 6 dakika boyunca 60 Hz'de iki çelik bilyeyle yeterince öğütün (bkz. Enkazı 1 mL PBS ile yeniden askıya alın. Karışımın 5 μL'sini 45 μL 50 mM NaOH'ye aktarın ve 5 dakika boyunca 95 ° C'de lize edin. Alkali lizis reaksiyonunu sonlandırmak için lizis sistemine 5 μL 1 M Tris-HCl (pH = 8.0) ekleyin.
NOT: Son transferden sonraki herhangi bir günde alkali lizis için yumurta seçilebilir ve gelişim durumlarına bağlı olarak birden fazla yumurta tek bir örnek olarak kullanılabilir (örneğin; beş adet 6 günlük embriyo bir örnek olarak kullanılabilir ve iki adet 10 günlük embriyo bir örnek olarak kullanılabilir). Bazen, alkali lizis yöntemini kullanarak yumurtaların genomik DNA'sını elde etmek mümkün değildir. Ticari genomik DNA ekstraksiyon kitleri, genomik DNA'yı yumurtalardan izole etmek için alternatif bir yöntem olarak kullanılabilir. - Hedef gen parçasını (Tablo 2 ve Tablo 3) büyütmek için PCR şablonu olarak lizis ürününün 1 μL'sini alın ve PCR ürünlerini dizileme için gönderin. CRISPR / Cas9 sisteminin hedef geni in vivo olarak parçalayıp parçalamadığını önceden değerlendirmek için dizileme sonuçlarını vahşi tip dizilimle karşılaştırın (Şekil 4A). İndellerin embriyonik aşamada tespit edilmesi koşuluyla yumurtaların geri kalanının daha sonra gelişmesine izin verin.
NOT: Bu şekilde, mutasyon oranı embriyo aşamasında önceden tahmin edilebilir. Bu adımda herhangi bir indel bulunmazsa, hedef gen için bazı yeni sgRNA'lar hazırlayın ve adım 2.1'deki nakavt protokolünü tekrarlayın. - Yumurtadan çıkan nimfleri bir yetiştirme kafesine aktarın ve adım 3.3'te açıklandığı gibi kültüre alın. Perileri beşinci instar aşamasına geldiğinde, onları plastik kültür kaplarıyla (1 nimf / fincan) ayırın.
NOT: Perileri beşinci instarlarına kadar geliştirmeleri genellikle yaklaşık 25-35 gün sürer ve en belirgin fenotip, kanat tomurcuklarının dördüncü veya beşinci karın segmentlerine uzanmasıdır. Ayrıca, daha ileri araştırmalarda hedef gen ve fenotipler arasındaki ilişkiyi tahmin etmek için ölü nimflerin fenotiplerinin kaydedilmesi önerilir. - Antenlerin yaklaşık 2 mm uzunluğunu diseksiyon makası ile kesin ve alkali lizis yöntemini kullanarak lize edin (adım 4.2). G0 mutantlarını tanımlamak için bu nimflerin hedef gen fragmanı dizisini yukarıda açıklandığı gibi (adım 4.3) analiz edin (Şekil 4B).
NOT: Lizis için kesilen antenler biraz daha uzun olabilir ve antenlerin taşlanması veya kıyılması, antenler doğrudan sindirilebilmesine rağmen lizis için yararlıdır. Sıralama sonucunda hedef bölgeye yakın birden fazla tepe noktasına sahip bireyler pozitif mutantlar olarak tanımlanır ve daha sonra gelişme ve çiftleşme için izin verilir.
5. Mutant hatların kurulması ve geçilmesi
- G0 mutantlarını ve vahşi tip çekirgeleri kullanarak çapraz üreme gerçekleştirin (Şekil 4B). Ookistleri toplayın ve bu ookistleri 30 ° C'de ayrı ayrı inkübe edin. Adım 4.2 ve 4.3'te açıklandığı gibi mutasyonları tespit etmek için her ookistte 3-6 gelişmiş yumurta kullanın. Mutasyon pozitif ookistleri sonraki gelişim için tutun ve mutasyon negatif ookistleri terk edin.
NOT: Embriyonik aşamada mutasyon oranı tahmini,G1 mutantlarının taranmasını büyük ölçüde hızlandırabilir. Genellikle, 3-6 gelişmiş yumurta, yukarıda tarif edildiği gibi PCR aracılı genotipleme için bir örnek olarak karıştırılabilir. - G1 perilerini adım 4.4'te açıklandığı gibi destekleyin. G 1 heterozigotlarını tespit etmek için adım 4.5'te açıklandığı gibi PCR tabanlı genotipleme yapmak için antenlerin yaklaşık2 mm uzunluğunu kesin. Mutasyonlarını tanımlamak için üreticinin talimatlarına göre TA-klonlaması yapın (bkz. G2 perileri elde etmek için aynı mutasyonlara sahip G1 heterozigotlarını kullanarak çapraz performans sergileyin.
NOT: PCR ürünlerinin Sanger dizilimi sadece heterozigotları bulmak için bilgi sağlayabilir, ancak kesin mutasyonları tanımlamak için yeterli bilgi sağlamaz. Bu nedenle, mutasyonları açıkça tanımlamak için PCR ürünlerini kullanarak TA klonlaması gereklidir ve kararlı mutant hatların kurulmasını teşvik edebilir. - G2 perilerini beşinci instarlarına kadar destekleyin. Daha fazla araştırma ve kararlı pasaj için uygun olan homozigotları ve / veya heterozigotları tanımlamak için adım 5.2'de açıklanan PCR tabanlı genotiplemeyi kullanın (Şekil 4B).
NOT: Homozigot ve heterozigotların karışmasından kaçınmaya dikkat edin. Her popülasyonun homozigotluğunu ve / veya heterozigotluğunu doğrulamak için her nesilde PCR tabanlı genotipleme yapılması önerilir. Bu kontrol için kullanılan çekirge sayısı popülasyon büyüklüğüne bağlıdır. Dahası, çekirge popülasyonu çapraz strateji ile genişletilebilir.
6. Yumurta kriyoprezervasyonu ve resüsitasyonu
- Kriyokonserve edilecek yumurtaları steril suyla yıkayın ve yukarıda tarif edildiği gibi (adım 3.8) 5-6 gün boyunca bir kültür kabında inkübe edin. Bu yumurtaları kültür kabında bir araya getirin ve filtre kağıdı parçalarıyla örtün. Tüm kültür yemeğini bir parafin filmle sarın.
- Çanağı 2 gün boyunca 25 ° C'de tutun, ardından nispeten daha düşük bir sıcaklıkta (13-16 ° C) 2 gün daha tutun. Ardından, kabı 6 ° C'lik bir buzdolabına aktarın. Yumurtalar için nemli bir ortam sağlamak için her 2 haftada bir içine su ekleyin (Şekil 5A).
NOT: Embriyoların 30 °C26'da 5-6 gün boyunca geliştirildikten sonra katatrepsis aşamasında olduğu tahmin edilmektedir. Degrade soğutma, yumurtaların kriyoprezervasyonu için yararlıdır (Tablo 5). - Kriyokorunmuş yumurtaları canlandırmak için, Petri kabını buzdolabından çıkarın ve 2 gün boyunca 25 ° C'de saklayın. Bu yumurtaları, nimfler yumurtadan çıkana kadar 30 ° C'lik bir inkübatöre koyun (Şekil 5B).
NOT: Kriyokorunmuş yumurtaları 30 °C'lik bir inkübatöre aktarmadan önce 25 °C'ye koymak gerekir. Embriyolar en az beş ay boyunca kriyokonserve edilebilir, ancak kriyoprezervasyon nedeniyle kuluçka hızı ve eklosyon oranı düşebilir (Tablo 5).
Sonuçlar
Bu protokol, Cas9 proteini ve in vitro sentezlenmiş sgRNA'dan oluşan RNP ile göçmen çekirgelerin homozigot mutantlarını üretmek için ayrıntılı adımları içerir. Aşağıdakiler, hedef seçimi, sgRNA sentezi ve doğrulaması (Şekil 1A), yumurta toplama ve enjeksiyonu, mutant tarama ve geçiş, kriyoprezervasyon ve homozigot yumurtaların resüsitasyonu dahil olmak üzere çekirgelerde CRISPR / Cas9 aracılı hedef gen nakavtının bazı temsili sonuçlarıdır.
Bu çalışmada, CRISPR/Cas9 sistemi için hedef yer, üç çevrimiçi programın (E-CRISP, CRISPOR ve ZiFit) sonuçlarına göre seçilmiş ve ilk ekzonda yer almıştır (Şekil 1B). Cas9 bölünme testine in vitro göre (Tablo 1), CRISPR / Cas9 RNP, PCR fragmanını (hedef bölgeyi içeren) yaklaşık% 55'lik bir bölünme oranıyla sindirebilir (Şekil 1C). Daha sonra, bu RNP, standart mikroenjeksiyon sistemi kullanılarak tek hücreli aşamalarında 120 döllenmiş yumurtaya mikroenjekte edildi (Şekil 2 ve Şekil 3). Embriyonik evre mutasyon oranı tahmini için dizileme sonuçları, hedef bölgede etkili genom düzenlemesini önermiştir (Şekil 4A). Ayrıca, bu çalışma %52.73'lük bir nimf kuluçka oranı ile sonuçlanmıştır veG0 yetişkinlerinin %66.7'si mozaik mutanttır (Tablo 4).
Ayrıca, G0 kimeraları, heterozigot G 1 bireyleri elde etmek için vahşi tip çekirgelerle çaprazlandı ve aynı mutasyonlara sahip G1 heterozigotları (TA-klonlama ile tarandı) G2 hayvanlarını üretmek için çaprazlandı. Mutantları saptamak için PCR tabanlı fenotipleme kullanıldı ve elde edilen homozigotlar kararlı mutant çizgileri oluşturmak için çaprazlandı (Şekil 4B).
Bu arada, homozigot yumurtaların fazlalığı, homozigotların kullanım oranını artırmak için kriyokorunmuştur. Kriyoprezervasyon süresinin uzaması ile kriyokorunmuş yumurtaların kuluçka hızı azalmış olsa da (Tablo 5), yumurtaları ıslak tutmak için filtre kağıdı parçalarının uygulanması ve bu korunmuş yumurtaların yükselen sıcaklık gradyanı ile geri kazanılmasını içeren iyileştirici eylemler resüsitasyon için yardımcı olmuştur (Şekil 5 ve Tablo 5). Son olarak, homozigot mutant popülasyonu sonraki araştırmalar için başarıyla tutuldu.
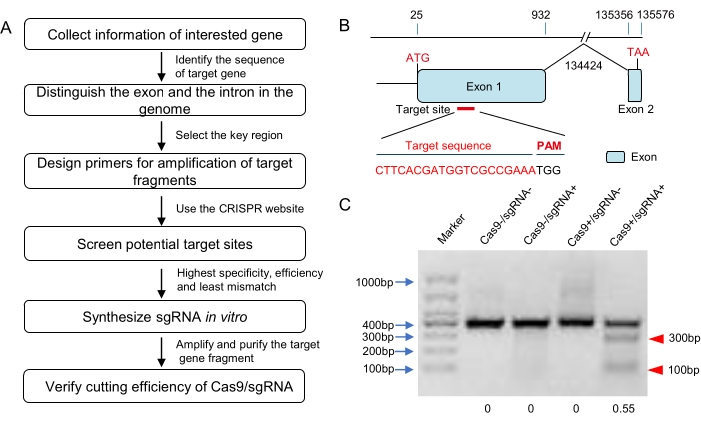
Şekil 1: Hedefin tasarımı ve sgRNA'nın in vitro doğrulaması. (A) Hedef seçimi, sgRNA sentezi ve in vitro biyoaktivite doğrulaması için akış diyagramı (çekirgeler dahil ancak bunlarla sınırlı olmamak üzere). (B) Gen yapısının ve hedef bölgenin şematik diyagramı. Bu hedef genin ekzonları mavi alanlar olarak gösterilir ve hedef bölge ekzon 1'deki başlangıç kodonunun aşağı akımında seçilmiştir. Hedef dizi kırmızı renkle vurgulanır. (C) İn vitro Cas9 bölünme testinin agaroz jel elektroforezi. Hedef diziyi (yaklaşık 400 bp uzunluğunda) barındıran bir DNA parçası güçlendirildi ve Cas9 sindirimi için substrat olarak kullanıldı. Beklenen küçük bantlar (burada yaklaşık 100 bp ve 300 bp; kırmızı üçgenlerle işaretlenmiş), sentezlenen sgRNA'nın etkili Cas9 bölünmesini indükleyebileceğini düşündürdü. Gri tonlama analizine göre bölünme oranı yaklaşık% 55 idi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Resim 2: Çekirge yumurtaları için iğne hazırlama ve mikroenjeksiyon pedi . (A) Çekirge yumurtalarının mikroenjeksiyonu için hazırlanmış bir iğnenin ucu. Ölçek çubuğu: 1 mm. (B) Üzerinde yumurta (kırmızı üçgenle belirtilen) bulunan bir mikroenjeksiyon pedinin resmi. Ölçek çubuğu 1 cm. (C) Mikroenjeksiyon pedinin boyutu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 3: Yumurta mikroenjeksiyonları. (A) Bir mikroskobu (ortada) ve bir mikroenjektöre bağlı bir mikromanipülatörü (sağda) gösteren kırmızı kutularla etiketlenmiş temsili bir mikroenjeksiyon sistemi (solda). Bilgisayar veri depolama ve yardımcı gözlem sağlamak için kullanılır. (B) Çekirge yumurtasının enjeksiyonu. Enjeksiyon bölgesi kırmızı üçgen ile işaretlenmiştir. (C) Mikroskop altında yumurtadan çıkmış bir perisi. Ölçek çubukları 1 mm'yi temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
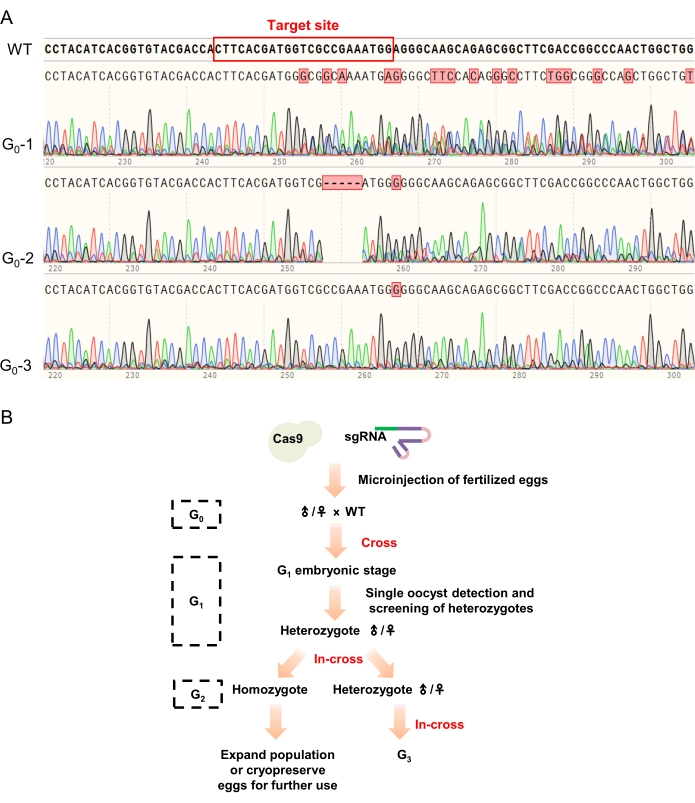
Şekil 4: G0 hayvanlarının sıralama sonuçları ve mutant çizgilerin geçiş stratejisi. (A) Tipik sıralama, G0 taramasıyla sonuçlanır. Hedef alanın yakınındaki çoklu tepe noktaları (vahşi tip dizisinde kırmızı bir dikdörtgenle işaretlenmiş), test edilen yumurtanın/çekirgenin CRISPR/Cas9 sistemi tarafından başarıyla düzenlendiğini (G 0-1 ve G0-2'de gösterildiği gibi), sıralama sonucunda herhangi bir değişiklik olmayan bireyin ise düzenlenmemiş ve terk edilmiş olarak kabul edildiğini göstermiştir (örneğin, G0-3). (B) Mutant hatların geçiş stratejisi. G0 hayvanları ilk olarak PCR aracılı genotipleme ile tarandı ve dizileme sonuçlarında çoklu pik noktası olanlar, G1 hayvanlarını oluşturmak için vahşi tip çekirgelerle çaprazlandı. G1 heterozigotlarını tanımlamak için PCR aracılı genotipleme ve TA klonlaması kullanıldı. Daha sonra, aynı mutasyonlara sahip heterozigotlar, daha fazla araştırma ve geçiş için G2 hayvanlarını (homozigotlar ve heterozigotlar) üretmek için çaprazlandı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.

Şekil 5: Yumurta kriyoprezervasyonu ve resüsitasyonu. (A) Kriyoprezervasyon prosedürü: Yumurtaları yumurta kabuklarından izole edin ve steril suyla yıkadıktan sonra 5-6 gün boyunca 30 ° C'de inkübe edin. Ardından, geliştirilen yumurtaları Petri kabında bir araya getirin ve küçük nemli filtre kağıdı parçaları ile örtün. Petri kabının tamamını bir parafin filmle sarın ve 2 gün boyunca 25 ° C'de tutun, ardından nispeten daha düşük bir sıcaklıkta (örneğin, 13-16 ° C) 2 gün daha saklayın. Son olarak, 6 ° C'de soğutun. (B) Resüsitasyon prosedürü: Kriyokorunmuş yumurtalı Petri kaplarını buzdolabından çıkarın ve filtre kağıdı artıklarını çıkardıktan sonra 2 gün boyunca 25 ° C'de saklayın. Daha sonra, yumurtalar, nimfler yumurtadan çıkana kadar 30 ° C'de sonraki gelişim için kültürlenebilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Reaktif | Hacim (μL) |
| Cas9 proteini (300 ng/μL) | 1 |
| sgRNA (300 ng/μL) | 1 |
| PCR ürünü (200 ng/μL) | 1 |
| 10×NEBuffer r3.1 | 1 |
| Nükleaz içermeyen su | 6 |
Tablo 1: İn vitro sindirim sistemi. 200 ng saflaştırılmış hedef parça (PCR ürünü), sentezlenen sgRNA'ların biyo-aktivitesini test etmek için CRISPR / Cas9 sistemi (her bileşenin 300 ng'si) ile karıştırıldı. Ticari bir tampon kullanıldı ve toplam hacmi 10 μL'ye çıkarmak için nükleaz içermeyen su eklendi.
| Reaktif | Hacim (μL) |
| 2xEs Taq MasterMix | 12.5 |
| İleri astar | 0.5 |
| Ters astar | 0.5 |
| Şablon (lizis ürünü) | 1 |
| Nükleaz içermeyen su | 10.5 |
Tablo 2: Hedef gen fragmanı amplifikasyonu için PCR sistemi. Hedef genin genomik fragmanını büyütmek için, ticari bir Taq karışımı kullanıldı ve üreticinin talimatlarına göre primerler eklendi. Şablon olarak lizis ürününün 1 μL'si kullanılmış ve toplam hacmi 25 μL'ye çıkarmak için nükleaz içermeyen su kullanılmıştır.
| Sıcaklık (°C) | Saat | Döngü |
| 95 | 5 dk | 1 |
| 95 | 30 saniye | 35 |
| 55 | 30 saniye | |
| 72 | 40 sn | |
| 72 | 10 dk | 1 |
Tablo 3: Hedef gen amplifikasyonu için PCR programı. Hedef gen amplifikasyonu için PCR programı şöyleydi: 5 dakika boyunca 95 ° C; 30 s için 95 °C, 30 s için 55 °C, 40 s için 72 °C 35 döngü; 10 dk esnasında 72 °C.
| Eşya | Veri |
| Hayır. enjekte edilen yumurtaların | 120 |
| Test edilmiş embriyolar | 10 |
| Hayır. yumurtadan çıkmış nimflerin | 58 |
| Kuluçka hızı | 52.73% |
| G0 yetişkin sayısı | 12 |
| Hayır. G0 mutantları | 8 |
| G0 yetişkinlerinde mutasyon etkinliği | 66.67% |
Tablo 4: Düzenleme verimliliğinin özeti. Hedef geni yok etmek için 120 yumurta enjekte edildi ve embriyo aşamasında test için 10 yumurta alındı. Geri kalan embriyolardan 58 nimf yumurtadan çıktı (kuluçka oranı% 52.73 idi). Son olarak, yetişkin aşamasına 12 G0 çekirge geliştirildi ve bunlardan 8'i hedef bölgede başarıyla düzenlendi. G0 erişkinlerinde mutasyon oranı %66.67 idi.
| Kontrol grubu | Grup 1 | Grup 2 | Grup 3 | Grup 4 | |
| Hayır. yumurta sayısı | 120 | 120 | 120 | 120 | 120 |
| Depolama için sıcaklık işlemi | 30 °C | 30°C (5-6 d)→6 °C | 30°C (5-6 d)→25°C (2 d)→13-16°C (2 d)→6 °C | 30°C (5-6 d)→25°C (2 d)→13-16°C (2 d)→6 °C | 30°C (5-6 d)→25°C (2 d)→13-16°C (2 d)→6 °C |
| Depolama süresi | 14 günler | 14 günler | 1 ay | 3 ay | 5 ay |
| Resüsitasyon için sıcaklık işlemi | 30 °C | 6°C→30°C | 6°C→25°C (2 d)→30 °C | 6°C→25°C (2 d)→30 °C | 6°C→25°C (2 d)→30 °C |
| Hayır. yumurtadan çıkmış çekirge | 108 | 0 | 96 | 86 | 78 |
| Kuluçka hızı | 90.00% | 0 | 80.00% | 71.67% | 65.00% |
| Hayır. yetişkin çekirge | 81 | 0 | 60 | 46 | 31 |
| Tıkanma oranı | 75.00% | 0 | 62.50% | 53.49% | 39.74% |
Tablo 5: Yumurtaların kriyoprezervasyonu ve resüsitasyonunun özeti. 600 yumurta kriyoprezervasyon ve resüsitasyon çalışması için beş gruba ayrıldı. 120 yumurtadan oluşan ilk grup (kontrol) her zaman 30 ° C'de inkübe edildi ve 14 gün boyunca saklandı. 120 yumurtadan oluşan ikinci grup (Grup 1), 5-6 gün boyunca 30 ° C'de kuluçkadan sonra buzdolabına aktarıldı ve 14 gün boyunca 6 ° C'de saklandı. Daha sonra, bu yumurtalar resüsitasyon için 30 ° C'ye transfer edildi. Diğer gruplar (grup 2, grup 3 ve grup 4, her grup 120 yumurta içeriyordu), protokolde (adım 6.1-6.3) açıklandığı gibi farklı bir depolama süresiyle (grup 2 için 1 ay, grup 3 için 3 ay ve grup 4 için 5 ay) gradyan soğutma ve geri kazanım sıcaklığı tedavisi yaşadı. Sonunda, kontrol grubundan 108 nimf yumurtadan çıktı (% 90'lık bir kuluçka oranında) ve bunların 81'i yetişkin aşamasına (eklosyon oranının% 75'i) gelişti. İkinci grupta (Grup 1) çekirge yumurtadan çıkmadı. Diğer grupların kuluçka hızı ve eklosyon hızı kontrol grubuna göre daha düşüktü ve depolama süresi ile birlikte azaldı. Grup 2'de yumurtadan çıkan 96 nimf ve bunların 60'ı yetişkin evresine kadar gelişti. Grup 3'te yumurtadan çıkan 86 nimf ve bunların 46'sı yetişkin evresine kadar gelişti. Grup 4'te, 78 nimf yumurtadan çıktı ve bunlardan 31'i yetişkin aşamasına geldi.
Tartışmalar
Çekirgeler, insan uygarlığından bu yana tarıma en yıkıcı zararlılar arasında yer almıştır23. CRISPR / Cas9 tabanlı genom düzenleme teknolojisi, çekirgelerdeki biyolojik mekanizmalar hakkında daha iyi bilgi ve umut verici bir haşere kontrol stratejisi sağlamak için güçlü bir araçtır. Bu nedenle, homozigot çekirge mutantlarının CRISPR / Cas9 aracılı inşası için etkili ve kullanımı kolay bir yöntem geliştirmek büyük fayda sağlamaktadır. Bazı harika çalışmalar bildirilmiş ve çekirgelerde genom düzenlemesi için bazı temel iş akışları sağlanmış olsa da18,20,21,22, tüm prosedürün sistematik bir optimizasyonu hala eksiktir. Genel olarak, CRISPR / Cas9 sisteminin embriyonik enjeksiyonu ile üretilen homozigot çekirge mutantı üç ana adıma ayrılabilir: a) sgRNA tasarımı, sentezi ve in vitro taraması, b) yumurta toplama, hazırlama ve enjeksiyon; ve c) mutant tarama ve homozigot bakımı. Bu protokol, optimize edilmiş bir iş akışı sağlar ve hedef yer seçimi, in vitro sgRNA taraması, yumurtaların mikroenjeksiyonu ve mutantların tespiti, CRISPR / Cas9 sistemi ile homozigot mutant çekirgelerin etkili bir şekilde üretilmesi için özellikle kritik öneme sahiptir.
İlk olarak, hedef bölge, karşılık gelen sgRNA'nın formu ve sgRNA konsantrasyonu, böceklerde genom düzenleme etkinliğinin kritik faktörleri olarak önerilmiştir18,27,28. Bu sorunu çözmek için öncelikle gen yapısını analiz etmeniz ve çevrimiçi kaynakları kullanarak ekzon 1'de veya başlangıç kodonunun yakınında birden fazla hedef site tasarlamanız önerilir. Daha sonra, sgRNA'yı in vitro olarak sentezleyin ve RNP'nin kesme verimliliğini optimize etmek için farklı konsantrasyonlarda Cas9 proteini ile karıştırın. Bu prosedür, yüksek biyoaktiviteye sahip bir sgRNA'nın tanımlanmasına ve aday hedef gen için RNP kompleksinin bileşiminin optimize edilmesine yardımcı olacaktır.
İkincisi, sınırlı bir sürede mümkün olduğunca çok taze yumurta toplamak ve kuluçka oranını ve mutasyon oranını iyileştirmek de genom düzenleme operasyonları için büyük zorluklardır. 16 (aydınlık):8 (karanlık) fotoperiyot koşulunda yetiştirilen iri yarı yetişkin çekirgeler, 09:00-11:00 saatleri arasında kısa sürede yeterli yumurta toplamak için kullanılır. Yumurtaları bakladan dikkatlice izole etmek için bir boya fırçası veya cımbız kullanarak yumurtalar arasında yavaşça aşağı doğru basınç uygulamak önemlidir. Yeterli pratikle, birden fazla kullanıcı bireysel yumurtaları bakladan güvenilir bir şekilde ayırabilir. Her yumurta izole edildikten ve steril su ile yıkandıktan sonra, mikroenjeksiyon sırasında yumurtaları stabilize etmek için yumurtalar tasarlanan enjeksiyon pedleri üzerine hizalanır (Şekil 2B,C). Yumurta, mikropillerin yakınında optimize edilmiş RNP ile enjekte edilir. Mekanik hasarı sınırlamak ve yumurtaların kirliliğini en aza indirmek için, yumurta kabuğu tabaklamanın mikroenjeksiyon21 için ideal olduğundan emin olmak için taze yumurtaların baklalarda yaklaşık 30 dakika kalmasına izin verilir, çünkü yoğunlaştırılmış yapısı ve yeterli bronzlaşmadan sonra istilaya karşı yüksek savunma kabiliyeti29,30. Bu arada, yayınlanan bir rapor, çekirge yumurtalarının sinsityal bölünmesi31'in, döşemeden sonra 0 saat ile 4 saat arasında bir noktada meydana geldiğini göstermiştir. Mevcut standart mikroenjeksiyon protokolü ile yaklaşık 100 yumurtanın enjeksiyonu 40 dakika içinde gerçekleştirilebilir. Birlikte ele alındığında, 100 döllenmiş yumurtanın bronzlaşması ve mikroenjeksiyonu prosedürü 2 saat içinde tamamlanabilir. Bu nedenle, CRISRP / Cas9 aracılı bölünme ve enjekte edilen yumurtalarda ve gelecekteki yetişkin çekirgelerde etkili mutasyon elde etmek için hedef genlerin onarımı için en az 2 saat kalmıştır.
Son olarak, çoğu mutant hayvanda homozigot üretmek için pas ve mutant tanımlama için etkili stratejiler önemlidir. Çekirgelerde, düzenlemeden sonra ölümcül olmayan genler için, burada önerilen çapraz strateji, G0 mutantlarının geniş tip çekirgelerle kesişmesi ve sonraki nesilde homozigot mutantlar üretmek için aynı mutasyonlara sahip G1 heterozigotları kullanılarak daha fazla haç yapılabilmesidir. Mutant kalıtım işlemi sırasında her çekirgedeki mutasyonu doğrulamak için, PCR tabanlı genotipleme için şablon olarak kısa bir anten segmentini sindirmek için alkali lizis yönteminin kullanılması önerilir. Son olarak, popülasyonu genişletmek için daha fazla çapraz geçiş için elde edilen homozigot yetişkinleri kullanın. Homozigot çekirgeler arasındaki popülasyon büyüklüğü ve gelişim aşaması farklılıkları ile sınırlı olarak, göçmen çekirge yumurtalarının düşük sıcaklık diapause ve yüksek sıcaklıkta diapause salınımı prensibine dayanan 6 °C'de kriyoprezervasyon ve gradyan sıcaklık artışı ile resüsitasyon için fazla yumurta önerilmektedir (Şekil 5)32,33.
Kısacası, CRISPR / Cas9 sisteminin, göçmen çekirgelerin fonksiyonel genomiğinin incelenmesini kolaylaştırmak için güvenilir bir araç olduğu kanıtlanmıştır. Bu ayrıntılı protokol, göçmen çekirgelerde ve diğer böceklerde CRISPR / Cas9 tabanlı gen düzenleme uygulamaları için referans olarak kullanılabilir.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma Çin Ulusal Doğa Bilimleri Vakfı (32070502, 31601697, 32072419 ve Çin Doktora Sonrası Bilim Vakfı (2020M672205) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10×NEBuffer r3.1 | New England Biolabs | B7030S | The buffer of in vitro Cas9 cleavage assays |
| 2xEs Taq MasterMix (Dye) | Cwbio | CW0690 | For gene amplification |
| 2xPfu MasterMix (Dye) | Cwbio | CW0686 | For gene amplification |
| CHOPCHOP | Online website for designing sgRNAs, http://chopchop.cbu.uib.no/. | ||
| CRISPOR | Online website for designing sgRNAs, http://crispor.org. | ||
| CRISPRdirect | Online website for designing sgRNAs, http://crispr.dbcls.jp/. | ||
| Electrophoresis power supply | LIUYI BIOLOGY | DYY-6D | Separation of nucleic acid molecules of different sizes |
| Eppendorf Tube | Eppendorf | 30125177 | For sample collection, etc. |
| Fine brushes | Annigoni | 1235 | For cleaning and isolating eggs. Purchased online. |
| Flaming/brown micropipette puller | Sutter Instrument | P97 | For making the microinjection needles |
| Gel Extraction Kit | Cwbio | CW2302 | DNA recovery and purification |
| Gel Imaging Analysis System | OLYMPUS | Gel Doc XR | Observe the electrophoresis results |
| GeneTouch Plus | Bioer | B-48DA | For gene amplification |
| Glass electrode capillary | Gairdner | GD-102 | For making injection needles with a micropipette Puller |
| Incubator | MEMMERT | INplus55 | For migratory locust embryo culture |
| Metal bath | TIANGEN | AJ-800 | For heating the sample |
| Micro autoinjector | Eppendorf | 5253000068 | Microinjection of embryos early in development |
| Micro centrifuge | Allsheng | MTV-1 | Used for mixing reagents |
| Microgrinder | NARISHIGE | EG-401 | To ground the tip of injection needle |
| Microloader | Eppendorf | 5242956003 | For loading solutions into the injection needles. |
| Micromanipulation system | Eppendorf | TransferMan 4r | An altinative manipulation system for microinjection |
| Microscope | cnoptec | SZ780 | For microinjection |
| Motor-drive Manipulator | NARISHIGE | MM-94 | For controling the position of the micropipette during the microinjection precedure |
| Multi-Sample Tissue Grinder | jingxin | Tissuelyser-64 | Grind and homogenize the eggs |
| ovipisition pot | ChangShengYuanYi | CS-11 | Filled with wet sterile sand for locust ovipositing in it. The oocysts are collected from this container. Purchased online. |
| Parafilm | ParafilmM | PM996 | For wrapping the petri dishes. |
| pEASY-T3 Cloning Kit | TransGen Biotech | CT301-01 | For TA cloning |
| Petri dish | NEST | 752001 | For culture and preservation of the eggs. |
| Pipettor | Eppendorf | Research plus | For sample loading |
| plastic culture cup | For rearing locusts seperately and any plastic cup big enough (not less than 1000 mL in volume) will do. Purchased online. | ||
| Precision gRNA Synthesis Kit | Thermo | A29377 | For sgRNA synthesis |
| Primer Premier | PREMIER Biosoft | Primer Premier 5.00 | For primer design |
| SnapGene | Insightful Science | SnapGene®4.2.4 | For analyzing sequences |
| Steel balls | HuaXinGangQiu | HXGQ60 | For sample grinding.Purchased online. |
| Tips | bioleaf | D781349 | For sample loading |
| Trans DNA Marker II | TransGen Biotech | BM411-01 | Used to determine gene size |
| TrueCut Cas9 Protein v2 | Thermo | A36496 | Cas9 protein |
| UniversalGen DNA Kit | Cwbio | CWY004 | For genomic DNA extraction |
| VANNAS Scissors | Electron Microscopy Sciences | 72932-01 | For cutting off the antennae |
| Wheat | To generate wheat seedlings as the food for locusts. Bought from local farmers. | ||
| ZiFiT | Online website for designing sgRNAs, http://zifit.partners.org/ZiFiT/ChoiceMenu.aspx. |
Referanslar
- Doudna, J. A. The promise and challenge of therapeutic genome editing. Nature. 578 (7794), 229-236 (2020).
- van Haasteren, J., Li, J., Scheideler, O. J., Murthy, N., Schaffer, D. V. The delivery challenge: fulfilling the promise of therapeutic genome editing. Nature Biotechnology. 38 (7), 845-855 (2020).
- McCarty, N. S., Graham, A. E., Studena, L., Ledesma-Amaro, R. Multiplexed CRISPR technologies for gene editing and transcriptional regulation. Nature Communications. 11 (1), 1281 (2020).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: Methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
- Anzalone, A. V., Koblan, L. W., Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nature Biotechnology. 38 (7), 824-844 (2020).
- Rees, H. A., Liu, D. R. Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. 19 (12), 770-788 (2018).
- Ishino, Y., Shinagawa, H., Makino, K., Amemura, M., Nakata, A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology. 169 (12), 5429-5433 (1987).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. eLife. 2, 00471 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nature Reviews Molecular Cell Biology. 20 (11), 698-714 (2019).
- Ai, D., et al. Embryo microinjection and knockout mutant identification of CRISPR/Cas9 genome-edited Helicoverpa Armigera (Hubner). Journal of Visualized Experiments: JoVE1. (173), e62068 (2021).
- Huang, Y., et al. CRISPR/Cas9 mediated knockout of the abdominal-A homeotic gene in the global pest, diamondback moth (Plutella xylostella). Insect Biochemistry and Molecular Biology. 75, 98-106 (2016).
- Gratz, S. J., et al. Highly specific and efficient CRISPR/Cas9-catalyzed homology-directed repair in Drosophila. Genetics. 196 (4), 961-971 (2014).
- Kistler, K. E., Vosshall, L. B., Matthews, B. J. Genome engineering with CRISPR-Cas9 in the mosquito Aedes aegypti. Cell Reports. 11 (1), 51-60 (2015).
- Li, Y., et al. CRISPR/Cas9 in locusts: Successful establishment of an olfactory deficiency line by targeting the mutagenesis of an odorant receptor co-receptor (Orco). Insect Biochemistry and Molecular Biology. 79, 27-35 (2016).
- Xu, X., et al. BmHpo mutation induces smaller body size and late stage larval lethality in the silkworm, Bombyx mori. Insect Science. 25 (6), 1006-1016 (2018).
- Chen, D., et al. CRISPR/Cas9-mediated genome editing induces exon skipping by complete or stochastic altering splicing in the migratory locust. BMC Biotechnology. 18 (1), 60 (2018).
- Zhang, T., et al. Egg tanning improves the efficiency of CRISPR/Cas9-mediated mutant locust production by enhancing defense ability after microinjection. Journal of Integrative Agriculture. 20 (10), 2716-2726 (2021).
- Guo, X., et al. 4-Vinylanisole is an aggregation pheromone in locusts. Nature. 584 (7822), 584-588 (2020).
- Zhang, L., Lecoq, M., Latchininsky, A., Hunter, D. Locust and grasshopper management. Annual Review of Entomology. 64, 15-34 (2019).
- Pétavy, G. Origin and development of the vitellophags during embryogenesis of the migratory locust, Locusta migratoria L. (Orthoptera : Acrididae). International Journal of Insect Morphology and Embryology. 14 (6), 361-379 (1985).
- Barry, S. K., et al. Injecting Gryllus bimaculatus eggs. Journal of Visualized Experiments: JoVE. (150), e59726 (2019).
- Watanabe, T., Noji, S., Mito, T. Genome editing in the cricket, Gryllus bimaculatus. Methods in Molecular Biology. 1630, 219-233 (2017).
- Du, M. H., et al. Suppression of Laccase 2 severely impairs cuticle tanning and pathogen resistance during the pupal metamorphosis of Anopheles sinensis (Diptera: Culicidae). Parasites & Vectors. 10 (1), 171 (2017).
- Eisner, T., Shepherd, J., Happ, G. M. Tanning of grasshopper eggs by an exocrine secretion. Science. 152 (3718), 95-97 (1966).
- Ho, K., Dunin-Borkowski, O. M., Akam, M. Cellularization in locust embryos occurs before blastoderm formation. Development. 124 (14), 2761-2768 (1997).
- Wang, X., et al. Interactive effect of photoperiod and temperature on the induction and termination of embryonic diapause in the migratory locust. Pest Managment Science. 77 (6), 2854-2862 (2021).
- Jarwar, A. R., et al. Comparative transcriptomic analysis reveals molecular profiles of central nervous system in maternal diapause induction of Locusta migratoria. G3-Genes Genomes Genetics. 9 (10), 3287-3296 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır