Method Article
基于CRISPR/Cas9技术构建迁徙蝗虫纯合突变体
* 这些作者具有相同的贡献
摘要
本研究为基于CRISPR/Cas9核糖核酸酶构建纯合蝗虫突变体提供了系统优化的程序,以及蝗虫卵冷冻保存和复苏的详细方法。
摘要
迁徙 蝗虫Locusta migratoria,不仅是给人类造成巨大经济损失的世界性瘟疫蝗虫之一,也是昆虫的重要研究模型。CRISPR/Cas9系统可以准确地定位特定的DNA位点并在靶位点内切割,有效地引入双链断裂以诱导靶基因敲除或将新的基因片段整合到特定位点中。CRISPR/Cas9介导的基因组编辑是解决蝗虫研究中遇到的问题的有力工具,也是蝗虫控制的一种有前途的技术。本研究为迁徙蝗虫中具有Cas9蛋白和单向导RNA(sgRNA)复合物的CRISPR / Cas9介导基因敲除提供了系统方案。详细描述了sgRNA靶位点的选择和设计,然后是sgRNA的 体外 合成和验证。后续程序包括卵筏采集和鞣卵分离,以实现低死亡率的成功显微注射、卵培养、突变率的初步估计、蝗虫繁殖以及突变体的检测、保存和传代,以确保编辑的蝗虫种群稳定。该方法可作为基于CRISPR/Cas9的基因编辑在迁徙蝗虫和其他昆虫中的参考应用。
引言
基因编辑技术可用于将插入或缺失引入特定的基因组位点,以人工修改目标基因的目的1。在过去的几年中,CRISPR/Cas9技术发展迅速,在生命科学的各个领域的应用范围越来越大2,3,4,5,6。CRISPR / Cas9系统于1987年发现7,并广泛存在于细菌和古细菌中。进一步的研究表明,它是一种原核适应性免疫系统,依赖于RNA引导的核酸酶Cas9来对抗噬菌体8。人工修饰的CRISPR/Cas9系统主要由两种组分组成,即单一向导RNA(sgRNA)和Cas9蛋白。sgRNA由与靶序列互补的CRISPR RNA(crRNA)和相对保守的辅助反式激活crRNA(tracrRNA)组成。当CRISPR/Cas9系统被激活时,sgRNA与Cas9蛋白形成核糖核蛋白(RNP),并通过RNA-DNA相互作用的碱基配对将Cas9引导到其靶位点。然后,双链DNA可以被Cas9蛋白切割,结果,双链断裂(DSB)出现在靶位点9,10,11,12的原间隔相邻基序(PAM)附近。为了减轻DSB造成的损伤,细胞将激活全面的DNA损伤反应,以有效地检测基因组损伤并启动修复程序。细胞中有两种不同的修复机制:非同源末端连接(NHEJ)和同源定向修复(HDR)。NHEJ是最常见的修复途径,可以快速修复DNA双链断裂并防止细胞凋亡。然而,它容易出错,因为在DSB附近留下了插入和缺失(插入缺失)的小片段,这通常会导致开放的阅读帧偏移,从而导致基因敲除。相比之下,同源修复是相当罕见的事件。在存在序列与DSB上下文同源的修复模板的情况下,细胞偶尔会根据附近的模板修复基因组断裂。HDR的结果是DSB被精确修复。特别是,如果模板中的同源序列之间存在额外的序列,它们将通过HDR整合到基因组中,这样可以实现特定的基因插入13。
随着sgRNA结构和Cas9蛋白变异体的优化和发展,基于CRISPR/Cas9的基因编辑系统也已成功应用于昆虫研究,包括但不限于黑腹果蝇、埃及伊蚊、森邦比克斯、阿米格拉螺旋藻、木星蝇和蝗虫迁徙14,15,16,17,18,19.据作者所知,尽管由Cas9蛋白和体外转录sgRNA组成的RNP已被用于蝗虫基因组编辑20,21,22,但仍然缺乏CRISPR / Cas9核糖核酸酶介导的迁徙蝗虫纯合突变体构建的系统性和详细的方案。
迁徙蝗虫是一种重要的农业害虫,分布全球,对粮食生产构成重大威胁,对小麦、玉米、水稻和小米等禾本科植物尤其有害23。基于基因组编辑技术的基因功能分析可为控制迁徙蝗虫提供新的靶点和新策略。本研究提出了通过CRISPR/Cas9系统 敲 除迁徙蝗虫基因的详细方法,包括靶位点的选择和sgRNA的设计,sgRNA的体外合成和验证,卵子的显微注射和培养,胚胎期突变率的估计,突变体的检测以及突变 体 的传代和保存。该方案可作为操纵绝大多数蝗虫基因的基础参考,可为其他昆虫的基因组编辑提供有价值的参考。
研究方案
1. 靶点选择和sgRNA设计
- 通过在NCBI和蝗虫数据库24上通过文献研究和/或搜索基因的mRNA或编码DNA序列(CDS)收集尽可能多的目标基因的序列信息。
- 将感兴趣的基因序列与其基因组DNA序列进行比较,以区分外显子和内含子区域。
- 根据研究目的选择目标站点设计的候选区域。设计引物对以扩增候选区域片段,并通过PCR产物的测序分析验证其野生型序列。
注意:选择候选目标区域有不同的策略。例如,在大多数基因/蛋白质功能研究中,使用靠近其起始密码子的外显子片段作为候选区域,以确保整个蛋白质/RNA功能在基因组编辑(即基因敲除)后丢失。对于特定域的功能分析,请选择域开头(或两端)的候选区域。 - 使用E-CRISP Design25 等在线资源在候选目标区域中搜索潜在的目标位点。
- 在参考基因组下拉列表中选择"黑腹果蝇BDGP6"(或任何其他昆虫),然后选择"输入是FASTA序列",然后将目标区域的序列粘贴到文本框中(FASTA格式)。
- 通过按"培养基"和"单一设计"的"开始sgRNA搜索"来启动应用程序,以获得可能的靶位点。根据预测分数从结果中选择1-3个潜在靶标,并相应地设计相应的sgRNA。
注意:CRISPR设计还有更多的在线平台,如CRISPOR,CHOPCHOP,CRISPRdirect,ZiFiT等(见 材料表)。其中一些具有对基因组序列数据在其数据库中的物种进行特异性检查的功能。然而,在任何在线网站上都没有找到蝗虫的基因组序列。最好使用多个在线工具进行蝗虫的CRISPR设计。综合考虑不同网站的结果,并根据最高特异性、最高效率和最小错配率的原则从结果中选择sgRNA(图1A,B)。
2. sgRNA体外的合成与验证
- 根据制造商手册(材料表)使用 sgRNA 合成试剂盒合成 sgRNA。该过程通常包括三个步骤:DNA模板扩增, 体外 转录和sgRNA纯化21。用无核酸酶水将合成的 sgRNA 稀释至 300 ng/μL 的储存浓度以供进一步使用。
- 扩增和纯化靶基因片段,作为 CRISPR/Cas9 系统 体外 切割测定的底物。按照制造商的说明执行以下步骤。
- 用无核酸酶水将购买的 Cas9 蛋白稀释至 300 ng/μL。在 37 °C 的切割缓冲液中将 1 μL sgRNA (300 ng/μL) 和 1 μL Cas9 蛋白 (300 ng/μL) 与 200 ng 纯化的目标片段孵育 1 小时(总体积为 10 μL;参见 表 1)。通过琼脂糖凝胶电泳估计sgRNA诱导的Cas9切割的效率(图1C)。选择具有高活性的sgRNA进行以下显微注射。
注意:琼脂糖凝胶电泳的结果可以使用图像处理软件转换为灰度图像,并且根据推测尺寸的条带的灰度估计切割效率。
3. 卵子的显微注射和培养
- 通过用微量移液器拉动玻璃毛细管来准备注射针(材料表)。参数设置如下:加热为 588,拉力设置为 90,速度为 60,时间设置为 40。用微型研磨机研磨注射针的尖端(材料表)。
注意:理想的针尖是开放且锋利的(图2A)。强烈建议为实验准备额外的针头,因为在注射过程中针头有时会堵塞或意外折断。 - 将 1 μL Cas9 蛋白 (300 ng/μL) 与 1 μL 经验证的 sgRNA (300 ng/μL) 混合在一起,以获得用于注射的 RNP。加入 8 μL 无 RNase 无菌水,使混合物的最终体积达到 10 μL。 彻底混合溶液并将其放在冰上。
注意:Cas9蛋白和sgRNA的最终浓度可以根据编辑结果进行优化。避免重复冷冻和解冻制备的RNP溶液,建议立即使用。 - 在30°C下用16(浅):8(暗)光周期将雄性和雌性成年蝗虫一起饲养,并为其提供足够的新鲜小麦幼苗作为食物。每天观察这些蝗虫,并在蝗虫交配后将产卵盆(装满湿无菌沙子的塑料花盆或杯子)放入饲养笼中产卵。
注意:通常,在饲养笼(40 cm x 40 cm x 40 cm)中饲养的100对成年蝗虫足以产生卵以敲除单个基因。如果需要更多的卵,则培养额外的蝗虫对。 - 从产卵罐中收集新鲜产下的蛋荚,等待约30分钟进行蛋鞣。用细刷子将鸡蛋从蛋荚中轻轻地从水中分离出来,并用无菌水清洗三次。将鸡蛋放在培养皿中,并加入无菌水以保持湿润。
注意:新产卵的鞣制可以显着提高突变效率21。 - 用制备的RNP溶液填充注射针,并将其加载到显微操纵器中(材料表)。
- 显微注射参数设置如下:注射压力(pi)为300 hPa,注射时间(ti)为0.5 s,补偿压力(pc)为25 hPa。
- 踩下踏板以评估注入溶液的体积。调整注射压力和注射时间,确保注射量约为50-100nL。
注意:排出针头中的残留空气,以使注射液尽可能连续和可控。针头和显微操纵器的连接需要紧密。
- 将无菌卵定期排列在注射垫上(图2B,C),并将垫放在显微镜的物体台上(图3A)。调整显微镜的放大倍率,直到观察到鸡蛋。在显微镜下调整显微注射针,直到可以看到注射尖端并将其放置在要注射的鸡蛋附近。
- 以合适的高度和30-45度的角度开始注射。小心地将尖端插入鸡蛋的微孔附近的鸡蛋中(图3B),然后踩下踏板以完成注射。快速缩回针头并移动注射垫以注射下一个鸡蛋。
注意:在显微注射过程中应观察到卵子的轻微膨胀。针孔处的少量细胞质渗漏是可以接受的。更换新的注射针,如果流出的过多,请调整注射角度。 - 将注射的卵子转移到培养皿(带有一块湿滤纸的培养皿)中,并将它们置于30°C的培养箱中。
注意:若虫从这些注射的卵中孵化大约需要13-14天(条件是靶基因的突变不会影响胚胎的发育)(图3C)。注射至少100个鸡蛋,以确保有足够的孵化和封闭量来敲除特定基因。
4. 突变率估计和突变体筛选
- 注射后每天检查注射卵子的发育情况。在前5天内每24小时将注射的卵子转移到新的培养皿中。
- 在注射后第6天( 或更晚),随机挑选并将10个鸡蛋转移到管中,并使用研磨机用两个钢球以60 Hz充分研磨鸡蛋6分钟(见 材料表)。用 1 mL PBS 重悬碎片。将 5 μL 混合物转移到 45 μL 的 50 mM NaOH 中,并在 95 °C 下裂解 5 分钟。向裂解系统中加入 5 μL 1 M Tris-HCl (pH=8.0) 以终止碱性裂解反应。
注意:可以在最后一次转移后的任何一天挑选出卵子进行碱性裂解,并且可以根据其发育情况将多个卵子用作一个样品(例如,五个6天大的胚胎可以用作一个样品,两个10天大的胚胎可以用作一个样品)。有时,使用碱裂解法获得鸡蛋的基因组DNA是不可行的。商业基因组DNA提取试剂盒可用作从卵子中分离基因组DNA的替代方法。 - 取1 μL裂解产物作为PCR模板,扩增靶基因片段(表2 和 表3),送PCR产物进行测序。将测序结果与野生型序列进行比较,初步评估CRISPR/Cas9系统是否在 体内 切割了靶基因(图4A)。允许其余的卵子进行后续发育,条件是在胚胎阶段检测到插入缺失。
注意:通过这种方式,可以在胚胎阶段初步估计突变率。如果在此步骤中未发现插入缺失,则为靶基因准备一些新的sgRNA,并重复步骤2.1中的敲除方案。 - 将孵化的若虫转移到饲养笼中,并按照步骤3.3中的说明进行培养。当若虫发育到第五龄期时,用塑料培养杯(1个若虫/杯)将它们分开。
注意:若虫通常需要大约 25-35 天才能发育到第五龄,最明显的表型是翼芽延伸到第四或第五腹节。此外,建议在进一步研究中记录死若虫的表型,以预测靶基因与表型之间的关系。 - 用解剖剪刀切下约2毫米长的触角,并使用碱裂解法裂解(步骤4.2)。如上所述(步骤4.3)分析这些若虫的靶基因片段序列以鉴定G0 突变体(图4B)。
注意:用于裂解的触角切口可以稍长一些,尽管触角可以直接消化,但研磨或切碎触角有助于裂解。测序结果中靶位点附近有多个峰的个体被鉴定为阳性突变体,并允许随后发育和交配。
5. 突变系的建立和传代
- 使用G0 突变体和野生型蝗虫进行杂交育种(图4B)。收集卵囊并在30°C下分别孵育这些卵囊。 如步骤4.2和4.3中所述,在每个卵囊中使用3-6个发育的卵来检测突变。保留突变阳性卵囊以供后续发育,并放弃突变阴性卵囊。
注意:胚胎阶段的突变率估计可以大大加快G1 突变体的筛选。通常,如上所述,可以将3-6个发育的卵子作为一个样品混合,用于PCR介导的基因分型。 - 按照步骤 4.4 中所述饲养 G1 若虫。切断约2mm长的触角以执行基于PCR的基因分型,如步骤4.5中所述,以检测G1 杂合子。根据制造商的说明(参见 材料表)进行TA克隆以鉴定其突变。使用具有相同突变的 G1 杂合子进行杂交以获得 G2 若虫。
注意:PCR产物的Sanger测序只能提供发现杂合子的信息,但没有足够的信息来识别确切的突变。因此,需要使用PCR产物进行TA克隆以明确识别突变,并且可以促进稳定突变系的建立。 - 饲养G2 若虫直到它们的第五龄。使用步骤5.2中描述的基于PCR的基因分型来鉴定适合进一步研究和稳定传代的纯合子和/或杂合子(图4B)。
注意:注意避免纯合子和杂合子混合。建议在每一代中进行基于PCR的基因分型,以确认每个群体的纯合子和/或杂合性。用于此检查的蝗虫数量取决于种群规模。此外,蝗虫的数量可以通过杂交策略扩大。
6. 卵子冷冻保存和复苏
- 用无菌水清洗要冷冻保存的鸡蛋,并如上所述(步骤3.8)在培养皿中孵育5-6天。将这些鸡蛋聚集在培养皿中,并用滤纸碎片覆盖它们。用石蜡膜包裹整个培养皿。
- 将培养皿在25°C下保持2天,然后在相对较低的温度(13-16°C)下再保持2天。然后,将盘子转移到6°C冰箱中。每 2 周加入一次水,为鸡蛋提供潮湿的环境(图 5A)。
注意:胚胎推测在30°C26下发育5-6天后处于katatrepsis阶段。梯度冷却有助于鸡蛋的冷冻保存(表5)。 - 为了复苏冷冻保存的卵子,将培养皿从冰箱中取出并在25°C下保持2天。将这些卵放入30°C孵化器中,直到若虫孵化(图5B)。
注意:在将它们转移到30°C培养箱之前,有必要将冷冻保存的鸡蛋放在25°C。胚胎可以冷冻保存至少五个月,尽管孵化率和封闭率会因冷冻保存而降低(表5)。
结果
该协议包含生成迁徙蝗虫纯合突变体的详细步骤,RNP由Cas9蛋白和 体外 合成的sgRNA组成。以下是CRISPR/Cas9介导的靶基因敲除在蝗虫中的一些代表性结果,包括靶标选择、sgRNA合成和验证(图1A)、卵子采集和注射、突变体筛选和传代、冷冻保存和纯合子卵的复苏。
在这项研究中,根据三个在线程序(E-CRISP,CRISPOR和ZiFit)的结果选择CRISPR / Cas9系统的目标位点,并位于第一个外显子中(图1B)。根据 体外Cas9 切割测定(表1),CRISPR / Cas9 RNP可以消化PCR片段(包含靶位点),切割率约为55%(图1C)。然后,使用标准显微注射系统将该RNP在其单细胞阶段显微注射到120个受精卵中(图2 和 图3)。胚胎阶段突变率估计的测序结果表明,在靶位点进行有效的基因组编辑(图4A)。此外,这项研究导致52.73%的若虫孵化率,66.7%的G0 成虫是马赛克突变体(表4)。
此外,将G0嵌合体与野生型蝗虫杂交以获得杂合的G 1个体,并将具有相同突变的G1杂合子(通过TA克隆筛选)杂交产生G2动物。基于PCR的表型用于检测突变体,并将获得的纯合子杂交以建立稳定的突变体系(图4B)。
同时,对多余的纯合子卵进行冷冻保存,以提高纯合子的利用率。尽管冷冻保存时间的延长降低了冷冻保存种蛋的孵化速率(表5),但补救措施包括使用滤纸碎片保持种蛋湿润,并在温度上升梯度下回收这些腌制种蛋,都有助于复苏(图 5和 表5)。最后,成功保留突变体的纯合群体以供后续研究使用。
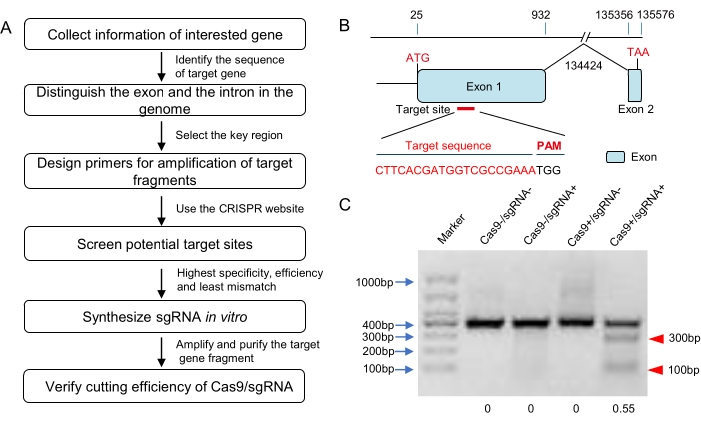
图1:靶标设计和sgRNA的 体外 验证 。 (A)靶标选择、sgRNA合成、 体外 生物活性验证(包括但不限于蝗虫)流程图。(B)基因结构和靶位点示意图。该靶基因的外显子显示为蓝色结构域,并且靶位点被选择在外显子1的起始密码子下游。目标序列以红色突出显示。(C)琼脂糖凝胶电泳结果体 外 Cas9裂解测定。将含有靶序列(长度约400 bp)的DNA片段扩增并用作Cas9消化的底物。预期的小条带(此处约为100 bp和300 bp;用红色三角形标记)表明合成的sgRNA可以诱导有效的Cas9切割。根据灰度分析,裂解率约为55%。 请点击此处查看此图的大图。

图2:刺槐卵的针头制备和显微注射垫。 (A)用于刺槐卵显微注射的准备好的针尖。比例尺:1毫米。 (B)显微注射垫的图片,上面排列着鸡蛋(用红色三角形表示)。比例尺代表 1 厘米。 (C) 显微注射垫的尺寸。请点击此处查看此图的大图。

图3:卵子显微注射。 (A)带有红色框的代表性显微注射系统,表示显微镜(中)和连接到显微注射器的显微操纵器(右)。该计算机用于数据存储和提供辅助观察。(二)注射刺槐卵。注射部位用红色三角形标记。(C)显微镜下孵化的若虫。比例尺代表 1 毫米。 请点击此处查看此图的大图。
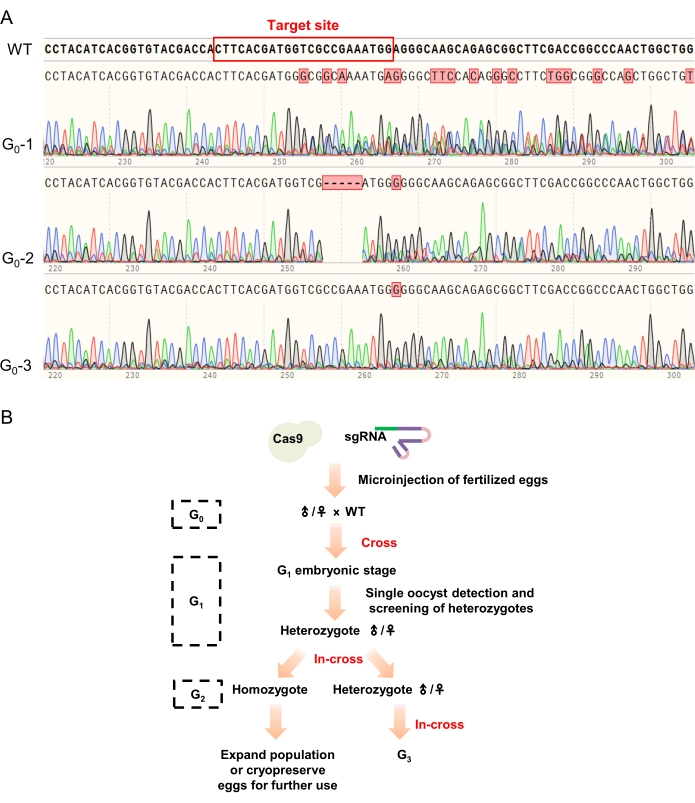
图4:G 0动物的测序结果和突变株系的传代策略。 (A)G0筛选的典型测序结果。靶位点附近的多个峰(在野生型序列中用红色矩形标记)表明被CRISPR/Cas9系统成功编辑了测试的卵/蝗虫(如G 0-1和G0-2所示),而测序结果没有任何变化的个体被认为是未编辑和放弃的(例如, G0-3)。(B)突变系的传代策略。首先通过PCR介导的基因分型对G0动物进行筛选,测序结果中有多个峰的动物与野生型蝗虫杂交,生成G1动物。PCR介导的基因分型和TA克隆用于鉴定G1杂合子。然后,将具有相同突变的杂合子杂交以产生G2动物(纯合子和杂合子)以进行进一步的研究和传代。请点击此处查看此图的大图。

图 5:卵子冷冻保存和复苏。 (A)冷冻保存程序:从蛋荚中分离出卵子,并在用无菌水洗涤后在30°C下孵育5-6天。然后,将发育好的鸡蛋聚集在培养皿中,并用小块潮湿的滤纸覆盖它们。用石蜡膜包裹整个培养皿,并在25°C下保持2天,然后在相对较低的温度(例如,13-16°C)下再保持2天。最后,将其冷藏在6°C。 (B)复苏程序:将装有冷冻保存鸡蛋的培养皿从冰箱中取出,并在去除滤纸屑后在25°C下保持2天。然后,可以将卵培养在30°C下进行后续发育,直到若虫孵化。请点击此处查看此图的大图。
| 试剂 | 体积(微升) |
| Cas9 蛋白 (300 ng/μL) | 1 |
| sgRNA (300 纳克/微升) | 1 |
| PCR 产物 (200 ng/μL) | 1 |
| 10×NEBuffer r3.1 | 1 |
| 无核酸酶水 | 6 |
表1: 体外 消化系统。 将200 ng纯化的靶片段(PCR产物)与CRISPR / Cas9系统(每种组分300 ng)混合,以测试合成的sgRNA的生物活性。使用商业缓冲液并加入无核酸酶的水,使总体积达到10 μL。
| 试剂 | 体积(微升) |
| 2xEs Taq 母混液 | 12.5 |
| 正向引物 | 0.5 |
| 反向底漆 | 0.5 |
| 模板(裂解产物) | 1 |
| 无核酸酶水 | 10.5 |
表2:用于靶基因片段扩增的PCR系统。 为了扩增靶基因的基因组片段,使用了商业Taq混合物,并根据制造商的说明添加了引物。使用1 μL裂解产物作为模板,并使用无核酸酶的水使总体积达到25 μL。
| 温度(°C) | 时间 | 周期 |
| 95 | 5 分钟 | 1 |
| 95 | 30 秒 | 35 |
| 55 | 30 秒 | |
| 72 | 40 秒 | |
| 72 | 10 分钟 | 1 |
表3:用于靶基因扩增的PCR程序。 靶基因扩增的PCR程序为:95°C,持续5分钟;35次循环,95°C持续30秒,55°C持续30秒,72°C持续40秒;72°C10分钟。
| 项目 | 数据 |
| 注射卵数量 | 120 |
| 经过测试的胚胎 | 10 |
| 孵化若虫的数量 | 58 |
| 孵化率 | 52.73% |
| G0 成人人数 | 12 |
| G0 突变体的数量 | 8 |
| G0 成人的突变效率 | 66.67% |
表 4:编辑效率汇总。 注射120个卵子以敲除靶基因,并在胚胎阶段取10个卵子进行测试。从其余胚胎孵化出58只若虫(孵化率为52.73%)。最终,12只G0 蝗虫发育到成虫期,其中8只在目标位点成功编辑。G0 成人突变率为66.67%。
| 控制组 | 组 1 | 第 2 组 | 第 3 组 | 第 4 组 | |
| 鸡蛋数量 | 120 | 120 | 120 | 120 | 120 |
| 储存温度处理 | 30 °C | 30°C (5-6 天)→6 °C | 30°C (5-6 天)→25°C (2 天)→13-16°C (2 天)→6 °C | 30°C (5-6 天)→25°C (2 天)→13-16°C (2 天)→6 °C | 30°C (5-6 天)→25°C (2 天)→13-16°C (2 天)→6 °C |
| 储存时间 | 14天 | 14天 | 1个月 | 3个月 | 5个月 |
| 复苏的温度治疗 | 30 °C | 6°C→30°C | 6°C→25°C (2 天)→30 °C | 6°C→25°C (2 天)→30 °C | 6°C→25°C (2 天)→30 °C |
| 孵化蝗虫数量 | 108 | 0 | 96 | 86 | 78 |
| 孵化率 | 90.00% | 0 | 80.00% | 71.67% | 65.00% |
| 蝗虫成虫数量 | 81 | 0 | 60 | 46 | 31 |
| 闭合率 | 75.00% | 0 | 62.50% | 53.49% | 39.74% |
表5:卵子冷冻保存和复苏的摘要。 将600个卵子分成5组进行冷冻保存和复苏研究。第一组(对照)120个鸡蛋始终在30°C下孵育并储存14天。将第二组(第1组)120枚鸡蛋在30°C孵育5-6天后转移到冰箱中,并在6°C下储存14天。然后,将这些卵子转移到30°C进行复苏。其他组(第2组,第3组和第4组,每组包含120个鸡蛋)按照方案(步骤6.1-6.3)所述进行梯度冷却和恢复温度处理,储存时间不同(第2组为1个月,第3组为3个月,第4组为5个月)。最后,对照组孵化108株若虫(孵化率为90%),其中81株发育到成虫期(闭合率的75%)。第二组(第1组)没有蝗虫孵化。其他组的孵化率和闭合率均低于对照组,且随贮藏时间的延长而下降。96只若虫在第2组孵化,其中60只发育到成虫阶段。86只若虫在第3组孵化,其中46只发育到成虫阶段。在第4组中,78只若虫孵化,其中31只发育到成虫阶段。
讨论
自人类文明以来,蝗虫一直是对农业最具破坏性的害虫之一23.基于CRISPR/Cas9的基因组编辑技术是更好地了解蝗虫生物学机制以及有前途的害虫控制策略的有力工具。因此,开发一种高效且易于使用的CRISPR/Cas9介导的纯合蝗虫突变体构建方法具有很大的益处。尽管已经报道了一些伟大的工作,并为蝗虫基因组编辑提供了一些基本的工作流程18,20,21,22,但仍然缺乏对整个过程的系统优化。一般来说,胚胎注射CRISPR/Cas9系统产生的纯合蝗突变体可分为三大步骤:a)sgRNA设计、合成和体外筛选,b)卵子采集、制备和注射;c)突变体筛选和纯合子维持。该协议提供了优化的工作流程,靶位点选择,体外sgRNA筛选,卵子显微注射以及检测突变体的步骤对于使用CRISPR / Cas9系统有效生成纯合突变蝗虫尤其重要。
首先,靶位点、相应sgRNA的形态和sgRNA的浓度被认为是昆虫基因组编辑效率的关键因素18,27,28。为了解决这个问题,建议首先分析基因结构,并使用在线资源在外显子1或起始密码子附近设计多个靶位点。然后,体外合成sgRNA,并与不同浓度的Cas9蛋白混合,以优化RNP的切割效率。该程序将有助于鉴定具有高生物活性的sgRNA,并优化候选靶基因的RNP复合物组成。
其次,在有限的时间内收集尽可能多的新鲜鸡蛋,提高孵化率和突变率也是基因组编辑操作的一大挑战。在16(浅):8(暗)光周期条件下饲养的群居成虫蝗虫用于在上午9:00-11:00的短时间内收集足够的卵。重要的是用画笔或镊子在鸡蛋之间轻轻向下施加压力,以小心地将鸡蛋与豆荚隔离开来。通过足够的练习,多个用户可以可靠地将单个鸡蛋与豆荚分离。分离每个鸡蛋并用无菌水洗涤后,将卵子对齐在设计的注射垫上(图2B,C),以在显微注射过程中稳定卵子。在小细胞附近将卵子注射优化的RNP。为了限制机械损伤并最大限度地减少鸡蛋的污染,允许新鲜鸡蛋在豆荚中停留约 30 分钟,以确保蛋壳鞣制是显微注射的理想选择21,因为它具有浓缩的结构和足够的鞣制后对入侵的高防御能力29,30.同时,一份已发表的报告表明,蝗虫卵的合胞体分裂31 发生在产卵后0 h至4 h之间的某个时间点。使用当前的标准显微注射方案,可以在40分钟内完成约100个卵子的注射。综上所述,100个受精卵的晒黑和显微注射过程可以在2小时内完成。因此,CRISRP / Cas9介导的切割和靶基因的修复至少还有2小时,以便在注射的卵和未来的成年蝗虫中实现有效突变。
最后,传代和突变鉴定的有效策略对于在大多数突变动物中产生纯合子非常重要。在蝗虫中,对于编辑后非致命的基因,这里建议的交叉策略是G0 突变体与宽型蝗虫杂交,并且可以使用具有相同突变的G1 杂合子进行进一步的杂交,以产生下一代纯合突变体。为了验证突变遗传过程中每个蝗虫的突变,建议使用碱裂解法消化一小段触角作为基于PCR的基因分型的模板。最后,使用获得的纯合成虫进一步杂交以扩大种群。受限于纯合蝗虫的种群规模和发育阶段差异,建议将多余的卵在6°C冷冻保存,并通过梯度温升进行复苏(图5),这是基于迁徙蝗虫卵低温滞育和高温滞育释放的原理32,33。
简而言之,CRISPR/Cas9系统已被证明是促进迁徙蝗虫功能基因组学研究的可靠工具。该详细协议可用作迁徙蝗虫和其他昆虫中基于CRISPR / Cas9的基因编辑应用的参考。
披露声明
提交人声明他们没有利益冲突。
致谢
这项工作得到了国家自然科学基金(32070502,31601697,32072419和中国博士后科学基金(2020M672205)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10×NEBuffer r3.1 | New England Biolabs | B7030S | The buffer of in vitro Cas9 cleavage assays |
| 2xEs Taq MasterMix (Dye) | Cwbio | CW0690 | For gene amplification |
| 2xPfu MasterMix (Dye) | Cwbio | CW0686 | For gene amplification |
| CHOPCHOP | Online website for designing sgRNAs, http://chopchop.cbu.uib.no/. | ||
| CRISPOR | Online website for designing sgRNAs, http://crispor.org. | ||
| CRISPRdirect | Online website for designing sgRNAs, http://crispr.dbcls.jp/. | ||
| Electrophoresis power supply | LIUYI BIOLOGY | DYY-6D | Separation of nucleic acid molecules of different sizes |
| Eppendorf Tube | Eppendorf | 30125177 | For sample collection, etc. |
| Fine brushes | Annigoni | 1235 | For cleaning and isolating eggs. Purchased online. |
| Flaming/brown micropipette puller | Sutter Instrument | P97 | For making the microinjection needles |
| Gel Extraction Kit | Cwbio | CW2302 | DNA recovery and purification |
| Gel Imaging Analysis System | OLYMPUS | Gel Doc XR | Observe the electrophoresis results |
| GeneTouch Plus | Bioer | B-48DA | For gene amplification |
| Glass electrode capillary | Gairdner | GD-102 | For making injection needles with a micropipette Puller |
| Incubator | MEMMERT | INplus55 | For migratory locust embryo culture |
| Metal bath | TIANGEN | AJ-800 | For heating the sample |
| Micro autoinjector | Eppendorf | 5253000068 | Microinjection of embryos early in development |
| Micro centrifuge | Allsheng | MTV-1 | Used for mixing reagents |
| Microgrinder | NARISHIGE | EG-401 | To ground the tip of injection needle |
| Microloader | Eppendorf | 5242956003 | For loading solutions into the injection needles. |
| Micromanipulation system | Eppendorf | TransferMan 4r | An altinative manipulation system for microinjection |
| Microscope | cnoptec | SZ780 | For microinjection |
| Motor-drive Manipulator | NARISHIGE | MM-94 | For controling the position of the micropipette during the microinjection precedure |
| Multi-Sample Tissue Grinder | jingxin | Tissuelyser-64 | Grind and homogenize the eggs |
| ovipisition pot | ChangShengYuanYi | CS-11 | Filled with wet sterile sand for locust ovipositing in it. The oocysts are collected from this container. Purchased online. |
| Parafilm | ParafilmM | PM996 | For wrapping the petri dishes. |
| pEASY-T3 Cloning Kit | TransGen Biotech | CT301-01 | For TA cloning |
| Petri dish | NEST | 752001 | For culture and preservation of the eggs. |
| Pipettor | Eppendorf | Research plus | For sample loading |
| plastic culture cup | For rearing locusts seperately and any plastic cup big enough (not less than 1000 mL in volume) will do. Purchased online. | ||
| Precision gRNA Synthesis Kit | Thermo | A29377 | For sgRNA synthesis |
| Primer Premier | PREMIER Biosoft | Primer Premier 5.00 | For primer design |
| SnapGene | Insightful Science | SnapGene®4.2.4 | For analyzing sequences |
| Steel balls | HuaXinGangQiu | HXGQ60 | For sample grinding.Purchased online. |
| Tips | bioleaf | D781349 | For sample loading |
| Trans DNA Marker II | TransGen Biotech | BM411-01 | Used to determine gene size |
| TrueCut Cas9 Protein v2 | Thermo | A36496 | Cas9 protein |
| UniversalGen DNA Kit | Cwbio | CWY004 | For genomic DNA extraction |
| VANNAS Scissors | Electron Microscopy Sciences | 72932-01 | For cutting off the antennae |
| Wheat | To generate wheat seedlings as the food for locusts. Bought from local farmers. | ||
| ZiFiT | Online website for designing sgRNAs, http://zifit.partners.org/ZiFiT/ChoiceMenu.aspx. |
参考文献
- Doudna, J. A. The promise and challenge of therapeutic genome editing. Nature. 578 (7794), 229-236 (2020).
- van Haasteren, J., Li, J., Scheideler, O. J., Murthy, N., Schaffer, D. V. The delivery challenge: fulfilling the promise of therapeutic genome editing. Nature Biotechnology. 38 (7), 845-855 (2020).
- McCarty, N. S., Graham, A. E., Studena, L., Ledesma-Amaro, R. Multiplexed CRISPR technologies for gene editing and transcriptional regulation. Nature Communications. 11 (1), 1281 (2020).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: Methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
- Anzalone, A. V., Koblan, L. W., Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nature Biotechnology. 38 (7), 824-844 (2020).
- Rees, H. A., Liu, D. R. Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. 19 (12), 770-788 (2018).
- Ishino, Y., Shinagawa, H., Makino, K., Amemura, M., Nakata, A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology. 169 (12), 5429-5433 (1987).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. eLife. 2, 00471 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nature Reviews Molecular Cell Biology. 20 (11), 698-714 (2019).
- Ai, D., et al. Embryo microinjection and knockout mutant identification of CRISPR/Cas9 genome-edited Helicoverpa Armigera (Hubner). Journal of Visualized Experiments: JoVE1. (173), e62068 (2021).
- Huang, Y., et al. CRISPR/Cas9 mediated knockout of the abdominal-A homeotic gene in the global pest, diamondback moth (Plutella xylostella). Insect Biochemistry and Molecular Biology. 75, 98-106 (2016).
- Gratz, S. J., et al. Highly specific and efficient CRISPR/Cas9-catalyzed homology-directed repair in Drosophila. Genetics. 196 (4), 961-971 (2014).
- Kistler, K. E., Vosshall, L. B., Matthews, B. J. Genome engineering with CRISPR-Cas9 in the mosquito Aedes aegypti. Cell Reports. 11 (1), 51-60 (2015).
- Li, Y., et al. CRISPR/Cas9 in locusts: Successful establishment of an olfactory deficiency line by targeting the mutagenesis of an odorant receptor co-receptor (Orco). Insect Biochemistry and Molecular Biology. 79, 27-35 (2016).
- Xu, X., et al. BmHpo mutation induces smaller body size and late stage larval lethality in the silkworm, Bombyx mori. Insect Science. 25 (6), 1006-1016 (2018).
- Chen, D., et al. CRISPR/Cas9-mediated genome editing induces exon skipping by complete or stochastic altering splicing in the migratory locust. BMC Biotechnology. 18 (1), 60 (2018).
- Zhang, T., et al. Egg tanning improves the efficiency of CRISPR/Cas9-mediated mutant locust production by enhancing defense ability after microinjection. Journal of Integrative Agriculture. 20 (10), 2716-2726 (2021).
- Guo, X., et al. 4-Vinylanisole is an aggregation pheromone in locusts. Nature. 584 (7822), 584-588 (2020).
- Zhang, L., Lecoq, M., Latchininsky, A., Hunter, D. Locust and grasshopper management. Annual Review of Entomology. 64, 15-34 (2019).
- Pétavy, G. Origin and development of the vitellophags during embryogenesis of the migratory locust, Locusta migratoria L. (Orthoptera : Acrididae). International Journal of Insect Morphology and Embryology. 14 (6), 361-379 (1985).
- Barry, S. K., et al. Injecting Gryllus bimaculatus eggs. Journal of Visualized Experiments: JoVE. (150), e59726 (2019).
- Watanabe, T., Noji, S., Mito, T. Genome editing in the cricket, Gryllus bimaculatus. Methods in Molecular Biology. 1630, 219-233 (2017).
- Du, M. H., et al. Suppression of Laccase 2 severely impairs cuticle tanning and pathogen resistance during the pupal metamorphosis of Anopheles sinensis (Diptera: Culicidae). Parasites & Vectors. 10 (1), 171 (2017).
- Eisner, T., Shepherd, J., Happ, G. M. Tanning of grasshopper eggs by an exocrine secretion. Science. 152 (3718), 95-97 (1966).
- Ho, K., Dunin-Borkowski, O. M., Akam, M. Cellularization in locust embryos occurs before blastoderm formation. Development. 124 (14), 2761-2768 (1997).
- Wang, X., et al. Interactive effect of photoperiod and temperature on the induction and termination of embryonic diapause in the migratory locust. Pest Managment Science. 77 (6), 2854-2862 (2021).
- Jarwar, A. R., et al. Comparative transcriptomic analysis reveals molecular profiles of central nervous system in maternal diapause induction of Locusta migratoria. G3-Genes Genomes Genetics. 9 (10), 3287-3296 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。