Method Article
بناء طفرات متماثلة الزيجوت من الجراد المهاجر باستخدام تقنية كريسبر / كاس 9
* These authors contributed equally
In This Article
Summary
توفر هذه الدراسة إجراء محسنا بشكل منهجي للبناء القائم على الريبونوكلياز CRISPR / Cas9 لمتحولات الجراد متماثل الزيجوت بالإضافة إلى طريقة مفصلة للحفظ بالتبريد وإنعاش بيض الجراد.
Abstract
الجراد المهاجر ، Locusta migratoria ، ليس فقط أحد جراد الطاعون في جميع أنحاء العالم الذي تسبب في خسائر اقتصادية هائلة للبشر ولكنه أيضا نموذج بحثي مهم لتحول الحشرات. يمكن لنظام CRISPR / Cas9 تحديد موقع دقيق في موضع معين من الحمض النووي والالتصاق داخل الموقع المستهدف ، مما يؤدي بكفاءة إلى إدخال فواصل مزدوجة الخيوط للحث على خروج الضربة القاضية للجين المستهدف أو دمج شظايا جينية جديدة في موضع معين. يعد تحرير الجينوم بوساطة كريسبر / كاس 9 أداة قوية لمعالجة الأسئلة التي تتم مواجهتها في أبحاث الجراد بالإضافة إلى تقنية واعدة لمكافحة الجراد. توفر هذه الدراسة بروتوكولا منهجيا للضربة القاضية الجينية بوساطة كريسبر / كاس 9 مع مركب بروتين Cas9 والحمض النووي الريبي أحادي التوجيه (sgRNAs) في الجراد المهاجر. يتم وصف اختيار المواقع المستهدفة وتصميم sgRNA بالتفصيل ، يليه التوليف في المختبر والتحقق من sgRNAs. تشمل الإجراءات اللاحقة جمع طوف البيض وفصل البيض المدبوغ لتحقيق الحقن المجهري الناجح مع معدل وفيات منخفض ، وزراعة البيض ، والتقدير الأولي لمعدل الطفرة ، وتكاثر الجراد ، وكذلك اكتشاف وحفظ ومرور الطفرات لضمان استقرار أعداد الجراد المحرر. يمكن استخدام هذه الطريقة كمرجع لتطبيقات تحرير الجينات القائمة على كريسبر / كاس 9 في الجراد المهاجر وكذلك في الحشرات الأخرى.
Introduction
يمكن استخدام تقنيات تحرير الجينات لإدخال عمليات الإدراج أو الحذف في موضع جينوم معين لتعديل الجين المستهدف بشكل مصطنع عن الغرض1. في السنوات الماضية ، تطورت تقنية CRISPR / Cas9 بسرعة ولديها نطاق متزايد من التطبيقات في مختلف مجالات علوم الحياة2،3،4،5،6. تم اكتشاف نظام CRISPR / Cas9 في عام 19877 ، ويوجد على نطاق واسع في البكتيريا والعتائق. أشارت الأبحاث الإضافية إلى أنه كان نظاما مناعيا تكيفيا بدائيات النواة يعتمد على النيوكلياز الموجه بالحمض النووي الريبي Cas9 لمحاربة العاثيات8. يتكون نظام CRISPR / Cas9 المعدل صناعيا بشكل أساسي من مكونين ، RNA موجه واحد (sgRNA) وبروتين Cas9. يتكون sgRNA من CRISPR RNA (crRNA) مكمل للتسلسل المستهدف و crRNA مساعد منشط (tracrRNA) ، والذي يتم حفظه نسبيا. عندما يتم تنشيط نظام CRISPR / Cas9 ، يشكل sgRNA بروتين نووي ريبي (RNP) مع بروتين Cas9 ويوجه Cas9 إلى موقعه المستهدف عبر الاقتران الأساسي لتفاعلات الحمض النووي الريبي والحمض النووي. بعد ذلك ، يمكن شق الحمض النووي المزدوج الخيط بواسطة بروتين Cas9 ونتيجة لذلك ، يظهر كسر الشريط المزدوج (DSB) بالقرب من الشكل المجاور للفضاء الأولي (PAM) للموقع المستهدف9،10،11،12. للتخفيف من الضرر الناجم عن DSBs ، ستقوم الخلايا بتنشيط استجابات تلف الحمض النووي الشاملة للكشف بكفاءة عن الأضرار الجينومية وبدء إجراء الإصلاح. هناك آليتان متميزتان للإصلاح في الخلية: الانضمام النهائي غير المتماثل (NHEJ) والإصلاح الموجه بالتماثل (HDR). NHEJ هو مسار الإصلاح الأكثر شيوعا الذي يمكنه إصلاح فواصل الحمض النووي المزدوجة بسرعة ويمنع موت الخلايا المبرمج. ومع ذلك ، فهو عرضة للخطأ بسبب ترك أجزاء صغيرة من عمليات الإدراج والحذف (indels) بالقرب من DSBs ، مما يؤدي عادة إلى تحول إطار قراءة مفتوح وبالتالي يمكن أن يؤدي إلى خروج الجينات بالضربة القاضية. في المقابل ، يعد الإصلاح المتماثل حدثا نادرا جدا. بشرط وجود قالب إصلاح بتسلسلات متماثلة مع سياق DSB ، تقوم الخلايا أحيانا بإصلاح الكسر الجينومي وفقا للقالب القريب. نتيجة HDR هي أن DSB يتم إصلاحه بدقة. على وجه الخصوص ، إذا كان هناك تسلسل إضافي بين التسلسلات المتماثلة في القالب ، دمجها في الجينوم من خلال HDR ، وبهذه الطريقة ، يمكن تحقيق إدخالات الجينات المحددة13.
مع تحسين وتطوير هياكل sgRNA ومتغيرات بروتين Cas9 ، تم أيضا تطبيق نظام التحرير الجيني القائم على CRISPR / Cas9 بنجاح في أبحاث الحشرات ، بما في ذلك على سبيل المثال لا الحصر ذبابة الفاكهة الميلانوجاستر ، الزاعجة المصرية ، بومبيكس موري ، هليكوفيرا أرميجيرا ، بلوتيلا زيلوستيلا ، والجراد المهاجر14،15،16،17،18، 19. على حد علم المؤلفين ، على الرغم من استخدام RNPs التي تتكون من بروتين Cas9 و sgRNA المنسوخ في المختبر لتحرير جينوم الجراد20،21،22 ، لا يزال هناك بروتوكول منهجي ومفصل للبناء بوساطة CRISPR / Cas9 ribonuclease للطفرات متماثلة الزيجوت للجراد المهاجر.
الجراد المهاجر هو آفة زراعية مهمة لها توزيع عالمي وتشكل تهديدات كبيرة لإنتاج الغذاء ، كونها ضارة بشكل خاص بالنباتات الجرامينية ، مثل القمح والذرة والأرز والدخن23. يمكن أن يوفر تحليل وظائف الجينات القائم على تقنيات تحرير الجينوم أهدافا جديدة واستراتيجيات جديدة لمكافحة الجراد المهاجر. تقترح هذه الدراسة طريقة مفصلة لضرب جينات الجراد المهاجر عبر نظام CRISPR / Cas9 ، بما في ذلك اختيار المواقع المستهدفة وتصميم sgRNAs ، والتوليف في المختبر والتحقق من sgRNAs ، والحقن المجهري وثقافة البيض ، وتقدير معدل الطفرات في المرحلة الجنينية ، والكشف عن الطفرات وكذلك مرور الطفرات والحفاظ عليها. يمكن استخدام هذا البروتوكول كمرجع أساسي لمعالجة الغالبية العظمى من جينات الجراد ويمكن أن يوفر مراجع قيمة لتحرير الجينوم للحشرات الأخرى.
Protocol
1. اختيار الموقع المستهدف وتصميم sgRNA
- اجمع أكبر قدر ممكن من معلومات التسلسل للجين محل الاهتمام من خلال البحث في الأدبيات و / أو البحث عن mRNA أو ترميز تسلسل الحمض النووي (CDS) للجين في قاعدة بيانات NCBI والجراد24.
- قارن تتابع الجين المعني بتتابع الحمض النووي الجينومي الخاص به لتمييز منطقتي إكسون وإنترون.
- حدد منطقة مرشحة لتصميم الموقع المستهدف بناء على الغرض من البحث. صمم أزواجا أولية لتضخيم جزء المنطقة المرشحة والتحقق من تسلسلها من النوع البري عن طريق تحليل تسلسل منتج تفاعل البوليميراز المتسلسل.
ملاحظة: هناك استراتيجيات مختلفة لاختيار المنطقة المستهدفة المرشحة. على سبيل المثال ، في معظم أبحاث وظائف الجينات / البروتين ، استخدم جزء الإكسون بالقرب من كودون البداية كمنطقة مرشحة لضمان فقدان وظيفة البروتين / الحمض النووي الريبي بالكامل بعد تحرير الجينوم (أي خروج المغلوب الجيني). أثناء تحليل وظيفة مجال معين ، حدد المنطقة المرشحة في بداية (أو كلا الطرفين) للمجال. - استخدم الموارد عبر الإنترنت مثل E-CRISP Design25 للبحث عن المواقع المستهدفة المحتملة في المنطقة المستهدفة المرشحة.
- حدد "Drosophila melanogaster BDGP6" (أو أي حشرة أخرى) في القائمة المنسدلة للجينومات المرجعية واختر "الإدخال هو تسلسل FASTA" متبوعا بلصق تسلسل المنطقة المستهدفة في مربع النص (بتنسيق FASTA).
- ابدأ التطبيق بالضغط على "بدء بحث sgRNA" باستخدام "متوسط" و "تصميم فردي" للحصول على المواقع المستهدفة المحتملة. حدد 1-3 أهداف محتملة من النتائج بناء على درجاتها المتوقعة وصمم sgRNAs المقابلة وفقا لذلك.
ملاحظة: هناك العديد من المنصات عبر الإنترنت لتصميم CRISPR ، مثل CRISPOR و CHOP و CRISPRdirect و ZiFiT وما إلى ذلك (انظر جدول المواد). بعضها لديه وظيفة التحقق من الخصوصية للأنواع التي توجد بيانات التسلسل الجيني الخاصة بها في قواعد بياناتها. ومع ذلك ، لم يتم العثور على التسلسل الجيني للجراد على أي موقع على الإنترنت. من الأفضل استخدام أكثر من أداة عبر الإنترنت لتصميم كريسبر في الجراد. بشكل شامل ، ضع في اعتبارك النتائج من مواقع الويب المختلفة وحدد sgRNA من النتائج على مبدأ أعلى خصوصية وأعلى كفاءة وأقل معدل عدم تطابق (الشكل 1 أ ، ب).
2. توليف والتحقق من sgRNA في المختبر
- توليف sgRNA باستخدام مجموعات تخليق sgRNA وفقا لدليل الشركة المصنعة (جدول المواد). يتضمن هذا الإجراء عادة ثلاث خطوات: تضخيم قالب الحمض النووي ، والنسخ في المختبر ، وتنقية sgRNA21. قم بتخفيف sgRNA المركب بالماء الخالي من النيوكلياز إلى تركيز تخزين 300 نانوغرام / ميكرولتر لمزيد من الاستخدام.
- تضخيم وتنقية جزء الجين المستهدف ليكون بمثابة الركيزة لمقايسة الانقسام في المختبر لنظام CRISPR / Cas9. قم بتنفيذ هذه الخطوات باتباع إرشادات الشركة المصنعة.
- قم بتخفيف بروتين Cas9 الذي تم شراؤه إلى 300 نانوغرام / ميكرولتر بالماء الخالي من النيوكلياز. احتضان 1 ميكرولتر من sgRNA (300 نانوغرام / ميكرولتر) و 1 ميكرولتر من بروتين Cas9 (300 نانوغرام / ميكرولتر) مع 200 نانوغرام من الجزء المستهدف المنقى في المخزن المؤقت للانقسام عند 37 درجة مئوية لمدة 1 ساعة (10 ميكرولتر من الحجم الكلي ؛ انظر الجدول 1). تقدير كفاءة انشقاق Cas9 الناجم عن sgRNA بواسطة الرحلان الكهربائي لهلام الأغاروز (الشكل 1C). حدد sgRNAs ذات النشاط العالي للحقن المجهري التالي.
ملاحظة: يمكن تحويل نتائج الرحلان الكهربائي لهلام الأغاروز إلى صور ذات تدرج رمادي باستخدام برنامج معالجة الصور ويتم تقدير كفاءة الانقسام وفقا للتدرج الرمادي لنطاقات الأحجام المتوقعة.
3. الحقن المجهري وزراعة البيض
- تحضير إبر الحقن عن طريق سحب الشعيرات الدموية الزجاجية مع مجتذب micropipette (جدول المواد). اضبط المعلمات على النحو التالي: الحرارة إلى 588 ، والسحب إلى 90 ، والسرعة إلى 60 ، والوقت إلى 40. طحن طرف إبرة الحقن مع طاحونة صغيرة (جدول المواد).
ملاحظة: أطراف الإبرة المثالية مفتوحة وحادة الحواف (الشكل 2 أ). يوصى بشدة بإعداد إبر إضافية للتجارب لأن الإبر يتم حظرها أحيانا أو كسرها عن طريق الخطأ أثناء الحقن. - امزج 1 ميكرولتر من بروتين Cas9 (300 نانوغرام / ميكرولتر) مع 1 ميكرولتر من sgRNA الذي تم التحقق منه (300 نانوغرام / ميكرولتر) معا للحصول على RNPs للحقن. أضف 8 ميكرولتر من الماء المعقم الخالي من RNase لجعل الحجم النهائي للخليط يصل إلى 10 ميكرولتر. امزج المحلول جيدا واحتفظ به على الجليد.
ملاحظة: يمكن تحسين التركيزات النهائية لبروتين Cas9 و sgRNAs وفقا لنتائج التحرير. تجنب التجميد المتكرر وذوبان محلول RNP المحضر ويوصى بالاستخدام الفوري. - قم بتربية ذكور وإناث الجراد البالغ معا عند 30 درجة مئوية مع فترة ضوئية 16 (خفيفة): 8 (داكنة) وزودهم بشتلات القمح الطازج الكافية كغذاء. راقب هذا الجراد يوميا وضع وعاء وضع البيض (إناء زهور بلاستيكي أو كوب مملوء بالرمل المعقم الرطب) في قفص التربية لوضع البيض بمجرد تزاوج الجراد.
ملاحظة: عادة ما يكون 100 زوج من الجراد البالغ الذي يتم تربيته في قفص تربية (40 سم × 40 سم × 40 سم) كافيا لتوليد بيض لضرب جين واحد. استزرع أزواج الجراد الإضافية إذا كانت هناك حاجة إلى المزيد من البيض. - اجمع قرون البيض الطازجة من وعاء وضع البيض وانتظر حوالي 30 دقيقة لدباغة البيض. اعزل البيض برفق عن قرون البيض في الماء باستخدام فرشاة ناعمة واغسلها بالماء المعقم ثلاث مرات. احتفظ بالبيض في طبق بتري وأضف الماء المعقم للحفاظ على رطوبته.
ملاحظة: يمكن أن يؤدي دباغة البيض الذي تم وضعه حديثا إلى تحسين كفاءة الطفرة بشكل كبير21. - املأ إبرة الحقن بمحلول RNP المحضر وقم بتحميله إلى المعالج الدقيق (جدول المواد).
- اضبط معلمات الحقن المجهري على النحو التالي: 300 hPa من ضغط الحقن (pi) ، 0.5 ثانية من وقت الحقن (ti) ، و 25 hPa من ضغط التعويض (pc).
- اضغط على الدواسة لتقييم حجم المحلول المحقون. اضبط ضغط الحقن ووقت الحقن للتأكد من أن حجم الحقن حوالي 50-100 نانولتر.
ملاحظة: استنفاد الهواء المتبقي في الإبرة لجعل محلول الحقن مستمرا ويمكن التحكم فيه قدر الإمكان. يجب أن يكون اتصال الإبرة والمعالج الدقيق ضيقا.
- رتب البويضات المعقمة بانتظام على وسادة الحقن (الشكل 2 ب ، ج) وضع الوسادة على طاولة الكائن في المجهر (الشكل 3 أ). اضبط تكبير المجهر حتى يتم ملاحظة البيض. اضبط إبرة الحقن المجهري تحت المجهر حتى يمكن رؤية طرف الحقن وضعه بالقرب من البويضة المراد حقنها.
- ابدأ الحقن على ارتفاع مناسب وزاوية 30-45 درجة. أدخل الطرف في البيضة بعناية بالقرب من ميكروبايل البيضة (الشكل 3 ب) واضغط على الدواسة لإنجاز الحقن. اسحب الإبرة بسرعة وحرك وسادة الحقن لحقن البويضة التالية.
ملاحظة: يجب ملاحظة توسع طفيف في البويضة أثناء الحقن المجهري. كمية صغيرة من تسرب السيتوبلازم في الثقب مقبولة. استبدل إبرة الحقن بإبرة جديدة أو اضبط زاوية الحقن إذا كان تدفق السائل أكثر من اللازم. - انقل البيض المحقون إلى طبق استزراع (طبق بتري مع قطعة من ورق الترشيح الرطب) ، وضعه في حاضنة على حرارة 30 درجة مئوية.
ملاحظة: سوف يستغرق الأمر حوالي 13-14 يوما حتى تفقس الحوريات من هذه البويضات المحقونة (بشرط ألا تؤثر طفرة الجين المستهدف على تطور الأجنة) (الشكل 3C). حقن ما لا يقل عن 100 بيضة لضمان كمية كافية من الفقس و eclosion لضرب جين معين.
4. تقدير معدل الطفرات وفحص الطفرات
- تحقق من تطور البيض المحقون كل يوم بعد الحقن. انقل البيض المحقون إلى طبق استزراع جديد كل 24 ساعة في أول 5 أيام.
- فياليوم السادس (أو في وقت لاحق) بعد الحقن ، اختر ونقل 10 بيضات بشكل عشوائي إلى أنبوب وطحن البيض بشكل كاف باستخدام كرتين فولاذيتين عند 60 هرتز لمدة 6 دقائق باستخدام مطحنة (انظر جدول المواد). أعد تعليق الحطام ب 1 مل من PBS. انقل 5 ميكرولتر من الخليط إلى 45 ميكرولتر من 50 مللي مول هيدروكسيد الصوديوم وتحلل عند 95 درجة مئوية لمدة 5 دقائق. أضف 5 ميكرولتر من 1 M Tris-HCl (الرقم الهيدروجيني = 8.0) إلى نظام التحلل لإنهاء تفاعل التحلل القلوي.
ملاحظة: يمكن قطف البيض للتحلل القلوي في أي يوم بعد النقل الأخير ويمكن استخدام بويضات متعددة كعينة واحدة اعتمادا على حالة نموها (على سبيل المثال ، يمكن استخدام خمسة أجنة عمرها 6 أيام كعينة واحدة ، ويمكن استخدام جنينين بعمر 10 أيام كعينة واحدة). في بعض الأحيان ، لا يكون من الممكن الحصول على الحمض النووي الجينومي للبيض باستخدام طريقة التحلل القلوي. يمكن استخدام مجموعات استخراج الحمض النووي الجينومي التجارية كطريقة بديلة لعزل الحمض النووي الجينومي من البيض. - خذ 1 ميكرولتر من منتج التحلل كقالب PCR لتضخيم جزء الجين المستهدف (الجدول 2 والجدول 3) وإرسال منتجات تفاعل البوليميراز المتسلسل للتسلسل. قارن نتائج التسلسل مع تسلسل النوع البري لتقييم مبدئي ما إذا كان نظام CRISPR / Cas9 قد شق الجين المستهدف في الجسم الحي (الشكل 4A). السماح لبقية البيض للتطور اللاحق بشرط أن يتم الكشف عن indels في المرحلة الجنينية.
ملاحظة: بهذه الطريقة ، يمكن تقدير معدل الطفرة بشكل مبدئي في مرحلة الجنين. إذا لم يتم العثور على indels في هذه الخطوة ، فقم بإعداد بعض sgRNAs الجديدة للجين المستهدف وكرر بروتوكول خروج المغلوب من الخطوة 2.1. - نقل الحوريات المفرغة إلى قفص تربية واستزراعها كما هو موضح في الخطوة 3.3. عندما تطورت الحوريات إلى المرحلة الخامسة ، افصلها بأكواب الثقافة البلاستيكية (1 حورية / كوب).
ملاحظة: عادة ما يستغرق الأمر حوالي 25-35 يوما حتى تتطور الحوريات إلى الجزء الخامس من الطور والنمط الظاهري الأكثر وضوحا هو أن براعم الجناح تمتد إلى الجزء الرابع أو الخامس من البطن. علاوة على ذلك ، يوصى بتسجيل الأنماط الظاهرية للحوريات الميتة للتنبؤ بالعلاقة بين الجين المستهدف والأنماط الظاهرية في مزيد من البحث. - قطع حوالي 2 مم طول الهوائيات مع مقص تشريح وتحليلها باستخدام طريقة التحلل القلوي (الخطوة 4.2). قم بتحليل تسلسل جزء الجين المستهدف لهذه الحوريات كما هو موضح أعلاه (الخطوة 4.3) لتحديد طفرات G0 (الشكل 4B).
ملاحظة: يمكن أن يكون قطع الهوائيات للتحلل أطول قليلا وطحن الهوائيات أو فرمها مفيد للتحلل على الرغم من أنه يمكن هضم الهوائيات مباشرة. يتم تحديد الأفراد الذين لديهم قمم متعددة بالقرب من الموقع المستهدف في نتيجة التسلسل على أنهم طفرات إيجابية ويسمح لهم بالتطور والتزاوج اللاحق.
5. إنشاء وتمرير خطوط متحولة
- إجراء التهجين باستخدام طفرات G0 والجراد البري (الشكل 4B). اجمع البويضات واحتضن هذه البويضات بشكل منفصل عند 30 درجة مئوية. استخدم 3-6 بويضات مطورة في كل كيس بويضة للكشف عن الطفرات كما هو موضح في الخطوتين 4.2 و 4.3. احتفظ بالبويضات إيجابية الطفرة للتطور اللاحق والتخلي عن البويضات السلبية الطفرة.
ملاحظة: يمكن أن يؤدي تقدير معدل الطفرة في المرحلة الجنينية إلى تسريع فحص طفرات G1 بشكل كبير. عادة ، يمكن خلط 3-6 بويضات مطورة كعينة واحدة للتنميط الجيني بوساطة تفاعل البوليميراز المتسلسل كما هو موضح أعلاه. - قم بإرجاع حوريات G1 كما هو موضح في الخطوة 4.4. قطع حوالي 2 مم من طول الهوائيات لإجراء التنميط الجيني القائم على تفاعل البوليميراز المتسلسل كما هو موضح في الخطوة 4.5 للكشف عن G1 متغاير الزيجوت. قم بإجراء استنساخ TA وفقا لتعليمات الشركة المصنعة (انظر جدول المواد) لتحديد طفراتها. أداء في التقاطع باستخدام G1 متغاير الزيجوت مع نفس الطفرات للحصول على G2 الحوريات.
ملاحظة: يمكن أن يوفر تسلسل سانجر لمنتجات تفاعل البوليميراز المتسلسل معلومات فقط لمعرفة الزيجوتات غير المتجانسة ، ولكن ليس معلومات كافية لتحديد الطفرات الدقيقة. وبالتالي ، فإن استنساخ TA باستخدام منتجات تفاعل البوليميراز المتسلسل مطلوب لتحديد الطفرات بوضوح ويمكن أن يعزز إنشاء خطوط متحولة مستقرة. - قم بتربية حوريات G2 حتى نجمها الخامس. استخدم التنميط الجيني القائم على تفاعل البوليميراز المتسلسل الموصوف في الخطوة 5.2 لتحديد الزيجوت المتماثل و / أو الزيجوتات غير المتجانسة المناسبة لمزيد من البحث والمرور المستقر (الشكل 4 ب).
ملاحظة: انتبه لتجنب خلط الزيجوت المتماثل والزيجوت. يوصى بإجراء التنميط الجيني القائم على تفاعل البوليميراز المتسلسل في كل جيل لتأكيد الزيجوت المتماثل و / أو تغاير الزيجوت لكل مجموعة سكانية. يعتمد عدد الجراد المستخدم في هذا الفحص على حجم السكان. علاوة على ذلك ، يمكن توسيع أعداد الجراد من خلال استراتيجية الصليب.
6. حفظ البيض بالتبريد والإنعاش
- اغسل البيض المراد حفظه بالماء المعقم واحتضانه في طبق استزراع كما هو موضح أعلاه (الخطوة 3.8) لمدة 5-6 أيام. اجمع هذه البيض معا في طبق الاستزراع وقم بتغطيتها بشظايا ورق الترشيح. لف طبق الثقافة بأكمله بفيلم البارافين.
- احفظ الطبق على حرارة 25 درجة مئوية لمدة يومين متبوعا بيومين آخرين عند درجة حرارة منخفضة نسبيا (13-16 درجة مئوية). ثم انقلي الطبق إلى ثلاجة على حرارة 6 درجات مئوية. أضف الماء إليه كل 2 أسابيع لتوفير بيئة رطبة للبيض (الشكل 5 أ).
ملاحظة: يعتقد أن الأجنة في مرحلة القطاتريبسيس بعد تطورها لمدة 5-6 أيام عند 30 درجة مئوية26. التبريد المتدرج مفيد للحفظ بالتبريد للبيض (الجدول 5). - لإنعاش البيض المحفوظ بالتبريد ، أخرج طبق بتري من الثلاجة واحتفظ به عند 25 درجة مئوية لمدة يومين. ضع هذه البيض في حاضنة 30 درجة مئوية حتى تفقس الحوريات (الشكل 5 ب).
ملاحظة: من الضروري وضع البيض المحفوظ بالتبريد عند 25 درجة مئوية قبل نقله إلى حاضنة 30 درجة مئوية. يمكن حفظ الأجنة بالتبريد لمدة خمسة أشهر على الأقل على الرغم من أن معدل الفقس ومعدل الاختزال يمكن أن ينخفض بسبب الحفظ بالتبريد (الجدول 5).
النتائج
يحتوي هذا البروتوكول على الخطوات التفصيلية لتوليد طفرات متماثلة الزيجوت من الجراد المهاجر مع RNP الذي يتكون من بروتين Cas9 و sgRNA المركب في المختبر . فيما يلي بعض النتائج التمثيلية للضربة القاضية الجينية المستهدفة بوساطة كريسبر / كاس9 في الجراد ، بما في ذلك اختيار الهدف ، وتوليف sgRNA والتحقق منه (الشكل 1 أ) ، وجمع البيض وحقنه ، وفحص الطفرات وتمريرها ، والحفظ بالتبريد ، وإنعاش البيض متماثل الزيجوت.
في هذه الدراسة ، تم اختيار الموقع المستهدف لنظام CRISPR / Cas9 وفقا لنتائج ثلاثة برامج عبر الإنترنت (E-CRISP و CRISPOR و ZiFit) ويقع في أول إكسون (الشكل 1 ب). وفقا لمقايسة الانقسام Cas9 في المختبر (الجدول 1) ، يمكن ل CRISPR / Cas9 RNP هضم جزء تفاعل البوليميراز المتسلسل (الذي يحتوي على الموقع المستهدف) بمعدل انشقاق يبلغ حوالي 55٪ (الشكل 1C). بعد ذلك ، تم حقن RNP هذا في 120 بويضة مخصبة في مرحلة الخلية الواحدة باستخدام نظام الحقن المجهري القياسي (الشكل 2 والشكل 3). اقترحت نتائج التسلسل لتقدير معدل طفرة المرحلة الجنينية تحريرا فعالا للجينوم في الموقع المستهدف (الشكل 4 أ). علاوة على ذلك ، أسفرت هذه الدراسة عن معدل فقس حورية بنسبة 52.73٪ و 66.7٪ من البالغين G0 كانوا طفرات فسيفساء (الجدول 4).
علاوة على ذلك ، تم تهجين الوهم G0 مع الجراد من النوع البري للحصول على أفراد G 1 متغاير الزيجوت وتم تهجين G1 متغاير الزيجوت مع نفس الطفرات (التي تم فحصها بواسطة استنساخ TA) لتوليد G2. تم استخدام التنميط الظاهري القائم على تفاعل البوليميراز المتسلسل للكشف عن الطفرات وتم تقاطع الزيجوت المتماثل الذي تم الحصول عليه لإنشاء خطوط متحولة مستقرة (الشكل 4 ب).
وفي الوقت نفسه ، تم حفظ البيض متماثل الزيجوت الزائد بالتبريد لتحسين معدل استخدام الزيجوت المتماثل. على الرغم من انخفاض معدل فقس البيض المحفوظ بالتبريد مع تمديد وقت الحفظ بالتبريد (الجدول 5) ، إلا أن الإجراءات العلاجية بما في ذلك تطبيق شظايا ورق الترشيح للحفاظ على البيض رطبا واستعادة هذه البيض المحفوظ مع تدرج ارتفاع درجة الحرارة كانت مفيدة للإنعاش (الشكل 5 والجدول 5). أخيرا ، تم الاحتفاظ بنجاح بالسكان متماثلي الزيجوت من المسوخ للبحث اللاحق.
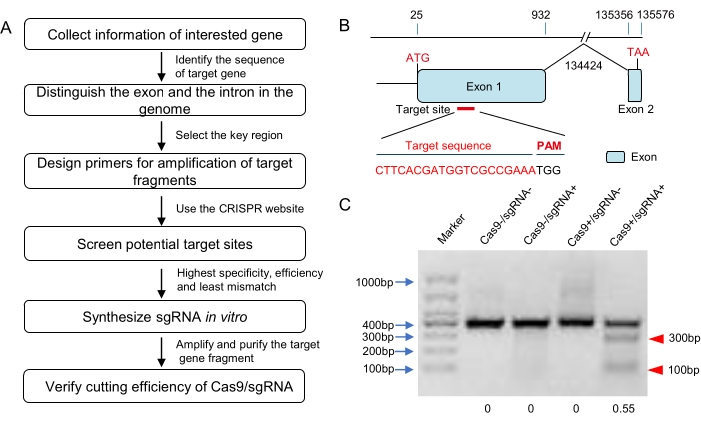
الشكل 1: تصميم الهدف والتحقق في المختبر من sgRNA. (أ) مخطط التدفق لاختيار الهدف ، وتخليق sgRNA ، والتحقق من النشاط الحيوي في المختبر (بما في ذلك على سبيل المثال لا الحصر الجراد). ب: رسم تخطيطي لتركيب الجينات والموقع المستهدف. تظهر إكسونات هذا الجين المستهدف في صورة مجالات زرقاء وتم اختيار الموقع المستهدف في اتجاه مجرى كودون البداية في الإكسون 1. يتم تمييز التسلسل الهدف باللون الأحمر. (ج) نتيجة الرحلان الكهربائي لهلام الأغاروز لمقايسة الانقسام Cas9 في المختبر. تم تضخيم جزء الحمض النووي الذي يؤوي التسلسل المستهدف (حوالي 400 نقطة أساس في الطول) واستخدامه كركيزة لهضم Cas9. تشير النطاقات الصغيرة المتوقعة (حوالي 100 نقطة أساس و 300 نقطة أساس هنا ؛ مميزة بمثلثات حمراء) إلى أن sgRNA المركب يمكن أن يحفز انقسام Cas9 الفعال. كان معدل الانقسام حوالي 55٪ وفقا لتحليل التدرج الرمادي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تحضير الإبرة ووسادة الحقن المجهري لبيض الجراد. أ: طرف إبرة معدة للحقن المجهري لبيض الجراد. شريط المقياس: 1 مم. (B) صورة لوسادة حقن مجهرية بها بيض (يشار إليها بمثلث أحمر) مرتبة عليها. يمثل شريط المقياس 1 سم. (ج) حجم وسادة الحقن المجهري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: حقن البيض المجهرية. (أ) نظام حقن مجهري تمثيلي مكتوب عليه مربعات حمراء تشير إلى مجهر (وسط) ومناور دقيق (يمين) متصل بحاقن دقيق (يسار). يستخدم الكمبيوتر لتخزين البيانات ولتوفير المراقبة المساعدة. ب: حقن بيضة الجراد. يتم تمييز موقع الحقن بمثلث أحمر. ج: حورية فقس تحت المجهر. تمثل قضبان المقياس 1 مم. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الرقم.
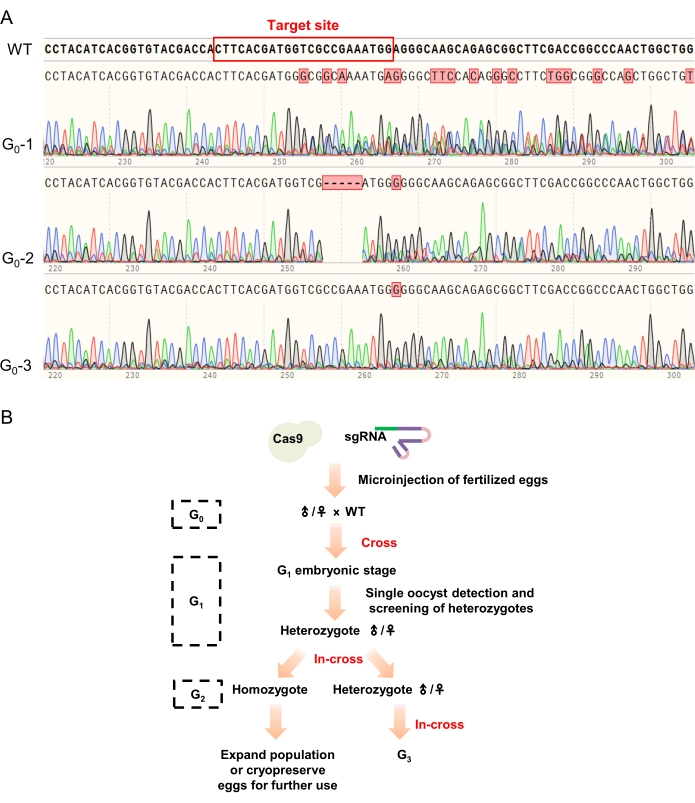
الشكل 4: نتائج تسلسل الحيوانات G 0 واستراتيجية تمرير الخطوط الطافرة. (أ) ينتج عن التسلسل النموذجي فحص G0. أشارت قمم متعددة بالقرب من الموقع المستهدف (معلمة بمستطيل أحمر في تسلسل النوع البري) إلى أن البويضة / الجراد المختبر قد تم تحريره بنجاح بواسطة نظام CRISPR / Cas9 (كما هو موضح في G 0-1 و G0-2) ، بينما تم اعتبار الفرد دون أي تغيير في نتيجة التسلسل غير محرر ومهجور (على سبيل المثال ، ز0-3). (ب) استراتيجية المرور للخطوط الطافرة. تم فحص G0 أولا عن طريق التنميط الجيني بوساطة تفاعل البوليميراز المتسلسل وتم تهجين الحيوانات ذات القمم المتعددة في نتائج تسلسلها مع الجراد البري لتوليد G1. تم استخدام التنميط الجيني بوساطة تفاعل البوليميراز المتسلسل واستنساخ TA لتحديد الزيجوتات غير المتجانسة G1. بعد ذلك ، تم تهجين الزيجوتات غير المتجانسة مع نفس الطفرات لتوليد G2 (متماثل الزيجوت و متغاير الزيجوت) لمزيد من البحث والتمرير. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: حفظ البيض بالتبريد وإنعاشه. (أ) إجراء الحفظ بالتبريد: عزل البيض من قرون البيض واحتضانها عند 30 درجة مئوية لمدة 5-6 أيام بعد غسلها بالماء المعقم. بعد ذلك ، اجمع البيض المتطور معا في طبق بتري وقم بتغطيته بقصاصات صغيرة من ورق الترشيح الرطب. لف طبق بتري بأكمله بغشاء بارافين واحتفظ به عند 25 درجة مئوية لمدة يومين ، متبوعا بيومين آخرين عند درجة حرارة منخفضة نسبيا (على سبيل المثال ، 13-16 درجة مئوية). أخيرا ، ضعه في الثلاجة على حرارة 6 درجات مئوية. (ب) إجراء الإنعاش: أخرج أطباق بتري مع البيض المحفوظ بالتبريد من الثلاجة واحتفظ بها عند 25 درجة مئوية لمدة يومين بعد إزالة قصاصات ورق الترشيح. بعد ذلك ، يمكن استزراع البيض للتطور اللاحق عند 30 درجة مئوية حتى تفقس الحوريات. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| الكاشف | الحجم (ميكرولتر) |
| بروتين Cas9 (300 نانوغرام / ميكرولتر) | 1 |
| sgRNA (300 نانوغرام / ميكرولتر) | 1 |
| منتج تفاعل البوليميراز المتسلسل (200 نانوغرام / ميكرولتر) | 1 |
| 10×NEBuffer r3.1 | 1 |
| ماء خال من النيوكلياز | 6 |
الجدول 1: نظام الهضم في المختبر . تم خلط 200 نانوغرام من الجزء المستهدف المنقى (منتج تفاعل البوليميراز المتسلسل) مع نظام كريسبر / كاس 9 (300 نانوغرام من كل مكون) لاختبار النشاط الحيوي ل sgRNAs المركبة. تم استخدام مخزن مؤقت تجاري وأضيف ماء خال من النيوكلياز لتعويض الحجم الإجمالي إلى 10 ميكرولتر.
| الكاشف | الحجم (ميكرولتر) |
| 2xEs تاك ماستر ميكس | 12.5 |
| التمهيدي إلى الأمام | 0.5 |
| التمهيدي العكسي | 0.5 |
| قالب (منتج التحلل) | 1 |
| ماء خال من النيوكلياز | 10.5 |
الجدول 2: نظام تفاعل البوليميراز المتسلسل لتضخيم شظايا الجينات المستهدفة. لتضخيم الجزء الجينومي للجين المستهدف ، تم استخدام مزيج Taq تجاري وأضيفت الاشعال وفقا لتعليمات الشركة المصنعة. تم استخدام 1 ميكرولتر من منتج التحلل كقالب وتم استخدام الماء الخالي من النيوكلياز لجعل الحجم الكلي إلى 25 ميكرولتر.
| درجة الحرارة (°C) | الوقت | دورات |
| 95 | 5 دقائق | 1 |
| 95 | 30 ثانية | 35 |
| 55 | 30 ثانية | |
| 72 | 40 ثانية | |
| 72 | 10 دقائق | 1 |
الجدول 3: برنامج تفاعل البوليميراز المتسلسل لتضخيم الجينات المستهدفة. كان برنامج تفاعل البوليميراز المتسلسل لتضخيم الجينات المستهدفة: 95 درجة مئوية لمدة 5 دقائق. 35 دورة من 95 درجة مئوية لمدة 30 ثانية ، 55 درجة مئوية لمدة 30 ثانية ، 72 درجة مئوية لمدة 40 ثانية ؛ 72 درجة مئوية لمدة 10 دقائق.
| العناصر | بيانات |
| عدد البيض المحقون | 120 |
| الأجنة المختبرة | 10 |
| رقم الحوريات الفقس | 58 |
| معدل الفقس | 52.73% |
| رقم G0 بالغ | 12 |
| رقم G0 المسوخ | 8 |
| كفاءة الطفرة في G0 البالغين | 66.67% |
الجدول 4: ملخص كفاءة التحرير. تم حقن 120 بويضة لضرب الجين المستهدف وتم أخذ 10 بويضات للاختبار خلال مرحلة الجنين. فقست 58 حورية من بقية الأجنة (كان معدل الفقس 52.73٪). أخيرا ، تم تطوير 12 جرادة G0 إلى مرحلة البلوغ وتم تحرير 8 منها بنجاح في الموقع المستهدف. كان معدل الطفرة في البالغين G0 66.67٪.
| المجموعة الضابطة | المجموعة 1 | المجموعة 2 | المجموعة 3 | المجموعة 4 | |
| رقم البيض | 120 | 120 | 120 | 120 | 120 |
| المعالجة الحرارية للتخزين | 30 درجة مئوية | 30 درجة مئوية (5-6 د) →6 درجة مئوية | 30 درجة مئوية (5-6 د) →25 درجة مئوية (2 د) →13-16 درجة مئوية (2 د) →6 درجة مئوية | 30 درجة مئوية (5-6 د) →25 درجة مئوية (2 د) →13-16 درجة مئوية (2 د) →6 درجة مئوية | 30 درجة مئوية (5-6 د) →25 درجة مئوية (2 د) →13-16 درجة مئوية (2 د) →6 درجة مئوية |
| وقت التخزين | 14 يوما | 14 يوما | 1 شهر | 3 أشهر | 5 أشهر |
| المعالجة الحرارية للإنعاش | 30 درجة مئوية | 6 °C →30 °C | 6 درجة مئوية →25 درجة مئوية (2 د) →30 درجة مئوية | 6 درجة مئوية →25 درجة مئوية (2 د) →30 درجة مئوية | 6 درجة مئوية →25 درجة مئوية (2 د) →30 درجة مئوية |
| رقم الجراد المفقس | 108 | 0 | 96 | 86 | 78 |
| معدل الفقس | 90.00% | 0 | 80.00% | 71.67% | 65.00% |
| رقم الجراد البالغ | 81 | 0 | 60 | 46 | 31 |
| معدل الإغلاق | 75.00% | 0 | 62.50% | 53.49% | 39.74% |
الجدول 5: ملخص الحفظ بالتبريد وإنعاش البيض. تم تقسيم 600 بيضة إلى خمس مجموعات لدراسة الحفظ بالتبريد والإنعاش. تم دائما تحضين المجموعة الأولى (التحكم) المكونة من 120 بيضة عند 30 درجة مئوية وتخزينها لمدة 14 يوما. تم نقل المجموعة الثانية (المجموعة 1) المكونة من 120 بيضة إلى الثلاجة بعد الحضانة عند 30 درجة مئوية لمدة 5-6 أيام وتخزينها عند 6 درجات مئوية لمدة 14 يوما. ثم تم نقل هذه البويضات إلى 30 درجة مئوية للإنعاش. شهدت المجموعات الأخرى (المجموعة 2 والمجموعة 3 والمجموعة 4 ، كل مجموعة تحتوي على 120 بيضة) تبريدا متدرجا ومعالجة درجة حرارة الاسترداد كما هو موضح في البروتوكول (الخطوات 6.1-6.3) مع وقت تخزين مختلف (شهر واحد للمجموعة 2 ، 3 أشهر للمجموعة 3 ، و 5 أشهر للمجموعة 4). أخيرا ، فقست 108 حوريات من المجموعة الضابطة (بمعدل فقس 90٪) وتطورت 81 منها إلى مرحلة البلوغ (75٪ من معدل الفقس). لا يفقس الجراد في المجموعة الثانية (المجموعة 1). كان معدل الفقس ومعدل التسرب للمجموعات الأخرى أقل مقارنة بالمجموعة الضابطة وانخفض مع وقت التخزين. فقست 96 حورية في المجموعة 2 و 60 منها تطورت إلى مرحلة البلوغ. 86 حورية فقست في المجموعة 3 و 46 منهم تطورت إلى مرحلة البلوغ. في المجموعة 4 ، فقست 78 حورية وتطورت 31 منها إلى مرحلة البلوغ.
Discussion
كان الجراد من بين أكثر الآفات تدميرا للزراعة منذ حضارةالبشر 23. تعد تقنية تحرير الجينوم القائمة على كريسبر / كاس 9 أداة قوية لتوفير معرفة أفضل بالآليات البيولوجية في الجراد بالإضافة إلى استراتيجية واعدة لمكافحة الآفات. وبالتالي ، من المفيد جدا تطوير طريقة فعالة وسهلة الاستخدام للبناء بوساطة كريسبر / كاس 9 لمتحولات الجراد متماثل الزيجوت. على الرغم من الإبلاغ عن بعض الأعمال الرائعة وقدمت بعض سير العمل الأساسي لتحرير الجينوم في الجراد18،20،21،22 ، إلا أنه لا يزال هناك نقص في التحسين المنهجي للإجراء بأكمله. بشكل عام ، يمكن تقسيم طفرة الجراد متماثل الزيجوت الناتجة عن الحقن الجنيني لنظام CRISPR / Cas9 إلى ثلاث خطوات رئيسية: أ) تصميم sgRNA وتوليفه وفحصه في المختبر ، ب) جمع البويضات وتحضيرها وحقنها. ج) فحص الطفرات والحفاظ على الزيجوت المتماثل. يوفر هذا البروتوكول سير عمل محسن وخطوات اختيار الموقع المستهدف ، وفحص sgRNA في المختبر ، والحقن الدقيق للبيض وكذلك الكشف عن الطفرات ضرورية بشكل خاص لتوليد الجراد الطافر متماثل الزيجوت بشكل فعال باستخدام نظام CRISPR / Cas9.
أولا ، تم اقتراح الموقع المستهدف ، وشكل sgRNA المقابل ، وتركيز sgRNA كعوامل حاسمة لكفاءة تحرير الجينوم في الحشرات18،27،28. لحل هذه المشكلة ، يوصى أولا بتحليل بنية الجينات وتصميم أكثر من موقع مستهدف واحد على exon 1 أو بالقرب من كودون البداية باستخدام الموارد عبر الإنترنت. بعد ذلك ، قم بتوليف sgRNA في المختبر واخلطه مع بروتين Cas9 بتركيزات مختلفة لتحسين كفاءة قطع RNP. سيساعد هذا الإجراء في تحديد sgRNA ذو النشاط الحيوي العالي وتحسين تكوين مركب RNP للجين المستهدف المرشح.
ثانيا ، يعد جمع أكبر عدد ممكن من البيض الطازج في وقت محدود وتحسين معدل الفقس وكذلك معدل الطفرات من التحديات الكبيرة لعمليات تحرير الجينوم. يستخدم الجراد البالغ القطيعي الذي يتم تربيته في حالة 16 (خفيف):8 (مظلم) لجمع ما يكفي من البيض في فترة قصيرة خلال 9: 00-11: 00 صباحا. من المهم الضغط برفق لأسفل بين البيض باستخدام فرشاة الرسم أو الملقط لعزل البيض بعناية عن الكبسولة. مع الممارسة الكافية ، يمكن للعديد من المستخدمين فصل البيض الفردي بشكل موثوق عن الكبسولة. بعد عزل كل بيضة وغسلها بالماء المعقم ، يتم محاذاة البيض على منصات الحقن المصممة (الشكل 2B ، C) لتثبيت البيض أثناء الحقن المجهري. يتم حقن البويضة ب RNP الأمثل بالقرب من الميكروبايل. للحد من الأضرار الميكانيكية وتقليل تلوث البيض ، يسمح للبيض الطازج بالبقاء في القرون لمدة 30 دقيقة تقريبا للتأكد من أن دباغة قشر البيض مثالية للحقن المجهري21 ، نظرا لهيكلها المكثف وقدرتها الدفاعية العالية على الغزو بعد دباغة كافية29,30. وفي الوقت نفسه ، أشار تقرير منشور إلى أن الانقسام المخلوي31 لبيض الجراد يحدث في مرحلة ما بين 0 ساعة و 4 ساعات بعد وضعه. مع بروتوكول الحقن المجهري القياسي الحالي ، يمكن حقن حوالي 100 بيضة في غضون 40 دقيقة. مجتمعة ، يمكن إكمال عملية الدباغة والحقن المجهري ل 100 بيضة مخصبة في غضون 2 ساعة. وبالتالي ، هناك ما لا يقل عن 2 ساعة متبقية للانقسام بوساطة CRISRP / Cas9 وإصلاح الجينات المستهدفة لتحقيق طفرة فعالة في البيض المحقون والجراد البالغ في المستقبل.
أخيرا ، تعد الاستراتيجيات الفعالة للمرور وتحديد الطفرات مهمة لتوليد الزيجوت المتماثل في معظم الحيوانات الطافرة. في الجراد ، بالنسبة للجينات غير القاتلة بعد التحرير ، فإن الإستراتيجية المتقاطعة المقترحة هنا هي أن طفرات G0 تتقاطع مع الجراد من النوع العريض ويمكن إجراء المزيد من التهجين باستخدام G1 متغاير الزيجوت مع نفس الطفرات لتوليد طفرات متماثلة الزيجوت في الجيل التالي. للتحقق من الطفرة في كل جراد أثناء عملية وراثة الطافرة ، يوصى باستخدام طريقة التحلل القلوي لهضم جزء قصير من الهوائيات كنموذج للتنميط الجيني القائم على تفاعل البوليميراز المتسلسل. أخيرا ، استخدم البالغين متماثلي الزيجوت الذين تم الحصول عليهم لمزيد من التهجين لتوسيع عدد السكان. ويوصى بالبويضات الزائدة للحفظ بالتبريد عند 6 درجات مئوية والإنعاش عن طريق ارتفاع درجة الحرارة المتدرجة (الشكل 5)، الذي يعتمد على مبدأ التمدد في درجات الحرارة المنخفضة وإطلاق الجراد المهاجر بدرجة حرارة عالية32,33.
باختصار، ثبت أن نظام كريسبر/كاس 9 أداة موثوقة لتسهيل دراسة علم الجينوم الوظيفي للجراد المهاجر. يمكن استخدام هذا البروتوكول المفصل كمرجع لتطبيقات تحرير الجينات القائمة على كريسبر / كاس 9 في الجراد المهاجر وكذلك في الحشرات الأخرى.
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل المؤسسة الوطنية للعلوم الطبيعية في الصين (32070502 ، 31601697 ، 32072419 ومؤسسة علوم ما بعد الدكتوراه الصينية (2020M672205).
Materials
| Name | Company | Catalog Number | Comments |
| 10×NEBuffer r3.1 | New England Biolabs | B7030S | The buffer of in vitro Cas9 cleavage assays |
| 2xEs Taq MasterMix (Dye) | Cwbio | CW0690 | For gene amplification |
| 2xPfu MasterMix (Dye) | Cwbio | CW0686 | For gene amplification |
| CHOPCHOP | Online website for designing sgRNAs, http://chopchop.cbu.uib.no/. | ||
| CRISPOR | Online website for designing sgRNAs, http://crispor.org. | ||
| CRISPRdirect | Online website for designing sgRNAs, http://crispr.dbcls.jp/. | ||
| Electrophoresis power supply | LIUYI BIOLOGY | DYY-6D | Separation of nucleic acid molecules of different sizes |
| Eppendorf Tube | Eppendorf | 30125177 | For sample collection, etc. |
| Fine brushes | Annigoni | 1235 | For cleaning and isolating eggs. Purchased online. |
| Flaming/brown micropipette puller | Sutter Instrument | P97 | For making the microinjection needles |
| Gel Extraction Kit | Cwbio | CW2302 | DNA recovery and purification |
| Gel Imaging Analysis System | OLYMPUS | Gel Doc XR | Observe the electrophoresis results |
| GeneTouch Plus | Bioer | B-48DA | For gene amplification |
| Glass electrode capillary | Gairdner | GD-102 | For making injection needles with a micropipette Puller |
| Incubator | MEMMERT | INplus55 | For migratory locust embryo culture |
| Metal bath | TIANGEN | AJ-800 | For heating the sample |
| Micro autoinjector | Eppendorf | 5253000068 | Microinjection of embryos early in development |
| Micro centrifuge | Allsheng | MTV-1 | Used for mixing reagents |
| Microgrinder | NARISHIGE | EG-401 | To ground the tip of injection needle |
| Microloader | Eppendorf | 5242956003 | For loading solutions into the injection needles. |
| Micromanipulation system | Eppendorf | TransferMan 4r | An altinative manipulation system for microinjection |
| Microscope | cnoptec | SZ780 | For microinjection |
| Motor-drive Manipulator | NARISHIGE | MM-94 | For controling the position of the micropipette during the microinjection precedure |
| Multi-Sample Tissue Grinder | jingxin | Tissuelyser-64 | Grind and homogenize the eggs |
| ovipisition pot | ChangShengYuanYi | CS-11 | Filled with wet sterile sand for locust ovipositing in it. The oocysts are collected from this container. Purchased online. |
| Parafilm | ParafilmM | PM996 | For wrapping the petri dishes. |
| pEASY-T3 Cloning Kit | TransGen Biotech | CT301-01 | For TA cloning |
| Petri dish | NEST | 752001 | For culture and preservation of the eggs. |
| Pipettor | Eppendorf | Research plus | For sample loading |
| plastic culture cup | For rearing locusts seperately and any plastic cup big enough (not less than 1000 mL in volume) will do. Purchased online. | ||
| Precision gRNA Synthesis Kit | Thermo | A29377 | For sgRNA synthesis |
| Primer Premier | PREMIER Biosoft | Primer Premier 5.00 | For primer design |
| SnapGene | Insightful Science | SnapGene®4.2.4 | For analyzing sequences |
| Steel balls | HuaXinGangQiu | HXGQ60 | For sample grinding.Purchased online. |
| Tips | bioleaf | D781349 | For sample loading |
| Trans DNA Marker II | TransGen Biotech | BM411-01 | Used to determine gene size |
| TrueCut Cas9 Protein v2 | Thermo | A36496 | Cas9 protein |
| UniversalGen DNA Kit | Cwbio | CWY004 | For genomic DNA extraction |
| VANNAS Scissors | Electron Microscopy Sciences | 72932-01 | For cutting off the antennae |
| Wheat | To generate wheat seedlings as the food for locusts. Bought from local farmers. | ||
| ZiFiT | Online website for designing sgRNAs, http://zifit.partners.org/ZiFiT/ChoiceMenu.aspx. |
References
- Doudna, J. A. The promise and challenge of therapeutic genome editing. Nature. 578 (7794), 229-236 (2020).
- van Haasteren, J., Li, J., Scheideler, O. J., Murthy, N., Schaffer, D. V. The delivery challenge: fulfilling the promise of therapeutic genome editing. Nature Biotechnology. 38 (7), 845-855 (2020).
- McCarty, N. S., Graham, A. E., Studena, L., Ledesma-Amaro, R. Multiplexed CRISPR technologies for gene editing and transcriptional regulation. Nature Communications. 11 (1), 1281 (2020).
- Manghwar, H., et al. CRISPR/Cas systems in genome editing: Methodologies and tools for sgRNA design, off-target evaluation, and strategies to mitigate off-target effects. Advanced Science. 7 (6), 1902312 (2020).
- Anzalone, A. V., Koblan, L. W., Liu, D. R. Genome editing with CRISPR-Cas nucleases, base editors, transposases and prime editors. Nature Biotechnology. 38 (7), 824-844 (2020).
- Rees, H. A., Liu, D. R. Base editing: precision chemistry on the genome and transcriptome of living cells. Nature Reviews Genetics. 19 (12), 770-788 (2018).
- Ishino, Y., Shinagawa, H., Makino, K., Amemura, M., Nakata, A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. Journal of Bacteriology. 169 (12), 5429-5433 (1987).
- Barrangou, R., et al. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 315 (5819), 1709-1712 (2007).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339 (6121), 823-826 (2013).
- Jinek, M., et al. RNA-programmed genome editing in human cells. eLife. 2, 00471 (2013).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Scully, R., Panday, A., Elango, R., Willis, N. A. DNA double-strand break repair-pathway choice in somatic mammalian cells. Nature Reviews Molecular Cell Biology. 20 (11), 698-714 (2019).
- Ai, D., et al. Embryo microinjection and knockout mutant identification of CRISPR/Cas9 genome-edited Helicoverpa Armigera (Hubner). Journal of Visualized Experiments: JoVE1. (173), e62068 (2021).
- Huang, Y., et al. CRISPR/Cas9 mediated knockout of the abdominal-A homeotic gene in the global pest, diamondback moth (Plutella xylostella). Insect Biochemistry and Molecular Biology. 75, 98-106 (2016).
- Gratz, S. J., et al. Highly specific and efficient CRISPR/Cas9-catalyzed homology-directed repair in Drosophila. Genetics. 196 (4), 961-971 (2014).
- Kistler, K. E., Vosshall, L. B., Matthews, B. J. Genome engineering with CRISPR-Cas9 in the mosquito Aedes aegypti. Cell Reports. 11 (1), 51-60 (2015).
- Li, Y., et al. CRISPR/Cas9 in locusts: Successful establishment of an olfactory deficiency line by targeting the mutagenesis of an odorant receptor co-receptor (Orco). Insect Biochemistry and Molecular Biology. 79, 27-35 (2016).
- Xu, X., et al. BmHpo mutation induces smaller body size and late stage larval lethality in the silkworm, Bombyx mori. Insect Science. 25 (6), 1006-1016 (2018).
- Chen, D., et al. CRISPR/Cas9-mediated genome editing induces exon skipping by complete or stochastic altering splicing in the migratory locust. BMC Biotechnology. 18 (1), 60 (2018).
- Zhang, T., et al. Egg tanning improves the efficiency of CRISPR/Cas9-mediated mutant locust production by enhancing defense ability after microinjection. Journal of Integrative Agriculture. 20 (10), 2716-2726 (2021).
- Guo, X., et al. 4-Vinylanisole is an aggregation pheromone in locusts. Nature. 584 (7822), 584-588 (2020).
- Zhang, L., Lecoq, M., Latchininsky, A., Hunter, D. Locust and grasshopper management. Annual Review of Entomology. 64, 15-34 (2019).
- Pétavy, G. Origin and development of the vitellophags during embryogenesis of the migratory locust, Locusta migratoria L. (Orthoptera : Acrididae). International Journal of Insect Morphology and Embryology. 14 (6), 361-379 (1985).
- Barry, S. K., et al. Injecting Gryllus bimaculatus eggs. Journal of Visualized Experiments: JoVE. (150), e59726 (2019).
- Watanabe, T., Noji, S., Mito, T. Genome editing in the cricket, Gryllus bimaculatus. Methods in Molecular Biology. 1630, 219-233 (2017).
- Du, M. H., et al. Suppression of Laccase 2 severely impairs cuticle tanning and pathogen resistance during the pupal metamorphosis of Anopheles sinensis (Diptera: Culicidae). Parasites & Vectors. 10 (1), 171 (2017).
- Eisner, T., Shepherd, J., Happ, G. M. Tanning of grasshopper eggs by an exocrine secretion. Science. 152 (3718), 95-97 (1966).
- Ho, K., Dunin-Borkowski, O. M., Akam, M. Cellularization in locust embryos occurs before blastoderm formation. Development. 124 (14), 2761-2768 (1997).
- Wang, X., et al. Interactive effect of photoperiod and temperature on the induction and termination of embryonic diapause in the migratory locust. Pest Managment Science. 77 (6), 2854-2862 (2021).
- Jarwar, A. R., et al. Comparative transcriptomic analysis reveals molecular profiles of central nervous system in maternal diapause induction of Locusta migratoria. G3-Genes Genomes Genetics. 9 (10), 3287-3296 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved