Method Article
Yetişkin Domuz Adacığı İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu ayrıntılı protokol, yetişkin domuz adacık izolasyonunun sindirim aşamasından saflaştırma yoluyla adacıkların nihai fonksiyonel değerlendirmesine kadar olan metodolojik adımlarını kapsar. Bu taslak, araştırma kurumlarında yetişkin domuz adacık izolasyonu için bir kılavuz olarak kullanılabilir.
Özet
Tip 1 diabetes mellitus (T1DM), pankreas β hücrelerinin otoimmün yıkımından kaynaklanır ve bu da insülin üretiminin çok az olmasına veya hiç olmamasına neden olur. Adacık nakli, geleneksel insülin tedavisi ile karşılaştırıldığında, glikometabolik kontrolün iyileşmesi, komplikasyonların ilerlemesinin azalması, hipoglisemik atakların azalması ile T1DM tedavisinde önemli bir rol oynamaktadır. Faz III klinik çalışmanın sonuçları, T1DM'de adacık allotransplantasyonunun güvenliğini ve etkinliğini de göstermiştir. Bununla birlikte, pankreas donörlerinin azlığı, yaygın kullanımını sınırlamaktadır. Domuz gibi adacıkların kaynağı olarak hayvanlar alternatif bir seçenek sunar. Domuz pankreasının mimarisi farelerin veya insanların adacıklarından farklı olduğundan, domuz adacık izolasyon prosedürü hala zordur. Hücresel transplantasyon yoluyla T1DM'yi tedavi etmek için alternatif domuz adacık kaynaklarının (ksenojeneik) klinik ortama çevrilmesi büyük önem taşıdığından, domuz adacıklarını izole etmek için uygun maliyetli, standardize ve tekrarlanabilir bir protokole acilen ihtiyaç duyulmaktadır. Bu el yazması, domuz adacıklarını insan olmayan primatlara başarıyla nakleden önceki protokollere dayalı olarak yetişkin domuz adacıklarını izole etmek ve saflaştırmak için basitleştirilmiş ve uygun maliyetli bir yöntemi açıklamaktadır. Bu, COBE 2991 Hücre İşlemcisi gibi özel ekipman kullanmadan yeni başlayanlar için bir kılavuz olacaktır.
Giriş
Tip 1 diabetes mellitus (T1DM), beta hücrelerinin otoimmün yıkımının insülin üretiminin çok az veya hiç olmamasına neden olduğu ciddi bir hastalıktır 1,2,3. T1DM'li hastaların önemli bir grubu, insülin tedavisi ile glisemik değişkenliği stabilize edemez ve hayatı tehdit eden hipoglisemik ataklar yaşar. Adacık nakli başarılı olduğunda bunu başarabilir. Dünya çapında 1.500'den fazla diyabetik hasta başarılı adacık nakli geçirmiştir ve pankreas naklinden daha düşük riskli ancak uzun vadeli sonuç başarısı göstermiştir4.
İnsülin tedavisi ile karşılaştırıldığında, adacık nakli komplikasyonların ilerlemesini azaltmada daha iyi sonuçlara sahiptir5. Faz III klinik çalışmanın sonuçları ayrıca T1DM6,7'de adacık allotransplantasyonunun güvenliğini ve etkinliğini göstermiştir. Adacık nakli, hayatı tehdit eden hipoglisemik ataklar yaşayan T1DM'li hastalar için şu anda mevcut olan en iyi terapötik seçenek olabilir.
Bununla birlikte, insan allojenik donör adacıklarının eksikliği, adacık transplantasyonunun yaygın kullanımını sınırlamaktadır 8,9. Bu nedenle, hayvan adacıklarının yerine kullanılması arzu edilir10. Domuz, klinik öncesi ksenotransplantasyonda adacık hücreleri için bir donör olarak seçilmiştir ve 1) kullanılabilirlik, 2) insanlarla metabolik benzerlikler, 3) oldukça büyük beta hücre kütlesi ve 4) insanlara immünolojik uyumluluğu geliştirmek için genetik mühendislik olasılığınedeniyle kliniğe potansiyel olarak çevrilebilirlik 11.
Adacıkların yüksek saflığı ve canlılığı, ksenotransplantasyonun başarısı için anahtar adımlardır. Bununla birlikte, adacıkları yetişkin domuz donörlerinden izole etme prosedürü, farelerin veya insanların adacıklarından farklı olan pankreasın mimarisi nedeniyle zordur12. Genel olarak konuşursak, domuz pankreas adacıklarının şekli kompakt değildir12. İnsan ve kemirgen pankreas adacıkları ile karşılaştırıldığında, domuz adacıkları daha kolay ayrışır12. Bununla birlikte, uzun bir kültür süresi ile birlikte adacık hücrelerinin dış tabakasının kendiliğinden ayrışması, pankreas adacık boyutunda10'da önemli bir azalmaya yol açar.
Adacık izolasyon işlemi sırasında, vericinin yaşı, sıcak iskemi süresi, enzimatik aktivite, enzimatik enjeksiyon ile şişkinlik gibi birçok faktör adacıkların kalitesini etkilemektedir13,14. Daha önceki birçok çalışma domuz adacık izolasyonu için yöntemler sağlasa da, araştırmacılar için etkili bir talimat olarak ayrıntılı bir adım adım video protokolü yoktur 10,15,16,17,18,19,20,21,22,23.
Bu amaçla, bu ayrıntılı protokol, organ alımından adacıkların izolasyon sonrası fonksiyonel değerlendirmesine kadar tüm izolasyon adımlarını kapsar ve kolay uygulanabilirlik için sürece basit ve anlaşılır bir genel bakış sunmayı umar. Bu protokol,10,11 değişiklikleriyle daha önce yayınlanan yöntemlere dayanmaktadır.
Protokol
Hayvanları içeren tüm prosedürler, Shenzhen İkinci Halk Hastanesi'nin Kurumsal hayvan bakımı ve kullanımı komitesi tarafından onaylanır ve tüm ulusal düzenlemelere uyar. Bu protokolde piyasadan satın alınan Duroc-Landrace-Yorkshire domuzları (~ 6 aylık) pankreas donörü olarak kullanılmıştır. Toplanan pankreasın ağırlığı 123.63 g ± 22.50 g idi. Deneyler sırasında koruyucu giysi, maske, eldiven ve boneler dahil olmak üzere kişisel koruyucu ekipman giyilir.
1. Medya hazırlığı
- Temizleme ortamı: 100 mL temizleme ortamı hazırlamak için Hank'in Dengeli Tuz Çözeltisi (HBSS), %2 domuz serumu, 20 mM 4- (2-hidroksietil) -1-piperazineetansülfonik asit (HEPES) ve %1 Penisilin-Streptomisin'i karıştırın (P / S).
- Toplama ortamı: RPMI 1640'ı %5 domuz serumu ve %1 Penisilin-Streptomisin (P/S) ile karıştırın.
- Kültür ortamı: CMRL 1066'yı %10 domuz serumu, 10 mmol/L nikotinamid, %1 P/S ve 2 mmol/L L-glutamin ile karıştırın.
- Enzim çözeltisi: HBSS'de 1 mg / mL Kollajenaz Tip V (aktivite: 918 birim / mg katı) çözeltisi hazırlayın.
- Düşük glikoz konsantrasyonu çözeltisi: Düşük glikoz konsantrasyonlu bir çözelti hazırlamak için, 1 mL Kreb's Ringer bikarbonat tamponuna (KRBB) %0.5 Sığır Serum Albümini (BSA) ve 2.8 mM D-Glikoz ekleyin.
- Yüksek glikoz konsantrasyon çözeltisi: Yüksek glikoz konsantrasyonlu bir çözelti hazırlamak için, 1 mL Kreb's Ringer bikarbonat tamponuna (KRBB) %0.5 Sığır Serum Albümini (BSA) ve 28 mM D-Glikoz ekleyin.
2. Pankreas alımı
- Domuz anestezisi ve deri hazırlığı
- Donör domuzu intramüsküler anestezik Lumianning (2.5-5 mg / kg) ve Propofol (2-3 mg / kg) enjeksiyonu ile uyuşturun (ayrıntılar için Malzeme Tablosuna bakınız).
- Gaz anestezi maskeleri ile 1-1.5 L / dk ventilasyon hacminde% 1 -% 3 izofluran ile anesteziyi sürdürün.
- Uygun anesteziyi onaylamak için kalp atış hızını izleyin. Anestezi altındayken kuruluğu önlemek için gözlerde veteriner merhemi kullanın.
- Karnı tıraş edin, iyodofor ile temizleyin ve domuzu uygun şekilde steril cerrahi örtü ile örtün.
- Karnın açılması
- Steril koşulları sağladıktan sonra, kısırlığa hafifçe yakın bir yerde ksifoidden göbek deliğine kadar orta hat laparotomi insizyonu yapın.
- Diyaframı kesin.
- Vasküler forseps kullanarak suprahepatik aort ve suprahepatik inferior vena kava'yı (IVC) izole edin ve ardından aynı yöntemle infrarenal aort ve infrahepatik IVC'yi izole edin.
- Kanın pıhtılaşmasını önlemek için domuza intravenöz heparin (100 U / kg) uygulayın.
- İnce ve kalın bağırsağı dıştan çıkarın ve pankreası tamamen ortaya çıkarmak için karaciğeri ve mideyi başa doğru itin.
- Pankreas perfüzyonu
- Aortu diyaframın üzerine vasküler forseps ile klempleyin, aortu aort kanülü (16 G) ile renal aort dalının üzerinden entübe edin ve 2-0 dikiş ipliği ile bağlayın.
- Hayvanı aort kanülü (16 G) yoluyla 2-3 litre soğuk HBSS solüsyonu (önceden torbalanmış ve 4 ° C'de tutulmuş) ile demleyin. HBSS solüsyonunu aort kanülünden yerçekimi ile infüze edin, suprahepatik IVC ve IVC perfüzyon sıvısını serbest bırakmak için kesilirken.
NOT: IVC çıkışı temizlenene kadar infüzyona devam edin.
- Pankreas eksizyonu
- Omentumu soyun, dalak ile birlikte pankreas ve dalak loblarını bulun ve ayırın.
- Pankreasın bağlı lobunu bitişik doku ile ayırın.
- Duodenumun inen kısmında ana pankreas kanalını bulun. Safra kanalını bir dikişle (2-0) bağlayın ve pankreas kanalının yakınında makasla kesin.
- Pankreasın başının her iki tarafına Vater ampullasını içeren duodenumun bir bölümünü vasküler forseps ile kelepçeleyin ve ardından duodenumu makasla rezeke edin.
- Tüm pankreası çıkarın, soğuk HBSS'ye daldırın ve hemen adacık izolasyon tesisine taşıyın.
NOT: Domuzlara pentobarbital sodyum (100-200 mg / kg) kullanılarak ötenazi yapıldı. HBSS'nin intraduktal infüzyonu veya koruma solüsyonu, pankreaslar yerel mezbahadan temin edilirse, organ alım bölgesinde pankreası şişirmek için kullanılabilir.
3. Aşağıdaki deneyler için üç biyogüvenlik kabini hazırlayın
- Pankreası temizlemek için böbrek havzası, cerrahi aletler ve beherler ile biyogüvenlik kabini #1'i kurun (bölüm 4, Şekil 1A).
- Biyogüvenlik kabini #2'yi bir su banyosu, peristaltik pompa, devridaim tüplü tüp standı ve adacık çürütmesi için bir çürütme odası ile kurun (bölüm 5, Şekil 1B).
- Enzim hazırlama, adacık saflaştırma ve aşağıdaki adımlar için tek kullanımlık filtreler ve santrifüj tüpleri ile biyogüvenlik kabini #3'ü kurun (bölüm 6-8, Şekil 1C).
4. Pankreas temizliği
- Pankreası temizleyin ve tartın.
- Pankreası 200 mL iyodofor içinde biyogüvenlik kabini #1'de 3 dakika boyunca durulayın. Pankreası 200 mL soğuk HBSS'de her biri 2 dakika olmak üzere iki kez durulayın.
- Temizlenmiş pankreası buz üzerinde 100 mL temizleme ortamı içeren bir böbrek havzasına koyun.
- Ampullayı kelepçeli tutun, duodenumu rezeke edin. Dış yağ ve bağ dokusunun pankreasını temizleyin.
- Pankreası tartın.
5. Pankreas sindirimi
- Kollajenaz infüzyonu
- Pankreasın halka şeklindeki dallarından birinin enine kesitini kesin ve ana pankreas kanalına 18 G'lik bir anjiyokat'ı (kanal çapları daha küçükse, 20 G'lik bir anjiyokatı düşünün) yerleştirin ve 2-0 örgülü ipek dikişle yerine dikin.
- Pankreasın başına yakın bağlantı lobundan geçen doku köprüsünü kesin ve enzim sızıntısını azaltmak için kateteri pankreasın başına yakın kesi tarafına sıkıştırın.
- Daha iyi intraduktal enzim infüzyonu için birden fazla anjiyokat yerleştirin. Bunun için, kanalı açığa çıkarmak için pankreas organını bölümlere ayırdıktan sonra ek anjiyokatlar (boyut 20-22 G) yerleştirin.
- Luer-lock konektörlü 1 m silikon tüp (16 #) dahil olmak üzere doldurma boru hattını takın. Tüpün orta kısmı peristaltik pompa kafasına gömülüdür.
- Boru sistemini (tüp boyutu 16 #) 300 mL 1 mg / mL, Kollajenaz Tip V (aktivite: 918 birim / mg) 24 ° C'ye önceden ısıtılmış doldurmak için peristaltik pompayı açın ve borulardaki hava kabarcıklarını çıkarın.
- Perfüzyon tüpünü anjiyokata bağlayın ve peristaltik pompayı 20 mL / dak hızında açın.
- Enzimin çoğu infüze edildiğinde ve pankreas iyice şiştiğinde perfüzyonu durdurun (Şekil 2B).
- Perfüzyon sırasında pankreas çevresinde oluşan berrak jelatinimsi dokuyu kesin.
NOT: Bu adım çok önemlidir çünkü jel haznedeki filtreyi tıkayabilir ve sindirilen dokunun toplanmasını zorlaştırabilir (Şekil 2B). - İnfüzyondan sonra anjiyokatları çıkarın.
- Doku sindirimi
- 1 L HBSS çözeltisini 36 °C'ye önceden ısıtın. Kapalı bir sisteme bağlı çürütme odası ve borudan oluşan çürütme sistemini önceden hazırlayın ve devrenin ısıtma bobinini 36 °C'lik bir su banyosuna aktarın.
- Pankreası 3-4 parçaya bölün ve Kollajenaz Tip V ile 500 mL'lik bir behere dökün.
- Beheri steril bir petri kabı kapağı ile örtün, biyogüvenlik kabini #2'ye aktarın ve beherin içeriğini dört silikonlu cam bilye ve 500 μm'lik bir ağ içeren sindirim odasına koyun.
- Hazneyi kapatın ve vidaları sıkın. Kalan enzimi devridaim kabına koyun ve peristaltik pompayı 80 mL/dk hızında açın.
- Devreyi tamamlanana kadar doldurmak için adım 5.2.1'de önceden ısıtılmış ılık HBSS solüsyonu (tipik olarak yaklaşık 150 mL) ekleyin. Hazneyi hafifçe sallayın ve silikonlu cam bilyeler dokuya çarpacak şekilde ters çevirin.
NOT: Domuz adacıkları insan dokusundan daha hassas olduğundan, hasarı önlemek için sallamalar eşit ve yavaş olmalıdır. Doku sindirilirken parçalanmaya ve odadan dışarı akmaya başlayacaktır. - 1 dakika çalkaladıktan sonra serbest adacıkları kontrol etmek için her 2 dakikada bir devreden bir numune (yaklaşık 1 mL) alın.
- Numuneyi 80 μL dithizone (DTZ) içeren 6 oyuklu bir plakaya yerleştirin. 2 mL fosfat tamponlu salin (PBS) ekleyin ve numuneyi mikroskop altında 40x büyütme ile inceleyin. DTZ, adacıkları kırmızıya boyayacaktır.
- Özetin toplanması
- Serbest adacıklar gözlenene kadar sindirime devam edin (birçoğu hala kısmen ekzokrin içinde sıkışıp kalmış olsa bile).
NOT: Adacık salınımı yaklaşık 10-15 dakika sürer, ancak sindirim süresi genellikle donörün yaşı, enzim lotları, enzim konsantrasyonu vb. tarafından etkilenir. - Devreyi açın ve serbest bırakılan dokuyu 1 L'lik şişelere toplayın. Kollajenaz Tip V'yi etkisiz hale getirmeye yardımcı olmak için toplarken şişeleri buz üzerinde tutun.
- Kalan ılık HBSS çözeltisini (~ 850 mL, adım 5.2.1) devridaim kabına ekleyin ve kalan sindirilmiş dokuyu sindirim odasından toplayın.
- Hazneye soğuk toplama ortamı ekleyin (devridaim kabı aracılığıyla ).
NOT: Doku peletleri küçüldüğünde toplamayı durdurun. Toplama aşaması (adım 5.3.2-5.3.3) 40-75 dakika ve 5-8 L toplama ortamı alabilir. - Dokuyu toplama şişesinden 250 mL konik santrifüj tüplerine aktarın ve 4 ° C'de 3 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı atın ve dokuyu 500 mL taze toplama ortamında yeniden süspanse edin.
- Tüm sindirim toplanana kadar hücre peletlerini soğuk toplama ortamında (500 mL) birleştirmeye devam edin.
- Soğuk ortamda asılı kalan hücre peletini santrifüjleme ile yıkayın (200 x g'de 3 dakika, 4 °C).
- Süpernatanı atın. Bölüm 6-8'de belirtilen adımları izleyerek hücre peletini değerlendirin ve miktarını belirleyin.
NOT: Nihai hacim pankreas boyutuna bağlıdır ancak 40-80 mL arasında olması beklenir.
- Serbest adacıklar gözlenene kadar sindirime devam edin (birçoğu hala kısmen ekzokrin içinde sıkışıp kalmış olsa bile).
6. Adacık arıtma
- Domuz adacıklarını yoğunluk gradyan ayrımı ile saflaştırın.
NOT: Kullanılan yoğunluk gradyan çözümlerinin ayrıntıları için Malzeme Tablosuna bakın.- 50 mL konik tüplere 2 mL pankreas dokusu ekleyin.
- Her 2 mL pankreas dokusunu yeniden süspanse etmek için 12 mL 1119 poliskaroz gradyanı (1.119 g /cm3) ekleyin.
- 10 mL 1083 polisakroz çözeltisi (1.083 g /cm3), 10 mL 1077 polisakroz çözeltisi (1.077 g /cm3), 10 mL 1037 polisakroz çözeltisi (1.037 g /cm3) ve 5 mL HBSS, art arda.
NOT: 1037 polisakaroz çözeltisi (1.037 g/cm3), 1077 polisakaroz çözeltisi (1.077 g/cm3) ve hipertonik sitrat pürin çözeltisi (38.5 mL:11.5 mL) karıştırılarak hazırlanır. - 900 °C'de 10 dakika boyunca frensiz 4 x g'da santrifüjleyin.
- 1077 polisakaroz çözeltisi ve 1037 polisakar çözeltisi katmanları arasındaki adacıkları aspire edin.
- Adacıkları 50 mL'lik bir santrifüj tüpüne aktarın, sıvıyı her tüpe eşit olarak dağıtın ve santrifüjlemeden önce dengeleyin.
- Domuz adacıklarını yıkayın
- 200 ° C'de 3 dakika boyunca 4 x g'da santrifüjleyin, süpernatanı atın. Hacmi 45 mL'ye çıkarmak için toplama ortamını ekleyin.
- 4 ° C'de 3 dakika boyunca 200 x g'da santrifüjleyin, yaklaşık 2 mL süpernatan bırakın; Karıştırmak için hafifçe çalkalayın.
- Tüm peletleri aynı 50 mL santrifüj tüpünde birleştirin. Hacmi 45 mL'ye çıkarmak için toplama ortamını ekleyin.
7. Adacık eşdeğerlerinin (IEQ) ve adacık kültürünün sayılması
- Adacıkların DTZ boyaması
- Adacıkları bir araya getirin, hacmi 250 mL'ye çıkarmak için daha fazla toplama ortamı ekleyin ve adacıkları yeniden askıya alın.
- Temsili numuneden 500 μL alın ve 80 μL DTZ içeren 35 mm'lik bir tabağa yerleştirin. Oda sıcaklığında 1-2 dakika inkübe etmesine izin verin ve ardından 2 mL PBS ekleyin.
- Ters çevrilmiş bir mikroskop altında 40x büyütmede inceleyin. Adacık agregaları DTZ tarafından kırmızıya boyanır.
- Lekeli adacıkların sayılması
- Lekeli adacıkları Tablo 1'de listelenen boyut kategorilerine bölerek sayın. Boyuta göre adacık eşdeğerini (IEQ) belirlemek için dönüştürme faktörünü kullanın.
NOT: IEQ dönüşümü, DTZ-pozitif agregaların çapının çoğunluğu 50 μm'den büyük olduğunda gerçekleştirilir (yetişkin (>2 yaş) ve bazı genç-yetişkin (6-12 ay) preparatları adım 7.2.4'e geçer). Diğer tüm durumlarda (6 aylıktan küçük genç domuzlarda ve kalan genç yetişkin domuzlarda), adacıkların sayısı partikül hacmine veya DNA içeriğine göre tahmin edilmiştir (7.2.2-7.2.3 adımlarına göre). - (İSTEĞE BAĞLI) Paletleri ölçmek için 2 dakika boyunca 4 ° C'de 200 x g'da santrifüjleyin.
- (İSTEĞE BAĞLI) Hücre proliferasyon test kiti ile tek adacıkların yanı sıra adacık hücresi peletlerinin DNA içeriğini değerlendirin. DNA içeriğinden ve immünositokimyasal analizden domuz beta hücre sayılarını tahmin edin.
- Tüm kategorileri ekleyin ve örnek için toplam IEQ'yu belirleyin. Bu sayıyı kesrin hacmiyle çarpın. (örneğin, 250 mL'lik bir fraksiyonun 500 μL'sinde 200 IEQ = 200 x 2 x 250 = 100.000 IEQ).
- Lekeli adacıkları Tablo 1'de listelenen boyut kategorilerine bölerek sayın. Boyuta göre adacık eşdeğerini (IEQ) belirlemek için dönüştürme faktörünü kullanın.
- Adacık kültürü
- Adacıkları 200 x g'da 4 °C'de 1 dakika santrifüjleyin; Süpernatanı atın.
- Adacıkları yeniden süspanse etmek için 5 mL önceden ısıtılmış kültür ortamı ekleyin ve 150 mm'lik bir Petri kabına aktarın.
NOT: 10.000 adacık/çanak yeniden askıya alın. - 150 mm'lik Petri kabında hacmi 30 mL'ye çıkarmak için daha fazla kültür ortamı ekleyin.
8. Adacık kalitesinin değerlendirilmesi
- Calcein (CA) -Propidium İyodür (PI) adacıkların boyanması
- 48 oyuklu bir plakaya 50 adacık seçin. 1 mL HBSS ile bir kez yıkayın.
- Hücre canlılığı boyama kitinin talimatlarına göre 1x CA ve 1x PI içeren karışımdan 200 μL ekleyin.
- Petri kabının üzerini örtün ve 37 °C'de 30 dakika boyunca bir inkübatöre koyun.
- Bir floresan mikroskobu kullanarak adacıkları görselleştirin ve görüntüleri yakalayın.
- CA-PI boyamadan sonra canlı hücreleri (yeşil) ve ölü hücreleri (kırmızı) sayarak canlılığı ölçün.
- Glukoz ile uyarılan insülin sekresyonu (GSIS)
- 24 oyuklu bir bitkinin üç kuyusuna 1 mL düşük glikoz konsantrasyonlu çözelti ekleyin.
- En az gece boyunca kültürden sonra, çapı 100-200 μm aralığında benzer büyüklükte 100 adacığı elle seçin ve bunları düşük glikoz konsantrasyonlu çözelti ile önceden doldurulmuş 24 oyuklu plakanın üç kuyucuğuna aktarın (adım 8.2.1'de olduğu gibi).
NOT: Kültür ortamını yıkamak için adacıkları kuyuya aktarmadan önce HBSS ile bir ara kuyuda yıkayın. - Adacıkları %5CO2 inkübatörde 37 °C'de 30 dakika inkübe edin.
- Süpernatanı adacıklara dokunmadan bir pipetle dikkatlice çıkarın.
- 1 mL yeni düşük glikoz konsantrasyonlu çözelti ekleyin.
- Adacıkları %5 CO2 inkübatörde 37 ° C'de 60 dakika inkübe edin.
- Süpernatanı toplayın (adacık yok) ve en az 500 μL'sini 1.5 mL'lik bir santrifüj tüpüne aktarın. Bu, düşük glikoz stimülasyonu altında salgılanan insülini içerecektir.
- Aynı kuyucuklara dikkatlice 1 mL yüksek glikoz konsantrasyonlu çözelti ekleyin.
- Adacıkları %5 CO2 inkübatörde 37 ° C'de 60 dakika inkübe edin.
- 500 μL daha kültür ortamını yeni bir 1.5 mL santrifüj tüpüne aktarın. Bu, yüksek glikoz stimülasyonu altında salgılanan insülini içerecektir.
- Düşük ve yüksek glikoz stimülasyonunu takiben salınan insülin konsantrasyonunu ölçmek için domuz insülini için enzime bağlı immünosorbent testi (ELISA) kitleri kullanın (adım 8.2.7 ve 8.2.10).
NOT: Stimülasyon İndeksi (SI), yüksek glukoz stimülasyonunu takiben ölçülen insülin konsantrasyonunun, düşük glukoz stimülasyonunu takiben insülin konsantrasyonuna bölünmesiyle hesaplanır.
Sonuçlar
Biyogüvenlik kabininin hazırlanışı Şekil 1'de gösterilmiştir. Üç bağımsız çalışma alanı kurulmuştur. Biyogüvenlik kabini #1, böbrek havzaları, cerrahi aletler ve pankreas kesimi için beherler ile donatılmıştır (Şekil 1A). Biyogüvenlik kabini #2, bir su banyosu, peristaltik pompa, devridaim tüplü tüp standı ve adacık çürütmesi için sindirim odası ile donatılmıştır (Şekil 1B). Biyogüvenlik kabini #3, enzim hazırlama, adacık saflaştırma ve aşağıdaki adımlar için tek kullanımlık filtreler ve santrifüj tüpleri ile donatılmıştır (Şekil 1C).
Pankreas (enzim perfüzyonundan önce ve sonra) Şekil 2'de gösterilmiştir. Kollajenaz Tip V solüsyonu, pankreasın başından başlayarak pankreas kanalı yoluyla tüm pankreasa perfüze edilir. Bağlantı lobu başarılı bir şekilde perfüze edilmezse, ayrı parçalara kesilmesi ve her birinin perfüze edilmesi gerekir.
Pankreas sindirimi, Şekil 3'te gösterildiği gibi sindirim odasında gerçekleştirilir. Mekanik bozulma sonrası pankreas dokusu ve sindirimden sonra kalan sindirilmemiş pankreas dokusu şekilde gösterilmiştir. Az miktarda sindirilmemiş doku tam sindirimi gösterir; Bununla birlikte, aşırı sindirimi de gösterebilir; Bu nedenle, pankreas organının% 15-25'i odacıkta kalırsa, kabul edilebilir. Sindirilen pankreas dokusu daha sonra Şekil 4'te gösterildiği gibi adacıkları asiner hücrelerden ayırmak (saflaştırma) için süreksiz yoğunluk gradyanlarında yıkanır ve santrifüjlenir. Pankreas adacıkları orta tabakada bulunur.
Adacıkların DTZ boyaması Şekil 5'te gösterilmiştir. Sindirimin durduğu ve toplamanın başladığı nokta (yani serbest adacıkların ortaya çıktığı zaman) Şekil 5A'da gösterilmiştir. Yoğunluk gradyanı ayrımından sonra saflaştırılmış domuz adacıkları Şekil 5B'de gösterilmektedir. Parlak alandaki adacıklar Şekil 6A'da gösterilmiştir. Adacık kalitesi, Şekil 6B'de gösterildiği gibi Calcein (CA) -Propidium Iodür (PI) boyaması ile incelenir. Canlı hücreler yeşil, ölü hücreler kırmızıdır. Bu protokolün ortalama adacık izolasyon verimi, önceki çalışmaya benzer şekilde (333.000 ± 129.000 IEQ/pankreas) 114.279 IEQ/pankreas ± 360.935 ve pankreasın 2.439-3.252 IEQ/g'sidir. Bu protokol ile adacıkların ortalama canlılığı %81'in üzerindedir, bu da önceki çalışmadan (%86.7) biraz daha düşüktür. Bu protokol ile ELISA ile ölçülen glikoz ile uyarılan insülin sekresyon testi (GSIS) ile elde edilen stimülasyon indeksinin (SI = düşük glikoz koşullarına karşı yüksek glikoz sırasında salınan insülin miktarları (mU/L) arasındaki oran) 1.4 ± 0.3'tür, bu da önceki çalışmaya benzer şekilde (1.75 ± 0.60)24. Yukarıdaki sonuçlar Tablo 2'de özetlenmiştir.

Şekil 1: Biyogüvenlik kabininin hazırlanması. (A) Biyogüvenlik kabini #1, steril alandaki böbrek havzasını, cerrahi aletleri ve beherleri gösterir. (B) (soldan sağa) su banyosu, peristaltik pompa, devridaim tüplü ve tüplü tüp standı ve sindirim hazneli biyogüvenlik kabini #2. (C) Tek kullanımlık filtreler ve santrifüj tüpleri içeren biyogüvenlik kabini #3. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Enzim perfüzyonu öncesi ve sonrası pankreas. (A) Enzim perfüzyonundan önce. (B) Enzim perfüzyonundan sonra şişmiş pankreas. Kırmızı ok, Kollajenaz Tip V çözeltisinin akışını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Sindirim odasındaki pankreas. (A) Mermerlerle sindirim ve bozulma sonrası pankreas dokusu. (B) Sindirimden sonra kalan pankreas dokusu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: Süreksiz yoğunluk gradyanlı santrifüjleme sonrası pankreas hücre tabakalaşması. Santrifüjlemeden sonra, adacıklar 1.077 g /cm3 ile HBSS tabakası arasında konsantre olacaktır ve alt tortu adacık olmayan dokudur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
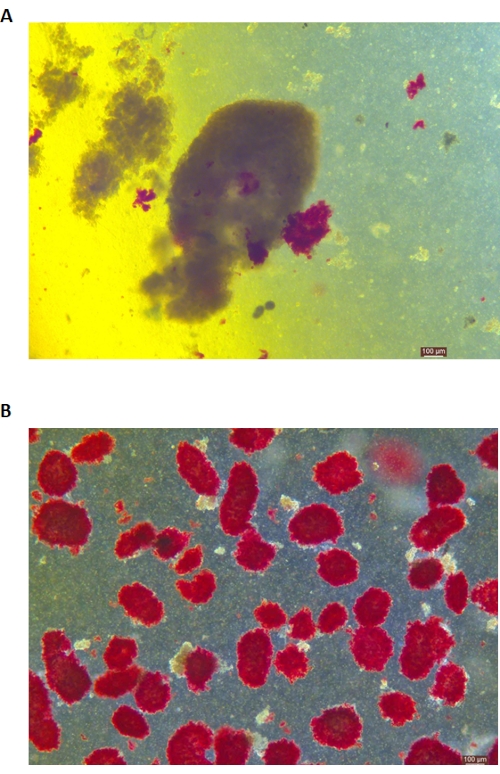
Şekil 5: Sindirim sırasında adacıkların ditizon (DTZ) lekelenmesi. (A) Örnekler sindirim odasından toplanır. Numunedeki adacıklar kırmızıya boyanmıştır. Toplamaya başlama sinyali, 1-2 adacığın ekzokrin dokudan tamamen serbest bırakıldığı zamandır. (B) Süreksiz yoğunluk gradyanı ile ayrılmış saflaştırılmış adacıklar. Ölçek çubuğu 100 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Canlı/ölü adacık hücresi canlılık boyama. (A) Parlak alandaki adacıklar. (B) Calcein (CA) -Adacıkların propidyum İyodür (PI) boyaması. Canlı hücreler yeşil, ölü hücreler kırmızıdır. Ölçek çubuğu 100 μm'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Kategori | Adacık Çap Aralığı (μm) | IEQ Dönüşüm Faktörü |
| 1 | 50–100 | x 0.167 |
| 2 | 101–150 | x 0.648 |
| 3 | 151–200 | x 1.685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6.315 |
| 6 | 301–350 | x 10.352 |
| 7 | >350 | x 15.833 |
Tablo 1: Adacık eşdeğerlerini (IEQ) hesaplamak için dönüşüm faktörleri.
| Bu protokol | Önceki çalışmalar24 | |
| Adacık verimi (IEQ/pankreas) | 360.935 ± 114.279 | 333.000 ± 129.000 |
| Adacıkların canlılığı | 81% | 86.70% |
| Adacık insülin stimülasyon indeksi | 1.4 ± 0.3 | 1,75 ± 0,60 |
Tablo 2: Bu protokol ile elde edilen sonuçların önceki çalışmalarla karşılaştırılması.
Tartışmalar
Domuzları adacık kaynağı olarak kullanan adacık ksenotransplantasyonu, insan adacıklarının kıtlığının üstesinden gelmek için umut verici bir yaklaşımdır. Yetişkin domuz adacıklarının izolasyonu zor olsa da, birkaç grup adacıkları tutarlı bir şekilde başarılı bir şekilde izole etmek için protokoller oluşturmuştur10,11. Yöntemden bağımsız olarak, ürünlerin yüksek kalitesini doğrulamak için adacık canlılığı ve fonksiyonel özellikleri gösterilmelidir. Bu protokol, anlaşılması ve çoğaltılması kolay olması için10,11 video formatında yayınlananlara dayanmaktadır.
Önceki raporlara ve deneyimlerimize göre, yetişkin domuz adacıklarının başarılı bir şekilde izole edilmesi için çeşitli parametreler kritik öneme sahiptir13,14. Kritik parametreler şunları içerir: (1) Donör domuz yaşı ve cinsiyeti: ikiden fazla litreye sahip dişi domuzlar (emekli yetiştiriciler olarak adlandırılır) genç domuzlara göre tercih edilir, çünkü çok sayıda yüksek kaliteli adacığı kolayca sağlayabilirler 25,26,27,28,29,30, (2) Sıcak iskemi süresi: otomatik sindirimi azaltmak için 10 dakika ile sınırlıdır 14, (3) Sindirim enzimi: Kollajenaz Tip V geçerli bir seçenektir, (4) Sindirim süresi: Aşırı sindirimi önlemek için sindirimi yeterince erken durdurmak önemlidir. Serbest adacıklar görüldüğü anda kısmen kapana kısılmış olsalar bile toplama işlemine geçilir. Sürecin çok başındayız.
Bu protokolün çeşitli avantajları vardır. Adacık saflaştırması için bir COBE 2991 hücre işlemcisi kullanan sürekli veya süreksiz yoğunluk gradyanları ile karşılaştırıldığında, bu protokol katmanı, konik tüpler ve standart bir santrifüj kullanarak yoğunluk gradyan çözeltileri üzerinde adacıklar. Yeni başlayanlar için uygun maliyetlidir ve ustalaşması kolaydır. Bu saflaştırma yöntemi daha fazla manuel emek gerektirdiğinden, toplu üretim ve büyük peletler, verimliliği artırmak için yine de bir COBE hücre işlemcisi gerektirebilir.
Bazı sorun giderme adımları da burada ele alınmıştır. (1) Pankreas dokusunun %25'inden fazlasının sindirilmediğini veya çoğu pankreas adacığının asiner doku ile kaplı olduğunu varsayalım. Bu durumda, olası nedenler arasında zayıf perfüzyon, enzim aktivitesini etkileyen artık kan, düşük enzim konsantrasyonu veya aktivitesi veya sindirim sırasında düşük sıcaklık yer alır. (2) Pankreas dokusunun aşırı sindirimi pankreas adacık parçalanmasına neden olabilir. Olası sebep, sıcak iskemi süresinin iyi kontrol edilmemesi, yüksek sindirim enzimi konsantrasyonu, sindirilmiş adacıkların sindirim enzimi çözeltisine daha uzun süre maruz kalması veya yüksek sindirim sıcaklığıdır. Bu sadece enzim / sindirim parametrelerinin standardizasyonu ve sürecin optimizasyonu ile önlenebilir. (3) Kültür işlemi sırasında pankreas adacık bütünlüğünün kaybı da meydana gelebilir. Bunun bazı nedenleri arasında düşük pankreas adacık saflığına, çok yüksek adacık kültürü yoğunluğuna, yetersiz beslenmeye veya mekanik hasara yol açan asiner kontaminasyon yer alır. Pankreas adacık bütünlüğünün kaybının üstesinden gelmek için, adacık ortamının hacmini artırın, ortamın yoğunluğunu artırın ve adacıkları daha yavaş ve daha kısa süre için santrifüjleyin.
Özetle, bu protokol, insan olmayan primat alıcılarına nakledilecek yetişkin domuz adacıklarını hazırlamak için başarıyla kullanılmıştır. Gelecekteki araştırmalar için adacıklar elde etmek için daha fazla kullanılacaktır.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması bildirmemiştir.
Teşekkürler
Profesör David K. C. Cooper'a (Transplantasyon Bilimleri Merkezi, Massachusetts General Hospital) tüm ksenotransplantasyon sistemini kurmamıza yardımcı olduğu için teşekkür ederiz. Bayan Xingling Hu'ya (Shenzhen İkinci Halk Hastanesi), Bayan Xiaohe Tian'a (California Üniversitesi, Berkeley), Bay Bo Zhou'ya (Boston Üniversitesi) yararlı tartışma ve önerileri için teşekkür ederiz. Bu çalışma, Çin Ulusal Anahtar Ar-Ge Programı (2017YFC1103701, 2017YFC1103704), Guangdong Eyaletindeki Üst Düzey Hastanelerin İnşası için Özel Fonlar (2019) ve Shenzhen'deki Sanming Tıp Projesi'nden (SZSM201812079) alınan hibelerle desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Referanslar
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), London, England. 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, Clifton, N.J. 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , Artechhouse. Norwood, MA. 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, Clifton, N.J. 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, Suppl 2 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır