Method Article
عزل جزيرة الخنزير البالغ
* These authors contributed equally
In This Article
Summary
يغطي هذا البروتوكول التفصيلي الخطوات المنهجية لعزل جزيرة الخنازير البالغة من مرحلة الهضم عبر التنقية إلى التقييم الوظيفي النهائي للجزر. يمكن استخدام هذا المخطط كمبدأ توجيهي لعزل جزر الخنازير البالغة في المؤسسات البحثية.
Abstract
يحدث داء السكري من النوع 1 (T1DM) بسبب تدمير المناعة الذاتية لخلايا β البنكرياس ، مما يؤدي إلى قلة إنتاج الأنسولين أو انعدامه. تلعب زراعة الجزر دورا مهما في علاج T1DM ، مع تحسين التحكم في التمثيل الغذائي السكري ، وتقليل تطور المضاعفات ، وتقليل نوبات نقص السكر في الدم عند مقارنتها بالعلاج بالأنسولين التقليدي. أظهرت نتائج المرحلة الثالثة من التجربة السريرية أيضا سلامة وفعالية زرع الجزر في T1DM. ومع ذلك ، فإن النقص في المتبرعين للبنكرياس يحد من استخدامه على نطاق واسع. تقدم كمصدر للجزر الصغيرة مثل الخنزير خيارا بديلا. نظرا لأن بنية بنكرياس الخنازير تختلف عن جزر الفئران أو البشر ، فإن إجراء عزل جزيرة الخنازير لا يزال يمثل تحديا. نظرا لأن ترجمة مصادر جزر الخنازير البديلة (الغريبة) إلى البيئة السريرية لعلاج T1DM من خلال الزرع الخلوي لها أهمية كبيرة ، فإن هناك حاجة ماسة إلى بروتوكول فعال من حيث التكلفة وموحد وقابل للتكرار لعزل جزر الخنازير. تصف هذه المخطوطة طريقة مبسطة وفعالة من حيث التكلفة لعزل وتنقية جزر الخنازير البالغة بناء على البروتوكولات السابقة التي نجحت في زرع جزر الخنازير في الرئيسيات غير البشرية. سيكون هذا دليلا للمبتدئين دون استخدام معدات متخصصة مثل معالج خلية COBE 2991.
Introduction
داء السكري من النوع 1 (T1DM) هو مرض خطير يؤدي فيه تدمير المناعة الذاتية لخلايا بيتا إلى إنتاج الأنسولين1،2،3. لا تستطيع مجموعة كبيرة من المرضى الذين يعانون من T1DM تثبيت نسبة السكر في الدم بالعلاج بالأنسولين ويعانون من نوبات نقص السكر في الدم تهدد الحياة. يمكن لزرع الجزر ، عندما ينجح ، تحقيق ذلك. خضع أكثر من 1,500 مريض بالسكري لعملية زرع جزرية ناجحة في جميع أنحاء العالم ، مما أظهر أقل خطورة ونجاحا في النتائج على المدى الطويل مقارنة بزراعةالبنكرياس 4.
بالمقارنة مع العلاج بالأنسولين ، فإن زرع الجزر له نتائج أفضل في تقليل تطور المضاعفات5. أظهرت نتائج المرحلة الثالثة من التجربة السريرية أيضا سلامة وفعالية زرع الجزر في T1DM6،7. قد تكون زراعة الجزر هي أفضل خيار علاجي متاح حاليا للمرضى الذين يعانون من T1DM الذين يعانون من نوبات نقص السكر في الدم تهدد الحياة.
ومع ذلك ، فإن النقص في الجزر المانحة الخيفية البشرية يحد من الاستخدام الواسع النطاق لزرع الجزر8،9. لذلك ، من المستحسن استخدام الجزر الحيوانية كبديل10. تم اختيار الخنزير كمتبرع للخلايا الجزيرية في زراعة الأجانب قبل السريرية ، وهو ذو إمكانية الترجمة إلى العيادة بسبب 1) التوافر ، 2) أوجه التشابه الأيضية مع البشر ، 3) كتلة خلايا بيتا الكبيرة إلى حد ما ، و 4) إمكانية الهندسة الوراثية لتحسين التوافق المناعي للبشر11.
يعد النقاء العالي وقابلية البقاء للجزر من الخطوات الرئيسية لنجاح زرع الأجانب. ومع ذلك ، فإن إجراء عزل الجزر الصغيرة عن المتبرعين بالخنازير البالغة يمثل تحديا بسبب بنية البنكرياس نفسه ، والتي تختلف عن جزر الفئران أوالبشر 12. بشكل عام ، شكل جزر البنكرياس الخنازير ليس مضغوطا12. بالمقارنة مع جزر البنكرياس البشرية والقوارض ، فإن جزر الخنازير تنفصل بسهولةأكبر 12. ومع ذلك ، فإن التفكك التلقائي للطبقة الخارجية من خلايا الجزر ، مصحوبا بوقت ثقافة طويل ، يؤدي إلى انخفاض كبير في حجم جزيرة البنكرياس10.
أثناء عملية عزل الجزيرة ، تؤثر العديد من العوامل على جودة الجزر ، مثل عمر المتبرع ، ووقت نقص التروية الدافئ ، والنشاط الأنزيمي ، والانتفاخ عن طريق الحقن الأنزيمي13،14. على الرغم من أن العديد من الدراسات السابقة قدمت طرقا لعزل جزر الخنازير ، إلا أنه لا يوجد بروتوكول فيديو مفصل خطوة بخطوة للباحثين كتعليمات فعالة10،15،16،17،18،19،20،21،22،23.
لهذا الغرض ، يغطي هذا البروتوكول التفصيلي جميع خطوات العزل ، من استرجاع الأعضاء إلى التقييم الوظيفي بعد العزل للجزر ، على أمل تقديم نظرة عامة بسيطة ومفهومة للعملية لسهولة التطبيق. يعتمد هذا البروتوكول على الطرق المنشورة سابقا مع التعديلات10،11.
Protocol
تتم الموافقة على جميع الإجراءات التي تنطوي على من قبل اللجنة المؤسسية لرعاية واستخدامها في مستشفى Shenzhen Second People's Hospital واتباع جميع اللوائح الوطنية. في هذا البروتوكول ، تم استخدام خنازير Duroc-Landrace-Yorkshire (~ 6 أشهر من العمر) التي تم شراؤها من السوق كمتبرعين للبنكرياس. كان وزن البنكرياس الذي تم جمعه 123.63 جم ± 22.50 جم. يتم ارتداء معدات الحماية الشخصية ، بما في ذلك الملابس الواقية والأقنعة والقفازات والقبعات ، أثناء التجارب.
1. إعداد وسائل الإعلام
- وسط التنظيف: لتحضير 100 مل من وسط التنظيف ، اخلطي محلول الملح المتوازن من هانك (HBSS) ، ومصل الخنازير 2٪ ، و 20 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبرازينات إيثان سلفونيك (HEPES) ، و 1٪ بنسلين ستربتومايسين (P / S).
- وسط التجميع: امزج RPMI 1640 مع مصل الخنازير بنسبة 5٪ و 1٪ بنسلين ستربتومايسين (P / S).
- وسط الاستزراع: امزج CMRL 1066 مع مصل الخنازير 10٪ ، و 10 مليمول / لتر من النيكوتيناميد ، و 1٪ P / S ، و 2 مليمول / لتر من الجلوتامين.
- محلول الإنزيم: تحضير محلول 1 مجم / مل من الكولاجيناز من النوع الخامس (النشاط: 918 وحدة / مجم صلب) في HBSS.
- محلول منخفض التركيز الجلوكوز: لتحضير محلول منخفض التركيز للجلوكوز ، أضف 0.5٪ ألبومين مصل البقر (BSA) و 2.8 ملي مولار D-Glucose إلى 1 مل من محلول بيكربونات رينجر (KRBB).
- محلول تركيز عالي من الجلوكوز: لتحضير محلول عالي التركيز من الجلوكوز ، أضف 0.5٪ ألبومين مصل البقر (BSA) و 28 ملي مولار D-Glucose إلى 1 مل من محلول بيكربونات رينجر (KRBB).
2. استرجاع البنكرياس
- تخدير الخنازير وتحضير الجلد
- تخدير الخنزير المتبرع بالحقن العضلي لمخدر Lumianning (2.5-5 مجم / كغ) وبروبوفول (2-3 مجم / كجم) (انظر جدول المواد للحصول على التفاصيل).
- الحفاظ على التخدير مع 1٪ -3٪ إيزوفلوران في حجم تهوية 1-1.5 لتر / دقيقة بواسطة أقنعة التخدير بالغازات.
- راقب معدل ضربات القلب للتأكد من التخدير المناسب. استخدم مرهم بيطري على العينين لمنع الجفاف أثناء التخدير.
- احلق البطن ، ونظفه باليودوفور ، وقم بتغطية الخنزير بستارة جراحية معقمة بشكل مناسب.
- فتح البطن
- بعد التأكد من الظروف المعقمة ، قم بعمل شق شق البطن في خط الوسط من الخنجري إلى السرة بالقرب من الذيل قليلا.
- شق الحجاب الحاجز.
- اعزل الشريان الأورطي فوق الرحمي والوريد الأجوف السفلي فوق الرحمي (IVC) باستخدام ملقط الأوعية الدموية ، ثم عزل الشريان الأورطي تحت الكلوي و IVC تحت الكبد بنفس الطريقة.
- إعطاء الهيبارين الوريدي (100 وحدة / كغ) للخنزير لمنع تخثر الدم.
- قم بإخراج الأمعاء الدقيقة والغليظة من الخارج ، وادفع الكبد والمعدة نحو الرأس لكشف البنكرياس بالكامل.
- نضح البنكرياس
- قم بتثبيت الشريان الأورطي فوق الحجاب الحاجز باستخدام ملقط الأوعية الدموية ، وقم بتنبيب الشريان الأورطي فوق فرع الشريان الأورطي عبر قنية الأبهر (16 جم) ، واربطه بخيط خياطة 2-0.
- نقع ب 2-3 لترات من محلول HBSS البارد (تم تعبئته مسبقا وصيانته عند 4 درجات مئوية) من خلال قنية الأبهر (16 جم). قم بنقع محلول HBSS من خلال قنية الأبهر عن طريق الجاذبية ، بينما يتم نقل IVC فوق الهيباتيك و IVC لإطلاق سائل التروية.
ملاحظة: استمر في التسريب حتى يصبح تدفق IVC واضحا.
- استئصال البنكرياس
- انزع الثرب وابحث عن البنكرياس وفصوص الطحال مع الطحال وافصلهما.
- افصل الفص المتصل للبنكرياس بالأنسجة المجاورة.
- أوجد قناة البنكرياس الرئيسية في الجزء الهابط من الاثني عشر. اربط القناة الصفراوية بخياطة (2-0) وقم بتقطيعها بمقص بالقرب من قناة البنكرياس.
- قم بتثبيت جزء من الاثني عشر يحتوي على أمبولة فاتر على جانبي رأس البنكرياس باستخدام ملقط الأوعية الدموية ، ثم قم باستئصال الاثني عشر بالمقص.
- أخرج البنكرياس بالكامل ، واغمره في HBSS البارد ، وانقله على الفور إلى مرفق عزل الجزيرة.
ملاحظة: تم القتل الرحيم للخنازير باستخدام البنتوباربيتال الصوديوم (100-200 مجم / كجم). يمكن استخدام التسريب داخل القناة ل HBSS أو محلول الحفظ لتوسيع البنكرياس في موقع شراء الأعضاء إذا تم شراء البنكرياس في المسلخ المحلي.
3. قم بإعداد ثلاث خزانات للسلامة الحيوية للتجارب التالية
- قم بإعداد خزانة السلامة الحيوية # 1 مع حوض الكلى والأدوات الجراحية والأكواب لتنظيف البنكرياس (القسم 4 ، الشكل 1 أ).
- قم بإعداد خزانة السلامة الحيوية # 2 مع حمام مائي ، ومضخة تمعجية ، وحامل أنبوب مع أنبوب إعادة التدوير ، وغرفة هضم لهضم الجزر (القسم 5 ، الشكل 1 ب).
- قم بإعداد خزانة السلامة الحيوية # 3 مع مرشحات يمكن التخلص منها وأنابيب طرد مركزي لإعداد الإنزيم وتنقية الجزر والخطوات التالية (الأقسام 6-8 ، الشكل 1C).
4. تنظيف البنكرياس
- نظف البنكرياس ووزنه.
- اشطف البنكرياس في 200 مل من اليودوفور لمدة 3 دقائق في خزانة السلامة الحيوية # 1. شطف البنكرياس في 200 مل من HBSS الباردة مرتين ، 2 دقيقة لكل منهما.
- ضع البنكرياس النظيف في حوض الكلى الذي يحتوي على 100 مل من وسط التنظيف على الثلج.
- حافظ على الأبولة مثبتة ، وقم بإزالة الاثني عشر. نظف البنكرياس من الدهون الخارجية والأنسجة الضامة.
- وزن البنكرياس.
5. هضم البنكرياس
- ضخ الكولاجيناز
- قم بقص مقطع عرضي لأحد الفروع الحلقية للبنكرياس وأدخل وعائية 18 جم (إذا كانت أقطار القناة أصغر ، ففكر في 20 جم من الأوعية الدموية) في قناة البنكرياس الرئيسية وخياطتها في مكانها باستخدام خياطة حريرية مضفرة 2-0.
- اقطع جسر الأنسجة الذي يمر عبر الفص المتصل بالقرب من رأس البنكرياس ، وقم بتثبيت القسطرة على جانب الشق بالقرب من رأس البنكرياس لتقليل تسرب الإنزيم.
- ضع العديد من الأوعية الدموية لتحسين تسريب الإنزيم داخل القناة. لهذا ، أدخل الأوعية الدموية الإضافية (الحجم 20-22 جم) بعد تقسيم عضو البنكرياس لفضح القناة.
- قم بتثبيت خط أنابيب التعبئة ، بما في ذلك أنبوب سيليكون بطول 1 متر (16 #) مع موصل قفل Luer. الجزء الأوسط من الأنبوب مضمن في رأس المضخة التمعجية.
- قم بتشغيل المضخة التمعجية لملء نظام الأنابيب (حجم الأنبوب 16 #) 300 مل من 1 مجم / مل ، الكولاجيناز من النوع الخامس (النشاط: 918 وحدة / مجم) مسخن مسبقا إلى 24 درجة مئوية وإزالة فقاعات الهواء في الأنابيب.
- قم بتوصيل أنبوب التروية بالأوعية الدموية ، وقم بتشغيل المضخة التمعجية بمعدل 20 مل / دقيقة.
- أوقف التروية عندما يتم حقن معظم الإنزيم ويكون البنكرياس منتفخا جيدا (الشكل 2 ب).
- قطع الأنسجة الجيلاتينية الصافية التي تتشكل حول البنكرياس أثناء التروية.
ملاحظة: هذه الخطوة مهمة جدا لأن الجل يمكن أن يسد المرشح في الغرفة ويجعل من الصعب جمع الأنسجة المهضومة (الشكل 2 ب). - قم بإزالة الأوعية الدموية بعد التسريب.
- هضم الأنسجة
- سخن 1 لتر من محلول HBSS إلى 36 درجة مئوية. قم بإعداد نظام الهضم الذي يتكون من غرفة الهضم والأنابيب المتصلة بنظام مغلق مسبقا ، وقم بنقل ملف التسخين الخاص بالدائرة إلى حمام مائي 36 درجة مئوية.
- نقطع البنكرياس إلى 3-4 قطع ونسكبها باستخدام الكولاجيناز من النوع الخامس في دورق سعة 500 مل.
- قم بتغطية الدورق بغطاء طبق بتري معقم ، وانقله إلى خزانة السلامة الحيوية # 2 وضع محتويات الدورق في غرفة الهضم التي تحتوي على أربعة كرات زجاجية من السيليكون وشبكة 500 ميكرومتر.
- أغلق الغرفة وشد البراغي. ضع الإنزيم المتبقي في الدورق المعاد تدويره وقم بتشغيل المضخة التمعجية بسرعة 80 مل / دقيقة.
- أضف محلول HBSS دافئ (عادة حوالي 150 مل) مسخنا مسبقا في الخطوة 5.2.1 لملء الدائرة حتى الانتهاء. هز الغرفة برفق واقلبها حتى تصطدم الرخام الزجاجي المصنوع من السيليكون بالأنسجة.
ملاحظة: نظرا لأن جزر الخنازير أكثر حساسية من الأنسجة البشرية ، يجب أن تكون الاهتزازات متساوية وبطيئة لتجنب التلف. عندما يهضم الأنسجة ، ستبدأ في الانهيار والتدفق خارج الغرفة. - خذ عينة (حوالي 1 مل) من الدائرة كل دقيقتين للتحقق من وجود جزر حرة بعد الاهتزاز لمدة دقيقة واحدة.
- ضع العينة في 6 صفيحة بئر مع 80 ميكرولتر من الديثيزون (DTZ). أضف 2 مل من المحلول الملحي المخزن بالفوسفات (PBS) وافحص العينة تحت المجهر بتكبير 40x. سوف تلطخ DTZ الجزر باللون الأحمر.
- جمع الملخص
- استمر في عملية الهضم حتى تتم ملاحظة الجزر الحرة (حتى لو كان العديد منها لا يزال محاصرا جزئيا في الإفراز).
ملاحظة: يستغرق إطلاق الجزيرة حوالي 10-15 دقيقة ، ولكن غالبا ما يتأثر وقت الهضم بعمر المتبرع ، والكثير من الإنزيم ، وتركيز الإنزيم ، وما إلى ذلك. - افتح الدائرة واجمع الأنسجة المنبعثة في زجاجات سعة 1 لتر. احتفظ بالزجاجات على الثلج أثناء التجميع للمساعدة في تعطيل الكولاجيناز من النوع الخامس.
- أضف محلول HBSS الدافئ المتبقي (~ 850 مل ، الخطوة 5.2.1) إلى دورق إعادة التدوير واجمع الأنسجة المهضومة المتبقية من غرفة الهضم.
- أضف وسط التجميع البارد إلى الغرفة (عبر الدورق المعاد تدويره).
ملاحظة: توقف عن التجميع عندما تصبح كريات الأنسجة أصغر. يمكن أن تستغرق مرحلة التجميع (الخطوات 5.3.2-5.3.3) ما يصل إلى 40-75 دقيقة و 5-8 لترات من وسائط التجميع. - انقل الأنسجة من زجاجة التجميع إلى أنابيب طرد مركزي مخروطية الشكل سعة 250 مل ، وأجهزة الطرد المركزي عند 200 × جم لمدة 3 دقائق عند 4 درجات مئوية.
- تخلص من المادة الطافية الأنسجة في 500 مل من وسط التجميع الطازج.
- استمر في دمج كريات الخلية في وسط تجميع بارد (500 مل) حتى يتم جمع كل الهضم.
- اغسل حبيبات الخلية المعلقة في الوسط البارد عن طريق الطرد المركزي (3 دقائق عند 200 × جم ، 4 درجات مئوية).
- تخلص من المادة الطافية. قم بتقييم وتحديد حبيبات الخلية باتباع الخطوات المذكورة في الأقسام 6-8.
ملاحظة: يعتمد الحجم النهائي على حجم البنكرياس ولكن من المتوقع أن يكون في حدود 40-80 مل.
- استمر في عملية الهضم حتى تتم ملاحظة الجزر الحرة (حتى لو كان العديد منها لا يزال محاصرا جزئيا في الإفراز).
6. تنقية الجزر
- تنقية جزر الخنازير عن طريق فصل تدرج الكثافة.
ملاحظة: راجع جدول المواد للحصول على تفاصيل حول حلول تدرج الكثافة المستخدمة.- أضف 2 مل من أنسجة البنكرياس إلى 50 مل من الأنابيب المخروطية الشكل.
- أضف 12 مل من 1119 تدرج عديد السكروز (1.119 جم /سم 3) لإعادة تعليق كل 2 مل من أنسجة البنكرياس.
- أضف 10 مل من محلول عديد السكروز 1083 (1.083 جم / سم3) ، و 10 مل من محلول عديد السكروز 1077 (1.077 جم / سم3) ، و 10 مل من محلول عديد السكروز 1037 (1.037 جم / سم3) ، و 5 مل من HBSS ، على التوالي.
ملاحظة: يتم تحضير 1037 محلول عديد السكروز (1.037 جم /سم 3) عن طريق خلط 1077 محلول عديد السكروز (1.077 جم / سم3) ومحلول بيورين سترات السترات مفرط التوتر (38.5 مل: 11.5 مل). - جهاز طرد مركزي عند 900 × جم بدون فرامل لمدة 10 دقائق عند 4 درجات مئوية.
- استنشق الجزر الصغيرة بين طبقات 1077 محلول عديد السكروز و 1037 محلول عديد السكروز.
- انقل الجزر إلى أنبوب طرد مركزي سعة 50 مل ، ووزع السائل بالتساوي في كل أنبوب ، وتوازن قبل الطرد المركزي.
- اغسل جزر الخنازير
- جهاز طرد مركزي عند 200 × جم لمدة 3 دقائق عند 4 درجات مئوية ، تخلص من المادة الطافية. أضف وسيط التجميع لرفع الحجم إلى 45 مل.
- جهاز طرد مركزي عند 200 × جم لمدة 3 دقائق عند 4 درجات مئوية ، تاركا حوالي 2 مل من المادة الطافية ؛ يرج برفق حتى يمتزج.
- اجمع جميع الكريات في نفس أنبوب الطرد المركزي سعة 50 مل. أضف وسيط التجميع لرفع الحجم إلى 45 مل.
7. عد معادلات الجزر (IEQ) وثقافة الجزر
- تلطيخ DTZ للجزر الصغيرة
- قم بتجميع الجزر معا ، وأضف المزيد من وسيط التجميع لرفع الحجم إلى 250 مل ، وأعد تعليق الجزر.
- خذ 500 ميكرولتر من العينة التمثيلية وضعها في طبق 35 مم مع 80 ميكرولتر من DTZ. اتركه يحتضن في درجة حرارة الغرفة لمدة 1-2 دقيقة ، ثم أضف 2 مل من PBS.
- افحص بتكبير 40x تحت المجهر المقلوب. مجاميع الجزر ملطخة باللون الأحمر بواسطة DTZ.
- عد الجزر الملطخة
- عد الجزر الملطخة عن طريق تقسيمها إلى فئات الحجم المدرجة في الجدول 1. استخدم عامل التحويل لتحديد مكافئ الجزيرة (IEQ) وفقا للحجم.
ملاحظة: يتم إجراء تحويل IEQ عندما يكون غالبية قطر الركام الموجب DTZ أكبر من 50 ميكرومتر (في البالغين (>2 سنة) وبعض الاستعدادات للشباب (6-12 شهرا) تنتقل إلى الخطوة 7.2.4). في جميع الحالات الأخرى (في الخنازير الصغيرة التي يقل عمرها عن 6 أشهر وفي الخنازير الشابة المتبقية) ، تم تقدير عدد الجزر بناء على حجم الجسيمات أو محتوى الحمض النووي (وفقا للخطوات 7.2.2-7.2.3). - (اختياري) جهاز طرد مركزي عند 200 × جم عند 4 درجات مئوية لمدة دقيقتين لقياس المنصات.
- (اختياري) قم بتقييم محتوى الحمض النووي للجزر المفردة ، وكذلك كريات خلايا الجزر بواسطة مجموعة مقايسة تكاثر الخلايا. استقراء أعداد خلايا بيتا الخنازير من محتوى الحمض النووي والتحليل الكيميائي المناعي.
- أضف جميع الفئات وحدد إجمالي IEQ للعينة. اضرب هذا الرقم في حجم الكسر. (على سبيل المثال ، 200 IEQs في 500 ميكرولتر من جزء 250 مل = 200 × 2 × 250 = 100,000 IEQs).
- عد الجزر الملطخة عن طريق تقسيمها إلى فئات الحجم المدرجة في الجدول 1. استخدم عامل التحويل لتحديد مكافئ الجزيرة (IEQ) وفقا للحجم.
- ثقافة الجزيرة
- الطرد المركزي الجزر عند 200 × جم عند 4 درجات مئوية لمدة دقيقة واحدة ؛ تخلص من المادة الطافية.
- أضف 5 مل من وسط الاستزراع المسخن مسبقا لإعادة تعليق الجزر ونقلها إلى طبق بتري مقاس 150 مم.
ملاحظة: أعد تعليق 10,000 جزيرة / طبق. - أضف المزيد من وسط الثقافة لرفع الحجم إلى 30 مل في طبق بتري مقاس 150 مم.
8. تقييم جودة الجزر
- الكالسين AM (CA) - تلطيخ بروبيديوم يوديد (PI) للجزر الصغيرة
- اختر 50 جزيرة صغيرة في طبق 48 بئرا. يغسل مرة واحدة ب 1 مل من HBSS.
- أضف 200 ميكرولتر من الخليط الذي يحتوي على 1x CA و 1x PI وفقا لتعليمات مجموعة تلطيخ قابلية الخلية للبقاء.
- غطي طبق بتري وضعيه في حاضنة على حرارة 37 درجة مئوية لمدة 30 دقيقة.
- تصور الجزر الصغيرة باستخدام المجهر الفلوري والتقط الصور.
- قم بتحديد قابلية البقاء عن طريق حساب الخلايا الحية (الخضراء) والخلايا الميتة (الحمراء) بعد تلطيخ CA-PI.
- إفراز الأنسولين المحفز بالجلوكوز (GSIS)
- أضف 1 مل من محلول تركيز الجلوكوز المنخفض إلى ثلاثة آبار من نبات 24 بئرا.
- بعد الاستزراع بين عشية وضحاها على الأقل ، انتقاء 100 جزيرة صغيرة ذات حجم مماثل في حدود قطر 100-200 ميكرومتر ونقلها إلى الآبار الثلاثة للوحة المكونة من 24 بئرا مملوءة مسبقا بمحلول منخفض التركيز الجلوكوز (كما في الخطوة 8.2.1).
ملاحظة: اغسل الجزر في بئر وسيط باستخدام HBSS قبل نقلها إلى البئر لغسل وسط الاستزراع. - احتضان الجزر الصغيرة في حاضنة ثاني أكسيد الكربون بنسبة 5٪عند 37 درجة مئوية لمدة 30 دقيقة.
- قم بإزالة المادة الطافية بعناية باستخدام ماصة دون لمس الجزر.
- أضف 1 مل من محلول جديد منخفض التركيز الجلوكوز.
- احتضان الجزر الصغيرة في حاضنة ثاني أكسيد الكربونبنسبة 5٪ عند 37 درجة مئوية لمدة 60 دقيقة.
- اجمع المادة الطافية (بدون جزر) وانقل ما لا يقل عن 500 ميكرولتر منه إلى أنبوب طرد مركزي سعة 1.5 مل. سيحتوي هذا على الأنسولين الذي يفرز تحت تحفيز منخفض الجلوكوز.
- أضف 1 مل من محلول تركيز الجلوكوز العالي بعناية في نفس الآبار.
- احتضان الجزر الصغيرة في حاضنة ثاني أكسيد الكربونبنسبة 5٪ عند 37 درجة مئوية لمدة 60 دقيقة.
- انقل 500 ميكرولتر أخرى من وسط الاستزراع إلى أنبوب طرد مركزي جديد سعة 1.5 مل. سيحتوي هذا على الأنسولين الذي يفرز تحت تحفيز الجلوكوز العالي.
- استخدم مجموعات مقايسة الممتز المناعي المرتبط بالإنزيم (ELISA) لأنسولين الخنازير لقياس تركيز الأنسولين المنبعث بعد تحفيز الجلوكوز المنخفض والمرتفع (الخطوتان 8.2.7 و 8.2.10).
ملاحظة: يتم حساب مؤشر التحفيز (SI) على أنه نسبة تركيز الأنسولين المقاس بعد تحفيز الجلوكوز العالي مقسوما على تركيز الأنسولين بعد تحفيز الجلوكوز المنخفض.
النتائج
يظهر إعداد خزانة السلامة الحيوية في الشكل 1. تم إنشاء ثلاث مساحات تشغيل مستقلة. خزانة السلامة الحيوية # 1 مزودة بأحواض الكلى والأدوات الجراحية والأكواب لتقليم البنكرياس (الشكل 1 أ). خزانة السلامة الحيوية # 2 مزودة بحمام مائي ، ومضخة تمعجية ، وحامل أنبوب مع أنبوب إعادة تدوير ، وغرفة هضم لهضم الجزر (الشكل 1 ب). خزانة السلامة الحيوية # 3 مزودة بمرشحات يمكن التخلص منها وأنابيب طرد مركزي لإعداد الإنزيم وتنقية الجزر والخطوات التالية (الشكل 1 ج).
يظهر البنكرياس (قبل وبعد نضح الإنزيم) في الشكل 2. يتم ترشيح محلول الكولاجيناز من النوع الخامس في البنكرياس بأكمله عبر قناة البنكرياس بدءا من رأس البنكرياس. إذا لم يتم ترشيح الفص المتصل بنجاح ، فيجب تقطيعه إلى قطع منفصلة ، ويجب أن يتم ترشيح كل واحدة.
يتم إجراء هضم البنكرياس في غرفة الهضم ، كما هو موضح في الشكل 3. يظهر في الشكل أنسجة البنكرياس بعد الاضطراب الميكانيكي ، وأنسجة البنكرياس غير المهضومة المتبقية بعد الهضم. تشير كمية صغيرة من الأنسجة غير المهضومة إلى الهضم الكامل. ومع ذلك ، قد يشير أيضا إلى الإفراط في الهضم. لذلك ، إذا بقي 15٪ -25٪ من عضو البنكرياس في الغرفة ، فهذا مقبول. ثم يتم غسل أنسجة البنكرياس المهضومة وطردها على تدرجات كثافة متقطعة لفصل الجزر عن خلايا الأسينار (التنقية) ، كما هو موضح في الشكل 4. تم العثور على جزر البنكرياس في الطبقة الوسطى.
يظهر تلطيخ DTZ للجزر في الشكل 5. تظهر النقطة التي يتوقف عندها الهضم ويبدأ التجميع (أي عندما تظهر الجزر الحرة) في الشكل 5 أ. تظهر جزر الخنازير المنقاة بعد فصل تدرج الكثافة في الشكل 5 ب. تظهر الجزر الصغيرة في الحقل الساطع في الشكل 6 أ. يتم فحص جودة الجزيرة عن طريق تلطيخ Calcein AM (CA) -Propidium Iodide (PI) ، كما هو موضح في الشكل 6 ب. الخلايا الحية خضراء والخلايا الميتة حمراء. يبلغ متوسط إنتاجية عزل الجزر لهذا البروتوكول 360,935 ± 114,279 IEQ / البنكرياس و 2,439-3,252 IEQ / g من البنكرياس ، وهو مشابه للدراسة السابقة (333,000 ± 129,000 IEQ / البنكرياس). متوسط جدوى الجزيرة بموجب هذا البروتوكول أعلى من 81٪ ، وهو أقل قليلا من الدراسة السابقة (86.7٪). إحدى النتائج التمثيلية لمؤشر التحفيز (SI = النسبة بين كميات الأنسولين (mU / L) المنبعثة أثناء ارتفاع الجلوكوز على ظروف الجلوكوز المنخفضة) التي تم الحصول عليها بواسطة اختبار إفراز الأنسولين المحفز بالجلوكوز (GSIS) المقاسة بواسطة ELISA بواسطة هذا البروتوكول هي 1.4 ± 0.3 ، وهو مشابه للدراسة السابقة (1.75 ± 0.60) 24. ويرد في الجدول 2 ملخص للنتائج المذكورة أعلاه.

الشكل 1: تحضير خزانة السلامة الحيوية. (أ) تظهر خزانة السلامة الحيوية # 1 حوض الكلى والأدوات الجراحية والأكواب في المجال المعقم. (ب) خزانة السلامة الحيوية # 2 مع حمام مائي (من اليسار إلى اليمين) ، ومضخة تمعجية ، وحامل أنبوب مع أنبوب وأنابيب إعادة التدوير ، وغرفة الهضم. (ج) خزانة السلامة الحيوية # 3 مع مرشحات يمكن التخلص منها وأنابيب الطرد المركزي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: البنكرياس قبل وبعد تروية الإنزيم. (أ) قبل نضح الإنزيم. (ب) البنكرياس المنتفخ بعد نضح الإنزيم. يشير السهم الأحمر إلى تدفق محلول الكولاجيناز من النوع الخامس. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: البنكرياس في غرفة الهضم. (أ) أنسجة البنكرياس بعد الهضم والاضطراب بالرخام. (ب) أنسجة البنكرياس المتبقية بعد الهضم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التقسيم الطبقي لخلايا البنكرياس بعد الطرد المركزي المتدرج الكثافة المتقطع. بعد الطرد المركزي ، ستتركز الجزر بين 1.077 جم / سم3 وطبقة HBSS ، والرواسب السفلية عبارة عن أنسجة غير جزيرة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
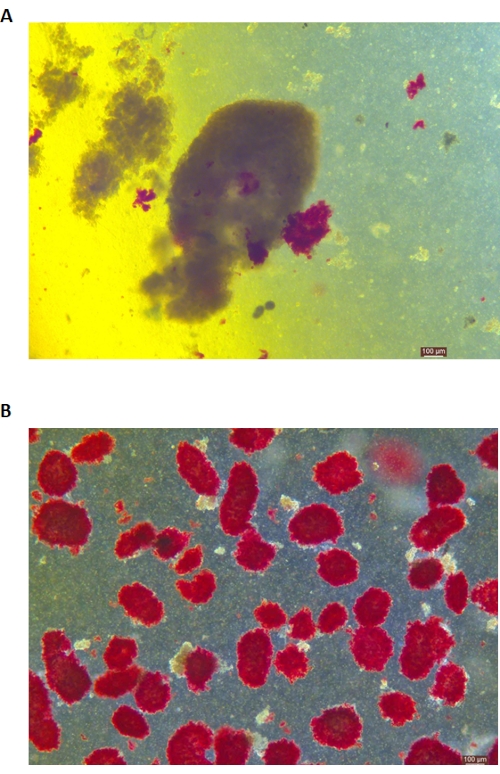
الشكل 5: تلطيخ ديثيزون (DTZ) للجزر أثناء الهضم. (أ) يتم جمع العينات من غرفة الهضم. الجزر الصغيرة في العينة مصبوغة باللون الأحمر. تكون إشارة بدء التجميع عندما يتم إطلاق 1-2 جزر بالكامل من الأنسجة الخارجية. (ب) الجزر المنقاة مفصولة بتدرج الكثافة المتقطع. شريط المقياس هو 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: تلطيخ جدوى خلايا الجزيرة الحية / الميتة. (أ) الجزر الصغيرة في مجال ساطع. (ب) الكالسين AM (CA) - تلطيخ يوديد البروبيديوم (PI) للجزر. الخلايا الحية خضراء والخلايا الميتة حمراء. شريط المقياس هو 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| باب | نطاق قطر الجزيرة (ميكرومتر) | عامل تحويل IEQ |
| 1 | 50–100 | س 0.167 |
| 2 | 101–150 | س 0.648 |
| 3 | 151–200 | س 1.685 |
| 4 | 201–250 | س 3.500 |
| 5 | 251–300 | س 6.315 |
| 6 | 301–350 | س 10.352 |
| 7 | >350 دولار | س 15.833 |
الجدول 1: عوامل التحويل لحساب معادلات الجزر (IEQ).
| هذا البروتوكول | الدراسات السابقة24 | |
| محصول الجزيرة (IEQ / البنكرياس) | 360,935 ± 114,279 | 333,000 ± 129,000 |
| جدوى الجزيرة | 81% | 86.70% |
| مؤشر تحفيز الأنسولين في الجزيرة | 1.4 ± 0.3 | 1.75 ± 0.60 |
الجدول 2: مقارنة النتائج التي تم الحصول عليها من خلال هذا البروتوكول مع الدراسات السابقة.
Discussion
يعد زرع الجزر ، باستخدام الخنازير كمصدر للجزر الصغيرة ، نهجا واعدا للتغلب على النقص في الجزر البشرية. على الرغم من أن عزل جزر الخنازير البالغة يمثل تحديا ، إلا أن العديد من المجموعات أنشأت بروتوكولات لعزل الجزر بنجاح10،11. بغض النظر عن الطريقة ، يجب إثبات صلاحية الجزيرة والخصائص الوظيفية لتأكيد الجودة العالية للمنتجات. يعتمد هذا البروتوكول على تلك المنشورة 10,11 بتنسيق فيديو بحيث يسهل فهمها وإعادة إنتاجها.
وفقا للتقارير السابقة وتجربتنا ، فإن العديد من المعلمات ضرورية للعزل الناجح لجزر الخنازير البالغة13،14. تشمل المعلمات الحاسمة (1) عمر وجنس الخنازير المانحة: تفضل إناث الخنازير التي تحتوي على أكثر من فضلتين (ما يسمى بالمربين المتقاعدين) على الخنازير الأصغر سنا لأنها يمكن أن توفر بسهولة عددا كبيرا من الجزر عالية الجودة25،26،27،28،29،30 ، (2) وقت نقص التروية الدافئ: الحد الأقصى إلى 10 دقائق من أجل تقليل الهضم الذاتي14(3) إنزيم الهضم: الكولاجيناز من النوع الخامس هو خيار صالح ، (4) وقت الهضم: من الضروري إيقاف الهضم مبكرا بما يكفي لتجنب الإفراط في الهضم. بمجرد ملاحظة الجزر الحرة ، تبدأ عملية التجميع حتى لو كانت محاصرة جزئيا. إنه مبكر جدا في العملية.
هذا البروتوكول له العديد من المزايا. بالمقارنة مع تدرجات الكثافة المستمرة أو المتقطعة باستخدام معالج خلية COBE 2991 لتنقية الجزر ، فإن طبقة البروتوكول هذه تتجاوز محاليل تدرج الكثافة باستخدام أنابيب مخروطية وجهاز طرد مركزي قياسي. إنه فعال من حيث التكلفة وسهل إتقانه للمبتدئين. نظرا لأن طريقة التنقية هذه تتطلب المزيد من العمل اليدوي ، فقد لا يزال الإنتاج بالجملة والكريات الكبيرة تتطلب معالج خلية COBE لزيادة الكفاءة.
تتم مناقشة بعض خطوات استكشاف الأخطاء وإصلاحها هنا أيضا. (1) لنفترض أن أكثر من 25٪ من أنسجة البنكرياس لم يتم هضمها ، أو أن معظم جزر البنكرياس مغطاة بأنسجة أسينار. في هذه الحالة ، تشمل الأسباب المحتملة ضعف التروية ، أو الدم المتبقي الذي يؤثر على نشاط الإنزيم ، أو انخفاض تركيز الإنزيم أو نشاطه ، أو انخفاض درجة الحرارة أثناء الهضم. (2) قد يؤدي الهضم المفرط لأنسجة البنكرياس إلى تجزئة جزيرة البنكرياس. السبب المحتمل هو أن وقت نقص التروية الدافئ لا يتم التحكم فيه بشكل جيد ، أو ارتفاع تركيز الإنزيم الهضمي ، أو التعرض الأطول للجزر المهضومة لمحلول الإنزيم الهضمي ، أو ارتفاع درجة حرارة الهضم. لا يمكن منع ذلك إلا عن طريق توحيد معلمات الإنزيم / الهضم وتحسين العملية. (3) قد يحدث أيضا فقدان سلامة جزيرة البنكرياس أثناء عملية الاستزراع. تشمل بعض أسباب ذلك تلوث الأسينار الذي يؤدي إلى انخفاض نقاء جزيرة البنكرياس ، أو كثافة ثقافة الجزر العالية جدا ، أو عدم كفاية التغذية ، أو التلف الميكانيكي. للتغلب على فقدان سلامة جزيرة البنكرياس ، قم بزيادة حجم وسط الجزيرة ، وزيادة كثافة الوسط ، وطرد الجزر الجزرية بشكل أبطأ ولفترة أقصر.
باختصار ، تم استخدام هذا البروتوكول بنجاح لإعداد جزر الخنازير البالغة لزرعها في متلقي الرئيسيات غير البشرية. وسيستخدم أيضا للحصول على الجزر الصغيرة للتحقيقات المستقبلية.
Disclosures
أفاد المؤلفون بعدم وجود تضارب في المصالح.
Acknowledgements
نشكر البروفيسور ديفيد ك. سي كوبر (مركز علوم زراعة الأعضاء ، مستشفى ماساتشوستس العام) لمساعدتنا في إنشاء نظام زرع الأعضاء بالكامل. نشكر الآنسة Xingling Hu (مستشفى Shenzhen Second People's) ، والآنسة Xiaohe Tian (جامعة كاليفورنيا ، بيركلي) ، والسيد Bo Zhou (جامعة بوسطن) على المناقشة والاقتراحات المفيدة. تم دعم هذا العمل من خلال منح من البرنامج الوطني للبحث والتطوير الرئيسي في الصين (2017YFC1103701 ، 2017YFC1103704) ، وصناديق خاصة لبناء مستشفيات رفيعة المستوى في مقاطعة قوانغدونغ (2019) ، ومشروع Sanming للطب في Shenzhen (SZSM201812079).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
References
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved