Method Article
Isolation von adulten Schweineinseln
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses detaillierte Protokoll umfasst die methodischen Schritte der Isolierung adulter Schweineinseln von der Verdauungsphase über die Reinigung bis hin zur abschließenden funktionellen Bewertung der Inseln. Diese Gliederung kann als Leitfaden für die Isolierung von adulten Schweineinseln in Forschungseinrichtungen verwendet werden.
Zusammenfassung
Typ-1-Diabetes mellitus (T1DM) wird durch eine autoimmune Zerstörung der β Zellen der Bauchspeicheldrüse verursacht, was zu einer geringen oder keiner Insulinproduktion führt. Die Inseltransplantation spielt eine wichtige Rolle bei der Behandlung von T1DM, mit der verbesserten glykometabolischen Kontrolle, dem reduzierten Fortschreiten der Komplikationen und der Verringerung hypoglykämischer Episoden im Vergleich zur traditionellen Insulintherapie. Die Ergebnisse der klinischen Phase-III-Studie zeigten auch die Sicherheit und Wirksamkeit der Insel-Allotransplantation bei T1DM. Der Mangel an Pankreasspendern schränkt jedoch die weite Verbreitung ein. Tiere als Quelle für Inselchen wie das Schwein bieten eine alternative Möglichkeit. Da sich die Architektur der Bauchspeicheldrüse des Schweins von der der Mäuse oder des Menschen unterscheidet, ist das Isolierungsverfahren für die Schweineinsel immer noch eine Herausforderung. Da die Translation alternativer Schweineinselquellen (xenogen) in das klinische Umfeld zur Behandlung von T1DM durch Zelltransplantation von großer Bedeutung ist, wird ein kostengünstiges, standardisiertes und reproduzierbares Protokoll für die Isolierung von Schweineinseln dringend benötigt. Dieses Manuskript beschreibt eine vereinfachte und kostengünstige Methode zur Isolierung und Reinigung adulter Schweineinseln, die auf den vorherigen Protokollen basieren, die erfolgreich Schweineinseln an nicht-menschliche Primaten transplantiert haben. Dies ist ein Leitfaden für Anfänger ohne die Verwendung von Spezialgeräten wie einem COBE 2991 Cell Processor.
Einleitung
Typ-1-Diabetes mellitus (T1DM) ist eine schwere Erkrankung, bei der die autoimmune Zerstörung von Betazellen zu einer geringen oder keiner Insulinproduktion führt 1,2,3. Eine beträchtliche Gruppe von Patienten mit T1DM kann die glykämische Labilität durch eine Insulintherapie nicht stabilisieren und erleidet lebensbedrohliche hypoglykämische Episoden. Wenn die Inseltransplantation erfolgreich ist, kann dies erreicht werden. Weltweit haben sich über 1.500 Diabetiker einer erfolgreichen Inseltransplantation unterzogen, die ein geringeres Risiko und dennoch einen langfristigen Erfolg als eine Bauchspeicheldrüsentransplantation aufweist4.
Im Vergleich zur Insulintherapie hat die Inseltransplantation bessere Ergebnisse bei der Verringerung des Fortschreitens der Komplikationen5. Die Ergebnisse der klinischen Phase-III-Studie zeigten auch die Sicherheit und Wirksamkeit der Insel-Allotransplantation bei T1DM 6,7. Die Inseltransplantation ist möglicherweise die beste derzeit verfügbare therapeutische Option für Patienten mit T1DM, die lebensbedrohliche hypoglykämische Episoden erleiden.
Der Mangel an humanen allogenen Spenderinseln schränkt jedoch die weit verbreitete Anwendung der Inselzelltransplantation ein 8,9. Daher ist die Verwendung von tierischen Inselzellen als Ersatz wünschenswert10. Das Schwein wurde als Spender für Inselzellen in der präklinischen Xenotransplantation ausgewählt und ist aufgrund von 1) Verfügbarkeit, 2) metabolischen Ähnlichkeiten mit dem Menschen, 3) ziemlich großer Betazellmasse und 4) Möglichkeit der genetischen Veränderung zur Verbesserung der immunologischen Kompatibilität mit dem Menschen von potenzieller Übertragbarkeit auf die Klinik11.
Hohe Reinheit und Lebensfähigkeit der Inselzellen sind wichtige Schritte für den Erfolg der Xenotransplantation. Das Verfahren zur Isolierung von Inselzellen aus erwachsenen Schweinespendern ist jedoch aufgrund der Architektur der Bauchspeicheldrüse selbst, die sich von den Inseln von Mäusen oder Menschen unterscheidet, eine Herausforderung12. Im Allgemeinen ist die Form der Pankreasinseln des Schweins nicht kompakt12. Im Vergleich zu Pankreasinseln von Menschen und Nagetieren dissoziieren Schweineinseln leichter12. Die spontane Dissoziation der äußeren Schicht der Inselzellen, begleitet von einer langen Kulturzeit, führt jedoch zu einer deutlichen Verringerung der Pankreas-Inselgröße10.
Während des Isolationsprozesses der Inselzellen beeinflussen viele Faktoren die Qualität der Inseln, wie z. B. das Alter des Spenders, die warme Ischämiezeit, die enzymatische Aktivität und die Dehnung durch enzymatische Injektion13,14. Obwohl viele frühere Studien Methoden zur Isolierung von Schweineinseln vorsahen, gibt es kein detailliertes Schritt-für-Schritt-Videoprotokoll für Forscher als wirksame Anleitung 10,15,16,17,18,19,20,21,22,23.
Zu diesem Zweck deckt dieses detaillierte Protokoll alle Isolationsschritte ab, von der Organentnahme bis zur funktionellen Beurteilung der Inselzellen nach der Isolierung, in der Hoffnung, einen einfachen und verständlichen Überblick über den Prozess für eine einfache Anwendbarkeit zu bieten. Dieses Protokoll basiert auf den zuvor veröffentlichten Methoden mit Modifikationen10,11.
Protokoll
Alle Eingriffe mit Tieren werden vom Institutional Animal Care and Use Committee des Shenzhen Second People's Hospital genehmigt und befolgen alle nationalen Vorschriften. In diesem Protokoll wurden auf dem Markt gekaufte Duroc-Landrace-Yorkshire-Schweine (~6 Monate alt) als Pankreasspender verwendet. Das Gewicht der entnommenen Bauchspeicheldrüse betrug 123,63 g ± 22,50 g. Während der Experimente wird persönliche Schutzausrüstung wie Schutzkleidung, Masken, Handschuhe und Mützen getragen.
1. Vorbereitung der Medien
- Reinigungsmedium: Zur Herstellung von 100 ml Reinigungsmedium mischen Sie Hank's Balanced Salt Solution (HBSS), 2 % Schweineserum, 20 mM 4-(2-Hydroxyethyl)-1-piperazinethensulfonsäure (HEPES) und 1 % Penicillin-Streptomycin (P/S).
- Auffangmedium: Mischen Sie RPMI 1640 mit 5 % Schweineserum und 1 % Penicillin-Streptomycin (P/S).
- Nährmedium: Mischen Sie CMRL 1066 mit 10 % Schweineserum, 10 mmol/l Nicotinamid, 1 % P/S und 2 mmol/l L-Glutamin.
- Enzymlösung: Bereiten Sie 1 mg/ml Kollagenase Typ V (Aktivität: 918 Einheiten/mg Feststoff) Lösung in HBSS vor.
- Lösung mit niedriger Glukosekonzentration: Um eine Lösung mit niedriger Glukosekonzentration herzustellen, fügen Sie 0,5 % Rinderserumalbumin (BSA) und 2,8 mM D-Glucose zu 1 ml Kreb's Ringer Bicarbonatpuffer (KRBB) hinzu.
- Lösung mit hoher Glukosekonzentration: Um eine Lösung mit hoher Glukosekonzentration herzustellen, fügen Sie 0,5 % Rinderserumalbumin (BSA) und 28 mM D-Glukose zu 1 ml Krebs Ringer-Bicarbonat-Puffer (KRBB) hinzu.
2. Entnahme der Bauchspeicheldrüse
- Schweineanästhesie und Hautvorbereitung
- Betäuben Sie das Spenderschwein mit intramuskulärer Injektion der Anästhetika Lumianning (2,5-5 mg/kg) und Propofol (2-3 mg/kg) (siehe Materialtabelle für Details).
- Halten Sie die Anästhesie mit 1%-3% Isofluran in einem Beatmungsvolumen von 1-1,5 l/min durch Gasanästhesiemasken aufrecht.
- Überwachen Sie die Herzfrequenz, um die richtige Anästhesie zu bestätigen. Verwenden Sie Tierarztsalbe auf den Augen, um Trockenheit während der Narkose zu verhindern.
- Rasieren Sie den Bauch, reinigen Sie ihn mit einem Jodophor und decken Sie das Schwein mit einem sterilen OP-Tuch ab.
- Öffnen des Bauches
- Nachdem Sie die sterilen Bedingungen sichergestellt haben, machen Sie einen Laparotomieschnitt in der Mittellinie vom Xiphoid bis zum Nabel etwas in der Nähe des Schwanzes.
- Das Zwerchfell einschneiden.
- Isolieren Sie die suprahepatische Aorta und die suprahepatische untere Hohlvene (IVC) mit einer Gefäßzange und isolieren Sie dann die infrarenale Aorta und die infrahepatische IVC mit der gleichen Methode.
- Verabreichen Sie dem Schwein intravenös Heparin (100 E/kg), um die Blutgerinnung zu verhindern.
- Äußere den Dünn- und Dickdarm und schieben Sie Leber und Magen in Richtung Kopf, um die Bauchspeicheldrüse vollständig freizulegen.
- Perfusion der Bauchspeicheldrüse
- Die Aorta mit einer Gefäßzange über dem Zwerchfell einklemmen, die Aorta oberhalb des Astes der Nierenaorta über die Aortenkanüle (16 G) intubieren und mit einem Nahtfaden 2-0 binden.
- Gießen Sie das Tier mit 2-3 Litern kalter HBSS-Lösung (zuvor in Säcken verpackt und bei 4 °C gehalten) durch die Aortenkanüle (16 G). Die HBSS-Lösung wird durch die Schwerkraft durch die Aortenkanüle infundiert, während die suprahepatische IVC und die IVC durchtrennt werden, um die Perfusionsflüssigkeit freizusetzen.
HINWEIS: Setzen Sie die Infusion fort, bis der IVC-Abfluss klar ist.
- Exzision der Bauchspeicheldrüse
- Schälen Sie das Omentum ab, suchen Sie die Bauchspeicheldrüse und den Milzlappen zusammen mit der Milz und trennen Sie sie.
- Trennen Sie den verbundenen Lappen der Bauchspeicheldrüse vom angrenzenden Gewebe.
- Finde den Hauptgang der Bauchspeicheldrüse im absteigenden Teil des Zwölffingerdarms. Lilizieren Sie den Gallengang mit einer Naht (2-0) und durchtrennen Sie ihn mit einer Schere in der Nähe des Bauchspeicheldrüsengangs.
- Klemmen Sie einen Abschnitt des Zwölffingerdarms, der die Vater-Ampulle enthält, mit einer Gefäßzange auf beide Seiten des Bauchspeicheldrüsenkopfes und resezieren Sie dann den Zwölffingerdarm mit einer Schere.
- Nehmen Sie die gesamte Bauchspeicheldrüse heraus, tauchen Sie sie in kaltes HBSS und transportieren Sie sie sofort in die Inselisolationsanlage.
HINWEIS: Die Schweine wurden mit Pentobarbital-Natrium (100-200 mg/kg) euthanasiert. Die intraduktale Infusion von HBSS oder Konservierungslösung kann verwendet werden, um die Bauchspeicheldrüse an der Stelle der Organentnahme zu dehnen, wenn die Bauchspeicheldrüse im örtlichen Schlachthof beschafft wird.
3. Bereiten Sie drei Biosicherheitswerkbänke für die folgenden Experimente vor
- Richten Sie eine Biosicherheitswerkbank #1 mit Nierenbecken, chirurgischen Instrumenten und Bechern zur Reinigung der Bauchspeicheldrüse ein (Abschnitt 4, Abbildung 1A).
- Richten Sie die Biosicherheitswerkbank #2 mit einem Wasserbad, einer Schlauchpumpe, einem Schlauchständer mit dem Umlaufschlauch und einer Verdauungskammer für den Inselaufschluss ein (Abschnitt 5, Abbildung 1B).
- Richten Sie die Biosicherheitswerkbank #3 mit Einwegfiltern und Zentrifugenröhrchen für die Enzymvorbereitung, die Inselreinigung und die folgenden Schritte ein (Abschnitte 6-8, Abbildung 1C).
4. Reinigung der Bauchspeicheldrüse
- Reinigen und wiegen Sie die Bauchspeicheldrüse.
- Spülen Sie die Bauchspeicheldrüse 3 Minuten lang in 200 ml Iodophor in der Biosicherheitswerkbank #1. Spülen Sie die Bauchspeicheldrüse zweimal zu je 2 Minuten mit 200 ml kaltem HBSS aus.
- Legen Sie die gereinigte Bauchspeicheldrüse in ein Nierenbecken mit 100 ml Reinigungsmedium auf Eis.
- Lassen Sie die Ampulle festklemmen, resezieren Sie den Zwölffingerdarm. Reinigen Sie die Bauchspeicheldrüse von äußerem Fett und Bindegewebe.
- Wiegen Sie die Bauchspeicheldrüse.
5. Verdauung der Bauchspeicheldrüse
- Infusion von Kollagenase
- Schneiden Sie einen Querschnitt durch einen der ringförmigen Äste der Bauchspeicheldrüse ab und führen Sie einen 18 G Angiokath (wenn die Gangdurchmesser kleiner sind, ziehen Sie einen 20 G Angiokath in Betracht) in den Hauptgang der Bauchspeicheldrüse und nähen Sie ihn mit einer 2-0 geflochtenen Seidennaht fest.
- Schneiden Sie die Gewebebrücke ab, die durch den Verbindungslappen in der Nähe des Bauchspeicheldrüsenkopfes verläuft, und klemmen Sie den Katheter an der Seite des Schnitts in der Nähe des Bauchspeicheldrüsenkopfes, um den Enzymaustritt zu reduzieren.
- Platzieren Sie mehrere Angiokathen für eine bessere intraduktale Enzyminfusion. Zu diesem Zweck werden nach dem Durchtrennen des Pankreasorgans zusätzliche Angiokathen (Größe 20-22 G) eingeführt, um den Gang freizulegen.
- Installieren Sie die Abfüllleitung, einschließlich eines 1 m langen Silikonschlauchs (16#) mit Luer-Lock-Anschluss. Der mittlere Teil des Schlauches ist in den peristaltischen Pumpenkopf eingelassen.
- Schalten Sie die Peristaltikpumpe ein, um das Schlauchsystem (Schlauchgröße 16#) mit 300 ml 1 mg/ml, Kollagenase Typ V (Aktivität: 918 Einheiten/mg) auf 24 °C vorgeheizt zu füllen und Luftblasen in den Rohrleitungen zu entfernen.
- Verbinden Sie den Perfusionsschlauch mit dem Angiokath und schalten Sie die Peristaltikpumpe mit einer Geschwindigkeit von 20 ml/min ein.
- Stoppen Sie die Perfusion, wenn der größte Teil des Enzyms infundiert wurde und die Bauchspeicheldrüse gut aufgebläht ist (Abbildung 2B).
- Schneiden Sie das durchsichtige gallertartige Gewebe ab, das sich während der Perfusion um die Bauchspeicheldrüse bildet.
HINWEIS: Dieser Schritt ist sehr wichtig, da das Gel den Filter in der Kammer verstopfen und das Auffangen des verdauten Gewebes erschweren kann (Abbildung 2B). - Entfernen Sie die Angiokathen nach der Infusion.
- Verdauung des Gewebes
- 1 l HBSS-Lösung auf 36 °C vorheizen. Bereiten Sie das Aufschlusssystem, bestehend aus der Aufschlusskammer und den Rohren, die zu einem geschlossenen System verbunden sind, im Voraus vor und überführen Sie die Heizspirale des Kreislaufs in ein 36 °C warmes Wasserbad.
- Schneiden Sie die Bauchspeicheldrüse in 3-4 Stücke und gießen Sie diese mit Kollagenase Typ V in ein 500 mL Becherglas.
- Decken Sie das Becherglas mit einem sterilen Petrischalendeckel ab, stellen Sie ihn in die Biosicherheitswerkbank #2 und geben Sie den Inhalt des Becherglases in die Aufschlusskammer, in der sich vier silikonisierte Glasmurmeln und ein 500 μm großes Netz befinden.
- Schließen Sie die Kammer und ziehen Sie die Schrauben fest. Geben Sie das restliche Enzym in das Umlaufbecherglas und schalten Sie die Peristaltikpumpe mit einer Geschwindigkeit von 80 mL/min ein.
- Fügen Sie eine warme HBSS-Lösung (typischerweise etwa 150 ml) hinzu, die in Schritt 5.2.1 vorgewärmt wurde, um den Kreislauf bis zur Fertigstellung zu füllen. Schütteln Sie die Kammer vorsichtig und drehen Sie sie um, so dass die silikonisierten Glasmurmeln auf das Gewebe treffen.
HINWEIS: Da Schweineinseln empfindlicher sind als menschliches Gewebe, sollte das Schütteln gleichmäßig und langsam erfolgen, um Schäden zu vermeiden. Während das Gewebe verdaut wird, beginnt es auseinanderzufallen und aus der Kammer zu fließen. - Entnehmen Sie alle 2 Minuten eine Probe (ca. 1 ml) aus dem Kreislauf, um nach 1 Minute Schütteln nach freiem Schütteln zu prüfen.
- Legen Sie die Probe in eine 6-Well-Platte mit 80 μl Dithizon (DTZ). Fügen Sie 2 ml phosphatgepufferte Kochsalzlösung (PBS) hinzu und untersuchen Sie die Probe unter dem Mikroskop mit 40-facher Vergrößerung. DTZ färbt Inselzellen rot.
- Sammlung des Digests
- Setzen Sie die Verdauung fort, bis freie Inselzellen beobachtet werden (auch wenn viele noch teilweise in den exokrinen Inseln eingeschlossen sind).
HINWEIS: Die Freisetzung der Insel dauert etwa 10-15 Minuten, aber die Verdauungszeit wird oft durch das Alter des Spenders, die Enzymchargen, die Konzentration des Enzyms usw. beeinflusst. - Öffnen Sie den Kreislauf und sammeln Sie das freigesetzte Gewebe in 1-Liter-Flaschen. Halten Sie die Flaschen während des Sammelns auf Eis, um die Kollagenase Typ V zu inaktivieren.
- Geben Sie die restliche warme HBSS-Lösung (~850 mL, Schritt 5.2.1) in das Rezirkulationsbecherglas und sammeln Sie das restliche verdaute Gewebe aus der Verdauungskammer.
- Geben Sie kaltes Auffangmedium in die Kammer (über den Umlaufbecher).
HINWEIS: Stoppen Sie die Sammlung, wenn die Gewebepellets kleiner werden. Die Sammelphase (Schritte 5.3.2-5.3.3) kann bis zu 40-75 min und 5-8 l Auffangmedium dauern. - Übertragen Sie das Gewebe aus der Auffangflasche in konische 250-ml-Zentrifugenröhrchen und zentrifugieren Sie es bei 200 x g für 3 min bei 4 °C.
- Den Überstand verwerfen und das Gewebe in 500 ml frischem Sammelmedium resuspendieren.
- Mischen Sie die Zellpellets weiter in kaltes Auffangmedium (500 mL), bis der gesamte Aufschluss gesammelt ist.
- Das im kalten Medium suspendierte Küvettenpellet durch Zentrifugation waschen (3 min bei 200 x g, 4 °C).
- Entsorgen Sie den Überstand. Bewerten und quantifizieren Sie das Zellpellet gemäß den in den Abschnitten 6-8 genannten Schritten.
HINWEIS: Das endgültige Volumen hängt von der Größe der Bauchspeicheldrüse ab, wird jedoch voraussichtlich innerhalb von 40-80 ml liegen.
- Setzen Sie die Verdauung fort, bis freie Inselzellen beobachtet werden (auch wenn viele noch teilweise in den exokrinen Inseln eingeschlossen sind).
6. Reinigung der Inselzellen
- Reinigen Sie die Schweineinseln durch Trennung durch Dichtegradienten.
HINWEIS: In der Materialtabelle finden Sie Einzelheiten zu den verwendeten Lösungen für den Dichtegradienten.- Geben Sie 2 ml Pankreasgewebe in konische 50-ml-Röhrchen.
- Fügen Sie 12 ml 1119 Polysaccharose Gradient (1,119 g/cm3) hinzu, um jeweils 2 ml Pankreasgewebe zu resuspendieren.
- Fügen Sie nacheinander 10 ml 1083 Polysaccharoselösung (1,083 g/cm3), 10 ml 1077 Polysaccharoselösung (1,077 g/cm3), 10 ml 1037 Polysaccharoselösung (1,037 g/cm3) und 5 ml HBSS hinzu.
HINWEIS: 1037 Polysaccharoselösung (1,037 g/cm3) wird durch Mischen von 1077 Polysaccharoselösung (1,077 g/cm3) und hypertonischer Citrat-Purinlösung (38,5 ml: 11,5 ml) hergestellt. - Zentrifugieren bei 900 x g ohne Bremse für 10 min bei 4 °C.
- Die Inselzellen werden zwischen den Schichten der Polysaccharoselösung 1077 und der Polysaccharoselösung 1037 aspiriert.
- Übertragen Sie die Inselzellen in ein 50-ml-Zentrifugenröhrchen, verteilen Sie die Flüssigkeit gleichmäßig in jedem Röhrchen und balancieren Sie sie vor der Zentrifugation aus.
- Schweineinseln waschen
- Bei 200 x g 3 min bei 4 °C zentrifugieren, den Überstand verwerfen. Fügen Sie das Auffangmedium hinzu, um das Volumen auf 45 ml zu erhöhen.
- Bei 200 x g für 3 min bei 4 °C zentrifugieren, wobei etwa 2 mL Überstand übrig bleiben; Zum Mischen leicht schütteln.
- Kombinieren Sie alle Pellets in dasselbe 50-ml-Zentrifugenröhrchen. Fügen Sie das Auffangmedium hinzu, um das Volumen auf 45 ml zu erhöhen.
7. Zählung von Inseläquivalenten (IEQ) und Inselkultur
- DTZ-Färbung von Inselzellen
- Bündeln Sie die Inseln, fügen Sie mehr Auffangmedium hinzu, um das Volumen auf 250 ml zu erhöhen, und resuspendieren Sie die Inseln.
- Entnehmen Sie 500 μl der repräsentativen Probe und geben Sie sie in eine 35-mm-Schale mit 80 μl DTZ. Lassen Sie es 1-2 Minuten bei Raumtemperatur inkubieren und fügen Sie dann 2 mL PBS hinzu.
- Untersuchen Sie bei 40-facher Vergrößerung unter einem inversen Mikroskop. Inselzuschlagstoffe werden durch die DTZ rot gefärbt.
- Zählung von fleckigen Inseln
- Zählen Sie die gebeizten Inseln, indem Sie sie in die in Tabelle 1 aufgeführten Größenklassen einteilen. Verwenden Sie den Umrechnungsfaktor, um das Inseläquivalent (IEQ) entsprechend der Größe zu bestimmen.
HINWEIS: Die IEQ-Umrechnung wird durchgeführt, wenn der überwiegende Durchmesser der DTZ-positiven Aggregate größer als 50 μm ist (bei Erwachsenen (>2 Jahre) und einigen Präparaten für junge Erwachsene (6-12 Monate) fahren Sie mit Schritt 7.2.4 fort). In allen anderen Fällen (bei jungen Schweinen unter 6 Monaten und bei den übrigen jungen erwachsenen Schweinen) wurde die Anzahl der Inselzellen auf der Grundlage des Partikelvolumens oder des DNA-Gehalts geschätzt (gemäß den Schritten 7.2.2-7.2.3). - (FAKULTATIV) Zentrifugieren Sie bei 200 x g bei 4 °C für 2 min, um die Paletten zu messen.
- (FAKULTATIV) Bewerten Sie den DNA-Gehalt einzelner Inselzellen sowie der Inselzellpellets mit dem Zellproliferations-Assay-Kit. Extrapolation der Anzahl der Betazellen von Schweinen aus dem DNA-Gehalt und der immunzytochemischen Analyse.
- Fügen Sie alle Kategorien hinzu, und bestimmen Sie den Gesamt-IEQ für die Stichprobe. Multipliziere diese Zahl mit dem Volumen des Bruchs. (z. B. 200 IEQs in 500 μl einer 250 mL-Fraktion = 200 x 2 x 250 = 100.000 IEQs).
- Zählen Sie die gebeizten Inseln, indem Sie sie in die in Tabelle 1 aufgeführten Größenklassen einteilen. Verwenden Sie den Umrechnungsfaktor, um das Inseläquivalent (IEQ) entsprechend der Größe zu bestimmen.
- Inselkultur
- Zentrifugieren Sie die Inselzellen bei 200 x g bei 4 °C für 1 min; Entsorgen Sie den Überstand.
- Geben Sie 5 ml vorgewärmtes Kulturmedium zur Resuspendierung der Inselzellen hinzu und geben Sie es in eine 150-mm-Petrischale.
HINWEIS: 10.000 Inseln/Schale resuspendieren. - Fügen Sie mehr Nährmedium hinzu, um das Volumen in der 150-mm-Petrischale auf 30 mL zu erhöhen.
8. Bewertung der Qualität der Inselchen
- Calcein AM (CA)-Propidiumiodid (PI)-Färbung von Inselzellen
- Pflücken Sie 50 Inselzellen von Hand in eine 48-Well-Platte. Einmal mit 1 mL HBSS waschen.
- Fügen Sie 200 μl der Mischung hinzu, die 1x CA und 1x PI enthält, gemäß den Anweisungen des Zellviabilitätsfärbekits.
- Decken Sie die Petrischale ab und stellen Sie sie für 30 min bei 37 °C in einen Inkubator.
- Visualisieren Sie die Inselzellen mit einem Fluoreszenzmikroskop und nehmen Sie die Bilder auf.
- Quantifizieren Sie die Lebensfähigkeit, indem Sie die lebenden Zellen (grün) und toten Zellen (rot) nach der CA-PI-Färbung zählen.
- Glukosestimulierte Insulinsekretion (GSIS)
- Geben Sie 1 ml Lösung mit niedriger Glukosekonzentration in drei Vertiefungen einer 24-Well-Pflanze.
- Nach mindestens einer Kultur über Nacht werden 100 ähnlich große Inselzellen mit einem Durchmesser von 100 bis 200 μm von Hand gepflückt und in die drei Vertiefungen der 24-Well-Platte überführt, die mit einer Lösung mit niedriger Glukosekonzentration vorgefüllt sind (wie in Schritt 8.2.1).
HINWEIS: Waschen Sie die Inselzellen in einer Zwischenvertiefung mit HBSS, bevor Sie sie in die Vertiefung umfüllen, um das Nährmedium auszuwaschen. - Inkubieren Sie die Inselzellen in einem 5%igen CO2 -Inkubator bei 37 °C für 30 Minuten.
- Entfernen Sie den Überstand vorsichtig mit einer Pipette, ohne die Inseln zu berühren.
- Fügen Sie 1 ml neue Lösung mit niedriger Glukosekonzentration hinzu.
- Inkubieren Sie die Inselzellen in einem 5%igen CO2 -Inkubator bei 37 °C für 60 Minuten.
- Der Überstand (keine Inseln) wird aufgefangen und mindestens 500 μl davon in ein 1,5-ml-Zentrifugenröhrchen überführt. Dies enthält Insulin, das bei niedriger Glukosestimulation ausgeschüttet wird.
- Geben Sie vorsichtig 1 ml Lösung mit hoher Glukosekonzentration in die gleichen Vertiefungen.
- Inkubieren Sie die Inselzellen in einem 5%igen CO2 -Inkubator bei 37 °C für 60 Minuten.
- Übertragen Sie weitere 500 μl des Nährmediums in ein neues 1,5-ml-Zentrifugenröhrchen. Dies enthält Insulin, das bei hoher Glukosestimulation ausgeschüttet wird.
- Verwenden Sie ELISA-Kits (Enzyme-linked Immunosorbent Assay) für Schweineinsulin, um die Konzentration des nach einer Stimulation mit niedrigem und hohem Glukosespiegel freigesetzten Insulin zu messen (Schritte 8.2.7 und 8.2.10).
HINWEIS: Der Stimulationsindex (SI) wird berechnet als das Verhältnis der nach einer Stimulation mit hohem Glukosespiegel gemessenen Insulinkonzentration dividiert durch die Insulinkonzentration nach einer Stimulation mit niedrigem Glukosespiegel.
Ergebnisse
Die Vorbereitung der Biosicherheitswerkbank ist in Abbildung 1 dargestellt. Es sind drei unabhängige Operationsräume eingerichtet. Die Biosicherheitswerkbank #1 ist mit Nierenbecken, chirurgischen Instrumenten und Bechern für die Bauchspeicheldrüsenbeschneidung ausgestattet (Abbildung 1A). Die Biosicherheitswerkbank #2 ist mit einem Wasserbad, einer Schlauchpumpe, einem Schlauchständer mit dem Umlaufschlauch und einer Aufschlusskammer für den Inselaufschluss ausgestattet (Abbildung 1B). Die Biosicherheitswerkbank #3 ist mit Einwegfiltern und Zentrifugenröhrchen für die Enzymvorbereitung, die Inselreinigung und die folgenden Schritte ausgestattet (Abbildung 1C).
Die Bauchspeicheldrüse (vor und nach der Enzymperfusion) ist in Abbildung 2 dargestellt. Kollagenase Typ V-Lösung wird über den Pankreasgang ausgehend vom Kopf der Bauchspeicheldrüse in die gesamte Bauchspeicheldrüse perfundiert. Wenn der Verbindungslappen nicht erfolgreich durchblutet wird, muss er in einzelne Stücke geschnitten werden, die jeweils durchblutet werden müssen.
Der Pankreasverdau wird in der Verdauungskammer durchgeführt, wie in Abbildung 3 dargestellt. In der Abbildung ist das Pankreasgewebe nach der mechanischen Unterbrechung und das nach der Verdauung verbleibende unverdaute Pankreasgewebe dargestellt. Eine kleine Menge unverdauten Gewebes deutet auf eine vollständige Verdauung hin; Es kann jedoch auch auf eine Überverdauung hinweisen; Wenn also 15%-25% des Pankreasorgans in der Kammer verbleiben, ist dies akzeptabel. Das verdaute Pankreasgewebe wird dann gewaschen und auf diskontinuierlichen Dichtegradienten zentrifugiert, um die Inselzellen von den Azinuszellen zu trennen (Reinigung), wie in Abbildung 4 gezeigt. Pankreasinseln befinden sich in der mittleren Schicht.
Die DTZ-Färbung der Inselzellen ist in Abbildung 5 dargestellt. Der Punkt, an dem die Verdauung gestoppt wird und die Sammlung beginnt (d. h. wenn freie Inseln erscheinen), ist in Abbildung 5A dargestellt. Gereinigte Schweineinseln nach Trennung durch Dichtegradient sind in Abbildung 5B dargestellt. Inselzellen im Hellfeld sind in Abbildung 6A dargestellt. Die Qualität der Inselzellen wird durch Calcein AM (CA)-Propidium Iodid (PI)-Färbung untersucht, wie in Abbildung 6B dargestellt. Lebende Zellen sind grün und tote Zellen rot. Die durchschnittliche Isolationsausbeute dieses Protokolls beträgt 360.935 ± 114.279 IEQ/Pankreas und 2.439-3.252 IEQ/g der Bauchspeicheldrüse, was der vorherigen Studie (333.000 ± 129.000 IEQ/Pankreas) ähnelt. Die durchschnittliche Lebensfähigkeit der Inselzellen nach diesem Protokoll liegt bei über 81 %, was etwas niedriger ist als in der vorherigen Studie (86,7 %). Eines der repräsentativen Ergebnisse des Stimulationsindex (SI = das Verhältnis zwischen den Insulinmengen (mU/L), die unter Bedingungen mit hoher Glukose und niedriger Glukose freigesetzt werden), die durch den mit diesem Protokoll mittels ELISA gemessenen Glukose-stimulierten Insulinsekretionstest (GSIS) erhalten wurden, beträgt 1,4 ± 0,3, was ähnlich wie in der vorherigen Studie (1,75 ± 0,60)24 ist. Die oben genannten Ergebnisse sind in Tabelle 2 zusammengefasst.

Abbildung 1: Die Vorbereitung der Biosicherheitswerkbank. (A) Die Biosicherheitswerkbank #1 zeigt das Nierenbecken, die chirurgischen Instrumente und die Becher im sterilen Bereich. (B) Biosicherheitswerkbank #2 mit (von links nach rechts) Wasserbad, Schlauchpumpe, Schlauchständer mit Umlaufschlauch und Schlauch sowie Aufschlusskammer. (C) Biosicherheitswerkbank #3 mit Einwegfiltern und Zentrifugenröhrchen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die Bauchspeicheldrüse vor und nach der Enzymperfusion. (A) Vor der Enzymperfusion. (B) Aufgeblähte Bauchspeicheldrüse nach Enzymperfusion. Der rote Pfeil zeigt den Fluss der Lösung von Kollagenase Typ V an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die Bauchspeicheldrüse in der Verdauungskammer. (A) Pankreasgewebe nach der Verdauung und Störung mit Murmeln. (B) Pankreasgewebe, das nach der Verdauung verbleibt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Pankreaszellschichtung nach diskontinuierlicher Dichtegradientenzentrifugation. Nach der Zentrifugation werden die Inselzellen zwischen 1,077 g/cm3 und der HBSS-Schicht konzentriert, und das Bodensediment besteht aus Nicht-Inselgewebe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
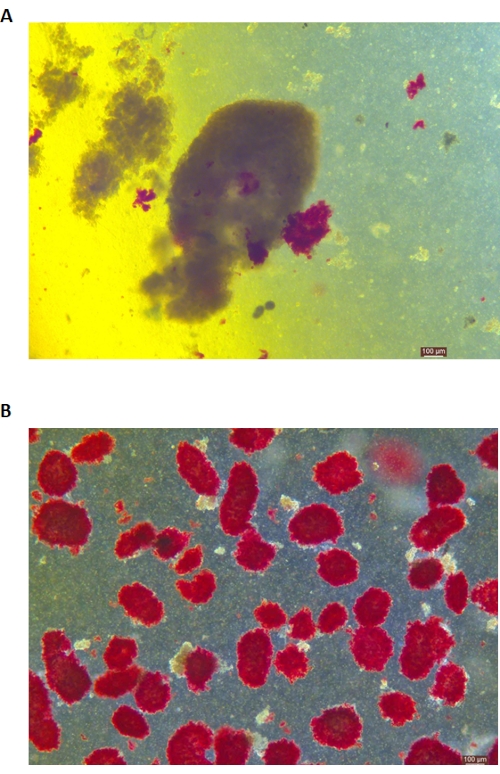
Abbildung 5: Dithizon (DTZ)-Färbung der Inselzellen während der Verdauung. (A) Die Proben werden aus dem Verdauungsraum entnommen. Die Inselchen in der Probe sind rot eingefärbt. Das Signal für den Beginn der Entnahme ist, wenn 1-2 Inselzellen vollständig aus dem exokrinen Gewebe gelöst sind. (B) Gereinigte Inselzellen, die durch einen diskontinuierlichen Dichtegradienten getrennt sind. Der Maßstabsbalken beträgt 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Färbung der Lebensfähigkeit lebender/toter Inselzellen. (A) Inselchen im Hellfeld. (B) Calcein AM (CA)-Propidiumiodid (PI)-Färbung von Inseln. Lebende Zellen sind grün und tote Zellen rot. Der Maßstabsbalken beträgt 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Kategorie | Durchmesserbereich der Insel (μm) | IEQ-Umrechnungsfaktor |
| 1 | 50–100 | x 0,167 |
| 2 | 101–150 | x 0,648 |
| 3 | 151–200 | x 1.685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6.315 cm |
| 6 | 301–350 | x 10.352 |
| 7 | >350 | x 15.833 |
Tabelle 1: Umrechnungsfaktoren zur Berechnung der Inseläquivalente (IEQ).
| Dieses Protokoll | Bisherige Studien24 | |
| Ausbeute der Inselzellen (IEQ/Pankreas) | 360.935 ± 114.279 | 333.000 ± 129.000 |
| Lebensfähigkeit der Inselchen | 81% | 86.70% |
| Index der Inselinsulinstimulation | 1,4 ± 0,3 | 1,75 ± 0,60 |
Tabelle 2: Vergleich der mit diesem Protokoll erzielten Ergebnisse mit früheren Studien.
Diskussion
Die Xenotransplantation von Inseln, bei der Schweine als Quelle für Inselchen verwendet werden, ist ein vielversprechender Ansatz, um den Mangel an menschlichen Inselzellen zu überwinden. Obwohl die Isolierung von adulten Schweineinseln eine Herausforderung darstellt, haben mehrere Gruppen Protokolle für die erfolgreiche konsequente Isolierung von Inselzellen etabliert10,11. Unabhängig von der Methode sollen die Lebensfähigkeit und die funktionellen Eigenschaften der Inselzellen nachgewiesen werden, um die hohe Qualität der Produkte zu bestätigen. Dieses Protokoll basiert auf den veröffentlichtenProtokollen 10,11 in einem Videoformat, um leicht verständlich und reproduzierbar zu sein.
Nach früheren Berichten und unseren Erfahrungen sind mehrere Parameter entscheidend für die erfolgreiche Isolierung von adulten Schweineinseln13,14. Zu den kritischen Parametern gehören (1) Alter und Geschlecht des Spenderschweins: Weibliche Schweine mit mehr als zwei Würfen (sogenannte pensionierte Züchter) werden gegenüber jüngeren Schweinen bevorzugt, da sie problemlos eine große Anzahl hochwertiger Inselzellen liefern können 25,26,27,28,29,30, (2) Warme Ischämiezeit: Begrenzung auf 10 Minuten, um die Autoverdauung zu reduzieren14, (3) Verdauungsenzym: Kollagenase Typ V ist eine gültige Option, (4) Verdauungszeit: Es ist wichtig, die Verdauung früh genug zu stoppen, um eine Überverdauung zu vermeiden. Sobald die freien Inseln beobachtet sind, wird der Sammelprozess gestartet, auch wenn sie teilweise gefangen sind. Es ist noch sehr früh in diesem Prozess.
Dieses Protokoll hat mehrere Vorteile. Im Vergleich zu kontinuierlichen oder diskontinuierlichen Dichtegradienten unter Verwendung eines COBE 2991-Zellprozessors für die Inselreinigung werden bei diesem Protokoll Inselzellen über Dichtegradientenlösungen mit konischen Röhrchen und einer Standardzentrifuge geschichtet. Es ist kostengünstig und für Anfänger leicht zu meistern. Da diese Reinigungsmethode mehr Handarbeit erfordert, kann für die Massenproduktion und große Pellets immer noch ein COBE-Zellprozessor erforderlich sein, um die Effizienz zu steigern.
Hier werden auch einige Schritte zur Fehlerbehebung erläutert. (1) Angenommen, mehr als 25 % des Pankreasgewebes werden nicht verdaut oder die meisten Pankreasinseln sind von Azinusgewebe bedeckt. In diesem Fall sind die möglichen Gründe eine schlechte Durchblutung, Restblut, das die Enzymaktivität beeinflusst, die niedrige Enzymkonzentration oder -aktivität oder eine niedrige Temperatur während der Verdauung. (2) Eine übermäßige Verdauung des Pankreasgewebes kann zu einer Fragmentierung der Pankreasinsel führen. Der mögliche Grund ist, dass die warme Ischämiezeit nicht gut kontrolliert wird, eine hohe Konzentration von Verdauungsenzymen, eine längere Exposition der verdauten Inselzellen gegenüber der Verdauungsenzymlösung oder eine hohe Verdauungstemperatur. Dies kann nur durch die Standardisierung der Enzym-/Verdauungsparameter und die Optimierung des Prozesses verhindert werden. (3) Während des Kulturprozesses kann es auch zu einem Verlust der Integrität der Pankreasinseln kommen. Einige Gründe dafür sind Azinuskontamination, die zu einer geringen Reinheit der Pankreasinseln führt, eine zu hohe Dichte der Inselkulturen, unzureichende Ernährung oder mechanische Beschädigungen. Um den Verlust der Integrität der Pankreasinseln zu überwinden, vergrößern Sie das Volumen des Inselmediums, erhöhen Sie die Dichte des Mediums und zentrifugieren Sie die Inselzellen langsamer und kürzer.
Zusammenfassend lässt sich sagen, dass dieses Protokoll erfolgreich zur Vorbereitung von adulten Schweineinseln für die Transplantation bei nicht-menschlichen Primatenempfängern eingesetzt wurde. Es wird weiterhin verwendet, um Inselzellen für zukünftige Untersuchungen zu erhalten.
Offenlegungen
Die Autoren berichten von keinen Interessenkonflikten.
Danksagungen
Wir danken Professor David K. C. Cooper (Center for Transplantation Sciences, Massachusetts General Hospital) für seine Hilfe bei der Einrichtung des gesamten Xenotransplantationssystems. Wir danken Miss Xingling Hu (Shenzhen Second People's Hospital), Miss Xiaohe Tian (University of California, Berkeley), Mr. Bo Zhou (Boston University) für hilfreiche Diskussionen und Anregungen. Diese Arbeit wurde durch Zuschüsse des National Key R&D Program of China (2017YFC1103701, 2017YFC1103704), Special Funds for the Construction of High-Level Hospitals in der Provinz Guangdong (2019) und des Sanming Project of Medicine in Shenzhen (SZSM201812079) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Referenzen
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten