Method Article
בידוד אי חזיר בוגר
* These authors contributed equally
In This Article
Summary
פרוטוקול מפורט זה מכסה את השלבים המתודולוגיים של בידוד איי חזירים בוגרים משלב העיכול דרך טיהור ועד להערכה התפקודית הסופית של האיים. מתווה זה יכול לשמש כקו מנחה לבידוד איי חזירים בוגרים במוסדות מחקר.
Abstract
סוכרת מסוג 1 (T1DM) נגרמת על ידי הרס אוטואימוני של תאי β בלבלב, מה שמביא לייצור אינסולין מועט או ללא ייצור כלל. השתלת איים ממלאת תפקיד חשוב בטיפול בסוכרת מסוג 1, עם שליטה גליקומטבולית משופרת, התקדמות מופחתת של סיבוכים, הפחתת אירועי היפוגליקמיה בהשוואה לטיפול מסורתי באינסולין. תוצאות הניסוי הקליני שלב III הוכיחו גם את הבטיחות והיעילות של השתלת איים בסוכרת מסוג 1. עם זאת, המחסור בתורמי לבלב מגביל את השימוש הנרחב בו. בעלי חיים כמקור לאיים כמו החזיר מציעים בחירה חלופית. מכיוון שהארכיטקטורה של לבלב החזיר שונה מאיי העכברים או בני האדם, הליך בידוד איי החזירים עדיין מאתגר. מכיוון שיש חשיבות רבה לתרגום של מקורות חלופיים של איי חזיר (קסנוגניים) לסביבה הקלינית לטיפול בסוכרת מסוג 1 באמצעות השתלה תאית, יש צורך בדחיפות בפרוטוקול חסכוני, סטנדרטי וניתן לשחזור לבידוד איי חזיר. כתב יד זה מתאר שיטה פשוטה וחסכונית לבידוד וטיהור איי חזיר בוגרים בהתבסס על הפרוטוקולים הקודמים שהשתילו בהצלחה איי חזיר לפרימטים שאינם אנושיים. זה יהיה מדריך למתחילים ללא שימוש בציוד מיוחד כגון מעבד תאים COBE 2991.
Introduction
סוכרת מסוג 1 (T1DM) היא מחלה קשה שבה הרס אוטואימוני של תאי בטא מביא לייצור אינסולין מועט או ללא ייצור אינסולין 1,2,3. קבוצה משמעותית של חולים עם סוכרת מסוג 1 אינה יכולה לייצב את היכולת הגליקמית באמצעות טיפול באינסולין וחווה אפיזודות היפוגליקמיות מסכנות חיים. השתלת איים, כאשר היא מצליחה, יכולה להשיג זאת. למעלה מ-1,500 חולי סוכרת עברו השתלת איים מוצלחת ברחבי העולם, מה שמראה סיכון נמוך יותר אך הצלחה בתוצאות ארוכות טווח מאשר השתלת לבלב4.
בהשוואה לטיפול באינסולין, להשתלת איים יש תוצאות טובות יותר בהפחתת התקדמות הסיבוכים5. תוצאות הניסוי הקליני שלב III הוכיחו גם את הבטיחות והיעילות של השתלת איים ב-T1DM 6,7. השתלת איים עשויה להיות האפשרות הטיפולית הטובה ביותר הזמינה כיום עבור חולים עם סוכרת מסוג 1 שחווים אפיזודות היפוגליקמיות מסכנות חיים.
עם זאת, המחסור באיים תורמים אלוגניים אנושיים מגביל את השימוש הנרחב בהשתלת איים 8,9. לכן, רצוי להשתמש באיים של בעלי חיים כתחליף10. החזיר נבחר כתורם לתאי איים בהשתלה פרה-קלינית, והוא בעל פוטנציאל לתרגום למרפאה בשל 1) זמינות, 2) דמיון מטבולי עם בני אדם, 3) מסת תאי בטא גדולה למדי, ו-4) אפשרות להנדסה גנטית לשיפור התאימות האימונולוגית לבני אדם11.
טוהר גבוה וכדאיות של איים הם צעדי מפתח להצלחת ההשתלה. עם זאת, ההליך לבידוד איים מתורמי חזירים בוגרים הוא מאתגר בגלל הארכיטקטורה של הלבלב עצמו, השונה מהאיים של עכברים או בני אדם12. באופן כללי, צורת איי הלבלב החזיריים אינה קומפקטית12. בהשוואה לאיי לבלב אנושיים ומכרסמים, איי חזירים מתנתקים ביתר קלות12. עם זאת, הדיסוציאציה הספונטנית של השכבה החיצונית של תאי האי, המלווה בזמן תרבית ארוך, מובילה להפחתה משמעותית בגודל אי הלבלב10.
במהלך תהליך בידוד האיים, גורמים רבים משפיעים על איכות האיים, כגון גיל התורם, זמן האיסכמיה החמה, פעילות אנזימטית, התנפחותם על ידי הזרקה אנזימטית 13,14. למרות שמחקרים קודמים רבים סיפקו שיטות לבידוד איי חזירים, אין פרוטוקול וידאו מפורט שלב אחר שלב לחוקרים כהוראה יעילה 10,15,16,17,18,19,20,21,22,23.
למטרה זו, פרוטוקול מפורט זה מכסה את כל שלבי הבידוד, החל מאחזור איברים ועד להערכה תפקודית לאחר הבידוד של האיים, בתקווה להציע סקירה פשוטה ומובנת של התהליך ליישום קל. פרוטוקול זה מבוסס על השיטות שפורסמו בעבר עם שינויים10,11.
Protocol
כל ההליכים הקשורים לבעלי חיים מאושרים על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של בית החולים השני של שנזן ובהתאם לכל התקנות הלאומיות. בפרוטוקול זה, חזירי דורוק-לנדרייס יורקשייר (~ גיל 6 חודשים) שנרכשו מהשוק שימשו כתורמי לבלב. משקל הלבלב שנאסף היה 123.63 גרם ±-22.50 גרם. ציוד מגן אישי, כולל ביגוד מגן, מסכות, כפפות וכובעים, נלבש במהלך הניסויים.
1. הכנת מדיה
- אמצעי ניקוי: להכנת 100 מ"ל של חומר ניקוי, מערבבים את תמיסת המלח המאוזנת של האנק (HBSS), סרום חזיר 2%, 20 מ"מ 4-(2-הידרוקסיאתיל)-1-פיפרזינאתיל-חומצה סולפונית (HEPES), ו-1% פניצילין-סטרפטומיצין (P/S).
- מדיום איסוף: מערבבים RPMI 1640 עם 5% סרום חזיר ו-1% פניצילין-סטרפטומיצין (P/S).
- מדיום תרבית: מערבבים CMRL 1066 עם 10% סרום חזיר, 10 מילימול/ליטר ניקוטינאמיד, 1% P/S ו-2 מילימול/ליטר L-גלוטמין.
- תמיסת אנזים: הכינו תמיסת קולגנאז 1 מ"ג/מ"ל מסוג V (פעילות: 918 יחידות/מ"ג מוצק) ב-HBSS.
- תמיסה בריכוז גלוקוז נמוך: להכנת תמיסה בריכוז גלוקוז נמוך, הוסף 0.5% אלבומין בסרום בקר (BSA) ו-2.8 מ"מ D-גלוקוז ל-1 מ"ל של מאגר ביקרבונט רינגר של קרב (KRBB).
- תמיסה עם ריכוז גלוקוז גבוה: להכנת תמיסה עם ריכוז גלוקוז גבוה, יש להוסיף 0.5% אלבומין בסרום בקר (BSA) ו-28 מ"מ D-גלוקוז ל-1 מ"ל של מאגר ביקרבונט רינגר (KRBB).
2. שליפת לבלב
- הרדמת חזירים והכנת עור
- יש להרדים את החזיר התורם באמצעות הזרקה תוך שרירית של חומרי הרדמה Lumianning (2.5-5 מ"ג/ק"ג) ופרופופול (2-3 מ"ג/ק"ג) (ראה טבלת חומרים לפרטים).
- שמור על הרדמה עם 1%-3% איזופלורן בנפח אוורור של 1-1.5 ליטר לדקה על ידי מסכות הרדמה בגז.
- עקוב אחר קצב הלב כדי לאשר את ההרדמה התקינה. יש להשתמש במשחה וטרינרית על העיניים כדי למנוע יובש בזמן ההרדמה.
- לגלח את הבטן, לנקות אותה ביודופור ולכסות את החזיר בווילון כירורגי סטרילי כראוי.
- פתיחת הבטן
- לאחר הבטחת תנאים סטריליים, בצע חתך לפרוטומיה בקו האמצע מהקסיפואיד לטבור מעט ליד הזנב.
- לחתוך את הסרעפת.
- בודד את אבי העורקים העל-הפטי ואת הווריד הנבוב התחתון העל-הפטי (IVC) באמצעות מלקחיים וסקולריים, ולאחר מכן בודד את אבי העורקים האינפרה-כלייתי ואת ה-IVC התת-הפטי באותה שיטה.
- תן הפרין תוך ורידי (100 יחידות לק"ג) לחזיר כדי למנוע קרישת דם.
- החוצה את המעי הדק והגס, ודחף את הכבד והקיבה לכיוון הראש כדי לחשוף את הלבלב במלואו.
- זלוף לבלב
- מהדקים את אבי העורקים מעל הסרעפת בעזרת מלקחיים וסקולריים, מחדירים את אבי העורקים מעל ענף אבי העורקים הכלייתי דרך צינורית אבי העורקים (16 G), וקושרים עם חוט תפר 2-0.
- החדירו לבעל החיים 2-3 ליטר תמיסת HBSS קרה (שנארזה בעבר ונשמרה ב-4 מעלות צלזיוס) דרך צינורית אבי העורקים (16 גרם). להחדיר את תמיסת HBSS דרך צינורית אבי העורקים על ידי כוח הכבידה, בעוד ה-IVC העל-הפטי וה-IVC עוברים טרנסקטציה כדי לשחרר את נוזל הזלוף.
הערה: המשך בעירוי עד שיציאת ה- IVC תהיה ברורה.
- כריתת לבלב
- מקלפים את האומנטום, מוצאים את הלבלב ואונות הטחול יחד עם הטחול ומפרידים ביניהם.
- הפרד את האונה המחוברת של הלבלב עם רקמה סמוכה.
- מצא את צינור הלבלב הראשי בחלק היורד של התריסריון. קשרו את צינור המרה בתפר (2-0) והעבירו אותו במספריים ליד צינור הלבלב.
- מהדקים קטע מהתריסריון המכיל את האמפולה של ווטר משני צידי ראש הלבלב בעזרת מלקחיים כלי דם, ואז כרתו את התריסריון בעזרת מספריים.
- הוציאו את כל הלבלב, טבלו אותו ב-HBSS קר והעבירו אותו מיד למתקן הבידוד של האי.
הערה: החזירים הומתו באמצעות נתרן פנטוברביטל (100-200 מ"ג/ק"ג). ניתן להשתמש בעירוי תוך-צינורי של HBSS או בתמיסת שימור כדי להרחיב את הלבלב באתר רכישת האיברים אם הלבלב נרכש בבית המטבחיים המקומי.
3. הכינו שלושה ארונות בטיחות ביולוגית לניסויים הבאים
- הקימו ארון בטיחות ביולוגית #1 עם אגן כליות, מכשירים כירורגיים וכוסות לניקוי הלבלב (סעיף 4, איור 1A).
- הקימו ארון בטיחות ביולוגית #2 עם אמבט מים, משאבה פריסטלטית, מעמד צינור עם צינור המחזור ותא עיכול לעיכול איים (סעיף 5, איור 1B).
- הגדר ארון בטיחות ביולוגית #3 עם מסננים חד פעמיים וצינורות צנטריפוגה להכנת אנזימים, טיהור איים והשלבים הבאים (סעיפים 6-8, איור 1C).
4. ניקוי לבלב
- מנקים ושוקלים את הלבלב.
- שטפו את הלבלב ב-200 מ"ל יודופור למשך 3 דקות בארון הבטיחות הביולוגית #1. שוטפים את הלבלב ב -200 מ"ל HBSS קר פעמיים, 2 דקות כל אחד.
- הכניסו את הלבלב הנקי לאגן כליות המכיל 100 מ"ל חומר ניקוי על קרח.
- שמור את האמפולה clamp, כרת את התריסריון. נקה את הלבלב משומן חיצוני ורקמת חיבור.
- שקלו את הלבלב.
5. עיכול הלבלב
- עירוי קולגנאז
- חותכים חתך רוחב של אחד הענפים הטבעתיים של הלבלב ומכניסים אנגיוקט 18 גרם (אם קוטר הצינור קטן יותר, קחו בחשבון אנגיוקט של 20 גרם) לצינור הלבלב הראשי ותפרו אותו למקומו בעזרת תפר משי קלוע 2-0.
- חתכו את גשר הרקמות העובר דרך האונה המחברת ליד ראש הלבלב, והדקו את הקטטר בצד החתך ליד ראש הלבלב כדי להפחית את דליפת האנזים.
- הנח אנגיוקאטים מרובים לעירוי אנזים תוך-צינורי טוב יותר. לשם כך, הכנס אנגיוקטים נוספים (גודל 20-22 גרם) לאחר חיתוך איבר הלבלב כדי לחשוף את הצינור.
- התקן את צינור המילוי, כולל צינור סיליקון באורך 1 מ' (16#) עם מחבר Luer-lock. החלק האמצעי של הצינור מוטבע בראש המשאבה הפריסטלטית.
- הפעל את המשאבה הפריסטלטית כדי למלא את מערכת הצינורות (גודל צינור 16#) 300 מ"ל של 1 מ"ג/מ"ל, קולגנאז מסוג V (פעילות: 918 יחידות/מ"ג) שחומם מראש ל-24 מעלות צלזיוס והסר בועות אוויר בצנרת.
- חבר את צינור הזלוף לאנגיוקט, והפעל את המשאבה הפריסטלטית בקצב של 20 מ"ל לדקה.
- עצרו את הזלוף כאשר רוב האנזים הוזרק והלבלב נפוח היטב (איור 2B).
- חותכים את הרקמה הג'לטינית השקופה שנוצרת סביב הלבלב במהלך הזלוף.
הערה: שלב זה חשוב מאוד מאחר שהג'ל יכול לסתום את המסנן בתא ולהקשות על איסוף הרקמה המעוכלת (איור 2B). - הסר את האנגיוקטים לאחר העירוי.
- עיכול רקמות
- מחממים 1 ליטר תמיסת HBSS ל -36 מעלות צלזיוס. הכינו מראש את מערכת העיכול המורכבת מתא העיכול והצינורות המחוברים למערכת סגורה, והעבירו את סליל החימום של המעגל לאמבט מים של 36 מעלות צלזיוס.
- חותכים את הלבלב ל 3-4 חתיכות ויוצקים אותם עם קולגנאז מסוג V לכוס של 500 מ"ל.
- מכסים את הכוס במכסה צלחת פטרי סטרילי, מעבירים אותה לארון בטיחות ביולוגית #2 ומכניסים את תכולת הכוס לתא העיכול המכיל ארבע גולות זכוכית סיליקון ורשת של 500 מיקרומטר.
- סגור את החדר והדק את הברגים. הכניסו את האנזים הנותר לכוס המחזור והפעילו את המשאבה הפריסטלטית במהירות של 80 מ"ל לדקה.
- הוסף תמיסת HBSS חמה (בדרך כלל בסביבות 150 מ"ל) שחוממה מראש בשלב 5.2.1 כדי למלא את המעגל עד לסיום. נענע את החדר בעדינות והפוך אותו כך שגולות הזכוכית הסיליקון יפגעו ברקמה.
הערה: מכיוון שאיי חזירים עדינים יותר מרקמה אנושית, הרעידות צריכות להיות אחידות ואיטיות כדי למנוע נזק. כאשר הרקמה מתעכלת, היא תתחיל להתפרק ולזרום החוצה מהחדר. - קח דגימה (כ -1 מ"ל) מהמעגל כל 2 דקות כדי לבדוק אם יש איים חופשיים לאחר ניעור במשך דקה.
- הנח את הדגימה בצלחת 6 בארות עם 80 מיקרוליטר דיתזון (DTZ). הוסף 2 מ"ל של מי מלח עם חוצץ פוספט (PBS) ובדוק את הדגימה במיקרוסקופ בהגדלה של פי 40. DTZ יכתים איים באדום.
- אוסף התקציר
- המשך בעיכול עד שנצפו איים חופשיים (גם אם רבים עדיין לכודים חלקית באקסוקרינה).
הערה: שחרור האי אורך כ-10-15 דקות, אך זמן העיכול מושפע לרוב מגיל התורם, כמות האנזימים, ריכוז האנזים וכו'. - פתח את המעגל ואסוף את הרקמה המשתחררת לבקבוקי 1 ליטר. שמור את הבקבוקים על קרח בזמן האיסוף כדי לעזור לנטרל את הקולגנאז מסוג V.
- הוסף את תמיסת HBSS החמה שנותרה (~850 מ"ל, שלב 5.2.1) לכוס המחזור ואסוף את הרקמה המעוכלת שנותרה מתא העיכול.
- הוסף מדיום איסוף קר לתא (דרך הכוס המחזורית).
הערה: הפסק את האיסוף כאשר כדורי הרקמה הולכים וקטנים. שלב האיסוף (שלבים 5.3.2-5.3.3) עשוי להימשך עד 40-75 דקות ו-5-8 ליטר של חומרי איסוף. - העבירו את הרקמה מבקבוק האיסוף לצינורות צנטריפוגה חרוטיים של 250 מ"ל, וצנטריפוגה ב-200 x גרם למשך 3 דקות ב-4 מעלות צלזיוס.
- השליכו את הסופרנטנט והשעו מחדש את הרקמה ב-500 מ"ל של מדיום איסוף טרי.
- המשיכו לשלב את כדורי התא למדיום איסוף קר (500 מ"ל) עד שכל העיכול נאסף.
- שטפו את גלולת התא התלויה במדיום הקר על ידי צנטריפוגה (3 דקות ב-200 x גרם, 4 מעלות צלזיוס).
- השליכו את הסופרנטנט. הערך וכימת את כדור התא לפי השלבים המוזכרים בסעיפים 6-8.
הערה: הנפח הסופי תלוי בגודל הלבלב אך צפוי להיות בטווח של 40-80 מ"ל.
- המשך בעיכול עד שנצפו איים חופשיים (גם אם רבים עדיין לכודים חלקית באקסוקרינה).
6. טיהור איים
- טהר את איי החזירים על ידי הפרדת שיפוע צפיפות.
הערה: עיין בטבלת החומרים לקבלת פרטים על פתרונות שיפוע הצפיפות שבהם נעשה שימוש.- הוסף 2 מ"ל רקמת לבלב לצינורות חרוטיים של 50 מ"ל.
- הוסף 12 מ"ל של שיפוע פוליסוכרוז 1119 (1.119 גרם/ס"מ3) כדי להשעות מחדש כל 2 מ"ל של רקמת הלבלב.
- הוסף 10 מ"ל של תמיסת פוליסוכרוז 1083 (1.083 גרם/ס"מ3), 10 מ"ל של תמיסת פוליסוכרוז 1077 (1.077 גרם/ס"מ3), 10 מ"ל של תמיסת פוליסוכרוז 1037 (1.037 גרם/ס"מ3), ו-5 מ"ל של HBSS, ברצף.
הערה: תמיסת פוליסוכרוז 1037 (1.037 גרם/ס"מ3) מוכנה על ידי ערבוב 1077 תמיסת פוליסוכרוז (1.077 גרם/ס"מ3) ותמיסת פורין ציטראט היפרטונית (38.5 מ"ל: 11.5 מ"ל). - צנטריפוגה ב-900 x גרם ללא בלם למשך 10 דקות ב-4 מעלות צלזיוס.
- שאפו את האיים בין השכבות של תמיסת פוליסוכרוז 1077 ותמיסת פוליסוכרוז 1037.
- מעבירים את האיים לצינור צנטריפוגה של 50 מ"ל, מחלקים את הנוזל באופן שווה בכל צינור, ומאזן לפני הצנטריפוגה.
- לשטוף איי חזירים
- צנטריפוגה ב-200 x גרם למשך 3 דקות ב-4 מעלות צלזיוס, השליכו את הסופרנטנט. הוסף את מדיום האיסוף כדי להעלות את הנפח ל -45 מ"ל.
- צנטריפוגה ב-200 x גרם למשך 3 דקות ב-4 מעלות צלזיוס, ומשאירה כ-2 מ"ל של סופרנטנט; יש לנער בעדינות כדי לערבב.
- שלב את כל הכדורים לאותו צינור צנטריפוגה של 50 מ"ל. הוסף את מדיום האיסוף כדי להעלות את הנפח ל -45 מ"ל.
7. ספירת שווי ערך לאיים (IEQ) ותרבות איים
- מכתים DTZ של איים
- חברו את האיים יחד, הוסיפו עוד אמצעי איסוף כדי להעלות את הנפח ל-250 מ"ל, והשעו מחדש את האיים.
- קח 500 מיקרוליטר מהדגימה המייצגת והניח אותה בצלחת של 35 מ"מ עם 80 מיקרוליטר DTZ. הניחו לו לדגור בטמפרטורת החדר למשך 1-2 דקות, ואז הוסיפו 2 מ"ל PBS.
- בדוק בהגדלה של פי 40 תחת מיקרוסקופ הפוך. אגרגטים של איים מוכתמים באדום על ידי ה-DTZ.
- ספירת איים מוכתמים
- ספרו את האיים המוכתמים על ידי חלוקתם לקטגוריות הגודל המפורטות בטבלה 1. השתמש במקדם ההמרה כדי לקבוע את שווה ערך האי (IEQ) בהתאם לגודל.
הערה: המרת IEQ מתבצעת כאשר רוב קוטר האגרגטים החיוביים ל-DTZ גדול מ-50 מיקרומטר (בתכשירים למבוגרים (>שנתיים) וכמה תכשירים למבוגרים צעירים (6-12 חודשים) ממשיכים לשלב 7.2.4). בכל המקרים האחרים (בחזירים צעירים מתחת לגיל 6 חודשים ובחזירים הבוגרים הצעירים הנותרים), מספר האיים הוערך על סמך נפח החלקיקים או תכולת הדנ"א (לפי שלבים 7.2.2-7.2.3). - (אופציונלי) צנטריפוגה ב-200 x גרם ב-4 מעלות צלזיוס למשך 2 דקות למדידת המשטחים.
- (אופציונלי) הערך את תכולת ה-DNA של איים בודדים, כמו גם של כדורי תאי האי על ידי ערכת בדיקת התפשטות התאים. אקסטרפולציה של מספרי תאי בטא של חזירים מתכולת ה- DNA וניתוח אימונוציטוכימי.
- הוסף את כל הקטגוריות וקבע את ה- IEQ הכולל עבור המדגם. הכפל את המספר הזה בנפח השבר. (למשל, 200 IEQs ב-500 מיקרוליטר של שבר של 250 מ"ל = 200 x 2 x 250 = 100,000 IEQs).
- ספרו את האיים המוכתמים על ידי חלוקתם לקטגוריות הגודל המפורטות בטבלה 1. השתמש במקדם ההמרה כדי לקבוע את שווה ערך האי (IEQ) בהתאם לגודל.
- תרבות האיים
- צנטריפוגה את האיים ב-200 x g ב-4 מעלות צלזיוס למשך דקה אחת; השליכו את הסופרנטנט.
- הוסף 5 מ"ל של מדיום תרבית שחומם מראש כדי להשעות מחדש איים ולהעביר לצלחת פטרי 150 מ"מ.
הערה: השעו 10,000 איים / צלחת. - הוסף עוד מדיום תרבית כדי להביא את הנפח עד 30 מ"ל בצלחת פטרי 150 מ"מ.
8. הערכת איכות האי
- Calcein AM (CA) - צביעת Propidium Iodide (PI) של איים
- בחר ידנית 50 איים לצלחת של 48 בארות. יש לשטוף פעם אחת עם 1 מ"ל HBSS.
- הוסף 200 מיקרוליטר מהתערובת המכילה 1x CA ו-1x PI בהתאם להוראות ערכת צביעת כדאיות התא.
- מכסים את צלחת הפטרי ומניחים אותה באינקובטור בחום של 37 מעלות צלזיוס למשך 30 דקות.
- דמיין את האיים באמצעות מיקרוסקופ פלואורסצנטי וצלם את התמונות.
- כמת את הכדאיות על ידי ספירת התאים החיים (ירוק) והתאים המתים (אדום) לאחר צביעת CA-PI.
- הפרשת אינסולין מגורה על ידי גלוקוז (GSIS)
- הוסף 1 מ"ל של תמיסת ריכוז גלוקוז נמוך לשלוש בארות של צמח בן 24 בארות.
- לאחר תרבית לילה לפחות, בחר ידנית 100 איים בגודל דומה בקוטר של 100-200 מיקרומטר והעביר אותם לשלוש הבארות של צלחת 24 הבארות המלאה מראש בתמיסת ריכוז גלוקוז נמוך (כמו בשלב 8.2.1).
הערה: שטפו את האיים בבאר ביניים עם HBSS לפני העברתם לבאר כדי לשטוף את מדיום התרבית. - דגרו את האיים בחממה של 5% CO2 בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות.
- הסר את הסופרנטנט בזהירות בעזרת פיפטה מבלי לגעת באיים.
- הוסף 1 מ"ל של תמיסה חדשה בריכוז גלוקוז נמוך.
- דגרו את האיים בחממה של 5% CO2 בטמפרטורה של 37 מעלות צלזיוס למשך 60 דקות.
- אוספים את הסופרנטנט (ללא איים) ומעבירים לפחות 500 מיקרוליטר ממנו לצינור צנטריפוגה של 1.5 מ"ל. זה יכיל אינסולין המופרש תחת גירוי גלוקוז נמוך.
- הוסף 1 מ"ל של תמיסת ריכוז גלוקוז גבוה בזהירות לאותן בארות.
- דגרו את האיים בחממה של 5% CO2 בטמפרטורה של 37 מעלות צלזיוס למשך 60 דקות.
- העבירו עוד 500 מיקרוליטר ממדיום התרבות לצינור צנטריפוגה חדש של 1.5 מ"ל. זה יכיל אינסולין המופרש תחת גירוי גלוקוז גבוה.
- השתמש בערכות בדיקת אימונוסורבנט מקושר לאנזים (ELISA) לאינסולין חזיר כדי למדוד את ריכוז האינסולין המשתחרר לאחר גירוי גלוקוז נמוך וגבוה (שלבים 8.2.7 ו-8.2.10).
הערה: מדד הגירוי (SI) מחושב כיחס בין ריכוז האינסולין שנמדד לאחר גירוי גלוקוז גבוה חלקי ריכוז האינסולין לאחר גירוי גלוקוז נמוך.
תוצאות
הכנת ארון הבטיחות הביולוגית מוצגת באיור 1. מוקמים שלושה חללי הפעלה עצמאיים. ארון בטיחות ביולוגית #1 מורכב מאגני כליות, מכשירים כירורגיים וכוסות לגיזום הלבלב (איור 1A). ארון בטיחות ביולוגית #2 מוגדר עם אמבט מים, משאבה פריסטלטית, מעמד צינור עם צינור המחזור ותא עיכול לעיכול איים (איור 1B). ארון בטיחות ביולוגית #3 מוגדר עם מסננים חד פעמיים וצינורות צנטריפוגה להכנת אנזימים, טיהור איים והשלבים הבאים (איור 1C).
הלבלב (לפני ואחרי זלוף אנזימים) מוצג באיור 2. תמיסת קולגנאז מסוג V מוחדרת לכל הלבלב דרך צינור הלבלב החל מראש הלבלב. אם האונה המחברת אינה מחוללת בהצלחה, יש לחתוך אותה לחתיכות נפרדות, ויש לחלחל כל אחת מהן.
עיכול הלבלב מתבצע בתא העיכול, כפי שמוצג באיור 3. רקמת הלבלב לאחר השיבוש המכני, ורקמת הלבלב הלא מעוכלת שנותרה לאחר העיכול מוצגת באיור. כמות קטנה של רקמה לא מעוכלת מעידה על עיכול מלא; עם זאת, זה עשוי להצביע גם על עיכול יתר; לכן, אם 15%-25% מאיבר הלבלב נשאר בתא, זה מקובל. רקמת הלבלב המעוכלת נשטפת וצנטריפוגה בשיפועי צפיפות לא רציפים כדי להפריד את האיים מתאי האצינר (טיהור), כפי שמוצג באיור 4. איי הלבלב נמצאים בשכבה האמצעית.
צביעת DTZ של האיים מוצגת באיור 5. הנקודה שבה העיכול נעצר ומתחיל האיסוף (כלומר, כאשר מופיעים איים חופשיים) מוצגת באיור 5A. איי חזיר מטוהרים לאחר הפרדת שיפוע צפיפות מוצגים באיור 5B. איים בשדה בהיר מוצגים באיור 6A. איכות האי נבדקת על ידי צביעת Calcein AM (CA) -Propidium Iodide (PI), כפי שמוצג באיור 6B. תאים חיים הם ירוקים ותאים מתים הם אדומים. תפוקת בידוד האיים הממוצעת של פרוטוקול זה היא 360,935 ±-114,279 IEQ/לבלב ו-2,439-3,252 IEQ/g של הלבלב, בדומה למחקר הקודם (333,000 ±-129,000 IEQ/לבלב). הכדאיות הממוצעת של האי לפי פרוטוקול זה היא מעל 81%, שהיא מעט נמוכה מהמחקר הקודם (86.7%). אחת התוצאות המייצגות של מדד הגירוי (SI = היחס בין כמויות האינסולין (mU/L) המשתחררות במהלך גלוקוז גבוה בתנאי גלוקוז נמוך) המתקבל על ידי בדיקת הפרשת אינסולין מגורה גלוקוז (GSIS) שנמדדה על ידי ELISA בפרוטוקול זה היא 1.4 ± 0.3, הדומה למחקר הקודם (1.75 ± 0.60)24. התוצאות לעיל מסוכמות בטבלה 2.

איור 1: הכנת ארון הבטיחות הביולוגית. (A) ארון בטיחות ביולוגית #1 מציג את אגן הכליות, המכשירים הכירורגיים והכוסות בשדה הסטרילי. (B) ארון בטיחות ביולוגית #2 עם אמבט מים (משמאל לימין), משאבה פריסטלטית, מעמד צינור עם צינור מחזור וצינורות ותא עיכול. (C) ארון בטיחות ביולוגית #3 עם מסננים חד פעמיים וצינורות צנטריפוגה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הלבלב לפני ואחרי זלוף אנזימים. (A) לפני זלוף אנזים. (B) לבלב נפוח לאחר זלוף אנזימים. החץ האדום מציין את זרימת התמיסה של קולגנאז מסוג V. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: הלבלב בתא העיכול. (A) רקמת הלבלב אחרי עיכול והפרעה בגולות. (B) רקמת הלבלב שנשארת אחרי העיכול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: ריבוד תאי לבלב לאחר צנטריפוגה של שיפוע צפיפות לא רציפה. לאחר צנטריפוגה, האיים יהיו מרוכזים בין 1.077 גרם/סמ "ק לשכבת HBSS, והמשקע התחתון הוא רקמה שאינה אי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
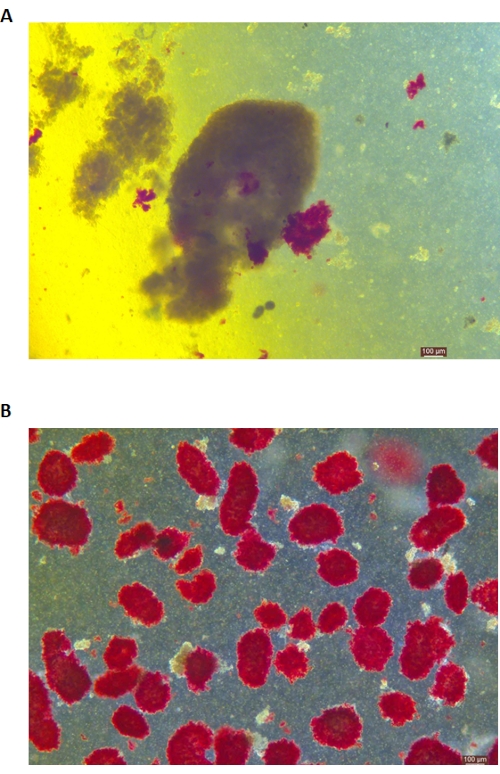
איור 5: צביעת דיתיזון (DTZ) של האיים במהלך העיכול. (A) דגימות נאספות מחדר העיכול. האיים במדגם צבועים באדום. האות לתחילת האיסוף הוא כאשר 1-2 איים משתחררים לחלוטין מרקמה אקסוקרינית. (B) איים מטוהרים המופרדים על ידי שיפוע צפיפות לא רציף. סרגל קנה המידה הוא 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: צביעת כדאיות של תאי איים חיים/מתים. (א) איים בשדה בהיר. (B) Calcein AM (CA) - צביעת Propidium Iodide (PI) של איים. תאים חיים הם ירוקים ותאים מתים הם אדומים. סרגל קנה המידה הוא 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| קטגוריה | תחום קוטר האיים (μm) | גורם המרה IEQ |
| 1 | 50–100 | פי 0.167 |
| 2 | 101–150 | x 0.648 |
| 3 | 151–200 | x 1.685 |
| 4 | 201–250 | פי 3.500 |
| 5 | 251–300 | x 6.315 |
| 6 | 301–350 | x 10.352 |
| 7 | >350 | x 15.833 |
טבלה 1: גורמי המרה לחישוב שווי ערך לאיים (IEQ).
| פרוטוקול זה | לימודים קודמים24 | |
| תפוקת איים (IEQ/לבלב) | 360,935 ± 114,279 | 333,000 ± 129,000 |
| כדאיות האי | 81% | 86.70% |
| אינדקס גירוי אינסולין באי | 1.4 ± 0.3 | 1.75 ± 0.60 |
טבלה 2: השוואה בין התוצאות שהתקבלו על ידי פרוטוקול זה למחקרים קודמים.
Discussion
השתלת איים, המשתמשת בחזירים כמקור לאיים, היא גישה מבטיחה להתגבר על המחסור באיים אנושיים. למרות שהבידוד של איי חזירים בוגרים הוא מאתגר, מספר קבוצות קבעו פרוטוקולים לבידוד מוצלח של איים באופן עקבי10,11. ללא קשר לשיטה, יש להוכיח את כדאיות האי ותכונות פונקציונליות כדי לאשר את האיכות הגבוהה של המוצרים. פרוטוקול זה מבוסס על אלה שפורסמו10,11 בפורמט וידאו כדי שיהיה קל להבנה ולשכפול.
על פי דיווחים קודמים וניסיוננו, מספר פרמטרים הם קריטיים לבידוד מוצלח של איי חזירים בוגרים13,14. הפרמטרים הקריטיים כוללים (1) גיל ומין החזיר התורם: חזירות עם יותר משתי המלטות (מה שנקרא מגדלים בדימוס) עדיפות על פני חזירים צעירים יותר מכיוון שהן יכולות לספק בקלות מספר רב של איים איכותיים 25,26,27,28,29,30, (2) זמן איסכמיה חם: הגבל ל-10 דקות על מנת להפחית את העיכול העצמי14, (3) אנזים עיכול: קולגנאז מסוג V הוא אפשרות תקפה, (4) זמן עיכול: חיוני להפסיק את העיכול מוקדם מספיק כדי למנוע עיכול יתר. ברגע שנצפים האיים החופשיים, תהליך האיסוף מתחיל גם אם הם לכודים חלקית. זה מוקדם מאוד בתהליך.
לפרוטוקול זה מספר יתרונות. בהשוואה לשיפועי צפיפות רציפים או לא רציפים באמצעות מעבד תאים COBE 2991 לטיהור איים, פרוטוקול זה שכבת איים על פני תמיסות שיפוע צפיפות באמצעות צינורות חרוטיים וצנטריפוגה סטנדרטית. זה חסכוני וקל לשלוט בו למתחילים. מכיוון ששיטת טיהור זו דורשת יותר עבודת כפיים, ייצור בכמויות גדולות וכדורים גדולים עדיין עשויים לדרוש מעבד תאי COBE כדי להגביר את היעילות.
כמה שלבים לפתרון בעיות נידונים גם כאן. (1) נניח שיותר מ-25% מרקמת הלבלב אינה מתעכלת, או שרוב איי הלבלב מכוסים ברקמת אצינאר. במקרה כזה, הסיבות האפשריות כוללות זלוף לקוי, שאריות דם המשפיעות על פעילות האנזים, ריכוז או פעילות אנזימים נמוכים, או טמפרטורה נמוכה במהלך העיכול. (2) עיכול מוגזם של רקמת הלבלב עלול להוביל לפיצול אי הלבלב. הסיבה האפשרית היא שזמן האיסכמיה החמה אינו נשלט היטב, ריכוז גבוה של אנזימי עיכול, חשיפות ארוכות יותר של איים מעוכלים לתמיסת אנזימי העיכול או טמפרטורת עיכול גבוהה. ניתן למנוע זאת רק על ידי סטנדרטיזציה של פרמטרי אנזימים/עיכול ואופטימיזציה של התהליך. (3) אובדן שלמות איי הלבלב עלול להתרחש גם במהלך תהליך התרבית. חלק מהסיבות לכך כוללות זיהום אצינרי המוביל לטוהר נמוך של איי הלבלב, צפיפות גבוהה מדי של תרבית איים, תזונה לא מספקת או נזק מכני. כדי להתגבר על אובדן שלמות איי הלבלב, הגדל את נפח מדיום האי, הגדל את צפיפות המדיום וצנטריפוגה את האיים לאט יותר ולזמן קצר יותר.
לסיכום, פרוטוקול זה הופעל בהצלחה להכנת איי חזירים בוגרים להשתלה בפרימטים שאינם אנושיים. הוא ישמש גם להשגת איים לחקירות עתידיות.
Disclosures
המחברים לא מדווחים על ניגודי אינטרסים.
Acknowledgements
אנו מודים לפרופסור דיוויד ק. ס. קופר (המרכז למדעי ההשתלות, בית החולים הכללי של מסצ'וסטס) על שעזר לנו להקים את כל מערכת ההשתלות. אנו מודים לגברת שינגלינג הו (בית החולים השני של שנג'ן), לגברת שיאוהה טיאן (אוניברסיטת קליפורניה, ברקלי), למר בו ג'ואו (אוניברסיטת בוסטון) על הדיון וההצעות המועילות. עבודה זו נתמכה על ידי מענקים מתוכנית המו"פ הלאומית של סין (2017YFC1103701, 2017YFC1103704), קרנות מיוחדות לבניית בתי חולים ברמה גבוהה במחוז גואנגדונג (2019) ופרויקט Sanming לרפואה בשנג'ן (SZSM201812079).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
References
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), London, England. 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, Clifton, N.J. 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , Artechhouse. Norwood, MA. 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, Clifton, N.J. 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, Suppl 2 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved