Method Article
Mechanobiyolojik Çalışmalar için Orbital Çalkalayıcıda Endotel Hücrelerinin 6 Kuyu Plakalarında Parçalanması
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, endotel hücre büyümesini yörüngesel çalkalayıcı modelini kullanarak kesme gerilme uygulaması için 6 kuyulu bir plakanın belirli bir bölgesiyle sınırlamak için bir kaplama yöntemini açıklar.
Özet
Kanın akışı ile arteriyel duvara uygulanan kesme stresi endotel hücre morfolojisini ve fonksiyonunu etkiler. Düşük büyüklük, salınımlı ve multiliksiyonel kesme gerilmelerinin tümü endotel hücrelerinde pro-aterosklerotik fenotipi uyarmak için öne sürülmüştür, yüksek büyüklük ve tek yönlü veya tek eksenli kesmenin endotel homeostazı teşvik ettiği düşünülmektedir. Bu hipotezler daha fazla araştırma gerektirir, ancak geleneksel in vitro tekniklerin sınırlamaları vardır ve hücrelere çok yönlü kesme gerilmeleri uygulama konusunda özellikle zayıftır.
Giderek artan bir kullanım elde eden bir yöntem, endotel hücrelerini bir yörünge çalkalayıcı platformunda standart çok kuyulu plakalarda kültüre etmektir; Bu basit, düşük maliyetli, yüksek verimli ve kronik yöntemde, dönen ortam kuyunun farklı bölgelerinde çok yönlü kesme de dahil olmak üzere farklı kesme desenleri ve büyüklükleri üretir. Bununla birlikte, önemli bir sınırlamaya sahiptir: bir bölgedeki hücreler, bir akış türüne maruz kalan, kuyunun diğer bölümlerindeki hücreleri etkileyen, farklı akışlara maruz kalan ortama aracılar bırakabilir, bu nedenle akış ve fenotip arasındaki belirgin ilişkiyi bozabilir.
Burada, hücrelerin yalnızca belirli kesme stresi özelliklerine maruz kalmalarını sağlayan yöntemin kolay ve uygun fiyatlı bir modifikasyonunun sunulmasını sunuyoruz. Hücre tohumlama, ilgi çekici bölgeyi fibronektin ile kaplayarak kuyunun tanımlanmış bir bölgesiyle sınırlandırılır, ardından passivating çözeltisi kullanılarak pasivasyon yapılır. Daha sonra, plakalar çalkalayıcı üzerinde döndürebilir, bu da hücrelerin konumlarına bağlı olarak düşük büyüklükte çok yönlü kesme veya yüksek büyüklükte tek eksenli kesme gibi iyi tanımlanmış kesme profillerine maruz kalmasına neden olur. Daha önce olduğu gibi, standart hücre kültürü plastik yazılımının kullanımı, hücrelerin daha basit bir şekilde daha fazla analizini sağlar. Değişiklik, endotelden tanımlanmış kesme stresi özellikleri altında salınan ve kuyunun başka bir yerinde bulunan hücreleri etkileyen çözünür mediatörlerin gösterilmesine zaten izin vermiştir.
Giriş
Damar hücrelerinin mekanik ortamlarına verdikleri yanıtlar kan damarlarının normal fonksiyonlarında ve hastalığın gelişiminde önemlidir1. Tüm kan damarlarının iç yüzeyini hizalayan endotel hücrelerinin (VC) mekanobiyolojisi, mekanobiyolojik araştırmaların özel bir odağı olmuştur, çünkü VC'ler doğrudan üzerlerindeki kan akışının yarattığı kesme stresini yaşarlar. İnflamatuar yanıtlar, değişen sertlik ve morfoloji, vazoaktif maddelerin salınımı ve kavernasyonel proteinlerin lokalizasyonu ve ekspresyonu gibi çeşitli fenotipik değişiklikler, EC'nin kesme stresine maruz kalmasına bağlıdır2,3,4. Kesmeye bağımlı endotel özellikleri de ateroskleroz 5 ,6,7gibi hastalıkların yamalı gelişimini açıklayabilir.
Stresin kontrol edilebildiği ve WC'lerin diğer hücre tiplerinden izole edilebildiği kültürde makasın VC'ler üzerindeki etkisini incelemek faydalıdır. VC'lere kesme stresi uygulamak için yaygın olarak kullanılan in vitro cihazlar paralel plaka akış odası ve koni ve plaka viskometresini içerir, ancak sadece tek eksenli sabit, salınımlı ve pulsatil akışuygulanabilir 8,9. Konik veya dallanma geometrili modifiye akış odaları ve stenotik geometriyi taklit eden mikroakışkan yongalar geliştirilmiş olsa da, düşük verimleri ve mümkün olan nispeten kısa kültür süresi10, 11.
Bir orbital çalkalayıcının platformuna yerleştirilen standart hücre kültürü plastik eşyalarında hücrelerin yetiştirildiği endotel mechanotransduction çalışması için orbital çalkalayıcı (veya iyi dönen) yöntem, yüksek verimli IC'lere kronik olarak karmaşık, mekansal olarak değişen kesme stres desenleri uygulayabildiği için giderek daha fazla dikkat çekmektedir (bkz. Warboys vd.12). Dönen bir kuyuda kesme stresinin mekansal ve zamansal varyasyonunu karakterize etmek için Hesaplamalı Akışkanlar Dinamiği (CFD) simülasyonları sunuldu. Plakanın yerleştiği çalkalayıcı platformun yörüngesel hareketinin neden olduğu kültür ortamının dönen hareketi, merkezde Düşük Büyüklükte Çok Yönlü Akışa (LMMF veya putatif olarak aterojenik akışa) ve 6 kuyulu bir plakanın kuyularının kenarında Yüksek Büyüklükteki Tek Eksenli Akışa (HMUF veya putatif olarak ateroprotektif akış) yol açar. Örneğin, zaman ortalamalı duvar kesme stresi (TAWSS) merkezde yaklaşık 0,3 Pa ve 5 mm yörünge yarıçapı 13 olan 150 rpm'de dönen 6 kuyu plakasının kenarında0,7 Pa'dır. Yöntem sadece ticari olarak kullanılabilen plastik eşyalar ve orbital çalkalayıcının kendisini gerektirir.
Bununla birlikte, yöntemin (ve diğer akışların in vitro olarak empoze edilmesine) bir dezavantajı vardır: VC'ler çözünür mediatörleri ve mikropartikülleri kesmeye bağımlı bir şekilde serbest bırakır14,15,16 ve bu secretome, dönen ortamdaki karıştırma nedeniyle kuyunun salındıkları bölgelerde VC'leri etkileyebilir. Bu, kesme stresinin EC fenotip üzerindeki gerçek etkilerini maskeleyebilirsiniz. Örneğin, Ghim ve arkadaşları, bunun farklı kesme profillerinin büyük parçacıkların hücrelerarası taşınması üzerindeki görünüşte aynı etkisini oluşturduğunu tahmin etmişler17.
Burada, yüzeyi pas geçirmek ve başka bir yerde büyümeyi önlemek için Pluronic F-127 kullanırken fibronektin kaplama kullanarak 6 kuyulu bir plakanın belirli bölgelerinde insan göbek damarı endotel hücresi (HUVEC) yapışıklığı teşvik etmek için bir yöntem açıklıyoruz. Yöntem, hücre büyümesini segmentlere ayırarak, VC'lerin yalnızca bir tür kesme profili yaşadığı ve kuyunun başka bir yerindeki diğer profillere maruz kalan VC'lerden gelen salgılardan etkilenmediği için yukarıda açıklanan sınırlamayı çözer.
Protokol
1. Cihazların imalatı ve reaktiflerin hazırlanması
- Paslanmaz çelik modülün imalatı
- Paslanmaz çelik modülü, sağlanan mühendislik çizimine göre bir CNC freze makinesi kullanarak 316 paslanmaz çelikten imal edin (Şekil 1).
- Polidimetilsiloksisan (PDMS) kalıbının 3D baskısı
- Sağlanan mühendislik çizimine göre SolidWorks kullanarak PDMS kalıbının 3D bilgisayar destekli tasarım (CAD) modelini hazırlayın (Şekil 2).
- CAD modelini bir STL dosyasına verin ve STL dosyasını Cura 2.6.2'ye alın.
- Modeli 50 mm/s baskı hızı ve %60 dolum yoğunluğu ile katmanlar halinde dilimleyin.
- Dosyayı G kodu olarak dışa aktarın ve yazdırmak için ultimaker2 3D yazıcıya yükleyin. Baskı malzemesi olarak polilaktik asit (PLA) kullanın.
- PDMS halkasının dökümü
- PDMS tabanını ve kürleme maddesini (her ikisi de silikon elastomer kitinden) %90,9 baz ve %9,1 kürleyici madde oranıyla karıştırın.
- İyi karıştırılır çözeltinin yaklaşık 2,6 mL'lik kısmını 3D baskılı kalıba dökün.
- Vakum gaz giderme odasında kabarcıkları çıkarın.
- 80 °C fırında 1 saat boyunca tedavi edin.
- PDMS halkasının oda sıcaklığına soğumasını bekleyin, ardından kürlenmiş PDMS halkasını kalıptan dikkatlice çıkarın. PDMS halkasının mühendislik çizimi Şekil 3'tegösterilmiştir.
- %1 Pluronic F-127 hazırlanması
- 5 g Pluronic F-127 tartın, bir cam şişeye dökün, ardından cam şişeye 100 mL steril su ekleyin. Bu% 5 Pluronic F-127 çözümü verir.
- Tüm Pluronic F-127 tozlarının suya batırıldığından emin olun, kapağı kapatın ve sıvı sterilizasyon döngüsü programı kullanarak otoklavlayın.
- Otoklavdan sonra, kullanmadan önce çözeltiyi oda sıcaklığına soğumaya bırakın.
- %1 Pluronic F-127 çözeltisi yapmak için 40 mL otomatik kapatılmış steril suya 10 mL%5 Pluronic F-127 çözeltisi ekleyin. Seyreltme işlemi biyogüvenlik kabini (BSC) davlumbazında gerçekleştirin.
- Oda sıcaklığında hem %1 hem de %5 Pluronic F-127 saklayın.
- %4 paraformaldehit hazırlanması (PFA)
- Bir cam kabın içine 800 mL fosfat tamponlu salin (PBS) ekleyin ve karıştırırken 60 °C'ye ısıtın (1,5,1 ila 1,5,5 adım arasında karıştırmaya devam edin).
- 40 g PFA tozu tartın ve sıcak PBS çözeltisine ekleyin.
DİkKAT: PFA tehlikelidir, duman kaputunda 1.5.2 ila 1.5.6 adımlarını uygulayın. - Çözeltiler netleşene kadar PFA çözeltisine yavaşça 1 M sodyum hidroksit (NaOH) ekleyin.
- PFA çözeltisinin pH'ını 1 M hidroklorik asit (HCl) ile yaklaşık 7,4'e ayarlayın.
- 1X PBS ile çözeltiyi 1 L'ye kadar toplar. Bu% 4 PFA 1 L verir.
- FSAF çözeltisini 0,2 μm filtrelerle filtreleyin ve partikülleri, aliquot'u çıkarın ve -20 °C dondurucuda dondurun.
- %0.1 Triton-X'in hazırlanması
- %0,1 Triton-X çözümü yapmak için 50 mL PBS'ye 50 μL saf Triton-X ekleyin.
- %1 sığır serum albümini hazırlanması (BSA)
- 0,5 g BSA ağırlığında, 50 mL santrifüj tüpüne dökün ve ardından tüpe 50 mL PBS ekleyin.
- Çözünmesi için bir silindir üzerinde oda sıcaklığında 1 saat yuvarlanmasına izin verin.
- %1 BSA'yı iki haftaya kadar 4 °C'de saklayın.
2. 6 kuyulu bir plakanın kaplanması
- Kullanmadan önce paslanmaz çelik modülü, PDMS halkasını ve cımbızı otoklavlav. Sonraki tüm prosedürleri bir BSC davlumbazında gerçekleştirin ve steriliteyi sağlamak için aseptik teknikleri gözlemleyin.
- PDMS halkasını cımbız kullanarak 6 kuyuya yerleştirin. PDMS halkasını kuyuyla merkezi olarak hizalamak için PDMS halkasının dış kenarını kullanın.
NOT: Sadece doku dışı kültür iyi tedavi edilen plakalar kullanılmalıdır. - Paslanmaz çelik modülü cımbız kullanarak PDMS halkasının üzerine yerleştirin.
- İç tutucu halka pensesinin uçlarını tutucu halkanın kavrama deliklerine yerleştirin, tutucuyu sıkın ve tutucuyu tutma halkasının çapını azaltmak için sıkın. 6 kuyuya takın, paslanmaz çelik modüle sıkıca bastırın ve PDMS halkasını kuyuda sabitlemek için penseyi serbest bırakın.
- PDMS halkası ve paslanmaz çelik modülün açılmasıyla kuyunun ortasına veya kenarına (ilgi alanına bağlı olarak) 1 mL 5 μg/mL fibronektin ekleyin.
- Fibronektin çözeltisinin tüm ilgi çekici bölgeyi kapsadığından emin olmak için plakayı döndürün.
- % 95 hava / % 5 CO2altında nemlendirilmiş bir inkübatörde 37 ° C'de 30 dakika kuluçkaya yatır.
- Fibronektin çözeltisini kuyudan çıkarın ve PBS ile iki kez yıkayın. PBS'yi kuyudan tamamen çıkarın.
- Saklama halkasını, paslanmaz çelik modülü ve PDMS halkasını kuyudan çıkarın.
- Kuyunun ortasına veya kenarına (kaplamasız yüzey) %1,5 mL Pluronic F-127 ekleyin ve kaplamasız yüzeyi geçmek için oda sıcaklığında 1 saat kuluçkaya yaslayın.
- Pluronic F-127 çözeltisini kuyudan çıkarın ve PBS ile üç kez yıkayın.
- Kaplamalıyı hemen iyi kullanın veya kaplanmış kuyuda bir PBS tabakası ile iki haftaya kadar 4 °C'de saklayın.
3. HUVEC'lerin Tohumlama
- Deneyde 5.
- Tüm kültür ortamını çıkarın ve PBS ile hücreleri bir kez yıkayın.
- % 0.05 tripsin 3 mL ekleyin ve 37 ° C'de 3 dakika boyunca% 95 hava / % 5 CO2altında nemlendirilmiş bir inkübatörde kuluçkaya yaslanın. Hücreleri yerinden çıkarmak için şişeye hafifçe dokunun.
NOT: Bu protokol HUVEC'ler kullanılarak test edilmiştir ve tripin konsantrasyonu ve inkübasyon süresi diğer VC'ler için farklı olabilir. - Çözeltiyi 15 mL santrifüj tüpüne aktarın ve önceden 37 °C'ye kadar ısıtılmış 6 mL kültür ortamı (örneğin, Lonza EGM-2) kullanarak tripsin nötralize edin.
- 5 dakika boyunca 200 x g'da santrifüj. Nötralize tripsin çözeltisini çıkarın ve 1 mL önceden uyarılmış kültür ortamı ile hücreleri yeniden kullanın.
- Bir hemositometre kullanarak hücreleri sayın ve 180k hücrelerini 1,5 mL önceden uyarılmış kültür ortamında kaplanmış 6 kuyulu bir plakaya koyun.
- Hücrelerin kuyuda eşit şekilde dağılmasını sağlamak için kuyu plakasını yanal olarak sallayın.
- Bir gecede %95 hava/%5 CO2'nin altında 37 °C nemlendirilmiş inkübatörde bırakın.
- Eklenmemiş hücreleri ve kültür ortamını çıkarın ve 2mL önceden uyarılmış kültür ortamı ile değiştirin.
NOT: ortamda yüzen birçok eklenmemiş hücre beklenir.
4. Yörüngesel çalkalayıcı kullanarak kesme stresi uygulaması
- HUVEC'ler 3 günlük büyümeden sonra birleştiğine ulaşmalıdır. Ortamı 1,9 mL önceden ısıtılan kültür ortamıyla değiştirin (2 mm yüksekliğe ulaşmak için).
- Plakayı% 95 hava / % 5 CO 2 altında nemlendirilmiş bir inkübatöre bir yörünge çalkalayıcının platformuna yerleştirin ve3 gün boyunca 150 rpm'de döndürün.
NOT: Orbital çalkalayıcının dış yüzeyini inkübatöre yerleştirmeden önce %70 etanol kullanarak silin. - (İsteğe bağlı) 2 günlük kesmeden sonra, sitokinler ve kesme stresi arasındaki etkileşimi araştırmak için kültür ortamına sitokinler eklenebilir. Tedaviden sonra, hücreleri başka bir gün için kesin. Bu çalışmada hücreleri aktive etmek için TNF-α kullanılmıştır.
- 3 günlük kesme stresi uygulamasından sonra analizler gerçekleştirin.
5. Hücrelerin boyanma ve görüntülenmesi
- 3 günlük kesmeden sonra, plakayı inkübatörden çıkarın ve PBS ile hücreleri iki kez yıkayın.
- Kuyuya %4 PFA'nın 1,5 mL'sini ekleyerek hücreleri sabitlayın ve oda sıcaklığında 10 dakika kuluçkaya yatırın.
- %4 PFA'yı kuyudan çıkarın ve PBS ile iki kez yıkayın.
- Kuyuya % 0,1 Triton-X ekleyerek hücrelerin dengesini bozun ve oda sıcaklığında 5 dakika kuluçkaya yatırın.
- %0,1 Triton-X solüsyonunun kuyudan çıkarılması ve blokaj için kuyuya %1 BSA'nın 1,5 mL'lik kısmını ekleyin. Oda sıcaklığında 1 saat boyunca% 1 BSA ile hücreleri kuluçkaya yatırın.
- Tavşan anti-insan ZO-1 antikorunu% 1 BSA'da 1:200 seyreltmede seyreltin. Kuyuya 1,5 mL seyreltilmiş antikor ekleyin ve 4 °C'de bir gecede hücrelerle kuluçkaya yatırın.
- Gecelik inkübasyondan sonra, seyreltilmiş antikorun çıkarılmasının ve hücreleri PBS ile üç kez yıkaması.
- Pbs'de 1:300 seyreltmede Alexa Fluor 488 etiketli keçi anti-tavşan IgG ikincil antikorunu seyreltin. Kuyuya 1,5 mL seyreltilmiş ikincil antikor ekleyin ve oda sıcaklığında 1 saat boyunca hücrelerle kuluçkaya yatırın.
- Seyreltilmiş ikincil antikorları çıkarın ve hücreleri PBS ile iki kez yıkayın.
- DRAQ5'i PBS'de 1:1000 seyreltmede seyreltin. Kuyuya 1,5 mL seyreltilmiş DRAQ5 ekleyin ve hücre çekirdeğini lekelemek için oda sıcaklığında 15 dakika boyunca hücrelerle kuluçkaya yatırın.
- Seyreltilmiş DRAQ5'i çıkarın ve PBS ile üç kez yıkayın.
- Konfokal mikroskopla kenardan kuyunun ortasına karo taraması yapın.
6. Şekil indeksinin ve hücre sayısının nicelleştirilmesi
- MATLAB R2016a kullanarak görüntüleri yayınlayın.
- LIF dosyasını konfokal mikroskoptan MATLAB'a okuyun ve birleştirilmiş döşeme taramasını ikili bir görüntüye dönüştürün, ardından çekirdekleri arka plandan ayırmak için görüntüyü alana ve yoğunluğa göre eşik yapın.
- İkili karo taramasını 1 mm radyal parçalara bölün.
- Her bir çekirdeğe bir elips tak.
- Hücre numarası vermek için her radyal segmentteki elips sayısını sayın.
- Şekil dizinini = SI = 4π x Alan / Çevre2olarak tanımlayın. Her elips18için şekil dizinini hesaplayın.
Sonuçlar
HUVEC'lerin fibronektin ile kaplanmamış kuyu plakası bölgelerine yapışması Pluronic F-127 pasivasyonu ile kırıldı; büyüme, kesme stresi uygulaması ile ve olmadan 72 saat kültürden sonra bile fibronektin ile kaplanmış bölge ile sınırlıydı (Şekil 4A, Şekil 4C). Pluronic F-127 pasivasyonu olmadan, HUVEC'ler fibronektin olmadan yüzeye tutturuldu ve 72 saat kültürle daha da çoğaldı (Şekil 4B, Şekil 4D).
HUVEC'lerin hizalanması ve uzaması, HMUF'a sahip dönen bir kuyunun kenarında belirgindir, LMMF'ye sahip olan kuyunun merkezindeki hücreler bir parke taşı morfolojisi sergiler ve hizalama göstermez (Şekil 5A, Şekil 5B). HUVEC'lerin uzaması şekil indeksi olarak ölçüldü: 4π x Alan/Çevre2. 1 şekil dizini bir daireyi gösterirken, 0 değeri bir çizgiyi gösterir. Merkezden radyal mesafe ile şekil indeksi azaldı, parçalı ve tam kuyular arasında anlamlı bir fark yoktu. TNF-α tedavisi, tedavi edilmemiş kontrollere kıyasla HUVEC'lerin uzamasını artırmıştır (Şekil 5C). HMUF ayrıca her iki koşulda da LMMF'ye kıyasla mm2 başına HUVEC sayısını artırdı. HUVEC sayısı yarıçap boyunca mesafe ile kademeli olarak arttı. Segmentli ve tam kuyularda yetişen HUVEC sayısında anlamlı bir fark gözlenmedi (Şekil 6).

Şekil 1 Paslanmaz çelik modülün mühendislik çizimi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Boyutlar mm olarak mevcuttur.

Şekil 2 PDMS kalıbının mühendislik çizimi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Boyutlar mm olarak mevcuttur.
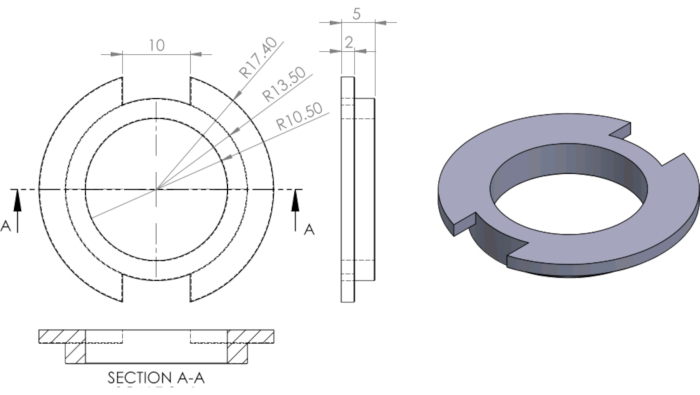
Şekil 3 Kuyuları segmentlere ayırırken kullanılan PDMS halkasının mühendislik çizimi. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Boyutlar mm olarak mevcuttur. Ghim ve ark.13'ten.

Şekil 4 Pluronic F-127'nin fibronektin kaplaması olmadan bölgeye insan göbek damarı endotel hücrelerinin (HUVEC) yapışıklıklarını önlediğini gösteren mikroskop görüntüleri. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen tıklayınız.
Kuyu yüzeyinin Pluronic F-127 ile pasivasyondan önce fibronektin ile önceden tedavi edilmemiş kısmına, 24 saat (A) ve 72 saat (C) büyümeden sonra hiçbir HUVEC bağlanmamıştır. Pluronic F-127 pasivasyonu olmadan, HUVEC'ler tohumlamadan 24 saat sonra fibronektin olmadan yüzeye tutturuldu (B) ve 72 saat (D) daha fazla çoğaldı. (Ölçek çubuğu = 500 μm). Ghim ve ark.13'ten.

Şekil 5 Parçalı veya tam bir kuyuda yamlu HUVEC'lerin morfolojisi. Bu rakamın daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Nükleer (kırmızı) leke, merkezde yamlu HUVEC'lerin (A) ve (B) tam bir kuyunun kenarında (ölçek çubuğu = 100 μm) morfolojisini gösterir. A ve B ayrıca ZO-1'in (yeşil) immünostainasyonu ile tanımlanmış hücre ana hatlarını gösterir. Uçtaki hücrelerin hizalanmasına ve uzamasına dikkat edin, ancak merkezde değil (C) Tam kuyularda yetişen HUVEC'ler ve parçalanmış kuyular arasında, işlenmemiş veya TNF-α tedavi edilen HUVEC için yuvarlaklığı gösteren nükleer şekil indeksinde önemli bir fark görülmedi. Hücreler kuyunun kenarına yakın daha uzundu. TNF-α tedavi edilen HUVEC'lerde daha fazla uzama eğilimi, konumlar arasında sürekli olarak önemli değildi. (İki yönlü ANOVA ve Bonferroni'nin geçici sonrası testi; n = 3). Bu rakam Ghim ve ark.13'ten değiştirilmiştir.

Şekil 6 Dönen bir kuyu plakasında radyal mesafe ile mm2 başına HUVEC sayısı artmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Farklı radyal konumlarda (A) işlenmemiş ve (B) TNF α işlem görmüş HUVEC'lerin yoğunluğunda tam ve parçalı kuyular arasında anlamlı bir fark gözlenmedi. Her iki durumda da, kenarda birim alan başına kuyunun merkezinden daha fazla hücre vardı. (İki yönlü ANOVA ve Bonferroni'nin geçici sonrası testi; n = 3). Bu rakam Ghim veark.
Tartışmalar
Dönen kuyu yöntemi, tek bir kuyuda karmaşık akış profilleri üretebilir - merkezde Düşük Büyüklükte Çok Yönlü Akış (LMMF) ve kuyunun kenarında Yüksek Büyüklükte Tek Eksenli Akış (HMUF). Bununla birlikte, çözünür aracılı kesme stresi salgıları dönen ortamda karıştırılacak ve tüm kuyudaki hücreleri etkileyecek ve belirli bir kesme stres profilinin hücreler üzerindeki gerçek etkisini maskeleyebilecektir.
Burada gösterilen kaplama yöntemi, hücrelerin büyümesini kuyunun belirli bir bölgesiyle sınırlayarak bu sorunun üstesinden gelir. Hücreler tipik olarak hidrofobik yüzeyler yerine hidrofilik yüzeylere bağlanır. Bu nedenle polistiren kültür gereci plazma oksidasyonu ile önceden tedavi edilir. Alternatif olarak, hidrofobik yüzeyler, bu protokolde gösterildiği gibi fibronektin gibi hücre dışı matris proteinleri ile kaplanabilir; fibronektin kaplamalı olmayan bölgeler, hidrofobik yüzeye artık yapıştırılma olmaması için Pluronic F-127 ile pasifleştirilmiştir.
Bu protokol, yazdırılan kalıbın doğruluğuna bağlıdır. 3D yazıcıya bağlı olarak, kalıbın tam boyutlarında değişiklik olabilir. Bu, son PDMS yapısını etkiler ve bu da hücrelerin kuyu içinde yanlış bir konuma yapışmasıyla sonuçlanır. Bu nedenle hücreler CFD tarafından modellenenden başka bir kesme stres profili yaşarlar. 3D yazıcı kullanmanın bir diğer dezavantajı, yazdırma sırasındaki büküm nedeniyle kalıbın düz olmayabileceğidir. Bu, Pluronic F-127'nin altına sızmasına izin vererek hücrelerin istenen konumlarda yapışmasını önleyen son PDMS yapısına neden olacaktır. Bu nedenle, kullanımdan önce sızıntıları kontrol etmek ve PDMS yapının boyutunu ölçmek çok önemlidir.
Bu yöntem, hücrelere belirli bir kesme stresi (HMUF veya LMMF) türünün uygulanmasına izin verme konusunda basit ancak etkilidir. Sarf malzemelerinin, reaktiflerin ve ekipmanların çoğu ticari olarak mevcut olduğu için kurulumu da uygundur. Bu yöntemin kullanılması sadece iyi tanımlanmış akışlara maruz kalan hücrelerin incelenmesine veya toplanmasına izin vermekle kalmaz, aynı zamanda bu hücreler tarafından koşullandırılmış ortamın toplanmasına da izin verir. Yöntem endotel mekanobiyolojisini araştıran yeni bir yol sağlar.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, İngiliz Kalp Vakfı proje hibesini (PDW'ye), Ulusal Tıbbi Araştırma Konseyi Singapur TAAP ve DYNAMO Hibesini (XW, NMRC/OFLCG/004/2018, NMRC/OFLCG/001/2017), A*STAR Lisansüstü Bursu (KTP'ye) ve İngiliz Kalp Vakfı Araştırma Mükemmelliği Merkezi öğrenciliğini (MA'ya) minnetle kabul etmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Cell and Media | |||
| Endothelial Growth Medium (EGM-2) | Lonza | cc-3162 | |
| Human Umbilical Vein Endothelial Cells | NA | NA | Isolated from cords obtained from donors with uncomplicated labour at the Hammersmith Hospital |
| Reagents and Materials | |||
| Alexa Fuor 488-labelled goat anti-rabbit IgG | Thermofisher Scientific | A11008 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Falcon 6 Well Clear Flat Bottom Not Treated | Scientific Laboratory Supplies Ltd | 351146 | |
| Fibronectin from Bovine Plasma | Sigma-Aldrich | F1141-5MG | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537-6X500ML | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Recombinant Human TNF-a | Peprotech | 300-01A | |
| RS PRO 2.85 mm Black PLA 3D Printer Filament, 1 kg | RS | 832-0264 | |
| Stainless Steel 316 | Metal Supermarket | NA | |
| Sylgard184 Silicone Elastomer kit | Farnell | 101697 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Zonula Occludens-1 (ZO-1) antibody | Cell Signaling Technology | 13663 | |
| DRAQ5 (5mM) | Bio Status | DR50200 | |
| Equipments | |||
| Grant Orbital Shaker PSU-10i | Scientific Laboratory Supplies Ltd | SHA7930 | |
| Leica TCS SP5 Confocal Microscope | Leica | NA | |
| Retaining Ring Pliers | Misumi | RTWP32-58 | |
| Retaining Rings/Internal/C-Type | Misumi | RTWS35 | |
| Ultimaker 2+3-D printer | Ultimaker | NA | |
| Softwares | |||
| Cura 2.6.2 | Ultimaker | NA | |
| MATLAB | The MathWorks | NA | |
| Solidworks 2016 | Dassault Systemes | NA |
Referanslar
- Hahn, C., Schwartz, M. A. Mechanotransduction in vascular physiology and atherogenesis. Nature Reviews Molecular Cell Biology. 10 (1), 53-62 (2009).
- Wang, C., Baker, B. M., Chen, C. S., Schwartz, M. A. Endothelial Cell Sensing of Flow Direction. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (9), 2130-2136 (2013).
- Tzima, E., et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress. Nature. 437, 426-431 (2005).
- Potter, C. M. F., Schobesberger, S., Lundberg, M. H., Weinberg, P. D., Mitchell, J. A., Gorelik, J. Shape and compliance of endothelial cells after shear stress in vitro or from different aortic regions: Scanning ion conductance microscopy study. PLoS ONE. 7 (2), 1-5 (2012).
- Asakura, T., Karino, T. Flow Patterns and Spatial Distribution of Atherosclerotic Lesions in Human. Circulation Research. 66 (4), 1045-1067 (1990).
- Bond, A. R., Iftikhar, S., Bharath, A. A., Weinberg, P. D. Morphological evidence for a change in the pattern of aortic wall shear stress with age. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 543-550 (2011).
- Giddens, D. P., Zarins, C. K., Glagov, S. The role of fluid mechanics in the localization and detection of atherosclerosis. Journal of biomechanical engineering. 115, 588-594 (1993).
- Schnittler, H. J., Franke, R. P., Akbay, U., Mrowietz, C., Drenckhahn, D. Improved in vitro rheological system for studying the effect of fluid shear stress on cultured cells. The American journal of physiology. 265, 289-298 (1993).
- Levesque, M. J., Nerem, R. M. The elongation and orientation of cultured endothelial cells in response to shear stress. Journal of biomechanical engineering. 107 (4), 341-347 (1985).
- Chiu, J., et al. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. Journal of Biomechanics. 36 (12), 1883-1895 (2003).
- Venugopal Menon, N., et al. A tunable microfluidic 3D stenosis model to study leukocyte-endothelial interactions in atherosclerosis. APL Bioengineering. 2 (1), 016103 (2018).
- Warboys, C. M., Ghim, M., Weinberg, P. D. Understanding mechanobiology in cultured endothelium: A review of the orbital shaker method. Atherosclerosis. 285, 170-177 (2019).
- Ghim, M., Pang, K. T., Arshad, M., Wang, X., Weinberg, P. D. A novel method for segmenting growth of cells in sheared endothelial culture reveals the secretion of an anti-inflammatory mediator. Journal of Biological Engineering. 12 (1), 15 (2018).
- Sage, H., Pritzl, P., Bornstein, P. Secretory phenotypes of endothelial cells in culture: comparison of aortic, venous, capillary, and corneal endothelium. Arteriosclerosis. 1 (6), 427-442 (1981).
- Tunica, D. G., et al. Proteomic analysis of the secretome of human umbilical vein endothelial cells using a combination of free-flow electrophoresis and nanoflow LC-MS/MS. Proteomics. 9, 4991-4996 (2009).
- Griffoni, C., et al. Modification of proteins secreted by endothelial cells during modeled low gravity exposure. Journal of Cellular Biochemistry. 112, 265-272 (2011).
- Ghim, M., et al. Visualization of three pathways for macromolecule transport across cultured endothelium and their modification by flow. American Journal of Physiology-Heart and Circulatory Physiology. 313 (5), 959-973 (2017).
- Levesque, M. J., Liepsch, D., Moravec, S., Nerem, R. M. Correlation of endothelial cell shape and wall shear stress in a stenosed dog aorta. Arteriosclerosis: An Official Journal of the American Heart Association, Inc. 6 (2), 220-229 (1986).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır