Method Article
Segmentación Del Crecimiento De Las Células Endoteliales En Placas De 6 Pozos En Una Coctelera Orbital Para Estudios Mecanobiológicos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método de recubrimiento para restringir el crecimiento de células endoteliales a una región específica de una placa de 6 pozos para la aplicación de esfuerzo de cizalladura utilizando el modelo de agitador orbital.
Resumen
La tensión del esquileo impuesta en la pared arterial por el flujo de sangre afecta a morfología y a la función endoteliales de la célula. Las tensiones de esquileo de baja magnitud, oscilatorias y multidireccionales se han postulado para estimular un fenotipo favorable-aterosclerótico en células endoteliales, mientras que la alta magnitud y el esquileo unidireccional o uniaxial se piensan para promover homeostasis endotelial. Estas hipótesis requieren la posterior investigación, pero las técnicas ines vitro tradicionales tienen limitaciones, y son particularmente pobres en la imposición de tensiones multidireccionales del esquilamiento en células.
Un método que está ganando uso cada vez mayor es cultivar células endoteliales en placas estándar de múltiples pozos en la plataforma de una coctelera orbital; en este método simple, de bajo costo, de alto rendimiento y crónico, el medio de remolino produce diferentes patrones y magnitudes de cizallamiento, incluida la cizalladura multidireccional, en diferentes partes del pozo. Sin embargo, tiene una limitación significativa: las células de una región, expuestas a un tipo de flujo, pueden liberar mediadores en el medio que afectan a las células en otras partes del pozo, expuestas a diferentes flujos, distorsionando así la relación aparente entre el flujo y el fenotipo.
Aquí presentamos una modificación fácil y asequible del método que permite que las células se expongan sólo a características específicas de esfuerzo de cizalladura. La siembra celular se restringe a una región definida del pozo mediante el recubrimiento de la región de interés con fibronectina, seguida de pasivación con solución pasivante. Posteriormente, las placas se pueden arremolinar en el agitador, lo que resulta en la exposición de las células a perfiles de cizallamiento bien definidos, como la cizalladura multidireccional de baja magnitud o la cizalladura uniaxial de alta magnitud, dependiendo de su ubicación. Como antes, el uso de plastificaciones estándar de cultivo celular permite un análisis adicional directo de las células. La modificación ya ha permitido la demostración de mediadores solubles, liberados del endotelio bajo características definidas de esfuerzo de cizalladura, que afectan a las células ubicadas en otras partes del pozo.
Introducción
Las respuestas de las células vasculares a su entorno mecánico son importantes en el funcionamiento normal de los vasos sanguíneos y en el desarrollo de la enfermedad1. La mecanobiología de las células endoteliales (CE) que recubre la superficie interior de todos los vasos sanguíneos ha sido un foco particular de la investigación mecanobiológica porque los CE experimentan directamente el estrés de cizallamiento generado por el flujo sanguíneo sobre ellos. Diversos cambios fenotípicos como las respuestas inflamatorias, la alteración de la rigidez y la morfología, la liberación de sustancias vasoactivas y la localización y expresión de proteínas de unión dependen de la exposición de la CE al estrés de cizallamiento2,3,4. Las propiedades endoteliales dependientes del cizalladura también pueden explicar el desarrollo irregular de enfermedades como la aterosclerosis5,6,7.
Es útil estudiar el efecto de la cizalladura sobre los CE en cultivo, donde las tensiones pueden ser controladas, y los CE pueden ser aislados de otros tipos de células. Los dispositivos in vitro comúnmente utilizados para aplicar tensión de cizalladura a los CE incluyen la cámara de flujo de placa paralela y el viscosímetro de cono y placa, pero solo se puede aplicar un flujo uniaxial constante, oscilatorio y pulsátil8,9. Aunque se han desarrollado cámaras de flujo modificadas con geometrías cónicas o ramificadas y chips microfluídicos que imitan una geometría estenótica, su bajo rendimiento y la duración relativamente corta del cultivo que es posible plantean un desafío10, 11.
El método de coctelera orbital (o pozo de remolino) para el estudio de la mecanotransducción endotelial, en la que las células se cultivan en utensilios de plástico de cultivo celular estándar colocados en la plataforma de una coctelera orbital, está ganando cada vez más atención porque es capaz de imponer crónicamente patrones de tensión de cizallamiento complejos y espacialmente variables en ces con alto rendimiento (véase la revisión de Warboys et al.12). Las simulaciones de dinámica de fluidos computacional (CFD) se han empleado para caracterizar la variación espacial y temporal de la tensión de cizalladura en un pozo girando. El movimiento de remolino del medio de cultivo causado por el movimiento orbital de la plataforma agitadora en la que se coloca la placa conduce a flujo multidireccional de baja magnitud (LMMF, o flujo supuestamente pro-aterogénico) en el centro y flujo uniaxial de alta magnitud (HMUF, o flujo supuestamente ateroprotector) en el borde de los pozos de una placa de 6 pozos. Por ejemplo, la tensión de cizalladura de pared promediada en el tiempo (TAWSS) es de aproximadamente 0,3 Pa en el centro y de 0,7 Pa en el borde de una placa de 6 pozos arremolinada a 150 rpm con un radio orbital de 5 mmde 13. El método requiere sólo utensilios de plástico disponibles comercialmente y la coctelera orbital en sí.
Hay, sin embargo, un inconveniente en el método (y en otros métodos de imposición de flujos in vitro): los CE liberan mediadores solubles y micropartículas de manera dependiente del cizallamiento14,15,16 y este secretoma puede afectar a los CE en regiones del pozo distintas de aquella en la que se liberaron, debido a la mezcla en el medio girante. Esto puede enmascarar los efectos reales de la tensión del esquilés sobre fenotipo de la EC. Por ejemplo, Ghim et al. han especulado que esto explica la influencia aparentemente idéntica de diferentes perfiles de cizalladura en el transporte transcelular de partículas grandes17.
Aquí se describe un método para promover la adhesión de células endoteliales de la vena umbilical humana (HUVEC) en regiones específicas de una placa de 6 pozos utilizando recubrimiento de fibronectina durante el uso de Pluronic F-127 para pasivar la superficie y prevenir el crecimiento en otros lugares. El método resuelve la limitación descrita anteriormente porque, al segmentar el crecimiento celular, los CE experimentan solo un tipo de perfil de cizallamiento, y no están influenciados por secretomas de CE expuestos a otros perfiles en otras partes del pozo.
Protocolo
1. Fabricación de dispositivos y preparación de reactivos
- Fabricación de módulos de acero inoxidable
- Fabrique el módulo de acero inoxidable de un acero inoxidable de grado 316 utilizando una fresadora CNC de acuerdo con el dibujo de ingeniería proporcionado (Figura 1).
- Impresión 3D de un molde de polidimetilsiloxano (PDMS)
- Prepare un modelo de diseño asistido por ordenador (CAD) 3D del molde PDMS utilizando SolidWorks de acuerdo con el dibujo de ingeniería proporcionado (Figura 2).
- Exporte el modelo CAD a un archivo STL e importe el archivo STL a Cura 2.6.2.
- Rebanar el modelo en capas con una velocidad de impresión de 50 mm/s y una densidad de relleno del 60%.
- Exporte el archivo como un código G y cárguelo en una impresora 3D Ultimaker2 para imprimirlo. Utilice ácido poliláctico (PLA) como material de impresión.
- Fundición del anillo PDMS
- Mezcle la base de PDMS y el agente de curado (ambos de un kit de elastómero de silicona) con la proporción de 90.9% base y 9.1% de agente de curado.
- Vierta aproximadamente 2,6 mL de la solución bien mezclada en el molde impreso en 3D.
- Retire las burbujas en una cámara de desgasificación al vacío.
- Curarlo durante 1 h en un horno de 80 °C.
- Deje que el anillo PDMS se enfríe a temperatura ambiente y, a continuación, retire el anillo PDMS curado cuidadosamente del molde. El dibujo de ingeniería del anillo PDMS se muestra en la Figura 3.
- Preparación de 1% Pluronic F-127
- Pesar 5 g de Pluronic F-127, verterlo en una botella de vidrio, luego añadir 100 ml de agua estéril en la botella de vidrio. Esto da una solución pluronic F-127 al 5%.
- Asegúrese de que todo el polvo Pluronic F-127 esté sumergido en el agua, cierre la tapa y autoclave utilizando un programa de ciclo de esterilización líquida.
- Después del autoclave, deje que la solución se enfríe a temperatura ambiente antes de su uso.
- Añadir 10 mL de solución Pluronic F-127 al 5% a 40 mL de agua estéril en autoclave para hacer una solución Pluronic F-127 al 1%. Realice la dilución en una campana de gabinete de bioseguridad (BSC).
- Guarde tanto 1% como 5% Pluronic F-127 a temperatura ambiente.
- Preparación de paraformadehído al 4% (PFA)
- Añadir 800 mL de solución salina tamponada con fosfato (PBS) a un vaso de precipitados de vidrio y calentarlo a 60 °C mientras se agita (mantener la agitación de la etapa 1.5.1 a 1.5.5).
- Pesar 40 g de polvo de PFA y añadirlo a la solución de PBS caliente.
PRECAUCIÓN: PFA es peligroso, realice los pasos 1.5.2 a 1.5.6 en una campana extractora de humos. - Agregue 1 M de hidróxido de sodio (NaOH) lentamente gota a gota en la solución de PFA hasta que las soluciones se despejen.
- Ajuste el pH de la solución de PFA a aproximadamente 7,4 con 1 M de ácido clorhídrico (HCl).
- Recarga la solución a 1 L con 1X PBS. Esto da 1 L de 4% PFA.
- Filtre la solución PFA con filtros de 0,2 μm para eliminar cualquier partícula, alícuota y congelar en un congelador de -20 °C.
- Preparación de 0.1% Triton-X
- Añadir 50 μL de Tritón-X puro en 50 mL de PBS para hacer una solución de Tritón-X al 0,1%.
- Preparación de albúmina sérica bovina al 1% (BSA)
- Pesar 0,5 g de BSA, verterlo en un tubo de centrífuga de 50 mL, y luego añadir 50 mL de PBS en el tubo.
- Dejar rodar durante 1 h a temperatura ambiente sobre un rodillo para disolverlo.
- Conservar 1% BSA a 4 °C durante un máximo de dos semanas.
2. Recubrimiento de una placa de 6 pozos
- Módulo de acero inoxidable de autoclave, anillo PDMS y pinzas antes de su uso. Realice todos los procedimientos posteriores en una campana BSC y observe técnicas asépticas para asegurar esterilidad.
- Coloque el anillo PDMS en un pozo de 6 pozos con pinzas. Utilice el borde externo del anillo PDMS para alinear el anillo PDMS de forma concéntrica con el pozo.
NOTA: Sólo se deben utilizar placas de pozos tratados con cultivo no tisular. - Coloque el módulo de acero inoxidable en la parte superior del anillo PDMS usando pinzas.
- Inserte las puntas de los alicates internos del anillo de retención en los orificios de agarre del anillo de retención, apriete el soporte para reducir el diámetro del anillo de retención. Encajándolo en el pozo de 6, presione firmemente en el módulo de acero inoxidable y suelte los alicates para asegurar el anillo PDMS en el pozo.
- Agregue 1 mL de fibronectina de 5 μg/mL en el centro o el borde del pozo (dependiendo de la región de interés) a través de la apertura del anillo PDMS y el módulo de acero inoxidable.
- Gire la placa para asegurarse de que la solución de fibronectina cubre toda la región de interés.
- Incubar durante 30 min a 37 °C en una incubadora humidificada bajo 95% aire/5%CO2.
- Retire la solución de fibronectina del pozo y lave dos veces con PBS. Retire completamente el PBS del pozo.
- Retire el anillo de retención, el módulo de acero inoxidable y el anillo PDMS del pozo.
- Añadir 1,5 mL de Pluronic F-127 al 1% en el centro o en el borde del pozo (superficie sin recubrimiento) e incubar durante 1 h a temperatura ambiente para pasivar la superficie sin recubrimiento.
- Retire la solución Pluronic F-127 del pozo y lave tres veces con PBS.
- Use el pozo recubierto inmediatamente o guárdelo a 4 °C durante un hasta dos semanas con una capa de PBS en el pozo recubierto.
3. Siembra de HUVECs
- Utilice HUVECs debajo del pasaje 5 en el experimento.
- Retire todo el medio de cultivo y lave las células una vez con PBS.
- Añadir 3 mL de tripsina al 0,05% e incubar durante 3 min a 37 °C en una incubadora humidificada bajo 95% de aire/5% deCO2. Toque suavemente el matraz para desalojar las células.
NOTA: Este protocolo ha sido probado usando HUVECs y la concentración de tripsina y su tiempo de incubación pueden ser diferentes para otro tipo de CE. - Transfiera la solución a un tubo centrífugo de 15 mL y neutralice la tripsina utilizando 6 mL de medio de cultivo (por ejemplo, Lonza EGM-2) precalentado a 37 °C.
- Centrífuga a 200 x g durante 5 min. Retire la solución de tripsina neutralizada y las células resuspend con 1 mL de medio de cultivo precalcinado.
- Cuente las células usando un hemocitómetro y sed las células 180k en una placa recubierta de 6 pozos en 1.5 mL de medio de cultivo precalcinado.
- Agite la placa del pozo lateralmente para asegurarse de que las células se distribuyan uniformemente en el pozo.
- Déjelo en una incubadora humidificada de 37 °C bajo 95% de aire/5% de CO2 durante la noche.
- Retire las células no unidas y el medio de cultivo y reemplácelo con 2 mL de medio de cultivo precalentado.
Nota : se esperan muchas celdas no adjuntas que flotan en el medio.
4. Aplicación de tensión de cizalladura utilizando una coctelera orbital
- Los HUVECs deben alcanzar la confluencia después de 3 días de crecimiento. Substituya el medio por 1,9 mL de medio de cultivo preguerra (para alcanzar una altura de 2 mm).
- Coloque la placa en la plataforma de una coctelera orbital en una incubadora humidificada bajo 95% de aire/5% de CO2 y gire a 150 rpm durante 3 días.
NOTA: Limpie la superficie exterior de la coctelera orbital con etanol al 70% antes de colocarla en la incubadora. - (Opcional) Después de 2 días de cizallamiento, los cytokines se pueden agregar al medio de cultivo para investigar la interacción entre los cytokines y la tensión del esquileo. Después del tratamiento, cizalla las células para otro día. En este estudio, el TNF-α fue utilizado para activar las células.
- Realizar análisis después de 3 días de aplicación de esfuerzo de cizalladura.
5. Tinción e imágenes de células
- Después de 3 días de cizalladura, retire la placa de la incubadora y lave las células dos veces con PBS.
- Fije las células agregando 1.5 mL de PFA al 4% en el pozo e incube durante 10 min a temperatura ambiente.
- Retire el PFA al 4% del pozo y lave dos veces con PBS.
- Permeabilizar las células añadiendo 0,1% de Tritón-X en el pozo e incubar durante 5 min a temperatura ambiente.
- Retire la solución tritón-X al 0,1% del pozo y agregue 1,5 mL de BSA al 1% en el pozo para bloquearla. Incubar las células con BSA al 1% durante 1 h a temperatura ambiente.
- Diluya el anticuerpo anti-humano ZO-1 del conejo en una dilución 1:200 en el 1% BSA. Añadir 1,5 mL de anticuerpo diluido en el pozo e incubarlo con las células durante la noche a 4 °C.
- Después de la incubación durante la noche, retire el anticuerpo diluido y lave las células tres veces con PBS.
- Diluya el anticuerpo secundario IgG anti-conejo de cabra etiquetado con Alexa Fluor 488 a una dilución de 1:300 en PBS. Añadir 1,5 mL de anticuerpo secundario diluido en el pozo e incubarlo con las células durante 1 h a temperatura ambiente.
- Retire el anticuerpo secundario diluido y lave las células dos veces con PBS.
- Diluir DRAQ5 a una dilución de 1:1000 en PBS. Añadir 1,5 mL de DRAQ5 diluido en el pozo e incubarlo con las células durante 15 min a temperatura ambiente para teñir los núcleos celulares.
- Retiramos el DRAQ5 diluido y lavamos tres veces con PBS.
- Realice un escaneo de baldosas desde el borde hasta el centro del pozo con un microscopio confocal.
6. Cuantificación del índice de forma y el número de celdas
- Postprocese las imágenes utilizando MATLAB R2016a.
- Lea el archivo LIF del microscopio confocal en MATLAB y convierta el escaneo de teselas combinado en una imagen binaria, luego calcule el umbral de la imagen por área e intensidad para distinguir los núcleos del fondo.
- Subdivida el escaneo de teselas binarias en segmentos radiales de 1 mm.
- Ajuste una elipse a cada núcleo individual.
- Cuente el número de elipses dentro de cada segmento radial para dar un número de celda.
- Definir el índice de forma = como SI = 4π x Área / Perímetro2. Calcular el índice de forma para cada elipse18.
Resultados
La adherencia de HUVECs a las regiones de la placa bien no revestida con fibronectin fue abrogada por la pasivación plurónica F-127; el crecimiento se limitó a la región recubierta de fibronectina incluso después de 72 h de cultivo, con y sin aplicación de esfuerzo de cizalladura(Figura 4A, Figura 4C). Sin la pasivación Pluronic F-127, los HUVECs se unieron a la superficie sin fibronectina y habían proliferado aún más por 72 h de cultivo(Figura 4B, Figura 4D).
La alineación y elongación de los HUVECs son evidentes en el borde de un pozo giratorio, que tiene HMUF, mientras que las células en el centro del pozo, que tiene LMMF, exhibieron una morfología de adoquín y ninguna alineación(Figura 5A, Figura 5B). El alargamiento de huvecs se cuantificó como índice de forma: 4π x Área/Perímetro2. Un índice de forma de 1 indica un círculo, mientras que un valor de 0 indica una línea. El índice de forma disminuyó con la distancia radial desde el centro, y no hubo diferencia significativa entre los pozos segmentados y llenos. El tratamiento con TNF-α aumentó el alargamiento de los HUVECs en comparación con los controles no tratados (Figura 5C). HMUF también aumentó el número de HUVECs por mm2 en comparación con LMMF en ambas condiciones. El número de HUVECs aumentó gradualmente con distancia a lo largo del radio. No se observó diferencia significativa en el número de HUVECs cultivados en pozos segmentados y llenos (Figura 6).

Figura 1 Dibujo de ingeniería del módulo de acero inoxidable. Haga clic aquí para ver una versión más grande de esta figura.
Las dimensiones están en mm.

Figura 2 Dibujo de ingeniería del molde PDMS. Haga clic aquí para ver una versión más grande de esta figura.
Las dimensiones están en mm.
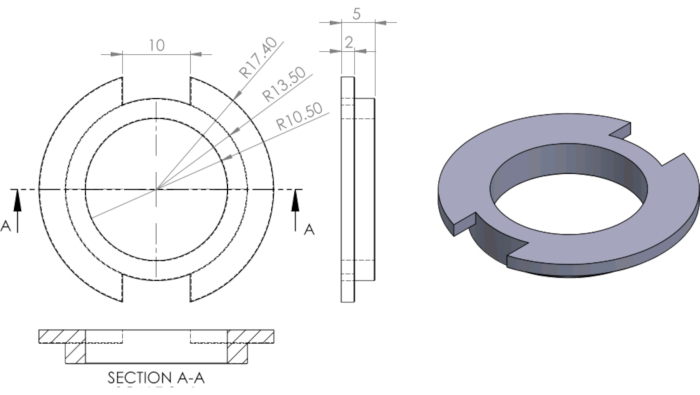
Figura 3 Dibujo de ingeniería del anillo PDMS utilizado para segmentar los pozos. Haga clic aquí para ver una versión más amplia de esta figura.
Las dimensiones están en mm. De Ghim et al.13.

Figura 4 Imágenes del microscopio que muestran que Pluronic F-127 previno la adhesión de las células endoteliales de la vena umbilical humana (HUVECs) a la región sin recubrimiento de fibronectina. Haga clic aquí para ver una versión más amplia de esta figura.
No se adjuntó ningunos HUVECs a la parte de la superficie del pozo que no había sido pre-tratada con fibronectin antes de la pasivación con Pluronic F-127, después de 24 h(a)y 72 h(c)del crecimiento. Sin la pasivación plurónica F-127, HUVECs fue atado a la superficie sin el fibronectin 24 h después de la siembra(b)y había proliferado más lejos por 72 h(d). (Barra de escala = 500 μm). De Ghim et al.13.

Figura 5 La morfología de los HUVECs cizallados en un pozo segmentado o lleno. Haga clic aquí para ver una versión más grande de esta figura.
La tinción nuclear (roja) muestra la morfología de los HUVECs cizallados (A) en el centro y (B) en el borde de un pozo lleno (barra de escala = 100 μm). A y B también muestran contornos celulares, delineados por inmunotensación de ZO-1 (verde). Nótese la alineación y elongación de las células en el borde pero no en el centro (C) No se observó ninguna diferencia significativa en el índice de forma nuclear, que indica redoplicación, entre huvecs cultivados en pozos llenos y pozos segmentados para HUVEC no tratado o TNF-α tratado. Las células eran más alargadas cerca del borde del pozo. Una tendencia para el mayor alargamiento en HUVECs TNF-α-tratado no era constantemente significativa a través de localizaciones. (ANOVA bidireccional y prueba post hoc de Bonferroni; n = 3). Esta cifra ha sido modificada de Ghim et al.13

Figura 6 El número de HUVECs por mm2 aumentó con la distancia radial en una placa de pozo girando. Haga clic aquí para ver una versión más amplia de esta figura.
No se observó ninguna diferencia significativa entre los pozos llenos y segmentados en la densidad de (A) huvecs no tratados y (B) TNF-α-tratados en diversas localizaciones radiales. En ambos casos, había más celdas por unidad de área en el borde que en el centro del pozo. (ANOVA bidireccional y prueba post hoc de Bonferroni; n = 3). Esta cifra ha sido modificada de Ghim et al13.
Discusión
El método de remolino-pozo es capaz de generar perfiles de flujo complejos en un solo pozo - Flujo multidireccional de baja magnitud (LMMF) en el centro y Flujo uniaxial de alta magnitud (HMUF) en el borde del pozo. Sin embargo, las secreciones mediadas por estrés de cizallamiento del mediador soluble se mezclarán en el medio de remolino y afectarán a las células en todo el pozo, potencialmente enmascarando el verdadero efecto de un perfil particular de esfuerzo de cizallamiento en las células.
El método de recubrimiento demostrado aquí supera este problema al restringir el crecimiento de las células a una región específica del pozo. Las células típicamente se unen a superficies hidrofílicas en lugar de a las hidrofóbicas. Por esta razón, la vajilla de cultivo de poliestireno se pretrata con oxidación plasmática. Alternativamente, las superficies hidrofóbicas se pueden revestir con las proteínas extracelulares de la matriz tales como fibronectin, según lo demostrado en este protocolo; las regiones revestidas no-fibronectin fueron pasivadas con Pluronic F-127 para prevenir cualquier adherencia residual a la superficie hidrofóbica.
Este protocolo depende de la precisión del molde impreso. Dependiendo de la impresora 3D, puede haber variación en las dimensiones exactas del molde. Esto afectará a la construcción final de PDMS, que a su vez dará como resultado que las celdas se adhieran en una ubicación incorrecta dentro del pozo. Por lo tanto, las células experimentarían un perfil de esfuerzo de cizalladura distinto al modelado por CFD. Otro inconveniente de usar una impresora 3D es que el molde puede no ser plano, debido a la deformación durante la impresión. Esto dará como resultado la construcción final de PDMS que permite que Pluronic F-127 se filtre debajo, evitando que las células se adhieran en las ubicaciones deseadas. Por lo tanto, es crucial comprobar si hay fugas y medir la dimensión de la construcción de PDMS antes de su uso.
Este método es simple pero eficaz para permitir la aplicación de un tipo específico de esfuerzo de cizalladura (HMUF o LMMF) a las células. También es conveniente configurar ya que la mayoría de los consumibles, reactivos y equipos están disponibles comercialmente. El uso de este método no sólo permite el examen o la recolección de células expuestas a flujos bien definidos, sino que permite la recolección de medios condicionados por esas células. El método proporciona una nueva vía que investiga la mecanobiología endotelial.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen una subvención para proyectos de la Fundación Británica del Corazón (a PDW), una beca TAAP y DYNAMO del Consejo Nacional de Investigación Médica de Singapur (a XW, NMRC/OFLCG/004/2018, NMRC/OFLCG/001/2017), una beca de posgrado A*STAR (a KTP) y una beca de estudiante del Centro de Excelencia en Investigación de la Fundación Británica del Corazón (a MA).
Materiales
| Name | Company | Catalog Number | Comments |
| Cell and Media | |||
| Endothelial Growth Medium (EGM-2) | Lonza | cc-3162 | |
| Human Umbilical Vein Endothelial Cells | NA | NA | Isolated from cords obtained from donors with uncomplicated labour at the Hammersmith Hospital |
| Reagents and Materials | |||
| Alexa Fuor 488-labelled goat anti-rabbit IgG | Thermofisher Scientific | A11008 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Falcon 6 Well Clear Flat Bottom Not Treated | Scientific Laboratory Supplies Ltd | 351146 | |
| Fibronectin from Bovine Plasma | Sigma-Aldrich | F1141-5MG | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537-6X500ML | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Recombinant Human TNF-a | Peprotech | 300-01A | |
| RS PRO 2.85 mm Black PLA 3D Printer Filament, 1 kg | RS | 832-0264 | |
| Stainless Steel 316 | Metal Supermarket | NA | |
| Sylgard184 Silicone Elastomer kit | Farnell | 101697 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Zonula Occludens-1 (ZO-1) antibody | Cell Signaling Technology | 13663 | |
| DRAQ5 (5mM) | Bio Status | DR50200 | |
| Equipments | |||
| Grant Orbital Shaker PSU-10i | Scientific Laboratory Supplies Ltd | SHA7930 | |
| Leica TCS SP5 Confocal Microscope | Leica | NA | |
| Retaining Ring Pliers | Misumi | RTWP32-58 | |
| Retaining Rings/Internal/C-Type | Misumi | RTWS35 | |
| Ultimaker 2+3-D printer | Ultimaker | NA | |
| Softwares | |||
| Cura 2.6.2 | Ultimaker | NA | |
| MATLAB | The MathWorks | NA | |
| Solidworks 2016 | Dassault Systemes | NA |
Referencias
- Hahn, C., Schwartz, M. A. Mechanotransduction in vascular physiology and atherogenesis. Nature Reviews Molecular Cell Biology. 10 (1), 53-62 (2009).
- Wang, C., Baker, B. M., Chen, C. S., Schwartz, M. A. Endothelial Cell Sensing of Flow Direction. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (9), 2130-2136 (2013).
- Tzima, E., et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress. Nature. 437, 426-431 (2005).
- Potter, C. M. F., Schobesberger, S., Lundberg, M. H., Weinberg, P. D., Mitchell, J. A., Gorelik, J. Shape and compliance of endothelial cells after shear stress in vitro or from different aortic regions: Scanning ion conductance microscopy study. PLoS ONE. 7 (2), 1-5 (2012).
- Asakura, T., Karino, T. Flow Patterns and Spatial Distribution of Atherosclerotic Lesions in Human. Circulation Research. 66 (4), 1045-1067 (1990).
- Bond, A. R., Iftikhar, S., Bharath, A. A., Weinberg, P. D. Morphological evidence for a change in the pattern of aortic wall shear stress with age. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 543-550 (2011).
- Giddens, D. P., Zarins, C. K., Glagov, S. The role of fluid mechanics in the localization and detection of atherosclerosis. Journal of biomechanical engineering. 115, 588-594 (1993).
- Schnittler, H. J., Franke, R. P., Akbay, U., Mrowietz, C., Drenckhahn, D. Improved in vitro rheological system for studying the effect of fluid shear stress on cultured cells. The American journal of physiology. 265, 289-298 (1993).
- Levesque, M. J., Nerem, R. M. The elongation and orientation of cultured endothelial cells in response to shear stress. Journal of biomechanical engineering. 107 (4), 341-347 (1985).
- Chiu, J., et al. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. Journal of Biomechanics. 36 (12), 1883-1895 (2003).
- Venugopal Menon, N., et al. A tunable microfluidic 3D stenosis model to study leukocyte-endothelial interactions in atherosclerosis. APL Bioengineering. 2 (1), 016103 (2018).
- Warboys, C. M., Ghim, M., Weinberg, P. D. Understanding mechanobiology in cultured endothelium: A review of the orbital shaker method. Atherosclerosis. 285, 170-177 (2019).
- Ghim, M., Pang, K. T., Arshad, M., Wang, X., Weinberg, P. D. A novel method for segmenting growth of cells in sheared endothelial culture reveals the secretion of an anti-inflammatory mediator. Journal of Biological Engineering. 12 (1), 15 (2018).
- Sage, H., Pritzl, P., Bornstein, P. Secretory phenotypes of endothelial cells in culture: comparison of aortic, venous, capillary, and corneal endothelium. Arteriosclerosis. 1 (6), 427-442 (1981).
- Tunica, D. G., et al. Proteomic analysis of the secretome of human umbilical vein endothelial cells using a combination of free-flow electrophoresis and nanoflow LC-MS/MS. Proteomics. 9, 4991-4996 (2009).
- Griffoni, C., et al. Modification of proteins secreted by endothelial cells during modeled low gravity exposure. Journal of Cellular Biochemistry. 112, 265-272 (2011).
- Ghim, M., et al. Visualization of three pathways for macromolecule transport across cultured endothelium and their modification by flow. American Journal of Physiology-Heart and Circulatory Physiology. 313 (5), 959-973 (2017).
- Levesque, M. J., Liepsch, D., Moravec, S., Nerem, R. M. Correlation of endothelial cell shape and wall shear stress in a stenosed dog aorta. Arteriosclerosis: An Official Journal of the American Heart Association, Inc. 6 (2), 220-229 (1986).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados