Method Article
Сегментирование роста эндотелиальных клеток в 6-луночных пластинах на орбитальном шейкере для механобиологических исследований
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает метод покрытия для ограничения роста эндотелиальных клеток определенной областью 6-луночной пластины для применения напряжения сдвига с использованием модели орбитального шейкера.
Аннотация
Напряжение сдвига, накладывало на артериальную стенку потоком крови, влияет на морфологию и функцию эндотелиальных клеток. Низкая величина, колебательные и разнонаправленные сдвиговые напряжения были постулированы для стимуляции проатеросклеротического фенотипа в эндотелиальных клетках, тогда как считается, что высокая величина и однонаправленный или одноосный сдвиг способствуют эндотелиальному гомеостазу. Эти гипотезы требуют дальнейшего изучения, но традиционные методы in vitro имеют ограничения и особенно плохо налагают разнонаправленные сдвиговые нагрузки на клетки.
Одним из методов, который получает все большее применение, является культивирования эндотелиальных клеток в стандартных многоскваженных пластинах на платформе орбитального шейкера; в этом простом, недорогом, высокопроизводительном и хроническом методе закручивающаяся среда производит различные узоры и величины сдвига, включая разнонаправленный сдвиг, в разных частях скважины. Однако он имеет существенное ограничение: клетки в одной области, подвергаясь воздействию одного типа потока, могут высвобождать медиаторы в среду, которые влияют на клетки в других частях скважины, подвергаясь воздействию различных потоков, тем самым искажая кажущуюся связь между потоком и фенотипом.
Здесь мы представляем простую и доступную модификацию метода, которая позволяет клеткам подвергаться воздействию только определенных характеристик напряжения сдвига. Посев клеток ограничивается определенной областью скважины путем покрытия интересующей области фибронектином с последующей пассивацией с использованием пассивационного раствора. Впоследствии пластины могут закручиваться на шейкере, что приводит к воздействию на клетки четко определенных профилей сдвига, таких как многонаправленный сдвиг низкой величины или одноосный сдвиг высокой величины, в зависимости от их местоположения. Как и прежде, использование стандартной пластиковой посуды для клеточных культур позволяет легко продолжить анализ клеток. Модификация уже позволила продемонстрировать растворимые медиаторы, высвобождаемые из эндотелия при определенных характеристиках сдвигового напряжения, которые влияют на клетки, расположенные в другом месте скважины.
Введение
Реакции сосудистых клеток на их механическую среду важны в нормальной функции кровеносных сосудов и в развитии заболевания1. Механобиология эндотелиальных клеток (ЭК), которые выстилают внутреннюю поверхность всех кровеносных сосудов, была в центре внимания механобиологических исследований, потому что ЭК непосредственно испытывают напряжение сдвига, создаваемое кровотоком над ними. Различные фенотипические изменения, такие как воспалительные реакции, измененная жесткость и морфология, высвобождение вазоактивных веществ, а также локализация и экспрессия соединительных белков зависят от воздействия EC на сдвиговое напряжение2,3,4. Сдвигозависимые эндотелиальные свойства могут также объяснять неоднородное развитие таких заболеваний, как атеросклероз5,6,7.
Полезно изучать влияние сдвига на ЭК в культуре, где стрессы можно контролировать, а ЭК можно выделить из других типов клеток. Обычно используемые устройства in vitro для применения напряжения сдвига к ЭК включают параллельно пластинчатую проточную камеру и конусно-пластинчатый вискозиметр, но может быть применен только одноосный устойчивый, колебательный и пульсирующий поток8,9. Хотя были разработаны модифицированные проточные камеры с конической или ветвящейся геометрией и микрофлюидные чипы, имитирующие стенотическую геометрию, их низкая пропускная способность и относительно короткая продолжительность культивирования, которая возможна, представляют собой проблему10, 11.
Орбитальный шейкер (или закручивающийся колодец) метод исследования эндотелиальной механотрансдукции, при котором клетки выращиваются в стандартной пластичной посуде для клеточных культур, помещенной на платформу орбитального шейкера, привлекает все большее внимание, поскольку он способен хронически накладывать сложные, пространственно изменяющиеся паттерны напряжения сдвига на ЭК с высокой пропускной способностью (см. обзор Warboys et al.12). Моделирование вычислительной гидродинамики (CFD) было использовано для характеристики пространственного и временного изменения напряжения сдвига в закрученной скважине. Закручивающееся движение культуральной среды, вызванное орбитальным движением шейкеровой платформы, на которой размещена плита, приводит к низкоразмерному многонаправленному потоку (LMMF, или мнимно проатерогенному потоку) в центре и одноосному потоку высокой величины (HMUF, или мнимому атеропротекторному потоку) на краю скважин 6-луночной пластины. Например, усредненное по времени напряжение сдвига стенки (TAWSS) составляет примерно 0,3 Па в центре и 0,7 Па на краю 6-луночной пластины, закрученной со скоростью 150 об/мин с радиусом орбиты 5 мм13. Метод требует только коммерчески доступной пластиковой посуды и самого орбитального шейкера.
Существует, однако, недостаток метода (и других методов наложения потоков in vitro): ЭК высвобождают растворимые медиаторы и микрочастицы в зависимости отсдвига14, 15,16, и этот секретом может влиять на ЭК в областях скважины, отличных от той, в которой они были высвобождаются, из-за перемешивания в закручивающейся среде. Это может маскировать фактическое влияние сдвигового стресса на фенотип EC. Например, Ghim et al. предположили, что это объясняет, по-видимому, идентичное влияние различных профилей сдвига на трансклеточный транспорт крупных частиц17.
Здесь мы описываем метод содействия адгезии эндотелиальных клеток пупочных вен человека (HUVEC) в определенных областях 6-скважинной пластины с использованием фибронектинового покрытия при использовании Pluronic F-127 для пассивации поверхности и предотвращения роста в других местах. Метод устраняет ограничение, описанное выше, поскольку, сегментируя рост клеток, ЭК испытывают только один вид профиля сдвига и не подвержены влиянию секретомов из ЭК, подвергающихся воздействию других профилей в других местах скважины.
протокол
1. Изготовление приборов и подготовка реагентов
- Изготовление модуля из нержавеющей стали
- Изготовить модуль из нержавеющей стали марки 316 с использованием фрезерного станка с ЧПУ в соответствии с предоставленным инженерным чертежом(рисунок 1).
- 3D-печать полидиметилсилоксановой (PDMS) формы
- Подготовьте 3D-модель автоматизированного проектирования (CAD) пресс-формы PDMS с помощью SolidWorks в соответствии с предоставленным инженерным чертежом(рисунок 2).
- Экспортируйте модель CAD в STL-файл и импортируйте STL-файл в Cura 2.6.2.
- Нарежьте модель на слои со скоростью печати 50 мм/с и плотностью заполнения 60%.
- Экспортируйте файл в виде G-кода и загрузите его на 3D-принтер Ultimaker2 для печати. Используйте полимолочную кислоту (PLA) в качестве печатного материала.
- Литье ПДМС кольца
- Смешайте основание PDMS и отверждающий агент (оба из набора силиконовых эластомера) с соотношением 90,9% основания и 9,1% отверждающего агента.
- Вылейте примерно 2,6 мл хорошо смешанного раствора в 3D-печатную форму.
- Удалите пузырьки в вакуумной дегазировке.
- Отверждать его в течение 1 ч в печи с 80 °C.
- Дайте кольцу PDMS остыть до комнатной температуры, затем осторожно извлеките отвержденное кольцо PDMS из формы. Инженерный чертеж кольца PDMS показан на рисунке 3.
- Подготовка 1% Pluronic F-127
- Взвесьте 5 г Pluronic F-127, налейте его в стеклянную бутылку, затем добавьте в стеклянную бутылку 100 мл стерильной воды. Это дает 5% раствор Pluronic F-127.
- Убедитесь, что весь порошок Pluronic F-127 погружен в воду, закройте крышку и автоклав, используя программу цикла жидкой стерилизации.
- После автоклава дайте раствору остыть до комнатной температуры перед использованием.
- Добавьте 10 мл 5% раствора Pluronic F-127 в 40 мл автоклавной стерильной воды, чтобы получить 1% раствор Pluronic F-127. Выполните разбавление в шкафу биобезопасности (BSC).
- Храните 1% и 5% Pluronic F-127 при комнатной температуре.
- Приготовление 4% параформальдегида (PFA)
- Добавьте 800 мл фосфатно-буферного физиологического раствора (PBS) в стеклянный стакан и нагрейте его до 60 °C во время перемешивания (продолжайте перемешивать со ступени 1.5.1 до 1.5.5).
- Взвесьте 40 г порошка PFA и добавьте его в теплый раствор PBS.
ВНИМАНИЕ: PFA опасен, выполните шаги 1.5.2 - 1.5.6 в вытяжном капоте. - Добавьте 1 М гидроксида натрия (NaOH) медленно по каплям в раствор PFA до тех пор, пока растворы не очистятся.
- Отрегулируйте рН раствора PFA примерно до 7,4 с 1 M соляной кислоты (HCl).
- Дополнить раствор до 1 л с 1X PBS. Это дает 1 л 4% PFA.
- Фильтруйте раствор PFA с помощью фильтров 0,2 мкм для удаления любых частиц, аликвоты и замораживания в морозильной камере с -20 °C.
- Приготовление 0,1% Тритон-Х
- Добавьте 50 мкл чистого Тритона-Х в 50 мл PBS, чтобы получить 0,1% раствор Тритон-Х.
- Препарат 1% бытового сывороточного альбумина (BSA)
- Взвесьте 0,5 г BSA, налейте его в 50 мл центрифужную трубку, а затем добавьте 50 мл PBS в трубку.
- Дайте ему свернуться в течение 1 ч при комнатной температуре на валике раствориться.
- Хранить 1% BSA при 4 °C в течение двух недель.
2. Покрытие 6-скважинной плиты
- Автоклавный модуль из нержавеющей стали, кольцо PDMS и пинцет перед использованием. Выполняйте все последующие процедуры в капюшоне BSC и соблюдайте асептические методы для обеспечения стерильности.
- Поместите кольцо PDMS в 6-ти ямку с помощью пинцетка. Используйте внешний край кольца PDMS, чтобы выровнять кольцо PDMS концентрически с колодезкой.
ПРИМЕЧАНИЕ: Следует использовать только хорошо обработанные пластины, не являющиеся тканевыми культурами. - Поместите модуль из нержавеющей стали поверх кольца PDMS с помощью пинцета.
- Вставьте кончики плоскогубцев внутреннего стопорного кольца в захватные отверстия стопорного кольца, сожмите держатель, чтобы уменьшить диаметр стопорного кольца. Вместите его в 6-лоток, плотно прижмите его к модулю из нержавеющей стали и отпустите плоскогубцы, чтобы закрепить кольцо PDMS в колодец.
- Добавьте 1 мл фибронектина 5 мкг/мл в центр или край скважины (в зависимости от интересующей области) через открытие кольца PDMS и модуля из нержавеющей стали.
- Закрутите пластину, чтобы убедиться, что раствор фибронектина покрывает всю интересуемую область.
- Инкубировать в течение 30 мин при 37 °C в увлажненный инкубатор под 95% воздуха /5% CO2.
- Достаньте раствор фибронектина из колодца и дважды промыть ПБС. Полностью удалите PBS из колодца.
- Извлеките из колодца стопорное кольцо, модуль из нержавеющей стали и кольцо PDMS.
- Добавьте 1,5 мл 1% Pluronic F-127 в центр или край скважины (поверхность без покрытия) и инкубируют в течение 1 ч при комнатной температуре, чтобы пассивировать поверхность без покрытия.
- Извлеките раствор Pluronic F-127 из колодца и трижды промойте PBS.
- Используйте хорошо покрытый сразу или храните его при 4 °C в течение двух недель со слоем PBS в покрытом колодце.
3. Посев HUVEC
- Используйте HUVECs ниже отрывка 5 в эксперименте.
- Удалите всю культурную среду и промыть клетки один раз PBS.
- Добавьте 3 мл 0,05% трипсина и инкубировать в течение 3 мин при 37 °C в увлажненный инкубатор под 95% воздуха / 5% CO2. Осторожно постучите по колбе, чтобы выбить клетки.
ПРИМЕЧАНИЕ: Этот протокол был протестирован с использованием HUVECs, и концентрация трипсина и время его инкубации могут отличаться для других типов ЭК. - Переложите раствор в центрифужную трубку 15 мл и нейтрализуйте трипсин, используя 6 мл питательной среды (например, Lonza EGM-2) предварительно разогрешенной до 37 °C.
- Центрифуга при 200 х г в течение 5 мин. Удалить нейтрализованный раствор трипсина и повторно суспендовать клетки 1 мл предварительной питательной среды.
- Подсчитайте клетки с помощью гемоцитометра и посейте 180k клеток в покрытую 6-скважинную пластину в 1,5 мл предварительной питательной среды.
- Встряхните пластину колодца сбоку, чтобы ячейки равномерно распределяли в колодец.
- Оставьте его в увлажненный инкубатор при 37 °C под 95% воздуха / 5% CO2 на ночь.
- Удалите неприкрепленные клетки и питательную среду и замените 2 мл предварительной питательной среды.
ПРИМЕЧАНИЕ: ожидается много неприсоединенных ячеек, плавающих в среде.
4. Применение напряжения сдвига с помощью орбитального шейкера
- HUVECs должны достичь слияния после 3 дней роста. Заменить среду 1,9 мл предварительной питательной среды (для достижения высоты 2 мм).
- Поместите пластину на платформу орбитального шейкера в увлажненный инкубатор под 95% воздуха/5% CO2 и вращайте ее при 150 об/мин в течение 3 дней.
ПРИМЕЧАНИЕ: Протрите внешнюю поверхность орбитального шейкера, используя 70% этанола, прежде чем поместить его в инкубатор. - (Необязательно) После 2 дней сдвига цитокины могут быть добавлены в культуральная среда для исследования взаимодействия между цитокинами и стрессом сдвига. После лечения срежют клетки еще на один день. В этом исследовании для активации клеток использовался α TNF..
- Выполняйте анализы после 3 дней применения напряжения сдвига.
5. Окрашивание и визуализация клеток
- После 3 дней сдвига снимите пластину из инкубатора и дважды промыть клетки PBS.
- Зафиксируйте клетки, добавив в колодец 1,5 мл 4% PFA и инкубируйте в течение 10 минут при комнатной температуре.
- Извлеките 4% PFA из колодца и дважды промыть PBS.
- Пермеабилизируют клетки, добавляя 0,1% Тритона-Х в скважину и инкубируют в течение 5 мин при комнатной температуре.
- Извлекают из скважины 0,1% раствор Тритона-Х и добавляют в скважину 1,5 мл 1% BSA для блокировки. Инкубируют клетки с 1% BSA в течение 1 ч при комнатной температуре.
- Разбавляют античеловеческое антитело к ZO-1 кролика в разведении 1:200 в 1% BSA. Добавьте 1,5 мл разбавленного антитела в колодец и инкубируют его с клетками в течение ночи при 4 °C.
- После ночной инкубации удалите разбавленные антитела и трижды промыть клетки PBS.
- Разбавлять alexa Fluor 488-меченое козье анти-кроликово-IgG вторичное антитело в разведении 1:300 в PBS. Добавьте в колодец 1,5 мл разбавленного вторичного антитела и инкубируют его с клетками в течение 1 ч при комнатной температуре.
- Удалите разбавленные вторичные антитела и дважды промыть клетки PBS.
- Разбавить DRAQ5 в разведении 1:1000 в PBS. Добавьте в колодец 1,5 мл разбавленного DRAQ5 и инкубируют его с клетками в течение 15 мин при комнатной температуре, чтобы окрасить ядра клеток.
- Удалите разбавленный DRAQ5 и трижды промойте PBS.
- Выполните сканирование плитки от края до центра колодца с помощью конфокального микроскопа.
6. Количественная оценка индекса формы и количества ячеек
- Пост-обработка изображений с помощью MATLAB R2016a.
- Прочитайте файл LIF с конфокального микроскопа в MATLAB и преобразуйте объединенное сканирование плитки в двоичное изображение, а затем порог изображения по площади и интенсивности, чтобы отличить ядра от фона.
- Подразделяют сканирование двоичной плитки на радиальные сегменты размером 1 мм.
- Подогнать эллипс к каждому отдельному ядру.
- Подсчитайте количество эллипсов в каждом радиальном сегменте, чтобы получить номер ячейки.
- Определите индекс формы = как SI = 4π x Площадь / Периметр2. Вычисление индекса фигуры для каждого эллипса18.
Результаты
Адгезия HUVEC к областям плиты скважины, не покрытым фибронектином, была отменена пассивацией Pluronic F-127; рост был ограничен областью, покрытой фибронектином, даже после 72 ч культуры, с применением и без применения сдвигового напряжения(Рисунок 4А, Рисунок 4С). Без пассивации Pluronic F-127 HUVEC прикреплялись к поверхности без фибронектина и размножались дальше на 72 ч культуры(рисунок 4B, рисунок 4D).
Выравнивание и удлинение HUVEC очевидны на краю закрученного колодца, который имеет HMUF, в то время как ячейки в центре скважины, которая имеет LMMF, показали морфологию булыжника и отсутствие выравнивания(рисунок 5A, рисунок 5B). Удлинение HUVEC было количественно определено как индекс формы: 4π x Площадь/Периметр2. Индекс фигуры 1 указывает на круг, тогда как значение 0 указывает на линию. Индекс формы уменьшался с радиальным расстоянием от центра, и не было существенной разницы между сегментированной и полной скважинами. Лечение TNF-α увеличение удлинения HUVEC по сравнению с необработанным контролем(рисунок 5C). HMUF также увеличил количество HUVEC намм2 по сравнению с LMMF в обоих условиях. Количество HUVEC постепенно увеличивалось с расстоянием по радиусу. Существенной разницы в количестве ХУВЭК, выращенных в сегментированных и полных скважинах, не наблюдалось(рисунок 6).

Рисунок 1 Инженерный чертеж модуля из нержавеющей стали. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Размеры в мм.

Рисунок 2 Технический чертеж пресс-формы PDMS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Размеры в мм.
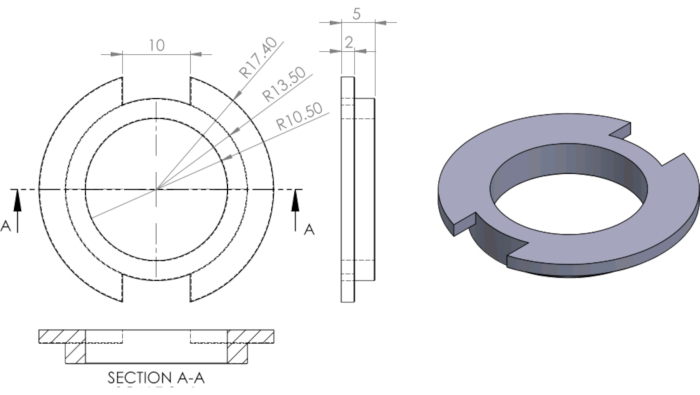
Рисунок 3 Инженерный чертеж кольца PDMS, используемого для сегментивки скважин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Размеры в мм. Из Гима и др.13.

Рисунок 4 Микроскопические изображения, показывающие, что Pluronic F-127 предотвращал адгезию эндотелиальных клеток пупочных вен человека (HUVECs) к области без фибронектинового покрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
К той части поверхности скважины, которая не была предварительно обработана фибронектином до пассивации плуроническим F-127, после 24 ч(A)и 72 ч(C)роста не были прикреплены HUVEC. Без пассивации Pluronic F-127 HUVEC прикреплялись к поверхности без фибронектина через 24 ч после посева(B)и размножались дальше на 72 ч(D). (Шкала = 500 мкм). Из Гима и др.13.

Рисунок 5 Морфология стриженных HUVEC в сегментированной или полной колодке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Ядерное (красное) пятно показывает морфологию стриженых HUVEC (A) в центре и (B) на краю полной скважины (шкала бар = 100 мкм). A и B также показывают клеточные очертания, очерченные иммуноокрашиванием ZO-1 (зеленый). Обратите внимание на выравнивание и удлинение ячеек на краю, но не в центре (C) Не было замечено существенной разницы в индексе ядерной формы, указывающей на округлость, между HUVEC, выращенными в полных скважинах, и сегментированными скважинами для необработанных или обработанных TNF-α HUVEC. Клетки были более вытянутыми у края колодца. Тенденция к большему удлинению в ХУВЕКах, обработанных ФНО-α, не была неизменно значимой в разных местах. (Двусторонний ANOVA и пост-хок бонферрони тест; n = 3). Эта цифра была изменена по сравнению с Ghim et al.13

Рисунок 6 Количество ХУВЕКов намм2 увеличивается с радиальным расстоянием в закручивающейся плите скважины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Не наблюдалось существенной разницы между полными и сегментированными скважинами в плотности (А) необработанных и (В) обработанных ФНО-α ХУВЭК в различных радиальных местах. В обоих случаях на единицу площади на краю было больше ячеек, чем в центре скважины. (Двусторонний ANOVA и пост-хок бонферрони тест; n = 3). Эта цифра была изменена по сравнению с Ghim et al13.
Обсуждение
Метод закрученной скважины способен генерировать сложные профили потока в одной скважине - низкоразмерный разнонаправленный поток (LMMF) в центре и одноосный поток высокой величины (HMUF) на краю скважины. Однако сдвиговые стресс-опосредованные выделения растворимого медиатора будут смешиваться в закручивающейся среде и влиять на клетки во всей скважине, потенциально маскируя истинное влияние определенного профиля напряжения сдвига на клетки.
Метод покрытия, продемонстрированный здесь, преодолевает эту проблему, ограничивая рост клеток определенной областью скважины. Клетки обычно прикрепляются к гидрофильным поверхностям, а не к гидрофобным. По этой причине полистирольная культуральная посуда предварительно обрабатывается плазменным окислением. Альтернативно, гидрофобные поверхности могут быть покрыты белками внеклеточного матрикса, такими как фибронектин, как показано в настоящем протоколе; области, покрытые нефибронектиновым покрытием, пассивировали Pluronic F-127 для предотвращения остаточной адгезии к гидрофобной поверхности.
Этот протокол зависит от точности печатной формы. В зависимости от 3D-принтера могут быть различия в точных размерах пресс-формы. Это повлияет на конечную конструкцию PDMS, что, в свою очередь, приведет к тому, что ячейки будут придерживаться неправильного местоположения внутри скважины. Таким образом, клетки будут испытывать профиль напряжения сдвига, отличный от того, который смоделировал CFD. Еще одним недостатком использования 3D-принтера является то, что форма может быть не плоской из-за деформации во время печати. Это приведет к окончательной конструкции PDMS, позволяющей Pluronic F-127 просачиваться под нее, предотвращая прилипание клеток в желаемых местах. Поэтому крайне важно проверить наличие утечек и измерить размер конструкции PDMS перед использованием.
Этот метод прост, но эффективен в том, что позволяет применять определенный тип напряжения сдвига (HMUF или LMMF) к клеткам. Это также удобно настроить, так как большинство расходных материалов, реагентов и оборудования коммерчески доступны. Использование этого метода не только позволяет обследовать или собирать клетки, подвергшиеся воздействию четко определенных потоков, но и позволяет собирать среду, обусловленную этими клетками. Метод обеспечивает новый путь исследования эндотелиальной механобиологии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы с благодарностью отмечают грант проекта Британского фонда сердца (PDW), грант Национального совета медицинских исследований Сингапура TAAP и DYNAMO (XW, NMRC / OFLCG / 004/2018, NMRC / OFLCG / 001/ 2017), стипендию A*STAR для выпускников (для KTP) и студенчество Британского центра исследований Сердца (для MA).
Материалы
| Name | Company | Catalog Number | Comments |
| Cell and Media | |||
| Endothelial Growth Medium (EGM-2) | Lonza | cc-3162 | |
| Human Umbilical Vein Endothelial Cells | NA | NA | Isolated from cords obtained from donors with uncomplicated labour at the Hammersmith Hospital |
| Reagents and Materials | |||
| Alexa Fuor 488-labelled goat anti-rabbit IgG | Thermofisher Scientific | A11008 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Falcon 6 Well Clear Flat Bottom Not Treated | Scientific Laboratory Supplies Ltd | 351146 | |
| Fibronectin from Bovine Plasma | Sigma-Aldrich | F1141-5MG | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537-6X500ML | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Recombinant Human TNF-a | Peprotech | 300-01A | |
| RS PRO 2.85 mm Black PLA 3D Printer Filament, 1 kg | RS | 832-0264 | |
| Stainless Steel 316 | Metal Supermarket | NA | |
| Sylgard184 Silicone Elastomer kit | Farnell | 101697 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Zonula Occludens-1 (ZO-1) antibody | Cell Signaling Technology | 13663 | |
| DRAQ5 (5mM) | Bio Status | DR50200 | |
| Equipments | |||
| Grant Orbital Shaker PSU-10i | Scientific Laboratory Supplies Ltd | SHA7930 | |
| Leica TCS SP5 Confocal Microscope | Leica | NA | |
| Retaining Ring Pliers | Misumi | RTWP32-58 | |
| Retaining Rings/Internal/C-Type | Misumi | RTWS35 | |
| Ultimaker 2+3-D printer | Ultimaker | NA | |
| Softwares | |||
| Cura 2.6.2 | Ultimaker | NA | |
| MATLAB | The MathWorks | NA | |
| Solidworks 2016 | Dassault Systemes | NA |
Ссылки
- Hahn, C., Schwartz, M. A. Mechanotransduction in vascular physiology and atherogenesis. Nature Reviews Molecular Cell Biology. 10 (1), 53-62 (2009).
- Wang, C., Baker, B. M., Chen, C. S., Schwartz, M. A. Endothelial Cell Sensing of Flow Direction. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (9), 2130-2136 (2013).
- Tzima, E., et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress. Nature. 437, 426-431 (2005).
- Potter, C. M. F., Schobesberger, S., Lundberg, M. H., Weinberg, P. D., Mitchell, J. A., Gorelik, J. Shape and compliance of endothelial cells after shear stress in vitro or from different aortic regions: Scanning ion conductance microscopy study. PLoS ONE. 7 (2), 1-5 (2012).
- Asakura, T., Karino, T. Flow Patterns and Spatial Distribution of Atherosclerotic Lesions in Human. Circulation Research. 66 (4), 1045-1067 (1990).
- Bond, A. R., Iftikhar, S., Bharath, A. A., Weinberg, P. D. Morphological evidence for a change in the pattern of aortic wall shear stress with age. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 543-550 (2011).
- Giddens, D. P., Zarins, C. K., Glagov, S. The role of fluid mechanics in the localization and detection of atherosclerosis. Journal of biomechanical engineering. 115, 588-594 (1993).
- Schnittler, H. J., Franke, R. P., Akbay, U., Mrowietz, C., Drenckhahn, D. Improved in vitro rheological system for studying the effect of fluid shear stress on cultured cells. The American journal of physiology. 265, 289-298 (1993).
- Levesque, M. J., Nerem, R. M. The elongation and orientation of cultured endothelial cells in response to shear stress. Journal of biomechanical engineering. 107 (4), 341-347 (1985).
- Chiu, J., et al. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. Journal of Biomechanics. 36 (12), 1883-1895 (2003).
- Venugopal Menon, N., et al. A tunable microfluidic 3D stenosis model to study leukocyte-endothelial interactions in atherosclerosis. APL Bioengineering. 2 (1), 016103 (2018).
- Warboys, C. M., Ghim, M., Weinberg, P. D. Understanding mechanobiology in cultured endothelium: A review of the orbital shaker method. Atherosclerosis. 285, 170-177 (2019).
- Ghim, M., Pang, K. T., Arshad, M., Wang, X., Weinberg, P. D. A novel method for segmenting growth of cells in sheared endothelial culture reveals the secretion of an anti-inflammatory mediator. Journal of Biological Engineering. 12 (1), 15 (2018).
- Sage, H., Pritzl, P., Bornstein, P. Secretory phenotypes of endothelial cells in culture: comparison of aortic, venous, capillary, and corneal endothelium. Arteriosclerosis. 1 (6), 427-442 (1981).
- Tunica, D. G., et al. Proteomic analysis of the secretome of human umbilical vein endothelial cells using a combination of free-flow electrophoresis and nanoflow LC-MS/MS. Proteomics. 9, 4991-4996 (2009).
- Griffoni, C., et al. Modification of proteins secreted by endothelial cells during modeled low gravity exposure. Journal of Cellular Biochemistry. 112, 265-272 (2011).
- Ghim, M., et al. Visualization of three pathways for macromolecule transport across cultured endothelium and their modification by flow. American Journal of Physiology-Heart and Circulatory Physiology. 313 (5), 959-973 (2017).
- Levesque, M. J., Liepsch, D., Moravec, S., Nerem, R. M. Correlation of endothelial cell shape and wall shear stress in a stenosed dog aorta. Arteriosclerosis: An Official Journal of the American Heart Association, Inc. 6 (2), 220-229 (1986).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены