Method Article
メカノ生物学的研究のための軌道シェーカー上の6ウェルプレートにおける内皮細胞の成長のセグメント化
要約
このプロトコルは、軌道シェーカーモデルを用いた剪断応力適用用に、内皮細胞の成長を6ウェルプレートの特定の領域に制限するコーティング方法を説明する。
要約
血液の流れによって動脈壁に課されるせん断応力は、内皮細胞の形態および機能に影響を及ぼす。低大きさ、振動および多方向せん断応力はすべて、内皮細胞におけるプロアテローム硬化性表現型を刺激するために仮定されているのに対し、高大きさおよび単一方向または単軸せん断は内皮恒常性を促進すると考えられている。これらの仮説はさらなる調査を必要とするが、従来のインビトロ技術には限界があり、細胞に多方向せん断応力を課すのが特に不十分である。
増加する使用を増やしている方法の 1 つは、軌道シェーカーのプラットフォーム上の標準的なマルチウェル プレートで内皮細胞を培養することです。このシンプルで低コストで高スループットで慢性的な方法では、渦巻き媒体は、井戸の異なる部分に多方向せん断を含む異なるパターンとシアーの大きさを生成します。しかし、それは大きな制限を有する:ある領域の細胞は、あるタイプの流れにさらされ、異なる流れにさらされ、したがって流れと表現型の間の明らかな関係を歪める、ウェルの他の部分の細胞に影響を与える媒体にメディエーターを放出する可能性がある。
ここでは、細胞が特定のせん断応力特性にのみ露出することを可能にする方法の簡単で手頃な方法の修正を提示します。細胞の播種は、フィブロネクチンで目的領域をコーティングすることによりウェルの定義された領域に制限され、続いて、不動態の溶液を用いたパッシベーションが行われます。その後、プレートをシェーカー上で旋回させることができ、その結果、位置に応じて、低マグニチュード多方向せん断または高マグニチュード単軸せん断などの明確に定義されたせん断プロファイルに細胞が露出する。以前と同様に、標準的な細胞培養プラスチック製品を使用することで、細胞のさらなる分析が簡単になります。この改変により、定義されたせん断応力特性の下で内皮から放出された可溶性メディエーターの実証が既に可能であり、ウェル内の他の場所に位置する細胞に影響を与える。
概要
血管細胞の機械的環境に対する応答は、血管の正常な機能および疾患1の発症において重要である。全血管の内部表面に並ぶ血管内皮細胞(IC)のメカノバイオロジーは、その上の血流によって発生するせん断ストレスを直接経験するため、メカノ生物学的研究の特に焦点となっている。炎症性反応、変化した剛性および形態、血管活性物質の放出、および結合タンパク質の局在および発現などの様々な表現型変化は、セア応力2、3、4へのEC曝露に依存する。せん断依存性の内皮性は、アテローム性動脈硬化症5、6、7などの疾患のパッチ状の発症を考慮することもできる。
ストレスを制御できる培養物の中で、シアーが他の細胞タイプから分離できる培養物のECsに及ぼす影響を調べることができると便利です。一般的に、ECsにせん断応力を加えるために体外装置に用いられるのは、平行プレート流れチャンバーとコーンプレート粘度計を含むが、単軸定型、振動性、および拍動性流れのみが8,9に適用できる。テーパードまたは分岐形状を有する変更された流れチャンバーと、ステナティック幾何学を模倣するマイクロ流体チップが開発されているが、その低スループットおよび可能な比較的短い培養時間は、課題10、11をもたらす。
細胞が軌道シェーカーのプラットフォーム上に置かれた標準的な細胞培養プラスチック製品で成長する内皮メカノトランスダクションの研究のための軌道シェーカー(または渦巻く井戸)法は、高スループットのIC上に慢性的に複雑で空間的に変化するせん断応力パターンを押し付けることができるため、注目を集めています(Warboysらら al al.計算流体力学(CFD)シミュレーションは、渦巻く井戸のせん断応力の空間的および時間的変動を特徴付けるために採用されています。プレートが配置されたシェーカープラットフォームの軌道運動によって引き起こされる培養媒体の渦巻き運動は、6ウェルプレートのウェルの端部の中央と高マグニチュード単軸流(HMUF、または推定アテローダ保護流)の低マグニチュード多方向流(LMMFまたは推定プロアテローム発生流)につながります。例えば、時間平均壁せん断応力(TAWSS)は、中心に約0.3 Pa、5mm軌道半径13で150rpmで渦巻く6ウェルプレートの端に約0.7 Paである。この方法は、市販のプラスチック製品と軌道シェーカー自体のみを必要とします。
しかし、この方法(およびインビトロで流れを課す他の方法)には欠点があります:ECsはせん断に依存する方法で可溶性メディエーターおよび微粒子を放出し、この分泌物は、渦巻き媒体中での混合のために、それらが放出された以外のウェルの領域のECsに影響を与える可能性があります。これは、EC表現型に対するせん断応力の実際の影響を隠す可能性があります。例えば、Ghimらは、これは大きな粒子17の細胞間輸送に対する異なるせん断プロファイルの明らかに同一の影響を占めていると推測している。
ここでは、プルロニックF-127を用いて表面をパッシベーションし、他の場所での成長を防ぐためにフィブロネクチンコーティングを用いて、6ウェルプレートの特定の領域におけるヒト臍静脈内皮細胞(HUVEC)接着を促進する方法を説明する。この方法は、細胞の成長をセグメント化することによって、ECは1種類のせん断プロファイルしか経験せず、ウェル内の他のプロファイルに露出したECからの分泌物の影響を受けないので、上記の制限を解決する。
プロトコル
1. 装置の製造と試薬の製造
- ステンレス製モジュールの製作
- 提供された工学図面に従ってCNC製粉機を使用して、グレード316ステンレス鋼からステンレスモジュールを製造する(図1)。
- ポリジメチルシロキサン(PDMS)型の3Dプリンティング
- 提供されたエンジニアリング図面に従ってSolidWorksを使用してPDMS金型の3Dコンピュータ支援設計(CAD)モデルを準備します(図2)。
- CAD モデルを STL ファイルにエクスポートし、STL ファイルを Cura 2.6.2 にインポートします。
- 50 mm/s の印刷速度と 60% の面材密度のレイヤーにモデルをスライスします。
- ファイルを G コードとしてエクスポートし、Ultimaker2 3D プリンターにアップロードして印刷します。印刷材料としてポリ乳酸(PLA)を使用します。
- PDMSリングの鋳造
- PDMSベースと硬化剤(シリコーンエラストマーキットから)を90.9%基剤と9.1%硬化剤の比率で混合します。
- 3Dプリント金型に約2.6mLの混合溶液を注ぎます。
- 真空脱気室の気泡を除去します。
- 80°Cの炉で1時間硬化します。
- PDMSリングを室温まで冷却し、硬化したPDMSリングを金型から慎重に取り外します。PDMS リングのエンジニアリング図面を図 3に示します。
- 1%の準備プロロニックF-127
- プルロニックF-127の5gを計量し、ガラス瓶に注ぎ、100mLの無菌水をガラス瓶に加えます。これにより、5%のプルロニックF-127溶液が与えられる。
- すべてのPluronic F-127粉末が水中に沈められていることを確認し、キャップを閉じて、液体滅菌サイクルプログラムを使用してオートクレーブします。
- オートクレーブの後、使用前に溶液を室温まで冷まします。
- 1%プルロニックF-127溶液を40mLのオートクレーブ滅菌水に加え、1%プルロニックF-127溶液を作ります。バイオセーフティキャビネット(BSC)フードで希釈を行います。
- 1%と5%の両方を室温で保存してください。
- 4%パラホルムアルデヒド(PFA)の調製
- 800 mL のリン酸緩衝生理食塩水 (PBS) をガラスビーカーに加え、撹拌しながら 60 °C に加熱します(ステップ 1.5.1 から 1.5.5 まで撹拌を続けます)。
- PFA粉末40gの重量を量り、温かいPBS溶液に加えます。
注意:PFAは危険です、ヒュームフードでステップ1.5.2から1.5.6を実行してください。 - 溶液が透明になるまで、1 M水酸化ナトリウム(NaOH)をPFA溶液にゆっくりと滴下します。
- PFA溶液のpHを約7.4に1Mの塩酸(HCl)で調整します。
- 1X PBSで溶液を1 Lに上げる。これは4%PFAの1 Lを与える。
- PFA溶液を0.2 μmフィルターでフィルターし、微粒子、アリコート、凍結を-20°Cの冷凍庫で除去します。
- 0.1%トリトン-Xの調製
- 50 mLのPBSに50μLの純粋なトリトン-Xを加え、0.1%のTriton-X溶液を作ります。
- 1%ウシ血清アルブミン(BSA)の調製
- BSAの0.5gを量り、50 mL遠心分離管に注ぎ、50 mLのPBSをチューブに加えます。
- ローラーの室温で1時間ロールして溶解させます。
- 4°Cで1%BSAを2週間保存してください。
2. 6ウェルプレートのコーティング
- 使用前に、ステンレス製のモジュール、PDMSリング、ピンセットをオートクレーブ。BSCフードで後続のすべての手順を実行し、無菌性を確保するために無菌技術を観察します。
- ピンセットを使用して、PDMSリングを6ウェルに入れ。PDMS リングの外部リムを使用して、PDMS リングをウェルと同心円状に揃えます。
注:非組織培養は、よく処理されたプレートのみを使用する必要があります。 - ピンセットを使用して、PDMSリングの上にステンレス製モジュールを置きます。
- 内部保持リングペンチの先端を保持リングのグリップ穴に挿入し、保持リングの直径を小さくするためにホルダーを絞ります。6ウェルにフィットし、ステンレス製のモジュールにしっかりと押し込み、ペンチを放してPDMSリングを井戸に固定します。
- PDMSリングとステンレス製モジュールの開口部を通して、ウェルの中心または端(関心領域に応じて)に5 μg/mLフィブロネクチンの1 mLを加えます。
- フィブロネクチン溶液が関心のあるすべての領域をカバーすることを確認するためにプレートを旋回します。
- 加湿インキュベーターで37°Cで30分間インキュベートし、95%の空気/5%CO2の下で蒸し暑くする。
- フィブロネクチン溶液を井戸から取り出し、PBSで2回洗浄します。井戸からPBSを完全に取り除きます。
- 保持リング、ステンレス製モジュール、PDMSリングをウェルから取り外します。
- 1%のプルロニックF-127の1.5 mLをウェル(コーティングされていない表面)の中心または端に加え、室温で1時間インキュベートしてコーティングされていない表面をパッシベーションします。
- ウェルからプルロニックF-127溶液を取り出し、PBSで3回洗浄します。
- すぐにコーティングを使用するか、4°Cで最大2週間保管し、PBSの層をうまくコーティングします。
3. ハヴェックの播種
- 実験では、パッセージ5の下のHUVECを使用します。
- すべての培地を取り除き、PBSで細胞を1回洗浄します。
- 0.05%のトリプシンを3 mL加え、95%空気/5%CO2の下で加湿インキュベーターで37°Cで3分間インキュベートします。フラスコを軽くたたいて細胞を取り除きます。
注: このプロトコルは、HUVEC を使用してテストされており、トリプシンの濃度とそのインキュベーション時間は、他のタイプの IC で異なる場合があります。 - 溶液を15 mL遠心分離チューブに移し、6 mLの培養培地(例えば、ロンザEGM-2)を使用してトリプシンを中和し、37°Cに予熱した。
- 200 x g で 5 分間遠心分離機。中和したトリプシン溶液を除去し、1 mLのプリウォーム化培養培地で細胞を再懸濁します。
- 血体細胞計を使用して細胞を数え、180k細胞を1.5mLの前温め培養培地でコーティングされた6ウェルプレートに入れた。
- ウェルプレートを横に振って、細胞がウェル内で均等に分配されるようにします。
- 37°C加湿インキュベーターを95%空気/5%CO2の下で一晩放置します。
- 未結合の細胞および培養培地を取り出し、2mLのプレウォームド培養培地に置き換える。
注: メディアに浮かぶ多くの未接続セルが期待されます。
4. 軌道シェーカーを用いたせん断応力適用
- HUVECは、成長の3日後に合流に達する必要があります。培地を1.9mLの温め込み培養培地に交換します(高さ2mmを達成するため)。
- 95%の空気/5%CO2の下で加湿インキュベーターで軌道シェーカーのプラットフォーム上にプレートを置き、3日間150 rpmで旋回します。
注:70%エタノールを使用して軌道シェーカーの外面を拭いてからインキュベーターに入れます。 - (オプション)2日間の剪断後、サイトカインを培養培地に添加して、サイトカインと剪断応力の相互作用を調べることができる。治療後、別の日のために細胞を剪断する。本研究では、TNF-αを使用して細胞を活性化した。
- せん断応力適用の3日後に分析を実行します。
5. 細胞の染色とイメージング
- 3日間のせん断後、インキュベーターからプレートを取り出し、PBSで細胞を2回洗浄します。
- ウェルに4%PFAの1.5 mLを加えて細胞を固定し、室温で10分間インキュベートします。
- ウェルから4%PFAを取り出し、PBSで2回洗います。
- ウェルに0.1%トリトン-Xを加えて細胞を透過させ、室温で5分間インキュベートします。
- ウェルから0.1%Triton-X溶液を取り除き、1%BSAの1.5 mLをブロッキング用ウェルに加えます。室温で1%BSAで細胞を1時間インキュベートします。
- 1%BSAで1:200希釈でウサギ抗ヒトZO-1抗体を希釈。1.5mLの希釈抗体をウェルに加え、4°Cで一晩細胞と一緒にインキュベートします。
- 一晩インキュベーションした後、希釈した抗体を取り除き、PBSで細胞を3回洗浄します。
- PBSで1:300希釈時に、アレクサフルオール488標識ヤギ抗ウサギIgG二次抗体を希釈した。希釈した二次抗体を1.5mLのウェルに加え、室温で1時間細胞と一緒にインキュベートします。
- 希釈した二次抗体を取り除き、PBSで細胞を2回洗浄します。
- PBSで1:1000の希釈でDRAQ5を希釈します。希釈したDRAQ5を1.5mL加え、室温で15分間細胞と一緒にインキュベートし、細胞核を染色します。
- 希釈したDRAQ5を取り出し、PBSで3回洗います。
- 共焦点顕微鏡で、端から井戸の中心までのタイルスキャンを実行します。
6. 形状指標と細胞数の定量化
- ポストはMATLAB R2016aを使用して画像を処理します。
- LIF ファイルを共焦点顕微鏡から MATLAB に読み込み、マージされたタイルスキャンをバイナリ画像に変換し、その後、画像を領域と強度で閾値にして、核と背景を区別します。
- バイナリ タイル スキャンを 1 mm 放射状のセグメントに分割します。
- 楕円を個々の核に合わせます。
- 各放射状セグメント内の楕円の数をカウントして、セル番号を指定します。
- シェイプインデックス = SI = 4π x 面積/周長2として定義します。楕円18の図形インデックスを計算します。
結果
フィブロネクチンでコーティングされていないウェルプレートの領域へのHUVECの接着は、Pluronic F-127パッシベーションによって消滅した。成長は、72時間の培養後もフィブロネクチンでコーティングされた領域に限定され、せん断ストレス用途の有無にかかわらず(図4A、図4C)。Pluronic F-127パッシベーションがなければ、ヒューベクはフィブロネクチンなしで表面に付着し、さらに72時間の培養によって増殖していた(図4B、図4D)。
HUVECのアライメントと伸びは、HMUFを有する渦巻き井戸の端に明らかであり、LMMFを有するウェルの中心にある細胞は石畳の形態と整列を示さなかった(図5A、図5B)。HUVECの伸びは形状指標として定量化されました: 4π x 面積/周長2.図形インデックス 1 は円を示し、値 0 は線を示します。形状指数は中心からの放射状距離で減少し、セグメント化された井戸と完全な井戸の間に有意な差はなかった。TNF α治療は、未治療のコントロールと比較してHUVECの伸びを増加した(図5C)。HMUFはまた、両方の条件下でLMMFと比較して、1mmあたり2のHUVECの数を増加させました。HUVECの数は、半径に沿って距離とともに徐々に増加しました。セグメント化されたフルウェルで成長したHUVECの数に有意差は認められなかった(図6)。

図1ステンレス製モジュールのエンジニアリング図面。この図の大きなバージョンを表示するには、ここをクリックしてください。
寸法は mm です。
寸法は mm です。
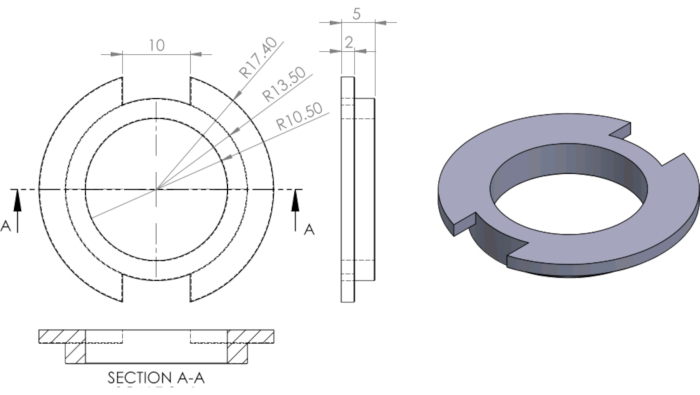
図3 井戸を分割するために使用されるPDMSリングのエンジニアリング図面。この図のより大きなバージョンを表示するには、ここをクリックしてください。
寸法は mm です。ギムらから13.

図4マイクロスコープ画像は、プロロニックF-127がフィブロネクチンコーティングを使用しない領域へのヒト臍帯静脈内皮細胞(HUVEC)接着を防止したことを示しています。
24h(A)および72h(C)の成長後、プロロニックF-127でパッシベーション前にフィブロネクチンで前処理されていなかったウェル表面の部分にHUVECは付着しなかった。Pluronic F-127パッシベーションがなければ、HUVECは、播種後24時間(B)を除いて表面に付着し、さらに72時間(D)増殖していた。(スケールバー= 500 μm)。ギムらから13.

図 5セグメント化された、または完全なウェルの相型 HUVEC の形態。
核(赤)染色は、中央に、(B)フルウェル(スケールバー=100μm)の端にせん断されたHUVEC(A)の形態を示す。 AおよびBはまた、細胞の輪郭を示し、ZO−1(緑色)の免疫染色によって線を引いた。注意 :エッジでの細胞の位置合わせと伸びは、中心ではなく(C)完全なウェルで成長した HUVEC とセグメント化されたウェルの間に、核形状指数に有意な差はなく、未処理またはTNF α処理 HUVEC に対して見られた。細胞は井戸の端付近でより細長かった。TNF治療HUVECにおける伸びが大きくなる傾向α、一貫して場所を越えて有意ではなかった。(双方向ANOVAとボンフェローニのポストホックテスト;n = 3)。この図はGhimら13から変更されました

図 61mm当たりのHUVECの数は 、旋回ウェルプレートの放射距離で増加した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
(A)未処理の(A)および(B)異なる放射状の場所でのTNF α処理HUVECの密度において、完全なウェルとセグメント化された井戸の間に有意な差は認められなかった。どちらの場合も、ウェルの中心よりもエッジの単位面積あたりのセル数が多かった。(双方向ANOVAとボンフェローニのポストホックテスト;n = 3)。この図はGhimら13から修正されました。
ディスカッション
渦巻きウェル法は、中央の低マグニチュード多方向流(LMMF)とウェルの端に高マグニチュード単軸流(HMUF)の単一ウェルで複雑な流れプロファイルを生成することができます。しかし、可溶性メディケーターの剪断ストレス媒介分泌物は、渦巻き培地中に混合され、ウェル全体の細胞に影響を与え、細胞に対する特定のせん断応力プロファイルの真の効果をマスキングする可能性がある。
ここで示したコーティング法は、細胞の成長をウェルの特定の領域に制限することによってこの問題を克服します。細胞は通常疎水性の表面ではなく親水性表面に付着する。このため、ポリスチレン培養器はプラズマ酸化で前処理される。あるいは、疎水性表面は、このプロトコルで示されるように、フィブロネクチンなどの細胞外マトリックスタンパク質でコーティングすることができます。非フィブロネクチン被覆領域は、疎水性表面への残留接着を防止するためにPluronic F-127でパッシベーションした。
このプロトコルは、印刷された金型の精度に依存します。3Dプリンタによっては、金型の正確な寸法にばらつきが生じる場合があります。これは最終的な PDMS コンストラクトに影響を与え、結果としてウェル内の間違った位置に接着するセルになります。したがって、セルはCFDによってモデル化されたものとは別のせん断応力プロファイルを経験します。3D プリンタを使用するもう 1 つの欠点は、印刷中のワーピングにより、金型が平坦でない可能性があります。これにより、最終的なPDMSコンストラクトにより、Pluronic F-127が下に漏れ、細胞が所望の場所に付着するのを防ぐことができます。したがって、リークをチェックし、使用前にPDMS構造の寸法を測定することが重要です。
この方法は、細胞に特定のタイプのせん断応力(HMUFまたはLMMF)を適用する上で、簡単でありながら効果的です。また、消耗品、試薬、および装置の大部分が市販されているとして設定することも便利です。この方法を使用すると、明確に定義されたフローにさらされた細胞の検査や収穫が可能であるだけでなく、それらの細胞によって条件付けされた培地の収集が可能になります。この方法は、内皮メカノバイオロジーを調査する新しい道を提供する。
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、英国心臓財団プロジェクト助成金(PDW)、全米医学研究評議会シンガポールTAAPおよびダイナモグラント(XW、NMRC/OFLCG/004/2018、NMRC/OFLCG/001/2017)、A*STAR大学院奨学金(KTP)、英国心臓財団研究優秀研究センター(MA)を認めています。
資料
| Name | Company | Catalog Number | Comments |
| Cell and Media | |||
| Endothelial Growth Medium (EGM-2) | Lonza | cc-3162 | |
| Human Umbilical Vein Endothelial Cells | NA | NA | Isolated from cords obtained from donors with uncomplicated labour at the Hammersmith Hospital |
| Reagents and Materials | |||
| Alexa Fuor 488-labelled goat anti-rabbit IgG | Thermofisher Scientific | A11008 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Falcon 6 Well Clear Flat Bottom Not Treated | Scientific Laboratory Supplies Ltd | 351146 | |
| Fibronectin from Bovine Plasma | Sigma-Aldrich | F1141-5MG | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537-6X500ML | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Recombinant Human TNF-a | Peprotech | 300-01A | |
| RS PRO 2.85 mm Black PLA 3D Printer Filament, 1 kg | RS | 832-0264 | |
| Stainless Steel 316 | Metal Supermarket | NA | |
| Sylgard184 Silicone Elastomer kit | Farnell | 101697 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Zonula Occludens-1 (ZO-1) antibody | Cell Signaling Technology | 13663 | |
| DRAQ5 (5mM) | Bio Status | DR50200 | |
| Equipments | |||
| Grant Orbital Shaker PSU-10i | Scientific Laboratory Supplies Ltd | SHA7930 | |
| Leica TCS SP5 Confocal Microscope | Leica | NA | |
| Retaining Ring Pliers | Misumi | RTWP32-58 | |
| Retaining Rings/Internal/C-Type | Misumi | RTWS35 | |
| Ultimaker 2+3-D printer | Ultimaker | NA | |
| Softwares | |||
| Cura 2.6.2 | Ultimaker | NA | |
| MATLAB | The MathWorks | NA | |
| Solidworks 2016 | Dassault Systemes | NA |
参考文献
- Hahn, C., Schwartz, M. A. Mechanotransduction in vascular physiology and atherogenesis. Nature Reviews Molecular Cell Biology. 10 (1), 53-62 (2009).
- Wang, C., Baker, B. M., Chen, C. S., Schwartz, M. A. Endothelial Cell Sensing of Flow Direction. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (9), 2130-2136 (2013).
- Tzima, E., et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress. Nature. 437, 426-431 (2005).
- Potter, C. M. F., Schobesberger, S., Lundberg, M. H., Weinberg, P. D., Mitchell, J. A., Gorelik, J. Shape and compliance of endothelial cells after shear stress in vitro or from different aortic regions: Scanning ion conductance microscopy study. PLoS ONE. 7 (2), 1-5 (2012).
- Asakura, T., Karino, T. Flow Patterns and Spatial Distribution of Atherosclerotic Lesions in Human. Circulation Research. 66 (4), 1045-1067 (1990).
- Bond, A. R., Iftikhar, S., Bharath, A. A., Weinberg, P. D. Morphological evidence for a change in the pattern of aortic wall shear stress with age. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 543-550 (2011).
- Giddens, D. P., Zarins, C. K., Glagov, S. The role of fluid mechanics in the localization and detection of atherosclerosis. Journal of biomechanical engineering. 115, 588-594 (1993).
- Schnittler, H. J., Franke, R. P., Akbay, U., Mrowietz, C., Drenckhahn, D. Improved in vitro rheological system for studying the effect of fluid shear stress on cultured cells. The American journal of physiology. 265, 289-298 (1993).
- Levesque, M. J., Nerem, R. M. The elongation and orientation of cultured endothelial cells in response to shear stress. Journal of biomechanical engineering. 107 (4), 341-347 (1985).
- Chiu, J., et al. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. Journal of Biomechanics. 36 (12), 1883-1895 (2003).
- Venugopal Menon, N., et al. A tunable microfluidic 3D stenosis model to study leukocyte-endothelial interactions in atherosclerosis. APL Bioengineering. 2 (1), 016103 (2018).
- Warboys, C. M., Ghim, M., Weinberg, P. D. Understanding mechanobiology in cultured endothelium: A review of the orbital shaker method. Atherosclerosis. 285, 170-177 (2019).
- Ghim, M., Pang, K. T., Arshad, M., Wang, X., Weinberg, P. D. A novel method for segmenting growth of cells in sheared endothelial culture reveals the secretion of an anti-inflammatory mediator. Journal of Biological Engineering. 12 (1), 15 (2018).
- Sage, H., Pritzl, P., Bornstein, P. Secretory phenotypes of endothelial cells in culture: comparison of aortic, venous, capillary, and corneal endothelium. Arteriosclerosis. 1 (6), 427-442 (1981).
- Tunica, D. G., et al. Proteomic analysis of the secretome of human umbilical vein endothelial cells using a combination of free-flow electrophoresis and nanoflow LC-MS/MS. Proteomics. 9, 4991-4996 (2009).
- Griffoni, C., et al. Modification of proteins secreted by endothelial cells during modeled low gravity exposure. Journal of Cellular Biochemistry. 112, 265-272 (2011).
- Ghim, M., et al. Visualization of three pathways for macromolecule transport across cultured endothelium and their modification by flow. American Journal of Physiology-Heart and Circulatory Physiology. 313 (5), 959-973 (2017).
- Levesque, M. J., Liepsch, D., Moravec, S., Nerem, R. M. Correlation of endothelial cell shape and wall shear stress in a stenosed dog aorta. Arteriosclerosis: An Official Journal of the American Heart Association, Inc. 6 (2), 220-229 (1986).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
