Method Article
İnsan Düzenleyici T Hücresi Klonlarının Üretilmesi
Bu Makalede
Özet
Bu protokol, Treg'e özgü demetillenmiş bölgede (TSDR) ve Treg'e özgü fenotipik özelliklerde stabil demetilasyon ile ultra yüksek saflıkta canlı insan Treg'inin üretilmesi için insan düzenleyici T hücrelerinin klonlanmasını ve genişletilmesini tanımlar.
Özet
İnsan düzenleyici T hücrelerinin (Treg), mevcut Treg zenginleştirme yöntemleri göz önüne alındığında, yüksek saflıkta izole edilmesi çok zordur. Bu yöntemler, farklı fizyolojik ve patolojik durumlarda değişen ekspresyon seviyelerine sahip çeşitli aktivasyona bağlı hücresel yüzey belirteçleri aracılığıyla Treg'in tanımlanmasına dayanmaktadır. Bu nedenle "Treg" olarak izole edilen popülasyonlar, bu hücrelerin kesin fenotipik ve fonksiyonel karakterizasyonunu, genomik ve proteomik karakterizasyonunu, farklı sağlık ve hastalık durumlarında güvenilir sayımlarını ve ayrıca terapötik amaçlar için izolasyonlarını ve genişlemelerini engelleyen önemli sayıda Treg efektör olmayan hücre (yani Teff) içerir. Özellikle ikincisi, Treg ile ilgili hücresel bölmelerde (örneğin, CD4 + CD25 + T hücreleri) bulunan efektör hücrelerin yanlışlıkla genişlemesi, Treg bazlı immünoterapiyi etkisiz ve hatta zararlı hale getirebileceğinden, büyük bir engel olmaya devam etmektedir. Bu çalışma, Treg'in popülasyona dayalı izolasyonu ve genişlemesi ile ilgili sorunları ortadan kaldıran bir yöntem sunmaktadır ve Treg aday klonlarının üretilmesinin, yalnızca dikkatlice incelenmiş, monoklonal hücrelerin müteakip seçimi, kültürü ve genişletilmesi ile birlikte, aylarca kültürde tutulabilen ultra saf bir Treg hücre ürününün üretilmesini sağlar, olası terapötik uygulamalar da dahil olmak üzere bu hücrelerin aşağı akış araştırmasını sağlamak.
Giriş
Bu protokolün amacı, ultra yüksek saflıkta, klonal insan Treg'in in vitro yayılımını sağlamaktır. Treg ile zenginleştirilmiş popülasyonların izolasyonu ve müteakip klonlama, istenen Treg fenotiplerinin seçilmesine ve bu hücrelerin biyolojisinin daha fazla incelenmesi, potansiyel terapötik yararlılıklarının araştırılması ve diğer deneysel aşağı akış uygulamaları için genişletilmesine izin verir.
Treg'in klonlanması, poliklonal izolasyon ve genişleme yaklaşımlarından önemli ölçüde daha iyi Treg saflığı sağlayacaktır. Bunun nedeni, diğerlerinin yanı sıra FOXP3 eksprese eden (FOXP3intCD45RAnegCD25int) Treg olmayan ve CD4+ CD25+ FOXP3- Teff1 dahil olmak üzere saflaştırılmış popülasyondan benzer veya farklı fenotiplere sahip T efektör hücrelerinin güvenilir, kontrollü bir şekilde dışlanmasıdır. Bu yaklaşımla elde edilen klonal hücre hatları, çok uzun süreli genişlemeyi (yani birkaç ay) ve hücrelerin in vitro kültürünü pratik olarak imkansız veya en azından son derece zorlayıcı hale getiren, hızla genişleyen Treg olmayan klonlarla aşırı büyüme sorunuyla karşı karşıya kalmaz. Klonal Treg ayrıca, insan iyi niyetli doğal Treg 1,2,3,4'ü gösteren epigenetik özelliklerin değerlendirilmesi için standart olarak kabul edilen yöntemler de dahil olmak üzere, genişleme sonrası fenotipik özelliklerinin kapsamlı bir şekilde incelenmesine izin verir (örneğin, TSDR'de kararlı demetilasyon).
Treg genişlemesi esas olarak hem araştırma hem de terapötik amaçlar için poliklonal hücre genişlemesi şeklinde gerçekleştirilmiştir 5,6,7. Teff kontaminasyonu ile ilgili sorunlar, Treg hücre bazlı immünoterapi yaklaşımlarının başarılı bir şekilde uygulanmasının önünde önemli bir engeldir. Literatürde monoklonal Treg'i genişletmek/oluşturmak için önceki girişimler azdır ve uzun vadede Treg özelliklerinin bakımını göstermede başarısız olmuştur8.
Bu yöntem, iyi niyetli insan Treg'in hücresel, moleküler ve metabolik özelliklerini inceleyen herkesin ilgisini çekecektir. Özellikle bu protokolün kullanılmasıyla üretilen ultra saf Treg ürünü, genomik yaklaşımlar kullanılarak yapılan analizlere uygundur. Genel olarak insan Treg'ini karakterize eden nispeten düşük genişleme oranları göz önüne alındığında, bu yöntem, çok sayıda hücrenin hızlı bir şekilde genişlemesini arayanlar için sınırlı bir kullanım olabilir. Bununla birlikte, bu protokolle üretilen Treg'in son derece yüksek saflığı göz önüne alındığında, daha az sayıda Treg, üretilen ürünün genel baskılayıcı potansiyelini sınırlayan efektör hücreler içeren poliklonal hücre hatlarının daha büyük genişlemelerine benzer veya hatta daha iyi etkinliğe sahip olabilir.
Protokol
Bu protokol, insan örneklerinin kullanımını içeren araştırmaların etik olarak yürütülmesine ilişkin tüm kurumsal yönergeleri takip eder. İnsan hücreleri ve diğer insan kan ürünleri ile çalışma, en azından BLS-2 güvenlik yönergelerine uygun olarak en azından BSL-2 sertifikalı bir ortamda gerçekleştirilmelidir.
1. CD4 + CD127loCD25hi hücreleri için insan periferik kan mononükleer hücrelerinin önceden zenginleştirilmesi
DİKKAT: Baştan sona steril teknik kullanın. Sivri uçları hemen uygun bir kesici alet kabına atın. Atmadan önce kan ve/veya kan ürünleri ile temas eden her şeyi ağartın. Biyogüvenlik kabininde çalışın.
- Periferik kan alımlarından veya lökoferezden insan lökositleri (yani "lökopaklar") için önceden zenginleştirilmiş insan periferik kanı veya kan ürünleri elde edin. Hücreleri hemen işleyin.
NOT: Gece boyunca depolamadan kaçınılamıyorsa, hücreleri oda sıcaklığında (RT) saklayın ve taşıyın. Soğuğa maruz kalmaktan kaçının. - Periferik kan mononükleer hücrelerini (PBMC'ler) daha önce tarif edildiği gibi yoğunluk gradyan ortamı üzerinde gradyan santrifüjleme ile izole edin9.
- Bir hemositometre veya hücre sayacı kullanarak PBMC'leri dikkatlice sayın. Mümkünse, Treg izolasyonuna devam etmek için en az 300 x 106 PBMC kullanın.
- PBMC'leri 50 x 106 hücre / mL konsantrasyonda izolasyon tamponunda (fosfat tamponlu salin [PBS] içinde 1.5 mM EDTA ile% 2 havuzlanmış insan AB serumu [PHS-AB]) içinde yeniden askıya alın ve üreticinin talimatlarına göre manyetik ayırmaya devam edin kullanılan ayırma kiti. Örneğin, bir CD4 + CD127lo T hücre popülasyonunun negatif izolasyonu için manyetik hücre sıralaması (Malzeme Tablosu) kullanın, ardından CD25 + hücreleri için pozitif seçim sıralaması yapın.
NOT: Treg'in manyetik saflaştırılması için kolon tabanlı ve kolonsuz yaklaşımlar dahil olmak üzere çeşitli ürünler kullanılabilir. Alternatif olarak, CD127loCD25yüksek CD4 + T hücreleri üzerinde geçit ile floresanla aktive edilen hücre sınıflandırması (FACS) yapılabilir. Bununla birlikte, standart FACS ekipmanı ile tam sterilite mümkün değildir, ancak önemli bir kontaminasyon riski oluşturur. Ek olarak, akışkan sistemi tarafından sağlanan hücresel stres ve hasar göz ardı edilemez ve alet lazerleri sonuçları etkileyebilir. - Elde edilen Treg ile zenginleştirilmiş popülasyonu CD4, CD3, CD127 ve CD25 için boyama yoluyla saflık açısından kontrol edin (Şekil 1). Doğru bir sonuç elde etmek için, Malzeme Tablosunda belirtilenden gibi, sıralama kitinde kullanılandan farklı bir CD25 bağlanma alanını tanıyan bir anti-insan CD25 antikoru seçin. Nowatzky ve ark.10'da tarif edilene benzer standart bir yüzey boyama protokolü kullanarak hücreleri boyayın ve sabitleyin.
2. Bir CD127loCD25hi önceden zenginleştirilmiş insan CD4 + T hücresi süspansiyonundan Treg'in klonlanması
- Adım 1.4'te elde edilen Treg ile zenginleştirilmiş (CD4 + CD127loCD25hi) hücreleri T hücre ortamında ([TCM]; RPMI 1640, %5 PHS-AB, %1 streptomisin/penisilin, %1 HEPES, %1 esansiyel olmayan amino asitler ve %1 glutamin) ile 300 IU/mL insan rekombinant interlökin-2 (IL-2) (Malzeme Tablosu) ~1−3 x 106 hücre/mL konsantrasyon ve sayım. Devam etmeden önce en az üç ayrı hücre sayımı elde edin ve ortalama hücre sayılarını hesaplayın, çünkü doğru sayımlar kesinlikle çok önemlidir.
- İki konsantrasyonda tek hücreli bir hücre süspansiyonu hazırlayın: (1) 3 hücre / mL ve (2) 6 hücre / mL. 100 μL/kuyucuklu süspansiyon 1 ile beş yuvarlak tabanlı 96 kuyulu plaka ve süspansiyon 2 ile beş plaka yükleyin. Sırasıyla 0.3 ve 0.6 hücre / kuyu dağılımı sağlamak için plakaları yüklerken hücreleri süspansiyon halinde tutmaya büyük özen gösterin.
NOT: Hücre konsantrasyonunu 1 hücreye/kuyuya çıkarmayın, çünkü bu, gerçek klonlar değil, oligoklonal hücre hatları elde etme riskini artırır. - Adım 1.2'deki gibi yoğunluk gradyanlı santrifüjleme yoluyla elde edilen taze izole edilmiş insan allojenik PBMC'lerinden besleyici hücreleri hazırlayın.
- ~ 10 x 106 PBMC / mL konsantrasyonda 50 mL'lik bir polipropilen tüpte IL-2 olmadan TCM'de insan allojenik PBMC'lerini yeniden süspanse ederek ışınlama için klonlama plakası başına en az 10 x 106 besleyici hücre hazırlayın. Tüpü sıkıca kapatın ve bir gama ışınlayıcıda veya X-ışını tabanlı bir ışınlama cihazında 35 Gy ile ışınlayın.
NOT: Işınlama, Teff'in proliferasyonunu kolaylaştıran besleyicilerden büyük miktarlarda sitokin salgılanmasını tetikler, ancak Treg genişlemesini olumsuz etkileyebilir. Bunlar daha sonra yıkanarak çıkarılacaktır. - Işınlamadan sonra hücreleri 450 x g ve RT'de 5 dakika santrifüjleyin ve süpernatanı aspire edin. Hücreleri, ortam/PBS'nin peletlenmiş besleyici hücre hacminin en az 2 katını kullanarak IL-10 olmadan TCM'de yeniden süspanse ederek yıkayın.
NOT: Klonlanacak donör hücrelerin insan lökosit antijeni (HLA) ekspresyon profilinin belirlenmesi önerilir. Bu, ilgili bir donörün türetildiği popülasyonda yaygın olan bir veya birkaç HLA tipi için basit boyama yoluyla yapılabilir (yani, HLA-A2 veya HLA-A24). Besleyici hücreler olarak kullanılan PBMC, besleyicilerin ışınlamaya bağlı apoptozundan önce hedef hücrelerin genleşme kültürlerinden yeniden tanımlanmasını/izolasyonunu sağlamak için bu HLA'yı eksprese etmemelidir. - Işınlanmış ve yıkanmış besleyici hücreleri TCM'de 300 IU / mL IL-2 ile 1 x 106 hücre / mL konsantrasyonda yeniden süspanse edin.
- 4 μg/mL konsantrasyonda (kültürde gerekli konsantrasyonun 2 katı) fitohemaglutinin-L (PHA-L) (Malzeme Tablosu) ekleyin ve hızlı bir şekilde adım 2.8'e geçin.
- Kaplanmış Treg ile zenginleştirilmiş hücrelere 4 μg / mL PHA-L ve 300 IU / mL IL-2 ile 100 μL TCM'de 100.000 ışınlanmış besleyici hücre ekleyin, bu da toplam 200 μL hacim ve her kuyucukta 2 μg / mL PHA-L konsantrasyonu ile sonuçlanır. 5 kat yukarı ve aşağı pipetleyerek iyice karıştırın. Besleyici hücrelerin Treg'e eklenmeden önce PHA-L'ye maruz kalma süresini gereken mutlak minimuma sınırlayın ve kaplanana kadar süspansiyon halinde tutun.
NOT: İlk tohumlama adımında kültürde 2 μg/mL'lik bir PHA-L konsantrasyonu sağlayın, ancak Treg klonlarının müteakip genişlemesi üzerine daha düşük bir 1 μg/mL konsantrasyon kullanın. Boyunca 300 IU / mL IL-2 kullanın. - 37 °C'de inkübe edin. TCM kullanarak ortamın% 50'sini 300 IU / mL IL-2 ile değiştirin, ancak 5-7. günlerde PHA-L olmadan.
3. Treg'in genişletilmesi ve kültürde klonların bakımı
- 12. günden başlayarak, çoğalan hücrelerin peletlerinin varlığı için kültürleri kontrol edin.
NOT: Besleyici hücreler tarafından oluşturulan topaklar olacaktır, ancak mikroskobik incelemede bunlar küçük, yuvarlak, ölmekte olan veya ölü hücreler olarak görünecektir, oysa çoğalan T hücreleri boyut olarak daha büyük olacak, parlak kontrast ve sağlıklı görünüme sahip olacak ve genellikle makroskopik incelemede kahverengi görünen bitişik hücre kümeleri oluşturacaktır. - Her 1-2 günde bir kültürleri incelemeye devam edin. Çoğalan geçici klonları tek kuyucuklara aktararak izole edin. Diğer kuyucuklardan kasıtsız hücre transferi olsa da, herhangi bir geçici veya yerleşik klonun çapraz kontaminasyonunu önlemek için her bir geçici klonu tek bir 96 kuyulu plakaya yerleştirin.
- Her 2-3 günde bir% 50 ortam değişikliği ile hücreleri koruyun ve gerektiği gibi bölün. Hücreleri yakından izleyin.
NOT: Ortam değişikliklerini ve bölünmeyi geciktirmek hücrelere zarar verebilir ve "aşırı bölünme" çoğalmalarını durdurabilir ve hücre ölümüne neden olabilir. - Adım 2.3-2.9'da tarif edildiği gibi ışınlanmış allojenik besleyicilerle hücreleri yeniden uyarın, ancak daha düşük PHA-L konsantrasyonları kullanın (ör., 300 IU / mL IL-2 ile TCM'de 1 μg / mL). Hücre boyutu küçüldüğünde ve hücreler, tipik olarak 2-3 hafta sonra olan uzun ovalin aksine yuvarlak hale geldiğinde yeniden uyarın.
NOT: Orijinal klonlama kültürünü en az 6-8 hafta koruyun. 2 hafta içinde veya kısa bir süre sonra görünür hale gelen 'erken' klonların çoğu gerçek Treg değil, hızlı çoğalan Treg/Teff olmayan hücreler olma eğilimindedir ve bazılarının kültürde gözle görülür şekilde görünmesi 1 aydan fazla sürecek olan 'geç' hücrelere göre incelemede başarısız olma olasılığı daha yüksektir.
4. Geçici Treg klonlarının incelenmesi
- Monoklonalite ve TSDR metilasyon durumu için ~ 1 x 106 hücreye çoğaldıktan sonra geçici klonların incelemesine başlayın.
- İsteğe bağlı olarak, daha fazla değerlendirme için ilgilenenleri tanımlamak için CD3, CD4, CD127 ve CD25 için boyama yoluyla hücre genişlemelerini ön eleme yapın (yani, CD3 + CD4 + CD127loCD25hi) (Şekil 2).
- Ticari olarak temin edilebilen boyama antikorları setlerini kullanarak Vβ boyama ile hücresel üründe tek bir Vβ zincirinin varlığının tanımlanması yoluyla monoklonalite oluşturun (Malzeme Tablosu; Şekil 3) üreticinin talimatlarına uyarak. Güvenilir bir analiz için numuneleri bir akış sitometresinde çalıştırırken en az 1 x 106 olay elde ettiğinizden emin olun, böylece küçük kirletici popülasyonlar tespit edilebilir. Bir canlılık boyası kullanın.
- Ticari sağlayıcılar veya kurum içi11,12 tarafından değerlendirilen FOXP3 lokusunda TSDR metilasyon durumuna sahip olun. Yeterli sonuçlar için en az 1 x 105 hücre elde edin.
- Adım 4.3 ve 4.4'te Treg kimliği ve klonalitesi doğrulandıktan sonra, hücreleri kriyoprezervasyon yapın veya aşağı akış uygulamaları için kullanın.
NOT: Alternatif, ancak çok daha az güvenilir inceleme yaklaşımları, FACS boyamaları 1,10 ve in vitro veya in vivo supresyon testleri13,14 ile Treg fenotipini belirlemektir. Treg baskılama testlerine aşırı güvenmekten kaçının13. Tahliller tipik olarak, ancak bunlarla sınırlı olmamak üzere, üçüncü taraf antijen sunan hücrelerin varlığında yanıtlayıcı T hücreleri (yani, PBMC veya saflaştırılmış T hücreleri, bazen Treg tükenmiş) veya CD3 / CD28 ile dereceli sayılarda Treg'in kokültürüne dayanır. Bu tahlillerin birçoğunun ciddi sınırlamaları vardır ve Treg'in aracılık ettiği gerçek baskılama derecesini abartabilir veya hafife alabilir. TSDR metilasyon durumu, Treg fenotipinin veya "kimliğinin" en kesin / güvenilir ölçüsü olmaya devam etmektedir3,15,16. FOXP3'ün X kromozomu üzerinde bulunduğunu ve kadınlarda bir X kromozomunun DNA metilasyonu ile inaktive edildiğini ve bunun TSDR metilasyon analizinin sonuçlarını etkilediğini unutmayın.
5. Treg'in Kriyoprezervasyonu
NOT: Treg, DMSO ve PHS-AB ile başarılı bir kriyoprezervasyondan sonra uzun süreli saklanabilir.
- Hücreleri kriyoprezervasyon yapmak için gereken kriyoviyal sayısını belirleyin. Bu, kriyoprezervasyon yapılacak toplam nihai hücre süspansiyonu hacmine (mL cinsinden) eşittir, çünkü flakon başına 1 mL dondurulur. Pipetleme/yüzey geriliminden kaynaklanan kayıpları hesaba katmak için bu hacme %10'luk bir güvenlik payı ekleyin.
NOT: Hücreler, tipik olarak 0.1−100 x 106 hücre / mL arasında olmak üzere geniş bir konsantrasyon aralığında kriyoprezervasyonla saklanabilir. - Kriyovialleri etiketleyin.
- Çözelti A (SA) oluşturun:% 50 RPMI ve% 50 PHS-AB veya insan plazmasını karıştırın. Plazma kullanılıyorsa, 4 ° C'de 20 dakika boyunca 2.000 x g'da döndürün.
NOT: SA hacmi, adım 5.1'de belirlendiği gibi kriyoprezervasyonla saklanacak hücre süspansiyonunun toplam nihai hacminin %75'i olmalıdır. - Çözelti B (SB) oluşturun:% 60 (h / v) PBS veya RPMI ve% 40 (h / h) dimetil sülfoksit (DMSO) karıştırın.
NOT: SB hacmi, adım 5.1'de belirlendiği gibi kriyoprezervasyonla saklanacak toplam nihai hücre süspansiyonu hacminin %25'i olmalıdır. - Her iki çözeltiyi de 4 °C'ye soğutun.
- SB'nin tamamını eşit miktarda SA ile karıştırarak dondurma ortamını hazırlayın ve buz üzerinde tutun.
- Treg'i adım 4.5'ten itibaren 450 x g'de 4 °C'de 5 dakika boyunca sıkın. Ortamı aspire edin ve atın ve kalan buz gibi SA'daki hücreleri yeniden askıya alın ve buz üzerinde tutun.
- Soğutulmuş dondurma ortamını 1: 1 oranında, tüpü sallarken buz üzerinde büyük bir tüpte SA'da yeniden süspanse edilen hücrelere yavaşça ekleyin.
- 1 mL / flakonda kriyoviyallere hızlı bir şekilde alikot edin. Kriyovialleri hemen RT'de bir dolap kutusuna yerleştirin ve gecikmeden -80 °C'lik bir dondurucuya aktarın. 24 saat sonra sıvıN2'ye aktarın.
Sonuçlar
Bu protokolün başarılı bir şekilde uygulanması, kararlı insan düzenleyici T hücresi klonlarının ve hatlarının üretilmesine yol açacaktır.
CD4 + CD127loCD25hi hücrelerinin ön seçimi/ön zenginleştirilmesi, çoğu insan Treg'ini içeren bir başlangıç popülasyonu elde etmek için basit bir yöntemdi (Şekil 1A-C). Tüm klonlar bir Treg fenotipi göstermedi. CD25hiCD127lo ekspresyonunun ölçülmesiyle klonların ön taraması, ilgilenilen klonları tanımlamak için makul bir yaklaşımdı ve ön seçimleri yoluyla hedef klonların üretilmesinin verimliliğini artırdı (Şekil 2A,B). Klonalitenin değerlendirilmesi, TCR Vβ için boyama ile kolayca elde edilebilir ve hücresel üründe tek bir Vβ zincirinin gösterilmesini gerektirir (Şekil 3A, B). Bununla birlikte, klonların yalnızca akış sitometrisi kullanılarak karakterizasyonu, özellikle FOXP3, CD25 ve CD127 boyamaları için gösterildiği gibi, Teff ve Treg hücrelerinin kusurlu ayrılması nedeniyle sonuçların yanlış yorumlanmasına yol açabilir (Şekil 4A). CD45RA ve FOXP3 / CD25'in birlikte kullanımı daha iyi ipuçları sağlayabilir, ancak CD45RA negatif alt kümesindeki orta ve yüksek FOXP3 ve / veya CD25 arasındaki kritik öneme sahip farklılaşma (FOXP3int CD45RAneg hücreleri baskılanmaz) zor olabilir, çünkü floresan eksi bir (FMO) geçit kontrolleri bu senaryoda sınırlı yardımcı olabilir, biyolojik kontroller (ideal olarak bu örnekte olduğu gibi Treg klonları) başlangıçta mevcut olmayabilir, ve doğal "kontrol" PBMC/T hücrelerinin lekelenmelerini optimize etmek ve/veya yorumlamak zor olabilir10. FOXP3 ve HELIOS'un kombine boyamaları tipik olarak en güvenilir sonuçları verirken, HELIOS'un bir Treg markörü olarak kullanımı, yaygın olarak kabul edilen TSDR'deki metilasyon durumunun aksine, biraz tartışmalı olmaya devam etmektedir. Şekil 4, bir Teff ve bir Treg klonunun akış sitometrisi (Şekil 4A) ve tek hücreli RNA dizilimi (Şekil 4B) ile VD(J) analizi ile karşılaştırılmasını göstermekte ve örtüşmeyen fenotipik ve gen ekspresyon profillerini göstermektedir. TCR repertuar çeşitliliği her iki hücre ürününde de 1 idi (yani, benzersiz bir VD (J) rekombinasyonu ile sadece bir Vβ zinciri ifade edilir), bu da monoklonalite kanıtı sağlar. Şekil 5'te, bir Treg hücre klonu proliferasyon döngüsünün kinetiği, zaman içinde Ki67 boyaması ile değerlendirildi ve bu da çoğu gerçek Treg klonunun yavaş çoğaldığını gösterdi.

Şekil 1: Treg içeren bir hücre popülasyonunun önceden zenginleşmesi. (A) İnsan CD3 + CD4 + CD127lo CD25 + hücreleri, tekli canlı CD3 + CD4 + lenfositler üzerinde kapılı PBMC içinde. Bu popülasyon, çoğu insan düzenleyici T hücresini içeriyordu ve zenginleştirme için başlangıç popülasyonu olarak hizmet etti. (B) Manyetik sıralama kullanılarak negatif seçim yoluyla CD127-CD4 + T hücreleri için zenginleştirme. (C) CD127-CD4 + popülasyonundan (mavi, histogram) CD25hi hücrelerinin (kırmızı, histogram) daha fazla zenginleştirilmesi, manyetik (burada gösterildiği gibi) veya FACS sıralaması yoluyla elde edilebilir. Yeşil, zenginleştirmeden önce PBMC popülasyonundaki CD25 ifadesini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: İyi niyetli Treg için hücre genişlemelerinin taranması. CD127 ve CD25 ekspresyon seviyelerinin akış sitometrik değerlendirmesi, ilk tarama için basit bir yaklaşımdı, ancak yüksek sayıda "yanlış" (yani metillenmiş) numune göz önüne alındığında, TSDR'de metilasyon durumunun doğrulanması gerekiyordu. (A) Klonlamadan 14 gün sonra elde edilen hücre genişlemeleri: hücre genişlemelerinin sadece 1'i (% 6) iyi niyetli Treg ile tutarlı olarak TSDR'de demetilasyon gösterdi. (B) 30 gün sonra tespit edilen hücre genişlemeleri: 6 genişlemeden 2'si (% 33), metilasyon durumuna göre Treg ile tutarlıydı. Canlı hücreler üzerinde kapılı. Hücreler CD4 + CD3 + CD8-'dir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Klonalitenin doğrulanması. Hücre genişlemelerinin monoklonalitesi doğrulanmalıdır. (A) Klonlar bir Vβ boyası için pozitif boyandı; görüntülenen durumda, Vβ17. (B) 24 insan Vβ özgüllüğü için tüm veri setini gösterir. (C) Tahlilin prensibi. Hücreler, her biri insan T hücresi reseptörünün bir Vβ zincirine özgü olan FITC/PE tek veya çift konjuge antikorlarla boyandı. Eşiğin üzerindeki her kadran, tek bir Vβ zinciri için lekelenme gösterdi, ancak diğerleri için değil. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
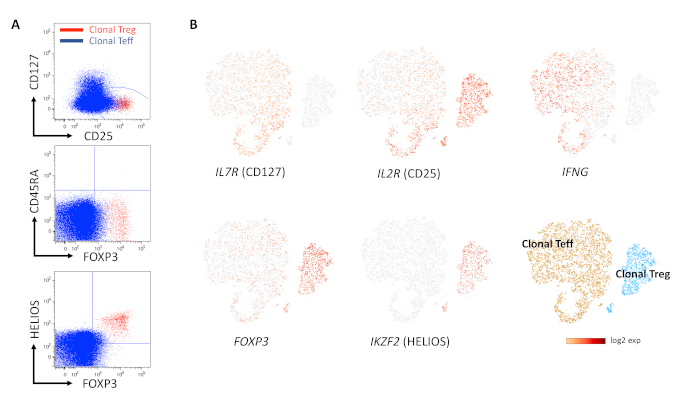
Şekil 4: Uzun süreli genişlemeden sonra Treg klonlarının fenotipik değerlendirmesi. (A) Bindirme grafiklerinde Treg (kırmızı) ve Teff (mavi) klonunun akış sitometrik analizi, insan Teff'indeki düşük FOXP3 ve CD25 ekspresyonu seviyeleri göz önüne alındığında, Treg ve Teff arasındaki farklılaşmanın zor olabileceğini göstermektedir. (B) Panel A'daki ile aynı hücresel ürünlerin V(D)J analizi ile tek hücreli RNA dizilimi, klonal Treg'e karşı klonal Teff'te HELIOS, FOXP3 ve CD25'in yüksek diferansiyel ekspresyonunu ve kültürde 51 hafta sonra IFNg ve CD127 ekspresyonunun olmadığını gösterir. Her numunedeki TCR çeşitliliği 1'dir (yani genişlemeler monoklonaldir). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Treg'in kültürde çoğalması. Besleyici ile uyarılan kültürde tipik bir genleşme döngüsü yaklaşık 2 hafta sürer ve daha sonra yeniden stimülasyon gerektirir. Bir Treg klonunun Ki67 ifadesinin 7 (kırmızı), 11 (mavi) ve 14 (yeşil) gündeki bindirme grafiği gösterilir. Ölmekte olan besleyici hücreler, Treg tarafından eksprese edilen, ancak besleyici hücre donörü tarafından eksprese edilmeyen HLA-A24 üzerinde canlılık boyama ve geçit yoluyla dışlandı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, Treg içeren başlangıç popülasyonlarından sınırlayıcı bir seyreltme ve besleyici hücre bazlı genişleme yaklaşımında elde edilen hücrelerin izolasyonu, genişlemesi ve dikkatli bir şekilde incelenmesi yoluyla ultra saf insan düzenleyici T hücrelerinin yayılmasını tanımlar.
Bu yaklaşımdaki kritik adımlar şunlardır: 1) uygun bir başlangıç popülasyonunun seçimi. Genel olarak, insan PBMC'si içindeki CD4 + T hücrelerinin CD127loCD25hi bölmesi, bu amaca uygun çok çeşitli Treg içerir10,17. 2) Başarılı klonlama için doğru hücre sayımları zorunludur, çünkü daha sonra oligoklonal hücre hatları oluşturabilen çok fazla hücrenin tohumlanması veya çok az tohumlama riski göz önüne alındığında, klonlama verimliliğini azaltır. Bu protokol sayma için standart bir hemositometre kullanır. Otomatik hücre sayaçları, ayarlar uygun şekilde optimize edilmişse ve sayımlar incelenmişse, alternatif olarak kullanılabilir. 3) Tohumlanmış birincil hücrelere sahip plakaların uzun süreli gözlemi ve bakımı. Treg yavaşça çoğalır, bu da klonların kültürde birkaç hafta sonra hücre peletleri şeklinde makroskopik olarak görünür hale gelebileceği anlamına gelir. Bu zaman çerçevesinin, sitotoksik CD8 + T hücreleri veya diğerleri gibi hızlı çoğalan Teff'in üretilmesinde uygulanan benzer klonlama yaklaşımları için tipik olandan önemli ölçüde farklı olduğuna dikkat etmek önemlidir. 4) Yavaş çoğalan klonların eleştirel değerlendirmesi. Treg'in yavaş çoğalma hızı genellikle, besleyici hücrelerin tipik olarak hızla çoğalan klonlar veya hücre hatları ile kokültürde ışınlamadan birkaç gün sonra öldüğü ışınlanmış besleyici hücre klonlama yaklaşımlarında genellikle karşılaşılmayan problemler yaratır. Treg'in düşük genleşme oranları göz önüne alındığında, besleyici hücreler, ışınlamaya rağmen genellikle kültürde 1-2 haftadan daha uzun süre bir miktar canlılık sağlar. Bu, elde edilen hücresel ürünün analizinden elde edilen sonuçların yorumlanmasını etkileyebilir ve araştırmacıyı yanıltabilir. Bu nedenle, genişletilmiş Treg'inkinden farklı olması gereken HLA ekspresyonu temelinde bir miktar canlılığı korumuş olabilecek besleyici hücrelerin ayrılması önerilir. Tüm besleyiciler, uygun şekilde ışınlanırsa sonuçta ölür. 5) Klonların bugüne kadar pyrosequencing ile incelenmesi, kültürde iyi niyetli Treg'in varlığını belirlemenin en güvenilir yöntemidir. Treg baskılama testleri ve fenotiplemenin tümü, her zaman güvenilir bir değerlendirmeye izin vermeyen ciddi sınırlamalara sahiptir. Pyrosequencing, ticari sağlayıcılara yaptırılabilir veya şirket içinde yapılabilir. Hücrelerin incelenmesi için harcanan zamanı ve maliyetleri sınırlamak için, önce monoklonaliteyi oluşturmak, ardından CD127olmayan veCD25yüksek fenotiplere sahip klonları ortadan kaldıran fenotipik tarama (örneğin, CD127/CD25 ekspresyonu) (bu, bazı iyi niyetli Treg'leri hariç tutabilir) ve ardından seçilen klonlarla pyrosequencing'e devam etmek mantıklıdır.
Tablo 1 , hızlı sorun giderme için bir araç sağlar.
| Sorun | Olası açıklama ve yaklaşım |
| 2 hafta sonra klon görülmez. | Bekleyin ve kültürü korumaya devam edin. Treg yavaş genişler ve tipik olarak görünür hücre peletleri oluşturmak için Teff'ten daha fazla zamana ihtiyaç duyar. |
| Elde edilen klonlar akış sitometrisi analizinde bir Treg fenotipi göstermez. | 1) Klonlar Teff'tir. Daha sonra görünür hale gelen klonları hasat edin - yavaş çoğalma göz önüne alındığında Treg olma olasılıkları daha yüksektir. |
| 2) Boyama paneli yeterince optimize edilmemiş. Paneli iyileştirin veya yayınlanmış optimize edilmiş bir Treg boyama panelikullanın 10. | |
| TSDR'de piro-dizileme yoluyla fenotipik olarak umut verici klonları doğrulayın. | |
| Elde edilen hücre hatları klonal değildir. | Tohumlanırken hücrelerin doğru bir şekilde sayıldığından ve tohumlamadan önce tortulaşmaya izin verilmediğinden emin olun. Besleyicileri ve birincil Treg'i birlikte kaplarken tohumlamadan hemen önce PHA-L ekleyin veya önce Treg'i tabaklayın ve ardından PHA ve besleyicileri ekleyin. PHA, hücrelerin topaklanmasına neden olur ve Treg ile zenginleştirilmiş hücreleri kaplarken tek hücre süspansiyonunun korunmasını olumsuz etkileyebilir. |
| Besleyici hücrelerin analiz sırasında öldüğünden veya şüphe durumunda ayıklandığından emin olun (yavaş genişleyen birincil hücrelerle birlikte kültürlendiğinde ışınlanmış besleyicilerin uzun süre hayatta kalmasına ilişkin yorumlara bakın). | |
| Klonlar, akış sitometrisi ile Treg fenotiplerini gösterir ve in vitro supresyon deneyleri TSDR'de demetillenmez. | TSDR'deki demetilasyon, baskılama testlerinin yerini alır ve akış sitometrisi analizi, Treg kimliğinin belirlenmesiyle sonuçlanır. Efektör hücreler, yanıtlayıcı T hücresi popülasyonunun hücre sayılarını, sitotoksik ve diğer etkiler yoluyla doza bağlı bir şekilde azaltabilir. Treg ve Teff'te değişken FOXP3 ve CD25 ekspresyonu seviyeleri göz önüne alındığında, doğru biyolojik kontroller elde edilemediğinde akış sitometrisi sonuçlarının klonlar için yorumlanması zor olabilir. |
| Kabul edilebilir ilk proliferasyona sahip Treg klonları, sonraki genişleme/stimülasyon döngülerinde genişlemeyi durdurur. | Deneyi tamamlamaya çalışın - bazı Treg klonları genişlemeyi durduracak. |
| Farklı allojenik besleyici hücre donörleri ile genişletme girişiminde bulunun - bazıları diğerlerinden daha iyi çalışır. | |
| Hücreler daha önce belirli bir besleyici hücre donörü ile iyi bir şekilde çoğaldıysa, mümkünse sonraki genişleme döngülerinde aynı donörden gelen hücreleri tekrar kullanarak genişletmek yardımcı olabilir. | |
| Canlı besleyici hücreler, hücre hattı/klonu analiz edilirken akış sitometrisi ile tespit edilebilir. | Bu, ışınlanmış besleyici hücrelerin normalden daha uzun süre hayatta kalmasına izin veren daha az rekabet olduğu için Treg yavaş çoğaldığında ortaya çıkabilir. Klonları, Treg'de bulunan, ancak besleyici hücrelerde bulunmayan HLA ifadesine göre sıralayın. Canlı bir boya kullandığınızdan emin olun. Düzgün bir şekilde ışınlanmış tüm besleyiciler sonunda ölecektir. |
Tablo 1: Sorun Giderme.
Bu yöntemin olası modifikasyonları şunları içerir: 1) Treg izolasyon yöntemi. FACS kullanımı mümkündür, ancak yukarıda belirtilen dezavantajlara tabidir. Bununla birlikte, hedeflenen başlangıç popülasyonunun fenotipik özelliklerinin daha iyi kontrol edilmesine izin verir ve manyetik sıralama ile belirli bir başlangıç popülasyonu kolayca elde edilemezse tercih edilebilir. 2) Başlangıç popülasyonu olarak belirli bir Treg alt kümesinin seçilmesi. Örneğin, TIGIT/CD226 ile CD39+ Treg ile standart veya CD45RA+FOXP3int ile CD45RA-FOXP3hi arasında. Treg alt kümelerini sınırlamak için, özellikle kararlı genişleme ve yüksek baskılayıcı aktiviteyeuygun çeşitli fenotipik özellikler önerilmiştir 18,19. 3) Dondurularak saklanmış ve taze besleyici hücreler. Çözülmüş (dondurularak saklanmış, ışınlanmış veya sonraki ışınlama ile ışınlanmamış) besleyici hücrelerin kullanımı mümkün olabilir, ancak önerilmez ve bu protokol için sistematik olarak değerlendirilmemiştir. 4) PCR ve akış sitometrisi ile klonalitenin incelenmesi. Dizileme, TCR Vβ boyamadan daha iyi kapsama sağlar ve monoklonite20'nin belirlenmesi için tercih edilebilir, ancak kurulum için Vβ boyamadan daha fazla çaba ve zaman gerektirir. 5) NSG farelerinde ksenojenik GVHD modelleri gibi in vivo supresyon deneyleri. Bunlar in vitro tahlillere tercih edilebilir, ancak zaman alıcı, emek yoğun ve pahalıdır14. NSG farelerinin kolonilerinin veya insan hücrelerinin diğer uygun bağışıklık yetmezliği olan murin alıcılarının rutin olarak korunduğu ortamlarda mümkün olabilirler. 6) Antijene özgü Treg klonlarının üretilmesi. Bu, tetramer/polimer boyamaları, antijen (AG) spesifik stimülasyon deneylerinde yanıtlayıcı hücre izolasyonu veya diğer benzer teknikler gibi antijene özgü Treg'in izolasyonu için uygun bir yaklaşımın uygulanması ve bu protokolün müteakip uygulanması yoluyla denenebilir. Bununla birlikte, tetramer boyama, izole edilmiş hücrelerin canlılığını değiştirebilir ve daha fazla hücrenin tohumlanması gerekebilir.
Bu protokolün sınırlamaları şunları içerir: 1) Treg'in yavaş çoğalması hücre verimini sınırlar. Treg'in yavaş proliferasyonu, uzun süreli in vitro genişlemelerinin ana sınırlamasıdır. Bu, burada sunulan protokol için geçerlidir. 2) Bilinmeyen antijen özgüllüğü. Mevcut protokol, bilinen AG özgüllüğüne dayalı olarak Treg'i seçmez. Ortaya çıkan ürünün monoklonalitesi, AG için yüksek derecede bir özgüllük anlamına gelirken, özgüllük a priori olarak bilinmemektedir. İnsan periferik kanındaki AG'ye özgü Treg'in düşük öncü frekansı göz önüne alındığında, bilinen AG özgüllüğüne sahip bir başlangıç popülasyonu seçmek zor olabilir, ancak istenen antijen (ler) e yanıt olarak daha önce genişletilen Treg'in önceden zenginleştirilmesi, polimerik MHC-peptit yaklaşımları veya diğer yöntemler kullanılarak doğrudan hedefleme ile ele alınabilir. 3) Genişleme sürecinde insan materyalinin kullanılması terapötik uygulamaları sınırlayabilir. İnsan besleyici hücrelerin kullanımı, terapötik uygulamalar için bir zorluk teşkil eder, ancak bunu engellemez. Bu protokolü gerçekleştirmek için gerekli tüm reaktifler İyi Üretim Uygulamaları (GMP) standartlarında (IL-2 ve PHA-L) mevcuttur. Yapay antijen sunan hücrelerin (APC) ve sitokin kokteyllerinin kullanılması, besleyici hücrelere olan ihtiyacı hafifletmeye yardımcı olabilir, ancak test edilmesi gerekmektedir. 4) Hücreler uzun süreli, in vitro genişlemiştir. Bu, uzun süreli in vitro kültürleri göz önüne alındığında, bu hücrelerin fizyolojik olarak meydana gelen Treg'i yeterince yansıttığının garantisi olmadığı anlamına gelir.
Bu yaklaşımın mevcut/alternatif yöntemlere karşı temel önemi, kültürde çok uzun süreler boyunca Treg'i tanımlayan spesifikasyonları koruyan ultra saf bir Treg hücre ürünü üretme kapasitesinde yatmaktadır. Klonlama yaklaşımı, araştırmacının genişleme deneylerinde ilerlemesine izin verilen hücrelerin özelliklerini kontrol etmesine izin verir, böylece Teff tipi hücrelerin yayılmasını ortadan kaldırır. Diğer yöntemlerin çoğu, Treg'in poliklonal veya oligoklonal genişlemesine dayanmıştır, bu da genellikle zaman içinde baskılayıcı işlevinin bozulmasına yol açar.
Yöntemin gelecekteki uygulamaları ve yönleri şunları içerir: 1) AG'ye özgü Treg klonlarının oluşturulması. Bu, iyi niyetli Treg'in yavaş proliferasyonu ile ilgili sınırlamaları kısmen ortadan kaldırabilir ve hedeflenen klinik uygulamalarda çok sayıda Treg'e olan ihtiyacı azaltabilir. 2) Düşük Treg sayısının gerekli olduğu uygulamalar. Bu, klonların fenotipik ve fonksiyonel analizini içerir (örneğin, RNA dizilimi). 3) Aşağı akış gen düzenleme yaklaşımları. Bu yöntem, örneğin insan Treg'deki spesifik gen fonksiyonlarının değerlendirilmesine ve manipüle edilmesine izin vermek için CRISPR-Cas9 modifikasyonu ile birleştirilebilir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu proje, Ulusal Sağlık Enstitüleri Ulusal Göz Enstitüsü tarafından K08EY025324 Numaralı Ödül (Nowatzky) ve Judith ve Stewart Colton Otoimmünite Merkezi'nden (Nowatzky) Colton Scholar Ödülü ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm Stericup, 500 mL | Millipore | 5500 | Media storage and preparation |
| 100x Nonessential amino acids | Gibco | 11140-050 | Media component |
| 15 mL conical centrifuge tubes (50/bag, case of 500) | ThermoFisher Scientific | 339650 | |
| 1M HEPES | Gibco | 15630-080 | Media component |
| 25 ml Single Well Pipet Basin | Fischer Scientific | 13-681-508 | |
| 50 mL Conical Centrifuge Tube (25/sleeve) | ThermoFisher Scientific | 339652 | |
| 50x Penicillin Streptomycin Soln | Corning | Corning, 30-001-Cl | Media component |
| CryoTube Vial Int Thread Round Btm Starfoot PP Screw Stopper Sterile PP 1.8 mL | Nalge Nunc | 377267 | |
| DMSO | Corning | 25-950-CQC | |
| EasySep Human CD25 positive selection kit | Stemcell Technologies | 18231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127low T cell Pre-Enrichment Kit | Stemcell Technologies | 19231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127lowCD25+ Regulatory T Cell Isolation Kit (alternative to item 12) | Stemcell Technologies | 18063 | Alternatives are FACS or MACS column-based sorting |
| Ficoll | GE Healthcare | 17-5442-03 | PBMC purification from peripheral blood of leukapheresis products; density gradient medium |
| Human AB Serum (PHS-AB) | Valley Biomedical Inc | HP1022 | Media component |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Thermo Fischer | L-34962 | Viability dye |
| Phytohemagglutinin-L (PHA-L) | Millipore/Sigma | 11249738001 | T cell stimulation |
| Recombinant IL-2 (e.g., PROLEUKINâ) | Prometheus | T cell stimulation and maintenance/ Media component | |
| RPMI 1640 | Gibco | 21870-076 | Media component |
| Staining antibodies for flowcytometry (Treg phenotyping) | See "Comments" | See "Comments" | Staining antibodies are enlisted in: Nowatzky et al. (2019) PubMed PMID: 30584695; PubMed Central PMCID: PMC6497402. In case EasySep Human CD25 positive selection kit is used, stain with 2A3 or BC96 anti-CD25 antibody, e.g.: Brilliant Violet 421 anti-human CD25 Antibody (Biolegend; 302629) |
| TCR Vβ Repertoire Kit; IOTest Beta Mark | Beckman Coulter | PN IM3497 | Vetting of expansions for monoclonality |
| Tissue Culture Plate, 96 Well, U-Bottom with Low Evaporation Lid | Corning | 353077 |
Referanslar
- Miyara, M., et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity. 30 (6), 899-911 (2009).
- Polansky, J. K., et al. DNA methylation controls Foxp3 gene expression. European Journal of Immunology. 38 (6), 1654-1663 (2008).
- Toker, A., et al. Active demethylation of the Foxp3 locus leads to the generation of stable regulatory T cells within the thymus. The Journal of Immunology. 190 (7), 3180-3188 (2013).
- Garg, G., et al. Blimp1 Prevents Methylation of Foxp3 and Loss of Regulatory T Cell Identity at Sites of Inflammation. Cell Reports. 26 (7), 1854-1868 (2019).
- Brunstein, C. G., et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood. 117 (3), 1061-1070 (2011).
- Hippen, K. L., et al. Massive ex vivo expansion of human natural regulatory T cells (T(regs)) with minimal loss of in vivo functional activity. Science Translational Medicine. 3 (83), 41(2011).
- Bluestone, J. A., et al. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Science Translational Medicine. 7 (315), 189(2015).
- Dromey, J. A., et al. Generation and expansion of regulatory human CD4(+) T-cell clones specific for pancreatic islet autoantigens. Journal of Autoimmunity. 36 (1), 47-55 (2011).
- Sabado, R. L., et al. Preparation of tumor antigen-loaded mature dendritic cells for immunotherapy. Journal of Visual Experiments. (78), e50085(2013).
- Nowatzky, J., Stagnar, C., Manches, O. OMIP-053: Identification, Classification, and Isolation of Major FoxP3 Expressing Human CD4(+) Treg Subsets. Cytometry A. 95 (3), 264-267 (2019).
- Zhang, Y., et al. Genome-wide DNA methylation analysis identifies hypomethylated genes regulated by FOXP3 in human regulatory T cells. Blood. 122 (16), 2823-2836 (2013).
- Spreafico, R., et al. A sensitive protocol for FOXP3 epigenetic analysis in scarce human samples. European Journal of Immunology. 44 (10), 3141-3143 (2014).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods in Molecular Biology. 707, 21-37 (2011).
- Workman, C. J., et al. In vivo Treg suppression assays. Methods in Molecular Biology. 707, 119-156 (2011).
- Feng, Y., et al. Control of the inheritance of regulatory T cell identity by a cis element in the Foxp3 locus. Cell. 158 (4), 749-763 (2014).
- Toker, A., Huehn, J. To be or not to be a Treg cell: lineage decisions controlled by epigenetic mechanisms. Science Signaling. 4 (158), 4(2011).
- Liu, W., et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. Journal of Experimental Medicine. 203 (7), 1701-1711 (2006).
- Fuhrman, C. A., et al. Divergent Phenotypes of Human Regulatory T Cells Expressing the Receptors TIGIT and CD226. The Journal of Immunology. 195 (1), 145-155 (2015).
- Gu, J., et al. Human CD39(hi) regulatory T cells present stronger stability and function under inflammatory conditions. Cellular & Molecular Immunology. 14 (6), 521-528 (2017).
- Genevee, C., et al. An experimentally validated panel of subfamily-specific oligonucleotide primers (V alpha 1-w29/V beta 1-w24) for the study of human T cell receptor variable V gene segment usage by polymerase chain reaction. European Journal of Immunology. 22 (5), 1261-1269 (1992).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır