Method Article
توليد استنساخ الخلايا التائية التنظيمية البشرية
In This Article
Summary
يصف هذا البروتوكول استنساخ وتوسيع الخلايا التائية التنظيمية البشرية لتوليد Treg بشري عالي النقاء قابل للحياة مع إزالة ميثيل مستقرة في المنطقة المنزوعة الميثيل الخاصة ب Treg (TSDR) وميزات النمط الظاهري الخاصة ب Treg.
Abstract
من المعروف أن الخلايا التائية التنظيمية البشرية (Treg) يصعب عزلها بدرجة نقاء عالية نظرا للطرق الحالية لتخصيب Treg. تعتمد هذه الطرق على تحديد Treg من خلال العديد من علامات السطح الخلوي المعتمدة على التنشيط بمستويات تعبير متفاوتة في ظروف فسيولوجية ومرضية مختلفة. لذلك غالبا ما تحتوي المجموعات المعزولة باسم "Treg" على أعداد كبيرة من الخلايا المستجيبة غير Treg (أي Teff) التي تعيق التوصيف الدقيق للنمط الظاهري والوظيفي لهذه الخلايا ، وتوصيفها الجيني والبروتيني ، وتعددها الموثوق به في حالات مختلفة من الصحة والمرض ، فضلا عن عزلها وتوسعها للأغراض العلاجية. هذا الأخير ، على وجه الخصوص ، لا يزال يمثل عقبة رئيسية ، حيث أن التوسع غير المقصود للخلايا المستجيبة الموجهة في المقصورات الخلوية ذات الصلة ب Treg (على سبيل المثال ، الخلايا التائية CD4 + CD25 + ) قد يجعل العلاج المناعي القائم على Treg غير فعال ، أو حتى ضارا. يقدم هذا العمل طريقة تتحايل على المشاكل المرتبطة بالعزلة السكانية والتوسع في Treg وتظهر أن توليد المستنسخة المرشحة Treg مع الاختيار اللاحق والثقافة والتوسع في الخلايا أحادية النسيلة التي تم فحصها بعناية فقط ، يتيح توليد منتج خلية Treg فائق النقاء يمكن الاحتفاظ به في الثقافة لعدة أشهر ، تمكين التحقيق في نهاية المطاف لهذه الخلايا ، بما في ذلك التطبيقات العلاجية المحتملة.
Introduction
الغرض من هذا البروتوكول هو تمكين الانتشار في المختبر للنقاء الفائق ، Treg البشري النسيل. يسمح عزل المجموعات السكانية المخصبة ب Treg والاستنساخ اللاحق باختيار الأنماط الظاهرية المرغوبة من Treg وتوسعها لمزيد من الدراسة لبيولوجيا هذه الخلايا ، واستكشاف فائدتها العلاجية المحتملة ، وغيرها من التطبيقات التجريبية في المصب.
سينتج عن استنساخ Treg نقاء Treg أفضل بكثير من مناهج العزل والتوسع متعددة النسيحة. ويرجع ذلك إلى الاستبعاد الموثوق به والخاضع للرقابة لخلايا المستجيب التائية ذات الأنماط الظاهرية المتشابهة أو المختلفة من السكان المنقاة ، بما في ذلك التعبير عن FOXP3 (FOXP3intCD45RAnegCD25int) non-Treg و CD4 + CD25 + FOXP3- Teff1 ، من بين أمور أخرى. لا تواجه خطوط الخلايا النسيلية التي تم الحصول عليها من خلال هذا النهج مشكلة فرط النمو مع استنساخ غير Treg سريع التوسع والذي يجعل التوسع طويل المدى (أي عدة أشهر) والثقافة المختبرية للخلايا مستحيلة عمليا أو على الأقل صعبة للغاية. يسمح Clonal Treg أيضا بفحص شامل لميزاته المظهرية بعد التوسع ، بما في ذلك من خلال الطرق المعترف بها كمعيار لتقييم السمات اللاجينية التي تدل على حسن نية الإنسان الطبيعيTreg 1،2،3،4 (على سبيل المثال ، إزالة الميثيل المستقرة في TSDR).
تم إجراء توسيع Treg بشكل أساسي في شكل توسيع الخلايا متعددة النسيلة للأغراض الاستقصائية والعلاجية5،6،7. تعد مشاكل تلوث Teff عقبة رئيسية أمام التنفيذ الناجح لنهج العلاج المناعي القائم على خلايا Treg. المحاولات السابقة لتوسيع / توليد Treg أحادي النسيلة في الأدبيات نادرة وفشلت في إظهار الحفاظ على ميزات Treg على المدى الطويل8.
ستكون هذه الطريقة ذات أهمية لأي شخص يدرس الخصائص الخلوية والجزيئية والتمثيل الغذائي للإنسان حسن النية . منتج Treg فائق النقاء الذي تم إنشاؤه من خلال استخدام هذا البروتوكول على وجه الخصوص يفسح المجال للتحليلات باستخدام الأساليب الجينومية. نظرا لمعدلات التوسع المنخفضة نسبيا التي تميز Treg البشري بشكل عام ، قد تكون هذه الطريقة ذات فائدة محدودة لأولئك الذين يسعون إلى التوسع السريع لأعداد هائلة من الخلايا. ومع ذلك ، نظرا للنقاء العالي للغاية ل Treg الذي تم إنشاؤه باستخدام هذا البروتوكول ، قد يكون لأعداد أصغر من Treg فعالية مماثلة أو حتى أفضل من التوسعات الأكبر لخطوط الخلايا متعددة النسيلة التي تحتوي على خلايا مستجيبة تحد من الإمكانات القمعية الإجمالية للمنتج الذي تم إنشاؤه.
Protocol
يتبع هذا البروتوكول جميع المبادئ التوجيهية المؤسسية المتعلقة بالسلوك الأخلاقي للبحث الذي ينطوي على استخدام عينات بشرية. يجب أن يتم العمل مع الخلايا البشرية ومنتجات الدم البشرية الأخرى على الأقل في بيئة معتمدة من BSL-2 وفقا لإرشادات السلامة BLS-2 كحد أدنى.
1. التخصيب المسبق لخلايا الدم المحيطي البشرية أحادية النواةلخلايا CD4 + CD127loCD25 hi
تنبيه: استخدم تقنية معقمة طوال الوقت. تخلص من الأدوات الحادة على الفور في حاوية أدوات حادة مناسبة. قم بتبييض أي شيء لامس الدم و / أو منتجات الدم قبل التخلص منه. العمل في خزانة السلامة البيولوجية.
- الحصول على الدم المحيطي البشري أو منتجات الدم المخصبة مسبقا للكريات البيض البشرية (أي "الطلاوة") من سحب الدم المحيطي أو فصادة الكريات البيضاء. معالجة الخلايا على الفور.
ملاحظة: إذا تعذر تجنب التخزين طوال الليل ، فقم بتخزين الخلايا ونقلها في درجة حرارة الغرفة (RT). تجنب التعرض للبرد. - عزل خلايا الدم المحيطية أحادية النواة (PBMCs) عن طريق الطرد المركزي المتدرج فوق وسط تدرج الكثافة كما هو موضحسابقا 9.
- عد PBMCs بعناية باستخدام مقياس كثافة الدم أو عداد الخلايا. إذا أمكن ، استخدم ما لا يقل عن 300 × 106 PBMC لمتابعة عزل Treg.
- أعد تعليق PBMCs في المخزن المؤقت المعزول (2٪ مصل AB البشري المجمع [PHS-AB] مع 1.5 ملي مولار EDTA في محلول ملحي مخزن بالفوسفات [PBS]) بتركيز 50 × 106 خلايا / مل واستمر في الفرز المغناطيسي وفقا لتعليمات الشركة المصنعة لمجموعة الفرز المستخدمة. على سبيل المثال ، استخدم فرز الخلايا المغناطيسية (جدول المواد) للعزل السلبي لمجموعة الخلايا التائية CD4 + CD127lo ، متبوعا بفرز الاختيار الإيجابي لخلايا CD25 + .
ملاحظة: يمكن استخدام مجموعة متنوعة من المنتجات للتنقية المغناطيسية ل Treg ، بما في ذلك الأساليب القائمة على الأعمدة والخالية من الأعمدة. بدلا من ذلك ، يمكن إجراء فرز الخلايا المنشطة بالفلورة (FACS) مع البوابات على خلايا CD127loCD25عالية CD4 + T ومع ذلك ، فإن العقم الكامل غير ممكن مع معدات FACS القياسية ، مما يشكل خطرا كبيرا للتلوث. بالإضافة إلى ذلك ، لا يمكن استبعاد الإجهاد الخلوي والضرر الناجم عن نظام السوائل ، وقد يؤثر ليزر الجهاز على النتائج. - تحقق من السكان المخصبين ب Treg الناتج للتأكد من نقائهم من خلال تلطيخ CD4 و CD3 و CD127 و CD25 (الشكل 1). اختر جسما مضادا ل CD25 مضادا للإنسان يتعرف على مجال ربط CD25 مختلف عن المجال المستخدم في مجموعة الفرز ، مثل العنصر المحدد في جدول المواد ، للحصول على نتيجة دقيقة. تلطيخ الخلايا وإصلاحها باستخدام بروتوكول تلطيخ السطح القياسي مثل ذلك الموصوف في Nowatzky et al.10.
2. استنساخ Treg من CD127loCD25مرحبا معلق الخلايا التائية البشرية CD4 + T
- إعادة تعليق الخلايا المخصبة ب Treg (CD4 + CD127loCD25hi) التي تم الحصول عليها في الخطوة 1.4 في وسائط الخلايا التائية ([TCM] ؛ RPMI 1640 ، 5٪ PHS-AB ، 1٪ ستربتومايسين / بنسلين ، 1٪ هيبيس ، 1٪ أحماض أمينية غير أساسية ، و 1٪ جلوتامين) مع 300 وحدة دولية / مل من الإنترلوكين المؤتلف البشري 2 (IL-2) (جدول المواد) بهدف تركيز ~ 1-3 × 106 خلايا / مل والعد. احصل على ثلاث أعداد منفصلة على الأقل من الخلايا واحسب متوسط أعداد الخلايا قبل المتابعة لأن التعداد الدقيق أمر بالغ الأهمية.
- قم بإعداد معلق خلية واحدة من الخلايا بتركيزين: (1) 3 خلايا / مل ، و (2) 6 خلايا / مل. قم بتحميل خمس ألواح بئر مستديرة القاع 96 مع 100 ميكرولتر / بئر من التعليق 1 ، وخمس ألواح مع تعليق 2. احرص بشدة على إبقاء الخلايا معلقة عند تحميل الألواح لضمان توزيع 0.3 و 0.6 خلية / بئر ، على التوالي.
ملاحظة: لا تزيد تركيز الخلية إلى خلية واحدة / بئر ، لأن هذا يزيد من خطر الحصول على خطوط الخلايا قليلة النسيلة وليس المستنسخة الحقيقية. - قم بإعداد الخلايا المغذية من PBMCs الخيفية البشرية المعزولة حديثا التي تم الحصول عليها من خلال الطرد المركزي المتدرج للكثافة كما في الخطوة 1.2.
- قم بإعداد ما لا يقل عن 10 × 106 خلايا مغذية لكل لوحة استنساخ للإشعاع عن طريق تعليق PBMCs الخيفية البشرية في الطب الصيني التقليدي بدون IL-2 في أنبوب بولي بروبيلين سعة 50 مل بتركيز ~ 10 ×10 6 PBMC / مل. أغلق الأنبوب بإحكام وقم بإشعاعه باستخدام 35 غراي إما في جهاز تشعيع جاما أو جهاز تشعيع قائم على الأشعة السينية.
ملاحظة: يؤدي التشعيع إلى إفراز كميات كبيرة من السيتوكينات من المغذيات التي تسهل تكاثر التيف ، ولكنها قد تؤثر سلبا على توسع Treg. سيتم إزالتها بعد ذلك عن طريق الغسيل. - خلايا الطرد المركزي عند 450 × جم و RT لمدة 5 دقائق بعد التشعيع ، وشفط المادة الطافية. اغسل الخلايا عن طريق تعليقها في الطب الصيني التقليدي بدون IL-2 باستخدام ما لا يقل عن 10 أضعاف حجم خلية التغذية المحببة للوسائط / PBS.
ملاحظة: يوصى بتحديد ملف تعريف تعبير مستضد الكريات البيض البشري (HLA) للخلايا المانحة المراد استنساخها. يمكن القيام بذلك من خلال تلطيخ بسيط لواحد أو عدة أنواع من أنواع HLA الشائعة بين السكان الذين يشتق منها المتبرع المعني (على سبيل المثال ، HLA-A2 أو HLA-A24). يجب ألا يعبر PBMC المستخدم كخلايا مغذية عن HLA هذا لتمكين إعادة تحديد / عزل الخلايا المستهدفة من مزارع التمدد قبل موت الخلايا المبرمج الناجم عن الإشعاع للمغذيات. - أعد تعليق الخلايا المغذية المشععة والمغسولة في الطب الصيني التقليدي ب 300 وحدة دولية / مل IL-2 بتركيز 1 × 106 خلايا / مل.
- أضف phytohemagglutinin-L (PHA-L) (جدول المواد) بتركيز 4 ميكروغرام / مل (2 ضعف التركيز المطلوب في المزرعة) وانتقل بسرعة إلى الخطوة 2.8.
- أضف 100,000 خلية تغذية مشعة في 100 ميكرولتر من الطب الصيني التقليدي مع 4 ميكروغرام / مل PHA-L و 300 وحدة دولية / مل IL-2 إلى الخلايا المخصبة ب Treg المطلية ، مما ينتج عنه حجم إجمالي يبلغ 200 ميكرولتر وتركيز PHA-L يبلغ 2 ميكروغرام / مل في كل بئر. تخلط جيدا عن طريق سحب العينة لأعلى ولأسفل 5 مرات. قلل من وقت تعرض خلايا التغذية إلى PHA-L قبل إضافتها إلى Treg إلى الحد الأدنى المطلق اللازم ، واحتفظ بها في حالة تعليق حتى يتم طلاؤها.
ملاحظة: تأكد من تركيز PHA-L يبلغ 2 ميكروغرام / مل في المزرعة في خطوة البذر الأولية ، ولكن استخدم تركيزا أقل ، 1 ميكروغرام / مل عند التوسع اللاحق في استنساخ Treg. استخدم 300 وحدة دولية / مل من IL-2 طوال الوقت. - احتضان عند 37 درجة مئوية. قم بتغيير 50٪ من الوسائط باستخدام الطب الصيني التقليدي باستخدام 300 وحدة دولية/مل IL-2 ولكن بدون PHA-L في الأيام 5-7.
3. توسيع Treg والحفاظ على المستنسخة في الثقافة
- ابتداء من اليوم 12 ، تحقق من الثقافات بحثا عن وجود حبيبات الخلايا المتكاثرة.
ملاحظة: ستكون هناك كريات تتكون من الخلايا المغذية ، ولكن عند الفحص المجهري ستظهر هذه الخلايا كخلايا صغيرة أو مستديرة أو محتضرة أو ميتة ، في حين أن الخلايا التائية المتكاثرة ستكون أكبر حجما ، مع تباين ساطع ومظهر صحي ، وغالبا ما تشكل مجموعات من الخلايا المجاورة التي تظهر بنية اللون في الفحص العياني - استمر في فحص الثقافات كل 1-2 أيام. عزل المستنسخة المؤقتة المتكاثرة عن طريق نقلها إلى آبار مفردة. ضع كل استنساخ مؤقت على صفيحة واحدة 96 بئر لتجنب التلوث المتبادل لأي استنساخ مؤقت أو ثابت على الرغم من نقل الخلايا غير المقصود من الآبار الأخرى.
- حافظ على الخلايا من خلال 50٪ من الوسائط التي تتغير كل 2-3 أيام وانقسمها حسب الضرورة. راقب الخلايا عن كثب.
ملاحظة: يمكن أن يؤدي تأخير تغييرات الوسائط والانقسام إلى إلحاق الضرر بالخلايا ويمكن أن يؤدي "الانقسام المفرط" إلى إيقاف تكاثرها ويؤدي إلى موت الخلايا. - إعادة تحفيز الخلايا بمغذيات خيفية مشعة كما هو موضح في الخطوات 2.3-2.9 ، ولكن استخدم تركيزات أقل من PHA-L (أي 1 ميكروغرام / مل في الطب الصيني التقليدي مع 300 وحدة دولية / مل IL-2). أعد التحفيز عندما ينخفض حجم الخلية وتصبح الخلايا مستديرة بدلا من الشكل البيضاوي الممدود الذي يحدث عادة بعد 2-3 أسابيع.
ملاحظة: الحفاظ على مزرعة الاستنساخ الأصلية لمدة 6-8 أسابيع على الأقل. تميل العديد من المستنسخة "المبكرة" التي تصبح مرئية في أو بعد أسبوعين بقليل إلى أن تكون غير حقيقية ، ولكنها تتكاثر بسرعة الخلايا غير Treg / Teff ومن المرجح أن تفشل في التدقيق أكثر من الخلايا "المتأخرة" ، والتي سيستغرق بعضها أكثر من شهر واحد لتظهر بشكل واضح في الثقافة.
4. فحص استنساخ Treg المبدئي
- ابدأ في فحص المستنسخة المبدئية بمجرد تكاثرها إلى ~ 1 × 106 خلايا من أجل أحادية النسيلة وحالة مثيلة TSDR.
- اختياريا ، توسعات الخلايا قبل الغربلة عن طريق تلطيخ CD3 و CD4 و CD127 و CD25 من أجل تحديد تلك التي تهمك (على سبيل المثال ، CD3 + CD4 + CD127loCD25hi) لمزيد من التقييم (الشكل 2).
- إنشاء أحادية النسيلة من خلال تحديد وجود سلسلة Vβ واحدة في المنتج الخلوي عن طريق تلطيخ Vβ باستخدام مجموعات من الأجسام المضادة للتلطيخ المتاحة تجاريا (جدول المواد ؛ الشكل 3) اتباع تعليمات الشركة المصنعة. تأكد من الحصول على ما لا يقل عن 1 × 106 أحداث عند تشغيل العينات على مقياس التدفق الخلوي لإجراء تحليل موثوق به ، بحيث يمكن اكتشاف المجموعات الملوثة الطفيفة. استخدم صبغة قابلة للحياة.
- لديك حالة مثيلة TSDR في موضع FOXP3 الذي تم تقييمه من قبل مقدمي الخدمات التجاريين أوداخليا 11،12. احصل على ما لا يقل عن 1 × 105 خلايا للحصول على نتائج مناسبة.
- بمجرد تأكيد هوية Treg واستنساخها في الخطوتين 4.3 و 4.4 ، قم بالحفاظ على الخلايا بالتبريد أو استخدامها في التطبيقات النهائية.
ملاحظة: تحدد مناهج التدقيق البديلة ، ولكن الأقل موثوقية ، النمط الظاهري Treg عن طريق صبغات FACS1،10 وفحوصات قمع في المختبر أو في الجسم الحي13،14. تجنب الاعتماد المفرط على فحوصات قمع Treg13. تعتمد المقايسات عادة ، ولكن ليس حصريا ، على الزراعة المشتركة ل Treg بأعداد متدرجة مع الخلايا التائية المستجيبة (أي PBMC أو الخلايا التائية المنقاة ، وأحيانا مستنفدة من Treg) في وجود خلايا مقدمة لمستضد طرف ثالث أو CD3 / CD28 مع تخفيف الصبغة الذي يمثل التكاثر كقراءة. العديد من هذه المقايسات لها قيود شديدة وقد تبالغ أو تقلل من تقدير الدرجة الفعلية للقمع بوساطة Treg. تظل حالة مثيلة TSDR هي المقياس الأكثر تحديدا / موثوقية للنمط الظاهري Treg أو "الهوية"3،15،16. لاحظ أن FOXP3 يقع على الكروموسوم X ، وفي الإناث ، يتم تعطيل كروموسوم X واحد عن طريق مثيلة الحمض النووي ، مما يؤثر على نتائج تحليل مثيلة TSDR.
5. الحفظ بالتبريد من Treg
ملاحظة: يمكن تخزين Treg على المدى الطويل بعد الحفظ بالتبريد الناجح باستخدام DMSO و PHS-AB.
- تحديد عدد المبردات المطلوبة لحفظ الخلايا بالتبريد. هذا يساوي الحجم النهائي الكلي لتعليق الخلية (بالمل) المراد حفظه بالتبريد ، لأنه يتم تجميد 1 مل لكل قارورة. أضف هامش أمان بنسبة 10٪ إلى هذا الحجم لحساب الخسائر الناجمة عن سحب العينات/التوتر السطحي.
ملاحظة: يمكن حفظ الخلايا بالتبريد بمجموعة واسعة من التركيزات ، عادة ما بين 0.1-100 × 106 خلايا / مل. - قم بتسمية cryovials.
- توليد الحل A (SA): امزج 50٪ RPMI و 50٪ PHS-AB أو البلازما البشرية. إذا تم استخدام البلازما ، فقم بالدوران عند 2,000 × جم لمدة 20 دقيقة عند 4 درجات مئوية.
ملاحظة: يجب أن يكون حجم SA 75٪ من الحجم النهائي الكلي لتعليق الخلية المراد حفظه بالتبريد على النحو المحدد في الخطوة 5.1. - توليد الحل B (SB): امزج 60٪ (حجم / حجم) PBS أو RPMI و 40٪ (حجم / حجم) ثنائي ميثيل سلفوكسيد (DMSO).
ملاحظة: يجب أن يكون حجم SB 25٪ من الحجم النهائي الكلي لتعليق الخلية المراد حفظه بالتبريد كما هو محدد في الخطوة 5.1. - قم بتبريد كلا المحاللين إلى 4 درجات مئوية.
- تحضير وسط التجميد عن طريق خلط كل SB مع أجزاء متساوية من SA واحتفظ بها على الجليد.
- قم بتدوير Treg من الخطوة 4.5 عند 450 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بشفط الوسائط والتخلص منها ، وأعد تعليق الخلايا في SA المثلج المتبقي واستمر في وضع الثلج.
- أضف ببطء وسط التجميد المبرد 1: 1 إلى الخلايا المعلقة في SA في أنبوب كبير على الجليد أثناء هز الأنبوب.
- قم بتقطيعه بسرعة إلى cryovials عند 1 مل / قارورة. ضع المبردات على الفور في صندوق خزانة في RT وانقلها إلى فريزر -80 درجة مئوية دون تأخير. نقل إلى السائل N2 بعد 24 ساعة.
النتائج
سيؤدي التنفيذ الناجح لهذا البروتوكول إلى توليد استنساخ وخطوط مستقرة للخلايا التائية التنظيمية البشرية.
كان الاختيار المسبق / التخصيب المسبق للخلاياالمصاحبة CD4 + CD127loCD25 طريقة مباشرة للحصول على مجموعة أولية تحتوي على معظم البشر Treg (الشكل 1 أ - ج). لم تعرض جميع المستنسخة نمطا ظاهريا Treg. كان الفحص المسبق للنسخ عن طريق قياس تعبير CD25hiCD127lo نهجا معقولا لتحديد المستنسخة ذات الأهمية ، وزيادة كفاءة توليد المستنسخة المستهدفة من خلال اختيارها المسبق (الشكل 2 أ ، ب). يمكن تحقيق تقييم الاستنساخ بسهولة عن طريق تلطيخ TCR Vβ ، ويتطلب عرض سلسلة Vβ واحدة في المنتج الخلوي (الشكل 3 أ ، ب). قد يؤدي توصيف المستنسخة فقط باستخدام قياس التدفق الخلوي إلى سوء تفسير النتائج ، بسبب الفصل غير الكامل لخلايا Teff و Treg ، على وجه الخصوص كما هو موضح في تلطيخ FOXP3 و CD25 و CD127 (الشكل 4 أ). قد يوفر الاستخدام المشترك ل CD45RA و FOXP3 / CD25 أدلة أفضل ، ولكن التمايز المهم للغاية بين FOXP3 المتوسط والعالي ، و / أو CD25 في المجموعة الفرعية السلبية CD45RA (لا تمنع خلايا FOXP3int CD45RA neg) يمكن أن يكون أمرا صعبا ، لأن عناصر التحكم في البوابات الفلورية ناقص واحد (FMO) ذات مساعدة محدودة في هذا السيناريو ، قد لا تكون الضوابط البيولوجية (من الناحية المثالية استنساخ Treg كما في هذا المثال) متاحة في البداية ، وقد يكون من الصعب تحسين و / أو تفسير تلطيخ خلايا PBMC / T الأصلية "للتحكم". في حين أن البقع المجمعة ل FOXP3 و HELIOS عادة ما تعطي النتائج الأكثر موثوقية ، فإن استخدام HELIOS كعلامة Treg لا يزال مثيرا للجدل إلى حد ما ، على عكس حالة المثيلة في TSDR ، وهو مقبول على نطاق واسع. يوضح الشكل 4 مقارنة بين استنساخ Teff و Treg واحد عن طريق قياس التدفق الخلوي (الشكل 4 أ) وتسلسل الحمض النووي الريبي أحادي الخلية (الشكل 4 ب) مع تحليل VD (J) ، مما يدل على ملامح النمط الظاهري والتعبير الجيني غير المتداخلة. كان تنوع ذخيرة TCR الخاصة بهم 1 في كلا المنتجين الخليين (أي يتم التعبير عن سلسلة Vβ واحدة فقط من خلال إعادة تركيب VD (J) فريدة) ، مما يوفر دليلا على أحادية النسيلة. في الشكل 5 ، تم تقييم حركية دورة تكاثر استنساخ خلية Treg بواسطة تلطيخ Ki67 بمرور الوقت ، مما يدل على الانتشار البطيء لمعظم المستنسخة الأصلية من Treg.

الشكل 1: التخصيب المسبق لمجموعة الخلايا المحتوية على Treg. (أ) خلايا CD3 + CD4 + CD127أو CD25 + داخل PBMC مسورة على الخلايا الليمفاوية CD3 + CD4 + الحية المفردة. احتوت هذه المجموعة على معظم الخلايا التائية التنظيمية البشرية وكانت بمثابة مجموعة البداية للتخصيب. (ب) تخصيب الخلايا التائية CD127-CD4 + من خلال الانتقاء السلبي باستخدام الفرز المغناطيسي. (ج) يمكن تحقيق مزيد من التخصيب للخلاياالمضحكة CD25 (الأحمر ، الرسم البياني) من مجموعة CD127-CD4 + (الأزرق ، الرسم البياني) إما من خلال الفرز المغناطيسي (كما هو موضح هنا) أو FACS. يمثل اللون الأخضر تعبير CD25 في مجموعة PBMC قبل التخصيب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: فحص توسعات الخلايا من أجل Treg حسن النية . كان تقييم قياس التدفق الخلوي لمستويات تعبير CD127 و CD25 نهجا مباشرا للفحص الأولي ، ولكنه تطلب تأكيدا لحالة المثيلة في TSDR نظرا للعدد الكبير من العينات "الكاذبة" (أي الميثيلية). (أ) تم الحصول على توسعات الخلايا بعد 14 يوما من الاستنساخ: أظهرت 1 (6٪) فقط من تمدد الخلايا إزالة الميثيل في TSDR بما يتفق مع Treg حسن النية . (ب) تمدد الخلايا المكتشفة بعد 30 يوما: 2 (33٪) من أصل 6 توسعات كانت متوافقة مع Treg لكل حالة مثيلة. مسور على الخلايا الحية. الخلايا هي CD4 + CD3 + CD8-. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التحقق من الاستنساخ. يجب التحقق من أحادية النسيلة لتوسعات الخلية. (أ) كانت المستنسخة ملطخة إيجابية لبقعة Vβ واحدة. في الحالة المعروضة ، Vβ17. (ب) يعرض مجموعة البيانات بأكملها ل 24 خصوصية Vβ بشرية. (ج) مبدأ الفحص. تم تلطيخ الخلايا بأجسام مضادة مترافقة مفردة أو مزدوجة FITC / PE ، كل منها خاص بسلسلة Vβ واحدة من مستقبلات الخلايا التائية البشرية. أظهر كل ربع أعلى من العتبة تلطيخا لسلسلة Vβ واحدة ، ولكن ليس غيرها. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
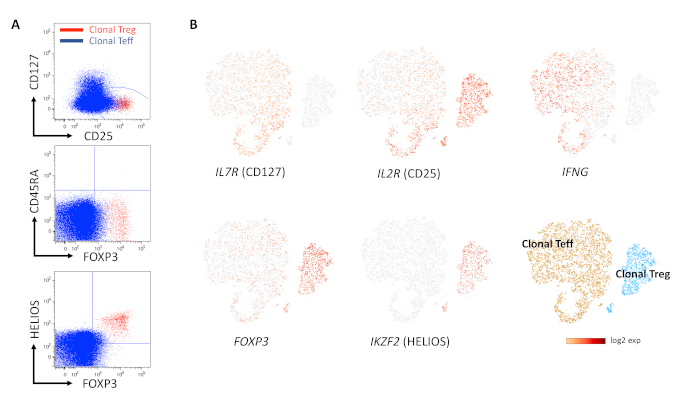
الشكل 4: تقييم النمط الظاهري لاستنساخ Treg بعد التوسع طويل الأجل. (أ) يوضح تحليل قياس التدفق الخلوي لاستنساخ Treg (الأحمر) و Teff (الأزرق) في مخططات التراكب أن التمايز بين Treg و Teff قد يكون صعبا نظرا للمستويات المنخفضة لتعبير FOXP3 و CD25 في Teff البشري. (ب) يوضح تسلسل الحمض النووي الريبي أحادي الخلية مع تحليل V (D) J لنفس المنتجات الخلوية كما في اللوحة A التعبير التفاضلي العالي ل HELIOS و FOXP3 و CD25 في Treg النسيلي مقابل Teffal Teff ، وغياب تعبير IFNg و CD127 بعد 51 أسبوعا في الثقافة. تنوع TCR في كل عينة هو 1 (أي أن التوسعات أحادية النسيلة). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: انتشار Treg في الثقافة. تستمر دورة التمدد النموذجية في الثقافة المحفزة بالمغذيات لمدة أسبوعين تقريبا ثم تتطلب إعادة التحفيز. يتم عرض مخطط تراكب لتعبير Ki67 لاستنساخ Treg ، في 7 (أحمر) و 11 (أزرق) و 14 (أخضر) يوما. تم استبعاد الخلايا المغذية المحتضرة من خلال تلطيخ الجدوى والبوابات على HLA-A24 الذي تم التعبير عنه بواسطة Treg ، ولكن ليس المتبرع بالخلايا المغذية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
يصف هذا البروتوكول انتشار الخلايا التائية التنظيمية البشرية فائقة النقاء من خلال عزل الخلايا التي تم الحصول عليها في نهج التخفيف المحدود والتوسع القائم على الخلايا المغذية من مجموعات البداية المحتوية على Treg.
الخطوات الحاسمة في هذا النهج هي: 1) اختيار مجموعة البداية المناسبة. بشكل عام ، يحتويمقصورة CD127loCD25 hi لخلايا CD4 + T داخل PBMC البشري على مجموعة متنوعة من Treg التي تناسب هذاالغرض 10،17. 2) يعد تعداد الخلايا الدقيق إلزاميا للاستنساخ الناجح نظرا لخطر بذر عدد كبير جدا من الخلايا ، والتي يمكن أن تولد لاحقا خطوط خلايا قليلة النسيلة ، أو بذر عدد قليل جدا ، مما يقلل من كفاءة الاستنساخ. يستخدم هذا البروتوكول مقياس كثافة الدم القياسي للعد. يمكن استخدام عدادات الخلايا الآلية ، إذا تم تحسين الإعدادات بشكل صحيح وتم فحص الأعداد ، بدلا من ذلك. 3) المراقبة والصيانة على المدى الطويل للصفائح ذات الخلايا الأولية المصنفة. تتكاثر Treg ببطء ، مما يعني أن المستنسخة قد تصبح مرئية بشكل مجهري في شكل كريات خلية فقط بعد عدة أسابيع في الثقافة. من المهم ملاحظة أن هذا الإطار الزمني يختلف اختلافا كبيرا عن ذلك النموذجي لأساليب الاستنساخ المماثلة المطبقة في توليد التيف سريع التكاثر ، مثل خلايا CD8 + T السامة للخلايا أو غيرها. 4) التقييم النقدي للنسخ التي تتكاثر ببطء. غالبا ما يخلق معدل الانتشار البطيء ل Treg مشاكل لا تواجهها عادة في مناهج استنساخ الخلايا المغذية المشععة ، حيث تموت الخلايا المغذية عادة بعد عدة أيام من التشعيع في الزراعة المشتركة مع المستنسخة أو خطوط الخلايا سريعة التكاثر. نظرا لمعدلات التوسع المنخفضة ل Treg ، غالبا ما تحتفظ الخلايا المغذية ببعض الجدوى في الثقافة لأكثر من 1-2 أسبوع ، على الرغم من التشعيع. يمكن أن يؤثر هذا على تفسير النتائج من تحليل المنتج الخلوي الناتج وتضليل المحقق. لذلك يوصى بفرز الخلايا المغذية التي ربما احتفظت ببعض الجدوى على أساس تعبير HLA ، والتي يجب أن تكون مختلفة عن تلك الموجودة في Treg الموسع. تموت جميع المغذيات في النهاية إذا تعرضت للإشعاع بشكل صحيح. 5) يعد فحص المستنسخة عن طريق pyrosequencing حتى الآن الطريقة الأكثر موثوقية لإثبات وجود Treg حسن النية في الثقافة. تحتوي فحوصات قمع Treg والتنميط الظاهري على قيود شديدة لا تسمح دائما بتقييم موثوق. يمكن الاستعانة بمصادر خارجية لمقدمي الخدمات التجارية أو إجراؤها داخليا. للحد من الوقت والتكاليف التي يتم إنفاقها على فحص الخلايا ، من المعقول أولا إنشاء أحادية النسيلة ، متبوعا بالفحص الظاهري (على سبيل المثال ، تعبير CD127 / CD25) القضاء على المستنسخة ذات الأنماطالظاهرية العالية غير CD127loCD25 (على الرغم من أن هذا قد يستبعد بعض الأنماط الظاهرية الحسنة النية) ثم المضي قدما في pyrosequencing باستخدام المستنسخة المحددة.
ويوفر الجدول 1 أداة لاستكشاف الأخطاء وإصلاحها بسرعة.
| مشكلة | التفسير والنهج المحتملين |
| لا يتم رؤية المستنسخة بعد أسبوعين. | انتظر واستمر في الحفاظ على الثقافة. تتوسع Treg ببطء وتحتاج عادة إلى مزيد من الوقت لتشكيل كريات الخلايا المرئية من Teff. |
| لا تظهر المستنسخة التي تم الحصول عليها نمطا ظاهريا Treg في تحليل قياس التدفق الخلوي. | 1) المستنسخة هي Teff. حصاد المستنسخة التي تصبح مرئية لاحقا - من المرجح أن تكون Treg ، نظرا للانتشار البطيء. |
| 2) لوحة التلوين غير محسنة بشكل كاف. صقل اللوحة أو استخدم لوحة تلطيخ Treg محسنةمنشورة 10. | |
| تحقق من المستنسخة الواعدة ظاهريا من خلال التسلسل الحراري في TSDR. | |
| خطوط الخلايا التي تم الحصول عليها ليست نسيلية. | تأكد من حساب الخلايا بدقة عند البذر وعدم السماح لها بالترسيب قبل البذر. أضف PHA-L مباشرة قبل البذر عند طلاء المغذيات و Treg الأولية معا ، أو قم بإخراج Treg أولا ثم أضف PHA والمغذيات. يتسبب PHA في تكتل الخلايا ويمكن أن يؤثر سلبا على الحفاظ على تعليق خلية واحدة عند طلاء الخلايا المخصبة ب Treg. |
| تأكد من أن الخلايا المغذية ميتة في وقت التحليل أو فرزها إذا كنت في شك (انظر التعليقات على البقاء الممتد للمغذيات المشعة عند زراعتها مع الخلايا الأولية التي تتوسع ببطء). | |
| تظهر المستنسخة الأنماط الظاهرية Treg عن طريق قياس التدفق الخلوي وقمع فحوصات قمع في المختبر بواسطة لا يتم إزالة الميثيل في TSDR. | يحل نزع الميثيل في TSDR محل فحوصات القمع ويؤدي تحليل قياس التدفق الخلوي إلى تحديد هوية Treg. يمكن للخلايا المستجيبة تقليل عدد خلايا الخلايا التائية المستجيبة بطريقة تعتمد على الجرعة من خلال التأثيرات السامة للخلايا وغيرها من التأثيرات. قد يكون من الصعب تفسير نتائج قياس التدفق الخلوي للنسخ عندما لا يمكن الحصول على ضوابط بيولوجية دقيقة بالنظر إلى مستويات متغيرة من تعبير FOXP3 و CD25 في Treg و Teff. |
| تتوقف استنساخ Treg ذات الانتشار الأولي المقبول عن التوسع في دورات التوسع / التحفيز اللاحقة. | حاول إكمال التجربة - ستتوقف بعض نسخ Treg عن التوسع. |
| حاول التوسع مع متبرعين مختلفين بالخلايا المغذية الخيفية - يعمل بعضها بشكل أفضل من البعض الآخر. | |
| إذا تكاثرت الخلايا سابقا بشكل جيد مع متبرع معين بالخلايا المغذية ، فقد يكون من المفيد التوسع باستخدام خلايا من نفس المتبرع مرة أخرى في دورات التوسع اللاحقة إذا كان ذلك ممكنا. | |
| يمكن اكتشاف خلايا التغذية القابلة للحياة عن طريق قياس التدفق الخلوي عند تحليل خط الخلية / الاستنساخ. | قد يحدث هذا عندما تتكاثر Treg ببطء حيث تكون هناك منافسة أقل مما يسمح للخلايا المغذية المشععة بالبقاء على قيد الحياة لفترة أطول من المعتاد. قم بفرز المستنسخة بناء على تعبير HLA الموجود في Treg ، ولكنه غائب في خلايا التغذية. تأكد من استخدام صبغة قابلة للحياة. ستموت جميع المغذيات المشعة بشكل صحيح في النهاية. |
الجدول 1: استكشاف الأخطاء وإصلاحها.
تشمل التعديلات المحتملة لهذه الطريقة ما يلي: 1) طريقة عزل Treg. يمكن استخدام FACS ، ولكن مع مراعاة العيوب المذكورة أعلاه. ومع ذلك ، فإنه يسمح بتحكم فوري أفضل في خصائص النمط الظاهري للسكان المبتدئين المستهدفين ويمكن أن يكون مفضلا إذا لم يتم الحصول بسهولة على مجموعة أولية محددة ذات أهمية عن طريق الفرز المغناطيسي. 2) اختيار مجموعة فرعية معينة من Treg كمجموعة أولية. على سبيل المثال ، TIGIT / CD226 مقابل CD39 + Treg مقابل القياسي أو CD45RA + FOXP3int مقابل CD45RA-FOXP3hi. تم اقتراح العديد من الخصائص المظهرية لترسيم المجموعات الفرعية Treg بشكل خاص قابلة للتوسع المستقر والنشاط القمعيالعالي 18،19. 3) الخلايا المغذية المحفوظة بالتبريد مقابل الخلايا المغذية الجديدة. قد يكون استخدام الخلايا المغذية المذابة (المشعة بالتبريد أو غير المشعة مع التشعيع اللاحق) ممكنا ولكن لا يوصى به ولم يتم تقييمه بشكل منهجي لهذا البروتوكول. 4) فحص الاستنساخ عن طريق تفاعل البوليميراز المتسلسل مقابل قياس التدفق الخلوي. يوفر التسلسل تغطية أفضل من تلطيخ TCR Vβ وقد يكون مفضلا لتحديد أحادية النسيلة20 ، ولكنه يتطلب المزيد من الجهد والوقت للإعداد أكثر من تلطيخ Vβ. 5) فحوصات قمع في الجسم الحي مثل نماذج GVHD الغريبة في فئران NSG. قد تكون هذه أفضل من المقايسات في المختبر ولكنها تستغرق وقتا طويلا وكثيفة العمالةومكلفة 14. قد تكون ممكنة في الأماكن التي يتم فيها الحفاظ بشكل روتيني على مستعمرات الفئران NSG أو غيرها من متلقي الفئران غير المؤهلين للمناعة للخلايا البشرية. 6) توليد استنساخ Treg الخاص بالمستضد. يمكن محاولة ذلك من خلال تطبيق نهج مناسب لعزل Treg الخاص بالمستضد ، مثل تلطيخ رباعي / بوليمر ، وعزل الخلايا المستجيبة في فحوصات التحفيز الخاصة بالمستضد (AG) ، أو أي تقنية أخرى مماثلة ، والتطبيق اللاحق لهذا البروتوكول. ومع ذلك ، قد يؤدي تلطيخ رباعي الخلايا إلى تغيير قابلية الخلايا المعزولة للحياة وقد يتعين زرع المزيد من الخلايا.
تشمل قيود هذا البروتوكول ما يلي: 1) الانتشار البطيء ل Treg يحد من إنتاجية الخلية. الانتشار البطيء ل Treg هو القيد الرئيسي لتوسيعها في المختبر على المدى الطويل. ينطبق هذا على البروتوكول المقدم هنا. 2) خصوصية مستضد غير معروفة. لا يحدد البروتوكول الحالي Treg استنادا إلى خصوصية AG المعروفة. في حين أن أحادية النسيلة للمنتج الناتج تنطوي على درجة عالية من الخصوصية ل AG ، فإن الخصوصية غير معروفة بداهة. قد يكون اختيار مجموعة أولية ذات خصوصية AG معروفة أمرا صعبا نظرا لانخفاض تردد السلائف ل Treg الخاص ب AG في الدم المحيطي البشري ، ولكن يمكن معالجته عن طريق التخصيب المسبق ل Treg الذي تم توسيعه مسبقا استجابة للمستضد (المستضدات) المطلوب ، أو الاستهداف المباشر باستخدام مناهج ببتيد معقد التوافق النسيجي الكبير البوليمرية ، أو طرق أخرى. 3) قد يؤدي استخدام المواد البشرية في عملية التوسع إلى الحد من التطبيقات العلاجية. يشكل استخدام الخلايا المغذية البشرية تحديا للتطبيقات العلاجية ولكنه لا يمنعه. جميع الكواشف اللازمة لتنفيذ هذا البروتوكول متوفرة في معايير ممارسات التصنيع الجيدة (GMP) (IL-2 و PHA-L). قد يساعد استخدام الخلايا العارضة للمستضد الاصطناعي (APC) وكوكتيلات السيتوكين في التخفيف من الحاجة إلى الخلايا المغذية ، ولكن لا يزال يتعين اختبارها. 4) الخلايا طويلة الأمد ، في المختبر متوسعة. هذا يعني أنه لا يوجد ما يضمن أن هذه الخلايا تعكس بشكل كاف Treg التي تحدث من الناحية الفسيولوجية نظرا لثقافتها المختبرية على المدى الطويل.
تكمن الأهمية الرئيسية لهذا النهج مقابل الأساليب الحالية / البديلة في قدرته على توليد منتج خلية Treg فائق النقاء يحافظ على مواصفات تحديد Treg على مدى فترات طويلة جدا من الزمن في الثقافة. يسمح نهج الاستنساخ للمحقق بالتحكم في خصائص الخلايا المسموح لها بالمضي قدما في تجارب التمدد ، وبالتالي القضاء على انتشار الخلايا من نوع Teff. اعتمدت معظم الطرق الأخرى على التوسع متعدد النسيلة أو قليل النسيلة ل Treg ، مما يؤدي غالبا إلى ضعف وظيفة المثبط بمرور الوقت.
تشمل التطبيقات والاتجاهات المستقبلية للطريقة ما يلي: 1) إنشاء استنساخ Treg الخاص ب AG. قد يؤدي هذا جزئيا إلى التحايل على القيود المتعلقة بالانتشار البطيء ل Treg حسن النية ويقلل من الحاجة إلى أعداد كبيرة من Treg في التطبيقات السريرية المستهدفة. 2) التطبيقات التي تتطلب أعداد منخفضة من Treg. يتضمن ذلك التحليل الظاهري والوظيفي للنسخ (على سبيل المثال ، تسلسل الحمض النووي الريبي). 3) مناهج التحرير الجيني النهائي. يمكن دمج هذه الطريقة مع تعديل CRISPR-Cas9 ، على سبيل المثال ، للسماح بتقييم ومعالجة وظائف جينية معينة في Treg البشري.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تم دعم هذا المشروع من قبل المعهد الوطني للعيون التابع للمعاهد الوطنية للصحة بموجب الجائزة رقم K08EY025324 (Nowatzky) وجائزة Colton Scholar من مركز جوديث وستيوارت كولتون للمناعة الذاتية (Nowatzky).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm Stericup, 500 mL | Millipore | 5500 | Media storage and preparation |
| 100x Nonessential amino acids | Gibco | 11140-050 | Media component |
| 15 mL conical centrifuge tubes (50/bag, case of 500) | ThermoFisher Scientific | 339650 | |
| 1M HEPES | Gibco | 15630-080 | Media component |
| 25 ml Single Well Pipet Basin | Fischer Scientific | 13-681-508 | |
| 50 mL Conical Centrifuge Tube (25/sleeve) | ThermoFisher Scientific | 339652 | |
| 50x Penicillin Streptomycin Soln | Corning | Corning, 30-001-Cl | Media component |
| CryoTube Vial Int Thread Round Btm Starfoot PP Screw Stopper Sterile PP 1.8 mL | Nalge Nunc | 377267 | |
| DMSO | Corning | 25-950-CQC | |
| EasySep Human CD25 positive selection kit | Stemcell Technologies | 18231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127low T cell Pre-Enrichment Kit | Stemcell Technologies | 19231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127lowCD25+ Regulatory T Cell Isolation Kit (alternative to item 12) | Stemcell Technologies | 18063 | Alternatives are FACS or MACS column-based sorting |
| Ficoll | GE Healthcare | 17-5442-03 | PBMC purification from peripheral blood of leukapheresis products; density gradient medium |
| Human AB Serum (PHS-AB) | Valley Biomedical Inc | HP1022 | Media component |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Thermo Fischer | L-34962 | Viability dye |
| Phytohemagglutinin-L (PHA-L) | Millipore/Sigma | 11249738001 | T cell stimulation |
| Recombinant IL-2 (e.g., PROLEUKINâ) | Prometheus | T cell stimulation and maintenance/ Media component | |
| RPMI 1640 | Gibco | 21870-076 | Media component |
| Staining antibodies for flowcytometry (Treg phenotyping) | See "Comments" | See "Comments" | Staining antibodies are enlisted in: Nowatzky et al. (2019) PubMed PMID: 30584695; PubMed Central PMCID: PMC6497402. In case EasySep Human CD25 positive selection kit is used, stain with 2A3 or BC96 anti-CD25 antibody, e.g.: Brilliant Violet 421 anti-human CD25 Antibody (Biolegend; 302629) |
| TCR Vβ Repertoire Kit; IOTest Beta Mark | Beckman Coulter | PN IM3497 | Vetting of expansions for monoclonality |
| Tissue Culture Plate, 96 Well, U-Bottom with Low Evaporation Lid | Corning | 353077 |
References
- Miyara, M., et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity. 30 (6), 899-911 (2009).
- Polansky, J. K., et al. DNA methylation controls Foxp3 gene expression. European Journal of Immunology. 38 (6), 1654-1663 (2008).
- Toker, A., et al. Active demethylation of the Foxp3 locus leads to the generation of stable regulatory T cells within the thymus. The Journal of Immunology. 190 (7), 3180-3188 (2013).
- Garg, G., et al. Blimp1 Prevents Methylation of Foxp3 and Loss of Regulatory T Cell Identity at Sites of Inflammation. Cell Reports. 26 (7), 1854-1868 (2019).
- Brunstein, C. G., et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood. 117 (3), 1061-1070 (2011).
- Hippen, K. L., et al. Massive ex vivo expansion of human natural regulatory T cells (T(regs)) with minimal loss of in vivo functional activity. Science Translational Medicine. 3 (83), 41(2011).
- Bluestone, J. A., et al. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Science Translational Medicine. 7 (315), 189(2015).
- Dromey, J. A., et al. Generation and expansion of regulatory human CD4(+) T-cell clones specific for pancreatic islet autoantigens. Journal of Autoimmunity. 36 (1), 47-55 (2011).
- Sabado, R. L., et al. Preparation of tumor antigen-loaded mature dendritic cells for immunotherapy. Journal of Visual Experiments. (78), e50085(2013).
- Nowatzky, J., Stagnar, C., Manches, O. OMIP-053: Identification, Classification, and Isolation of Major FoxP3 Expressing Human CD4(+) Treg Subsets. Cytometry A. 95 (3), 264-267 (2019).
- Zhang, Y., et al. Genome-wide DNA methylation analysis identifies hypomethylated genes regulated by FOXP3 in human regulatory T cells. Blood. 122 (16), 2823-2836 (2013).
- Spreafico, R., et al. A sensitive protocol for FOXP3 epigenetic analysis in scarce human samples. European Journal of Immunology. 44 (10), 3141-3143 (2014).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods in Molecular Biology. 707, 21-37 (2011).
- Workman, C. J., et al. In vivo Treg suppression assays. Methods in Molecular Biology. 707, 119-156 (2011).
- Feng, Y., et al. Control of the inheritance of regulatory T cell identity by a cis element in the Foxp3 locus. Cell. 158 (4), 749-763 (2014).
- Toker, A., Huehn, J. To be or not to be a Treg cell: lineage decisions controlled by epigenetic mechanisms. Science Signaling. 4 (158), 4(2011).
- Liu, W., et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. Journal of Experimental Medicine. 203 (7), 1701-1711 (2006).
- Fuhrman, C. A., et al. Divergent Phenotypes of Human Regulatory T Cells Expressing the Receptors TIGIT and CD226. The Journal of Immunology. 195 (1), 145-155 (2015).
- Gu, J., et al. Human CD39(hi) regulatory T cells present stronger stability and function under inflammatory conditions. Cellular & Molecular Immunology. 14 (6), 521-528 (2017).
- Genevee, C., et al. An experimentally validated panel of subfamily-specific oligonucleotide primers (V alpha 1-w29/V beta 1-w24) for the study of human T cell receptor variable V gene segment usage by polymerase chain reaction. European Journal of Immunology. 22 (5), 1261-1269 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved