Method Article
인간 조절 T 세포 클론의 생성
요약
이 프로토콜은 Treg 특이적 탈메틸화 영역(TSDR) 및 Treg 특이적 표현형 특징에서 안정적인 탈메틸화를 갖춘 초고순도 생존 가능한 인간 Treg의 생성을 위한 인간 조절 T 세포의 클로닝 및 확장을 설명합니다.
초록
인간 조절 T 세포(Treg)는 현재의 Treg 농축 방법을 고려할 때 고순도로 분리하기 어려운 것으로 악명이 높습니다. 이러한 방법은 다양한 생리학적 및 병리학적 조건에서 다양한 발현 수준을 가진 여러 활성화 의존적 세포 표면 마커를 통한 Treg의 식별을 기반으로 합니다. 따라서 "Treg"로 분리된 집단에는 상당한 수의 non-Treg effector 세포(즉, Teff)가 포함되어 있는 경우가 많으며, 이는 이러한 세포의 정확한 표현형 및 기능적 특성화, 게놈 및 단백질체 특성화, 다양한 건강 및 질병 상태에서의 신뢰할 수 있는 계수, 치료 목적을 위한 격리 및 확장을 방해합니다. 특히 후자는 Treg 관련 세포 구획(예: CD4+CD25+ T 세포)으로 귀환하는 효과기 세포의 부주의한 확장으로 인해 Treg 기반 면역 요법이 비효과적이거나 심지어 해로울 수 있기 때문에 주요 장애물로 남아 있습니다. 이 연구는 Treg의 집단 기반 분리 및 증식과 관련된 문제를 우회하는 방법을 제시하고, 신중하게 검사된 단클론 세포의 후속 선택, 배양 및 증식을 통한 Treg 후보 클론의 생성이 수개월 동안 배양에 보관할 수 있는 초순수 Treg 세포 생성물의 생성을 가능하게 함을 보여줍니다. 가능한 치료 응용 프로그램을 포함하여 이러한 세포에 대한 다운스트림 연구를 가능하게 합니다.
서문
이 프로토콜의 목적은 초고순도 클론 human Treg의 체외 증식을 가능하게 하는 것입니다. Treg가 풍부한 집단의 분리 및 후속 클로닝을 통해 원하는 Treg 표현형을 선택하고 이러한 세포의 생물학에 대한 추가 연구, 잠재적인 치료 유용성 탐색 및 기타 실험적 다운스트림 응용 프로그램을 위한 확장을 수행할 수 있습니다.
Treg를 클로닝하면 다클론 분리 및 확장 방법보다 훨씬 더 나은 Treg 순도를 얻을 수 있습니다. 이는 FOXP3 발현(FOXP3int, CD45RA,neg, CD25int), non-Treg 및 CD4+, CD25+, FOXP3-Teff1 등을 포함하여 정제된 집단에서 유사하거나 다른 표현형을 가진 T effector cell을 신뢰할 수 있고 통제된 배제에 기인합니다. 이 접근법을 통해 얻은 클론 세포주는 매우 장기적인 확장(즉, 수개월) 및 세포의 체외 배양을 실질적으로 불가능하게 하거나 적어도 극도로 어렵게 만드는 빠르게 팽창하는 non-Treg 클론으로 인한 과증식 문제에 직면하지 않습니다. Clonal Treg는 또한 인간의 진정한 자연 Treg 1,2,3,4(예: TSDR에서 안정적인 탈메틸화)를 나타내는 후성유전학적 특징의 평가를 위한 표준으로 인정되는 방법을 포함하여 확장 후 표현형 특징에 대한 광범위한 검사를 허용합니다.
Treg 확장은 주로 연구 및 치료 목적으로 다클론 세포 확장의 형태로 수행되었습니다 5,6,7. Teff 오염 문제는 Treg 세포 기반 면역 요법 접근법의 성공적인 구현에 대한 주요 장애물입니다. 문헌에서 단클론 Treg를 확장/생성하려는 이전의 시도는 드물었고 장기적으로 Treg 특징의 유지를 보여주지 못했습니다8.
이 방법은 진정한 인간 Treg의 세포, 분자 및 대사 특성을 연구하는 모든 사람에게 흥미로울 것입니다. 특히 이 프로토콜의 사용을 통해 생성된 초순수 Treg 산물은 게놈 접근 방식을 사용한 분석에 적합합니다. 일반적으로 인간 Treg를 특징짓는 상대적으로 낮은 팽창률을 감안할 때 이 방법은 엄청난 수의 세포의 급속한 확장을 원하는 사람들에게는 제한적으로 사용될 수 있습니다. 그러나 이 프로토콜로 생성된 Treg의 순도가 매우 높다는 점을 감안할 때 더 적은 수의 Treg는 생성된 산물의 전반적인 억제 전위를 제한하는 효과기 세포를 포함하는 다클론 세포주의 더 큰 확장과 유사하거나 더 나은 효능을 가질 수 있습니다.
프로토콜
이 프로토콜은 인체 샘플 사용과 관련된 연구의 윤리적 수행과 관련된 모든 기관 지침을 따릅니다. 인간 세포 및 기타 인간 혈액 제제에 대한 작업은 최소한 BLS-2 안전 지침에 따라 BSL-2 인증 환경에서 이루어져야 합니다.
1. CD4+CD127loCD25hi 세포를 위한 인간 말초 혈액 단핵 세포의 사전 농축
주의 : 전체적으로 멸균 기술을 사용하십시오. 날카로운 물건은 적절한 날카로운 물건 용기에 즉시 폐기하십시오. 폐기하기 전에 혈액 및/또는 혈액 제제와 접촉한 모든 것을 표백하십시오. 생물 안전 캐비닛에서 작업하십시오.
- 말초 혈액 채취 또는 백혈구 성분 채취 또는 백혈구 성분 채취를 통해 인간 백혈구(즉, "백혈구")가 풍부한 혈액 제제를 얻습니다. 셀을 즉시 처리하십시오.
알림: 야간 보관을 피할 수 없는 경우 실온(RT)에서 셀을 보관하고 운송하십시오. 추위에 노출되지 않도록 하십시오. - 앞서 설명한 바와 같이 밀도 구배 매질에서 구배 원심분리를 통해 말초 혈액 단핵 세포(PBMC)를 분리합니다9.
- 혈구계 또는 세포 계수기를 사용하여 PBMC를 주의 깊게 계수합니다. 가능하면 최소 300 x 106 PBMC를 사용하여 Treg 절연을 진행하십시오.
- PBMC를 50 x 106 cells/mL 농도의 분리 완충액(인산염 완충 식염수[PBS]에 1.5mM EDTA가 포함된 2% 풀링 인간 AB 혈청[PHS-AB])에 재현탁하고 사용된 분류 키트의 제조업체 지침에 따라 자기 분류를 진행합니다. 예를 들어, CD4+CD127lo T 세포 집단의 음성 분리를 위해 자기 세포 분류(Table of Materials)를 사용한 다음 CD25+ 세포에 대해 양성 선택 분류를 사용합니다.
참고: Treg의 자기 정제에는 컬럼 기반 및 컬럼 없는 접근법을 포함한 다양한 제품을 사용할 수 있습니다. 또는 CD127loCD25높은 CD4+ T 세포에 게이팅을 사용한 형광 활성화 세포 분류(FACS)를 수행할 수 있습니다. 그러나 표준 FACS 장비로는 완전한 멸균이 불가능하므로 심각한 오염 위험이 있습니다. 또한 유체 시스템에 의해 발생하는 세포 스트레스 및 손상은 배제할 수 없으며 기기 레이저가 결과에 영향을 미칠 수 있습니다. - CD4, CD3, CD127 및 CD25에 대한 염색을 통해 생성된 Treg-enriched 집단의 순도를 확인합니다(그림 1). 정확한 결과를 얻으려면 Table of Materials에 명시된 것과 같이 분류 키트에 사용된 것과 다른 CD25 결합 도메인을 인식하는 anti-human CD25 항체를 선택하십시오. Nowatzky et al.10에 설명된 것과 같은 표준 표면 염색 프로토콜을 사용하여 세포를 염색하고 고정합니다.
2. CD127loCD25hi preenriched human CD4+ T cell suspension에서 Treg 클로닝
- 단계 1.4에서 수득한 Treg-농축된(CD4+CD127loCD25hi) 세포를 T 세포 배지([TCM]; RPMI 1640, 5% PHS-AB, 1% 스트렙토마이신/페니실린, 1% HEPES, 1% 비필수 아미노산 및 1% 글루타민)과 300 IU/mL의 인간 재조합 인터루킨-2(IL-2)(재료 표)는 ~1−3 x 106 cells/mL 및 count의 농도를 목표로 합니다. 정확한 계수가 절대적으로 중요하기 때문에 진행하기 전에 최소 3개의 개별 세포 수를 얻고 평균 세포 수를 계산하십시오.
- 두 가지 농도로 세포의 단일 세포 현탁액을 준비합니다: (1) 3 cells/mL 및 (2) 6 cells/mL. 현탁액 1의 100μL/웰로 5개의 둥근 바닥 96 웰 플레이트를 로드하고 현탁액 2로 5개의 플레이트를 로드합니다. 각각 0.3 및 0.6 세포/웰의 분포를 보장하기 위해 플레이트를 로드할 때 세포를 현탁액으로 유지하도록 세심한 주의를 기울이십시오.
참고: 세포 농도를 1 cell/well로 증가시키지 마십시오, 이는 진정한 클론이 아닌 oligoclonal 세포주를 얻을 위험을 증가시키기 때문입니다. - 1.2단계에서와 같이 밀도 구배 원심분리를 통해 얻은 갓 분리된 인간 동종 PBMC에서 공급세포를 준비합니다.
- ~10 x 106 PBMC/mL의 농도로 50mL 폴리프로필렌 튜브에서 IL-2가 없는 TCM에서 인간 동종 PBMC를 재현탁하여 방사선 조사를 위해 클로닝 플레이트당 최소 10 x 106 feeder cell을 준비합니다. 튜브를 단단히 닫고 감마 조사기 또는 X선 기반 조사 장치에 35Gy를 조사합니다.
참고: 방사선 조사는 Teff의 증식을 촉진하는 공급기에서 다량의 사이토카인 분비를 유발하지만 Treg 확장에 부정적인 영향을 미칠 수 있습니다. 이것들은 다음으로 세탁으로 제거됩니다. - 450 x g 에서 세포를 원심분리하고 방사선 조사 후 5분 동안 실온하고 상층액을 흡인합니다. 배지/PBS의 펠릿화된 공급 세포 부피의 최소 10배를 사용하여 IL-2 없이 TCM에서 세포를 재현탁하여 세포를 세척합니다.
참고: 클론 처리할 공여자 세포의 인간 백혈구 항원(HLA) 발현 프로파일을 결정하는 것이 좋습니다. 이는 각 공여자가 유래한 집단에서 공통적인 하나 또는 여러 HLA 유형(즉, HLA-A2 또는 HLA-A24)에 대한 간단한 염색을 통해 수행할 수 있습니다. 공급세포로 사용되는 PBMC는 공급체의 방사선 유도 세포사멸 전에 확장 배양에서 표적 세포의 재식별/분리를 가능하게 하기 위해 이 HLA를 발현해서는 안 됩니다. - 방사선 조사 및 세척된 공급세포를 1 x 106 cells/mL의 농도로 300 IU/mL IL-2로 TCM에 재현탁합니다.
- 4 μg/mL(배양에 필요한 농도의 2배)의 농도로 phytohemagglutinin-L(PHA-L)(재료 표)을 추가하고 2.8단계로 빠르게 진행합니다.
- 100μL의 TCM에 4μg/mL PHA-L 및 300IU/mL IL-2와 함께 조사된 100,000개의 방사선 조사된 공급 세포를 플레이트된 Treg 농축 세포에 추가하여 각 웰에서 총 부피 200μL 및 2μg/mL의 PHA-L 농도를 얻습니다. 위아래로 5회 피펫팅하여 잘 섞습니다. Treg에 추가하기 전에 PHA-L에 대한 공급 세포의 노출 시간을 필요한 절대 최소값으로 제한하고 플레이트가 생성될 때까지 현탁액을 유지합니다.
참고: 초기 파스팅 단계에서 배양액에서 2 μg/mL의 PHA-L 농도를 보장하되, Treg 클론의 후속 팽창 시에는 더 낮은 1 μg/mL 농도를 사용하십시오. 전체적으로 300 IU/mL의 IL-2를 사용하십시오. - 37 °C에서 배양합니다. 5-7일에 300IU/mL IL-2가 있지만 PHA-L이 없는 TCM을 사용하여 배지의 50%를 변경합니다.
3. Treg의 확장 및 배양에서 클론 유지
- 12일차부터 증식하는 세포의 펠릿이 있는지 배양액을 확인합니다.
참고: 영양 세포에 의해 형성된 펠릿이 있지만 현미경 검사에서는 작거나 둥글거나 죽어가는 세포로 나타나는 반면, 증식하는 T 세포는 크기가 더 크고 대비가 밝고 건강한 모양으로 종종 거시적 검사에서 갈색으로 보이는 인접한 세포의 클러스터를 형성합니다. - 1-2일마다 배양을 계속 검사합니다. 증식하는 임시 클론을 단일 웰로 옮겨 격리합니다. 각 임시 클론을 단일 96 웰 플레이트에 배치하여 다른 웰에서 의도하지 않은 세포 전달로 인해 주어진 임시 또는 확립된 클론의 교차 오염을 방지합니다.
- 2-3일마다 50%의 배지 교체를 통해 세포를 유지하고 필요에 따라 분할합니다. 세포를 면밀히 모니터링하십시오.
참고: 배지 변경 및 분할을 지연하면 세포에 해를 끼칠 수 있으며 "과도한 분할"은 세포의 증식을 저지하고 세포를 사멸시킬 수 있습니다. - 2.3-2.9단계에 설명된 대로 방사선 조사된 동종 공급기로 세포를 재조정하되 더 낮은 PHA-L 농도(즉, 300IU/mL IL-2를 사용한 TCM의 1μg/mL)를 사용합니다. 세포 크기가 감소하고 세포가 둥글게 될 때 일반적으로 2-3주 후인 길쭉한 타원형과 반대로 재충전합니다.
참고: 원래 클로닝 배양을 최소 6-8주 동안 유지하십시오. 2주 또는 2주 직후에 가시화되는 많은 '초기' 클론은 진정한 Treg가 아닌 경향이 있지만, 빠르게 증식하는 non-Treg/Teff 세포이며 '후기' 세포보다 심사에 실패할 가능성이 더 높으며, 그 중 일부는 배양에서 눈에 띄게 나타나는 데 1개월 이상이 걸립니다.
4. 임시 Treg 클론 심사
- 임시 클론이 ~1 x 106 세포로 증식하면 단클론성 및 TSDR 메틸화 상태에 대한 검사를 시작합니다.
- 선택적으로, CD3, CD4, CD127 및 CD25를 염색하여 세포 확장을 사전 스크리닝하여 추가 평가를 위해 관심 항목(즉, CD3+CD4+CD127loCD25hi)을 식별합니다(그림 2).
- 시판되는 염색 항체 세트를 사용하여 Vβ 염색에 의한 세포 생성물 내 단일 Vβ 사슬의 존재 확인을 통해 단클론성을 확립합니다(Table of Materials; 그림 3) 제조업체의 지침에 따라. 신뢰할 수 있는 분석을 위해 유세포 분석기에서 샘플을 실행할 때 최소 1 x 106 이벤트를 획득하여 소량의 오염 집단을 검출할 수 있도록 하십시오. 생존 염료를 사용하십시오.
- 상업 제공자 또는 사내에서 평가한 FOXP3 유전자 자리에서 TSDR 메틸화 상태가 있어야 합니다11,12. 적절한 결과를 얻으려면 최소 1 x 105 세포를 얻으십시오.
- 4.3단계 및 4.4단계에서 Treg 정체성 및 클론성이 확인되면 세포를 동결 보존하거나 다운스트림 애플리케이션에 사용합니다.
참고: 대안적이지만 훨씬 덜 신뢰할 수 있는 심사 접근법은 FACS 염색 1,10 및 시험관 내 또는 생체 내 억제 분석13,14에 의해 Treg 표현형을 결정하는 것입니다. Treg 억제 분석법에 대한 과도한 의존을 피하십시오13. 분석은 일반적으로 배타적이지는 않지만 일반적으로 제3자 항원 제시 세포 또는 염료 희석이 판독값으로 나타나는 CD3/CD28의 존재 하에 반응 T 세포(즉, PBMC 또는 정제된 T 세포, 때로는 Treg가 고갈됨)와 함께 등급화된 숫자의 Treg의 공동 배양을 기반으로 합니다. 이러한 분석의 대부분은 심각한 한계를 가지고 있으며 Treg에 의해 매개되는 실제 억제 정도를 과대 또는 과소 평가할 수 있습니다. TSDR 메틸화 상태는 Treg 표현형 또는 "정체성"3,15,16의 가장 확실하고 신뢰할 수 있는 척도로 남아 있습니다. FOXP3는 X 염색체에 위치하며 여성의 경우 하나의 X 염색체가 DNA 메틸화에 의해 비활성화되어 TSDR 메틸화 분석 결과에 영향을 미칩니다.
5. Treg의 냉동 보존
참고: Treg는 DMSO 및 PHS-AB를 사용하여 성공적으로 동결 보존한 후 장기간 보관할 수 있습니다.
- 세포를 동결 보존하는 데 필요한 cryovials의 수를 결정합니다. 이는 바이알당 1mL가 동결되기 때문에 동결 보존할 세포 현탁액의 총 최종 부피(mL)와 동일합니다. 피펫팅/표면 장력으로 인한 손실을 설명하기 위해 이 부피에 10%의 안전 여유를 추가하십시오.
참고: 세포는 일반적으로 0.1-100 x 106 cells/mL 사이의 광범위한 농도로 동결 보존할 수 있습니다. - cryovials에 레이블을 지정합니다.
- 용액 A(SA) 생성: 50% RPMI와 50% PHS-AB 또는 인간 플라즈마를 혼합합니다. 플라즈마를 사용하는 경우 2,000 x g 에서 4°C에서 20분 동안 회전합니다.
참고: SA의 부피는 5.1단계에서 결정된 대로 동결 보존할 세포 현탁액의 총 최종 부피의 75%여야 합니다. - 용액 B(SB) 생성: 60%(v/v) PBS 또는 RPMI와 40%(v/v) 디메틸설폭사이드(DMSO)를 혼합합니다.
참고: SB의 부피는 5.1단계에서 결정된 대로 동결 보존할 세포 현탁액의 총 최종 부피의 25%여야 합니다. - 두 용액을 모두 4°C로 냉각합니다.
- SB를 모두 SA와 동일한 비율로 혼합하여 냉동 매체를 준비하고 얼음에 보관하십시오.
- 4.5 x g에서 450 x g 에서 4 ° C에서 5 분 동안 Treg를 스핀합니다. 배지를 흡인 및 폐기하고, 얼음처럼 차가운 SA에 남아 있는 세포를 재현탁하고 얼음 위에 보관합니다.
- 튜브를 흔들면서 얼음 위의 큰 튜브에 SA에 재현탁한 세포에 냉각된 동결 매체를 1:1로 천천히 첨가합니다.
- 1 mL/바이알에서 극저온 여과액으로 빠르게 분취합니다. 즉시 극저온 여과제를 RT의 찬장 상자에 넣고 지체 없이 -80°C 냉동고로 옮깁니다. 24시간 후에 액체 N2 로 옮깁니다.
결과
이 프로토콜의 성공적인 구현은 안정적인 인간 조절 T 세포 클론 및 라인의 생성으로 이어질 것입니다.
CD4+CD127loCD25hi 세포의 사전 선택/사전 농축은 대부분의 human Treg를 포함하는 시작 집단을 얻는 간단한 방법이었습니다(그림 1A–C). 모든 클론이 Treg 표현형을 나타내는 것은 아닙니다. CD25hiCD127lo 발현 측정에 의한 클론의 사전 스크리닝은 관심 클론을 식별하기 위한 합리적인 접근 방식이었으며 사전 선택을 통해 타겟 클론 생성의 효율성을 높였습니다(그림 2A, B). 클론성 평가는 TCR Vβ에 대한 염색을 통해 쉽게 달성할 수 있으며, 세포 산물에서 하나의 단일 Vβ 사슬을 입증해야 했습니다(그림 3A,B). 그러나 유세포 분석만을 사용하여 클론을 특성화하면 특히 FOXP3, CD25 및 CD127 염색에서 볼 수 있듯이 Teff 및 Treg 세포의 불완전한 분리로 인해 결과가 잘못 해석될 수 있습니다(그림 4A). CD45RA와 FOXP3/CD25를 함께 사용하면 더 나은 단서를 제공할 수 있지만, CD45RA 음성 하위 집합(FOXP3int CD45RAneg cell은 억제하지 않음)에서 중간 및 높은 FOXP3 및/또는 CD25 사이의 매우 중요한 구별은 이 시나리오에서 형광 마이너스 1(FMO) 게이팅 제어가 제한적인 도움이 되기 때문에 생물학적 제어(이상적으로는 이 예에서와 같이 Treg 클론)를 초기에 사용할 수 없기 때문에 어려울 수 있습니다. 그리고 네이티브 "대조군" PBMC/T 세포의 염색은 최적화 및/또는 해석이 어려울 수 있습니다10. FOXP3와 HELIOS를 결합한 염색이 일반적으로 가장 신뢰할 수 있는 결과를 제공했지만, 널리 받아들여지는 TSDR의 메틸화 상태와 달리 HELIOS를 Treg 마커로 사용하는 것은 다소 논란의 여지가 있습니다. 그림 4는 유세포 분석(그림 4A) 및 VD(J) 분석을 통한 단일 세포 RNA 염기서열분석(그림 4B)을 통해 하나의 Teff 클론과 하나의 Treg 클론을 비교하여 비중첩 표현형 및 유전자 발현 프로파일을 보여줍니다. 이들의 TCR 레퍼토리 다양성은 두 세포 산물에서 모두 1이었으며(즉, 고유한 VD(J) 재조합을 통해 하나의 Vβ 사슬만 발현됨) 단클론성의 증거를 제공했습니다. 그림 5에서 Treg 세포 클론 증식 주기의 동역학은 시간 경과에 따른 Ki67 염색에 의해 평가되었으며, 이는 대부분의 진정한 Treg 클론의 느린 증식을 입증했습니다.

그림 1: Treg 함유 세포 집단의 사전 농축. (A) 일중항 살아있는 CD3+CD4+ 림프구에 개폐된 PBMC 내의 인간 CD3+CD4+ CD127lo CD25+ 세포. 이 집단은 대부분의 인간 조절 T 세포를 포함하고 있으며 농축을 위한 시작 집단 역할을 했습니다. (B) 자기 분류를 사용한 음성 선택을 통한 CD127-CD4+ T 세포 농축. (C) CD127-CD4+ 집단(파란색, 히스토그램)에서 CD25hi 세포(빨간색, 히스토그램)의 추가 농축은 자기(여기 그림 참조) 또는 FACS 분류를 통해 달성할 수 있습니다. 녹색은 농축 전 PBMC 집단에서 CD25 발현을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 실제 Treg에 대한 세포 확장 스크리닝. CD127 및 CD25 발현 수준의 유세포 분석 평가는 초기 스크리닝을 위한 간단한 접근 방식이었지만 "false"(즉, 메틸화된) 샘플의 수가 많기 때문에 TSDR에서 메틸화 상태를 확인해야 했습니다. (A) 클로닝 14일 후 얻은 세포 확장: 세포 확장의 1(6%)만이 실제 Treg와 일치하는 TSDR에서 탈메틸화를 보여주었습니다. (B) 30일 후 세포 확장 감지: 6개의 확장 중 2개(33%)가 메틸화당 Treg 상태와 일치했습니다. 살아있는 세포에 게이트가 있습니다. 셀은 CD4+CD3+CD8-입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 클론성 검증. 세포 확장의 단클론성을 확인해야 합니다. (A) 클론은 하나의 Vβ 염색에 대해 양성으로 염색되었습니다. 표시된 경우, Vβ17. (B) 24개의 인간 Vβ 특이성에 대한 전체 데이터 세트를 보여줍니다. (C) 분석의 원리. 세포는 인간 T 세포 수용체의 하나의 Vβ 사슬에 대해 각각 특이적인 FITC/PE 단일 또는 이중 접합 항체로 염색되었습니다. 임계값 위의 각 사분면은 하나의 단일 Vβ 사슬에 대한 염색을 표시했지만 다른 사슬에 대해서는 염색을 나타내지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
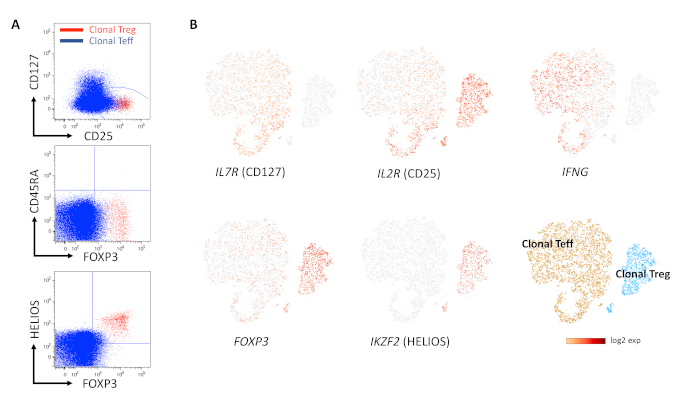
그림 4: 장기 확장 후 Treg 클론의 표현형 평가. (A) 오버레이 플롯에서 Treg(빨간색) 및 Teff(파란색) 클론의 유세포 분석은 인간 Teff에서 FOXP3 및 CD25 발현 수준이 낮기 때문에 Treg와 Teff 간의 구별이 어려울 수 있음을 보여줍니다. (B) 패널 A와 동일한 세포 산물에 대한 V(D)J 분석을 사용한 단일 세포 RNA 염기서열분석은 클론 Treg 대 클론 Teff에서 HELIOS, FOXP3 및 CD25의 높은 차등 발현과 배양 51주 후 IFNg 및 CD127 발현의 부재를 보여줍니다. 각 샘플의 TCR 다양성은 1입니다(즉, 확장은 단클론성). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 배양에서 Treg의 확산. 피더 자극 배양의 일반적인 팽창 주기는 약 2주 동안 지속되며 그 후에는 재조정이 필요합니다. Treg 클론의 Ki67 발현을 7일(빨간색), 11일(파란색) 및 14일(녹색)로 표현한 오버레이 플롯이 표시됩니다. 죽어가는 영양세포는 Treg에 의해 발현된 HLA-A24에 대한 생존율 염색 및 게이팅을 통해 제외되었지만, 공급세포 공여자는 제외되지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 Treg를 함유한 시작 집단에서 제한 희석 및 공급세포 기반 확장 접근법에서 얻은 세포의 분리, 확장 및 신중한 검사를 통해 초순수 인간 조절 T 세포의 증식을 설명합니다.
이 접근법의 중요한 단계는 다음과 같습니다: 1) 적절한 시작 모집단의 선택. 일반적으로 인간 PBMC 내 CD4+ T 세포의 CD127loCD25hi 구획에는 이러한 목적에 적합한 다양한 Treg가 포함되어 있습니다10,17. 2) 너무 많은 세포를 파종하여 올리고클론 세포주를 생성하거나 너무 적은 세포를 파종하여 클로닝 효율성을 감소시킬 수 있는 위험을 감안할 때 성공적인 클로닝을 위해서는 정확한 세포 수가 필수적입니다. 이 프로토콜은 계수를 위해 표준 혈구계를 사용합니다. 설정이 적절하게 최적화되고 카운트가 검사된 경우 자동화된 셀 계수기를 대안으로 사용할 수 있습니다. 3) 파종된 일차 세포가 있는 플레이트의 장기 관찰 및 유지 보수. Treg는 천천히 증식하는데, 이는 클론이 배양에서 몇 주 후에야 세포 펠릿 형태로 거시적으로 보이게 될 수 있음을 의미합니다. 이 기간은 세포독성 CD8+ T 세포 등과 같이 빠르게 증식하는 Teff의 생성에 적용되는 유사한 클로닝 접근 방식의 일반적인 방식과 크게 다르다는 점에 유의하는 것이 중요합니다. 4) 천천히 증식하는 클론에 대한 비판적 평가. Treg의 느린 증식 속도는 종종 방사선 조사된 공급세포 클로닝 접근 방식에서 일반적으로 직면하지 않는 문제를 일으키며, 공급세포는 일반적으로 빠르게 증식하는 클론 또는 세포주와 함께 공동 배양에서 방사선 조사 후 며칠 후에 죽습니다. Treg의 낮은 팽창률을 감안할 때, 공급세포는 방사선 조사에도 불구하고 1-2주 이상 배양에서 약간의 생존력을 유지하는 경우가 많습니다. 이는 결과 세포 산물의 분석 결과 해석에 영향을 미치고 연구자를 오도할 수 있습니다. 따라서 HLA 발현을 근거로 어느 정도 생존력을 유지했을 수 있는 공급세포를 분류하는 것이 좋으며, 이는 확장된 Treg의 발현과 달라야 합니다. 모든 모이통은 적절하게 방사선에 조사되면 결국 죽습니다. 5) 현재까지 파이로시퀀싱에 의한 클론 조사는 배양에서 진정한 Treg의 존재를 확인하는 가장 신뢰할 수 있는 방법입니다. Treg 억제 분석 및 표현형 분석은 모두 신뢰할 수 있는 평가를 항상 허용하는 것은 아닌 심각한 한계가 있습니다. 파이로시퀀싱은 상용 공급업체에 아웃소싱하거나 사내에서 수행할 수 있습니다. 세포 검사에 소요되는 시간과 비용을 제한하기 위해 먼저 단클론성(monoclonality)을 확립한 다음 표현형 스크리닝(예: CD127/CD25 발현)을 수행하여 CD127loCD25 표현형이높은 클론을 제거한 다음(일부 실제 Treg를 제외할 수 있음) 선택한 클론으로 파이로시퀀싱을 진행하는 것이 합리적입니다.
표 1 은 빠른 문제 해결을 위한 도구를 제공합니다.
| 문제 | 가능한 설명 및 접근 방식 |
| 2주 후에는 클론이 보이지 않습니다. | 기다렸다가 문화를 계속 유지하십시오. Treg는 천천히 팽창하며 일반적으로 Teff보다 눈에 보이는 세포 펠릿을 형성하는 데 더 많은 시간이 필요합니다. |
| 얻어진 클론은 유세포 분석 분석에서 Treg 표현형을 나타내지 않습니다. | 1) 클론은 테프입니다. 나중에 볼 수 있게 되는 복제 복제 동물은 느린 증식을 감안할 때 Treg일 가능성이 더 높습니다. |
| 2) 염색 패널이 충분히 최적화되지 않았습니다. 패널을 정제하거나 공개된 최적화된 Treg 염색 패널10을 사용하십시오. | |
| TSDR에서 파이로 시퀀싱을 통해 표현형적으로 유망한 클론을 확인합니다. | |
| 얻어진 세포주는 클론성이 아닙니다. | 파종할 때 세포가 정확하게 계수되고 파종 전에 침전되지 않았는지 확인하십시오. 피더와 1차 Treg를 함께 도금할 때 파종 직전에 PHA-L을 추가하거나 Treg를 먼저 플레이트아웃한 다음 PHA와 피더를 추가합니다. PHA는 세포 응집을 유발하고 Treg 농축 세포를 도금할 때 단일 세포 현탁액을 유지하는 데 부정적인 영향을 미칠 수 있습니다. |
| 분석 시점에 공급세포가 죽었는지 또는 의심스러울 경우 분류해야 합니다(천천히 팽창하는 일차 세포와 공동 배양할 때 방사선 조사된 공급체의 생존 연장에 대한 설명 참조). | |
| 클론은 유세포 분석에 의해 Treg 표현형을 나타내고 TSDR에서 탈메틸화되지 않음에 의해 in vitro 억제 분석에서 억제됩니다. | TSDR의 탈메틸화는 억제 분석을 대체하며 유세포 분석 결과 Treg 동일성을 결정합니다. 효과기 세포는 세포 독성 및 기타 효과를 통해 용량 의존적 방식으로 반응 T 세포 집단의 세포 수를 감소시킬 수 있습니다. Treg 및 Teff에서 다양한 수준의 FOXP3 및 CD25 발현을 감안할 때 정확한 생물학적 대조군을 얻을 수 없는 경우 클론에 대한 유세포 분석 결과를 해석하기 어려울 수 있습니다. |
| 허용 가능한 초기 증식을 가진 Treg 클론은 후속 확장/자극 주기에서 팽창을 멈춥니다. | 실험을 완료해 보세요 - 일부 Treg 클론은 확장을 멈춥니다. |
| 다른 동종 공급세포 공여체로 확장 시도 - 일부는 다른 것보다 더 잘 작동합니다. | |
| 이전에 특정 공급세포 공여체에서 세포가 잘 증식한 경우, 가능한 경우 후속 확장 주기에서 동일한 공여체의 세포를 다시 사용하여 증식하는 것이 도움이 될 수 있습니다. | |
| Viable feeder cell은 세포주/클론을 분석할 때 유세포 분석으로 검출할 수 있습니다. | 이는 Treg가 천천히 증식할 때 발생할 수 있는데, 이는 경쟁이 적기 때문에 방사선 조사된 공급 세포가 평소보다 더 오래 생존할 수 있기 때문입니다. Treg에는 존재하지만 feeder cells에는 없는 HLA 발현을 기반으로 클론을 분류합니다. 반드시 생존 염료를 사용하십시오. 적절하게 방사선에 노출된 모든 사료는 결국 죽게 됩니다. |
표 1: 문제 해결.
이 방법의 가능한 수정은 다음과 같습니다 : 1) Treg 분리 방법. FACS의 사용은 가능하지만 위에서 언급한 단점이 있습니다. 그러나 이는 표적화된 시작 모집단의 표현형 특성을 더 잘 즉각적으로 제어할 수 있게 해주며 관심 있는 특정 시작 모집단이 자기 분류에 의해 쉽게 얻어지지 않는 경우 바람직할 수 있습니다. 2) 특정 Treg 하위 집합을 시작 모집단으로 선택합니다. 예를 들어, TIGIT/CD226 대 CD39+ Treg 대 표준 또는 CD45RA+FOXP3int 대 CD45RA-FOXP3hi. Treg 부분 집합을 구분하기 위해 몇 가지 표현형 특성이 제안되었으며, 특히 안정적인 팽창과 높은 억제 활성에 적합합니다18,19. 3) 냉동 보존 vs. 신선한 공급 세포. 해동(cryopreserved, irradiated 또는 non-irradiated with subsequent irradiation) feeder cell의 사용이 가능할 수 있지만 권장되지 않으며 이 프로토콜에 대해 체계적으로 평가되지 않았습니다. 4) PCR vs. 유세포 분석에 의한 클론성 심사. 염기서열분석은 TCR Vβ 염색보다 적용 범위가 우수하고 단클론성20 측정에 더 적합할 수 있지만 Vβ 염색보다 설정하는 데 더 많은 노력과 시간이 필요합니다. 5) NSG 마우스의 이종발생 GVHD 모델과 같은 생체 내 억제 분석. 이는 in vitro assay보다 선호될 수 있지만 시간이 많이 걸리고 노동 집약적이며 비용이 많이 듭니다14. NSG 마우스의 군체 또는 인간 세포의 다른 적절한 면역 무능력 쥐 수용자가 일상적으로 유지되는 환경에서 실현 가능할 수 있습니다. 6) 항원 특이적 Treg 클론의 생성. 이는 사합체/폴리머 염색, 항원(AG) 특이적 자극 분석에서 반응 세포 분리 또는 기타 유사한 기술과 같은 항원 특이적 Treg의 분리를 위한 적절한 접근 방식의 적용과 이 프로토콜의 후속 적용을 통해 시도할 수 있습니다. 그러나 테트라머 염색은 분리된 세포의 생존력을 변화시킬 수 있으며 더 많은 세포를 파종해야 할 수 있습니다.
이 프로토콜의 한계는 다음과 같습니다: 1) Treg의 느린 증식은 세포 수율을 제한합니다. Treg의 느린 증식은 장기적인 체외 확장의 주요 제한 사항입니다. 이는 여기에 제시된 프로토콜에 적용됩니다. 2) 알 수 없는 항원 특이성. 현재 프로토콜은 알려진 AG 특이성에 따라 Treg를 선택하지 않습니다. 결과 산물의 단클론성은 AG에 대한 높은 수준의 특이성을 의미하지만, 특이성은 선험적으로 알려져 있지 않습니다. 인간 말초 혈액에서 AG 특이적 Treg의 낮은 전구체 빈도를 감안할 때 알려진 AG 특이성을 가진 시작 모집단을 선택하는 것은 어려울 수 있지만, 원하는 항원에 대한 반응으로 이전에 확장된 Treg의 사전 농축, 고분자 MHC-펩타이드 접근법을 사용한 직접 표적화 또는 기타 방법으로 해결할 수 있습니다. 3) 확장 과정에서 인체 물질을 사용하면 치료 적용이 제한될 수 있습니다. 인간 공급 세포의 사용은 치료 응용 분야에 어려움을 제기하지만 이를 배제하지는 않습니다. 이 프로토콜을 수행하는 데 필요한 모든 시약은 GMP(Good Manufacturing Practice) 표준(IL-2 및 PHA-L)에서 사용할 수 있습니다. 인공 항원제시세포(APC)와 사이토카인 칵테일을 사용하면 공급세포의 필요성을 완화하는 데 도움이 될 수 있지만 아직 테스트가 남아 있습니다. 4) 세포는 장기적이고 시험관 내에서 확장됩니다. 이는 이러한 세포가 장기간의 체외 배양을 감안할 때 생리학적으로 발생하는 Treg를 적절하게 반영한다는 보장이 없음을 의미합니다.
기존/대체 방법과 비교했을 때 이 접근법의 주요 중요성은 배양에서 매우 오랜 기간 동안 Treg 정의 사양을 유지하는 초순수 Treg 세포 생성물을 생성할 수 있는 능력에 있습니다. 클로닝 접근 방식을 통해 연구자는 확장 실험에서 계속 진행할 수 있는 세포의 특성을 제어할 수 있으므로 Teff형 세포의 증식을 제거할 수 있습니다. 대부분의 다른 방법은 Treg의 다클론 또는 올리고클론 확장에 의존해 왔으며, 이는 종종 시간이 지남에 따라 억제 기능이 손상됩니다.
이 방법의 향후 응용 프로그램 및 방향은 다음과 같습니다 : 1) AG 특이적 Treg 클론의 생성. 이는 진정한 Treg의 느린 증식과 관련된 제한을 부분적으로 우회하고 표적 임상 적용에서 많은 수의 Treg의 필요성을 줄일 수 있습니다. 2) 적은 수의 Treg가 필요한 응용 프로그램. 여기에는 클론의 표현형 및 기능 분석(예: RNA 염기서열분석)이 포함됩니다. 3) 다운스트림 유전자 편집 접근법. 이 방법은 예를 들어 CRISPR-Cas9 변형과 결합하여 인간 Treg의 특정 유전자 기능을 평가하고 조작할 수 있습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 프로젝트는 미국 국립보건원(National Institutes of Health)의 국립 안과 연구소(National Eye Institute)의 수상 번호 K08EY025324(Nowatzky)과 Judith and Stewart Colton Center for Autoimmunity(Nowatzky)의 Colton Scholar Award의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22 µm Stericup, 500 mL | Millipore | 5500 | Media storage and preparation |
| 100x Nonessential amino acids | Gibco | 11140-050 | Media component |
| 15 mL conical centrifuge tubes (50/bag, case of 500) | ThermoFisher Scientific | 339650 | |
| 1M HEPES | Gibco | 15630-080 | Media component |
| 25 ml Single Well Pipet Basin | Fischer Scientific | 13-681-508 | |
| 50 mL Conical Centrifuge Tube (25/sleeve) | ThermoFisher Scientific | 339652 | |
| 50x Penicillin Streptomycin Soln | Corning | Corning, 30-001-Cl | Media component |
| CryoTube Vial Int Thread Round Btm Starfoot PP Screw Stopper Sterile PP 1.8 mL | Nalge Nunc | 377267 | |
| DMSO | Corning | 25-950-CQC | |
| EasySep Human CD25 positive selection kit | Stemcell Technologies | 18231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127low T cell Pre-Enrichment Kit | Stemcell Technologies | 19231 | Alternatives are FACS or MACS column-based sorting |
| EasySep Human CD4+CD127lowCD25+ Regulatory T Cell Isolation Kit (alternative to item 12) | Stemcell Technologies | 18063 | Alternatives are FACS or MACS column-based sorting |
| Ficoll | GE Healthcare | 17-5442-03 | PBMC purification from peripheral blood of leukapheresis products; density gradient medium |
| Human AB Serum (PHS-AB) | Valley Biomedical Inc | HP1022 | Media component |
| LIVE/DEAD Fixable Blue Dead Cell Stain Kit, for UV excitation | Thermo Fischer | L-34962 | Viability dye |
| Phytohemagglutinin-L (PHA-L) | Millipore/Sigma | 11249738001 | T cell stimulation |
| Recombinant IL-2 (e.g., PROLEUKINâ) | Prometheus | T cell stimulation and maintenance/ Media component | |
| RPMI 1640 | Gibco | 21870-076 | Media component |
| Staining antibodies for flowcytometry (Treg phenotyping) | See "Comments" | See "Comments" | Staining antibodies are enlisted in: Nowatzky et al. (2019) PubMed PMID: 30584695; PubMed Central PMCID: PMC6497402. In case EasySep Human CD25 positive selection kit is used, stain with 2A3 or BC96 anti-CD25 antibody, e.g.: Brilliant Violet 421 anti-human CD25 Antibody (Biolegend; 302629) |
| TCR Vβ Repertoire Kit; IOTest Beta Mark | Beckman Coulter | PN IM3497 | Vetting of expansions for monoclonality |
| Tissue Culture Plate, 96 Well, U-Bottom with Low Evaporation Lid | Corning | 353077 |
참고문헌
- Miyara, M., et al. Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor. Immunity. 30 (6), 899-911 (2009).
- Polansky, J. K., et al. DNA methylation controls Foxp3 gene expression. European Journal of Immunology. 38 (6), 1654-1663 (2008).
- Toker, A., et al. Active demethylation of the Foxp3 locus leads to the generation of stable regulatory T cells within the thymus. The Journal of Immunology. 190 (7), 3180-3188 (2013).
- Garg, G., et al. Blimp1 Prevents Methylation of Foxp3 and Loss of Regulatory T Cell Identity at Sites of Inflammation. Cell Reports. 26 (7), 1854-1868 (2019).
- Brunstein, C. G., et al. Infusion of ex vivo expanded T regulatory cells in adults transplanted with umbilical cord blood: safety profile and detection kinetics. Blood. 117 (3), 1061-1070 (2011).
- Hippen, K. L., et al. Massive ex vivo expansion of human natural regulatory T cells (T(regs)) with minimal loss of in vivo functional activity. Science Translational Medicine. 3 (83), 41 (2011).
- Bluestone, J. A., et al. Type 1 diabetes immunotherapy using polyclonal regulatory T cells. Science Translational Medicine. 7 (315), 189 (2015).
- Dromey, J. A., et al. Generation and expansion of regulatory human CD4(+) T-cell clones specific for pancreatic islet autoantigens. Journal of Autoimmunity. 36 (1), 47-55 (2011).
- Sabado, R. L., et al. Preparation of tumor antigen-loaded mature dendritic cells for immunotherapy. Journal of Visual Experiments. (78), e50085 (2013).
- Nowatzky, J., Stagnar, C., Manches, O. OMIP-053: Identification, Classification, and Isolation of Major FoxP3 Expressing Human CD4(+) Treg Subsets. Cytometry A. 95 (3), 264-267 (2019).
- Zhang, Y., et al. Genome-wide DNA methylation analysis identifies hypomethylated genes regulated by FOXP3 in human regulatory T cells. Blood. 122 (16), 2823-2836 (2013).
- Spreafico, R., et al. A sensitive protocol for FOXP3 epigenetic analysis in scarce human samples. European Journal of Immunology. 44 (10), 3141-3143 (2014).
- Collison, L. W., Vignali, D. A. In vitro Treg suppression assays. Methods in Molecular Biology. 707, 21-37 (2011).
- Workman, C. J., et al. In vivo Treg suppression assays. Methods in Molecular Biology. 707, 119-156 (2011).
- Feng, Y., et al. Control of the inheritance of regulatory T cell identity by a cis element in the Foxp3 locus. Cell. 158 (4), 749-763 (2014).
- Toker, A., Huehn, J. To be or not to be a Treg cell: lineage decisions controlled by epigenetic mechanisms. Science Signaling. 4 (158), 4 (2011).
- Liu, W., et al. CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells. Journal of Experimental Medicine. 203 (7), 1701-1711 (2006).
- Fuhrman, C. A., et al. Divergent Phenotypes of Human Regulatory T Cells Expressing the Receptors TIGIT and CD226. The Journal of Immunology. 195 (1), 145-155 (2015).
- Gu, J., et al. Human CD39(hi) regulatory T cells present stronger stability and function under inflammatory conditions. Cellular & Molecular Immunology. 14 (6), 521-528 (2017).
- Genevee, C., et al. An experimentally validated panel of subfamily-specific oligonucleotide primers (V alpha 1-w29/V beta 1-w24) for the study of human T cell receptor variable V gene segment usage by polymerase chain reaction. European Journal of Immunology. 22 (5), 1261-1269 (1992).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유